米酒是以糯米、大米等为原料,经糊化后接种酒曲发酵而成的低度酒精饮品,富含氨基酸、有机酸和维生素等多种营养物质[1-2]。研究表明,米酒的风味与原料选用息息相关,一方面米酒的涩味、苦味和鲜味可能与原料中蛋白质含量相关[3],米酒的甜味及醇厚感与原料中淀粉含量和支链淀粉与直链淀粉的比例相关[4-5],另一方面原料中的蛋白质和淀粉在米酒发酵过程中水解形成氨基酸和葡萄糖,并被酵母菌等选择性利用转化成一系列风味物质,如乙醇[6]、高级醇[7-8]、酯[9-10]、糠醛等[11],从而进一步影响米酒的风味。因此,关于米酒原料及对米酒影响的研究得到重视,目前相关研究聚焦于原料种类差异(大米、粳米和糯米)、支链淀粉含量和蛋白含量差异,较少关注品种、种植产区及贮存年份差异[12]。本研究拟以贵州和东北地区出产的10种大米作为研究对象,分析其淀粉含量差异,并监控发酵过程中葡萄糖的含量,初步构建淀粉含量与米酒发酵中葡萄糖变化的关联,为通过分析原料主要成分控制米酒风味品质提供理论研究基础,对相关酿酒大米品种的推广种植及在米酒酿造中的应用具有重要意义。
1 材料与试剂
1.1 材料与试剂
实验菌株为酿酒酵母FBKL2.8022,大米样品信息如表1所示。
表1 大米样品信息表
Table 1 Rice samples in this study
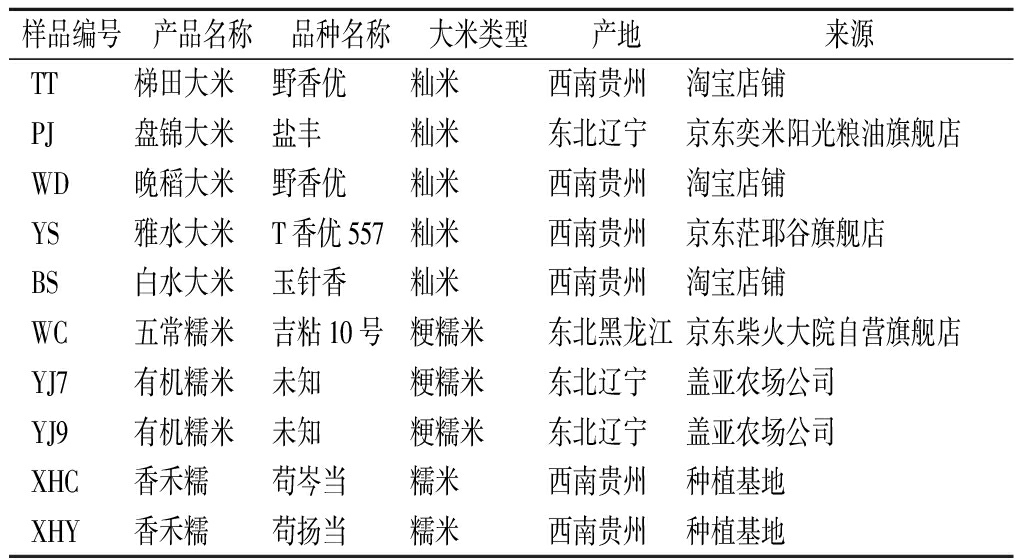
样品编号产品名称品种名称大米类型产地来源TT梯田大米野香优籼米西南贵州淘宝店铺PJ盘锦大米盐丰籼米东北辽宁京东奕米阳光粮油旗舰店WD晚稻大米野香优籼米西南贵州淘宝店铺YS雅水大米T香优557籼米西南贵州京东茫耶谷旗舰店BS白水大米玉针香籼米西南贵州淘宝店铺WC五常糯米吉粘10号粳糯米东北黑龙江京东柴火大院自营旗舰店YJ7有机糯米未知粳糯米东北辽宁盖亚农场公司YJ9有机糯米未知粳糯米东北辽宁盖亚农场公司XHC香禾糯苟岑当糯米西南贵州种植基地XHY香禾糯苟扬当糯米西南贵州种植基地
支链淀粉、直链淀粉,北京索莱宝Solarbio公司;氢氧化钾,天津市致远化学试剂有限公司;盐酸,重庆川东化工(集团)有限公司;碘,天津市科密欧化学试剂有限公司;碘化钾、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS),国药集团化学试剂有限公司;氢氧化钠,成都金山化学试剂有限公司;丙三醇,天津市富宇精细化工有限公司;葡萄糖,天津市永大化学试剂有限公司。本实验所用试剂除支链淀粉和直链淀粉为标准品外,其余均为分析纯。
1.2 仪器与设备
DK-98-IIA电热恒温水浴锅,天津市泰斯特仪器有限公司;精密pH计,上海日岛科学仪器有限公司;BSA124S-CW电子天平,赛多利斯科学仪器(北京)有限公司;GFL-230鼓风干燥箱,天津市莱玻特瑞仪器设备有限公司;800A多功能粉碎机,永康市金穗机械制造厂;XH-C涡旋混合器,姜堰市康健医疗器具有限公司;VARIOSKAN FLASH酶标仪,美国Thermo Fisher Scientific公司。
1.3 试剂配制
支链淀粉标准溶液(质量浓度2 mg/mL):称取0.05 g支链淀粉标准品,加入5 mL KOH(0.5 mol/L)溶液,100 ℃左右水浴分散溶解10 min,加蒸馏水定容至25 mL,用10 μm膜过滤,备用;直链淀粉标准溶液2 mg/mL的配制与支链淀粉一致;碘试剂、HCl(0.1 mol/L)溶液配制参考文献[13];2 mol/L NaOH溶液(称取8 g NaOH,定容至100 mL);DNS试剂:称取0.65 g DNS溶于少量水中,加2 mol/L NaOH溶液32.5 mL,再加入4.5 g丙三醇,摇匀,移入100 mL容量瓶,冷却后加蒸馏水定容至100 mL,贮存于棕色瓶中;葡萄糖标准溶液(质量浓度10 g/L):准确称取烘干至恒重后的葡萄糖0.500 g,用蒸馏水溶解并定容至50 mL;葡萄糖标准溶液(质量浓度250 g/L):称取烘干至恒重后的葡萄糖6.252 g,定容至25 mL。
1.4 实验方法
1.4.1 采用双波长分析法检测淀粉含量
1.4.1.1 检测波长与淀粉溶液浓度的选择
目前已有报道研究中利用双波长测定淀粉含量所用的波长皆不相同[14-15],对比发现扫描波谱时所采用的淀粉溶液浓度存在差异,本研究在采用唐佳代[13]所用淀粉溶液(0.04 mg/mL)时获取的支链淀粉与直链淀粉峰值差异过大,影响波长的确定,因此为验证淀粉溶液浓度对扫描波谱的影响,从而选择最佳测定波长,本研究设有4组可见光波段扫描图谱方法,方法(1)(2)支链淀粉质量浓度为0.1 mg/mL,直链淀粉质量浓度为0.04 mg/mL,2种方法静置时间不同;方法(3)支链淀粉质量浓度为0.14 mg/mL,直链淀粉质量浓度为0.052 mg/mL;方法(4)支链淀粉质量浓度为0.3 mg/mL,直链淀粉质量浓度为0.026 mg/mL。分别取2 mg/mL支链淀粉标准溶液200 μL[方法(1)(2)]、700 μL[方法(3)]、1 500 μL[方法(4)],或取2 mg/mL直链淀粉标准溶液200 μL[方法(1)(2)]、260 μL[方法(3)]、130 μL[方法(4)],加入蒸馏水5 mL,用HCl(0.1 mol/L)将pH调至3.0左右,加入碘试剂0.1 mL,再用蒸馏水定容至10 mL,静置[方法(1)(3)(4)静置15 min,方法(2)为20 min]后以蒸馏水为空白,利用酶标仪400~900 nm进行步径为1 nm的可见光波段扫描。最后绘制可见光波段扫描曲线,并选择参比波长和测定波长。
1.4.1.2 支链淀粉标准曲线的绘制
吸取2 mg/mL支链淀粉标准溶液0、150、300、450、600、750、900 μL分别放入烧杯,加蒸馏水5 mL,以0.1 mol/L HCl溶液调至pH 3.0左右,加入碘试剂0.1 mL,用蒸馏水定容至10 mL后静置15 min,以蒸馏水为空白,在所选参比和测定波长下分别测定吸光值,得ΔA支链淀粉。以ΔA支链淀粉为纵坐标,支链淀粉含量为横坐标绘制标准曲线。
1.4.1.3 直链淀粉标准曲线的绘制
吸取2 mg/mL直链淀粉标准溶液0、25、50、75、100、125、150 μL分别放入烧杯,后续操作与1.4.1.2相同,最终得到ΔA直链淀粉。以ΔA直链淀粉为纵坐标,直链淀粉含量为横坐标绘制成标准曲线。
1.4.1.4 脱水脱脂大米粉的获取
使用粉碎机将大米粉碎,过100目筛后得到大米粉备用。大米粉的水分含量参考GB 5009.3—2016中直接干燥法进行测定,得到水分含量W1;脂肪含量按照GB 5009.6—2016中索氏抽提法进行检测,得到脂肪含量W2。
1.4.1.5 原料中淀粉含量的测定
准确称取0.05 g脱水脱脂大米粉,加入10 mL KOH(0.5 mol/L)溶液,沸水浴10 min,冷却后加蒸馏水定容至50 mL,10 μm膜过滤,作为样液备用。吸取样液1 mL,加入5 mL蒸馏水,后续操作与1.4.1.2一致,设置3组平行,得到ΔA直链淀粉、ΔA支链淀粉。查标准曲线得到糯米样品中直链和支链淀粉的含量[13]。淀粉含量计算如公式(1)和公式(2)所示:
支链淀粉含量![]()
(1)
直链淀粉含量![]()
(2)
式中:X1,标准曲线中所得直链淀粉含量,mg/mL;X2,标准曲线中所得支链淀粉含量,mg/mL;W1,糯米粉中水分含量,%;W2,糯米粉中脂肪含量,%;m,脱脂糯米粉干燥后质量,g。
1.4.2 米酒发酵实验
准确称取100 g大米,加水浸泡过夜,用纱布过滤后将米放入瓶中,121 ℃灭菌20 min。冷却后加入150 mL无菌水、1.89 g α-淀粉酶和0.56 g糖化酶,搅拌均匀,60 ℃ 水浴中酶解30 min,按照1×106 cells/mL的浓度将酵母菌株FBKL2.8022接种,进行米酒发酵,发酵温度为30 ℃,每24 h记录发酵液的失重[13, 16]。以酶解后未接菌时作为发酵零点(记为0);认为发酵液重量损失达到一半时即发酵中点(记为1);当失重小于0.2 g/d时认为发酵结束即发酵终点(记为2)。分别对3个时间点(0、1、2)的米酒发酵液进行取样、处理和检测。
1.4.3 米酒发酵过程中葡萄糖含量的测定
1.4.3.1 葡萄糖标准曲线的绘制
按照表2分别加入葡萄糖溶液、蒸馏水和DNS试剂,充分混匀,于沸水浴中加热煮沸5 min,冰水冷却至室温后分别向各管中加蒸馏水400 μL,混匀,静置20 min,吸取200 μL于酶标板中进行测定。以管1为空白对照,540 nm下测得吸光度,绘制吸光度-葡萄糖浓度曲线。
表2 葡萄糖浓度梯度
Table 2 Concentration gradient of glucose
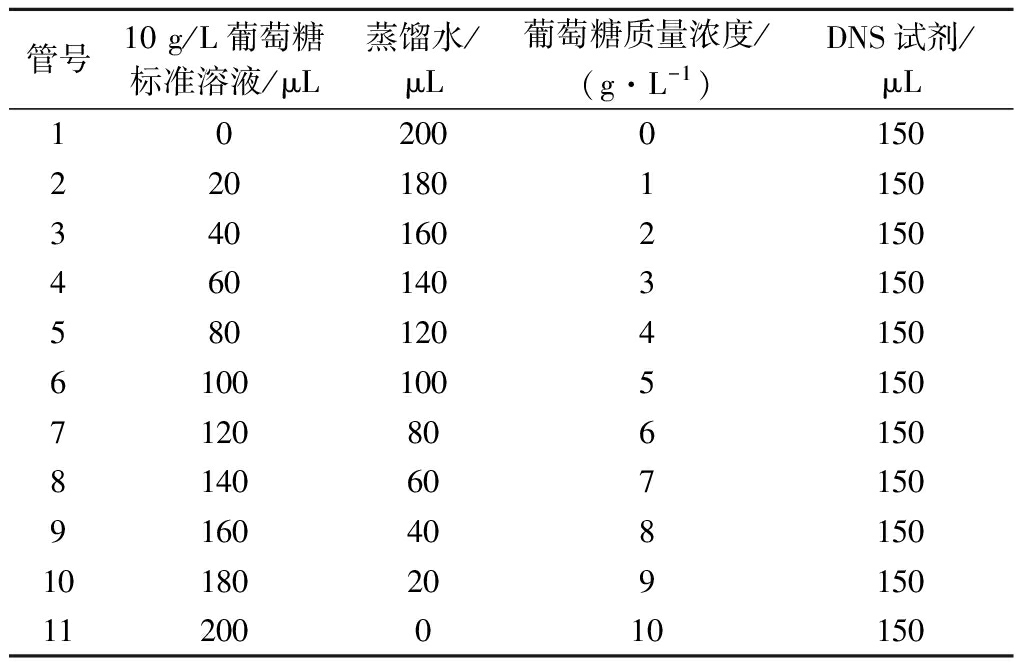
管号10 g/L葡萄糖标准溶液/μL蒸馏水/μL葡萄糖质量浓度/(g·L-1)DNS试剂/μL1020001502201801150340160215046014031505801204150610010051507120806150814060715091604081501018020915011200010150
1.4.3.2 葡萄糖标准曲线的验证
取200 μL葡萄糖溶液(250 g/L葡萄糖标准溶液稀释100倍),加入150 μL DNS试剂,充分混匀后于沸水浴中加热煮沸5 min,后续操作步骤与1.4.3.1一致。将所测吸光度值带入已建好的葡萄糖标准曲线中得到葡萄糖含量,并与实际含量(250 g/L)进行比较。葡萄糖含量计算如公式(3)所示:
葡萄糖含量/(g·L-1)
=标曲所得葡萄糖含量×稀释倍数
(3)
1.4.3.3 米酒发酵液中葡萄糖含量的测定
将取出的发酵液离心后取上清液,稀释100倍,取稀释样液200 μL,加入150 μL DNS试剂,混匀,沸水浴加热煮沸5 min,后续操作步骤与1.4.3.2一致,最终计算获取发酵液中葡萄糖含量。不同阶段葡萄糖含量的变化计算如公式(4)和公式(5)所示:
前期葡萄糖消耗量/(g·L-1)
=发酵零点葡萄糖含量-发酵中点葡萄糖含量
(4)
后期葡萄糖消耗量/(g·L-1)
=发酵零点葡萄糖含量-发酵终点葡萄糖含量-前期葡萄糖消耗量
(5)
本文按照化学公式:C6H12O6=2C2H5OH+2CO2,分别计算酒精度和CO2生成量所对应的葡萄糖消耗量。葡萄糖消耗量计算如公式(6)和公式(7)所示:
(6)
(7)
式中:y,葡萄糖消耗量,g/L;x,酒精度,%vol;z,CO2失重,g;0.789,酒精密度,g/cm3。
1.4.4 数据分析
差异性分析:使用SPSS 21.0软件对不同品种大米原料与淀粉含量进行单因素分析,使用测量数据至少3个平行,以不同品种大米作为因子,与其对应的淀粉含量和支直比作为因变量,进行两两比较,采用Duncan′s新复极差法分析显著性水平,当P<0.05时表示差异显著。
相关性分析:使用SPSS 21.0软件,分别以米酒发酵过程中的前期葡萄糖消耗量、后期葡萄糖消耗量、葡萄糖总消耗量作为变量1,以支链淀粉含量、直链淀粉含量、总淀粉含量、支/直比、不同品种(综合前面4个参数)作为变量2,进行相关性分析。通过选择双变量相关分析中的Pearson和双侧检验方法,可以直接获取相关系数,相关系数在0.8~1.0表示极强相关,0.6~0.8表示强相关,0.4~0.6表示中等程度相关,0.2~0.4表示弱相关,值越大表示越相关。该方法可同时给出相关系数的显著性标记结果,当P<0.05时表示相关性显著,P<0.01时表示极显著,P>0.05时表示不显著。本研究分别在10种原料、糯米与非糯米原料、西南原料与东北原料层面进行相关性分析。使用Excel 2017对分析数据进行作图。
2 结果与分析
2.1 不同品种大米淀粉含量差异分析
2.1.1 基于酶标仪比色法采用双波长分析淀粉含量的条件研究
图1是支链、直链淀粉-碘复合物在波长400~900 nm扫描的吸收峰,采用等吸光度法进行作图选择波长必须满足2个基本条件:(1)共存组分在这2个波长应具有相同吸收值,以免测定值受影响;(2)待测组分在这2个波长的吸收值应足够大。通常以待测组分最大吸收波长作为测定波长,参比波长的确定在于测定波长的选择[17],若待测组分的最大吸收波长不适用于作为测定波长,在满足以上2个条件下可选择曲线上的其他波长代替[18]。如图1-a和图1-b所示,淀粉标准溶液浓度相同,静置时间不同所得的波谱扫描图稍有差异,直链淀粉变化不大,支链淀粉的峰有些许增加从而与直链淀粉交汇,根据上述原理选择的测定与参比波长结果较近,由此可知,静置时间对于该测定方法的影响较小。如图1-c所示,使用标准曲线中最大浓度的支链与直链淀粉溶液进行扫描[19],直链淀粉出现更明显的峰,支链淀粉的峰则不明显。图1-d使用高浓度的支链淀粉和低浓度的直链淀粉进行波普扫描,结果都出现明显的峰,利于进行等吸光度作图[17]。双波长法是利用2个波长的吸光度差值,从而消减2类淀粉吸收背景的相互影响,由此提高了测定的灵敏度和选择性[20],根据作图原理和扫描图谱可知,选择能最大消除相互吸收背景的测定和参比波长可使结果更好。本实验确定支链淀粉0.3 mg/mL,直链淀粉0.026 mg/mL为最佳波谱扫描的淀粉标准溶液浓度;由此波谱扫描图得到支链淀粉测定波长为538 nm,参比波长为755 nm,直链淀粉测定波长为632 nm,参比波长为438 nm。此结果与张雪梅等[21]确定的波长结果相近。

a-方法(1);b-方法(2);c-方法(3);d-方法(4)
图1 支链淀粉、直链淀粉的波谱扫描图
Fig.1 Spectrogramof amylopectin and amylose
由图1-d波谱扫描图表明538、755、632、438 nm作为测定与参比波长是最佳选择。在此波长条件下根据2.1.2、2.1.3方法绘制分别得到支链淀粉标准曲线y=1.181 6x-0.003 4(R2=0.995 5),直链淀粉的标准曲线y=10.961 0x-0.006 0(R2=0.990 0),2种标准曲线回归方程的相关系数均大于0.99,具有很好的线性关系。
2.1.2 不同大米中支链和直链淀粉含量差异分析
本研究采用双波长法结合酶标仪比色法测定了不同品种大米中的淀粉含量,按方法1.4.1.4测得各大米的水分含量W1和脂肪含量W2,再通过1.4.1.5中公式计算得到大米淀粉含量,如表3所示。大米中淀粉的含量因品种与产地环境的不同会出现一定差异,非糯米品种TT与YS的支链淀粉含量差异不显著,但在直链淀粉含量上YS明显高于TT(P<0.05),其余品种间均存在显著差异;相对非糯米而言,不同糯米品种间的淀粉含量差异显著性较小;总淀粉的差异主要由支链淀粉引起,这与相关研究结果一致[22]。本实验所用10种大米中,所有样品的支链淀粉含量(23.89%~83.59%)均高于直链淀粉含量(2.07%~10.66%),其中白水贡米的支链与总淀粉含量明显高于其他品种(P<0.05),分别为(83.59±2.70)%、(90.68±2.88)%;贵州梯田大米(TT)的支链、直链淀粉含量比最大(13.94%),晚稻大米(WD)最小(5.83%)。
表3 不同品种大米原料成分的含量
Table 3 Content of ingredients in different varieties of rice

样品编号品种大米类型支链淀粉含量/%直链淀粉含量/%总淀粉含量/%支直比/%TT野香优籼米 78.61±0.61b5.64±0.27d84.25±0.88b13.94PJ盐丰籼米 72.38±1.55c10.66±0.14a83.04±1.59b6.79WD野香优籼米 55.11±0.91d9.46±0.22b64.57±1.14c5.83YST香优557籼米 76.95±1.85b10.33±0.17a87.28±2.02ab7.45BS玉针香籼米 83.59±2.70a7.09±0.18c90.68±2.88a11.79WC吉粘10号粳糯米29.75±1.26e2.81±0.22e32.56±1.48d10.59YJ7∗未知粳糯米23.89±0.91f2.07±0.09f25.97±1.00e11.54YJ9未知粳糯米24.58±0.51f2.72±1.04e27.30±1.55e9.04XHC苟岑当糯米 29.31±2.07e2.50±0.18ef31.81±2.25d11.72XHY苟扬当糯米 27.42±1.26ef2.27±0.22ef29.69±1.48de12.08
注:“*”表示大米产于2017年,其余均为2019年;同一列中不同小写字母表示差异显著(P<0.05)
2.2 米酒发酵液中葡萄糖的含量
2.2.1 葡萄糖标准曲线的选择及验证
在1.4.3.1条件下得到不同范围的葡萄糖标准曲线(图2-a):0~10 g/L:y=0.443 2x+0.240 1(R2=0.991 9);0~8 g/L:y=0.469 3x+0.167 1(R2=0.993 5);0~6 g/L:y=0.504 1x+0.092 0(R2=0.997 1),3个范围的回归方程的相关系数均在0.99以上,具有良好的线性关系。而范围越小,R2值越高,因此选择0~6 g/L作为本次葡萄糖含量测定的标准曲线。
为进一步确定方法的可靠性,按照1.4.3.2实验方法对葡萄糖标准曲线进行验证,由图2可知,250 g/L葡萄糖标准溶液与0~6 g/L的标准曲线中结果更接近,更适合用于测定米酒发酵液中葡萄糖的含量。
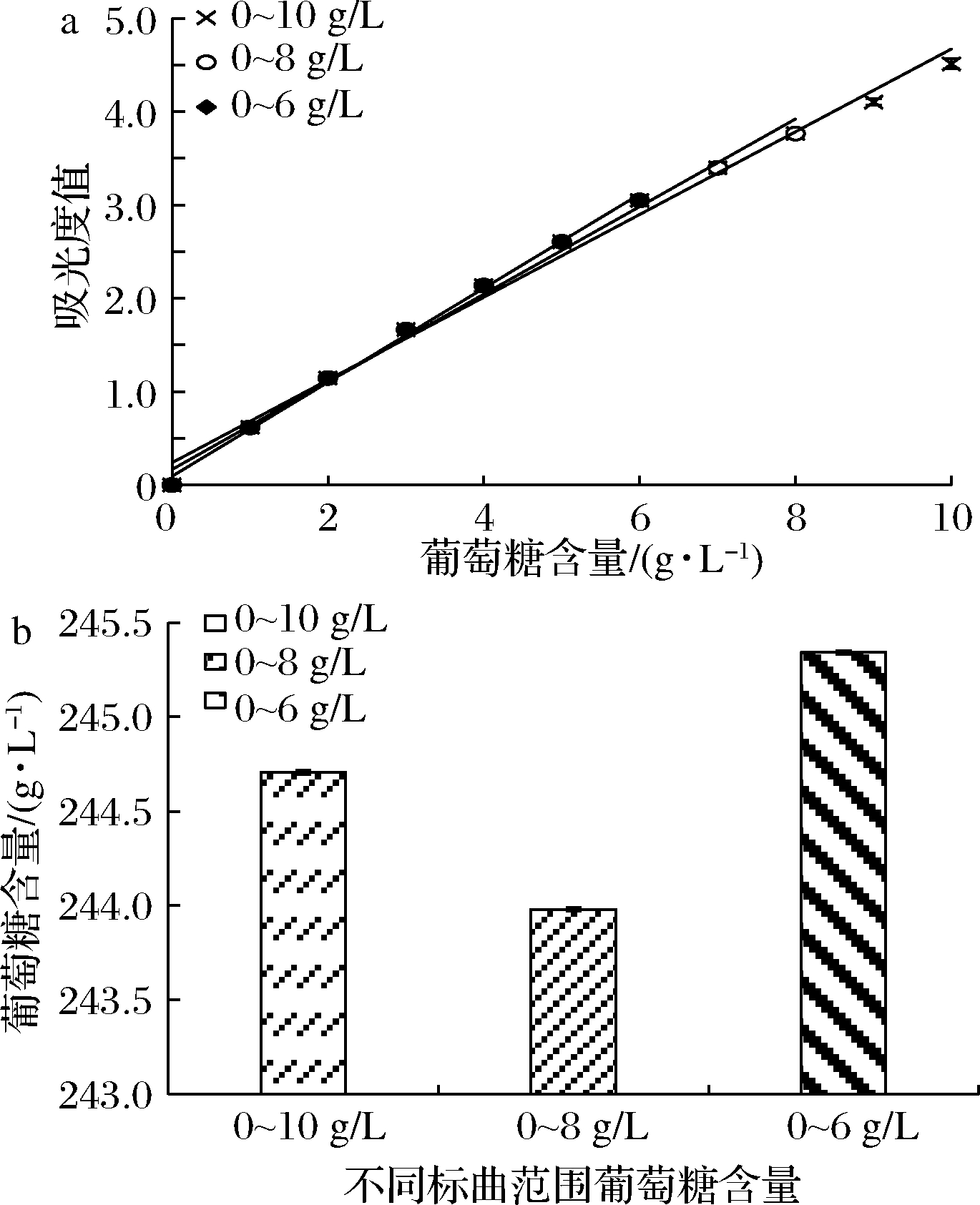
a-不同范围葡萄糖标准曲线;b-葡萄糖标准曲线的验证
图2 不同范围的葡萄糖标准曲线与验证
Fig.2 Different range of glucose standard curve and verification
2.2.2 米酒发酵过程中葡萄糖的含量变化
在米酒发酵过程中,淀粉经酶解后成为葡萄糖,为微生物的生长繁殖提供能量,酵母菌不断利用糖代谢产生酒精直到发酵结束,葡萄糖含量的变化一定程度上反映了糖化与发酵速度的平衡和协调关系[23]。由图3-b可知,10种大米发酵的米酒在0~1阶段(发酵前期)消耗的葡萄糖量皆多于1~2阶段(发酵后期),这可能与酵母菌在不同阶段的活跃程度有关,发酵前期菌体活性较高,生长代谢活跃,葡萄糖消耗量大,随发酵时间延长,酵母菌生长趋于衰亡而导致代谢缓慢。图3-a和图3-b显示了米酒整个发酵过程中葡萄糖的含量变化,空白组(未接菌)中淀粉逐渐水解为葡萄糖但未被消耗而使葡萄糖含量持续增加,接菌米酒发酵液中的葡萄糖被酵母菌利用转化为酒精使其含量呈持续下降趋势[24]。图3-c是通过3种不同方式计算的米酒发酵过程中葡萄糖总消耗量的对比图,由图3可知,以CO2失重计算的葡萄糖总消耗量与以酒精度计算的消耗量最接近,而DNS法测得的结果稍偏高,以酒精度计算消耗的葡萄糖消耗总量最低,说明酵母菌除了将葡萄糖代谢为酒精外,还生成其他的代谢副产物。不同原料间葡萄糖的消耗量(DNS法)也存在一定差异,WC与其他原料相比显著偏高,BS、YS、WD和TT之间无显著差异,YJ7、YJ9、XHY、XHC和PJ之间也无显著差异,但与BS、YS、WD和TT相比显著偏高。另外,接菌米酒发酵液中葡萄糖的含量都呈下降趋势,但是酵母菌对不同原料的葡萄糖消耗量不尽相同,可见酵母对不同原料中物质成分的利用存在差别,由此推测原料中淀粉含量的差异会通过影响米酒发酵过程中葡萄糖的代谢进而影响米酒的风味品质,这一点还需要进一步研究证实。
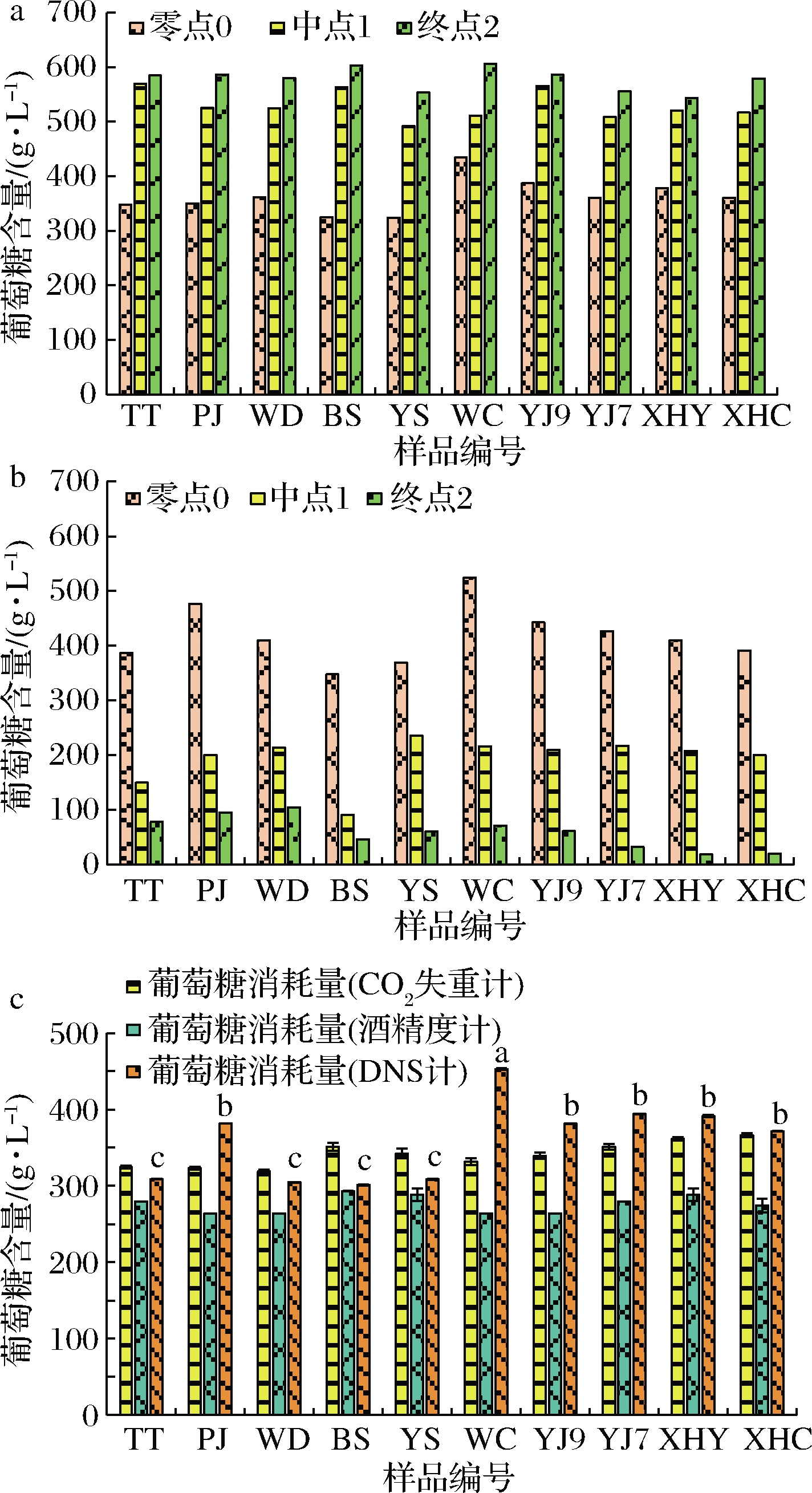
a-空白组;b-发酵米酒;c-不同计算方式的葡萄糖消耗量
图3 米酒发酵过程中葡萄糖的含量变化
Fig.3 Changes of glucose content during rice wine fermentation 注:小写字母代表显著水平P<0.05,不同小写字母表示 存在显著差异,相同小写字母表示没有显著差异
2.3 淀粉与葡萄糖含量之间的相关性
由于目前米酒品质与原料成分的关系尚未明确建立,本研究在淀粉理论与实际转化葡萄糖的基础上进一步分析两者间的相关联系,推测其对米酒品质风味差异的影响,从而进行原料选择。总淀粉含量少的糯米原料(WC、YJ9、YJ7、XHY和XHC)所制作的米酒发酵液中葡萄糖的含量稍低于非糯米原料(TT、PJ、WD、BS和YS),淀粉的支直比与米酒发酵前期的葡萄糖消耗量呈现相似趋势,如图4-a所示,支直比越高的原料,其制作的米酒在发酵前期消耗的葡萄糖量则越多(不含TT),初步说明原料中淀粉的支直比与米酒发酵过程中葡萄糖被酵母菌的利用代谢具有较大相关性。有相关研究表示支链与直链淀粉的比值超过10.44时,则可用于米酒的酿造,而低于6.57时,酿造的米酒会产生苦涩感[25]。因此,本实验通过对不同品种大米的研究发现除晚稻大米(WD)外,所有原料的支链、直链淀粉比值均大于6.57,皆可用于米酒的酿造,其中糯米的支直比均值大于非糯米原料,与多数研究优先选择糯米作为米酒的酿造原料一致。
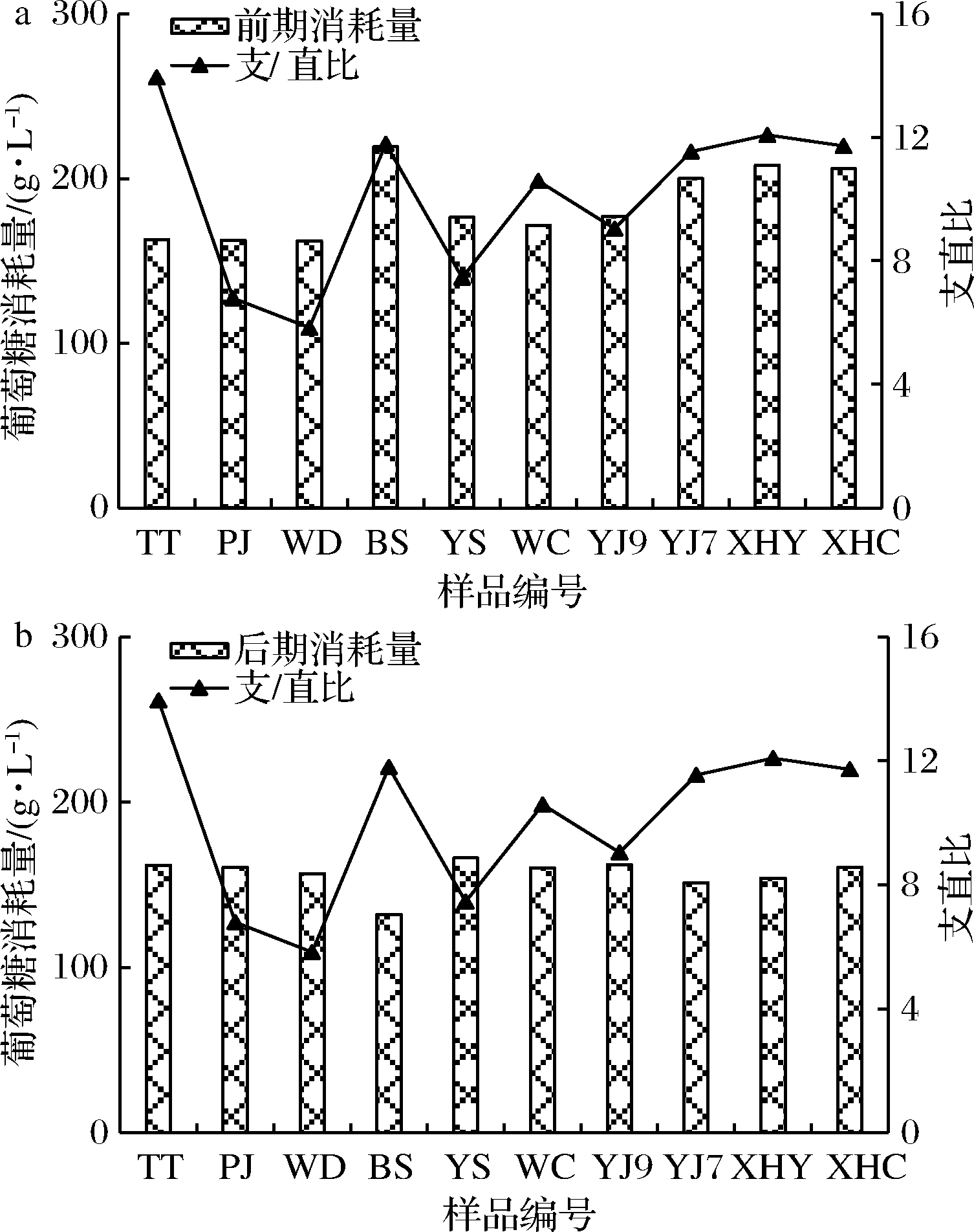
a-支直比与前期葡萄糖消耗量的变化; b-支直比与后期葡萄糖消耗量的变化
图4 淀粉与葡萄糖的关系
Fig.4 The relationship between starch and glucose
10种原料的淀粉与葡萄糖的相关性分析显示(表4),米酒发酵过程中葡萄糖的消耗量与淀粉呈现一定相关性,其中后期葡萄糖消耗量、总葡萄糖消耗量与支链淀粉、总淀粉的相关系数绝对值均大于0.6,表现出强相关性,并在P<0.01水平上极显著负相关,后期和总葡萄糖消耗量与大米品种的相关系数分别达到0.761 和0.506,同样体现了较强相关性,在P<0.01水平上极显著正相关,说明米酒发酵过程中葡萄糖的消耗与大米品种、淀粉含量具有较强相关性。非糯米原料层面的相关性分析发现,后期葡萄糖消耗量与直链淀粉的相关性系数达到0.704,相关性很强,在P<0.01 水平上极显著相关。相较非糯米而言,糯米发酵米酒的葡萄糖消耗量与大米品种更显著相关。直链淀粉主要与后期葡萄糖消耗量和葡萄糖总消耗量具有较强相关性,仅在糯米原料中表现出与前期葡萄糖消耗量的中等相关,这可能与糯米原料的总淀粉含量较低有关。葡萄糖消耗量与大米品种(4种因素叠加检测相关性)呈现的相关性最多,且相关系数值最高。
表4 淀粉与葡萄糖的相关性分析
Table 4 Correlation analysis of starch and glucose

原料葡萄糖消耗量大米品种支链淀粉直链淀粉总淀粉支/直比前期葡萄糖消耗量-0.255-0.100-0.145-0.0490.04310种原料后期葡萄糖消耗量0.761∗∗-0.615∗∗-0.429∗-0.665∗∗-0.232葡萄糖总消耗量 0.506∗∗-0.727∗∗-0.585∗∗-0.724∗∗-0.191前期葡萄糖消耗量-0.604∗-0.110-0.3090.1530.236非糯米原料后期葡萄糖消耗量-0.4570.1140.704∗∗-0.131-0.516∗葡萄糖总消耗量 -0.342-0.0190.4650.067-0.325前期葡萄糖消耗量-0.738∗∗0.0450.548∗0.127-0.325糯米原料后期葡萄糖消耗量0.562∗0.191-0.5100.1360.453葡萄糖总消耗量 -0.699∗∗0.2460.4360.331-0.124西南原料前期葡萄糖消耗量-0.2900.046-0.3140.1330.501∗后期葡萄糖消耗量0.764∗∗-0.601∗∗-0.291-0.674∗∗-0.381葡萄糖总消耗量 0.832∗∗-0.857∗∗-0.789∗∗-0.871∗∗-0.019前期葡萄糖消耗量0.4500.2940.2920.295-0.218东北原料后期葡萄糖消耗量0.762∗∗-0.663∗-0.718∗∗-0.677∗0.630∗葡萄糖总消耗量 0.155-0.283-0.345-0.2960.360
注:**表示在0.01水平(双侧)上极显著,*表示在0.05水平(双侧)上显著;0.8~1.0表示极强相关,0.6~0.8表示强相关,0.4~0.6表示中等程度相关,0.2~0.4表示弱相关;下划线表示强相关和极强相关
综上所述,在所有原料发酵米酒过程中,葡萄糖的前期消耗量与淀粉间的相关较弱,而与后期葡萄糖消耗量则均呈现负相关,主要因为酵母菌在发酵前期代谢较快,到发酵后期逐渐减缓所致。通过非糯米和糯米原料的相关性分析对比发现,直链淀粉与非糯米发酵过程中葡萄糖的后期消耗量相关性极强,糯米原料则是与葡萄糖的前期消耗量具有中等相关。另外,东北原料相较西南原料,其葡萄糖的消耗量与淀粉有更好的正相关性,但西南原料的葡萄糖消耗量与原料呈现更强的相关性,由于东北和西南原料品种不相同,因此该相关性只能部分说明品种与产区的叠加影响。总之,不同品种、不同地区的原料能对米酒的发酵造成不同程度的影响,此结果为深入了解原料成分与发酵过程中淀粉和葡萄糖的关系,以及为原料品种的选择奠定了基础。
3 结论
本研究利用酶标仪比色法结合双波长及DNS法测定淀粉和葡萄糖含量,选择支链淀粉测定与参比波长分别为538、755 nm,直链淀粉测定与参比波长分别为632、438 nm作为最佳淀粉检测条件,并在此条件下建立的标准曲线线性关系良好、可靠,样品检测结果准确性高;葡萄糖质量浓度在0~6 g/L时,线性关系最好,y=0.504 1x+0.092 0(R2=0.997 1)。10种大米原料中,样品的支链淀粉均比直链淀粉含量高,支/直比范围在5.83%~13.94%,以白水贡米(BS)的支链淀粉和总淀粉含量最高;糯米原料(WC、YJ9、YJ7、XHY和XHC)中总淀粉含量均低于非糯米,但在发酵过程中的葡萄糖消耗量却高于非糯米原料,且对于糯米原料而言,酵母菌代谢消耗的葡萄糖量均更接近于葡萄糖总含量,足以说明酵母菌能更好的利用糯米中的营养物质,更表现其对不同原料中物质成分的利用是存在差别的,且淀粉与葡萄糖的相关性也体现了不同原料成分对米酒发酵的不同程度的影响效应。
以上研究结论是否依赖于种植地区环境等相关因素还有待更深入的研究,这为今后米酒产业发展及米酒原料选择提供了数据支撑。目前,有关酶标仪检测淀粉与葡萄糖含量的研究还鲜有报道,对于米酒酿造原料中淀粉与葡萄糖含量变化之间的联系,及对米酒品质的影响也有待进一步的探究。
[1] WEI X L, LIU S P, YU J S, et al.Innovation Chinese rice wine brewing technology by bi-acidification to exclude rice soaking process[J].Journal of Bioscience and Bioengineering, 2017, 123(4):460-465.
[2] MENG L P, LIN H, PAN S L, et al.Chinese rice wine polyphenol compounds inhibit vascular smooth muscle cell dedifferentiation and its mechanism[J].International Journal of Clinical and Experimental Medicine, 2016, 9(9):17 539-17 548.
[3] CHEN T, WU F H, GUO J J, et al.Effects of glutinous rice protein components on the volatile substances and sensory properties of Chinese rice wine[J].Journal of the Science of Food & Agriculture, 2020, 100(8):3 297-3 307.
[4] 张高楠, 苏钰亭, 赵思明, 等.4种甜米酒主要营养成分与滋味特征对比及分析[J].华中农业大学学报, 2018, 37(2):89-95.
ZHANG G N, SU Y T, ZHAO S M, et al.Analyses of nutritional composition in four kinds of fermented sweet rice wines and sensory evaluation with electronic tongue[J].Journal of Huazhong Agricultural University, 2018, 37(2):89-95.
[5] LAI Q, LI Y H, WU Y W, et al.The quality of rice wine influenced by the crystal structure of rice starch[J].Journal of Food Science and Technology-Mysore, 2019, 56(4):1 988-1 996.
[6] 程度, 邱树毅.高粱对酱香型白酒品质影响研究进展[J/OL].食品科学, 2021.https://kns.cnki.net/kcms/detail/11.2206.TS.20210406.1527.055.html.
CHEN D, QIU S Y.Research progress on the effect of sorghum on the quality of Maotai-flavor liquor[J/OL].Food Science, 2021.https://kns.cnki.net/kcms/detail/11.2206.TS.20210406.1527.055.html.
[7] 袁国亿, 王春晓, 何宇淋, 等.酶标仪比色法检测浊米酒中高级醇含量的研究[J].食品与发酵工业, 2021, 47(6):221-227.
YUAN G Y, WANG C X, HE Y L, et al.Detection of higher alcohols content in turbid rice wine by the colorimetric method of microplate reader[J].Food and Fermentation Industries, 2021, 47(6):221-227.
[8] HUANG G D, REN H, WANG A L, et al.iTRAQ-based proteomic analysis reveals the molecule mechanism of reducing higher alcohols in Chinese rice wine by nitrogen compensation[J].Annals of Microbiology, 2021, 71(1):1-13.
[9] LI W, WANG J H, ZHANG C Y, et al.Regulation of Saccharomyces cerevisiae genetic engineering on the production of acetate esters and higher alcohols during Chinese Baijiu fermentation[J].Journal of Industrial Microbiology & Biotechnology, 2017, 44(6):949-960.
[10] DONG J, XU H Y, ZHAO L B, et al.Enhanced acetate ester production of Chinese liquor yeast by overexpressing ATF1 through precise and seamless insertion of PGK1 promoter[J].Journal of Industrial Microbiology & Biotechnology, 2014, 41(12):1 823-1 828.
[11] 邹凌波, 王栋, 余海燕, 等.基于理化指标和风味成分的酿造米酒分类及其相关特性分析[J].食品与发酵工业, 2019, 45(13):78-84.
ZOU L B, WANG D, YU H Y, et al.Classification and characteristics of typical fermented Mijiu based on physicochemical parameters and flavor components[J].Food and Fermentation Industries, 2019, 45(13):78-84.
[12] WU Q, CAO S, XU Y.Effects of glutinous and nonglutinous sorghums on Saccharomyces cerevisiae fermentation for Chinese liquor making[J].International Journal of Food Science & Technology, 2017, 52(6):1 348-1 357.
[13] 唐佳代. 贵州传统小曲微生物群落结构及功能酵母的筛选[D].贵阳:贵州大学, 2019.
TANG J D.Microbial community structure and screening of functional yeasts in Guizhou traditional Xiaoqu[D].Guiyang:Guizhou University, 2019.
[14] 黄岩, 张燕萍.双波长法测定糯米粉支链淀粉的含量[J].食品科技, 2014, 39(7):138-141.
HUANG Y, ZHANG Y P.Determination of amylopectin in the glutinous rice flour by dual-wavelength spectrophotometry[J].Food Science and Technology, 2014, 39(7):138-141.
[15] 谭亮, 董琦, 耿丹丹, 等.双波长比色法测定不同产地和品种青稞中直链淀粉和支链淀粉的含量[J].食品工业科技, 2015, 36(2):79-84.
TAN L, DONG Q, GENG D D, et al.Determination of amylase and amylopectin in hullessbarley from different habitats and varieties by dual-wavelength colorimetric method[J].Science and Technology of Food Industry, 2015, 36(2):79-84.
[16] WANG C X, TANG J D, QIU S Y.Profiling of fungal diversity and fermentative yeasts in traditional Chinese Xiaoqu[J].Frontiers in Microbiology, 2020, 11:2 103.
[17] 焦梦悦, 高涵, 王伟娜, 等.四种测定直链淀粉和支链淀粉方法的比较[J].食品工业科技, 2019, 40(12):259-264.
JIAO M Y, GAO H, WANG W N, et al.Comparison of four methods for the determination of amylose and amylopectin[J].Science and Technology of Food Industry, 2019, 40(12):259-264.
[18] 厦门大学化学系分析化学教研室. 双波长分光光度法原理简介[J].分析化学, 1978, 6(3):224-231.
Department of Analytical Chemistry, Department of Chemistry, Xiamen University.Brief introduction to the principle of Dual Wavelength Spectrophotometry[J].Chinese Journal of Analytical Chemistry, 1978, 6(3):224-231.
[19] 范明顺, 张崇玉, 张琴, 等.双波长分光光度法测定高粱中的直链淀粉和支链淀粉[J].中国酿造, 2008(11):85-87.
FAN M S, ZHANG C Y, ZHANG Q, et al.Determination of amylose and amylopectin content in sorghum by dual wavelength method[J].China Brewing, 2008(11):85-87.
[20] 刘姗, 王建军, 范小娟, 等.稻米直链淀粉检测技术的研究现状与展望[J].中国粮油学报, 2015, 30(3):140-146.
LIU S, WANG J J, FAN X J, et al.Status and prospects for determination for amylose content in rice[J].Journal of the Chinese Cereals and Oils Association, 2015, 30(3):140-146.
[21] 张雪梅, 张玲, 高飞虎, 等.不同分散温度、时间对双波长法测定大米中淀粉质量分数的影响研究[J].西南大学学报(自然科学版), 2020, 42(4):49-55.
ZHANG X M, ZHANG L, GAO F H, et al.The effects of different conditions (dispersion temperature and time) in dual wavelength violet spectrophotographic determination of rice starch content[J].Journal of Southwest University (Natural Science), 2020, 42(4):49-55.
[22] 马艳弘, 钟小仙, 乔月芳, 等.双波长法测定珍珠粟淀粉中直链和支链淀粉的含量[J].江苏农业科学, 2016, 44(12):331-334.
MA Y H, ZHONG X X, QIAO Y F, et al.Determination of amylose and amylopectin in pearl millet starch by dual wavelength method[J].Jiangsu Agricultural Sciences, 2016, 44(12):331-334.
[23] 黄治国, 侯海波, 罗惠波, 等.浓香型白酒酒醅发酵过程中淀粉和还原糖的变化规律研究[J].中国酿造, 2012, 31(7):107-110.
HUANG Z G, HOU H B, LUO H B, et al.Changes of starch and reducing sugars of fermented grains in fermentation of srrong-flavor liquor[J].China Brewing, 2012, 31(7):107-110.
[24] 李玉珍, 肖怀秋, 兰立新, 等.大米液态发酵过程中蛋白质及还原糖的动态变化初探[J].江苏调味副食品, 2008, 25(3):19-21.
LI Y Z, XIAO H Q, LAN L X, et al.Research on the dynamic changes of protein and reducing sugar in the process of rice fermentation with liquid-state[J].Jiangsu Condiment and Subsidiary Food, 2008, 25(3):19-21.
[25] 蒋世云. 不同淀粉质对米甜酒品质影响的研究[J].中国酿造, 2003(3):23-25.
JIANG S Y.Study on the effect of different types of starch on the quality of glutinous rice wine[J].China Brewing, 2003(3):23-25.