糖尿病是一种严重影响人体健康的代谢性疾病,常伴有严重的并发症,如神经病变、视网膜病变、肾病等[1]。近年来,大量的研究表明氧化应激的发生是糖尿病及其并发症的主要发病机理之一[2]。而抗氧化剂能够消除体内过多的自由基,防止氧化损伤,是预防和治疗糖尿病及其并发症的有效手段。α-葡萄糖苷酶则是糖尿病患者餐后血糖控制不佳的主要原因之一,抑制α-葡萄糖苷酶可以有效地避免餐后血糖飙升并预防糖尿病并发症的发生。目前常用的抗氧化剂及α-葡萄糖苷酶抑制剂多为合成的药物,开发安全有效的天然抗氧化剂和α-葡糖苷酶抑制剂在食品和药品领域有着重要的意义。
多花黄精(Polygonatum cyrtonema Hua)作为药食同源中药材,具有补气养阴,健脾,润肺,益肾等功效[3];多花黄精与肉类一起烹饪,或制成茶或药酒,已成为非常流行的食品或饮品。现代药理研究显示,多花黄精在抗氧化、抗衰老、增强免疫力、抗肿瘤、降血糖等方面表现出较好的药理活性[4]。不同种类的活性成分,如甾体皂苷类、黄酮类、多糖类、凝集素、氨基酸和生物碱类等组成了多花黄精的效应物质[5]。多花黄精生品“戟人咽喉”,经反复蒸、晒后,色泽由浅入深、甜味由无到有、刺激性气味逐渐减弱直至消失的同时补脾润肺益肾的作用增强[6],其变化的本质仍不清楚。当前,多花黄精的研究主要集中在黄精多糖,其他不同极性部位的成分及活性研究很少。本研究在测定多花黄精生品(P. cyrtonema,PC)与多花黄精蒸制品(steam-processed P. cyrtonema,PCS)醇提物的多糖、总黄酮和总多酚含量的基础上,对多花黄精炮制前后不同极性部位的抗氧化及降血糖活性进行评估,旨在筛选最佳活性部位,为进一步研究和利用多花黄精作为天然抗氧化剂和降血糖食品提供理论依据。
1 材料与方法
1.1 材料与试剂
多花黄精生品及蒸制品于2021年购于安徽省六安市金寨森沣生物有限公司,经安徽中医药大学药学院刘守金教授鉴定为百合科植物多花黄精的干燥根茎和制黄精。DPPH、ABTS、还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)和抗坏血酸(维生素C),阿拉丁试剂有限公司(上海,中国);硝基蓝四氮唑(nitrotetrazolium blue chloride,NBT)、浓硫酸、硫酸亚铁、磷酸钠、双氧水,国药集团化学试剂有限公司;对硝基苯-β-D-吡喃半乳糖苷(p-nitrophenyl-β-D-galactopyranoside,PNPG)、α-葡萄糖苷酶,上海源叶生物科技有限公司。
1.2 仪器和设备
Multiskan spectrum全波长酶标仪,美国赛默飞世尔科技有限公司;UV-2700紫外可见分光光度计,日本岛津公司;XP26分析天平(十万分之一),瑞士Mettler-Toledo公司;Simplicity-185超纯水仪,美国Millipore公司;GZX-9070电热恒温干燥箱,上海博讯公司。
1.3 实验方法
1.3.1 样品的制备
醇提物的制备:分别称取100 g多花黄精生品与蒸制品,用1 L 50%的乙醇浸泡1 h后,加热回流提取3次,每次2 h,过滤,滤液减压浓缩至干,冷冻干燥,计算出膏率。
不同极性萃取部位的制备:取醇提物,加入250 mL温水混悬,冷却至室温后,依次用等体积的石油醚、乙酸乙酯、正丁醇溶液分别萃取3次,减压回收溶剂,冷冻干燥后,得到各萃取部位,称重,保存备用。
1.3.2 多花黄精生品与蒸制品醇提物中多糖、总黄酮和总多酚含量测定
1.3.2.1 多糖含量测定
采用苯酚-硫酸法[7]进行葡萄糖标准曲线的建立和样品的测定。在490 nm处测得标准曲线的回归方程为y=22.036x+0.003,r= 0.999 5, 样品吸光度代入标准曲线计算出含量。
1.3.2.2 总黄酮含量测定
采用硝酸铝比色法[8]进行芦丁标准曲线的建立和样品的测定。510 nm 处测得标准曲线的回归方程为y=12.203x-0.008(r=0.999 5)。多花黄精生品及蒸制品醇提物总黄酮含量以1g干样品中芦丁当量表示(mg/g)。
1.3.2.3 总多酚含量测定
采用福林-酚法[9]对没食子酸进行标准曲线的建立以及样品的测定。于760 nm下测定吸光值,测得标准曲线的回归方程为y=0.717x+0.013 (r=0.999 5)。多花黄精生品及蒸制品醇提物含量以1g干样品中没食子酸当量表示(mg/g)。
1.3.3 体外抗氧化活性
1.3.3.1 DPPH自由基清除能力的测定
参考文献[10]的方法,并稍作调整。取1 mL不同质量浓度的各极性萃取相溶液及维生素C溶液(0、0.2、0.4、0.6、0.8、1.0 mg/mL),加入2 mL 0.2 mmol/L的DPPH-乙醇溶液,摇匀,避光反应30 min,在517 nm下测定吸光度,平行测定3次。以蒸馏水代替样品为空白对照(A0),以蒸馏水代替反应液为(A2),维生素C作阳性对照,清除率计算如公式(1)所示:
清除率![]()
(1)
式中:A1样品吸光度,A2为样品对照组吸光度,A0为空白对照组吸光度。
1.3.3.2 羟自由基(·OH)清除能力的测定
参考文献[11]的方法,并稍作调整。取1 mL不同质量浓度的各极性萃取相及维生素C溶液(0、0.2、0.4、0.6、0.8、1 mg/mL)与1 mL FeSO4(6 mmol/L),1 mL H2O2(6 mmol/L)混合,37 ℃孵育10 min,再加1 mL水杨酸-乙醇溶液(6 mmol/L)混匀,37 ℃孵育30 min。在510 nm下测定吸光度。以蒸馏水做空白对照,维生素C作阳性对照,按公式(1)计算清除率。
1.3.3.3 ABTS阳离子自由基清除能力的测定
参考文献[12]的方法,并稍作改进。7 mmol/L ABTS溶液与2.45 mmol/L过硫酸铵混合避光氧化12 h,ABTS混合液用pH=7.4的PBS稀释至在734 nm波长下,吸光度为0.8±0.02。取1 mL不同质量浓度的各极性萃取相及维生素C溶液(0、0.2、0.4、0.6、0.8、1.0 mg/mL)与2 mL ABTS混合液混合,室温放置6 min,在734 nm处测吸光度。以蒸馏水代替样品为空白对照(A0),以蒸馏水代替反应液为(A2),维生素C作阳性对照,按公式(1)计算清除率。
1.3.3.4 超氧阴离子自由基![]() 清除能力的测定
清除能力的测定
参考文献[13]的方法,并稍作修改。取1 mL不同质量浓度的各极性萃取相及维生素C溶液(0、0.2、0.4、0.6、0.8、1.0 mg/mL),与1 mL 557 μmol/L NADH、1 mL 45 μmol/L 吩嗪硫酸甲酯(phenazine methosulfate,PMS)、1 mL 108 μmol/L NBT混匀于25 ℃下温浴5 min,在波长560 nm下测定吸光度。以蒸馏水做空白对照,维生素C作阳性对照。按公式(1)计算清除率。
1.3.4 α-葡萄糖苷酶的抑制活性
以阿卡波糖作为阳性对照,参考文献[14]的方法并做适当修改。各极性萃取相均用磷酸盐缓冲液(pH =6.9)稀释成不同质量浓度(0.5、1.0、1.5、2.0、2.5、3.0、4.0 mg/mL)的样品溶液。于96孔板中加入20 μL不同质量浓度的样品溶液和110 μL的磷酸缓冲液(pH=6.8),20 μL 0.5 U/mL的α-葡萄糖苷酶溶液,混匀后置于37 ℃的孵育箱放置15 min,然后加入20 μL 3 mmol/L的PNPG,继续在37 ℃条件下孵育30 min,最后加入1.0 mol/L Na2CO3终止液100 μL于405 nm处测定吸光度(A),平行测定3次。抑制率计算如公式(2)所示:
抑制率![]()
(2)
式中:Ac,对照组的吸光度,Ab,不含PNPG对照组,As,待测样品组的吸光度。
1.4 统计学处理方法
实验数据采用Origin 9.0,SPSS 20.0软件进行数据处理,绘图及分析。试验数据均为3次重复测定结果的平均值,计算结果以平均数±标准差表示。
2 结果与分析
2.1 黄精醇提物的总成分分析
多花黄精生品和蒸制品醇提物的多糖含量,总黄酮含量,总多酚含量存在显著性差异(P<0.001)。生品在炮制后,多糖含量由(11.390±0.013)%降低至(9.092±0.021)%,总黄酮含量由(0.932±0.001) mg/g上升至(1.082±0.005) mg/g,总酚含量由(1.128±0.002) mg/g 上升至(1.455±0.015) mg/g,结果表明反复蒸制后多花黄精多糖含量降低,总黄酮和总酚含量增多。
2.2 自由基清除能力
2.2.1 DPPH自由基的清除能力
如图1-a和图1-e所示,在质量浓度为0~1.0 mg/mL时,多花黄精生品和蒸制品各极性萃取相均具有良好的清除能力,并呈浓度依赖性。多花黄精生品和蒸制品各极性萃取相清除能力顺序都为:乙酸乙酯相>水相>醇提物>正丁醇相>石油醚相。乙酸乙酯萃取相清除能力最强,在质量浓度为1.0 mg/mL时,生品乙酸乙酯相的清除率达75.56%,蒸制品乙酸乙酯相的清除率达90.71%,IC50=0.284 mg/mL,接近阳性对照维生素C,其IC50=0.128 mg/mL。蒸制品醇提物清除率为60.84%,大于生品醇提物清除率(50.80)%,且蒸制品IC50值为0.727 mg/mL,小于生品醇提物IC50值(0.940 mg/mL),蒸制品醇提物对DPPH 自由基的清除作用明显强于生品。说明炮制加工可提高多花黄精醇提物清除DPPH自由基的能力,且生品与蒸制品清除DPPH自由基的活性成分主要集中在乙酸乙酯相中。
2.2.2 ·OH的清除能力
如图1-b和图1-f所示,在质量浓度为0~1.0 mg/mL时,多花黄精炮制前后不同萃取相均表现出一定的清除·OH的能力,且与浓度呈正相关。生品各相清除能力顺序为:乙酸乙酯相>醇提物>水相>石油醚相>正丁醇相,蒸制品各相清除能力顺序为:乙酸乙酯相>醇提物>水相>正丁醇相>石油醚相。炮制前后各相抗氧化能力发生改变,多花黄精生品与蒸制品清除·OH活性成分主要集中在乙酸乙酯相中。蒸制品醇提物IC50值为0.850 mg/mL ,小于生品醇提物IC50值(0.896 mg/mL),二者相比,蒸制品的清除作用明显强于生品,说明多花黄精在蒸制后对·OH的清除能力有所增强。
2.2.3 ABTS阳离子自由基的清除能力
如图1-c和图1-g所示,多花黄精炮制前后不同极性萃取相均有良好的清除ABTS阳离子自由基的能力,在质量浓度为0~1.0 mg/mL时,随着质量浓度的增加,清除能力不断增强。多花黄精生品与蒸制品各萃取相清除能力顺序都为:乙酸乙酯相>水相>醇提物>正丁醇相>石油醚相。蒸制品醇提物IC50值为0.787 mg/mL,小于生品醇提物IC50值(0.931 mg/mL),二者相比,蒸制品醇提物的清除作用明显强于生品,这表明多花黄精蒸制后对ABTS阳离子自由基的清除能力有所增强。生品与蒸制品均是乙酸乙酯部位清除能力最强,说明多花黄精生品与蒸制品清除ABTS阳离子自由基的活性成分主要集中在乙酸乙酯相中。
![]() 的清除能力
的清除能力
如图1-d和图1-h所示,在质量浓度为0~1.0 mg/mL时,多花黄精炮制前后的各相均具有较好的清除![]() 的能力,并且呈现出一定的量效关系。生品各相清除能力顺序为:乙酸乙酯相>水相>醇提物>石油醚相>正丁醇相,蒸制品各相清除能力顺序为:乙酸乙酯相>醇提物>水相>正丁醇相>石油醚相,两者均是乙酸乙酯相的清除能力最强。在质量浓度为1.0 mg/mL时,生品乙酸乙酯相的清除率达到了80.55%,蒸制品清除率达到90.27%,接近阳性对照维生素C清除率(96.90%);蒸制品醇提物清除率(75.06%)大于生品醇提物清除率(41.33%),蒸制品醇提物IC50值为0.515 mg/mL,小于生品醇提物IC50(1.017 mg/mL),即蒸制品醇提物清除能力强于生品醇提物。说明炮制加工可提高多花黄精醇提物清除
的能力,并且呈现出一定的量效关系。生品各相清除能力顺序为:乙酸乙酯相>水相>醇提物>石油醚相>正丁醇相,蒸制品各相清除能力顺序为:乙酸乙酯相>醇提物>水相>正丁醇相>石油醚相,两者均是乙酸乙酯相的清除能力最强。在质量浓度为1.0 mg/mL时,生品乙酸乙酯相的清除率达到了80.55%,蒸制品清除率达到90.27%,接近阳性对照维生素C清除率(96.90%);蒸制品醇提物清除率(75.06%)大于生品醇提物清除率(41.33%),蒸制品醇提物IC50值为0.515 mg/mL,小于生品醇提物IC50(1.017 mg/mL),即蒸制品醇提物清除能力强于生品醇提物。说明炮制加工可提高多花黄精醇提物清除![]() 的能力,且生品与蒸制品清除
的能力,且生品与蒸制品清除![]() 的活性成分主要集中在乙酸乙酯相中。
的活性成分主要集中在乙酸乙酯相中。

a-生黄精不同极性部位对DPPH自由基清除能力;b-生黄精不同极性部位对·OH清除能力;c-生黄精不同极性部位对ABTS阳离子 自由基清除能力;d-生黄精不同极性部位对![]() 清除能力;e-制黄精不同极性部位对DPPH自由基清除能力;f-制黄精不同 极性部位对·OH清除能力;g-制黄精不同极性部位对ABTS阳离子自由基清除能力;h-制黄精不同极性部位对
清除能力;e-制黄精不同极性部位对DPPH自由基清除能力;f-制黄精不同 极性部位对·OH清除能力;g-制黄精不同极性部位对ABTS阳离子自由基清除能力;h-制黄精不同极性部位对![]() 清除能力
清除能力
图1 多花黄精不同极性萃取相对DPPH自由基、·OH、ABTS阳离子自由基和![]() 的清除能力
的清除能力
Fig.1 In vitro antioxidant activities of PC and PCS′s different polar extracts evaluated by the DPPH, ·OH, ABTS and ![]()
2.3 对α-葡萄糖苷酶抑制活性
如图2-a和图2-b所示,多花黄精炮制前后各萃取相均对α-葡萄糖苷酶具有抑制活性。在质量浓度为0~4.0 mg/mL时,生品各相对α-葡萄糖苷酶的抑制作用强弱为:乙酸乙酯相>水相>正丁醇相>醇提物>石油醚相,而蒸制品的排序为:乙酸乙酯相>水相>醇提物>正丁醇相>石油醚相。生品与蒸制品的乙酸乙酯相抑制率均高于其他萃取相,在质量浓度为4.0 mg/mL时,生品乙酸乙酯相的抑制率达到了59.38%,蒸制品乙酸乙酯相的抑制率达到了87.21%,IC50值为1.369 mg/mL,表明生品与蒸制品乙酸乙酯相中的活性成分对α-葡萄糖苷酶抑制能力最强。蒸制品醇提物抑制率为59.74%,大于生品醇提物抑制率36.34%,且蒸制品IC50值为2.560 mg/mL小于生品醇提物IC50值(4.331 mg/mL),蒸制品醇提物对α-葡萄糖苷酶抑制作用明显强于生品, 表明多花黄精蒸制后对α-葡萄糖苷酶的抑制活性有所增强。
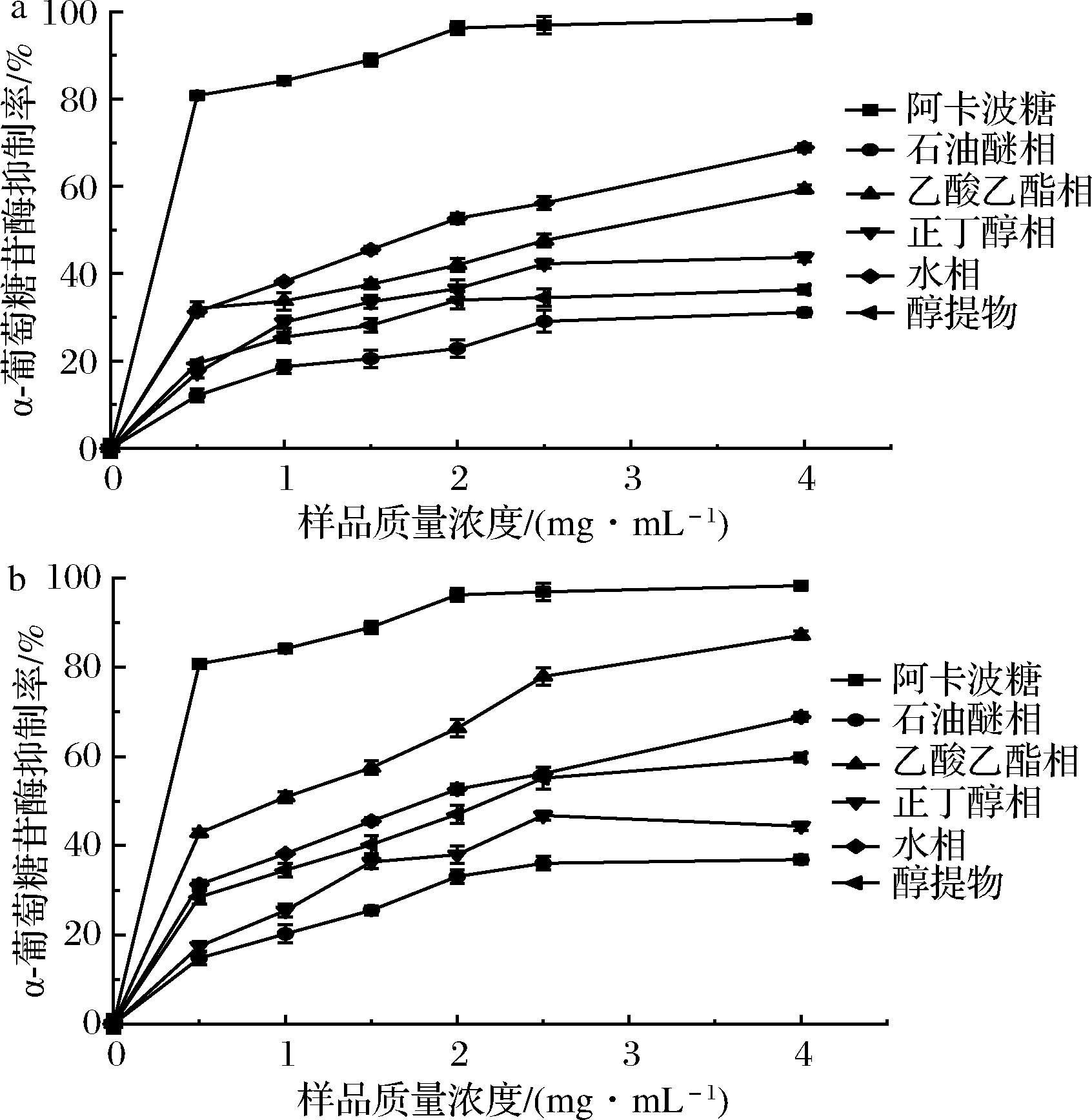
a-生黄精不同极性部位对α-葡萄糖苷酶的抑制率;b-制黄精不同 极性部位对α-葡萄糖苷酶的抑制率
图2 多花黄精不同极性部位对α-葡萄糖苷酶的抑制率
Fig.2 Relative α-glucosidase inhibition rates of PC and PCS′s different polar extracts
3 结论与讨论
本实验在分析多花黄精生品与蒸制品醇提物的物质组成基础上,测定了多花黄精生品与蒸制品醇提物体外抗氧化和降血糖活性。结果表明,多花黄精炮制后醇提物的多糖含量降低,总黄酮及总多酚含量增加,体外抗氧化活性和对α-葡萄糖苷酶抑制作用增加。综合4种自由基实验和α-葡萄糖苷酶抑制动力学实验分析,多花黄精生品与蒸制品的乙酸乙酯部位活性最强,石油醚部位相对较弱,表明多花黄精不同极性部位的抗氧化能力和降血糖活性存在差异。多酚类物质和黄酮类物质可通过促进胰岛素的合成与分泌,抑制葡萄糖的摄取、转运等方面调节血糖[15-16]。多花黄精炮制过程中黄酮类及多酚类成分会富集,使其含量增加,这可能是炮制后的多花黄精抗氧化活性和抑制α-葡萄糖苷酶活性增强的原因。多酚类和黄酮类物质多集中在乙酸乙酯萃取相,提示多花黄精抗氧化及降血糖的活性物质可能与此两类成分相关。另外,炮制后的多花黄精多糖含量降低,可能是由于多花黄精在炮制过程中发生了美拉德反应,使得多糖被水解成了易于煎出的低聚糖,从而有利于药效的发挥。但是多花黄精中主要发挥活性作用的物质仍不明确,需要进一步深入研究。
[1] SHOBANA S, SREERAMA Y N, MALLESHI N G.Composition and enzyme inhibitory properties of finger millet (Eleusine coracana L.) seed coat phenolics:Mode of inhibition of α-glucosidase and pancreatic amylase[J].Food Chemistry, 2009, 115 (4):1 268-1 273.
[2] FRIEDEWALD W T.Effects of intensive glucose lowering in type 2 diabetes[J].Journal of Vascular Surgery, 2008, 48(3):770.
[3] 李亚霖, 周芳, 曾婷, 等.药用黄精化学成分与活性研究进展[J].中医药导报, 2019, 25(5):86-89.
LI Y L, ZHOU F, ZENG T, et al.Research progress on chemical components and activties of Huangjing (Polygonatum sibiricum red) [J].Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2019, 25 (5):86-89.
[4] LI L, LIAO B Y, THAKUR K, et al.The rheological behavior of polysaccharides sequential extracted from Polygonatum cyrtonema Hua[J].International Journal of Biological Macromolecules, 2018, 109:761-771.
[5] JIN J, LAO J, ZHOU R R, et al.Simultaneous identification and dynamic analysis of saccharides during steam processing of rhizomes of Polygonatum cyrtonema by HPLC-QTOF-MS/MS[J].Molecules, 2018, 23(11):2 855.
[6] 郑晓倩, 金传山, 张亚中, 等.黄精九蒸九晒炮制过程中糖类成分动态变化[J].中成药, 2020,42(7):1 837-1 841.
ZHENG X Q, JIN C S, ZHANG Y Z, et al.Dynamic changes of saccharides from Polygonatum cyrtonema during Nine-Steam-Nine-Bask processing[J].Chinese Traditional Patent Medicine, 2020, 42(7):1 837-1 841.
[7] 王迎香, 唐子惟, 彭腾, 等.苯酚-硫酸法测定酒蒸多花黄精多糖含量的优化[J].食品工业科技, 2021, 42(18):308-316.
WANG Y X, TANG Z W, PENG T, et al.Optimization of phenol sulfuric acid method for the polysaccharide content of wine-steamed Polygonatum cyrtonema Hua[J].Science and Technology of Food Industry, 2021, 42(18):308-316.
[8] CHEN G L, ZHANG X, CHEN S G, et al.Antioxidant activities and contents of free, esterified and insoluble-bound phenolics in 14 subtropical fruit leaves collected from the south of China[J].Journal of Functional Foods, 2017, 30(1):290-302.
[9] BANOTHU V, NEELAGIRI C, ADEPALLY U, et al.Phytochemical screening and evaluation of in vitro antioxidant and antimicrobial activities of the indigenous medicinal plant Albizia odoratissima[J].Pharmaceutical Biology, 2017, 55(1):1 155-1 161.
[10] SHIMADA K, FUJIKAWA K, YAHARA K, et al.Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J].Journal of Agricultural & Food Chemistry, 1992, 40(6):945-948.
[11] LI L, THAKUR K, LIAO B Y, et al.Antioxidant and antimicrobial potential of polysaccharides sequentially extracted from Polygonatum cyrtonema Hua[J].International Journal of Biological Macromolecules, 2018, 114:317-323.
[12] GRIFFIN N E, DURAKO M J.The effect of pulsed versus gradual salinity reduction on the physiology and survival of Halophila johnsonii Eiseman[J].Marine Biology, 2012, 159(7):1 439-1 447.
[13] WU W L, ZHU Y T, ZHANG L, et al.Extraction, preliminary structural characterization,and antioxidant activities of polysaccharides from Salvia miltiorrhiza Bunge[J].Carbohydrate Polymers, 2012, 87(2):1 348-1 353.
[14] 孟爱莲, 陈媛媛, 马嫄, 等.苦笋壳提取物不同极性相抗氧化与降血糖活性研究[J].食品与发酵工业, 2022,48(3):92-98.
MENG A L, CHEN Y Y, MA Y, et al.Antioxidant and hypoglycemic activities of different polar phases of bitter bambooshoot husk extract[J]. Food and Fermentation Industries, 2022,48(3):92-98.
[15] 黄修晴, 初众, 房一明, 等.植物多酚降血糖机制的研究进展[J].食品工业科技, 2021, 42(18):461-469.
HUANG X Q, CHU Z, FANG Y M, et al.Research progress on hypoglycemic mechanism of plant polyphenols[J].Science and Technology of Food Industry, 2021, 42 (18):461-469.
[16] HANHINEVA K, TÖRRÖNEN R, BONDIA-PONS I, et al.Impact of dietary polyphenols on carbohydrate metabolism[J].International Journal of Molecular Sciences, 2010, 11(4):1 365-1 402.