L-苯丙氨酸(L-phenylalanine,L-Phe)与L-酪氨酸(L-tyrosine,L-Tyr)、L-色氨酸(L-tryptophan,L-Trp)同属芳香族氨基酸,为莽草酸途径产物之一[1-2]。可作为新型甜味剂阿斯巴甜的合成前体[3],也可作为抗癌药物的载体[4],在食品与医药方面具有极大的应用价值,目前常采用微生物发酵法获取[5]。
微生物利用葡萄糖等为碳源合成L-Phe的代谢途径较长,需要经过糖酵解途径(glycolytic pathway,EMP)、柠檬酸(tricarboxylic acid,TCA)循环、戊糖磷酸途径(pentose phosphate pathway,PPP)与莽草酸途径(shikimic acid pathway),其中多个关键酶与L-Phe的合成关系密切。金属离子作为重要的酶激活剂,其种类与用量影响到关键酶活力的强弱进而影响到L-Phe 产量与糖酸转化率。金属离子对酶的激活/抑制作用机理错综复杂,表现为:不添加或添加过少的金属离子无法对酶起激活作用,如5×10-3~10×10-3moL/L的Mg2+可激活NADH+合酶,但低于或高于此浓度均无法起到激活作用;金属离子对酶的作用具有一定的选择性,如Ca2+对肌球蛋白腺三磷酸起到激活作用,却对脱羧酶有抑制作用;有时离子之间也有拮抗作用,如Ca2+可以抑制Mg2+激活的酶,再者金属离子之间也可以相互取代,如Mn2+离子可以取代Mg2+激活的激酶[6]。核黄素(维生素B2)在生物体内是重要辅酶黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)和黄素单核苷酸(flavin mononucleotide,FMN)的合成前体[7],FAD和FMN作为黄素蛋白的辅酶参与传递氢的有关代谢,在呼吸和生物氧化中起着重要的作用[8]。磷酸吡哆醛(pyridoxal phosphate,PLP)是细胞140多种酶的辅酶,在氨基酸的合成、相互转化和降解等代谢反应中起重要作用,常见的反应包括:催化α-酮酸转化为氨基酸的转氨酶以及一系列的消旋作用、脱羧作用和羟醛反应[9]。维生素H过量会导致菌体代谢旺盛[10],生长过快,出现糖酸转化率大幅降低的问题;过少或者不添加维生素H会导致菌体生长较慢、生物量较低,产酸效率偏低等问题。
为解决上述问题,本研究对L-Phe发酵中使用的微量元素与生长因子(Mg2+、Fe2+、Mn2+、Cu2+、Zn2+、Co2+、Ca2+、Ni2+、PLP、维生素B2、维生素H,以下统称为微量元素)用量进行了优化调整,以关键酶活力、L-Phe产量与糖酸转化率等为指标,展示了优化后微量元素用量的优越性,解决了微量元素用量粗放的问题,对工业化微生物发酵生产L-Phe具有指导意义。
1 材料与方法
1.1 菌种
L-Phe大肠杆菌生产菌,天津科技大学代谢工程实验室。
1.2 培养基
种子培养基(g/L):葡萄糖30,酵母粉4,蛋白胨2,MgSO4·7H2O 1.5,KH2PO4 2.0,硫酸铵2.0,维生素B1 1×10-3,FeSO4·7H2O 1×10-2,MnSO4·H2O 5×10-3,维生素H 1×10-3,酪氨酸1.5,卡那霉素20。
发酵培养基(g/L):葡萄糖20,MgSO4·7H2O 2,酵母粉4.5,蛋白胨1.5,硫酸铵2,K2HPO4·3H2O 6,酪氨酸1.2,谷氨酸1.2,维生素B1、维生素B3、维生素B5、维生素B12 2.5 mL/L,维生素H 0~2×10-3,FeSO4·7H2O 0~40×10-3,MnSO4·H2O 0~25×10-3,CaCl2·2H2O 0~33×10-3,CuSO4·5H2O 0~0.7 ×10-3,CoCl2·6H2O 0~60×10-3,ZnSO4 0~3×10-3,维生素B2 0~10×10-3,PLP 0~10×10-3,卡那霉素1×10-2。
1.3 仪器与设备
LDZH-100KBS型全自动立式蒸汽灭菌器,天津博鑫生物科技有限公司;5 L自动控制发酵罐,上海保兴生物设备工程有限公司;SBA-40E生物传感分析仪,山东省科学院生物研究所;Agilent1200高效液相色谱仪、Agilent Technologies;752分光光度计,上海分析仪器厂;OLYMPUS生物显微镜,日本OLYMPUS会社;S-433D氨基酸分析仪,德国赛卡姆公司。
1.4 培养方法
1.4.1 菌种活化
取甘油保菌管中菌株置于固体斜面培养基上,于37 ℃恒温培养12 h,传代2次。
1.4.2 摇瓶、5 L发酵罐培养
参考文献[10]。
1.5 检测与分析方法
1.5.1 pH、溶氧值、生物量、温度值测定
参考文献[11]。
1.5.2 L-Phe及副产物测定
发酵液中L-Phe、丙氨酸(L-alanine,L-Ala)产量采用LC20AT高效液相色谱仪测定[12],乙酸检测参考文献[13],谷氨酸使用SBA生物传感分析仪测定。
1.5.3 酶粗液提取
取发酵液,4 ℃、6 500 r/min低速低温离心6 min,弃上清液,收集菌体,称量菌体湿重。利用0.1 mol/L的Tris-HCL缓冲液冲洗菌体2次,离心后弃上清液,再次使用该溶液重悬。利用超声细胞破碎仪破碎细胞,过程持续冰浴,将处理后的液体离心,取上清液即为酶粗液。
1.5.4 DAHP、CM、PDT、芳香族氨基酸转氨酶(tyrB编码)酶活测定
参考文献[14-16],其中DAHP又称3-脱氧-D-阿拉伯庚酮糖酸-7-磷酸合成酶(3-deoxy-D-arabinone glycolic acid-7-phosphate synthetase,DAHP),CM为分支酸变位酶(chorismate mutase, CM),PDT为预苯酸脱水酶(prephenate dehydratase, PDT)。
1.5.5 酶活力定义方式
本实验所测酶活力定义方式均为:1 g鲜重菌体在1 mL反应体系中1 h产生1 μmoL产物定义为1个酶活力单位[μmoL/(h·g鲜重)]。
1.5.6 残糖测定及耗糖速率、转化率计算
参考文献[17]。
1.5.7 单因素试验用量表
按表1所示微量元素设置10组实验,每组添加单一微量元素,设置5个浓度梯度与3个平行实验,实验结果取3组平行实验平均值,特别指出,鉴于自来水中Ca2+、Mg2+离子含量较多,因此实验用水均为纯净水。
表1 微量元素及其用量
Table 1 Trace elements and their dosage
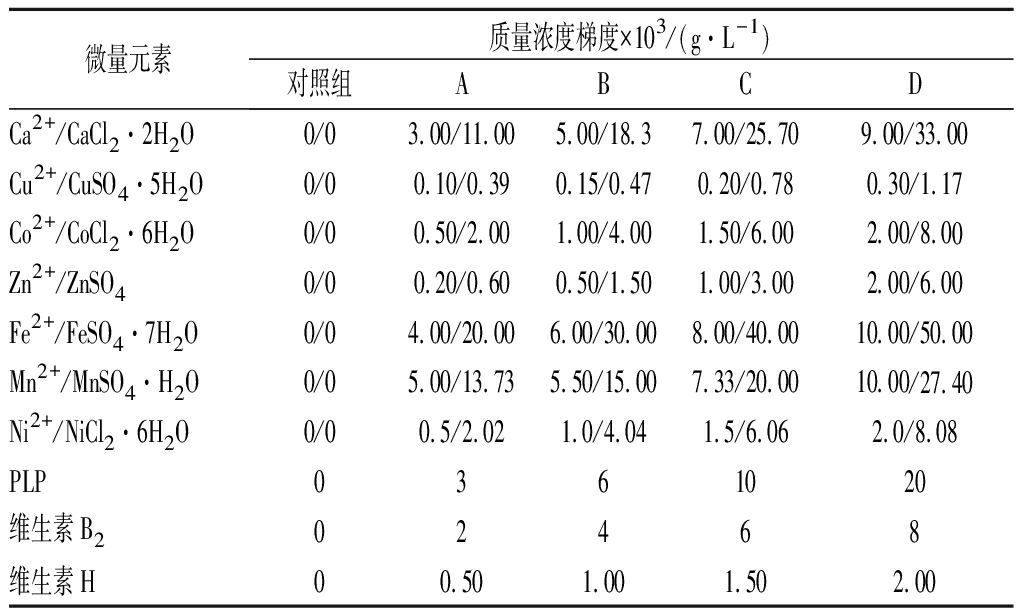
微量元素质量浓度梯度×103/(g·L-1)对照组ABCDCa2+/CaCl2·2H2O0/03.00/11.005.00/18.37.00/25.709.00/33.00Cu2+/CuSO4·5H2O0/00.10/0.390.15/0.470.20/0.780.30/1.17Co2+/CoCl2·6H2O0/00.50/2.001.00/4.001.50/6.002.00/8.00Zn2+/ZnSO40/00.20/0.600.50/1.501.00/3.002.00/6.00Fe2+/FeSO4·7H2O0/04.00/20.006.00/30.008.00/40.0010.00/50.00Mn2+/MnSO4·H2O0/05.00/13.735.50/15.007.33/20.0010.00/27.40Ni2+/NiCl2·6H2O0/00.5/2.021.0/4.041.5/6.062.0/8.08PLP0361020维生素B202468维生素H00.501.001.502.00
注:Ca2+/CaCl2·2H2O指金属离子与相应化合物的用量
1.5.8 正交试验探究部分微量元素与生长因子的最适浓度
如表2所示,本部分实验在单因素试验结果的基础上设置5个因素4个水平的正交试验L16(54),对起较大影响作用的PLP、FeSO4·7H2O、MnSO4·H2O、维生素B2、CoCl2·6H2O 5种微量元素的用量通过正交试验进一步优化研究。
表2 正交实验因素水平表
Table 2 Level table of orthogonal experimental factors

水平因素×103/(g·L-1)FeSO4·7H2OMnSO4·H2OCoCl2·6H2OPLP维生素B2128.014.05.09.55.0230.014.55.510.05.5332.015.06.010.56.0435.015.56.511.06.5
2 结果与分析
2.1 添加单一微量元素对发酵的影响
如图1所示,以CuSO4·5H2O、CoCl2·2H2O、ZnSO4、FeSO4·7H2O为例,实验涉及的10种微量元素对L-Phe产量的影响主要有4种形式:(1)CuSO4·5H2O 添加量≤0.47×10-3 g/L时,产量较对照组(11.2 g/L)有一定提高,当添加量达到1.17×10-3 g/L时,产量较对照组降低了7.1%;(2)CoCl2·2H2O 质量浓度≤6×10-3 g/L时,产量随添加量提高而提高,在6×10-3 g/L时产量为14.9 g/L,较对照组提升了33.0%,当添加量提高到8×10-3 g/L时,产量相对稳定,未出现明显的升降趋势,具有类似效果的还有NiCl2·6H2O、PLP、维生素B2;(3)ZnSO4、CaCl2·2H2O的添加对L-Phe的产量没有明显的影响,不具备分析意义;(4)FeSO4·7H2O添加量≤3×10-2 g/L时,产量随添加量的升高而升高,且在添加3×10-2 g/L时产量为18.2 g/L,较对照组提高了62.5%,当添加量>3×10-2 g/L时,产量出现一定程度的下滑,但始终高于对照组,具有类似效果的还有MnSO4·H2O、维生素H。值得注意的是,单一添加MnSO4·H2O时发酵液颜色随着MnSO4·H2O添加量的提高而变黑,检测得知生成大量乙酸,因此也可以认为添加MnSO4·H2O的实验组中L-Phe产量的下降和乙酸的积累具有直接关系。
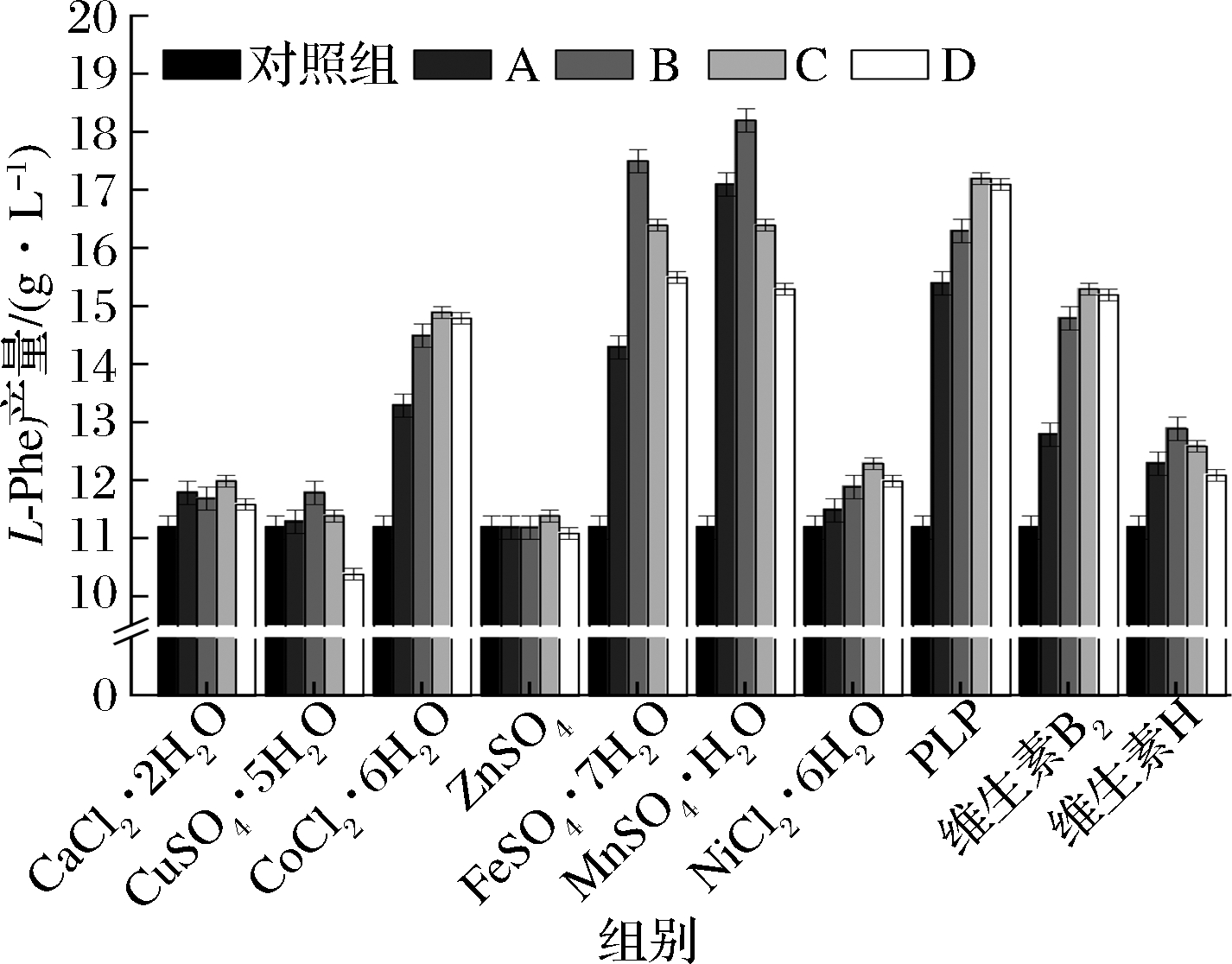
图1 单一微量元素对L-Phe产量的影响
Fig.1 Effect of single trace element on the yield of L-phenylalanine 注:A、B、C、D指相应微量元素不同浓度梯度
如图2所示,FeSO4·7H2O、维生素H对生物量的影响较大,Fe2+在电子传递、氧的传递、TCA循环、基因调控和DNA的生物合成等生物学过程具有重要作用[18],因此不难解释FeSO4·7H2O对生物量的正向作用,当过量添加时,铁在有氧条件下并不利于微生物生长,氧气和还原氧类可以与铁反应对生命产生破坏性的影响[19],因此在添加量为30×10-3 g/L时生物量为66.4,继续添加时生物量降低;维生素H可在脂肪酸生物合成、氨基酸代谢和糖异生的羧化反应中作为酶促辅因子,例如作为乙酰CoA羧化酶的辅酶,参与脂肪酸的合成,进而影响磷脂的合成[20],后者作为细胞膜的主要成分,是限制细胞生长的主要因素,因此维生素H的添加量越高,生物量越大,但涨幅逐渐降低,其中添加2×10-3 g/L的实验组,生物量为62.0,较对照组提高了19%。MnSO4·H2O的添加同样对生物量起到了促进作用,Mn2+离子在EMP中作为多个关键酶的辅因子,影响糖的利用进而影响到能量代谢,进一步影响到微生物的生长代谢,不过在Mg2+存在时,这种促进作用并不明显。其他微量元素相对FeSO4·7H2O、维生素H、MnSO4·H2O对生物量的影响并不明显,但适量添加时还是会有一定的促进作用。
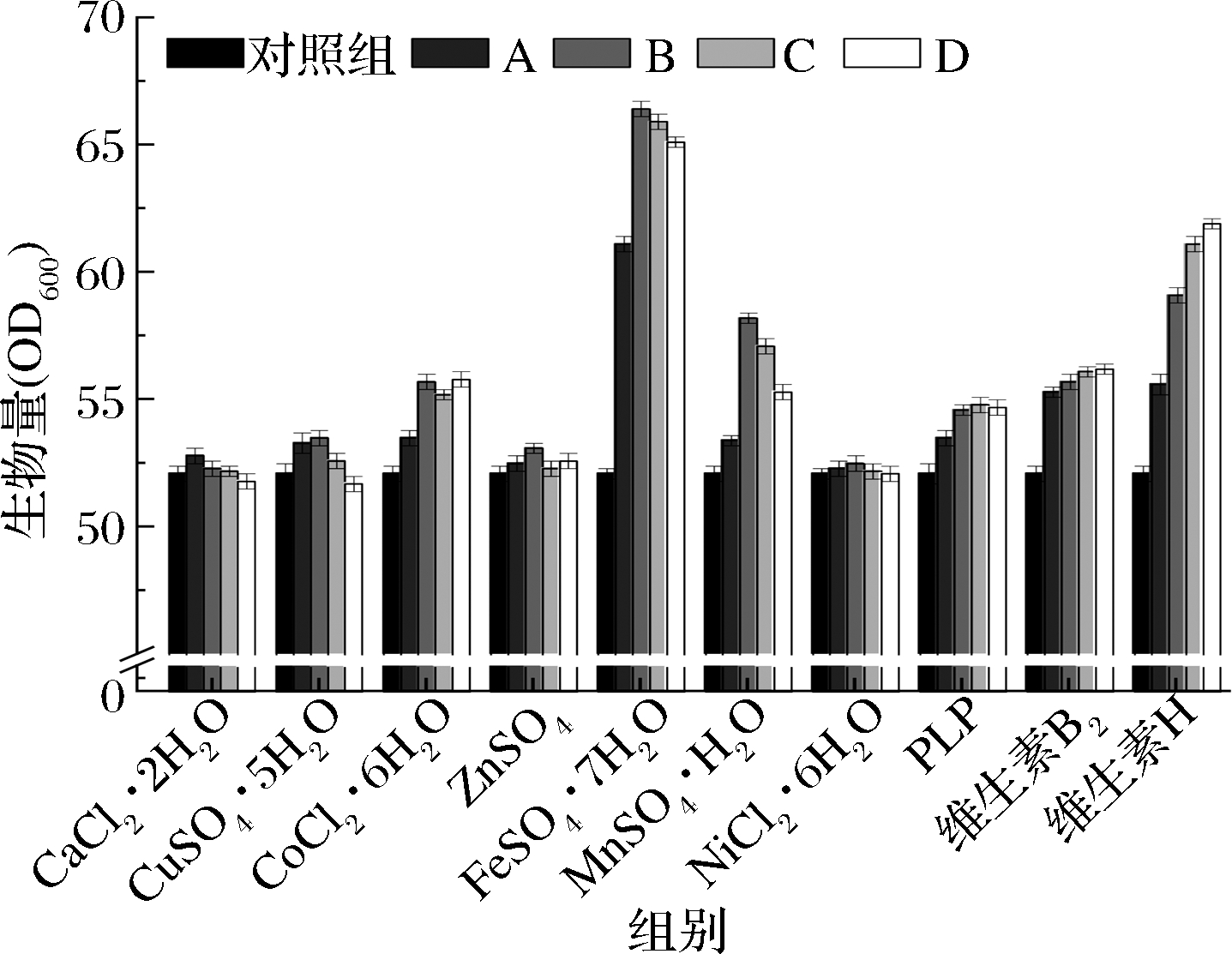
图2 单一微量元素对生物量的影响
Fig.2 Effect of single trace element on biomass
2.2 微量元素缺失对发酵的影响
2.2.1 微量元素缺失对产量、转化率、生物量的影响
综合2.1中的实验结果,认为CaCl2·2H2O、CuSO4·5H2O、CoCl2·6H2O、ZnSO4、FeSO4·7H2O、MnSO4·H2O、NiCl2·6H2O、PLP、维生素B2、维生素H最适添加量分别为1.1×10-2、4.7×10-4、6×10-3、6×10-4、3×10-2、1.5×10-2、6.06×10-3、1×10-2、6×10-3、1×10-3 g/L,在均添加最适浓度的前提下,以实验涉及的10种微量元素全部添加为对照组,探究微量元素单一缺失对发酵的影响,结果取3组平行实验平均值,如图3所示。
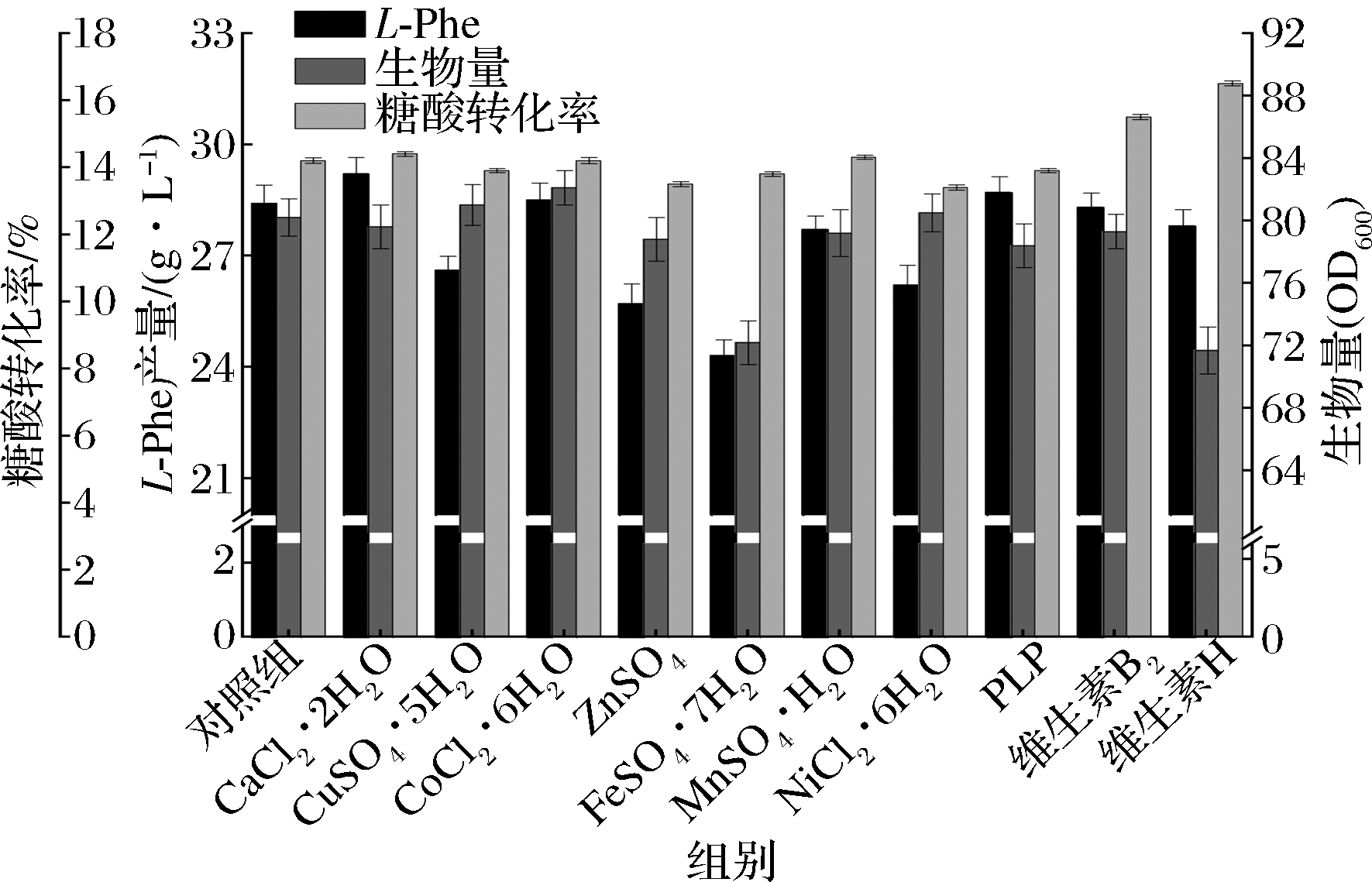
图3 微量元素缺失对发酵的影响
Fig.3 Effect of lack of trace elements on fermentation 注:横坐标代表缺失对应的微量元素的实验组
如图3所示,从生物量差异来看,FeSO4·7H2O、维生素H的缺失对生物量影响最大,较对照组分别降低了10.0%、10.6%,剩余8种微量元素对生物量影响并不显著,因此可以看出FeSO4·7H2O、维生素H在菌体生长过程中的必要性,且不能通过添加其他微量元素弥补;从L-Phe产量来看,MnSO4·H2O、FeSO4·7H2O的缺失对产量的影响最为显著,分别较对照组降低了15.0%、10.1%,其次是CoCl2·6H2O、PLP,当两者缺失时产量较对照组分别降低了7.0%、8.5%,Mn2+、Fe2+和Co2+离子作为NADH酶的酶激活剂[21-22],能够很大程度上提高L-Phe的产量,即使报道[21]称Mn2+能够优先与NADH酶结合,但本实验证明了Mn2+、Fe2+、Co2+的单独缺失均会影响L-Phe的产量。PLP的缺失也影响到了最终产量,推测该物质可作为其他关键酶的辅酶,进而影响L-Phe的产量。其他微量元素的缺失并未造成明显的产量下降,其中CuSO4·5H2O的缺失反而使得产量较对照组提高了2.1%;从糖酸转化率来看,CoCl2·6H2O、FeSO4·7H2O、MnSO4·H2O、PLP、维生素B2的缺失分别使得糖酸转化率较对照组下降了2.8%、4.6%、3.5%、6.3%、2.8%,CoCl2·6H2O、FeSO4·7H2O、MnSO4·H2O、PLP对转化率造成的影响与产量的变化趋势相同,因此认为转化率下降是由于产量下降引起,维生素B2是生物体内一些氧化还原酶的辅基,对电子传递、脱氢等反应具有催化作用,可以认为维生素B2促进了菌体的能量代谢,进而提高了糖酸转化率,但其具体作用机制还待研究。维生素H的缺失很大程度上提高了糖酸转换率,较对照组提高了8.5%,对应菌体量下降明显,即使在2.1的结果中证明了维生素H单一存在可以一定程度的提升L-Phe的产量,但这种提升完全能够被其他微量元素替代,因此外源添加维生素H并不适合大肠杆菌发酵生产L-Phe。
2.2.2 微量元素缺失对酶活力的影响
L-Phe合成途径中的限速酶为DAHP、CM、PDT[4],最终生成的苯丙酮酸在芳香族氨基酸转氨酶的作用下生成L-Phe,因此将上述4种酶统称为关键酶。
根据2.1中的结果得知,实验涉及的10种微量元素对提高L-Phe产量的影响顺序为:MnSO4·H2O>FeSO4·7H2O>CoCl2·6H2O>PLP>维生素B2>维生素H>>NiCl2·6H2O、CaCl2·2H2O、CuSO4·5H2O、ZnSO4(后4位不分先后,且远远小于前6位);对提高L-Phe糖酸转化率的影响顺序为:PLP>FeSO4·7H2O>MnSO4·H2O>维生素B2、CoCl2·6H2O>>维生素H、NiCl2·6H2O、CaCl2·2H2O、CuSO4·5H2O、ZnSO4(后5位不分先后,且远远小于前5位),因此默认对实验结果影响较小的NiCl2·6H2O、CaCl2·2H2O、CuSO4·5H2O、ZnSO4以通过单因素试验得到了最佳添加量,并猜测CoCl2·6H2O、FeSO4·7H2O、MnSO4·H2O、PLP、维生素B2为L-phe合成途径中关键酶的辅酶或辅因子,因此本部分实验以5种物质均添加最适用量作为对照组,单一缺失任意一种为实验组,取样检测4种关键酶的酶活力,实验结果如图4所示。
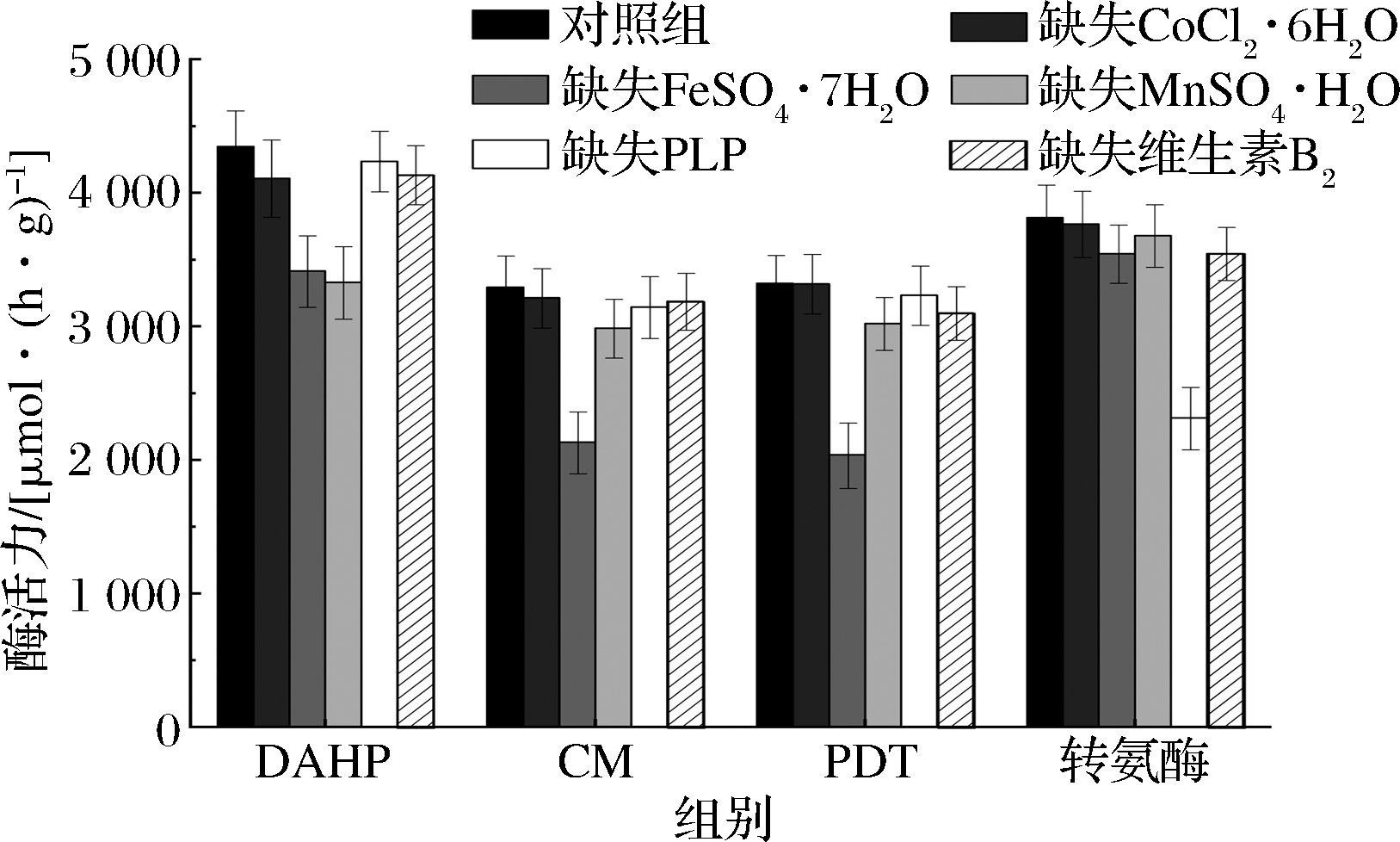
图4 微量元素缺失对酶活力的影响
Fig.4 Effect of lack of trace elements on enzyme activity
如图4所示,对照组DAHP酶活力为4 347.3 μmoL/(h·g),FeSO4·7H2O的缺失使得酶活力较对照组下降了21.5%,MnSO4·H2O的缺失使得酶活力下降了23.4%,证明了FeSO4·7H2O、MnSO4·H2O的不可缺少性,其余微量元素的缺失并未引起酶活力的明显下降;对照组CM酶活力为3 292.5 μmoL/(h·g),FeSO4·7H2O的缺失使得酶活力较对照组下降了35.2%,其余微量元素并未引起酶活力的明显下降,因此可以认为CM是Fe2+依赖性的;对照组PDT酶活力为3 321.4 μmoL/(h.g),FeSO4·7H2O的缺失使得酶活力下降了33.6%,这与CM情况类似,因此认为Fe2+对CM-PDT是至关重要的辅因子;对照组芳香族氨基酸转氨酶活力为3 813.8 μmoL/(h·g),PLP的缺失使得酶活力下降了39.3%,因此认为PLP是芳香族氨基酸转氨酶至关重要的辅因子。维生素B2的缺失使得每个酶相对对照组均出现了一定程度的下降,但未引起某个具体的关键酶活力的明显下降,认为维生素B2作为氧化脱氢类酶的辅酶,并不能直接影响到芳香族氨基酸的生成,但能在EMP、磷酸戊糖途径(pentose phosphate pathway,HMP)等途径中加快能量代谢,从而间接提高L-Phe的产量与转化率。CoCl2·6H2O的缺失使得DAHP、CM活力轻微下降,并未影响到其他3种酶的活力,但结合2.2.1中结论,CoCl2·6H2O的缺失使得产量与转化率均下降明显,推测该物质可作为莽草酸途径相关酶的辅因子,从而影响到L-Phe的生成。
2.3 正交分析探究关键微量元素的最适用量
2.2.2的实验结果证明了CoCl2·6H2O、FeSO4·7H2O、MnSO4·H2O、PLP、维生素B2为L-Phe发酵过程中的关键因素,因此本研究继续对这5种物质的用量进行优化,结果如表3所示。
表3 L-Phe产量正交试验结果
Table 3 Results of orthogonal experiment on L-Phe yield

实验因素×103/(g·L-1)FeSO4·7H2OMnSO4·H2OCoCl2·6H2OPLP维生素B2L-Phe产量/(g·L-1)转化率/%11111132.314.421222230.115.731333331.214.241444429.713.752123432.814.362214329.614.672341229.513.582432128.714.493134230.114.6103243129.314.5113312428.514.5123421328.014.1134142330.314.3144231428.914.3154324129.513.8164413227.613.8均值1(L-Phe产量、转化率)30.825/14.50031.375/14.00029.500/14.27529.675/14.07529.950/14.275均值2(L-Phe产量、转化率)30.150/14.20029.475/14.77530.100/14.47529.400/14.72529.325/14.350均值3(L-Phe产量、转化率)28.975/14.42529.675/14.00029.725/14.37530.225/14.15029.775/14.300均值4(L-Phe产量、转化率)29.075/14.00028.500/13.95029.700/14.00029.725/14.17529.975/14.200极差(L-Phe产量、转化率)1.850/1.5002.875/0.8250.600/0.4750.825/0.6500.650/0.150
如表3所示,从产量均值来看,因素FeSO4·7H2O、MnSO4·H2O、CoCl2·6H2O、PLP、维生素B2的最适添加量分别为28×10-3、14.0×10-3、5.5×10-3、10×10-3、6.5×10-3 g/L,由产量极差可知因素FeSO4·7H2O、MnSO4·H2O为影响L-Phe产量的主要因素,其中MnSO4·H2O为关键因素。因素CoCl2·6H2O、PLP、维生素B2极差均较小,对产量的影响并不显著,为次要因素;由转化率均值可知,因素FeSO4·7H2O、MnSO4·H2O、CoCl2·6H2O、PLP、维生素B2的最适添加量分别为2.8×10-2、1.45×10-2、5.5×10-3、1×10-3、5.5×10-3 g/L。由转化率极差可知因素FeSO4·7H2O、MnSO4·H2O、PLP为影响糖酸转化率的主要因素,其中FeSO4·7H2O为关键因素。因素CoCl2·6H2O、维生素B2极差较小,对转化率的影响并不显著,为次要因素。
综合来看,FeSO4·7H2O、MnSO4·H2O、PLP用量的进一步优化对产量与转化率有较大影响,因素FeSO4·7H2O在2.8×10-2 g/L时两项均值均为最大,因素MnSO4·H2O取1.4×10-2 g/L时产量均值最大,取1.45×10-2 g/L时转化率均值最大,因此可有选择性的选择MnSO4·H2O的添加量,PLP取1×10-2 g/L时产量均值最大,取9.5×10-3 g/L时转化率均值最大,但PLP对转化率的影响远大于对产量的影响,因此选取9.5×10-3 g/L为最适添加量。CoCl2·6H2O、维生素B2的浓度变化在本部分实验中并未明显影响到转化率与产量,因此可以认为二者已达最适用量,再次优化并无意义。
2.4 5 L发酵罐发酵验证
前期实验确定了维生素H对L-Phe发酵的不利影响,得知了其余9种微量元素的最适添加量,但由于摇瓶发酵具有较大的局限性,因此在之前实验的基础上,以CaCl2·2H2O、CuSO4·5H2O、CoCl2·6H2O、ZnSO4、FeSO4·7H2O、MnSO4·H2O、NiCl2·6H2O、PLP、维生素B2分别添加1.1×10-2、4.7×10-4、6×10-3、6×10-4、2.8×10-2、1.4×10-2、6.06×10-3、1×10-2、6×10-3 g/L为实验组,以不添加微量元素作为对照实验,使用5 L发酵罐进行发酵实验,检验前期微量元素用量优化结果。
2.4.1 微量元素对生物量与耗糖速率的影响
由图5可知,实验组生物量与耗糖速率在发酵过程中始终高于对照组,最大生物量122.8远远大于对照组最大生物量101.3,达到最大耗糖速率的时间比对照组提前了4 h,但在数值上相近;在发酵进行到34 h时,对照组生物量开始呈现下降趋势,耗糖速率也呈现大幅度的下滑,此时实验组生物量与耗糖速率均处于稳定期;当发酵进行到40 h,对照组几乎无法继续摄糖,生物量持续下降,无法继续进行发酵,此时实验组生物量依据处于稳定期,但耗糖速率有所下降;发酵50 h,实验组生物量依旧没有明显的下降趋势,但此时耗糖速率下降严重,因此结束发酵,发酵周期较对照组延长了10 h。

图5 耗糖速率与生物量过程变化
Fig.5 Variation of sugar consumption rate and biomass in fermentation process
2.4.2 微量元素对L-Phe产量及实时转化率的影响
实时转换率是指发酵进行到某一时刻时,在该时刻生产的总酸与总糖之比,该数据可体现出发酵过程中各个时间段的产酸效率,因此设法延长高效率时期或者提高最大实时转化率均有利于L-Phe的发酵生产。
由图6可知,当微量元素缺失时,L-Phe产量总体偏低,且增加趋势平稳,最终产量为56.4 g/L,这与转化率曲线趋势大致相同,整体呈上升趋势,在22~26 h出现下降趋势,这是因为L-Phe在临近结晶浓度时会形成松软的假晶体状态[23],同时伴随大量的发酵泡沫,此时难以继续生成L-Phe,但菌体持续耗糖,导致转化率下降;实验组产量在经历了0~20 h的缓慢积累后,在20~35 h达到了产酸的高峰期,之后增长速度减缓,但总量依旧在增长,最终产量为85.4 g/L,较对照组增加了51.4%。实验组实时转化率曲线波动程度较对照组较大,在0~6 h急剧上升,由于种子液培养时间较长,因此在接发酵后菌体立即开始产酸,且此时菌体扩增速度较缓慢,转换率急剧上升,在6 h后,生物量开始迅速增加,虽然产酸也在增加,但大部分葡萄糖用于菌体生长,因此糖酸转化率呈现下降趋势,在24 h前后,产量接近结晶浓度,与对照组相同,此时转化率进一步下降,当L-Phe结晶后,菌体进入产酸高峰期,此时转化率与产量均迅速增加,直至发酵后期(40 h后)产酸速率再次减缓,但耗糖速率下降并不明显,转化率再次降低,最终转化率为26.3%,远大于对照组的21.4%,即使实验组转化率曲线波动较大,但在整个发酵过程中,实时转化率均高于对照组,因此实验组更具优势。
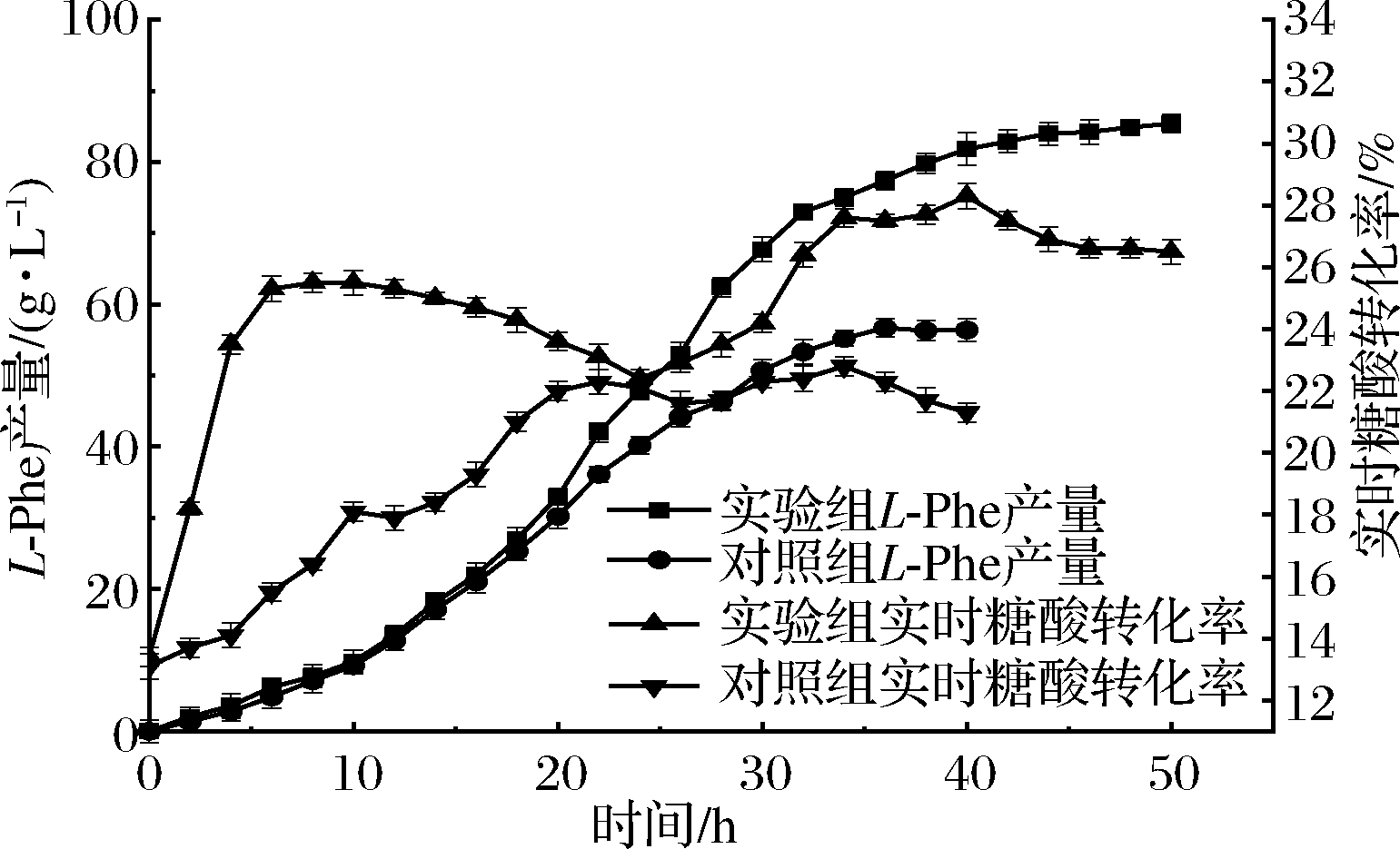
图6 实时转化率与产量过程变化
Fig.6 Variation of real-time conversion rate and yield in fermentation process
2.4.3 微量元素对副产物的影响
取发酵结束时发酵液进行副产物含量检测,结果如图7所示。
实验组产生了0.8 g/L的乙酸、1.2 g/L的谷氨酸(L-glutamic acid,L-Glu)与0.2 g/L的L-Trp,均不会对菌体的生长代谢以及后续提取造成影响。对照组乙酸含量为6.7 g/L,此时的乙酸含量可严重影响菌体的生长代谢,是对照组发酵后期生物量迅速下降的主要原因;L-Glus与L-Trp含量达到了3.3、1.4 g/L,分别比对照组增加了175%、600%,既影响转化率,又提高了后续分离提取难度;对照组发酵液中检测出来了L-Ala(1.8 g/L),这在实验组并未检出,推测是由于莽草酸途径关键酶活力不够,导致糖酵解途径大量积累丙酮酸,而丙酮酸作为L-Ala的直接前体,经过一步反应即可生成L-Ala,通常来讲L-Ala只作为氨基酸代谢的中间体,难以积累[24],但对照组在发酵后期衰亡严重,菌体几乎无法进行代谢反应,使得L-Ala能够少量积累。

图7 副产物产量对比
Fig.7 Comparison of by-product yield
3 结论
金属离子、维生素等微量元素可在微生物众多代谢途径中起到关键作用,如作为关键酶的辅酶、辅因子,或者作为反应前体物质的载体等,L-Phe作为莽草酸途径的主要代谢产物,其合成路径长、副产物多,涉及的酶促反应较多,因此对微量元素的种类及用量要求较高,本研究通过单因素试验、正交试验、发酵罐验证实验,以关键酶活力、L-Phe产量、糖酸转化率、副产物含量等为指标,对L-Phe发酵涉及的微量元素种类及用量进行优化了,最终确定的种类为及用量分别为:CaCl2·2H2O 1.1×10-2 g/L、CuSO4·5H2O 4.7×10-4 g/L、CoCl2·6H2O 6×10-3 g/L、ZnSO4 6 ×10-4 g/L、FeSO4·7H2O 2.8×10-2 g/L、MnSO4·H2O 1.4×10-2 g/L、NiCl2·6H2O 6.06×10-3 g/L、PLP 9.5×10-3 g/L、维生素B2 6×10-3 g/L。以不添加微量元素为对照组,优化后产酸期明显延长,DAHP、CM、PDT、芳香族氨基酸转氨酶的酶活力显著提高,生物量(OD600)达到了122.8,较对照组提高了17.5%,L-Phe产量达到了85.4 g/L,较对照组提高了51.4%,糖酸转化率达到了26.3%,较对照组提高了18.6%,副产物种类与含量均远低于对照。本实验确定了维生素B2对L-Phe发酵的促进作用与生物素(维生素H)的负面影响,针对性优化了CoCl2·6H2O、PLP的用量,进一步优化了FeSO4·7H2O、MnSO4·H2O等微量元素的用量。最终L-Phe产量较文献[4]最高记载提高了4.5%,这对L-Phe的工业化生产具有积极意义。
[1] LIU X Z, NIU H, LI Q, et al.Metabolic engineering for the production of L-phenylalanine in Escherichia coli[J].3 Biotech, 2019, 9(3):85-93.
[2] 江晶洁, 刘涛, 林双君.基于莽草酸途径微生物合成芳香族化合物及其衍生物的研究进展[J].生命科学, 2019, 31(5):430-448.
JIANG J J, LIU T, LIN S J.Research progress on the biosynthesis of aromatic compounds by microorganisms[J].Chinese Bulletin of Life Sciences, 2019, 31(5):430-448.
[3] WU J, LIU Y F, ZHAO S, et al.Application of dynamic regulation to increase L-phenylalanine production in Escherichia coli[J].Journal of Microbiology and Biotechnology, 2019, 29(6):923-932.
[4] 门佳轩, 熊博, 郝亚男, 等.代谢工程优化大肠杆菌高效合成L-苯丙氨酸[J].食品科学, 2021, 42(2):114-120.
MEN J X, XIONG B, HAO Y N, et al.Metabolic engineering of Escherichia coli for efficient synthesis of L-phenylalanine[J].Food Science, 2021, 42(2):114-120.
[5] ZHOU H Y, LIAO X Y, WANG T W, et al.Enhanced L-phenylalanine biosynthesis by co-expression of pheAfbr and aroFwt[J].Bioresource Technology, 2010, 101(11):4 151-4 156.
[6] 王镜岩. 生物化学[M].第三版.北京:高等教育出版社, 2009:380-381.
WANG J Y, Biochemistry[M].3th ed.Beijing:Higher Education Press, 2009:380-381.
[7] VITRESCHAK A G, RODIONOV D A, MIRONOV A A, et al.Regulation of riboflavin biosynthesis and transport genes in bacteria by transcriptional and translational attenuation[J].Nucleic Acids Research,2002, 30(14):3 141-3 151.
[8] 蔺兴法. 枯草芽孢杆菌X42产核黄素发酵过程优化[D].天津:天津大学, 2010.
LIN X F.Study on optimization of riboflavin fermentation by B.subtilis X42[D].Tianjin:Tianjin University, 2010.
[9] KERRY J A, KWOK F.Purification and characterization of pyridoxal kinase from human erythrocytes[J].Preparative Biochemistry, 1986, 16(3):199-216.
[10] 徐达, 梅漫莉, 徐庆阳, 等.生物素对L-缬氨酸发酵的影响[J].食品科学, 2019, 40(22):213-218.
XU D, MEI M L, XU Q Y, et al.Effect of biotin addition on microbial production of L-valine[J].Food Science, 2019, 40(22):213-218.
[11] 张玉富, 熊海波, 徐庆阳, 等.生物素及膜偶联间歇透析发酵对黄色短杆菌生产L-亮氨酸的影响[J].食品与发酵工业, 2019, 45(9):15-20.
ZHANG Y F, XIONG H B, XU Q Y, et al.Effects of biotin and membrane coupled intermittent dialysis fermentation on the production of L-leucine by Brevibacterium flavum[J].Food and Fermentation Industries, 2019, 45(9):15-20.
[12] B EZ-VIVEROS J L,OSUNA J,HERN
EZ-VIVEROS J L,OSUNA J,HERN NDEZ-CH
NDEZ-CH VEZ G, et al.Metabolic engineering and protein directed evolution increase the yield of L-Phenylalanine synthesized from glucose in Escherichia coli[J].Biotechnology & Bioengineering, 2010, 87(4):516-524.
VEZ G, et al.Metabolic engineering and protein directed evolution increase the yield of L-Phenylalanine synthesized from glucose in Escherichia coli[J].Biotechnology & Bioengineering, 2010, 87(4):516-524.
[13] 徐达, 梅漫莉, 徐庆阳.氯化胆碱对L-缬氨酸发酵的影响[J].食品与发酵工业, 2019, 45(17):14-19.
XU D, MEI M L, XU Q Y.Effects of choline chloride on L-valine fermentation[J].Food and Fermentation Industries, 2019, 45(17):14-19.
[14] 郝大利. 大肠杆菌色氨酸代谢途径关键酶基因aroG的定点突变与基因trpBA的共表达[D].无锡: 江南大学, 2013.
HAO D L.Site-directed mutagenesis and expression of the key enzyme gene (aroG,trpBA) of tryptophan pathways synthesis in the E.coli[D].WuXi: Jiangnan University, 2013.
[15] NELMS J, EDWARDS R M, WARWICK J, et al.Novel mutations in the PheA gene of Escherichia coli K-12 which result in highly feedback inhibition-resistant variants of chorismate mutase/prephenate dehydratase[J].Applied and Environmental Microbiology, 1992, 58(8):2 592-2 598.
[16] 唐红梅. 副干酪乳杆菌芳香族氨基酸转氨酶克隆表达及其酶学性质研究[D].苏州:苏州大学, 2013.
TANG H M.Clonging, expression and properties of aromatic aminotransferase from Lactobacillus paracasei[D].Suzhou:Suzhou University, 2013.
[17] 熊海波, 刘云鹏, 徐庆阳.超声对谷氨酸棒杆菌发酵L-异亮氨酸的影响[J].食品与发酵工业, 2021, 47(4):40-46.
XIONG H B, LIU Y P, XU Q Y.Effect of ultrasound on L-isoleucine fermented by Corynebacterium glutamate[J].Food and Fermentation Industries, 2021, 47(4):40-46.
[18] ANDREWS S C, ROBINSON A K, RODR GUEZ-QUI
GUEZ-QUI ONES F.Bacterial iron homeostasis[J].FEMS Microbiology Reviews, 2003, 27(2-3):215-237.
ONES F.Bacterial iron homeostasis[J].FEMS Microbiology Reviews, 2003, 27(2-3):215-237.
[19] TOUATI D.Iron and oxidative stress in bacteria[J].Archives of Biochemistry & Biophysics, 2000, 373(1):1-6.
[20] 陈宁. 氨基酸工艺学[M].北京:中国轻工业出版社, 2013:42-46.
CHEN N. Amino Acid Technology[M].Beijing:China Light Industry Publishing House, 2013:42-46.
[21] STEPHENS C M, BAUERLE R.Analysis of the metal requirement of 3-deoxy-D-arabino-heptulosonate-7-phosphate synthase from Escherichia coli[J].Journal of Biological Chemistry, 1991, 266(31):20 810-20 817.
[22] BALACHANDRAN N, HEIMHALT M, LIUNI P, et al.Potent inhibition of 3-deoxy-d-arabinoheptulosonate-7-phosphate(DAHP) synthase by DAHP oxime, a phosphate group mimic[J].Biochemistry, 2016, 55(48):6 617-6 629.
[23] TAKORS R.Model-based analysis and optimization of an ISPR approach using reactive extraction for pilot-scale L-phenylalanine production[J].Biotechnology Progress, 2004, 20(1):57-64.
[24] 潘海亮. 高效利用水稻秸秆产L-丙氨酸大肠杆菌工程菌的构建及其发酵研究[D].武汉:湖北工业大学, 2020.
PAN H L.Effect fermentation of rice straw for L-alanine by metabolically engineered Escherichia coli[D].Wuhan:Hubei University of Technology, 2020.