多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期女性常发的一种异质性内分泌疾病,全球范围内育龄妇女患病率约8%~13%[1],主要临床表现为肥胖、月经失调、雄激素过多、胰岛素抵抗、卵巢多囊样变和代谢性疾病[2-5]。其病因可能与遗传因素、环境因素、雄激素代谢异常、内分泌异常、肠道菌群等多方面相关[6]。肠道菌群被称为人体的“第二器官”,达到动态平衡后能够通过适应肠道环境,使其数量和种类在肠道形成一道屏障,防止脂多糖(lipopolysaccharide,LPS)进入体循环,从而对机体起到保护作用[7]。而其代谢产物短链脂肪酸(short-chain fatty acids,SCFAS)可被肠黏膜细胞吸收,确保肠黏膜正常的屏障作用[8]。
已有研究证明,移植健康大鼠肠道菌群的PCOS大鼠血清中雄激素水平下降,发情周期改善,卵巢功能恢复正常[9],这表明改变肠道菌群可以影响PCOS症状,靶向肠道菌群的PCOS疗法具有很大应用前景。益生菌是广为应用的肠道菌群调节剂。目前研究表明,摄入益生菌可以缓解PCOS症状:AHMADI等[10]发现,益生菌的摄入可以降低PCOS妇女体重、血糖、甘油三酯、超低密度脂蛋白(very low-density lipoprotein,VLDL)胆固醇水平;HE等[11]通过对PCOS大鼠进行益生菌干预,发现特定益生菌可以通过调节性激素相关肠道菌群来缓解大鼠PCOS症状。石刘婷等[12]研究发现,植物乳杆菌CCFM1019、LP4、LP5发酵豆乳可以改善PCOS大鼠的卵巢病变,降低其血清中睾酮水平,提高其血清中雌二醇水平。为了进一步研究植物乳杆菌发酵豆乳对PCOS的缓解作用是否与肠道菌群调节有关,本研究分析了植物乳杆菌CCFM1019、LP4、LP5发酵豆乳对PCOS大鼠肠道菌群及其代谢物短链脂肪酸的影响,以期寻找植物乳杆菌发酵豆乳缓解PCOS的潜在机制。
1 材料与方法
1.1 材料与试剂
大豆,嘉祥永胜食品有限公司;蔗糖,市售;来曲唑片,江苏恒瑞医药股份有限公司;羧甲基纤维素(carboxymethyl cellulose,CMC),上海麦克林生化科技有限公司;达英-35,拜尔医药保健有限公司;Fast DNA Spin Kit for Feces试剂盒,美国MP Biomedicals公司;DNA Gel/PCR Purification Midiprep kit试剂盒,美国BIOMIGA公司;植物乳杆菌CCFM1019、LP4、LP5,江南大学生物技术中心菌种保藏库。
1.2 仪器与设备
PB300-N电子天平,梅特勒-托利多国际贸易(上海)有限公司;GRP-9160型隔水式恒温培养箱,上海森信实验仪器有限公司;5804R Eppendorf高速冷冻离心机,德国艾本德股份公司;超低温冰箱、气象色谱质谱联用仪,美国赛默飞世尔科技公司;高通量组织研磨器,宁波新芝生物科技股份有限公司;PCR仪,美国Bio-Rad公司;Illumina MiSeq高通量测序仪,美国Illumina公司。
1.3 发酵豆乳的制备
不同类型的发酵豆乳制备参照石刘婷等[12]的方法进行。
1.4 动物实验设计
动物实验参照石刘婷等[12]设计。详细处理及分组见表1。
表1 实验动物分组与处理
Table 1 Grouping and treatment of experimental animals

组别数量处理时长/周处理方法空白组64每天灌胃0.5 mL/100g BW的1% CMC溶液(0~21 d)每天灌胃2 mL未发酵豆乳(0~28 d)模型组64每天灌胃0.5 mL/100g BW的来曲唑悬浊液(0~21 d)每天灌胃2 mL未发酵豆乳(0~28 d)达英-35组64每天灌胃0.5 mL/100g BW的来曲唑悬浊液(0~21 d)每天灌胃0.45 mL/100g BW达英-35悬浊液(0~28 d)CCFM1019组64每天灌胃0.5 mL/100g BW的来曲唑悬浊液(0~21 d)每天灌胃2 mL含1×108 CFU/mL的CCFM1019发酵豆乳(0~28 d)LP4组64每天灌胃0.5 mL/100g BW的来曲唑悬浊液(0~21 d)每天灌胃2 mL含1×108 CFU/mL的LP4发酵豆乳(0~28 d)LP5组64每天灌胃0.5 mL/100g BW的来曲唑悬浊液(0~21 d)每天灌胃2 mL含1×108 CFU/mL的LP5发酵豆乳(0~28 d)
1.5 粪便中短链脂肪酸的测定
将50 mg冻干后的粪便样品置于1.5 mL EP管中,加入500 μL饱和NaCl溶液浸泡粪便,30 min后,采用高通量组织研磨器将粪便破碎至无明显块状物。加入20 μL 10%(体积分数)硫酸溶液进行酸化,加入800 μL乙醚用以萃取短链脂肪酸,14 000 r/min离心15 min。离心后取上层乙醚相,将其加入到装有2 mL 0.25 g无水硫酸钠的EP管中,14 000 r/min离心15 min。将上清液加入到气相瓶中,采用GC-MS分析乙酸(acetate)、丙酸(propionate)、异丁酸(isobutyric acid)、丁酸(butyrate)、异戊酸(isovaleric acid)及戊酸(valeric acid)的含量。
1.6 DNA提取和PCR扩增
大鼠麻醉处死前,收集新鲜粪便于无菌塑料管中,-80 ℃快速保存。采用Fast DNA Spin Kit for Feces 试剂盒对粪便的菌群DNA进行提取,并对16S rRNA基因V3~V4可变区进行PCR扩增;采用DNA Gel/PCR Purification Midiprep kit试剂盒纯化PCR产物。
1.7 肠道菌群高通量测序
对PCR产物以等摩尔量进行定量和汇总;使用Illumina MiSeq高通量测序仪对样品进行测序;采用QIIME对16S rRNA序列数据进行处理。对原始reads进行过滤、合并、多路分离以进行质量控制,使用与UCLUST 97%的相似性截止将其聚类为操作分类单元(operational taxonomic units,OTUs)。最后,利用核糖体数据库项目RDP对每个OTU的分类进行分析。
1.8 数据分析
数据以“均数±标准差”表示,用GraphPad Prism 5进行数据分析并作图;将实验数据进行正态分布检验,对符合正态分布的数据进行单因素方差分析(Fisher′s LSD检验),对不符合正态分布的数据进行非参数检验(Kruskal-Wallis检验);采用IBM SPSS Statistics 20进行显著性分析采用Spearman进行相关性分析;P<0.05为差异具有统计学意义。
2 结果与分析
2.1 植物乳杆菌发酵豆乳对PCOS大鼠粪便中短链脂肪酸的影响
如图1所示,与空白组相比,来曲唑处理的PCOS大鼠粪便中6种短链脂肪酸乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸的水平均有所下调;由图1-c、图1-e可知,植物乳杆菌CCFM1019、LP5发酵豆乳上调了PCOS大鼠异丁酸、异戊酸水平,但与模型组无统计学差异(P>0.05)。植物乳杆菌LP4发酵豆乳对PCOS大鼠粪便中短链脂肪酸水平无明显影响。
2.2 植物乳杆菌发酵豆乳对PCOS肠道菌群的影响
2.2.1 肠道菌群多样性分析
通过Observed spieces、Chao 1、Shannon、Simpson指数评估肠道菌群的α多样性。由图2可知,空白组与模型组Observed spieces、Chao 1、Shannon、Simpson指数无明显差异(P>0.05)。与模型组相比,CCFM1019组显著提高了Observed spieces(P<0.001)、Chao 1(P<0.01)、Shannon(P<0.05)、Simpson(P<0.05)指数,LP4组显著提高了Observed spieces(P<0.01)、Chao 1(P<0.01)、Shannon指数(P<0.05),LP5组显著提高了Observed spieces、Chao 1指数(P<0.05),说明3种植物乳杆菌发酵豆乳能够提高PCOS大鼠肠道菌群的物种。
多样性基于Bray-Curtis距离的主坐标轴分析(principal coordinate analysis,PCoA)(图3)结果表明,空白组与模型组之间肠道菌群在分布上具有显著性差异;植物乳杆菌CCFM1019、LP4、LP5发酵豆乳的干预对PCOS大鼠肠道菌群结构的调节具有一定相似性,但与模型组相比,组成上具有显著性差异。进一步非参数多元方差分析(Adonis)分析显示,3株植物乳杆菌发酵豆乳干预后的PCOS大鼠肠道菌群结构上无显著性差异且明显区别于空白组与模型组的肠道菌群(表2)。这提示,3株植物乳杆菌发酵豆乳的干预对PCOS大鼠肠道菌群造成影响,虽然未能使PCOS大鼠肠道菌群恢复至正常,但是结合3株植物乳杆菌发酵豆乳对PCOS大鼠症状的缓解作用,我们认为,植物乳杆菌CCFM1019、LP4、LP5发酵豆乳能够将PCOS大鼠肠道菌群调节到一种新的稳态,而这种稳态有利于PCOS大鼠病理表型的恢复。
表2 Adonis分析数据
Table 2 Data analysis of Adonis
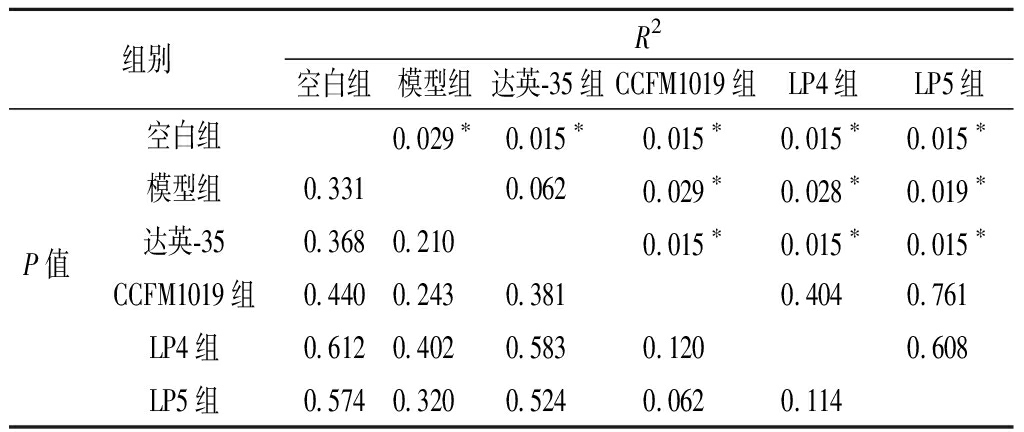
组别R2空白组模型组达英-35组CCFM1019组LP4组LP5组空白组0.029∗0.015∗0.015∗0.015∗0.015∗模型组0.3310.0620.029∗0.028∗0.019∗P值达英-350.3680.2100.015∗0.015∗0.015∗CCFM1019组0.4400.2430.3810.4040.761LP4组0.6120.4020.5830.1200.608LP5组0.5740.3200.5240.0620.114
注:*表示P<0.05
2.2.2 肠道菌群组成分析
研究考察了门水平的菌群变化,各实验组大鼠的肠道菌群主要由Firmicutes、Bacteroidetes构成(图4)。与空白组相比,来曲唑诱导的PCOS大鼠Firmicutes、Bacteroidetes水平未发生明显改变。与模型组相比,植物乳杆菌CCFM1019发酵豆乳降低了Firmicutes相对丰度并提高了Bacteroidetes相对丰度,从而降低了Firmicutes/Bacteroidetes值但差异无统计学意义(P>0.05);植物乳杆菌LP4、LP5发酵豆乳的干预效果与CCFM1019组相反,且差异无统计学意义(P>0.05)(图5)。
各实验组大鼠肠道菌群属水平组成如图6所示。与模型组相比,植物乳杆菌CCFM1019发酵豆乳显著降低了Lactobacillus(P<0.001)、Prevotellaceae UCG-001(P<0.01)相对丰度,同时降低了Ruminococcaceae UCG-014相对丰度,但差异无统计学意义(P>0.05);植物乳杆菌LP4发酵豆乳显著降低了Lactobacillus(P<0.01)、Prevotellaceae UCG-001(P<0.01)相对丰度,同时降低了Ruminococcaceae UCG-014、Parabacteroides相对丰度,提高了Lachnospira、Anaerostipes相对丰度,差异无统计学意义(P>0.05);植物乳杆菌LP5发酵豆乳显著降低了Lactobacillus(P<0.05)、Prevotellaceae UCG-001(P<0.001)相对丰度,同时降低了Ruminococcaceae UCG-014、Parabacteroides相对丰度,提高了Anaerostipes相对丰度,但差异无统计学意义(P>0.05)(图7)。
2.3 肠道菌群与短链脂肪酸、性激素水平的相关性分析
前期研究了植物乳杆菌发酵豆乳的干预对性激素水平的影响[12]。本研究进一步对肠道菌群和短链脂肪酸、性激素水平相关性进行了Spearman分析。由图8可知,Lactobacillus的相对丰度与睾酮呈正相关,并且相关性有统计学意义(P<0.05);Prevotellaceae UCG-001的相对丰度与促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)呈正相关,并且相关性有统计学意义(P<0.05);Ruminococcaceae UCG-014的相对丰度与GnRH呈正相关,与异戊酸水平呈负相关,且2种相关性均具有统计学意义(P<0.05);Lachnospira的相对丰度与雌二醇呈正相关(P<0.05)。各实验组大鼠性激素水平见石刘婷等[12]的研究。

a-乙酸水平;b-丙酸水平;c-异丁酸水平;d-丁酸水平;e-异戊酸水平;f-戊酸水平
图1 植物乳杆菌发酵豆乳对PCOS大鼠粪便中短链脂肪酸水平的影响
Fig.1 Effect of L.plantarum fermented soymilk on fecal SCFAs of PCOS rats
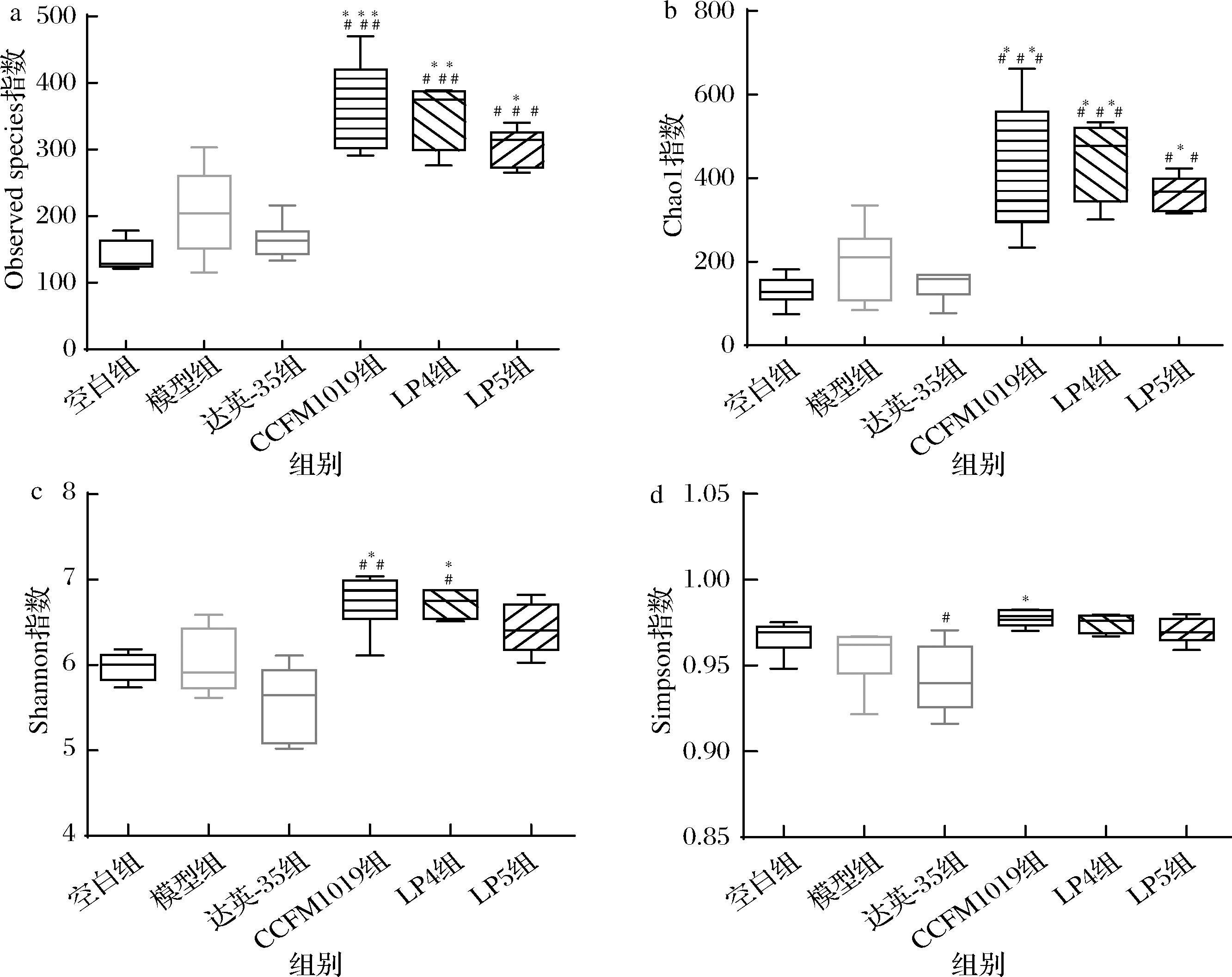
a-Observed spieces指数;b-Chao 1指数;c-Shannon指数;d-Simpson指数
图2 植物乳杆菌发酵豆乳对PCOS大鼠肠道菌群α多样性的影响
Fig.2 Effect of L.plantarum fermented soymilk on α diversity of gut microbiota in PCOS rats 注:*与模型组比较,P<0.05;**与模型组比较,P<0.01;***与模型组比较,P<0.001;#与空白组相比,P<0.05;##与空白组比较,P<0.01; ###与空白组比较,P<0.001(下同)

图3 基于Bray-Curtis距离的PCoA
Fig.3 PCoA analysis by the Bray-Curtis

图4 各门水平所占比例
Fig.4 The proportion of each phylum level

a-Firmicutes相对丰度;b-Bacteroidetes相对丰度; c-Firmicutes/Bacteroidetes比值
图5 植物乳杆菌发酵豆乳对PCOS大鼠肠道菌群门 水平的影响
Fig.5 Effect of L. plantarum fermented soymilk on the phylum level of gut microbiota in PCOS rats

图6 各属水平所占比例
Fig.6 The proportion of each genus level
3 结论
近年来的研究表明,PCOS患者与健康人体之间肠道菌群存在显著差异[13-14],肠道菌群失调可能通过影响微生物相关物质及代谢物,包括胆汁酸[15]、短链脂肪酸[16]和LPS[17]等触发PCOS症状。通过肠道微生物调节剂(如益生菌)的干预可以改善肠道菌群失调以缓解POCS症状[16,18]。本研究通过对PCOS大鼠灌胃植物乳杆菌CCFM1019、LP4、LP5发酵豆乳发现:3种植物乳杆菌发酵豆乳显著提高了PCOS大鼠肠道菌群的α-多样性,且干预后大鼠的肠道菌群与模型组相比具有显著差异。植物乳杆菌CCFM1019

a-Lactobacillus相对丰度;b-Prevotellaceae UCG-001相对丰度;c-Ruminococcaceae UCG-014相对丰度;d-Anaerostipes相对丰度; e-Parabacteroides相对丰度;f-Lachnospira相对丰度
图7 植物乳杆菌发酵豆乳对PCOS大鼠肠道菌群属水平的影响
Fig.7 Effect of L. plantarum fermented soymilk on the genus level of gut microbiota in PCOS rats

图8 短链脂肪酸、性激素与不同属的相关性
Fig.8 Correlation between sex hormones, SCFAs and differential genera 注:*表示P<0.05;**表示P<0.01;***表示P<0.001
发酵豆乳表现出了降低Firmicutes/Bacteroidetes的趋势。Firmicutes与Bacteroidetes的比值与肥胖密切相关[19],因此CCFM1019发酵豆乳的干预可能有利于肥胖PCOS患者体重的下降。此外与模型组相比,3种植物乳杆菌发酵豆乳均能显著降低Lactobacillus、Prevotellaceae UCG-001相对丰度,同时有降低Ruminococcaceae UCG-014相对丰度的趋势。SHERMAN等[20]发现Lactobacillus的减少可以改善肠道屏障功能;ZHANG等[21]发现,与正常人群相比,Prevotellaceae在肥胖人群肠道中含量丰富,这可能与其能够发酵膳食纤维,促进机体吸收营养成分有关。王萍等[22]发现,瘤胃球菌属与身体代谢机制有关,HALL等[23]研究发现,Ruminococcus gnavus与肠道慢性炎症显著相关。相关性分析结果表明,Lactobacillus的丰度与睾酮呈正相关;Prevotellaceae UCG-001、Ruminococcaceae UCG-014的丰度与GnRH呈正相关。3种植物乳杆菌发酵豆乳可能是通过下调Lactobacillus、Prevotellaceae UCG-001、Ruminococcaceae UCG-014相对丰度来调节睾酮、GnRH水平以缓解PCOS症状。
综上所述,植物乳杆菌CCFM1019、LP4、LP5发酵豆乳能够调节PCOS大鼠的肠道菌群多样性以及特定菌群的组成,这些菌群的相对丰度与大鼠的性激素水平具有一定相关性。说明植物乳杆菌CCFM1019、LP4、LP5发酵豆乳可能通过调节肠道菌群来影响PCOS大鼠的性激素水平。进一步研究3种发酵豆乳及豆乳中差异性物质、以及这些差异物质对肠道内环境的影响,将有助于进一步解析植物乳杆菌发酵豆乳缓解PCOS症状的机制。
[1] 苑广慧, 郝翠芳, 李宁.多囊卵巢综合征伴胰岛素抵抗患者肠道菌群分析[J].生殖医学杂志, 2021, 30(3):354-361.
YUAN G H, HAO C F, LI N.Analysis of intestinal microbiota in patients with polycystic ovary syndrome and insulin resistance[J].Journal of Reproductive Medicine, 2021, 30(3):354-361.
[2] 单珂, 高慧.高雄激素表现多囊卵巢综合征产妇的围生结局分析[J].中国实用医药, 2021, 16(13):123-125.
SHAN K, GAO H.Perinatal outcome analysis of hyperandrogenic polycystic ovary syndrome in parturient women[J].China Practical Medicine, 2021, 16(13):123-125.
[3] LIM S S, DAVIES M J, NORMAN R J, et al.Overweight, obesity and central obesity in women with polycystic ovary syndrome:A systematic review and meta-analysis[J].Human Reproduction Update, 2012, 18(6):618-637.
[4] ZENG B, LAI Z W, SUN L J, et al.Structural and functional profiles of the gut microbial community in polycystic ovary syndrome with insulin resistance (IR-PCOS):A pilot study[J].Research in Microbiology, 2019, 170(1):43-52.
[5] 安洁, 周琴, 薛毅芳.肠道微生态与多囊卵巢综合征发病机制的相关性[J].河南中医, 2021, 41(1):153-158.
AN J, ZHOU Q, XUE Y F.The correlation between intestinal microecology and pathogenesis of polycystic ovary syndrome[J].Henan Traditional Chinese Medicine, 2021, 41(1):153-158.
[6] 乔杰, 齐新宇, 徐雅兰, 等.关注影响女性健康的重要生殖内分泌疾病多囊卵巢综合征[J].中国实用妇科与产科杂志, 2020, 36(1):1-9.
QIAO J, QI X Y, XU Y L, et al.Pay attention to important reproductive endocrinologic diseasesaffecting female health-polycystic ovary syndrome[J].Chinese Journal of Practical Gynecology and Obstetrics, 2020, 36(1):1-9.
[7] 于辉, 董安琴, 赵阳, 等.肠道菌群在冠心病合并心衰患者中的变化及益生菌干预效果研究[J].军事医学, 2021, 45(6):443-448.
YU H, DONG A Q, ZHAO Y, et al.Changes in intestinal flora in patients with coronary heart disease and heart failure and effects of probiotics interventions[J].Military Medical Sciences, 2021, 45(6):443-448.
[8] 李乐愚, 成金燕, 徐瑞颜.肠道菌群及其代谢产物与2型糖尿病关系的研究进展[J].当代医药论丛, 2020, 18(7):8-10.
LI L Y, CHENG J Y, XU R Y.The relationship between intestinal flora and its metabolites and type 2 diabetes mellitus[J].Contemporary Medicine Forum, 2020, 18(7):8-10.
[9] GUO Y J, QI Y E, YANG X F, et al.Association between polycystic ovary syndrome and gut microbiota[J].PLoS One, 2016, 11(4):e0153196.
[10] AHMADI S, JAMILIAN M, KARAMALI, et al.Probiotic supplementation and the effects on weight loss, glycaemia and lipid profiles in women with polycystic ovary syndrome:A randomized, double-blind, placebo-controlled trial[J].Human Fertility (Cambridge, England), 2017, 20(4):254-261.
[11] HE Y F, WANG Q Q, LI X, et al.Lactic acid bacteria alleviate polycystic ovarian syndrome by regulating sex hormone related gut microbiota[J].Food & Function, 2020, 11(6):5 192-5 204.
[12] 石刘婷, 贺禹丰, 杨羽倩, 等.植物乳杆菌发酵豆乳对多囊卵巢综合征大鼠的影响[J].食品与发酵工业, 2022,48(4):165-170.
SHI L T, HE Y F, YANG Y Q, et al.Effects of soymilk fermented by Lactobacillus plantarum on rats with polycystic ovary syndrome[J].Food and Fermentation Industries, 2022,48(4):165-170.
[13] LIU R, ZHANG C H, SHI Y, et al.Dysbiosis of gut microbiota associated with clinical parameters in polycystic ovary syndrome[J].Frontiers in Microbiology, 2017, 8:324.
[14] JOBIRA B, FRANK D N, PYLE L, et al.Obese adolescents with PCOS have altered biodiversity and relative abundance in gastrointestinal microbiota[J].The Journal of Clinical Endocrinology & Metabolism, 2020, 105(6):e2 134-e2 144.
[15] QI X Y, YUN C Y, SUN L L, et al.Publisher correction:Gut microbiota-bile acid-interleukin-22 axis orchestrates polycystic ovary syndrome[J].Nature Medicine, 2019, 25(8):1 225-1 233.
[16] ZHANG J C, SUN Z H, JIANG S M, et al.Probiotic Bifidobacterium lactis V9 regulates the secretion of sex hormones in polycystic ovary syndrome patients through the gut-brain axis[J].mSystems, 2019, 4(2):e00017-e00019.
[17] EVERARD A, BELZER C, GEURTS L, et al.Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity[J].Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(22):9 066-9 071.
[18] 朱晓霞, 夏朋滨, 何亚琼.补充维生素D联合益生菌对多囊卵巢综合征患者肠道菌群多样性、代谢和激素水平的影响[J].中国微生态学杂志, 2020, 32(3):317-321.
ZHU X X, XIA P B, HE Y Q.Effects of vitamin D and probiotics supplementation on bacterial diversity, metabolism and hormone level in patients with polycystic ovary syndrome[J].Chinese Journal of Microecology, 2020, 32(3):317-321.
[19] 焦婷, 朱慧越, 司倩, 等.罗伊氏乳杆菌CCFM8631缓解小鼠非酒精性脂肪性肝病与其对肠道菌群及短链脂肪酸的调节显著相关[J].食品与发酵工业, 2020, 46(10):35-43.
JIAO T, ZHU H Y, SI Q, et al.Significant correlation between relieving of non-alcoholic fatty liver disease and regulation on gut microbiota and short-chain fatty acids in mice by Lactobacillus reuteri CCFM8631[J].Food and Fermentation Industries, 2020, 46(10):35-43.
[20] SHERMAN S B, SARSOUR N, SALEHI M, et al.Prenatal androgen exposure causes hypertension and gut microbiota dysbiosis[J].Gut Microbes, 2018, 9(5):400-421.
[21] ZHANG H S, DIBAISE J K, ZUCCOLO A, et al.Human gut microbiota in obesity and after gastric bypass[J].Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(7):2 365-2 370.
[22] 王萍, 王颖, 万红, 等.代谢综合征患者肠道菌群特征探析[J].广西医学, 2020, 42(19):2 501-2 504.
WANG P, WANG Y, WAN H, et al.Characteristics of gut microbiota in patients with metabolic syndrome[J].Guangxi Medical Journal, 2020, 42(19):2 501-2 504.
[23] HALL A B, YASSOUR M, SAUK J, et al.A novel Ruminococcus gnavus clade enriched in inflammatory bowel disease patients[J].Genome Medicine, 2017, 9(1):103.