食物过敏是指机体进食食物后,某些蛋白刺激免疫系统产生的异常反应[1],表现在皮肤、呼吸道和胃肠道的一些不良反应,甚至引起过敏性休克以及死亡[2]。食物过敏是世界公认的食品安全问题之一,约影响全球3.5%~4.0%的人口[3]。在亚洲,约有40%的儿童和33%的成人对虾蟹等甲壳类食物过敏[4]。甲壳类动物被联合国粮农组织认定为八大类食物过敏原之一,虾及其制品是海鲜过敏的主要原因[5]。虾中过敏原包含有原肌球蛋白(tropomyosin, TM)、肌球蛋白轻链、丙酮酸激酶、精氨酸激酶和肌钙结合蛋白等。其中,TM引起的过敏可达80%,是虾中最主要的过敏原[6-8]。
TM分子质量为32~39 kDa[9],是由2条相同的α-螺旋链互相缠绕组成的杆状结构,具有盐溶性和热稳定性[10]。TM是肌动蛋白动力学的调节剂,在肌肉收缩中具有调节肌动蛋白和肌球蛋白相互作用的功能,广泛存在于脊椎动物和无脊椎动物肌肉组织中[11]。目前TM纯化方法主要有等电点沉淀法、硫酸铵盐析、柱层析和高效液相色谱技术等[8,12-14],但纯化后的TM产量小、纯度低,且所用设备昂贵,因此操作简单、耗时短、纯度高且成本低的纯化方法的研究十分重要。
本研究以凡纳滨对虾为原料,根据TM的特性,采用经丙酮去脂,热处理除杂,硫酸铵沉淀盐析,采用柱层析进一步纯化以获得高纯度TM。通过LC-MS/MS结合Western blot对TM进行鉴定,并进行生物信息学研究,分析其理化性质并预测其空间结构,以期为TM致敏性的消减研究奠定基础。
1 材料与方法
1.1 材料与试剂
凡纳滨对虾(Litopenaeus vannamei),30尾/kg,购于广东省湛江市东风水产市场,经冰猝死后2 h内运至实验室。
考马斯亮蓝染液、10×PBS(pH 7.4、0.1 mol/L)和Tris-HCl(pH 7、0.02 mol/L),北京酷来搏科技有限公司;DEAE FF、XK16/100层析柱,美国GE公司;预染蛋白marker,SMOBIO公司;12%预制胶、蛋白上样缓冲液、10×变性电泳液、封闭液、转膜液,上海碧云天生物技术有限公司;考马斯亮蓝蛋白测定试剂盒,生工生物工程(上海)股份有限公司;硫酸铵、氯化钠、蔗糖,罗恩试剂;其他试剂均为分析纯,国药集团。
1.2 仪器与设备
低温高速离心机,美国sigma公司;AKTA purifier 100型制备型蛋白质纯化系统,美国GE;紫外分光光度计,岛津(中国)有限公司;垂直电泳仪,北京六一有限公司;电转仪、化学发光系统,上海天能科技有限公司;电喷雾-组合型离子阱Orbitrap 质谱仪、毛细管高效液相色谱仪,赛默飞(上海)有限公司;涡旋仪、脱色摇床,美国Scliogex公司。
1.3 实验方法
1.3.1 TM分离纯化
TM提取液的制备参考邵虎明[8]的方法并略作修改,虾去头尾和虾线后绞碎,加入过夜预冷的丙酮(1∶4, g∶mL),磁力搅拌4 h。样品离心15 min(4 ℃, 8 500 r/min),弃掉上清液,取沉淀,重复上述步骤,直到虾肉无色,虾肉于通风橱中挥干即得到虾肉粉。取100 g虾肉粉按照1∶6(g∶mL)加入PBS(0.1 mol/L,pH 7.4),磁力搅拌6 h,4 ℃离心10 min,10 000 r/min,取上清液,沉淀中加入PBS重复上述步骤,合并2次上清液得到蛋白粗提液。将粗提液置于沸水浴中加热6 min,取出后离心10 min(4 ℃, 8 500 r/min),上清液中加入350 g/L硫酸铵,离心15 min(4 ℃, 8 500 r/min),沉淀复溶于Tris-HCl(0.02 mol/L,pH 7)中,-80 ℃保存备用。
TM纯化参考韩建勋[13]的方法,采用阴离子柱对蛋白粗提液进行分离纯化。层析柱经Tris-HCl(0.02 mol/L, pH 7)平衡后,用含有1 mol/L NaCl的Tris-HCl 线性洗脱,流速1.5 mL/min,洗脱峰溶液收集后进行SDS-PAGE实验,确定为目的蛋白后对洗脱液进行透析除盐,蛋白浓缩后于-80 ℃保存备用。
1.3.2 蛋白浓度测定与SDS-PAGE分析
以BSA标准品作为标准蛋白,96孔板中分别加入20 μL质量浓度为0、0.125、0.25、0.5、0.75、1、1.5 mg/mL标准品和20 μL样品,加入200 μL G250染色液,595 nm下测其最大光密度值,绘制标准曲线,计算样品蛋白质含量。
将纯化的TM稀释至1 mg/mL,采用12%预制胶进行SDS-PAGE实验。Marker上样5 μL,样品上样15 μL。10 μL蛋白上样缓冲液(5×)与40 μL样品混合,沸水浴6 min。电泳条件为电压120 V,电流40 mA。电泳结束后进行考马斯亮蓝染色,采用脱色液进行脱色处理,至蛋白质条带清晰结束。
1.3.3 质谱鉴定
1.3.3.1 胰蛋白酶(trypsin)酶解
将目的条带切成1 mm×1 mm×1 mm胶粒,加入50% 乙腈50% mmol/L NH4HCO3进行脱色,加入10 μL质量浓度为15 ng/mL胰蛋白酶,4 ℃冰箱孵育40 min后加10 μL 50 mmol/L NH4HCO3溶液,37 ℃水浴酶切16 h,冷却后加入2 μL甲酸,混匀后上机分析。
1.3.3.2 质谱检测和蛋白鉴定
预柱:300 μm i.d×5 mm,Acclaim PepMap RPLC C18,5 μm,100Å,分析柱:150 μm i.d.× 150 mm,Acclaim PepMap RPLC C18,1.9 μm。流动相A为0.1%甲酸-2%乙腈,流动相B为0.1%甲酸-80%乙腈;流速:600 nL/min。采集信息数据,经过MaxQuant(1.6.2.10)数据库检索,对蛋白质进行鉴定。
1.3.3.3 Western blot分析
免疫印迹分析参照ZHANG等[15]的方法略作修改。将纯化好的蛋白调整质量浓度至100 μg/mL,按照1.3.2中进行SDS-PAGE后转移至预先活化好的PVDF膜,室温下用Western封闭液封闭,30 min后TBST洗膜5次,3 min/次。与稀释2 000倍兔抗虾TM免疫球蛋白G(immunoglobulin,IgG)抗体在4 ℃冰箱中摇晃孵育过夜,TBST洗膜5次,3 min/次。与稀释10 000倍的羊抗兔IgG抗体室温下孵育1 h,TBST洗膜5次,3 min/次。加入ECL显色,采用天能5200化学发光仪拍照并分析结果。
1.3.3.4 TM生物信息学分析
从NCBI检索得到凡纳滨对虾TM氨基酸序列(Gene ID:113820940),采用Expasy和CamSol Intrinsic站点分析TM生物学信息、氨基酸组成、疏水性、溶解度;分别采用SOPMA、Jpred4、COR IV、Raptor X、S2D、NetSurfP-2.0预测TM二级结构;利用SWISS-MODEL站点进行三维结构同源建模,并对建模结果进行评估。
2 结果与分析
2.1 TM的分离纯化
凡纳滨对虾虾肉经丙酮去脂、PBS粗提、热处理除杂、硫酸铵沉淀、柱层析后进行SDS-PAGE,结果见图1。对虾肌肉组织成分复杂,至少含有19种蛋白质(图1-a),相对分子质量最大可超180 kDa,大多数集中在35 kDa以上,在约36 kDa处有明显条带。经沸水浴后,大多数不耐热蛋白变性。硫酸铵沉淀富集后经柱层析,约36 kDa处有单一条带,经凝胶成像和灰度分析,纯度为98%(图1-b)。洗脱曲线出现单一洗脱峰(图1-c),采用Western blot分析纯化后TM活性,结果显示在36 kDa处有阳性反应。

a-TM纯化SDS-PAGE图(M-marker;1-PBS粗提蛋白;2-热处理后 蛋白;3-硫酸铵沉淀;4-TM纯化蛋白);b-TM Western blot分析 (M-marker;1-TM);c-TM纯化洗脱曲线
图1 TM纯化图
Fig.1 The purification results of TM
2.2 TM鉴定
SDS-PAGE确定其分子质量为36 kDa,电泳胶粒经脱色、脱水、还原烷基化、酶切后获得肽段混合物,经LC-MS/MS鉴定,利用MaxQuant(1.6.2.10)数据库检索和物种筛选,发现目的蛋白与凡纳滨对虾中TM gi:1536079568匹配分值最高,为323.31分,鉴定为TM。
2.3 TM理化特性分析
利用ExPASY网站中ProtParam站点分析TM氨基酸组成(表1),由284个氨基酸组成,含量最多的氨基酸是谷氨酸(Glu,19%),其次是亮氨酸(Leu,11.6%)和丙氨酸(Ala,11.3%)。氨基酸组成中不含有半胱氨酸(Cys)、脯氨酸(Pro)、色氨酸(Trp)、硒半胱氨酸(Sec)和吡咯赖氨酸(Pyl),且不含天冬氨酸衍生物和谷氨酸衍生物。其中负电荷残基数Arg和Lys共49个占比17.25%,正电荷残基数Asp和Glu共72个占比25.35%,预测TM是细胞间蛋白[16]。TM分子式为C1387H2303N411O491S8,理论等电点4.72。脂肪指数79.12、不稳定系数39.00,预测TM在较广温度范围内为稳定蛋白[16-17]。
表1 凡纳滨对虾原肌球蛋白氨基酸含量和残基参数分析
Table 1 Analysis of amino acid content and residue parameters of tropomyosin from L.vannamei TM
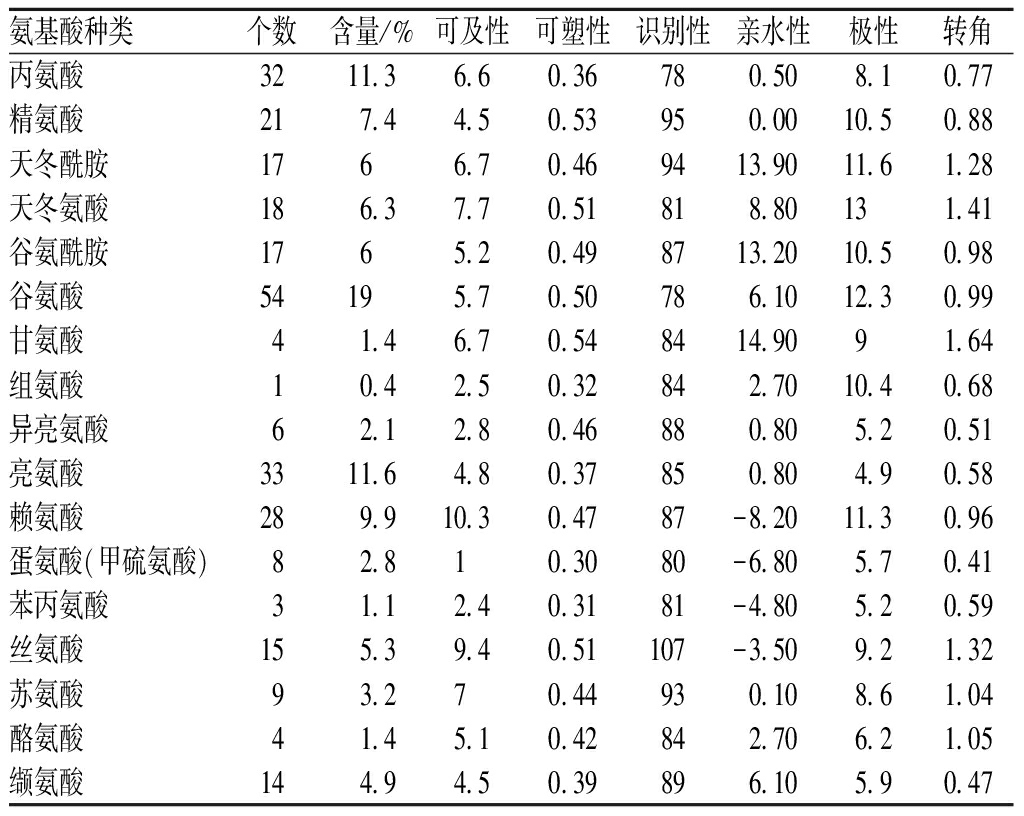
氨基酸种类个数含量/%可及性可塑性识别性亲水性极性转角丙氨酸3211.36.60.36780.508.10.77精氨酸217.44.50.53950.0010.50.88天冬酰胺1766.70.469413.9011.61.28天冬氨酸186.37.70.51818.80131.41谷氨酰胺1765.20.498713.2010.50.98谷氨酸54195.70.50786.1012.30.99甘氨酸41.46.70.548414.9091.64组氨酸10.42.50.32842.7010.40.68异亮氨酸62.12.80.46880.805.20.51亮氨酸3311.64.80.37850.804.90.58赖氨酸289.910.30.4787-8.2011.30.96蛋氨酸(甲硫氨酸)82.810.3080-6.805.70.41苯丙氨酸31.12.40.3181-4.805.20.59丝氨酸155.39.40.51107-3.509.21.32苏氨酸93.270.44930.108.61.04酪氨酸41.45.10.42842.706.21.05缬氨酸144.94.50.39896.105.90.47
2.4 TM蛋白溶解度和亲水性分析
采用CamSol Intrinsic和ExPASY预测TM溶解度和疏水性,结果见图2。TM溶解度综合得分3.79,分数>1的区域表示高溶解度区域,而分数<-1的为难溶性区域(图2-a),表明TM氨基酸在所有区域都是可溶的。通过ExPASY网站ProtScale站点分析TM疏水性,68位、215位天冬酰胺(Asn)分别得分1.222(max),-3.067(min)(图2-b),亲水性区域占77%,表明其为亲水蛋白。
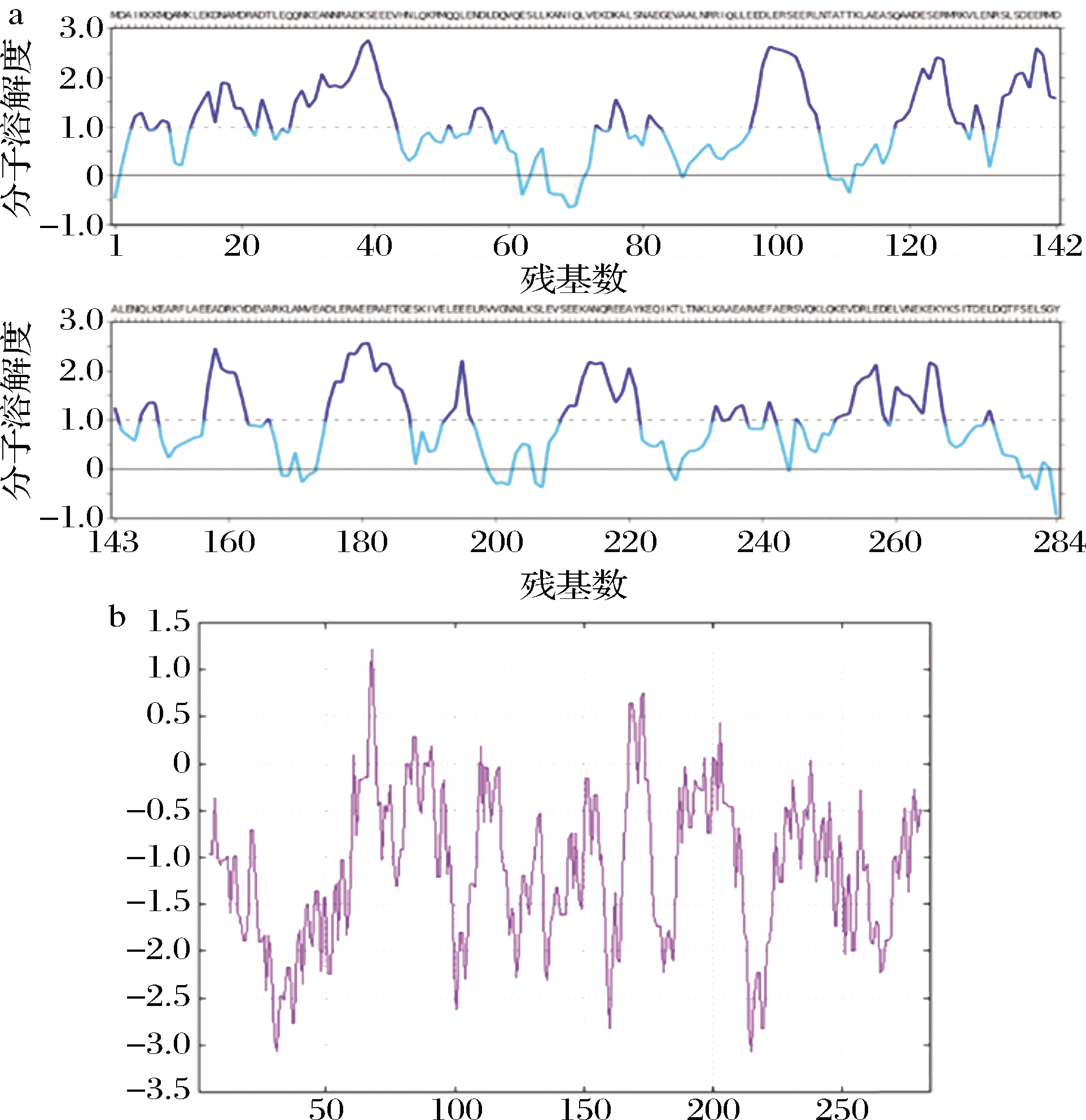
a-溶解度;b-疏水性
图2 TM溶解度参数
Fig.2 Solubility parameters of TM
构成抗原表位的多数氨基酸都带有电荷,并有极性。可及性、可塑性、识别性、亲水性和转角是抗原表位区域的理化参数,通过分析其参数并结合已有过敏原数据库可比较结合表位。蛋白质可及性和片段可塑性是预测抗原表位的重要特征[18]。可及性反映了抗原分子的空间结构,表示氨基酸残基和溶剂分子所接触的可能性,对TM氨基酸残基采用ProtScale分析(图3),第268残基赖氨酸(Lys)可及性最高,第92残基异亮氨酸(Ile)最低,平均值为6.16,26~41、72~83、108~136、158~166、184~190、202~219、222~236、246~252及261~276为可及性区域,高于平均值水平。FU等[19]和ZHANG等[18]通过BepiPred服务器分别预测中国对虾和斑节对虾TM抗原表位也证实了高可及性有利于形成抗原表位。分子可塑性表示抗原构象中多肽骨架的可活动性,平均值为0.45,第101残基精氨酸(Arg)最高为0.494,第172残基缬氨酸(Val)最低为0.403,24~41、55~60、92~106、119~141、159~164、177~199、207~223及246~273为可塑性区域,高于平均值水平。第132残基天冬酰胺(Asn)识别性最大为91.889,第238残基精氨酸(Arg)识别性最低为80.222,平均值为85.67,大于平均值的区域为30~33、35~38、41~53、59~68、75~79、87~94、101~111、124~138、185~190、199~214、225~231、244~249、265~273及277~280。
亲水性残基位于分子表面,其最高峰成为抗原表位的可能性较大[20],采用HPLC/retention pH 7.4分析亲水性,第68残基天冬酰胺(Asn)最大为4.4,第100残基谷氨酸(Glu)最小为-9.1,亲水性均值为-2.0,大于平均值的区域为5~15、19~22、46~51、61~79、87~95、106~117、126~133、149~152、164~173、189~207、223~235、245~249、266~275及277~280,TM空间结构高亲水性的存在是其致敏的理论依据[18]。极性最大11.244为第215残基天冬酰胺(Asn),第68残基天冬酰胺(Asn)极性最小为7.478,平均值为9.514,大于平均值的区域为16~20、23~45、54~59、77~80、99~106、118~124、134~143、157~164、176~186、211~234及254~269。XU等[21]通过DNAStar和AntheProt Protean软件以氨基酸亲水性、可塑性等参数预测了凡纳滨对虾、大黄鱼和菲律宾蛤仔TM的抗原表位,并以高亲水性、可塑性、极性区域合成表位进行了Dot bolt和ELISA实验发现虾TM合成表位有明显的阳性反应。转角多位于蛋白分子的表面,有利于结合抗体,较大可能成为抗原表位,其最大值1.097为第279残基丝氨酸(Ser),第168残基赖氨酸(Lys)和169残基亮氨酸(Leu)转角最小为0.7,均值为0.92,大于平均值的区域为16~21、23~39、54~60、76~83、98~108、117~125、132~143、158~164、181~190、202~207、209~220、254~256及265~280。

a-可及性;b-可塑性;c-识别性;d-亲水性;e-极性;f-转角
图3 凡纳滨对虾TM表位区域参数
Fig.3 Regional parameters of TM epitopes from L.vannamei
2.5 TM二级结构预测
将凡纳滨对虾TM(gi:1536079568)氨基酸序列导入SOPMA中分析二级结构(图4-a),在284个氨基酸中,α螺旋氨基酸有280个,占98.59%;无规则卷曲氨基酸4个,占比1.4%。JPred4分析结果见图4-b,TM中含有大量的α-螺旋和少量无规则卷曲,不含β-折叠,与SOPMA结果一致。COR IV预测结果见图4-c,TM结构组成包括α螺旋(89.08%)、延伸链(2.11%)和无规则卷曲(8.8%)。RaptorX软件预测结果见图4-d,TM中279个氨基酸形成α-螺旋(98.23%),5个氨基酸形成无规则卷曲(1.76%)。S2D软件预测TM中54个氨基酸形成无规则卷曲(19.01%),230个氨基酸形成α-螺旋(80.99%)(图4-e)。NetSurfP-2.0软件预测TM中6个氨基酸为无规则卷曲(2.11%),278个氨基酸为α-螺旋(97.89%)(图4-f)。预测结果表明TM二级结构以α-螺旋为主,可能含有β-折叠,含有少量无规则卷曲。

a-SOPMA;b-JPred4;c-COR IV;d-RaptorX;e-S2D;f-NetSurfP-2.0
图4 不同软件预测凡纳滨对虾TM二级结构的结果
Fig.4 Prediction results of secondary structure of TM from L.vannamei using different software
2.6 三级结构预测
使用SWISS-MODEL站点对TM三级结构同源建模,选取相似度达55.99%的1c1 g.2.A蛋白B链为模板构建TM三级结构,并对模型进行评估,结果见图5,其中98.05%位于拉氏图可靠区域,表明预测模型可行。
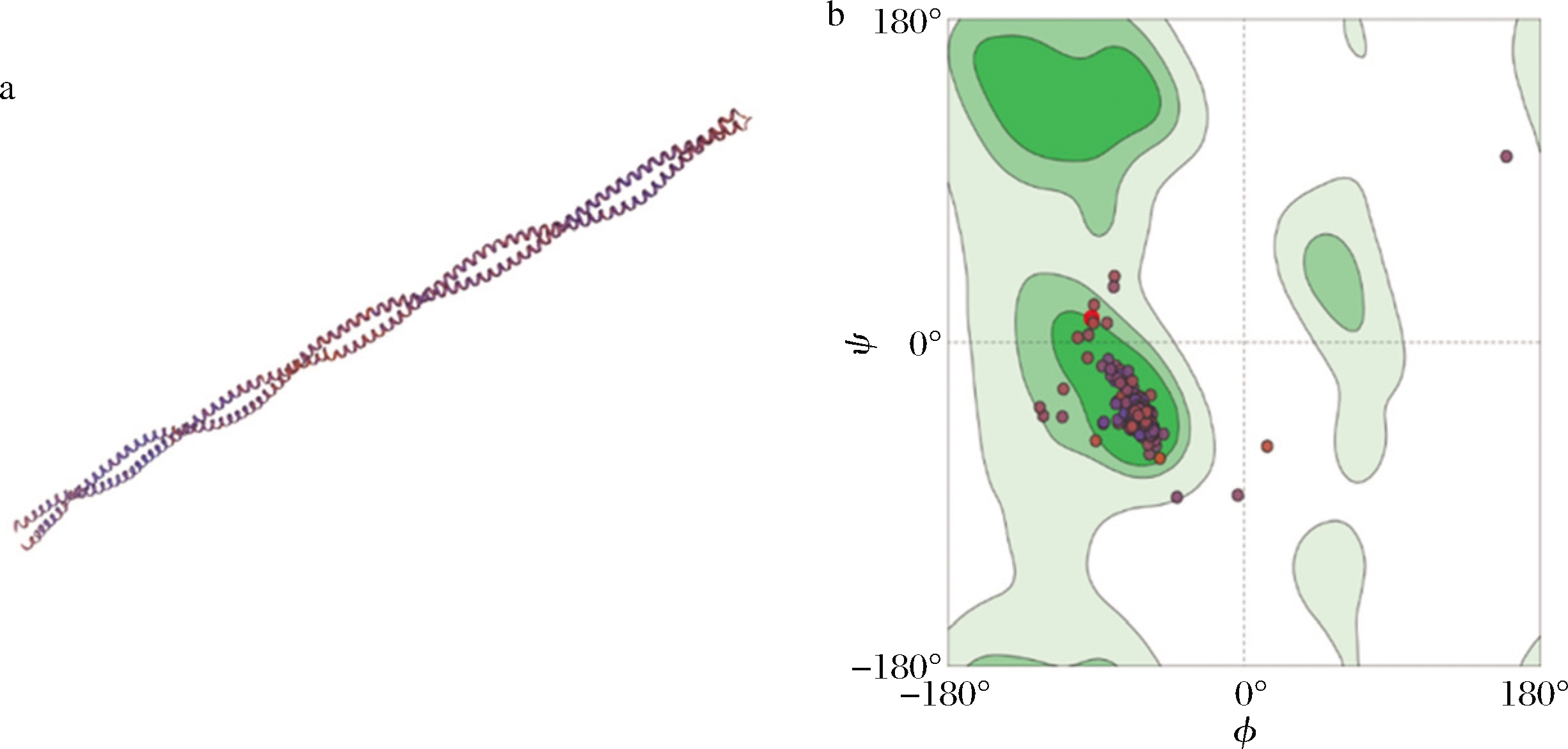
a-三级结构;b-拉氏图
图5 TM三级结构和拉氏图
Fig.5 Three-dimension structure and Ramachandran
Figure of TM
3 结论
凡纳滨对虾肌肉经过丙酮去脂、PBS粗提和热处理除杂后,采用硫酸铵沉淀结合柱层析纯化,得到了纯度为98%的TM。SDS-PAGE显示TM分子质量36 kDa,胶粒经LC-MS/MS鉴定后,肽段覆盖率可达75%。进一步采用生物信息学分析,TM为热稳定蛋白,属于亲水性蛋白。对其二级结构进行预测,发现TM以α-螺旋为主,可能含有β-折叠,含有少量无规则卷曲,其三级结构简单,无复杂的四级结构。
由于TM具有耐酸碱、耐高温的特性,常规的热处理方式无法破坏其抗原表位,达到消减致敏性的作用。目前诸多学者采用美拉德反应、酶促交联、酶水解等化学法和超声、高静压、辐照、等离子体等物理法消减TM致敏性[7,13,22-23],虽然会一定程度上降低致敏性,但是长时间的处理会带来一些负面影响。如:化学法会引起食品风味和质构的改变并产生有害物质,而且过程无法精准控制;物理法产生的消减程度不一,且长时间的物理场对食品质地会产生一定的影响[1,24]。采用单一加工方式消减效果并不理想,采用联合方法消减过敏原致敏性正逐渐兴起,LIU等[25]采用美拉德反应结合热处理TM,与单独热处理和美拉德反应相比,其消化率有所提高且IgG/IgE结合活性降低。
[1] 傅玲琳,王彦波.食物过敏:从致敏机理到控制策略[J].食品科学, 2021, 42(19):1-19.
FU L L, WANG Y B.Food allergy:From sensitization mechanism to control strategy[J].Food Science, 2021, 42(19):1-19.
[2] RENZ H, ALLEN K J, SICHERER S H, et al.Food allergy[J].Nature Reviews Disease Primers, 2018, 4(1):1-20.
[3] KING T, COLE M, FARBER J M, et al.Food safety for food security:Relationship between global megatrends and developments in food safety[J].Trends in Food Science & Technology, 2017, 68:160-175.
[4] HAJEB P, SELAMAT J.A contemporary review of seafood allergy[J].Clinical Reviews in Allergy & Immunology, 2012, 42(3):365-385.
[5] 潘晓东,黄百芬,蔡增轩,等.超高效液相色谱-四极杆静电场轨道离子阱质谱分析沼虾过敏原蛋白[J].预防医学, 2020, 32(10):1 010-1 012;1 017.
PAN X D, HUANG B F, CAI Z X, et al.Analysis of allergen protein in Macrobrachium by ultra-high performance liquid chromatography coupled with quadrupole orbitrap mass spectrometry[J].Preventive Medicine, 2020, 32(10):1 010-1 012;1 017.
[6] CHINNAPPAN R, RAHAMN A A, ALZABN R, et al.Aptameric biosensor for the sensitive detection of major shrimp allergen, tropomyosin[J].Food Chemistry, 2020, 314:126133.
[7] ZHANG Z Y, LI X M, LI Z X, et al.Investigation of glycated shrimp tropomyosin as a hypoallergen for potential immunotherapy[J].Food & Function, 2021, 12(6):2 750-2 759.
[8] 邵虎明. 日本沼虾原肌球蛋白的分离鉴定及致敏性分析[D].南昌:南昌大学, 2019.
SHAO H M.Preparation, identification and allergenicity assessment of tropomyosin from Macrobrachium nipponense [D].Nanchang:Nanchang University,2019.
[9] RUETHERS T, TAKI A C, JOHNSTON E B, et al.Seafood allergy:A comprehensive review of fish and shellfish allergens[J].Molecular Immunology, 2018, 100:28-57.
[10] KLUEBER J, COSTA J, RANDOW S, et al.Homologous tropomyosins from vertebrate and invertebrate:Recombinant calibrator proteins in functional biological assays for tropomyosin allergenicity assessment of novel animal foods[J].Clinical & Experimental Allergy, 2020, 50(1):105-116.
[11] REESE G, AYUSO R, LEHRER S B.Tropomyosin:An invertebrate pan-allergen[J].International Archives of Allergy and Immunology, 1999, 119(4):247-258.
[12] 林江伟. 克氏原螯虾致横纹肌溶解危害物与过敏原的分析[D].厦门:集美大学, 2012.
LIN J W.Analysis of the hazardous substance causing crayfish-induced rhabdomyolysis and the allergens from crayfish [D].Xiamen:Jimei University,2012.
[13] 韩建勋. 高静压处理对虾原肌球蛋白致敏性及结构变化规律研究[D].北京:中国农业大学, 2016.
HAN J X.Effect of high hydrostatic pressure on the allergenicity and structure of tropomyosin from shrimp[D].Beijing:China Agricultural University,2016.
[14] 傅玲琳,富舒洁,王彦波,等.凡纳对虾原肌球蛋白硫酸铵沉淀分离纯化方法的优化[J].食品科学, 2017, 38(18):187-192.
FU L L, FU S J, WANG Y B, et al.Optimization of purification by ammonium sulfate precipitation of the major allergen tropomyosin from shrimp (Litopenaeus vannamei)[J].Food Science, 2017, 38(18):187-192.
[15] ZHANG Z Y, LI X M, XIAO H, et al.Insight into the allergenicity of shrimp tropomyosin glycated by functional oligosaccharides containing advanced glycation end products[J].Food Chemistry, 2020, 302:125348.
[16] SATYANARAYANA S D V, KRISHNA M S R, PAVAN KUMAR P, et al.In silico structural homology modeling of nif a protein of rhizobial strains in selective legume plants[J].Journal of Genetic Engineering and Biotechnology, 2018, 16(2):731-737.
[17] IDICULA-THOMAS S, BALAJI P V.Understanding the relationship between the primary structure of proteins and its propensity to be soluble on overexpression in Escherichia coli[J].Protein Science, 2005, 14(3):582-592.
[18] ZHENG L N, LIN H, PAWAR R, et al.Mapping IgE binding epitopes of major shrimp (Penaeus monodon) allergen with immunoinformatics tools[J].Food and Chemical Toxicology, 2011, 49(11):2 954-2 960.
[19] FU L L, WANG J B, NI S Q, et al.Identification of allergenic epitopes and critical amino acids of major allergens in chinese shrimp (Penaeus chinensis) by immunoinformatics coupled with competitive-binding strategy[J].Journal of Agricultural and Food Chemistry, 2018, 66(11):2 944-2 953.
[20] 郑伟. 蛋白质结构研究及B细胞表位预测[D].天津:南开大学, 2014.
ZHENG W.Protein structure analysis and B cell epitope prediction[D].Tianjin:Nankai University,2014.
[21] XU L L, CHEN J, SUN L R, et al.Analysis of the allergenicity and B cell epitopes in tropomyosin of shrimp (Litopenaeus vannamei) and correlation to cross-reactivity based on epitopes with fish (Larimichthys crocea) and clam (Ruditapes philippinarum)[J].Food Chemistry, 2020, 323:126763.
[22] KHAN M U, AHMED I, LIN H, et al.Potential efficacy of processing technologies for mitigating crustacean allergenicity[J].Critical Reviews in Food Science and Nutrition, 2019, 59(17):2 807-2 830.
[23] DONG X, WANG J, RAGHAVAN V.Critical reviews and recent advances of novel non-thermal processing techniques on the modification of food allergens[J].Critical Reviews in Food Science and Nutrition, 2021, 61(2):196-210.
[24] NAIK A S, SURYAWANSHI D, KUMAR M, et al.Ultrasonic treatment:A cohort review on bioactive compounds, allergens and physico-chemical properties of food[J].Current Research in Food Science, 2021, 4:470-477.
[25] LIU M, HUAN F, HAN T, et al.Combination processing method reduced IgE-binding activity of Litopenaeus vannamei by modifying lysine, arginine, and cysteine on multiple allergen epitopes[J].Journal of Agricultural and Food Chemistry, 2021, 69(16):4 865-4 873.