冷冻贮藏被广泛用于肉及肉制品的保藏,以延长其货架期并保持品质。然而,冻藏过程中冰晶的形成和生长会破坏肉的微观结构,因此在解冻时常造成细胞膜损伤,出现脂质和蛋白质氧化等问题[1]。脂质氧化是肉及肉制品品质劣变的主要非微生物原因[2],不仅降低了肉的营养价值,而且会导致肉感官品质的下降,这些变化包括颜色、质地、气味等,会影响消费者的接受度[3]。
空气解冻和静水解冻是肉及肉制品传统的解冻方法,但这些解冻方法耗时较长且造成肉及肉制品内外温差较大,容易导致产品质量劣变[4]。近年来出现了一些新的解冻方法,如微波解冻、高压解冻、超声波解冻和欧姆解冻等。超声波是以高于人类听觉阈值的机械波为基础的声波,分为高(100~1 MHz)和低(16~199 kHz)2个频率范围。超声波可以产生空化效应,加速解冻过程,缩短解冻时间,被认为是一种快速、稳定的解冻方法[5]。LI等[6]研究认为,相对于其他超声波功率,280 W解冻能够维持鱼片内部的水分更加稳定。张昕[7]研究发现,超声波解冻可有效提高鸡胸肉解冻速率并显著改善新鲜度,但解冻后鸡胸肉保水性较差且肉色偏暗,其中180 W超声波解冻对鸡胸肉品质负面影响最小。马超锋等[8]研究了不同功率的超声波解冻罗非鱼,发现与传统流水解冻相比,450 W超声波能较好地保持罗非鱼片的品质。但MILES等[9]的研究表明,超声波解冻功率在430 kHz及以下时,存在表面过热、穿透性差等缺点。
近年来,随着调理食品的兴起,调理冷冻猪肝因便捷、耐贮藏、适口等优点,深受餐饮行业的喜爱。但猪肝含有丰富的不饱和脂肪酸,其在加工过程中极易被氧化,导致肉色变暗[10-11]。因此研究不同解冻方式应用于冷冻猪肝的适宜性很有必要。我们先前的研究发现,冷藏解冻和超声波解冻是能够保持猪肝品质的解冻方式,但有关超声波解冻猪肝的最适功率有待进一步研究[11]。本研究以冷冻猪肝为原料,探究了不同超声波功率解冻对猪肝脂质氧化稳定性的影响,以期为超声波解冻方式在冷冻副产物食品中的应用提供参考。
1 材料与方法
1.1 材料与试剂
硼酸、无水乙醇、溴甲酚绿、甲基红、三氯乙酸、碳酸钾、盐酸、磷酸二氢钾、氢氧化钠、乙二胺四乙酸、吐温-20、柠檬酸、柠檬酸钠、正己烷、异丙醇、三氯甲烷、硫酸、硫酸铜、酒石酸钾钠、氯化钠、无水硫酸钠,分析纯,成都市科龙化工试剂厂;硫酸奎宁、亚油酸钠、二硫苏糖醇、2-硫代巴比妥酸、牛血清蛋白,分析纯,上海源叶生物科技有限公司。
1.2 仪器与设备
F-4700荧光分光光度计,日本HITACHI公司;T-25 高速匀浆机,德国IKA公司;pH直测仪,德国Matthaus公司;5804R冷冻离心机,德国Eppendorf公司;UV1810S紫外分光光度计,上海佑科仪器仪表有限公司;热电偶测温仪,德国Ebro公司;SB-5200 DTDN超声波清洗机(300 W),宁波新芝生物科技股份有限公司;HH-6恒温水浴锅,国华电器有限公司;PL303分析天平,METTLER TOLEDO公司;LD510电子天平,沈阳龙腾电子有限公司;MP511型pH计,上海三信仪表厂。
1.3 实验方法
1.3.1 试验设计
于屠宰场购买当天离体、大小一致的新鲜猪肝3个,每个约2 kg(6月龄猪),用冰袋保护运回实验室。将猪肝用20 g/L生理盐水浸泡2 h,剥去薄膜,除去较大的血管和胆管,以及猪肝边角部位,以保证猪肝块的部位统一。将预处理好的猪肝在无菌条件下处理成大小一致的块状,每块60~70 g。分割好的猪肝真空袋包装后在-18 ℃冰箱冻藏60 h。从冰箱中取出猪肝,分别采用冷藏(4 ℃)解冻和120、180、240及300 W 超声波解冻(频率40 kHz,温度20 ℃)对猪肝进行解冻处理,待猪肝中心温度达到2 ℃作为解冻终点。解冻后的猪肝置于4 ℃冰箱冷藏,每隔24 h测定指标。
1.3.2 解冻时间的测定
将热电偶测温仪插入猪肝中心部,每隔30 s记录1次温度,直至猪肝中心温度达到(2±0.2) ℃。猪肝中心温度降至2 ℃所用的时间即为解冻时间。
1.3.3 解冻损失的测定
称量解冻前肉样质量m0和解冻后肉样m1,按公式(1)计算解冻损失:
解冻损失![]()
(1)
1.3.4 新鲜度的测定
使用pH直测仪测定猪肝的pH值,测定前pH计用4.64和7.00的标准溶液校正。
挥发性盐基氮(total volatile bases nitrogen,TVB-N)含量测定参考SENAPATI等[12]的方法。将10 g硼酸溶解于200 mL乙醇(95%)中,加入0.3 g/L溴甲酚绿和0.6 g/L甲基红各5 mL,用蒸馏水定容至1 000 mL,制备硼酸吸收液。准确称取10 g猪肝与45 mL 22 g/L三氯乙酸匀浆(12 000 r/min)60 s,匀浆液于8 000×g离心10 min,取上清液。将5 mL上清样品置于Conway皿的外室中,取3 mL的硼酸吸收液于Conway皿的内室中,用带缺口毛玻璃将Conway皿密封,再加入5 mL碳酸钾溶液(10 g/L)于Conway皿的外室中。将密封的Conway皿在37 ℃孵育2 h。使用0.01 mol/L盐酸滴定内室中的硼酸液体,直到其恢复至原始颜色。通过消耗的盐酸总量计算样品中TVB-N含量(mg/100g)。
1.3.5 脂氧合酶(lipoxygenase,LOX)活力的测定
参考HE等[13]的方法。准确称取1 g猪肝于15 mL 50 mmol/L磷酸盐缓冲液(1 mmol/L二硫苏糖醇、1 mmol/L乙二胺四乙酸,pH 7.0)中匀浆。将匀浆液于6 600×g离心30 min(4 ℃),取上清液。使用双缩脲法[14]测定上清液的蛋白质浓度。取300 μL底物溶液(28 mg/mL亚油酸钠,3.6%吐温-20,pH 9.0)与2.7 mL柠檬酸缓冲溶液(50 mmol/L,pH 5.5)混合,于37 ℃保温10 min,加入150 μL上清液,立即在234 nm处测定吸光度OD0,检测时间为135 s,间隔15 s记录1次数据,重复9次取平均值,按公式(2)计算LOX活力:
LOX活力/(U·mg-1蛋白![]()
(2)
式中:OD135为反应135 s的吸光值;OD0为反应0 s的吸光值;0.001为常数。
1.3.6 共轭二烯(conjugated diene,CD)值的测定
参考GEORGANTELIS等[15]的方法,并稍加修改。2 g肉样与20 mL去离子水匀浆(12 000 r/min,30 s)。取2 mL匀浆液,加入20 mL提取溶剂[V(正己烷)∶V(异丙醇)=3∶1)],振荡1 min,3 000×g离心5 min(4 ℃),于233 nm处测定上层清液吸光值。按公式(3)计算CD值:
(3)
式中:Aλ为233 nm的吸光值;C为脂质溶液在提取剂中的质量浓度,g/100mL;d为光程,1 cm。
1.3.7 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值的测定
参考阮一凡等[16]的方法,并稍做修改。称取猪肝5.0 g,加入75 g/L三氯乙酸(含1 g/L乙二胺四乙酸二钠)25 mL,振摇45 min,6 000×g离心5 min(4 ℃)。取上清液5 mL,加入0.02 mol/L硫代巴比妥酸溶液5 mL,在沸水浴中保温40 min;取出冷却后,加入5 mL三氯甲烷混匀,静置分层后吸取上清液,测定532和600 nm波长处的吸光值。TBARS值按照公式(4)计算:
TBARS值![]()
(4)
式中:A532为532 nm处的吸光值;A600为600 nm处的吸光值;V为上清液体积,mL;M为丙二醛的摩尔质量,72 g/mol;m为样品的质量,g;l为光程,1 cm;ε为摩尔消光系数,156 000 L/(mol·cm)。
1.3.8 荧光化合物含量的测定
参考AUBOURG等[17]的方法,并稍作修改。称取2 g 肉样与20 mL去离子水匀浆(12 000 r/min,30 s)。取2 mL匀浆液,加入20 mL提取溶剂[V(正己烷)∶V(异丙醇)=3∶1],振荡1 min,3 000×g离心5 min,取上层有机相和下层水相。使用荧光分光光度计分别测定有机相和水相在393/463 nm和327/415 nm处、狭缝为5时的荧光值。相对荧光值Fr=F/Fst,其中,F为样品在激发/发射最大值时的荧光值,Fst为1 μg/mL硫酸奎宁溶液(用0.05 mol/L硫酸溶解)对应的荧光值。荧光转化(δF)用Fr的比值表示,δF=Fr(393/463 nm)/Fr(327/415 nm)。δFaq为水相的荧光转化,δFor为有机相中荧光转化。
1.4 数据统计分析
所有试验重复3次,结果以平均值±标准差表示;采用SPSS 21.0软件对数据进行统计处理,用单因素方差分析Duncan法检测各处理平均数间的差异显著性(P<0.05)。
2 结果与分析
2.1 超声波解冻对猪肝解冻时间和解冻损失的影响
不同超声波功率下猪肝的解冻时间和解冻损失见图1。对照组所需解冻时间最长,为(430.83±4.86) min;超声波组解冻时间为11.05~18.63 min。随着超声波功率的增加,解冻时间显著缩短(P<0.05)。这可能是由于超声功率达到一定水平时,由于空穴效应使冷冻猪肝的结构出现了微小的孔洞,加速了解冻速率[18]。此外,由于超声波诱导的空穴效应,解冻液体也可以产生微流,这有助于热传递和冰晶的溶解[19]。本研究结果与张昕[7]采用超声波解冻鸡肉的结果一致。
除P-120 W处理组外,其余超声波解冻组猪肝的解冻损失均显著高于对照组(P<0.05),且随超声波功率增加,猪肝解冻损失显著增加(P<0.05)。解冻时间、冰晶位置、水的再吸收、肌肉蛋白质的状态及保水能力等是造成超声波解冻食品过程中失水的主要因素[20]。解冻损失影响肉制品的重量、感官特性和保水能力[21]。XIA等[21]研究了5种解冻方式对冷冻猪肉品质的影响,发现冷藏解冻在所有处理中具有最低的解冻损失。本研究中,超声波解冻相较于冷藏解冻耗时明显缩短,但解冻损失显著升高,这可能是超声波具有机械作用,其机械波通过解冻液体传播振荡,猪肝组织中的冰晶由于受到机械振荡而快速融化,且功率越大,机械振荡越剧烈,因此解冻损失比冷藏解冻高[7]。
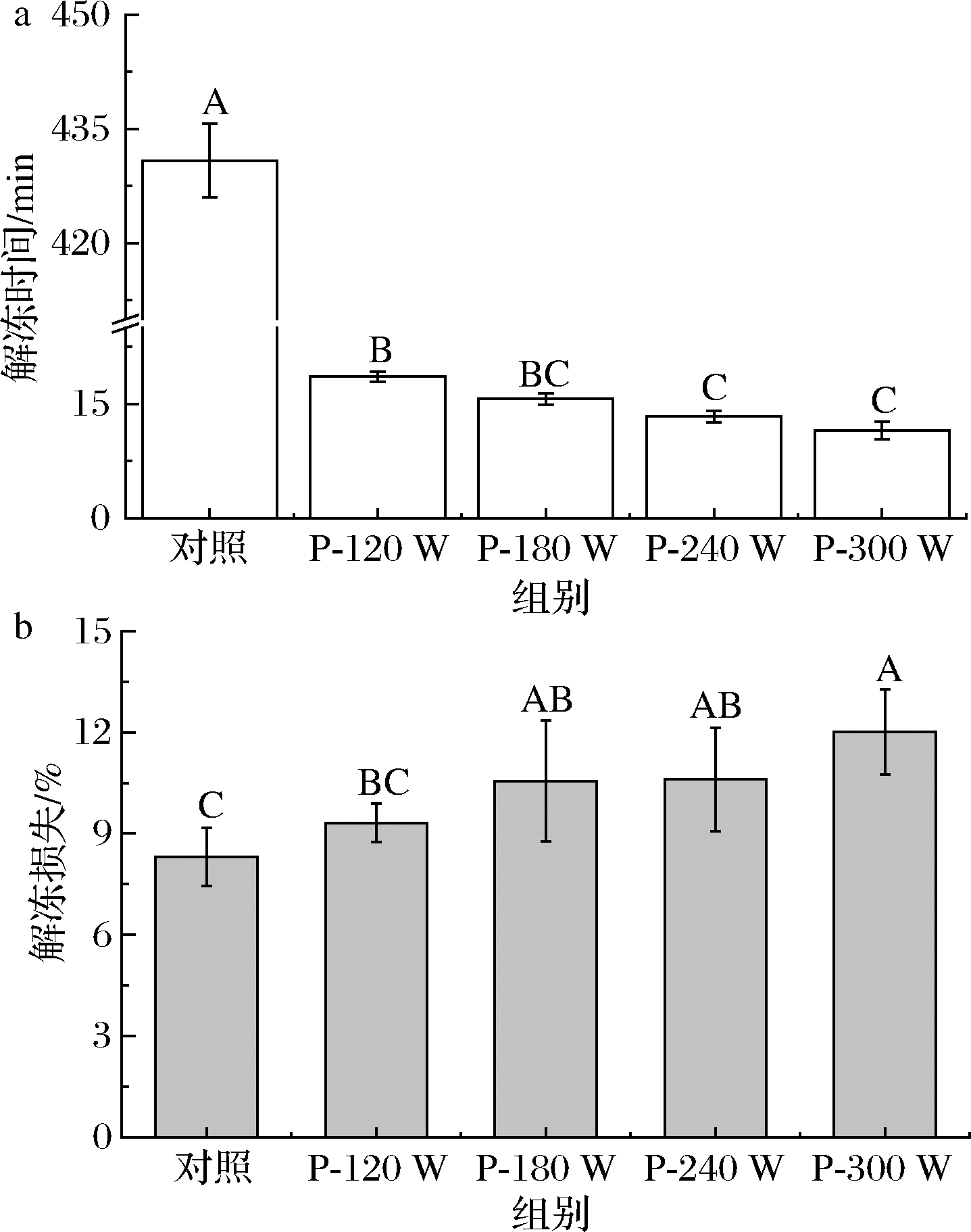
a-解冻时间;b-解冻损失
图1 不同超声波处理猪肝的解冻时间和解冻损失
Fig.1 The thawing time and thawing loss of porcine liver with different ultrasonic treatments 注:不同大写字母表示不同解冻处理之间差异显著(P<0.05)(下同)
2.2 超声波解冻对猪肝新鲜度的影响
pH值是肉类品质的客观指标,它会影响肉品的色泽、汁液流失及嫩度等[22]。由表1可知,猪肝的pH在冷藏0~72 h下降(P<0.05)。pH值的下降源于糖酵解后有机酸的积累,如乳酸、琥珀酸等[23]。此外,ATP相关化合物的分解也会导致pH值降低。解冻结束至72 h短期冷藏过程,P-240 W和P-300 W解冻组pH值显著低于对照组(P<0.05),其余超声波解冻组的pH值与对照组均无明显区别(P>0.05)。这可能是由于超声波解冻猪肝的解冻损失较高造成的。肌肉中矿物质和小分子蛋白会随着汁液一起流失,从而破坏肌肉细胞的离子平衡, 进而引起pH值变化[7,22]。TVB-N是表征肉品新鲜度的另外一个指标, GB 2707—2016中规定鲜(冻)畜、禽产品中TVB-N≤15 mg/100g。由表1可知,冷藏结束(72 h)时,不同解冻处理的猪肝TVB-N为8.51~9.81 mg/100g, 新鲜度均保持在安全范围;解冻结束(0 h)时, P-180 W、P-240 W和P-300 W 处理组猪肝的TVB-N显著低于对照(P<0.05),而P-120 W组TVB-N与对照无明显差异(P>0.05);冷藏24~72 h期间,P-240 W和P-300 W组的TVB-N显著低于对照(P<0.05),P-120 W、P-180 W与对照组无差异(P>0.05);在整个冷藏过程,对照样品的TVB-N最高,而P-240 W和P-300 W组猪肝的TVB-N最低。这种组间变化趋势与pH值变化相一致,可能与解冻及冷藏过程中含氮物质的降解有关[24]。谷小慧[23]认为,超声波处理肉的TVB-N相对较低,是由于超声波对酶的钝化作用及对微生物的杀灭作用,从而使含氮物质的分解减慢。
表1 不同超声波解冻猪肝在冷藏期间的pH和TVB-N值
Table 1 The pH and TVB-N values of porcine liver with different ultrasonic treatments during refrigerated storage

指标冷藏时间对照P-120 WP-180 WP-240 WP-300 WpH0 h6.17±0.05aA6.16±0.05aA6.14±0.03aA6.09±0.02aB6.07±0.02aB24 h6.15±0.06aA6.15±0.03aA6.12±0.04abAB6.08±0.04aB6.07±0.05aB48 h6.08±0.05bA6.05±0.08bA6.07±0.04bA5.99±0.06bC6.02±0.05bAB72 h5.95±0.09cA5.88±0.04cAB5.89±0.08cA5.82±0.07cBC5.80±0.07cCTVB-N/[mg·(100g)-1]0 h6.13±0.33dA 5.56±0.51dAB 5.05±0.26dBC 4.69±0.45cCD 4.33±0.22cD24 h7.43±0.28cA7.22±0.11cAB6.81±0.50cBC6.51±0.24bC6.86±0.25bABC48 h8.80±0.45bA8.49±0.53bA7.97±0.76bAB7.00±0.44bB7.34±0.38bB72 h9.81±0.44aA9.31±0.38aAB9.20±0.54aAB8.51±0.25aB8.88±0.43aB
注:同行肩标不同大写字母表示不同解冻处理之间差异显著(P<0.05);同列肩标不同小写字母表示不同冷藏时间之间差异显著(P<0.05)(下同)
2.3 超声波解冻对猪肝LOX活力的影响
LOX是一种内源性酶,可以被过氧化物激活,在脂质的酶促氧化过程中起重要作用。LOX除了催化脂肪酸氧化形成不稳定的氢过氧化物外,还能引起过氧氢基团旁C—C键的裂解形成醛和烷烃,这两类化合物参与了食品中气味物质的形成[25]。LOX活力通常会随肌肉所处部位以及pH而发生变化[26]。由图2看出,猪肝LOX活力在0~24 h增加,但在48 h时有轻微的下降;在之后的冷藏时间(48~72 h),LOX活力显著增加。周心雅等[27]研究表明,兔肉不同部位的LOX活力在冷藏期表现为先增大后减小的趋势。尤海琳[28]研究表明,海胆性腺LOX活力在0~12 h冷藏期间下降,但在12~24 h 期间上升。HUI等[29]发现,干香肠在30 d贮藏期间的LOX持续上升。LOX活力的这种差异可能与肉品种类、肉品加工方式,以及肉品加工过程中肌肉的pH变化有关。冷藏期间,超声波解冻组LOX活力显著低于对照(P<0.05),这表明超声波处理延缓了猪肝的脂质氧化,可能与超声波钝化酶的活性有关。在不同超声波解冻组中,P-120 W处理组具有最高的LOX活力(P<0.05);而P-180 W处理组LOX活力高于P-240 W和P-300 W,但3组间LOX活力在0~72 h无显著差异(P>0.05)。王帮国等[30]的研究表明,随着超声波功率增加,白鲢鱼LOX活力逐渐下降;当功率大于210 W时,酶活力下降较为显著,这与本研究结果部分类似。王帮国等[30]认为,LOX活力下降主要源于超声波改变了酶的二级和三级结构。
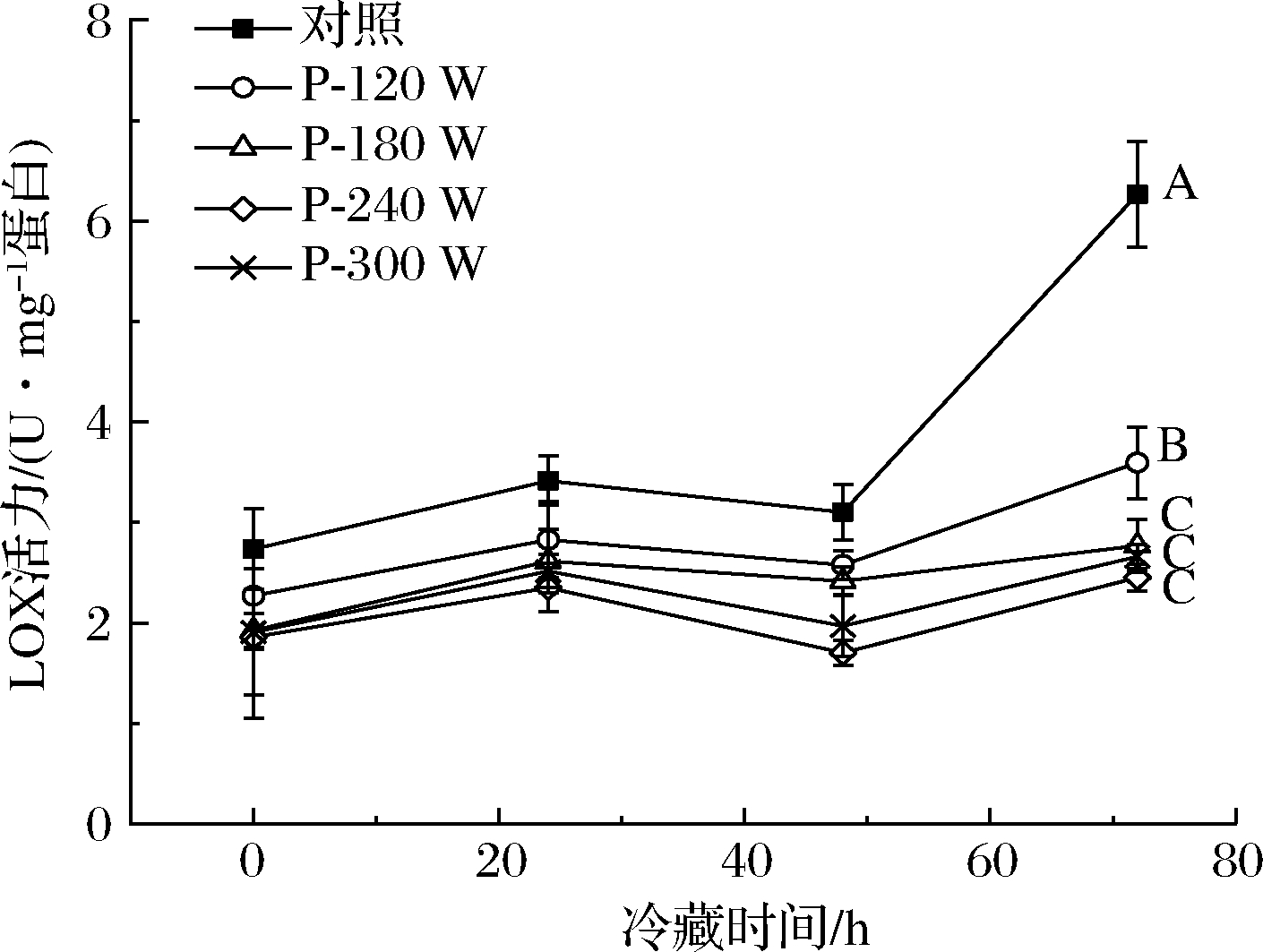
图2 不同超声波解冻猪肝在冷藏期间的LOX酶活力
Fig.2 LOX activity of porcine liver with different ultrasonic treatments during refrigerated storage
2.4 超声波解冻对猪肝CD值的影响
普遍认为,多不饱和脂肪酸极易受自由基攻击,从而导致双键与共轭二烯的排列。共轭二烯极不稳定,会进一步分解形成次级氧化产物。因此,共轭二烯值作为脂质氧化过程的中间体,反映了氢过氧化物生成和进一步分解的变化[31]。猪肝初级氧化产物CD值如表2所示,冷藏0~48 h,对照、P-120 W及P-180 W处理组猪肝的CD值显著增加(P<0.05), 而P-240 W和P-300 W处理组猪肝的CD值无明显改变(P>0.05);冷藏末期(48~72 h), 所有处理组猪肝的CD值均下降(P<0.05)。本研究结果与KIM等[32]的报道一致,即用黄花叶粉处理生鲜猪肉的CD值在冷藏前期显著增加,随后下降。CD值的降低与共轭氢过氧化物降解导致次级脂质氧化产物的形成有关[33]。冷藏期间, P-120 W处理组和对照组的CD值无显著区别(P>0.05),而P-240 W和P-300 W处理组CD值显著低于其他处理组(P<0.05)。这表明,与对照及低功率超声波(120 W)相比,中高功率超声波(180~300 W)解冻有利于延缓猪肝脂质氧化的初始氧化过程。
表2 不同超声波解冻猪肝在冷藏期间的CD值
Table 2 CD value of porcine liver with different ultrasonic treatments during refrigerated storage
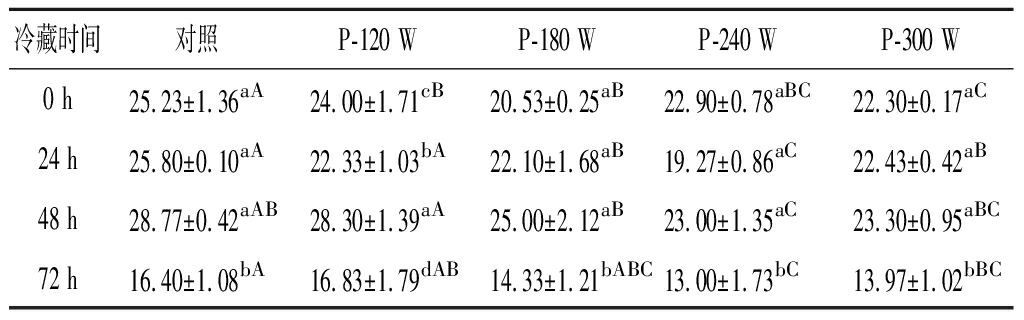
冷藏时间对照P-120 WP-180 WP-240 WP-300 W0 h25.23±1.36aA24.00±1.71cB20.53±0.25aB22.90±0.78aBC22.30±0.17aC24 h25.80±0.10aA22.33±1.03bA22.10±1.68aB19.27±0.86aC22.43±0.42aB48 h28.77±0.42aAB28.30±1.39aA25.00±2.12aB23.00±1.35aC23.30±0.95aBC72 h16.40±1.08bA16.83±1.79dAB14.33±1.21bABC13.00±1.73bC13.97±1.02bBC
2.5 超声波对猪肝TBARS的影响
不同处理方式下猪肝TBARS值见表3。随冷藏时间延长,猪肝TBARS值呈上升的趋势。0~72 h短期冷藏过程中,P-120 W处理组与对照间无显著差异(P>0.05),但其余超声波处理组的TBARS值均低于对照(P<0.05)。这可能是由于中高功率超声波的机械作用使解冻液体分子间发生了剧烈碰撞,加速了猪肝冰晶的融解,迅速通过了-5~0 ℃这一生化反应最剧烈的阶段[34]。朱明明等[35]研究了不同解冻方式下猪肉的脂质氧化程度,结果表明,100 W超声波解冻猪肉后的TBARS值[(0.19±0.03) mg/kg]略高于冷藏解冻[(0.15±0.01) mg/kg],但无显著差异,这与本研究结果类似。在不同超声波处理条件下,P-120 W处理组的TBARS值最高,其次为P-180 W和P-300 W,而P-240 W处理组最低,这与LOX活力有关(图2)。张昕[7]研究发现,随超声波功率增加,鸡胸肉中丙二醛含量升高,脂质氧化加剧。这与本研究不一致,造成这种差异的原因可能是原料品种及原料中脂肪的含量及存在形式的不同。
表3 不同超声波解冻猪肝在冷藏期间的TBARS值
Table 3 The TBARS value of porcine liver with different ultrasonic treatments during refrigerated storage

冷藏时间对照P-120 WP-180 WP-240 WP-300 W0 h2.49±0.09cA2.39±0.06cAB2.35±0.09cB2.35±0.00cB2.29±0.03dB24 h3.35±0.11bA3.25±0.07bAB3.18±0.05bB2.86±0.05bC2.78±0.11cC48 h3.68±0.10aA3.53±0.12aAB3.43±0.09aB3.26±0.07aC3.39±0.06bBC72 h3.80±0.12aA3.77±0.22aA3.52±0.13aBC3.32±0.05aC3.58±0.07aAB
2.6 超声波解冻对猪肝荧光化合物的影响
脂质过氧化产生的羰基化合物,如丙二醛,可与蛋白质、氨基酸反应生成具有![]() 结构并发荧光的席夫碱[36]。因此,荧光的相对强度可间接反映脂质过氧化水平。表4显示了不同超声波功率解冻后样品在有机相(δFor)和水相(δFaq)中的荧光位移。荧光在有机相中的位移显示,解冻后猪肝的δFor在冷藏期间呈先增加后减小的趋势,δFor在冷藏第48 h达到最大值(P <0.05)。AUBOURG等[17]报道,随贮藏时间延长,沙丁鱼脂质氧化加剧,δFor也增加;但随脂质的进一步氧化,δFor又会下降。IIO等[37]认为,δFor下降的原因是脂质氧化形成的荧光物质仍然附着在氨基成分上,导致这些化合物不溶于有机溶剂。解冻结束(0 h)时,不同处理间的δFor差异不显著(P>0.05),但在随后的冷藏时间内,对照组的δFor高于超声波处理组。荧光在水相中的位移显示,随冷藏时间延长,所有样品的δFaq均上升。冷藏48 h,不同解冻组间δFaq有差异(P <0.05),但在其余冷藏时间,各组间的δFaq没有明显区别(P>0.05)。由表4看出,在冷藏的前期(0~48 h),负责δF值的荧光化合物多为脂溶性化合物;然而,随着脂质损伤的增加,这些化合物在水相中的溶解性逐渐增强。AUBOURG等[17]也发现了与本研究类似的结果。总体来讲,超声波处理组中,P-120 W处理组δFor和δFaq在整个冷藏期间相对较高(P<0.05),而P-240 W处理组最低(P<0.05)。
结构并发荧光的席夫碱[36]。因此,荧光的相对强度可间接反映脂质过氧化水平。表4显示了不同超声波功率解冻后样品在有机相(δFor)和水相(δFaq)中的荧光位移。荧光在有机相中的位移显示,解冻后猪肝的δFor在冷藏期间呈先增加后减小的趋势,δFor在冷藏第48 h达到最大值(P <0.05)。AUBOURG等[17]报道,随贮藏时间延长,沙丁鱼脂质氧化加剧,δFor也增加;但随脂质的进一步氧化,δFor又会下降。IIO等[37]认为,δFor下降的原因是脂质氧化形成的荧光物质仍然附着在氨基成分上,导致这些化合物不溶于有机溶剂。解冻结束(0 h)时,不同处理间的δFor差异不显著(P>0.05),但在随后的冷藏时间内,对照组的δFor高于超声波处理组。荧光在水相中的位移显示,随冷藏时间延长,所有样品的δFaq均上升。冷藏48 h,不同解冻组间δFaq有差异(P <0.05),但在其余冷藏时间,各组间的δFaq没有明显区别(P>0.05)。由表4看出,在冷藏的前期(0~48 h),负责δF值的荧光化合物多为脂溶性化合物;然而,随着脂质损伤的增加,这些化合物在水相中的溶解性逐渐增强。AUBOURG等[17]也发现了与本研究类似的结果。总体来讲,超声波处理组中,P-120 W处理组δFor和δFaq在整个冷藏期间相对较高(P<0.05),而P-240 W处理组最低(P<0.05)。
表4 不同超声波解冻猪肝在冷藏期间的荧光化合物含量
Table 4 Fluorescent compounds contents of porcine liver with different ultrasonic treatmentsduring refrigerated storage
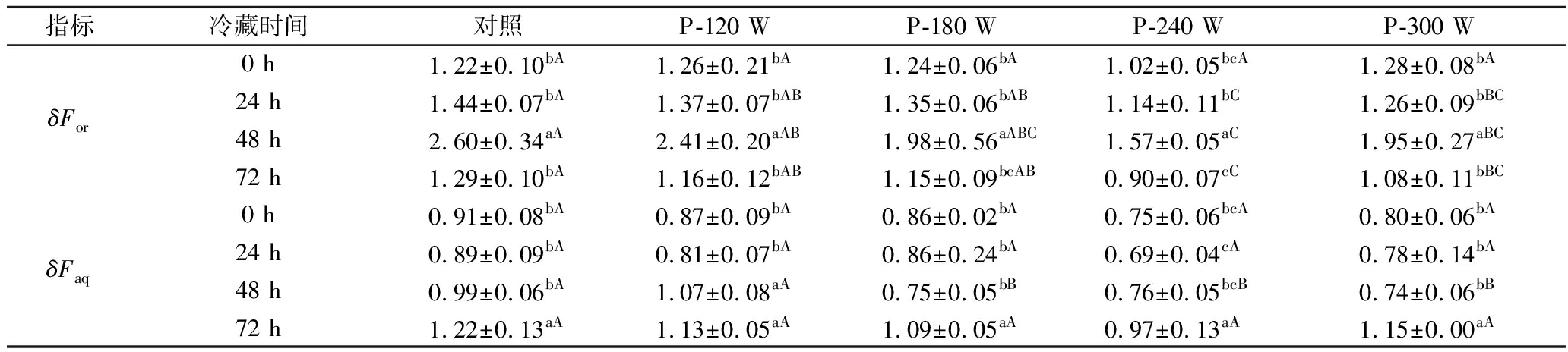
指标冷藏时间对照P-120 WP-180 WP-240 WP-300 WδFor0 h1.22±0.10bA1.26±0.21bA1.24±0.06bA1.02±0.05bcA1.28±0.08bA24 h1.44±0.07bA1.37±0.07bAB1.35±0.06bAB1.14±0.11bC1.26±0.09bBC48 h2.60±0.34aA2.41±0.20aAB1.98±0.56aABC1.57±0.05aC1.95±0.27aBC72 h1.29±0.10bA1.16±0.12bAB1.15±0.09bcAB0.90±0.07cC1.08±0.11bBCδFaq0 h 0.91±0.08bA0.87±0.09bA0.86±0.02bA0.75±0.06bcA0.80±0.06bA24 h0.89±0.09bA0.81±0.07bA0.86±0.24bA0.69±0.04cA0.78±0.14bA48 h0.99±0.06bA1.07±0.08aA0.75±0.05bB0.76±0.05bcB0.74±0.06bB72 h1.22±0.13aA1.13±0.05aA1.09±0.05aA0.97±0.13aA1.15±0.00aA
3 结论
与冷藏解冻相比,超声波解冻能大幅度缩短冷冻猪肝的解冻时间,提高解冻效率,但会造成猪肝解冻损失的增加,且超声波功率越大,解冻损失越大。此外,超声波解冻可以使猪肝在短期冷藏期间有较好的新鲜度。在0~72 h冷藏期间,P-120 W组猪肝CD值与冷藏解冻组无显著差异,但LOX活力显著低于冷藏解冻组(P<0.05);P-180 W、P-240 W和P-300 W处理组猪肝的LOX活力、CD值、TBARS值及荧光化合物含量(δFor和δFaq)均低于冷藏解冻组,其中P-240 W处理组猪肝具有最低的CD值、TBARS值及荧光化合物含量。综上,超声波解冻不但能提高解冻效率,还能提高猪肝脂质的氧化稳定性,使猪肝在短期冷藏期间维持较好的品质,特别是240 W解冻条件下的猪肝有较好的新鲜度及脂质氧化稳定性。
[1] LEYGONIE C, BRITZ T J, HOFFMAN L C.Impact of freezing and thawing on the quality of meat:Review[J].Meat Science, 2012, 91(2):93-98.
[2] MIN B, AHN D U.Mechanism of lipid peroxidation in meat and meat products — A review[J].Food Science and Biotechnology, 2005,14(1):152-163.
[3] DOMíNGUEZ R, PATEIRO M, GAGAOUA M, et al.A comprehensive review on lipid oxidation in meat and meat products[J].Antioxidants, 2019,8(10):429.
[4] MOUSAKHANI-GANJEH A, HAMDAMI N, SOLTANIZADEH N.Thawing of frozen tuna fish (Thunnus albacares) using still air method combined with a high voltage electrostatic field[J].Journal of Food Engineering, 2016,169:149-154.
[5] SHI Z J, ZHONG S Y, YAN W J, et al.The effects of ultrasonic treatment on the freezing rate, physicochemical quality, and microstructure of the back muscle of grass carp (Ctenopharyngodon idella) [J].LWT, 2019, 111:301-308.
[6] LI X X, MA Y Y, SUN P, et al.Effect of ultrasonic thawing on protein properties and muscle quality of Bonito[J].Journal of Food Processing and Preservation, 2021, 45(1):e14930.
[7] 张昕. 不同解冻工艺对鸡胸肉品质的影响[D].南京:南京农业大学, 2017.
ZHANG X.Effects of different thawing methods on the quality of chicken breast[D].Nanjing:Nanjing Agricultural University, 2017.
[8] 马超锋, 关志强, 李敏, 等.超声波解冻对壳聚糖涂膜罗非鱼片的水分分布及品质相关性研究[J].食品工业科技, 2017, 38(2):332-336;369.
MA C F, GUAN Z Q, LI M, et al.The relationship between water distribution and quality of tilapia fillets with chitosan film as affected by different ultrasonic wave [J].Science and Technology of Food Industry, 2017, 38(2):332-336;369.
[9] MILES C A, MORLEY M J, RENDELL M.High power ultrasonic thawing of frozen foods[J].Journal of Food Engineering, 1999, 39(2):151-159.
[10] 刘安军,史建超,刘有志,等.不同动物肝脏中脂肪酸成分分析[J].食品研究与开发, 2007, 28(7):121-124.
LIU A J, SHI J C, LIU Y Z, et al.The analysis of fatty acid composition in the different animals′ livers[J].Food Research and Development, 2007, 28(7):121-124.
[11] 李锦锦,莫然,唐善虎,等.不同解冻方式对猪肝理化特性及氧化稳定性的影响[J].食品工业科技, 2021, 42(14):301-308.
LI J J, MO R, TANG S H, et al.Effects of different thawing methods on physicochemical properties and oxidation stability of porcine liver[J].Science and Technology of Food Industry, 2021, 42(14):301-308.
[12] SENAPATI M, SAHU P P.Meat quality assessment using Au patch electrode Ag-SnO2/SiO2/Si MIS capacitive gas sensor at room temperature[J].Food Chemistry, 2020, 324:126893.
[13] HE Y X, ZHOU M Y, XIA C L, et al.Volatile flavor changes responding to heat stress-induced lipid oxidation in duck meat[J].Animal Science Journal, 2020, 91(1):e13461.
[14] GORNALL A G, BARDAWILL C J, DAVID M M.Determination of serum proteins by means of the biuret reaction[J].Journal of Biological Chemistry, 1949, 177(2):751-766.
[15] GEORGANTELIS D, BLEKAS G, KATIKOU P, et al.Effect of rosemary extract, chitosan and α-tocopherol on lipid oxidation and colour stability during frozen storage of beef Burgers[J].Meat Science, 2007, 75(2):256-264.
[16] 阮一凡,潘道东,孙杨赢,等.混菌发酵鸭腿工艺优化及其贮藏品质特性[J].食品科学, 2020, 41(10):101-109.
RUAN Y F, PAN D D, SUN Y Y, et al.Optimization of production of fermented duck thigh with a mixed starter culture of Lactobacillus plantarum and saccharomyces cerevisiae and changes in its quality characteristics during storage[J].Food Science, 2020, 41(10):101-109.
[17] AUBOURG S P, SOTELO C G, PÉREZ-MART N R.Assessment of quality changes in frozen sardine (Sardina pilchardus) by fluorescence detection[J].Journal of American Oil Chemists Society, 1998, 75(5):575-580.
N R.Assessment of quality changes in frozen sardine (Sardina pilchardus) by fluorescence detection[J].Journal of American Oil Chemists Society, 1998, 75(5):575-580.
[18] LI X X, SUN P, MA Y Y, et al.Effect of ultrasonic thawing on the water holding capacity, physicochemical properties, and structure of frozen tuna fish (Thunnus tonggol) myofibrillar proteins[J].Journal of the Science of Food and Agriculture, 2019, 99 (11):5 081-5 093.
[19] CHENG L N, SUN D W, ZHU Z W, et al.Emerging techniques for assisting and accelerating food freezing processes:A review of recent research progresses[J].Critical Reviews in Food Science and Nutrition, 2017, 57(4):769-781.
[20] GUO Z L, GE X Z, YANG L H, et al.Ultrasound-assisted thawing of frozen white yak meat:Effects on thawing rate, meat quality, nutrients, and microstructure[J].Ultrasonics Sonochemistry, 2021, 70:105 345.
[21] XIA X F, KONG B H, LIU J, et al.Influence of different thawing methods on physicochemical changes and protein oxidation of porcine longissimus muscle[J].LWT-Food Science and Technology, 2012, 46(1):280-286.
[22] SWATLAND H J.How pH causes paleness or darkness in chicken breast meat[J].Meat Science, 2008, 80(2):396-400.
[23] 谷小慧. 超声波对冷冻肉品质影响的研究[D].大连:大连工业大学, 2013.
GU X H.Study of the effect of ultrasonic wave on frozen meat quality[D].Dalian:Dalian Polytechnic University, 2013.
[24] YANG X Q, WANG H, BADONI M.Effects of meat pH and the initial numbers of spores of Clostridium estertheticum on the development of blown pack spoilage of vacuum packaged beef[J].International Journal of Food Science and Technology, 2014, 49 (7):1 619-1 625.
[25] JIN G F, ZHANG J H, YU X, et al.Crude lipoxygenase from pig muscle:Partial characterization and interactions of temperature, NaCl and pH on its activity[J].Meat Science, 2011, 87(3):257-263.
[26] 靳国锋. 干腌培根加工过程中脂质氧化调控机制研究[D].南京:南京农业大学, 2011.
JIN G F.Study on the regulation mechanism of lipid oxidation during the processing of dry-cured bacon[D].Nanjing:Nanjing Agricultural University, 2011.
[27] 周心雅,贺稚非,王兆明,等.冷藏对兔肉不同部位新鲜度及腥味物质己醛和己酸变化的影响[J].食品与发酵工业, 2019, 45(6):122-126.
ZHOU X Y, HE Z F, WANG Z M, et al.Effects of chilled storage on changes in freshness and off-odor compounds in different parts of rabbit meat[J].Food and Fermentation Industries, 2019, 45(6):122-126.
[28] 尤海琳. 冷藏过程中海胆性腺磷脂降解变化研究[D].大连:大连海洋大学, 2019.
YOU H L.The degradation of phospholipids in sea urchin during cold storage[D].Dalian:Dalian Ocean University, 2019.
[29] HUI T, ZHANG Y W, JAMALI M A, et al.Incorporation of pig back fat in restructured dry cured ham to, enhance the lipase and lipoxygenase activities[J].European Journal of Lipid Science and Technology, 2017, 119(2):1500581.
[30] 王帮国,余振宇,林琳,等.超声波、超高压对白鲢鱼肌肉脂肪氧合酶构象及酶活力的影响[J].食品科学, 2018, 39(3):169-175.
WANG B G, YU Z Y, LIN L, et al.Effect of ultrasonic wave and ultra high pressure treatment on conformation and enzyme activity of lipoxygenase in silver carp muscle[J].Food Science, 2018, 39(3):169-175.
[31] 张凯歌. 煮制条件对卤鸡腿脂质氧化的影响研究[D].郑州:河南农业大学, 2018.
ZHANG K G.Study on the effect of cooking conditions on lipid oxidation of braised chicken legs[D].Zhengzhou:Henan Agricultural University, 2018.
[32] KIM Y J, KIM H Y, CHOE J H, et al.Antioxidant activity of goldenrod (Solidago virgaurea) leaf and stem powder on raw ground pork during chilled storage[J].Korean Journal for Food Science of Animal Resources, 2013, 33(1):1-8.
[33] W JCIAK K M, DOLATOWSKI Z J.Shelf life of organic roast pork enriched with acid whey-plant extracts combination[J].Journal of Food Quality, 2016, 39(3):171-180.
JCIAK K M, DOLATOWSKI Z J.Shelf life of organic roast pork enriched with acid whey-plant extracts combination[J].Journal of Food Quality, 2016, 39(3):171-180.
[34] 王雪松, 谢晶.不同解冻方式对冷冻竹荚鱼品质的影响[J].食品科学,2020,41(23):137-143.
WANG X S, XIE J.Effects of different thawing methods on the quality of frozen horse mackerel[J].Food Science, 2020, 41(23):137-143.
[35] 朱明明,王亚秋,刘新建,等.快速与慢速解冻对冷冻猪肉品质特性及蛋白变性的影响[J].食品工业科技, 2018,39(23):23-30;36.
ZHU M M, WANG Y Q, LIU X J, et al.Effects of rapid and slow thawing methods on quality characteristics and protein denaturation of frozen pork[J].Science and Technology of Food Industry, 2018, 39(23):23-30;36.
[36] 纪俊敏,谢文磊.生物体系中脂质过氧化及抗氧化剂抗氧化活性的检测与评价[J].中国油脂, 2004, 29(7):33-37.
JI J M, XIE W L.Determination and evaluation of lipid peroxidation and antioxidative activity of antioxidant in biological system[J].China Oils and Fats, 2004, 29(7):33-37.
[37] IIO T, YODEN K.Fluorescence formation from hydroperoxide of phosphatidylcholine with amino compound [J].Lipids, 1988,23(1):65-67.