随着人们对可持续型和环境友好型产品的广泛关注,利用天然生物大分子构建活性成分的递送体系愈发受到重视。其中,蛋白质/多糖复合载体因其高生物相容性、可生物降解性及无毒性,逐渐成为用于构建胶体粒子的最常见食品级生物聚合物[1]。例如,利用反溶剂法制备具有核壳结构的玉米醇溶蛋白/阿拉伯胶运载体系,可以实现对生育酚的高效负载且具备良好的酸碱稳定性[2];大豆分离蛋白与大豆多糖可通过自组装制备单分散纳米颗粒并与姜黄素结合形成微胶囊结构[3];乳清蛋白、酪蛋白可以同带有相反电荷的多糖以静电力相结合,而后通过疏水作用和静态猝灭与花色苷发生相互作用,增强花色苷的稳定性[4]。但目前关于蛋白/多糖相互作用的研究主要聚焦在单一的蛋白和多糖,而对以蛋清蛋白为代表的复杂蛋白体系与多糖相互作用的研究较少。壳聚糖(chitosan, CS)是自然界中为数不多的碱性食品级阴离子多糖,具有良好的抗氧化性、成膜性和抑菌性[5]。诸多研究结果表明,蛋白质与多糖间的相互作用力主要是静电力,此种作用力高度依赖生物高分子的自身特性,如总浓度,混合比例,侧链基团种类,同时还受环境条件如pH和温度的影响[6]。此外,热处理可加速多糖/蛋白体系相变的发生,适当加热可制备微凝胶[7],此种微凝胶与蛋白质/多糖复合物在理化性质上是否存在差异尚缺少充分的实验证据。
本研究以蛋清蛋白(egg white protein, EW)与CS为原料,利用简单的静电相互作用制备EW/CS复合物,并将其加热得到EW/CS微凝胶。从浊度、粒径、Zeta电位、紫外光谱及流变学角度分析微凝胶与复合物性质上的差异,并进一步探究两者用于花青素(anthocyanin, AN)的稳态维持与递送的可行性[8],以期为构建特定的胶体递送体系提供依据。
1 材料与方法
1.1 实验材料
蛋清蛋白粉末,使用新鲜蛋清进行冷冻干燥制备,由95%的蛋白质组成,脂肪含量以干重计小于1%;壳聚糖(脱乙酰度为75%),北京索莱宝科技有限公司;蓝莓花青素提取物,密苏里州圣路易斯公司(中国)。
1.2 仪器与设备
UV-1900 紫外分光光度计,上海佑科仪器仪表有限公司;DHR1型流变仪,美国TA公司;ZS90型激光粒度仪,英国马尔文仪器有限公司。
1.3 实验方法
1.3.1 EW/CS复合物与微凝胶的制备
称取壳聚糖粉和蛋清粉,于室温下分别溶解于0.8%(体积分数)醋酸溶液和0.1%(质量分数)NaOH溶液,磁力搅拌使之完全溶解以制备成2 mg/mL溶液。将EW溶液按照不同比例缓慢滴入CS溶液中,同时以纯蛋清和CS为对照。通过加入0.1 mol/L的醋酸或0.1 mol/L的NaOH调节体系至不同pH值,室温下搅拌30 min以制得复合物。将制备的复合物于60 ℃加热30 min得到微凝胶。
1.3.2 聚合物质量比对EW/CS体系性质的影响
在pH为6.0,EW质量浓度为1.0 mg/mL的条件下,分别按照EW与CS质量比=10∶2、10∶4、10∶6、10∶8和10∶10制备EW/CS复合物和微凝胶,进行浊度、粒径、Zeta电位、紫外吸收光谱及流变学性质的测定。
1.3.3 pH值对EW/CS体系性质的影响
设置EW质量浓度为1.0 mg/mL,EW与CS质量比=10∶8,通过添加0.1 mol/L HCl或NaOH溶液调整复合体系pH值=2、3、4、5、6、7,制备EW/CS复合物和微凝胶,进行粒径、Zeta电位、紫外吸收光谱及流变学性质的测定。
1.3.4 AN提取物含量对EW/CS体系性质的影响
设置EW质量浓度为1.0 mg/mL,EW与CS质量比=10∶8,pH 6.0,添加1%、3%、5%、7%、9%和12%(质量分数)的蓝莓AN提取物,制备EW/CS/AN复合物和微凝胶,进行理化性质的测定。
1.3.5 浊度、粒径和Zeta电位分析
使用UV-分光光度计,以蒸馏水为空白对照,于600 nm,25 ℃条件下测量样品浊度。使用激光粒度仪,以相同浓度的CS溶液和EW溶液作为对照,在25 ℃测量样品的粒径和Zeta电位。
1.3.6 紫外吸收光谱扫描
使用分光光度计,测试温度25 ℃,扫描范围220~500 nm,测量不同样品的UV-Vis吸收光谱。同时以1.0 mg/mL的CS溶液和EW溶液作为对照。
1.3.7 流变学性质的测定
使用流变仪在室温(25 ℃)下测定不同样品的表观黏度和动态黏弹性质,测试夹具CP4/40,间距1.0 mm,锥角4°,平衡5 min,应力0.1 Pa,应力剪切范围1~100 s-1[9]。
1.3.8 AN负载量的测定
称取CS粉和花青素,于室温下溶解于0.8%醋酸溶液,磁力搅拌使之完全溶解以制备成CS 1.6 mg/mL、AN 0.5 mg/mL的溶液。与等量2 mg/mL EW溶液混合并调节体系pH=6,分别制备复合物与微凝胶。负载率的计算方法参照文献[10]并加以改动:分别精密吸取5 mL的微粒溶液至于Ultra-15超滤离心管中(截留分子质量10 000),于4 000 r/min转速离心30 min,游离AN分离至外部离心管,在530 nm处用紫外分光光度计测定其吸光值,通过制作的标准曲线确定未负载AN含量,按公式(1)计算负载率:
负载率![]()
(1)
1.4 数据分析
使用Origin 2017和Excel 2017分析所有数据。通过单向方差分析(ANOVA)对样本进行比较,并通过SPSS软件使用Duncan检验分析显着差异。所有数据重复测量3次并表示为平均值±标准偏差。
2 结果与分析
2.1 聚合物质量比的影响
2.1.1 浊度、Zeta电位和粒径
生物高分子间的相互作用可以用浊度进行简单表征。浊度主要由溶液中聚合物分子质量和大小的变化引起,因此浊度的变化被认为是蛋白质-多糖聚合物形成或解离的结果[11]。一般情况下,胶体乳液的浊度受溶液中颗粒的浓度、折射率以及粒径影响,而这些指标在溶液中形成复合物或微凝胶的过程中都会发生改变。因此,本研究结合浊度、粒径和Zeta电位的测量结果来表征EW与CS间发生的相互作用,结果如图1所示。
如图1-a,纯CS溶液(0∶10)在pH 6.0时不含有大的悬浮颗粒,吸光度接近于0。在EW浓度固定的条件下,随着混合体系中CS的浓度增大,复合物与微凝胶体系的浊度均下降,ZHANG等[6]研究中豌豆分离蛋白/壳聚糖复合物水溶液浊度随着CS浓度的升高而下降的趋势一致。由图1-b中也可以看出,CS的添加使复合物与微凝胶的粒径均降低,这可能是由于CS浓度的增加,体系中与单位蛋白结合的壳聚糖分子增加,改变了蛋白原有的伸展结构,使其折射率下降、光散射减少,从而引起浊度和粒径的降低[12]。
CS是一种碱性多糖,在广泛的pH的范围内都带有正电荷。蛋清中大部分蛋白质的等电点在4.5~6.0,在低pH条件下蛋清溶液带负电荷。EW/CS体系相比于EW(10∶0)溶液具有更高的正电荷,但相对于CS溶液(0∶10)电性较弱(图1-c),说明EW和CS在一定pH范围内发生了电荷中和,可以推测它们之间很有可能形成静电复合物[13]。

a-浊度;b-粒径;c-电位
图1 EW与CS质量比对复合物与微凝胶浊度、粒径和Zeta电位的影响(P<0.05)
Fig.1 Effect of mass ratio of EW to CS on turbidity, particle size and Zeta potential of complexes and microgels(P<0.05) 注:大写字母不同表示相同原料比例下两处理组样品结果差异显著;小写字母不同表示同处理组样品在不同原料比例下结果差异显著(下同)
2.1.2 紫外吸收光谱
为了进一步验证CS的结合对EW微观构象的影响,对不同比例的复合物与微凝胶进行了紫外吸收光谱扫描。构成蛋白质的酪氨酸和色氨酸残基具有紫外吸收性质,当蛋白质分子所处的微环境发生改变,会引起氨基酸残基构象变化,进而使基团的紫外吸收光谱发生变化[14]。当蛋白质与多糖相互作用后会引起吸收峰的位移和吸光度的改变,这些变化于280 nm附近对环境变化高度敏感[15],故可利用UV光谱曲线反映EW与CS的相互作用结果。如图2所示,CS溶液在280 nm处无紫外吸收,复合物与微凝胶在280 nm处的吸收峰强度高于相同浓度的EW溶液,说明CS与EW蛋白间发生了相互作用,这种相互作用导致EW结构骨架趋于松散,肽链的伸展使得蛋白质分子内部疏水区中芳香族氨基酸残基裸露。吸收峰强度的增强也表明此种构象的变化有利于蛋白质分子中色氨酸和酪氨酸残基芳香环的π-π*跃迁[14]。随着CS添加量的增加,复合物在280 nm处的吸收峰值下降,这可能是由于长碳链壳聚糖的空间屏蔽作用使蛋白质与多糖的结合更为紧密,减少了蛋白质中芳香族氨基酸的暴露[6]。微凝胶在280 nm处的吸收峰值均高于对应的复合物,这可能与热处理导致的蛋白质结构改变有关。
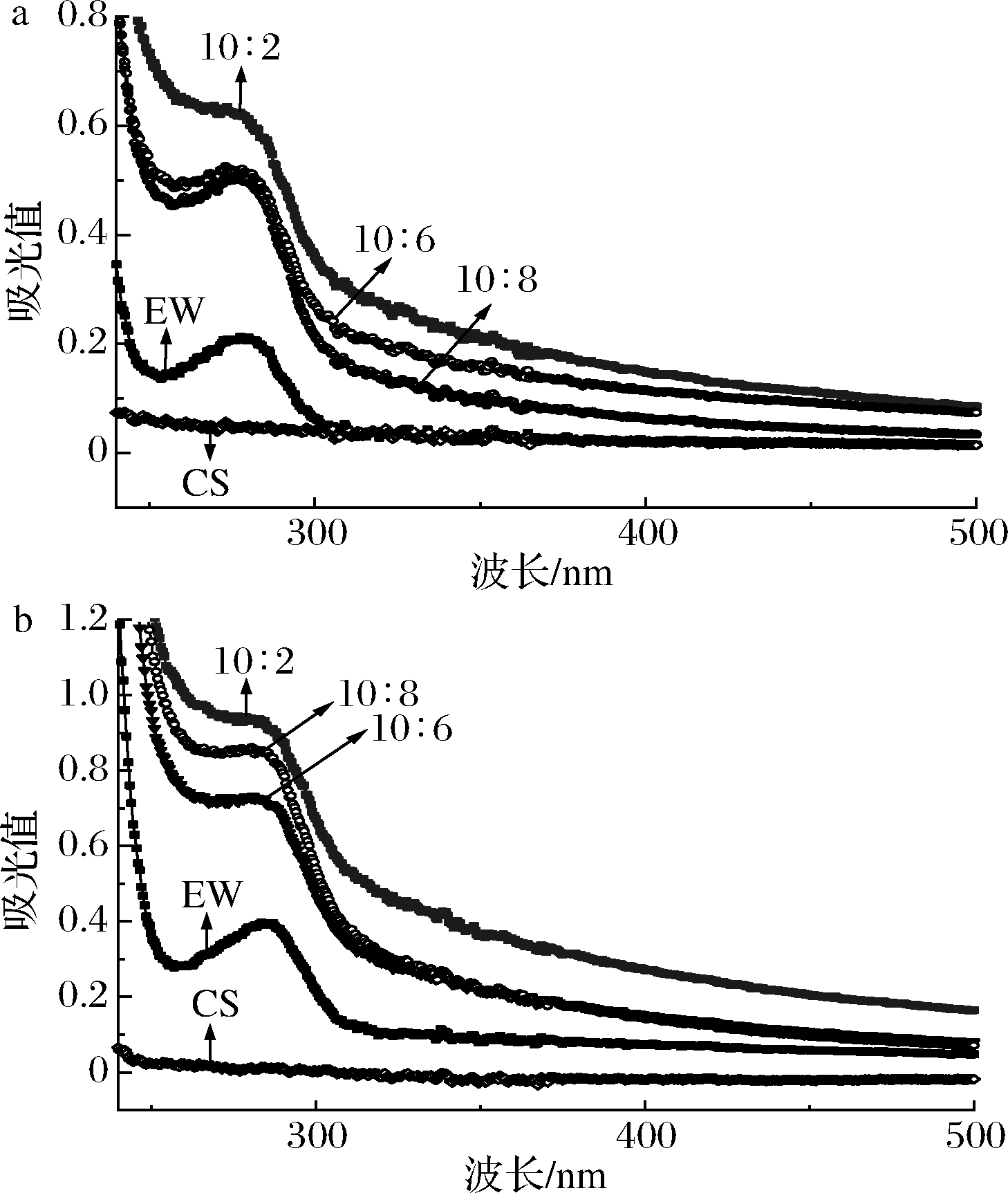
a-复合物;b-微凝胶
图2 EW与CS质量比对复合物与微凝胶紫外吸收的影响
Fig.2 Effect of mass ratio of EW to CS on UV absorption of complexes and microgels
2.1.3 流变学性质
黏弹性质是反映高分子内部结构与性质的重要指标。先前的研究结果表明,复合物黏度与对小分子药物的包埋率存在正相关性[16],因而分析复合物与微凝胶的黏度可在一定程度上反应其功能性质。EW/CS不同体系黏度变化如图3所示。复合物和微凝胶黏度均随剪切速率增加而降低,表明二者为假塑性流体[17],在剪切速率增加的过程中,分子按照剪切的方向呈现线性排列。在复合物中(图3-a),CS的添加明显提高了蛋清溶液的黏度,说明CS与EW发生相互的作用改变了体系的物理特性。在微凝胶体系中,纯EW溶液黏度的明显增加,可能是由于蛋白在变性温度附近长时间加热导致部分凝集造成的(图3-b)。低浓度CS的添加并没有显著影响蛋清蛋白的黏度,但当EW与CS的质量比达到1∶1后,微凝胶体系的黏度反而下降,这可能是由于蛋白可以通过物理相互作用与多糖结合,导致体系电荷被中和,分子链的运动和扩散更容易进行,体系更容易达到能量较低的稳定状态[18],这可以进一步通过动态扫描获得相应的黏弹性参数来进行验证。图3-c、图3-d显示了不同的EW/CS体系中储能模量(G′)随时间的变化情况。EW和CS发生相互作用时G′值会迅速增加,凝胶点是体系G′为1 Pa时的参数点,是多糖/蛋白体系相转变的重要参数[19]。由图3可以看出,CS的添加缩短了EW形成可溶性复合物及凝胶网格的时间,但是当复合物中EW∶CS超过10∶4后(微凝胶10∶6),CS的添加使得体系中未被中和的电荷量增加,体系能量较高难以达到稳定状态,EW/CS凝胶网格形成延缓。
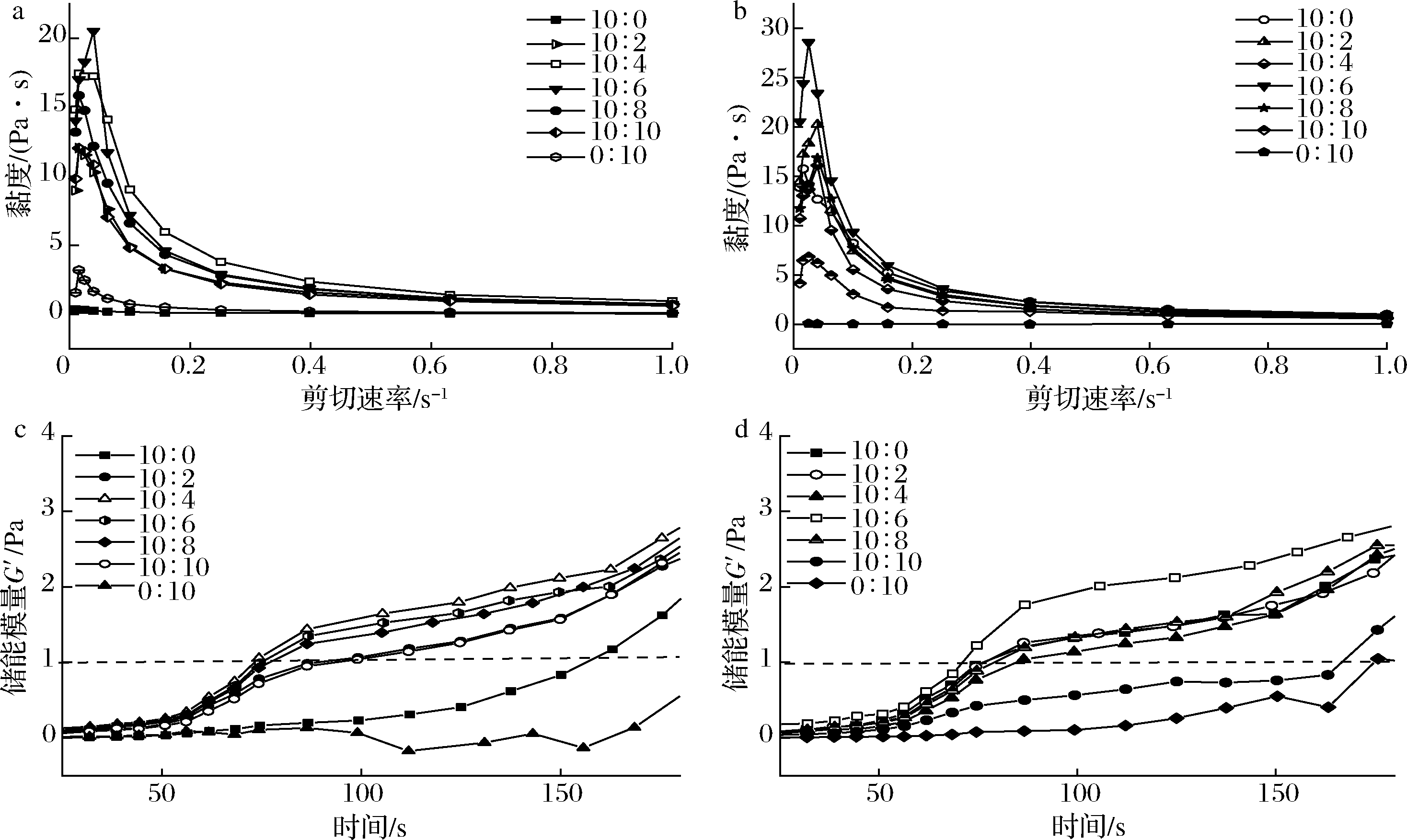
a-复合物黏度;b-微凝胶黏度;c-复合物储能模量;d-微凝胶储能模量
图3 EW/CS质量比对复合物与微凝胶流变学性质的影响
Fig.3 Effect of mass ratio of EW to CS on the rheological properties of complexes and microgels
2.2 环境pH的影响
2.2.1 粒径和Zeta电位
pH值会影响静电相互作用的大小与范围,进而对通过此种相互作用结合的蛋白/多糖性质造成改变[20]。如前所述,EW和CS在一定pH范围内会发生电荷中和,实验pH范围内(pH 2.0~6.0)就有此种中和反应发生,复合物与微凝胶2种体系在此范围内都较为稳定,但复合物体系比微凝胶体系的Zeta电位具有更高的pH稳定性(图4-a)。此外,在pH变化过程中微凝胶平均粒径均高于复合物(图4-b)。以上结果表明,对复合物进行热处理会引起其微观结构的改变和电位特性的变化,这些变化将会影响其稳定性。

a-电位;b-粒径
图4 环境pH对复合物与微凝胶Zeta电位和粒径的影响 (P<0.05)
Fig.4 Effect of environmental pH on the Zeta potential and particle size of complexes and microgels(P<0.05)
2.2.2 紫外吸收光谱
如图5-a,单一EW溶液于pH 5时紫外吸收峰达最大值,在此等电点附近的环境pH条件下,蛋白分子间发生凝集导致吸光度增加。CS的加入改变了其原有的电荷性质,使EW溶液于280 nm处的吸收峰降低。pH 4条件下EW溶液与EW/CS混合溶液吸光度峰值基本相同,说明较低的pH值更有利于复合物结构的稳定。如图5-b,微凝胶中紫外吸收光谱整体变化趋势与复合物近似,随着环境pH改变,EW/CS微凝胶峰值波动较大,表明微凝胶随环境pH变化结构改变更为明显,有望用于酸碱触发释放载体的构建。而复合物相对稳定,可适用于持续释放载体的构建。
2.2.3 流变学性质
EW与CS在酸性水溶液中均带电荷,具有聚电解质特性,因而环境pH对其溶液性质存在一定影响。如图6-a,EW/CS复合物黏度随pH增大而上升,并于pH 6时达到最大值,微凝胶中pH-黏度整体变化趋势与复合物基本一致,但黏度曲线随环境pH变化更显著,进一步表明EW/CS微凝胶对环境pH的改变更为敏感。
2.3 AN提取物含量
AN具有多种生理活性,但其自身性质结构不稳定[21]。本研究对EW与CS质量比为10∶8,环境pH为6,AN提取物添加量为8%时,EW/CS复合物与微凝胶对花青素的负载率进行计算。结果如图7所示,EW/CS复合物与微凝胶均可实现对AN的有效负载,负载率分别为55.31%和50.61%,这可能是由于复合物在加热形成微凝胶的过程中结构发生改变,影响了对AN的负载。因此,本研究进一步考察了AN添加量对EW/CS复合体系结构与性质的影响,如图8和图9所示。
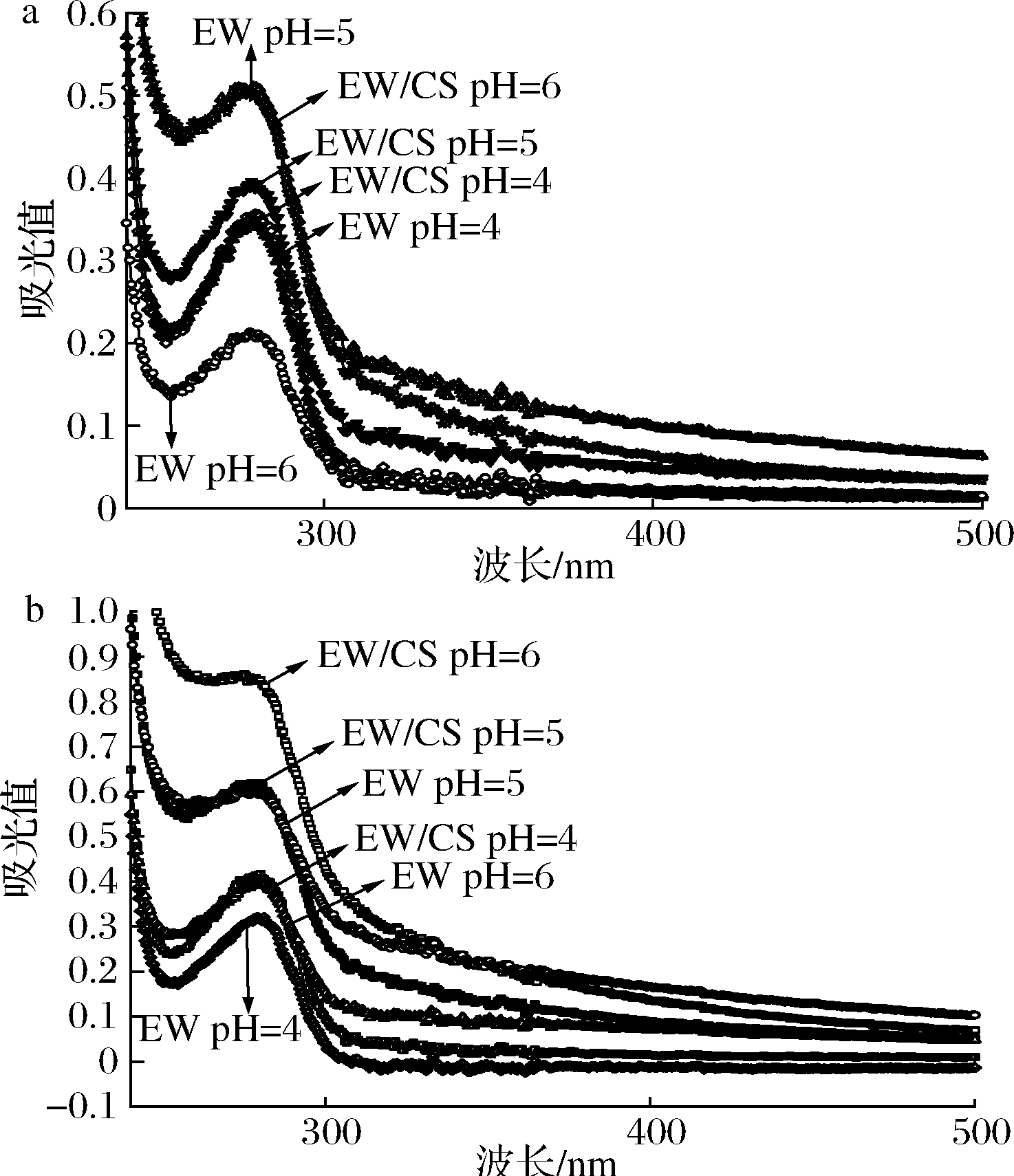
a-复合物;b-微凝胶
图5 环境pH对复合物与微凝胶紫外吸收光谱的影响
Fig.5 Effect of environmental pH on the viscosity of complexes and microgels

a-复合物黏度;b-微凝胶黏度;c-复合物储能模量;d-微凝胶储能模量
图6 环境pH对复合物与微凝胶流变学性质的影响
Fig.6 Effect of environmental pH on the rheological properties of complexes and microgels
2.3.1 浊度、粒径和Zeta电位
AN在水溶液中溶解呈弱酸性,带负电,其添加会影响蛋白/多糖体系的特性[22]。如图8所示,当AN添加量低于3%(质量分数)时,复合物与微凝胶体系浊度、粒径降低,Zeta电位升高。当AN添加量超过3%,复合物与微凝胶体系浊度、粒径升高,Zeta电位降低,电荷平衡状态难以维系,溶质部分析出,体系稳定状态被破坏。微凝胶体系的粒径在AN添加量为1%~5%时低于复合物(图8-a)。综上所述,在AN添加量为3%时体系较为稳定。
2.3.2 流变学性质
AN可以与多糖产生氢键相互作用而影响体系的流变学性质[23]。如图9所示,EW/CS复合物和微凝胶体系中,AN添加量对复合物体系黏度的影响不大,但加入AN后EW/CS微凝胶黏度明显高于复合物(图9-a,图9-b)。同时,微凝胶的凝胶网格形成时间明显延长(图9-c,图9-d),这是由于AN自身带有的电荷影响了体系原有的静电相互作用[22],这种相互作用的改变破坏了EW/CS间结合的稳定性,进而也对体系的热稳定性造成影响。

图7 复合物与微凝胶对花青素的负载(P<0.05)
Fig.7 Complexation of anthocyanin by complexes and microgels (P<0.05)
3 结论
利用简单的静电相互作用驱动方法可以制备EW/CS复合物,对复合物加热可得微凝胶,2种体系均可用于AN的负载与递送。EW与CS的质量比对

a-粒径;b-电位;c-浊度
图8 花青素添加量对复合物与微凝胶粒径、Zeta电位和浊度的影响(P<0.05)
Fig.8 Effect of anthocyanin addition on particle size, Zeta potential and turbidity of complexes and microgels(P<0.05)

a-复合物黏度;b-微凝胶黏度;c-复合物储能模量;d-微凝胶储能模量
图9 花青素添加量对复合物与微凝胶流变学性质的影响
Fig.9 Effect of anthocyanin addition on the rheological properties of complexes and microgels
复合物和微凝胶的粒径及电荷性质有显著影响。通过改变pH和AN的添加量,可以调节EW与CS间的静电相互作用,从而可对形成的复合物及微凝胶的性质进行调控。2种体系相比,EW/CS的微凝胶对环境变化更为敏感,适用于酸碱触发释放载体的构建,而复合物性质相对稳定,适用于持续释放载体的构建。
[1] 高雅馨, 于有强, 朱巧莎, 等.天然生物大分子及其复合物在食品微凝胶传递体系中的应用研究进展[J].食品科学, 2019, 40(15):323-329.
GAO Y X, YU Y Q, ZHU Q S, et al.A literature review on the application of natural biomacromolecules and their complexes in food microgel delivery system[J].Food Science, 2019, 40(15):323-329.
[2] 许雪儿, 李娟, 陈正行, 等.玉米醇溶蛋白-阿拉伯胶纳米颗粒的制备及性质表征[J].食品与发酵工业, 2018,44(7):179-184.
XU X E, LI J, CHEN Z X, et al.Preparation and characterization of zein-arabic gum nanoparticles[J].Food and Fermentation Industries, 2018,44(7):179-184.
[3] 陈敬鑫, 刘族昕, 吕静祎, 等.大豆分离蛋白/可溶性大豆多糖作为生物活性物质包埋载体的研究进展[J].中国粮油学报, 2021,36(4):193-202.
CHEN J X, LIU Z X, LYU J Y, et al.Research progress of soybean isolation protein/soluble soybean polysaccharide as the imbedded carrier of bioactive substance [J].Journal of the Chinese Cereals and Oils Association, 2021, 2021,36(4):193-202.
[4] 马小强, 白卫滨, 陈嘉莉, 等.花色苷递送系统的应用研究进展[J/OL].食品科学, 2021.http://kns.cnki.net/kcms/detail/11.2206.TS.20210430.1603.036.html.
MA X Q, BAI W B, CHEN J L, et al.Research progress in the application of delivery system for anthocyanin[J/OL].Food and Fermentation Industries, 2021.http://kns.cnki.net/kcms/detail/11.2206.TS.20210430.1603.036.html.
[5] 邵平, 于江, 陈杭君, 等.食品包装涂布纸生物聚合物基质分类及应用[J].食品与发酵工业, 2020, 46(2):286-292.
SHAO P, YU J, CHEN H J, et al.Classification and application of biopolymer matrix for food packaging coated paper [J].Food and Fermentation Industries, 2020, 46(2):286-292.
[6] ZHANG Q, DONG H M, GAO J.et al.Field pea protein isolate/chitosan complex coacervates:Formation and characterization[J].Carbohydrate Polymers, 2020, 250:116925.
[7] PEI Y Q, LI Z S, MCCLEMENTS D J, et al.Comparison of structural and physicochemical properties of lysozyme/carboxymethylcellulose complexes and microgels[J].Food Research International, 2019, 122:273-282.
[8] 冯思敏, 王丽玲, 廖杰, 等.花青素纳米载体的研究进展[J].食品工业科技, 2021, 42(4):330-336.
FENG S M, WANG L L, LIAO J, et al.Progress on anthocyanidin nano-carriers [J].Science and Technology of Food Industry, 2021, 42(4):330-336.
[9] 刘圣雅, 彭媛媛, 张甫生, 等.酸诱导对大豆蛋白/高酯果胶复合体系凝胶特性的影响[J].食品与发酵工业, 2019, 45(6):104-109.
LIU S Y, PENG Y Y, ZHANG F S, et al.Effect of acid induction on gelling properties of soy protein isolate/high-methoxy pectin complex system [J].Food and Fermentation Industries, 2019, 45(6):104-109.
[10] 李菁, 滕伟, 洪育冰, 等.载蛋白的脂多糖胺纳米囊泡研究[J].中国新药杂志, 2020, 29(4):456-463.
LI J, TENG W, HONG Y B, et al.Study on protein-loaded lipopolysaccharide-amine nanopolymersomes [J].Chinese Journal of New Drugs, 2020, 29(4):456-463.
[11] YÜCETEPE A, YAVUZ-DÜZGÜN M,  ENSU E, et al.The impact of pH and biopolymer ratio on the complex coacervation of Spirulina platensis protein concentrate with chitosan[J].Journal of Food Science and Technology, 2021, 58(4):1 274-1 285.
ENSU E, et al.The impact of pH and biopolymer ratio on the complex coacervation of Spirulina platensis protein concentrate with chitosan[J].Journal of Food Science and Technology, 2021, 58(4):1 274-1 285.
[12] 赵伟刚, 鹿振武, 逯盛芳, 等.大豆分离蛋白与壳聚糖复合材料的制备[J].应用化学, 2015, 32(3):327-334.
ZHAO W G, LU Z W, LU S F, et al.Preparation of composite based on soybean protein isolates and chitosan [J].Chinese Journal of Applied Chemistry, 2015, 32(3):327-334.
[13] 许威, 李斌.多糖/蛋白质复合体系相转变及其在食品中的应用[J].食品科技, 2017, 42(1):76-81.
XU W, LI B.Phase transformation behavior and application in food field of polysaccharide/protein system [J].Food Science and Technology, 2017, 42(1):76-81.
[14] 岳鑫, 包怡红.基于荧光及紫外光谱法对红松种鳞多酚与乳清蛋白相互作用的研究[J].现代食品科技, 2019, 35(7):114-120.
YUE X, BAO Y H.Interaction between the polyphenols from Pinus koraiensis seeds scales and whey protein studied by fluorescence and ultraviolet spectroscopy [J].Modern Food Science and Technology,2019, 35(7):114-120.
[15] 吴云雪, 李娟, 高晴, 等.EGCG与乳清蛋白相互作用的光谱分析[J].食品研究与开发, 2020, 41(1):7-13.
WU Y X, LI J, GAO Q, et al.Spectral analysis of the interaction between EGCG and whey protein isolate [J].Food Research and Development, 2020, 41(1):7-13.
[16] 王卉, 白燕, 杨波, 等.海藻酸钠/微晶纤维素复合壁材的性能及对精油微胶囊缓释性的影响[J].食品科技, 2020, 45(2):111-116.
WANG H, BAI Y, YANG B, et al.Properties and effect on controlled release of essential oil microcapsules of sodium alginate/microcrystalline cellulose composite wall [J].Food Science and Technology,2020,45(2):111-116.
[17] 王旭, 李昕, 许朵霞, 等.大豆多糖对乳清分离蛋白—乳状液稳定性与流变特性的影响[J].食品工业科技, 2017, 38(19):1-6.
WANG X, LI X, XU D X, et al.Influence of soybean polysaccharide on the physical stability and rheological properties of whey protein isolate emulsion [J].Science and Technology of Food Industry, 2017, 38(19):1-6.
[18] MENDE S, PETER M, BARTELS K.et al.Addition of purified exopolysaccharide isolates from S.thermophilus to milk and their impact on the rheology of acid gels[J].Food Hydrocolloids, 2013, 32(1):178-185.
[19] KILIC-AKYILMAZ M, KOCAMAN E, GULSUNOGLU Z, et al.Changes in physicochemical properties and gelation behaviour of caseinomacropeptide isolate by treatment with transglutaminase[J].International Dairy Journal, 2018, 84:85-91.
[20] YUE L L, JIN W, CHI S M, et al.pH-responsive chitosan/sulfobutyl ether-β-cyclodextrin supramolecular nanoparticles for controlled release of sodium ferulate[J].Polymer Engineering and Science,2020,60(10):2 403-2 413.
[21] 吴晓琼, 贾定坤, 傅志贤, 等.原花青素多重乳液水凝胶的制备及评价[J].粮食与油脂, 2020, 33(12):125-128.
WU X Q, JIA D K, FU Z X, et al.Preparation and evaluation of multiple emulsion hydrogel of procyanidin [J].Cereals & Oils, 2020, 33(12):125-128.
[22] LIUDVINAVICIUTE D, RUTKAITE R, BENDORAITIENE J, et al.Formation and characteristics of alginate and anthocyanin complexes[J].International Journal of Biological Macromolecules, 2020, 164:726-734.
[23] 苗兰鸽, 许燕, 赵思明, 等.花青素对不同直链淀粉含量的淀粉理化特性的影响[J].食品工业科技, 2020, 41(14):22-28.
MIAO L G, XU Y, ZHAO S M, et al.Effects of anthocyanin on physicochemical properties of starches with different amylose contents [J].Science and Technology of Food Industry, 2020, 41(14):22-28.