胶囊作为药物中的常见剂型,方便服用且可提高药物稳定性。当前,明胶胶囊已成为市面上应用最广和加工技术最成熟的胶囊产品[1],明胶具有良好的成膜性,但该分子中含的各种活性基团容易与醛、多酚、还原糖和维生素C等交联,影响胶囊的崩解和稳定性[2]。明胶主要通过牛、猪等动物皮骨中提取的骨胶、皮胶发酵得到,由于宗教信仰,动物源性明胶胶囊受素食主义者和伊斯兰教等人群的抵制[3]。随着养殖业滥用药品的增加,以及激素的大量使用,动物产品的安全性越来越受到人们的质疑。国内“毒胶囊”事件的爆发影响和威胁着人们的健康,也让明胶胶囊的研制及应用雪上加霜。因此,寻求质量可控、安全可靠且成本低廉的植物原料制备胶囊代替传统的明胶胶囊具有重要意义。
羧甲基淀粉具有优良的成膜性和崩解性[4];魔芋葡甘聚糖(konjac glucomannan,KGM)是安全可食用的天然多糖,它具有优良的凝胶性、成膜性和生物可降解性,逐渐成为食品和药品包装中重要的包装材料[5-6]。胶囊所需囊材的必要条件是能形成热可逆凝胶,虽然羧甲基淀粉具有优良的成膜性和崩解性,但是不能形成热可逆凝胶。因此将κ-卡拉胶与羧甲基淀粉共混,由于分子间的相互协同作用,可形成热可逆凝胶,在此基础上加入KGM,使混合后形成的凝胶效果更好,兼具KGM凝胶的高弹性和κ-卡拉凝胶的高强度。囊材的成膜性是其制备胶囊的重要依据,膜的制备工艺也相比胶囊制备工艺简单,更易操作,且机械性和阻隔性等性能易于准确测定。因此,可以通过研究膜的性能来预判胶囊的性能,从而确定制备胶囊的配方和工艺条件,并减少胶囊在制备过程中出现问题的几率。
目前已出现少量以变性淀粉或魔芋胶与卡拉胶混合制备胶囊的专利,但是,对不同原料复配等性能报道较少。在复配体系中,组分的比例影响其成膜性,以及各组分之间的相容性,进而影响胶囊的性质。因此,本试验以κ-卡拉胶/KGM/羧甲基淀粉制备复合膜作为研究对象,研究了混合胶(κ-卡拉胶与KGM等质量混合)与羧甲基淀粉不同配比(质量比:10∶0、9∶1、8∶2、7∶3、6∶4、5∶5、4∶6与3∶7)对复合膜机械性能、阻隔性能和溶解性的影响;并用透光率、红外光谱、X-射线衍射与扫描电镜等评估复合膜的相容性,分析了各成分对膜特性的影响;最后基于复配体系成膜特性的基础,确定2种配比,参照明胶胶囊生产工艺,以这2种配比制备植物基空心胶囊,并研究产品的溶出性与稳定性。研究结果有助于为新型植物胶囊的研制提供理论依据,为羧甲基淀粉、KGM的应用提供新的途径。
1 材料与方法
1.1 实验材料
羧甲基淀粉,参照张运芳[7]的方法,以玉米淀粉为原料实验室自制,取代度为(0.677±0.012)%;魔芋葡甘聚糖(食品级),康家客食品有限公司;卡拉胶(食品级),上海北连生物科技有限公司;KCl,(食品级),河南强利化工产品有限公司;甘油(食品级),国药集团化学试剂有限公司。西咪替丁,重庆科瑞制药(集团)有限公司;明胶胶囊,市售。
1.2 仪器和设备
FA2004A型电子分析天平,上海横平科学仪器有限公司;DHG-9070A型鼓风干燥箱,上海齐欣科学仪器有限公司;XLW(G)-PC智能电子拉力机、CHY-CA型薄膜厚度测量仪,济南兰光机电技术有限公司;HCJ-4C磁力搅拌水浴锅,常州恩培仪器制造有限公司;Spectrum 100红外光谱仪,美国Perkin Elmer公司;STA 449 F3同步热分析仪,德国耐驰公司;D8 Advance型X射线衍射仪,德国布鲁克公司;S-4800场发射扫描电子显微镜,日本日立公司;NDJ-5S 型旋转黏度计,上海越平仪器有限公司。LB-881B六管崩解仪,无锡科达仪器厂;RCZ-6B型溶出仪,上海黄海药检仪器厂;MMI001千分尺,上海明宝工具有限公司。
1.3 实验方法
1.3.1 不同配比复合膜制备
由于分子间的相互协同作用,κ-卡拉胶与KGM复配比例不同,复配体系性能不同,从而影响复合膜的性能。因此,本研究通过预实验测定κ-卡拉胶/KGM成膜性、凝胶性,固定了κ-卡拉胶与KGM质量比为5∶5,配成混合胶。制备:混合胶在加入了0.1%的KCl(占总物质质量百分比,下同)、0.1%的甘油(占固体物质量百分比,下同)的去离子水中搅拌混匀,配成1%(质量百分比,下同)的溶液;羧甲基淀粉在加入了1‰的KCl、10%的甘油的去离子水中搅拌混匀,配成4%的溶液。前者溶胀30 min(80 ℃),并补充散失的水分,后者静置1 h(25 ℃)。将混合胶与羧甲基淀粉在80 ℃下按不同的比例混合,配成质量比分别为10∶0、9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8和1∶9的胶液,充分搅拌均匀,离心脱气后,倒入培养皿流延成膜,50 ℃干燥24 h,冷却后揭膜,在室温下相对湿度为43%的硝酸镁饱和溶液环境中保存3 d以上。
1.3.2 复合膜性能的测定
1.3.2.1 厚度测定
在均匀待测膜的中心与边缘区随机取点,选取至少10个不同点用测厚仪测定,结果取平均值,单位以mm表示[8]。
1.3.2.2 机械性能测定
取完整、薄厚均匀的膜,裁剪大小为100.0 mm×15.0 mm(长×宽),使用智能电子拉力机进行测定。测试条件:上下探头间距为(60.0±0.5) mm,拉伸速率50 mm/min,拉伸强度(tensile strength,TS)、断裂伸长率(elongation at break,EAB)和杨氏模量(e-modulus,EM)按公式(1)~公式(3)计算[8-9]。
(1)
式中:F,最大断裂应力,N;S,膜样品横截面积,mm2。
(2)
式中:L,试样原始标线距离,mm;ΔL,试样断裂时标线距离-试样原始标线距离,mm。
(3)
式中:EM,杨氏模量,应力与应变的比值,表示材料抵抗变形的能力,MPa;σ,应力,单位面积上所受到的力(F/A,其中A表示面积),MPa;ε:应变,在外力作用下的相对形变(相对伸长ΔL/L)。
1.3.2.3 水蒸气透过率(water vapor permeability,WVP)测定
拟杯子法测定:称取2.0 g无水CaCl2(0%相对湿度)于称量瓶中,用待测膜将瓶口密封以做成透湿杯,称重。然后将其置于底部放有饱和CaCl2溶液(75%相对湿度)的干燥器中,每隔24 h称重,最后计算WVP[10],如公式(4)所示:
(4)
式中:m,透湿杯的增重,g;d,膜厚度,mm;A,试样的透过面积,m2;t,时间变化,d;P,水蒸气透过膜两侧的蒸汽压差,kPa。
1.3.2.4 氧气透过率测定
将15 g新鲜大豆油倒入锥形瓶,用薄厚均匀的待测膜密封瓶口,并在培养箱中陈化7 d,测定大豆油的过氧化值[11],用过氧化值的大小评价膜的阻氧性。
1.3.2.5 溶解率
将膜在相对湿度为0%的干燥器中贮存10 d后,选取完整、厚度均匀的膜,裁剪大小相近,质量约0.25 g,放入装有100 mL蒸馏水的三角瓶中,37 ℃振荡水浴10 min(50 r/min),抽滤分离膜未溶解部分,100 ℃烘干至恒重[11]。膜的溶解率按公式(5)计算:
溶解率![]()
(5)
式中:m0,样品溶解前质量,g;m1,样品烘干后质量,g。
1.3.3 复合膜相容性研究
1.3.3.1 透光率分析
裁剪大小为5.0 cm×1.0 cm的膜,将其紧贴于比色皿一侧,以空皿为对照,在400~800 nm下测定透光率。
1.3.3.2 红外光谱分析
选取完整、厚度均匀的膜,将其在4 000~400 cm-1内扫描,记录膜的红外光谱图。
1.3.3.3 X-射线衍射分析
选取完整、厚度均匀、大小一致的膜。实验条件:X-射线源为Cu-Kα线,扫描角度 3~45°,扫描速度为4 °/min。
1.3.3.4 扫描电镜分析
选择完整、厚度均匀的膜,裁剪为2.5 mm×2.5 mm,固定在样品台上,在真空状态下镀金,观察复合膜的表面,放大倍数为10 000倍。
1.3.4 复合膜热重分析
样品用量为5~10 mg,升温速率为10 ℃/min,扫描范围为室温到500 ℃。
1.3.5 胶囊的制备工艺流程
本试验依照胶囊传统蘸胶法制备胶囊,工艺流程如下:
配料→溶胶→保温→蘸胶→干燥→脱壳、切割→成品
工艺要点:选取复合膜性能良好的胶液配比,80 ℃混胶30 min,胶液脱气,55 ℃保温30 min。将胶囊模具竖直缓慢没入胶液,4~8 s后匀速拔出,再连续翻转数次,50 ℃干燥2~2.5 h。将干燥好的样品取出冷却回湿,用胶囊钳拔下,再将囊坯截成规定的长度。
1.3.6 胶囊性能检测
根据2015版《中国药典》中对明胶胶囊的要求,对制备胶囊的松紧度、脆碎度、崩解时限、干燥失重与灼烧残渣进行测定[12]。
1.3.7 胶囊溶出性能
选择西咪替丁作为模型药物,根据2015版《中国药典》四部通则0931中溶出度测定第一法——蓝法测定。
1.3.8 胶囊稳定性试验
1.3.8.1 高温下质量变化
称取一定量的胶囊样品,置于密封洁净的广口瓶中,60 ℃下保存,于第5天、第10天取样,记录其质量变化。
1.3.8.2 高温下溶出度变化
将西咪替丁装入准备好的胶囊中,高温下放置,于第5天、第10天取样,按1.3.7测其溶出性能,并以0 d测定结果作为对照[13]。
1.3.9 数据处理
采用Origin 9.1 作图,SPSS 24.0对实验数据进行分析处理。
2 结果与分析
2.1 不同配比复合膜的性能
2.2.1 不同配比复合膜的机械性能
由图1可知,随着羧甲基淀粉占比增加,复合膜的抗拉强度和杨氏模量逐渐增加,当混合胶与羧甲基淀粉质量比为7∶3时,抗拉强度最高,杨氏模量最大,随后呈降低趋势。由此说明,添加适量羧甲基淀粉可提高膜的拉伸性能。混合胶与羧甲基淀粉质量比从9∶1到4∶6,复合膜的抗拉强度一直强于κ-卡拉胶/KGM膜(即混合胶与羧甲基淀粉质量比为10∶0,下同)。说明在一定范围内,这3种组分分子之间具有良好的相容性,羧甲基淀粉与二者充分混溶,使得κ-卡拉胶/KGM共混物的结构在一定程度上重新排列,产生了协同效应使得分子间的联结更加致密[14];也可能是卡拉胶中具有强阴离子性的半硫酸酯基能与羧甲基淀粉中的Na+相互作用[15],从而提高了复合膜的抗拉强度。但随着羧甲基淀粉用量继续增加,抗拉强度和杨氏模量降低,是由于羧甲基淀粉分子之间的氢键作用要强于其与κ-卡拉胶及与KGM之间的氢键作用,在复配膜结构中表现微观的相分离[16],从而导致了复配膜抗拉强度的下降,抵抗形变的能力降低。当混合胶与羧甲基淀粉质量比为9∶1、8∶2时,复合膜的断裂伸长率受羧甲基淀粉含量影响较小,当混合胶与羧甲基淀粉质量比在8∶2之后,随着羧甲基淀粉的增加,复合膜的断裂伸长率缓慢下降,二者比例在6∶4后,下降趋势明显。一方面可能是由于加入的羧甲基淀粉分别与κ-卡拉胶、KGM 2种分子相互作用,各组分分子之间相互缠绕,网络结构更加紧密,相互约束阻碍了聚合物链的活动[17];另一方面,羧甲基淀粉单独成膜有硬而脆的特点,韧性低[18],因此较多的羧甲基淀粉会使复合膜的断裂伸长率下降。

a-抗拉强度;b-断裂伸长率;c-杨氏模量
图1 不同配比对复合膜机械性能的影响
Fig.1 Effect of compound proportion on mechanical properties of blend films
2.2.2 不同配比复合膜的阻隔性能
水蒸气透过率和氧气透过率越低说明膜的阻隔性能越好。由图2可知,随着羧甲基淀粉用量的增加,复合膜的水蒸气透过率和氧气透过率先降低后升高,当混合胶与羧甲基淀粉质量比为7∶3时,二者降到最低值。此外,混合胶与羧甲基淀粉质量比从9∶1到2∶8,复合膜的阻隔性能一直优于κ-卡拉胶/KGM膜。由于羧甲基淀粉的加入,让各组分分子之间的相互作用更强,结构更加紧密,且相互缠绕导致复合膜中孔隙变得更曲折,一定程度上会对水分子在膜中的扩散起到阻碍作用[19],从而降低水蒸气透过率与氧气的透过率。但是随着羧甲基淀粉进一步增加,羧甲基淀粉分子之间的氢键作用要强于其与κ-卡拉胶及KGM之间的氢键作用,在复配膜结构中表现微观的相分离[16],从而导致复配膜的水蒸气透过率与氧气透过率上升,这与上文复合膜的抗拉强度的解释一致。
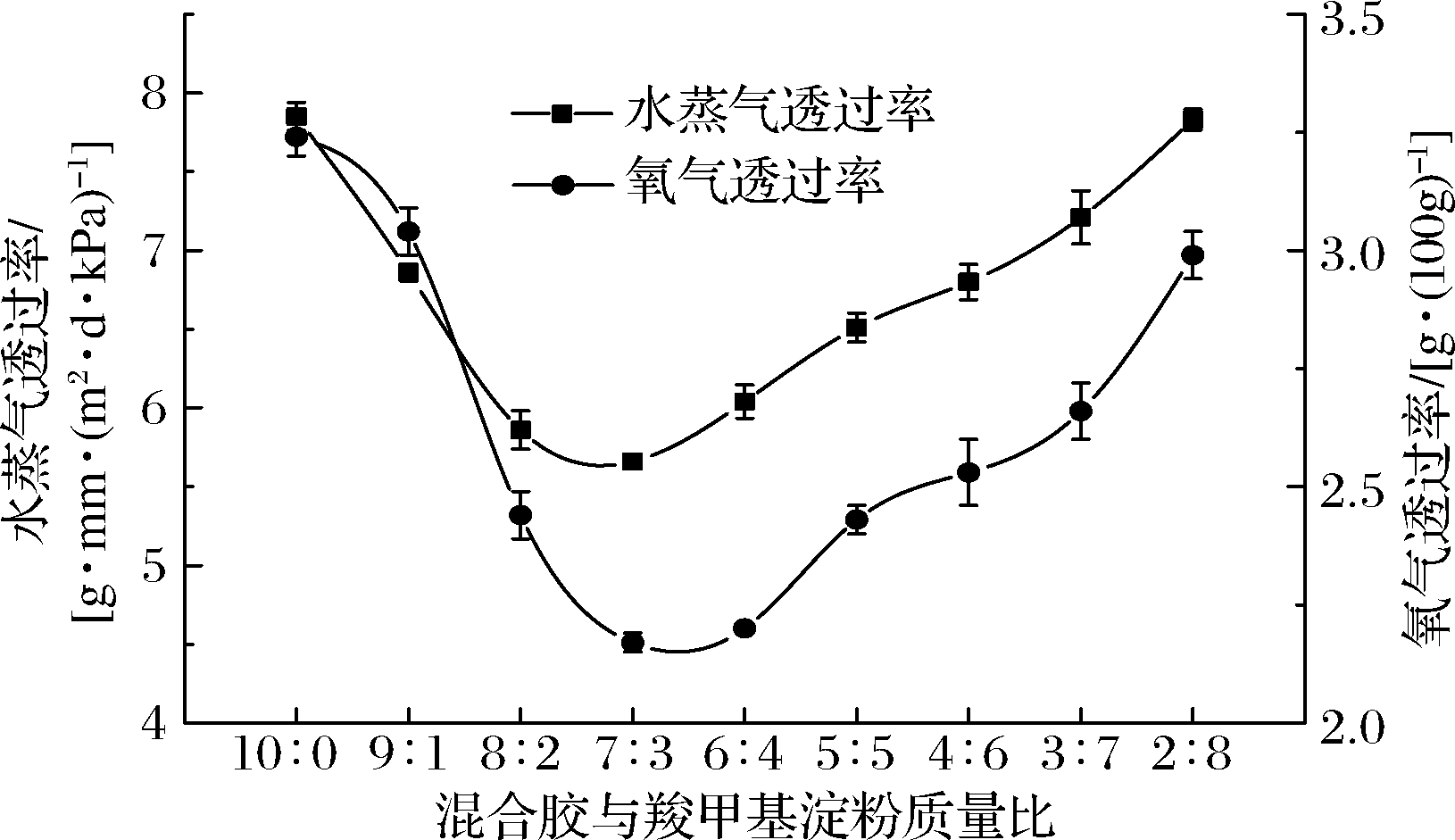
图2 不同配比对复合膜阻隔性能的影响
Fig.2 Effect of compound proportion on barrier properties of blend films
2.2.3 不同配比复合膜的溶解度
崩解性表示胶囊在溶液中溶解快慢的程度,是胶囊性能中的关键指标。膜的溶解度又与胶囊的崩解性能正相关。因此,可通过测定复合膜的溶解度间接反映胶囊崩解性能。由图3可知,随着羧甲基淀粉用量的增加,复合膜溶解度逐渐增加,原因是卡拉胶一般在温度为70 ℃以上时才能充分溶解[20],室温下不易溶于冷水[21],而羧甲基淀粉的水溶性好,当复合膜中羧甲基淀粉占比增加,卡拉胶占比减少,复合膜的溶解性就呈上升趋势。当混合胶与羧甲基淀粉质量在7∶3以后,复合膜溶解性表现较好,如6∶4溶解度87.76%,5∶5溶解度89.22%。此外,在试验中发现,复合膜不是直接溶于水中,而是在水中先溶胀后变软,网络结构被破坏后再发生溶解。
综合考虑机械性能、阻隔性能和溶解性,选取混合胶与羧甲基淀粉质量比为6∶4和5∶5进行胶囊制备研究。

图3 不同配比对复合膜溶解度的影响
Fig.3 Effect of compound proportion on the solubility of blend films
2.2.4 复合膜相容性研究
2.2.4.1 透光率分析
材料在可见光区的高透明性对于其应用非常重要,通常用透光率来评价复合材料的相容性,若复合材料组分之间有良好的相容性,则透光率较高;反之,当光透过膜时,会出现光的散射或反射,透光率较低[22]。由图4可知,κ-卡拉胶/KGM膜透光率在76%左右,显示出较高的透明性,一方面是因为κ-卡拉胶和KGM本身具有很高的透明度,另一方面与其膜内部分子之间强的相互作用有关,从而透光率较高。随着羧甲基淀粉用量的增加,复合膜的透光率逐渐降低,但混合胶与羧甲基淀粉质量比从9∶1到4∶6降低程度较小,3∶7与2∶8透光率降低程度较大,这主要与羧甲基淀粉本身的透光率有关[23]。由前期试验测得羧甲基淀粉溶液透光率为37.4%,当羧甲基淀粉比例增加时,复合膜的透光率下降。但9∶1到2∶8复合膜的透光率仍远高于羧甲基淀粉溶液的透光率,说明复合膜各组分之间有较好的相容性。

图4 不同配比对复合膜透光率的影响
Fig.4 Effect of compound proportion on the transparency of blend films
2.2.4.2 红外光谱分析
由图5可知,所有膜在3 600~3 300 cm-1都出现了较宽的吸收带,是分子中—OH的伸缩振动吸收峰[24],2 900~2 800 cm-1附近的峰为C—H的伸缩振动吸收峰,950~900 cm-1是C—O的振动吸收峰,1 300~750 cm-1范围内为指纹识区域。不同的膜有不同的特征峰,对于κ-卡拉胶膜,在1 220 cm-1处出现的峰为硫酸酯基团中的O—S—O 伸缩振动吸收峰,在922 cm-1处的吸收峰为脱水半乳糖中C—O—C的伸缩振动吸收峰,845 cm-1处的吸收峰为半乳糖-4-硫酸盐中C4—O—S的伸缩振动吸收峰[20]。对于KGM膜,1 720 cm-1处的吸收峰为乙酰基中C![]() O的非对称伸缩振动吸收峰[25]。
O的非对称伸缩振动吸收峰[25]。
κ-卡拉胶/KGM复合膜较单独的κ-卡拉胶膜、KGM膜来说,1 720 cm-1处的C![]() O、845 cm-1处的C4—O—S吸收峰强度减弱,1 220 cm-1处的O—S—O吸收峰消失,说明κ-卡拉胶与KGM之间存在强烈的相互作用;添加羧甲基淀粉后,3 600~3 300 cm-1范围内的羟基伸缩振动峰变宽且向低波数区移动,这是因为三者的分子之间产生了强烈的氢键作用,使参与氢键作用的羟基的化学键力常数降低,吸收频率向低波数方向移动[26]。
O、845 cm-1处的C4—O—S吸收峰强度减弱,1 220 cm-1处的O—S—O吸收峰消失,说明κ-卡拉胶与KGM之间存在强烈的相互作用;添加羧甲基淀粉后,3 600~3 300 cm-1范围内的羟基伸缩振动峰变宽且向低波数区移动,这是因为三者的分子之间产生了强烈的氢键作用,使参与氢键作用的羟基的化学键力常数降低,吸收频率向低波数方向移动[26]。
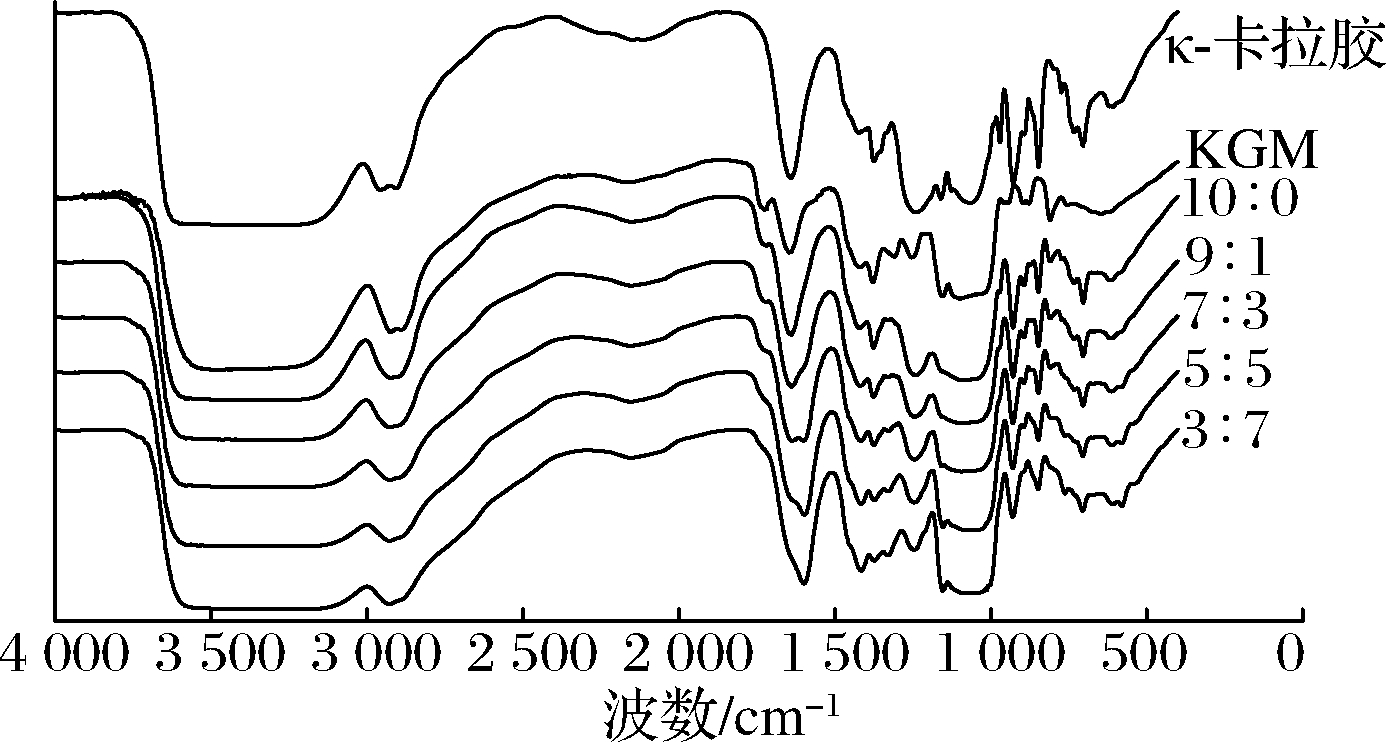
图5 不同配比复合膜红外光谱图
Fig.5 FTIR patterns of blend films with compound proportion
2.2.4.3 X-射线衍射分析
X-射线衍射可以用来表示膜的相容性,研究分子间的相互作用。若复合膜中各组分之间有较强的相互作用,衍射谱图则将表现为某些聚合物组分的特征衍射峰消失[27-28]。由图6可知,所有复合膜都无强衍射峰,不存在结晶区,是典型的无定型结构[29]。10∶0复合膜在15°附近有一个衍射峰,20°左右有一个较宽的衍射峰。当羧甲基淀粉加入到复合膜后,随着用量增加,复合膜在15°处的衍射峰强度逐渐减弱甚至消失,是因为羧甲基淀粉与κ-卡拉胶、KGM间存在较强的相互作用,从而打破了κ-卡拉胶/KGM膜原有的稳定结构,对其结构性能产生影响,与宋彦志等[30]、刘颖[31]的结果一致,进一步说明羧甲基淀粉添加后复合膜各组分间呈现出良好的相容性[32-33]。

图6 不同配比复合膜X-射线衍射图谱
Fig.6 X-ray patterns of blend films with compound proportion
2.2.4.4 扫描电镜分析
由图7可知,在相同的放大倍数(10 000倍)下,10∶0膜表面的微观结构明显粗糙,膜表面有一些块状突起。随着羧甲基淀粉比例的增加,复合膜表面更加光滑均匀且平整,没有裂隙和小孔,所有的复合膜样品均未出现相分离现象,说明κ-卡拉胶、KGM与羧甲基淀粉三者之间存在较强的相互作用,使得膜的结构变得紧密,三者有良好的相容性[34],这与红外光谱、X-射线衍射等试验结果一致。

a-10∶0;b-9∶1;c-7∶3;d-5∶5;e-3∶7
图7 不同配比复合膜的扫描电镜图
Fig.7 SEM images of blend films with compound proportion
2.2.5 热重分析
由图8可知,复合膜热失重过程分为2个阶段:第1阶段在50~120 ℃,由复合膜内的水分随温度升高蒸发所致,对应的微商热重(differential thermos gravimetry,DTG)曲线表现一个小峰[35],第2阶段在250~400 ℃,热重(thermos gravimetry , TG)曲线急剧下滑,在该阶段内复合膜发生失重量显著,主要是复合膜各组分的热降解反应,相应的DTG曲线则出现一个大峰[36]。由TG、DTG曲线可得到相应的热分解数据,其中10∶0膜的初始失重温度和最大失重速率温度分别为251.3和274.4 ℃,600 ℃时的残炭为32.3%;与10∶0复合膜相比,加入羧甲基淀粉后的复合膜的初始失重温度与最大失重速率温度均得到了提高,例如:9∶1复合膜的初始失重温度和最大失重速率温度分别为253.6、277.1 ℃,在600 ℃时的残炭为32.39%;7∶3复合膜分别是258.6、279.3 ℃,在600 ℃时的残炭为32.99%;5∶5复合膜分别为266.4、281.8 ℃,在600 ℃时的残炭为33.60%。这种总体趋势向高温方向移动的现象说明羧甲基淀粉的加入使复合膜的热稳定性提高,且κ-卡拉胶、KGM与羧甲基淀粉三者之间存在氢键相互作用[22]。
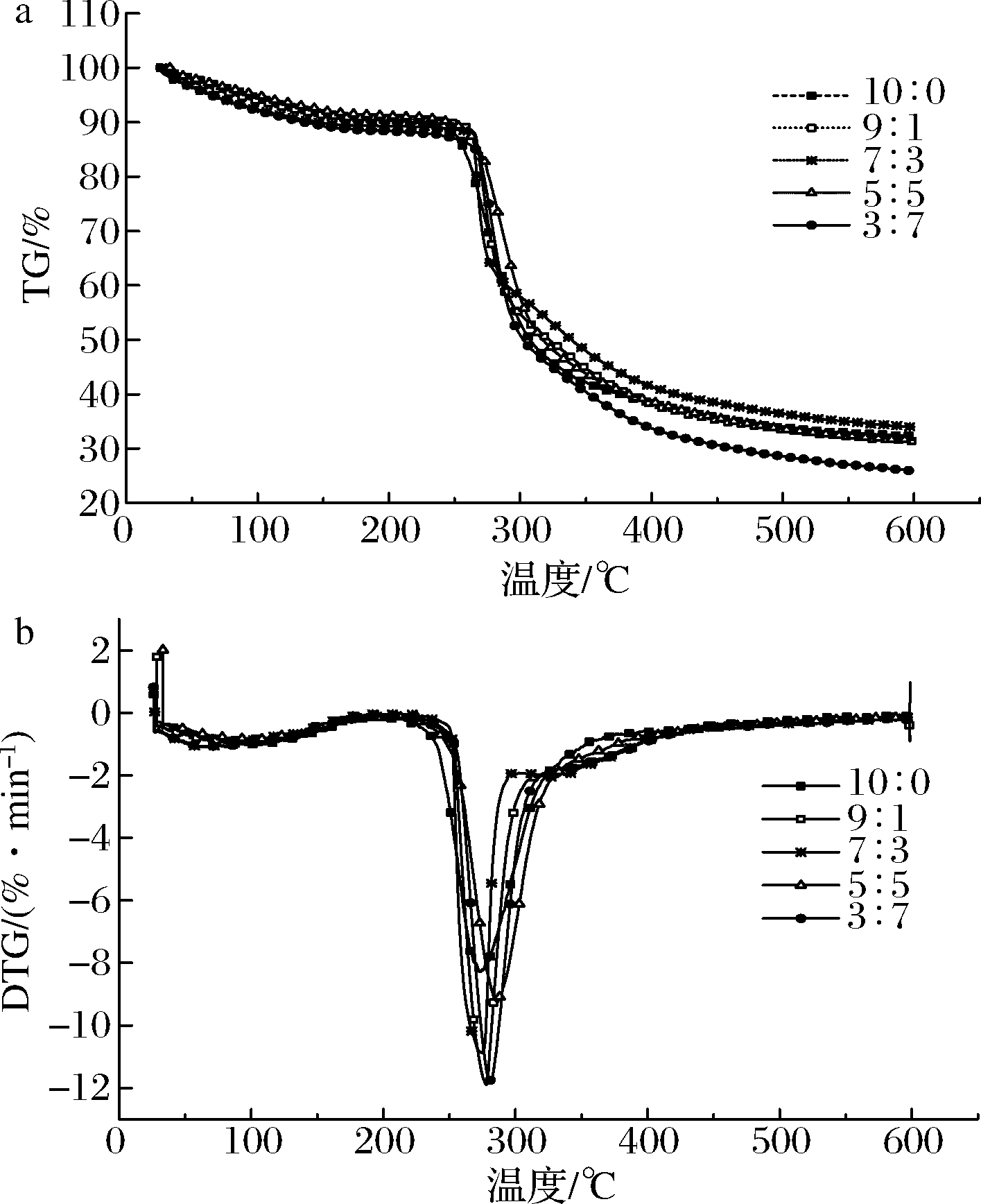
a-TG;b-DTG
图8 不同配比复合膜的TG曲线和DTG曲线
Fig.8 TG and DTG curves of blend films with compound proportion
2.2.6 胶囊性能检测
混合胶与羧甲基淀粉质量比为6∶4和5∶5时,复合膜综合性能良好,因此选择它们作为胶囊制备的研究,制备出6∶4胶囊、5∶5胶囊,同时制备未加入羧甲基淀粉的胶囊(10∶0胶囊),并购买明胶胶囊与两者对比性能差异。
2.2.6.1 外观、气味及尺寸检测
自制胶囊图片见图9,胶囊外观光洁、色泽均匀无软瘪变形和黑点,符合药典标准。自制2种胶囊的尺寸、气味等性能指标见表1,自制胶囊在气味、尺寸方面符合药典标准。
a-6∶4胶囊;b-5∶5胶囊
图9 胶囊图片
Fig.9 Picture of capsule
表1 胶囊尺寸和气味
Table 1 Size and smell of capsule

项目国家标准检测结果6∶4胶囊5∶5胶囊长度/mm帽9.8 ± 0.49.829.83体16.6 ± 0.416.6116.62厚/mm 帽0.085~0.115 (±0.02)0.1020.105体0.085~0.110 (±0.02)0.1030.105性状 色泽均匀、无异臭、无变形色泽均匀、无异臭、无变形色泽均匀、无异臭、无变形
2.2.6.2 性能指标检测
(1)松紧度试验结果均无漏粉现象,符合药典标准。
(2)脆碎度试验结果无胶囊破裂,符合药典标准。
(3)崩解时限试验中,6∶4与5∶5胶囊符合药典标准,而未加羧甲基淀粉的10∶0胶囊,远高于标准,说明羧甲基淀粉在胶囊崩解性能中起着关键作用,羧甲基淀粉占比越高,胶囊崩解时限越短。
(4)干燥失重试验结果符合药典标准。
(5)灼烧残渣试验结果符合药典标准。
具体见表2。
2.2.7 溶出性能
由图10可知,西咪替丁药物溶出时间在2~10 min,明胶胶囊的溶出性能高于6∶4与5∶5胶囊。因为明胶胶囊在3 min之内快速溶胀,并开始崩解,6 min时,快速崩解,药物从胶囊中快速溶出;而自制胶囊在2~6 min时,处于溶胀阶段,未出现明显崩解,当溶出时间超过6 min后,胶囊开始崩解,药物从胶囊中快速溶出。自制胶囊在2~6 min时溶出慢的原因可能是KGM、κ-卡拉胶的加入增强了膜的网络结构,从而降低了胶囊的溶解性能。此外,自制胶囊在溶解时容易在药物表面形成一层黏稠状的液体,部分药物被包裹在里面,不能及时释放出来,从而也降低了药物的溶出。但是当溶出时间为15 min时,6∶4胶囊、5∶5胶囊和明胶胶囊中西咪替丁的累积溶出百分率分别达到了87.70%、89.45%和93.62%,完全符合药典的规定(在20 min时,西咪替丁累积溶出百分率达到75%及以上)。此外,5∶5胶囊溶出性能优于6∶4胶囊,说明羧甲基淀粉有利于增强胶囊的溶出性能。当溶出时间超过20 min时,3种胶囊的累积溶出百分率几乎相同,都达到95%以上。
表2 胶囊性能指标检测
Table 2 Properties test of capsule
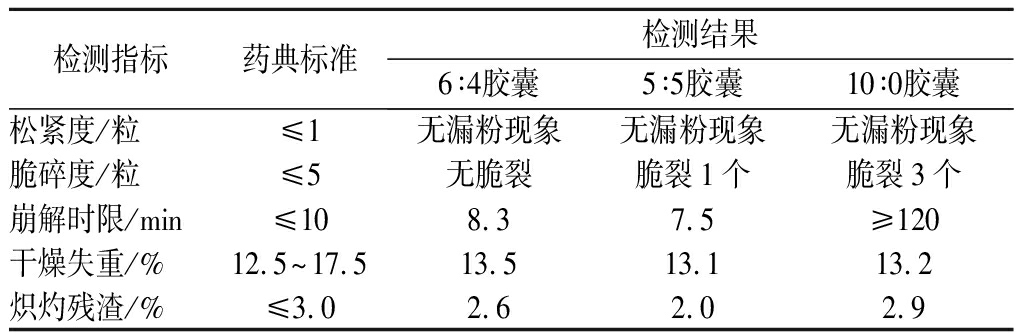
检测指标药典标准检测结果6∶4胶囊5∶5胶囊10∶0胶囊松紧度/粒≤1无漏粉现象无漏粉现象无漏粉现象脆碎度/粒≤5无脆裂脆裂1个脆裂3个崩解时限/min≤108.37.5≥120干燥失重/%12.5~17.513.513.113.2炽灼残渣/%≤3.02.62.02.9
2.2.8 稳定性试验
2.2.8.1 高温下质量变化
由表3可知,所有胶囊在高温下(60 ℃)质量略有下降,且自制胶囊比明胶胶囊失重少,失重都在5%之内,说明这些胶囊在高温下稳定[20]。
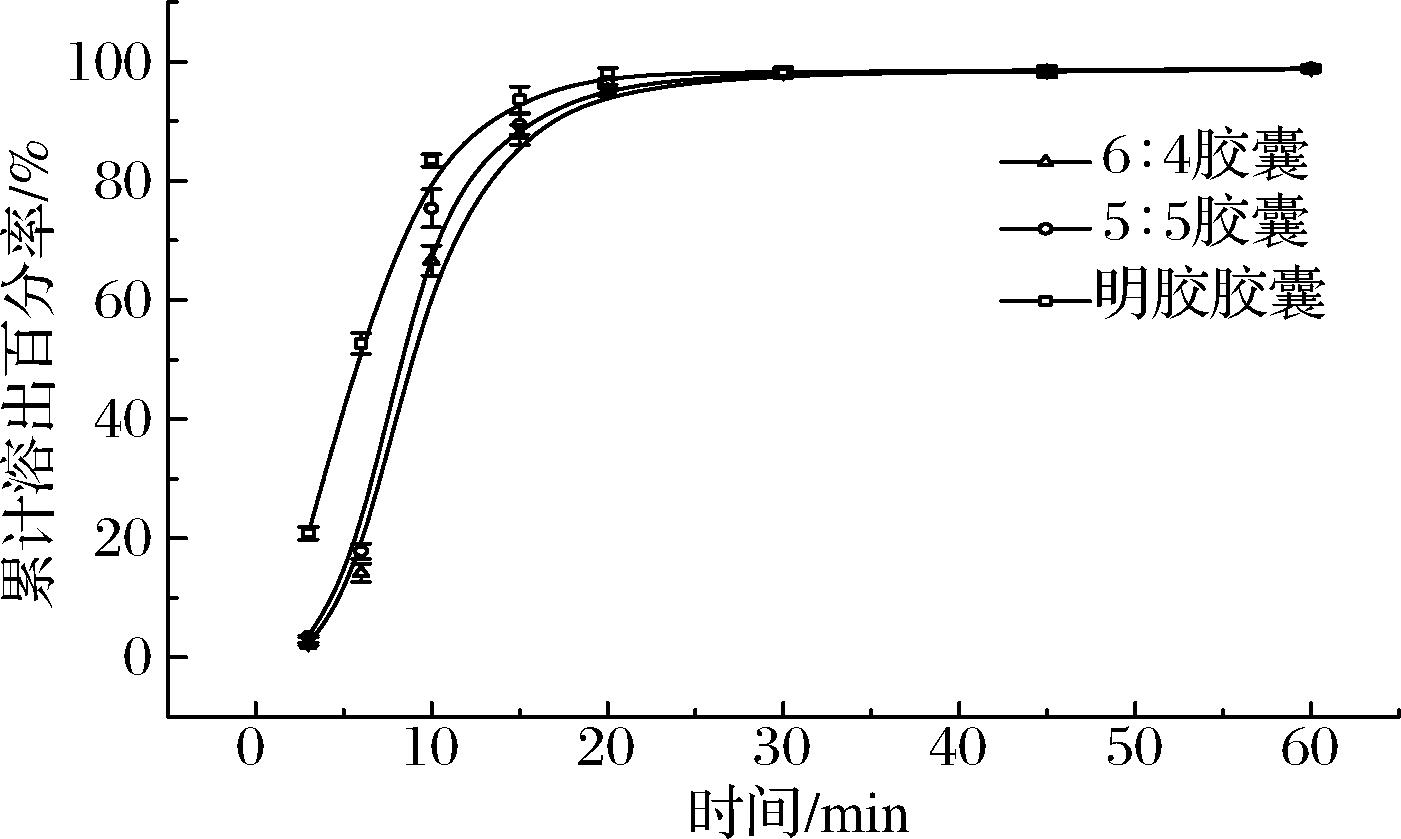
图10 西咪替丁胶囊溶出曲线
Fig.10 The dissolution curve of cimetidine capsules
表3 胶囊在高温下失重结果
Table 3 Results of capsule in high temperature
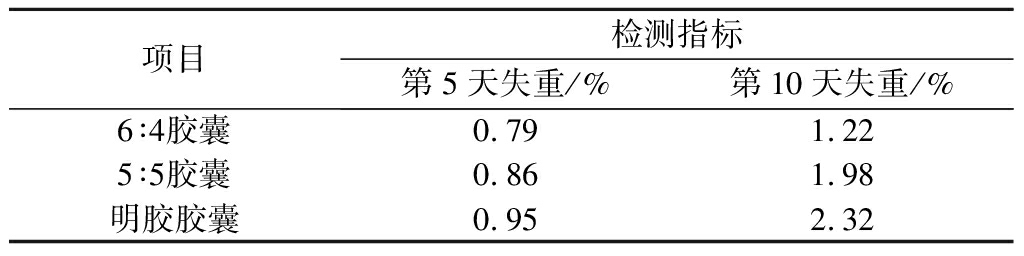
项目检测指标第5天失重/%第10天失重/%6∶4胶囊0.791.225∶5胶囊0.861.98明胶胶囊0.952.32
2.2.8.2 高温下溶出度变化
由图11可知,对于自制6∶4、5∶5胶囊,在高温条件下放置时间越长,药物溶出时间越短,但不影响药物的最终溶出量,说明高温对自制胶囊的影响不大。而明胶胶囊随着高温时间延长,药物的溶出量减少,从而导致最终溶出量降低,这可能与明胶胶囊在高温下容易发黏有关。由此可得自制胶囊的高温稳定性优于明胶胶囊。
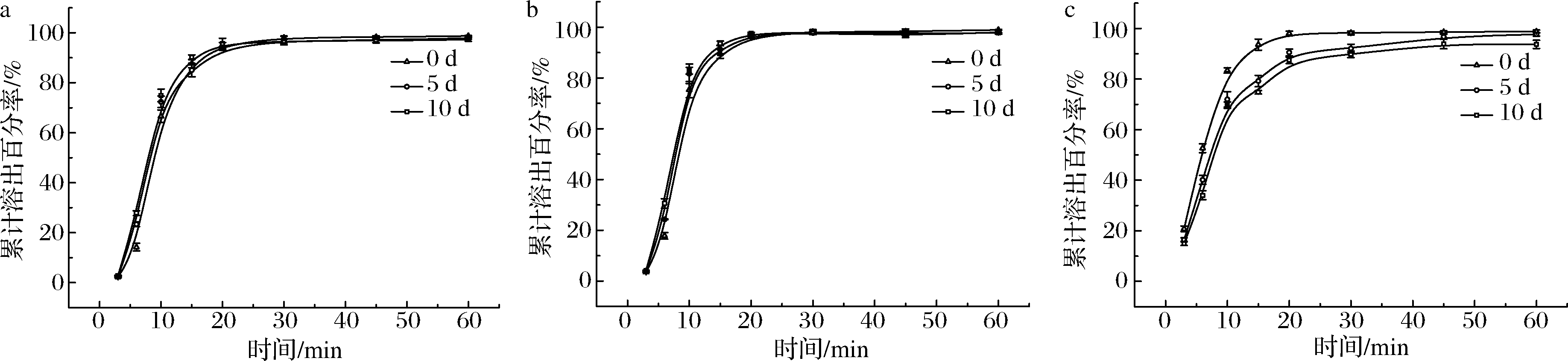
a-6∶4胶囊;b-5∶5胶囊;c-明胶胶囊
图11 西咪替丁胶囊在高温下的溶出曲线
Fig.11 The dissolution curve of cimetidine capsules in high temperature
3 结论
本试验采用流延法制备可降解的κ-卡拉胶/KGM/羧甲基淀粉复合膜,测定了不同配比复合膜的机械性能、阻隔性能和溶解性。用红外光谱、X-射线衍射、扫描电镜等仪器研究复合膜的相容性,并分析了复合膜热稳定性。根据明胶硬胶囊的生产工艺,制备空心胶囊。主要结论如下:
(1)对不同配比的复合膜的性能研究发现,添加适量的羧甲基淀粉可以改善复合膜的机械性能和阻隔性能,提高溶解度,当混合胶与羧甲基淀粉质量比为6∶4和5∶5时,复合膜综合性能良好。
(2)透光率、红外光谱、X-射线衍射结果表明,κ-卡拉胶/KGM/羧甲基淀粉复合膜的组分间存在氢键相互作用,微观形貌结果表明复合膜具有均匀、致密的结构,热重分析表明加入羧甲基淀粉可以提高复合膜的热稳定性。综上,在复合膜中κ-卡拉胶、KGM与羧甲基淀粉三者之间通过氢键相互作用,使复合膜表现出良好的相容性,适合作为胶囊囊材。
(3)根据中国药典的规定,对自制6∶4,5∶5胶囊进行了性能检测,自制2种胶囊成品的外观光滑,无味,松紧度、脆碎度、崩解时限、干燥失重及灼烧残渣均符合药典标准,以10∶0胶囊作对比,可得羧甲基淀粉在胶囊崩解性能中起关键作用,羧甲基淀粉比例越高,胶囊崩解时限越短。
(4)以明胶胶囊作对比,西咪替丁作为模型药物,当溶出时间到达15 min时,6∶4胶囊、5∶5胶囊中西咪替丁的累积溶出百分率分别达到了87.70%、89.45%,完全符合国家药典标准。自制胶囊高温稳定性优于明胶胶囊,在高温后药物溶出时间提前,并不影响最终溶出量。
[1] 张良, 王燕斐, 刘宏生, 等.天然植物高分子药用胶囊的研究与发展[J].高分子学报, 2013(1):1-10.
ZHANG L, WANG Y F, LIU H S, et al.Development of capsules from natural plan polymers[J].Acta Polymerica Sinica, 2013(1):1-10.
[2] MISSAGHI S, FASSIHI R.Evaluation and comparison of physicomechanical characteristics of gelatin and hypromellose capsules[J].Drug Development and Industrial Pharmacy, 2006, 32(7):829-838.
[3] POELOENGASIH C D, ANGGRAENI F D.Exploring the characteristics of sago starch films for pharmaceutical application[J].Starch-Starke, 2015, 66(11-12):1 103-1 108.
[4] 李令金. 空心硬胶囊用酸解羟丙基复合变性淀粉的研究[D].无锡:江南大学, 2018.
LI L J.Study on acid-hydrolyzed-hydroxypropylated starch applied to hollow hard capsules[D].Wuxi:Jiangnan University, 2018.
[5] BELEN G, BEATRIZ M, REMEDIOS Y, et al.Manufacture and properties of glucomannans and glucomannooligosaccharides derived from konjac and other sources[J].Journal of Agricultural and Food Chemistry, 2017, 65(10):2 019-2 031.
[6] 张锐, 刘建群, 舒积成.空心胶囊用氧化魔芋葡甘聚糖的绿色制备工艺研究[J].食品工业, 2018, 39(5):75-78.
ZHANG R, LIU J Q, SHU J C.Study ongreen preparation of oxidating konjac glucomannan for hollow capsules[J].The Food Industry, 2018, 39(5):75-78.
[7] 张运芳. 微波固相法制备交联—羧甲基玉米淀粉及其性质应用研究[D].重庆:西南大学, 2009.
ZHANG Y F.Studies on the preparation of cross-linked carboxylmethyl corn starch(CCMS) by microwave solide-state method and its properties and application[D].Chongqing:Southwest University, 2009.
[8] 黄艳, 张媛, 徐小青, 等.魔芋葡甘聚糖可食膜配方优化[J].食品工业科技, 2016, 37(4):330-336.
HUANG Y, ZHANG Y, XU X Q, et al.Formulation optimization of edible films based on konjac glucomannan by response surface analysis[J].Science and Technology of Food Industry, 2016, 37(4):330-336.
[9] TABARI M.Characterization of a new biodegradable edible film based on sago starch loaded with carboxymethyl cellulose nanoparticles[J].Nanomedicine Research Journal, 2018, 3(1):25-30.
[10] AYDINLI M, TUTAS M.Water sorption and water vapour permeability properties of polysaccharide (locust bean gum) based edible films[J].LWT-Food Science and Technology, 2000, 33(1):63-67.
[11] 吴佳. 普鲁兰壳聚糖复合可食用膜的性质研究[D].无锡:江南大学, 2012.
WU J.Characterization of pullulan-chitosan blend film[D].Wuxi:Jiangnan University, 2012.
[12] 国家药典委员会. 中国药典:四部[M].北京:化学工业出版社, 2015.
Chinese Pharmacopoeia Commission.Chinese Pharmacopoeia:Four[M].Beijing:Chemical Industry Press, 2015.
[13] 李荣荣. 淀粉基植物复合膜材的制备工艺及性能研究[D].聊城:聊城大学, 2017.
LI R R.Preparation and characteristics research of starch-based plant complex membrane[D].Liaocheng:Liaocheng University, 2017.
[14] 王虹霞, 丁克毅, 刘军.果胶/壳聚糖/魔芋胶三元复合膜的结构及应用性能分析[J].食品与生物技术学报, 2015, 34(4):407-412.
WANG H X, DING K Y, LIU J.Analysis studie on the structure and application of pectin-chitosan-konjacgum composite membrane[J].Journal of Food Science and Biotechnology, 2015, 34(4):407-412.
[15] 侯秀斌, 薛志欣, 夏延致.TiO2对琼胶-κ-卡拉胶膜性能的影响[J].复合材料学报, 2018, 35(12):3 450-3 457.
HOU X B, XUE Z X, XIA Y Z.Effect of TiO2 on properties of agar-κ-carrageenan films[J].Acta Materiae Compositae Sinica, 2018, 35(12):3 450-3 457.
[16] SHIH C M, SHIEH Y T, TWU Y K.Preparation and characterization of cellulose/chitosan blend films[J].Carbohydrate Polymers, 2009, 78(1):169-174.
[17] 肖力源, 余国贤, 雷晏琳, 等.玉米淀粉/壳聚糖/魔芋葡甘露聚糖复合膜的制备及物性研究[J].中国粮油学报, 2018, 33(4):86-92;100.
XIAO L Y, YU G X, LEI Y L, et al.Preparation and physical properties of corn/chitosan/konjac glucomannan composite film[J].Journal of the Chinese Cereals and Oils Association, 2018, 33(4):86-92;100.
[18] 刘莹, 刘颖, 胡美娜.壳聚糖/羧甲基淀粉复合膜的制备及性能研究[J].化工新型材料, 2017, 45(7):78-80.
LIU Y, LIU Y, HU M N.Preparation and performance study on chitosan/carboxymethyl starch composite membrane[J].New Chemical Materials, 2017, 45(7):78-80.
[19] MARTINS J T, BOURBON A I, PINHEIRO A C, et al.Biocomposite films based on κ-carrageenan/locust bean gum blends and clays:Physical and antimicrobial properties[J].Food and Bioprocess Technology, 2013, 6(8):2 081-2 092.
[20] 王盛莉. 氧化魔芋葡甘聚糖—大豆分离蛋白基空心胶囊囊材研究[D].武汉:湖北工业大学, 2009.
WANG S L.Studies on vacant capsules material of oxidized konjac glucomannan-soy protein isolate[D].Wuhan:Hubei University of Technology, 2009.
[21] 裴健. 基于明胶胶囊改进的变性淀粉筛选与共混膜材料表征[D].武汉:华中农业大学, 2013.
PEI J.Screening of modified starch and characterization of gelatin starch blending films based on improvement of capsules[D].Wuhan:Huazhong Agricultural University, 2013.
[22] 鲍文毅, 徐晨, 宋飞, 等.纤维素/壳聚糖共混透明膜的制备及阻隔抗菌性能研究[J].高分子学报, 2015(1):49-56.
BAO W Y, XU C, SONG F, et al.Preparation and properties of cellulose /chitosan transparent films[J].Acta Polymerica Sinica, 2015(1):49-56.
[23] MU C, GUO J, LI X, et al.Preparation and properties of dialdehyde carboxymethyl cellulose crosslinked gelatin edible films[J].Food Hydrocolloids, 2012, 27(1):22-29.
[24] HE H, YE J, ZHANG X, et al.κ-Carrageenan/locust bean gum as hard capsule gelling agents[J].Carbohydrate Polymers, 2017, 175:417-424.
[25] 黄晴. 两种魔芋精粉的基础应用特性研究[D].武汉:华中农业大学, 2016.
HUANG Q.Study on basical application properties of refined konjac flour from two species[D].Wuhan:Huazhong Agricultural University, 2016.
[26] CHEN J, LIU C, CHEN Y, et al.Structural characterization and properties of starch/konjac glucomannan blend films[J].Carbohydrate Polymers, 2008, 74(4):946-952.
[27] YANG M, SHI J, XIA Y, et al.Effect of SiO2, PVA and glycerol concentrations on chemical and mechanical properties of alginate-based films[J].International Journal of Biological Macromolecules, 2018, 107:2 686-2 694.
[28] XU X, LI B, KENNEDY J F, et al.Characterization of konjac glucomannan-gellan gum blend films and their suitability for release of nisin incorporated therein[J].Carbohydrate Polymers, 2007, 70(2):192-197.
[29] ZHANG B G, XIE F W, ZHANG T L, et al.Different characteristic effects of ageing on starch-based films plasticised by 1-ethyl-3-methylimidazolium acetate and by glycerol[J].Carbohydrate Polymers, 2016, 146(1):67-79.
[30] 宋彦志, 祝志峰, 李世安.辛烯基琥珀酸酯-羧甲基淀粉膜力学性能的研究[J].中国塑料, 2020, 34(4):25-29.
SONG Y Z, ZHU Z F, LI S A.Study on mechanical performance of octenylsuccinyl-carboxymethyl starch films[J].China Plastics, 2020, 34(4):25-29.
[31] 刘颖. 羧甲基淀粉-壳聚糖复合膜的制备及性能研究[D].阜新:辽宁工程技术大学, 2017.
LIU Y.Preparation and performance research of carboxymethyl starch-chitosan composite membrane[D].Fuxin:Liaoning Technical University, 2017.
[32] ZHANG C G, SUN G H, CAO L L, et al.Accurately intelligent film made from sodium carboxymethyl starch/kappa-carrageenan reinforced by mulberry anthocyanins as an indicator[J].Food Hydrocolloids, 2020, 108:106 012.
[33] DIVYA N, SEEMA S, MURLIDHAR M, et al.Crosslinked chitosan films with controllable properties for commercial applications[J].International Journal of Biological Macromolecules, 2018, 120:1 256-1 264.
[34] 陈妮娜. 交联羧甲基纤维素-藕粉复合膜的制备与表征[J].中国食品添加剂, 2017(8):74-82.
CHEN N N.Preparation and characterization of composite membranes of crosslinked carboxymethyl cellulose-lotus root starch[J].China Food Additives, 2017(8):74-82.
[35] ROMANI V P, PRENTICE-HERNANDEZ C, MARTINS V G.Active and sustainable materials from rice starch, fish protein and oregano essential oil for food packaging[J].Industrial Crops and Products, 2017, 97:268-274.
[36] 刘莉莉, 李思东, 唐冰, 等.壳聚糖/明胶食品保鲜复合膜的热稳定性研究[J].食品工业科技, 2014, 35(8):310-312;327.
LIU L L, LI S D, TANG B, et al.Study on the thermal stability of chitosan/gelatin composite films for food preservation[J].Science and Technology of Food Industry, 2014, 35(8):310-312;327.