塑料作为石油化工产业的产品,因其低成本、易成形、疏水性和生物惰性等优点而被广泛用于食品包装[1]。但有限的不可再生资源、环境污染及食品安全等问题使人们对无毒、可降解的天然聚合物材料产生了浓厚兴趣[2]。目前,研究者已经开发了基于不同生物聚合物的食品包装膜,如多糖(淀粉、纤维素和壳聚糖等)、蛋白质(大豆蛋白、玉米醇溶蛋白和乳清蛋白等)和脂质(石蜡、乙酸甘油酯和虫胶树脂等)[3]。这些生物基薄膜不仅作为可生物降解材料,而且作为生物活性化合物的载体,受到了广泛关注[4]。在各种生物聚合物中,壳聚糖(chitosan,CS)无毒、可生物降解和优异的成膜性能使其更适合食品包装[5]。然而,普通CS膜的机械、抗氧化和抗菌性能较低限制了其在食品包装行业的应用[5]。
研究认为天然的活性物质,如植物多酚和精油可显著提高CS膜的抗氧化和抑菌性能。此外,多酚类化合物可能会与壳聚糖分子链上的羟基或氨基形成分子间氢键或发生静电相互作用,从而改变壳聚糖膜的物理性能[5-6]。例如,紫薯提取物和肉桂精油增强了CS膜的抗氧化和抗菌活性[7-8],黑豆种皮提取物和山竹皮粉均可提高CS膜的机械性能和水蒸气阻隔能力[9-10]。葡萄渣作为酿酒和葡萄汁行业的固体残渣,占所用葡萄质量的20%~25%[11]。传统的处理方式多为堆肥或用作动物饲料,这极大浪费了其中的天然活性物质[11]。据报道,葡萄渣提取物富含儿茶素、表儿茶素、没食子酸和原花青素等多酚类物质,且展现出良好的抗菌、抗氧化和抗炎症等多种生物效应[12-13]。葡萄皮渣提取物能够抑制金黄色葡萄球菌和枯草芽孢杆菌的生长[14],降低菜籽油和大豆油的过氧化值[15],提高鸡肉和牛肉的贮藏稳定性[16]。目前,针对葡萄渣提取物的抗氧化和抑菌能力已有了广泛研究,其在食品保鲜中的应用也得到了大量评价,但在CS基薄膜中加入葡萄渣乙醇提取物的研究却未见文献报道。
本研究的目的是制备用于食品包装的CS基膜,并探究葡萄渣乙醇提取物(ethanol extract of grape pomace,EEGP)的添加量对CS膜物化性能、力学特性、分子结构、抗氧化能力的影响。通过模拟油脂氧化实验,评估CS-EEGP复合膜的氧阻隔性能及抗氧化能力。此外,研究了它们作为活性食品包装材料潜在的抑菌能力。
1 材料与方法
1.1 材料与试剂
葡萄渣(品种为赤霞珠,主要多酚类物质为白藜芦醇和原花青素),甘肃祁连葡萄酒业有限责任公司;壳聚糖(高黏度,>400 mPa·s),上海麦克林生化有限公司;DPPH,上海蓝季生物有限公司;ABTS,山东西亚化学股份有限公司;枯草芽孢杆菌(ATCC 6633)、大肠杆菌(ATCC 8739)和金黄色葡萄球菌(CMCC 26003),齐齐哈尔大学食品与生物工程学院。猪肉脂肪,齐齐哈尔当地市场。所有其他试剂均为分析纯。
1.2 仪器与设备
中草药粉碎机,天津市泰斯特仪器有限公司;GZX-9146MB电热鼓风干燥箱,海博讯实业有限公司;2.5 L Freeze Dry System真空冷冻干燥机,美国Labconco公司;GBCY01数显膜测厚仪,浙江盛泰芯电子科技有限公司;UV-5100紫外可见分光光度计,上海元析仪器有限公司;CR-10 Plus色差仪,杭州柯盛行仪器有限公司;TA.XT plusC质构分析仪,英国Stable Micro System公司;S-4300扫描电子显微镜,日本日立株式会社;Spotlight 400红外光谱仪,美国Perkin Elmer公司;SmartLab X-射线衍射仪,日本理学公司;AIE-200脉冲封口机,美国国际电动公司。
1.3 实验方法
1.3.1 EEGP的制备
EEGP是根据刘芸等[14]的方法制备的,并稍加修改。葡萄渣在50 ℃恒温条件下干燥8 h,粉碎并过100目筛得到葡萄渣粉。取葡萄渣粉100 g浸于500 mL 70%乙醇溶液中,室温下浸提2 h。将提取液以6 000 r/min离心10 min,所得沉渣以上述方法再次提取。合并2次上清液并在50 ℃下减压浓缩。所得浓缩液在-40 ℃真空干燥48 h。冻干粉末贮存-20 ℃下备用。
1.3.2 CS-EEGP膜的制备
CS-EEGP膜是根据RIAZ等[4]的流延法制备的,稍作修改。将2 g CS溶于100 mL 1%的醋酸溶液中,搅拌4 h使 CS完全溶解。再加入1 g甘油作为增塑剂,搅拌30 min。之后,将不同质量分数的EEGP(0%,1%,3%,5%,质量分数,基于CS的质量,下同)加入到CS成膜溶液中,搅拌30 min。膜溶液中的气泡通过真空脱气(0.1 MPa,2 h)去除。将相同体积(30 mL)的CS-EEGP溶液倒在15 cm×15 cm的有机玻璃板上。在25 ℃放置12 h后,移到60 ℃干燥箱中干燥2 h,小心揭下CS-EEGP膜。将含有0%、1%、3%、5%EEGP的CS薄膜分别指定为CS、CS-EEGP1、CS-EEGP3和CS-EEGP5膜,并在放有饱和溴化钠溶液的干燥器中(56%相对湿度,25 ℃)平衡48 h。
1.3.3 膜厚度的测定
使用数显膜测厚仪测量薄膜厚度。取每片膜的5个随机位置的厚度平均值作为膜厚度。
1.3.4 膜含水量的测定
根据RIAZ等[17]的方法测定薄膜含水量。从干燥器中取出薄膜并切成2 cm×2 cm的片状。称取膜片初始质量M1,然后在105 ℃干燥至恒重,测得质量M2。薄膜含水量的计算方法如公式(1)所示:
含水量![]()
(1)
1.3.5 膜水溶性的测定
参照RIAZ等[17]的方法,将薄膜切成2 cm×2 cm的片状并在105 ℃干燥至恒重,测得质量M1。然后,将它们放入装有50 mL蒸馏水的100 mL烧杯中并在室温静置24 h。取出并在105 ℃干燥至恒重,测得质量M2。薄膜水溶性的计算方法如公式(2)所示:
水溶性![]()
(2)
1.3.6 膜水蒸气渗透性的测定
CS基膜水蒸气渗透性(water vapor permeability,WVP)通过CRIZEL等[18]的重量分析法测定,并稍作修改。将薄膜(直径10 cm)密封在直径为6.1 cm的塑料杯的顶部,塑料杯内以无水氯化钙颗粒填充(维持0%的相对湿度)。称重后将杯子放入装有饱和氯化钠溶液的干燥器中,保持恒定的湿度(75%)和温度(25 ℃)。每隔24 h记录1次杯子质量的变化,连续7 d。薄膜WVP的计算方法如公式(3)所示:
(3)
式中:W,塑料杯的总质量增加量,g;x,膜厚度,mm;A,渗透面积,m2,t,经过的时间,s;ΔP,薄膜的分蒸汽压差(25 ℃时为3 200 Pa),g/(m·s·Pa)。
1.3.7 膜颜色的测定
按照GB/T 7921—2008的方法用色差仪测定膜片的颜色参数[19]。亮度(L*)、红度(a*)和黄度(b*)值用于表征膜颜色。使用前经标准白板校准(L=91.8,a=-2.2,b=-2.7)。根据RIAZ等[4]的方法计算总色差(ΔE)、黄度指数(yellowness index,YI)和白度指数(whiteness index,WI),计算如公式(4)~公式(6)所示:
(4)
(5)
(6)
1.3.8 膜透光率和不透明度的测量
根据RIAZ等[17]的方法测量薄膜透光率和不透明度。将薄膜切成1 cm×3 cm的长条状,使用紫外分光光度计测量薄膜在600 nm处吸收度值。此外,不透明度的计算方法如公式(7)所示:
不透明度![]()
(7)
式中:A600,薄膜在600 nm处的吸光度值;x,膜厚度,mm。
1.3.9 膜机械性能的测定
根据GB/T 1040.3—2006的方法[20],使用质构分析仪对薄膜的机械性能进行了评估。薄膜的抗拉强度和断裂伸长率的计算方法分别如公式(8)、公式(9)所示:
抗拉强度![]()
(8)
断裂伸长率![]()
(9)
式中:F,最大拉伸强度,N;x,膜厚度,mm;W,膜宽度,mm;ΔL,膜断裂时的伸长量,mm;L0,膜的初始长度,mm。
1.3.10 扫描电子显微镜
通过扫描电子显微镜(scanning electron microscopy,SEM)观察薄膜表面和横截面的微观结构。在5 kV加速电压和2 000倍或1 000倍放大倍数下获得了样品的SEM照片。在此之前,薄膜在液氮中破碎,然后溅射镀金。
1.3.11 傅里叶变换红外光谱
根据WANG等[9]的方法,使用傅立叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)/近红外光谱(near infrared spectrum instrument,NIRS)对薄膜的分子结构进行分析。在4 000~500 cm-1频率范围内扫描16次获得每个频谱结果。
1.3.12 X射线衍射
根据GUO等[21]描述的方法,通过X射线衍射(X-ray diffraction,XRD)分析薄膜的结晶特征。仪器参数设置为45 kV,200 mA,衍射角2θ为5°~60°,扫描速度4°/min。
1.3.13 膜的DPPH自由基清除活性
采用RIAZ等[22]的方法测定了CS基膜的DPPH自由基清除活性,并稍作修改。将10 mg薄膜混合到3 mL 0.2 mmol/L甲醇DPPH溶液中,并在黑暗环境中静置1 h。然后,测量反应混合物在517 nm处的吸光度。根据公式(10)计算膜的DPPH自由基清除活性:
DPPH自由基清除活性![]()
(10)
式中:A0,甲醇DPPH溶液的吸光度;A1,薄膜反应混合物的吸光度。
1.3.14 膜的ABTS阳离子自由基清除活性
膜的抗氧化能力通过清除ABTS阳离子自由基的方法进行评估[22]。将ABTS溶解在20 mmol/L pH 4.5的乙酸缓冲溶液中,以获得7 mmol/L ABTS溶液。该溶液与2.45 mmol/L过硫酸钾溶液按体积比1∶1混合,然后在室温黑暗环境静置12~16 h。测量前使用乙酸缓冲溶液将稳定的ABTS阳离子自由基贮存液吸光度调整为0.70±0.02。取10 g薄膜和3 mL ABTS工作液混合并孵育6 min,在734 nm处测量吸光度。膜的ABTS自由基清除活性通过公式(11)计算:
ABTS阳离子自由基清除活性![]()
(11)
式中:A0,ABTS工作液的吸光度;A1,薄膜反应混合物的吸光度。
1.3.15 猪油包装
根据MENG等[23]的方法将猪油从猪肉脂肪中提炼并包装在薄膜袋中,每袋6 g。薄膜袋的边界用脉冲密封机密封。然后将其在(60±1)℃的电鼓风干燥箱中贮存7 d。每24 h测定1次猪油的过氧化值(peroxide value,POV),并与暴露在空气中的猪油进行比较。
1.3.16 猪油POV的测定
根据MENG等[23]的方法稍加修改测定猪油的POV。将3 g猪油加入含有30 mL V(氯仿)∶V(乙酸)=2∶3混合溶液的碘量瓶中。轻轻摇动碘量瓶使猪油完全溶解。然后将加入1 mL饱和碘化钾溶液的碘量瓶转移到暗室中。3 min后,加入100 mL蒸馏水并摇匀,立即用0.01 mol/L硫代硫酸钠溶液滴定至浅黄色。再加入1 mL淀粉指示剂,继续进行滴定并摇动碘量瓶,直到蓝紫色完全消失。同时进行试剂空白实验。POV的计算如公式(12)所示:
(12)
式中:V,样品消耗的硫代硫酸钠溶液体积,mL;V0,试剂空白实验消耗的硫代硫酸钠溶液体积,mL;c,消耗的硫代硫酸钠溶液浓度,mol/L;m,猪油质量,g。
1.3.17 微生物分析
采用圆盘扩散法测定薄膜的抗菌活性[24]。枯草芽孢杆菌和大肠杆菌用无菌0.5%氯化钠肉汤进行扩增,金黄色葡萄球菌用无菌7.5%氯化钠肉汤进行扩增。使用前,用无菌生理盐水将获得的细菌悬浮液的细胞密度调整为104 CFU/mL。将薄膜切割成直径为10 mm的圆盘,并在紫外线照射下灭菌10 min。之后将圆盘置于涂有0.2 mL细菌稀释液的琼脂培养基上,并在37 ℃下培养48 h。用游标卡尺测量抑菌圈的直径,抑菌圈的大小反映了薄膜的抑菌效果。
1.4 数据分析
所有实验一式3份。使用IBM SPSS统计程序进行统计分析。在95%置信水平下,采用双向方差分析(analysis of variance,ANOVA)确定各组之间的显著差异。数据平均值之间的显著差异通过邓肯检验进行分析,P<0.05表示差异显著。
2 结果与分析
2.1 膜厚度
膜厚度对薄膜的机械性能、水蒸气透过率、紫外线和光的阻隔性能具有较大的影响,是一个重要参数[25]。膜厚度不仅受膜材的性质、干燥条件和制备方法的影响,还受添加物种类的影响[26-27]。如表1所示,EEGP的加入显著提高了CS膜的厚度(P<0.05)。随着EEGP浓度的增加,CS基膜的厚度由0.047 mm增加到0.093 mm。膜厚度的增加与引入膜基质中的固体物含量增加有关[28]。另一方面,EEGP多羟基的结构促进了多酚通过分子间相互作用(氢键或共价键)与一个以上的CS分子结合。其结果是CS膜更加致密,导致厚度增加。
表1 含不同浓度EEGP的CS基膜的物理性质
Table 1 Physical properties of CS-based films with different concentration of EEGP
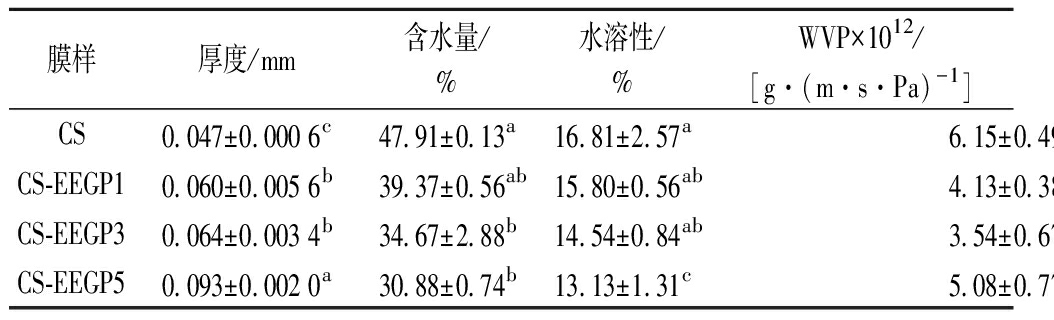
膜样厚度/mm含水量/%水溶性/%WVP×1012/[g·(m·s·Pa)-1]CS0.047±0.000 6c47.91±0.13a16.81±2.57a6.15±0.49aCS-EEGP10.060±0.005 6b39.37±0.56ab15.80±0.56ab4.13±0.38bcCS-EEGP30.064±0.003 4b34.67±2.88b14.54±0.84ab3.54±0.67cCS-EEGP50.093±0.002 0a30.88±0.74b13.13±1.31c5.08±0.77ab
注:数值表示为平均值±标准差;同一列中不同字母表示差异显著(P<0.05)(下同)
2.2 含水量和水溶性
如表1所示,添加EEGP后CS膜的含水量和水溶性均降低。由于CS分子链含有丰富的亲水基团,如—OH和—NH2,所以CS膜的含水量最高[29]。相反,EEGP的引入导致CS膜含水量降低,这是因为EEGP中花青素与CS亲水基团强烈相互作用限制了CS与水分子形成分子间氢键[30]。因此,随着EEGP浓度的增加,CS-EEGP薄膜的含水量显著降低(P<0.05)。CS膜展现出最高的水溶性,这归因于甘油和CS的亲水基团与水的结合能力[30]。随着EEGP的加入,CS-EEGP薄膜的水溶性逐渐降低。与CS膜相比(16.81%),CS-EEGP5膜的水溶性降低了21.89%,差异显著(P<0.05)。CS-EEGP膜水溶性的降低与添加的天然物质有部分不易溶于水有关。
2.3 WVP
WVP反映了薄膜对水蒸气的阻隔性能[5]。结果如表1所示,CS-EEGP膜的WVP小于CS膜。当EEGP的添加量从0增加到3%,CS膜的WVP由6.15×10-12 g/(m·s·Pa)下降至3.54×10-12 g/(m·s·Pa)。这表明EEGP的加入可显著提高CS膜的水蒸气阻隔性能。这是由于酚类化合物与CS链之间的分子间相互作用形成了致密的网络结构。此外,薄膜厚度的增加也是影响CS膜WVP的重要因素[27]。当EEGP添加量增加到5%,CS-EEGP5膜的WVP开始上升,但仍低于CS膜。这是因为EEGP在CS膜中的分散不均匀造成部分致密的网络结构被破坏[30],这种分散不均匀的现象在图1中可观察到。总的来说,EEGP的加入降低了CS膜的WVP。该结果优于添加了黑豆种皮提取物[12.58×10-11 g/(m·s·Pa)][9]、韭菜根提取物[7.81×10-11 g/(m·s·Pa)][4]和山竹果皮粉[2.12×10-10 g/(m·s·Pa)][10]的CS基薄膜。

a-CS;b-CS-EEGP1;c-CS-EEGP3;d-CS-EEGP5
图1 CS膜和CS-EEGP膜
Fig.1 CS film and CS-EEGP films
2.4 膜的颜色、透光率和不透明度
薄膜的物理外观,尤其是颜色,通常会影响消费者对薄膜包装食品的接受程度[6]。从视觉上看,CS膜为无色透明,随着EEGP含量的增加逐渐变暗(图1)。所有测试薄膜表面的颜色参数如表2所示。结果表明,添加EEGP后,CS膜L*和WI显著降低,a*、b*、ΔE和YI显著增加(P<0.05)。EEGP为紫红色,但CS-EEGP膜呈现更直观的灰色,这是由于EEGP中花青素的结构和颜色发生了变化[26,30]。当EEGP含量达到5%时,CS-EEGP5薄膜的b*和YI值较高,L*和WI值较低。同时,ΔE也达到最大,CS-EEGP5薄膜变得更暗。
可见光和紫外光作为引发氧自由基的因素之一,会加速食品的氧化变质,影响食品的品质[18,23]。测定的薄膜的阻光性能结果如表2所示。CS膜展现出较差紫外光阻隔性能,EEGP的加入可显著改变这种性能。随着EEGP添加量的不断增大,CS-EEGP膜的紫外光透射率逐渐减小。CS膜阻挡紫外光能力的提高与EEGP所富含的花青素有关,其能吸收波长为270~280 nm和465~550 nm的光。此外,与CS膜相比,CS-EEGP5膜的不透明度增高48.65%。该结果与EEGP的加入使CS膜变暗有关。
表2 含不同浓度EEGP的CS基膜的颜色、透光率和不透明度
Table 2 Color, transmittance and opacity of CS-based films with different concentration of EEGP

膜样L∗a∗b∗ΔEYIWI透光率/%不透明度/(A·mm-1)CS91.3±0.40a-2.2±0.00d-1.7±0.00d1.2±0.22d-2.7±0.01d90.8±0.39a88.582±0.77a1.112±0.07bCS-EEGP185.2±0.44b-1.4±0.00c0.8±0.26c7.5±0.56c1.3±0.45c85.1±0.45b85.845±1.59b1.190±0.19bCS-EEGP382.0±0.70c-0.5±0.12b1.5±0.38b10.8±0.74b2.7±0.68b82.0±0.72c80.172±0.98c1.478±0.10aCS-EEGP581.0±0.29d0.4±0.06a2.6±0.46a12.3±0.44a4.6±0.82a80.8±0.32d70.199±0.09d1.653±0.04a
2.5 膜的机械性能
机械性能反映了薄膜的机械阻力和柔韧性。通过抗拉强度和断裂伸长率两个重要参数来评估薄膜的结构完整性和阻隔性能[5]。在实际应用中薄膜的完整性和可变形性对食品包装、运输和贮藏具有很大的影响[22]。此外,影响复合膜机械性能的因素有以下几种:天然活性物质的类型和含量、生物基材的种类以及两者之间的相互作用[5]。如表3所示,EEGP的加入显著降低了CS膜的抗拉强度和断裂伸长率(P<0.05)。CS膜机械性能更强(35.68 MPa和40.34%),主要是CS分子中的大量活性基团(如—OH 和—NH2)形成了分子间氢键[21]。CS-EEGP膜机械阻力和柔韧性的降低与酚类化合物阻断CS膜中的链-链相互作用有关[30]。LIU等[6]指出,CS膜的机械性能会受到薄膜网络微观结构、加入的活性化合物的类型和含量以及分子间作用力的极大影响。
表3 不同EEGP浓度下CS基膜的力学性能
Table 3 Mechanical properties of CS-based films with different concentration of EEGP

膜样抗拉强度/MPa断裂伸长率/%CS35.68±0.93a40.34±0.46aCS-EEGP127.79±2.40b38.77±1.05aCH-EEGP324.58±1.31c31.68±2.27bCH-EEGP515.72±0.28d23.01±0.92c
2.6 SEM
EEGP的分布和CS基膜的形貌如图1所示。CS膜平滑完整,无孔隙和裂纹。EEGP的加入并未破坏CS膜结构的完整性。但是,当EEGP添加量从1%增加到5%时,CS-EEGP膜中聚集物增多。
通过扫描电镜对CS-EEGP膜微观结构进行进一步观察。结果表明,CS膜的表面和横截面光滑且连续(图2)。EEGP的加入并未显著改变CS膜的微观结构。随着EEGP含量的增加,CS-EEGP膜表面的白点增多,这是因为CS膜中聚集物增多。这种聚集物是因为多酚与CS的交联。此外,CS-EEGP膜的横截面紧密且连续,并未观察到气孔或者缝隙。但是添加了EEGP的CS膜上侧出现带状絮状物。该条带随着EEGP含量的增加而变宽。这是CS-EEGP膜表面出现白点的原因,CS膜内部絮状物因聚集而形成突起。RIAZ等[4]将这种聚集归结于多酚的亲水性。

a-CS膜表面;b-CS-EEGP1薄膜表面;c-CS-EEGP3薄膜表面; d-CS-EEGP5薄膜表面;e-CS膜横截面;f-CS-EEGP1薄膜截面; g-CS-EEGP3薄膜截面;h-CS-EEGP5薄膜横截面
图2 CS基膜表面和横截面的SEM显微照片
Fig.2 SEM micrographs of the surface and cross-section of CS-based films
2.7 FT-IR光谱
通过FT-IR光谱研究CS基膜中CS和EEGP分子间相互作用,如图3所示,3 271.75 cm-1处的特征带是O—H和N—H的重叠振动,2 924.5、2 876.67、1 406.61 cm-1处的特征带对应于C—H的对称和非对称振动吸收峰[2,6,30]。此外,在1 635.87、1 548.76 cm-1处有2个条带分别对应于酰胺I带(酰胺基的C![]() O拉伸)和酰胺II带(N—H弯曲)[6,9]。1 064.84 cm-1处的强带和1 024.38 cm-1属于C—O伸缩,这是典型的糖类结构[30]。EEGP的FT-IR光谱在3 268.75 cm-1有一宽峰对应O—H拉伸,1 604.89 cm-1处为酚类化合物的特征带[18]。在1 500~1 250 cm-1处有一些谱带,表明苯环的存在。900~600 cm-1处的谱带是由苯环的取代基位置引起的。然而,EEGP的引入并没有显著改变CS膜的FT-IR光谱。值得注意的是,CS膜的特征谱带在3 271.75 cm-1处变宽,随着EEGP含量的增加,N—H弯曲谱带逐渐减小。这是由于多酚中含有丰富的羟基,这些羟基会与CS中的氨基或羟基形成分子间氢键[10,30]。此外,1 548.74 cm-1处的酰胺II带也略有移动。研究者在研究黑豆种皮提取物、紫色和黑色茄子提取物对CS膜FT-IR光谱的影响时发现,花青素的存在是CS膜谱带移动的主要因素,因为花青素中的羟基结构可以与CS分子相互作用[9,25]。
O拉伸)和酰胺II带(N—H弯曲)[6,9]。1 064.84 cm-1处的强带和1 024.38 cm-1属于C—O伸缩,这是典型的糖类结构[30]。EEGP的FT-IR光谱在3 268.75 cm-1有一宽峰对应O—H拉伸,1 604.89 cm-1处为酚类化合物的特征带[18]。在1 500~1 250 cm-1处有一些谱带,表明苯环的存在。900~600 cm-1处的谱带是由苯环的取代基位置引起的。然而,EEGP的引入并没有显著改变CS膜的FT-IR光谱。值得注意的是,CS膜的特征谱带在3 271.75 cm-1处变宽,随着EEGP含量的增加,N—H弯曲谱带逐渐减小。这是由于多酚中含有丰富的羟基,这些羟基会与CS中的氨基或羟基形成分子间氢键[10,30]。此外,1 548.74 cm-1处的酰胺II带也略有移动。研究者在研究黑豆种皮提取物、紫色和黑色茄子提取物对CS膜FT-IR光谱的影响时发现,花青素的存在是CS膜谱带移动的主要因素,因为花青素中的羟基结构可以与CS分子相互作用[9,25]。
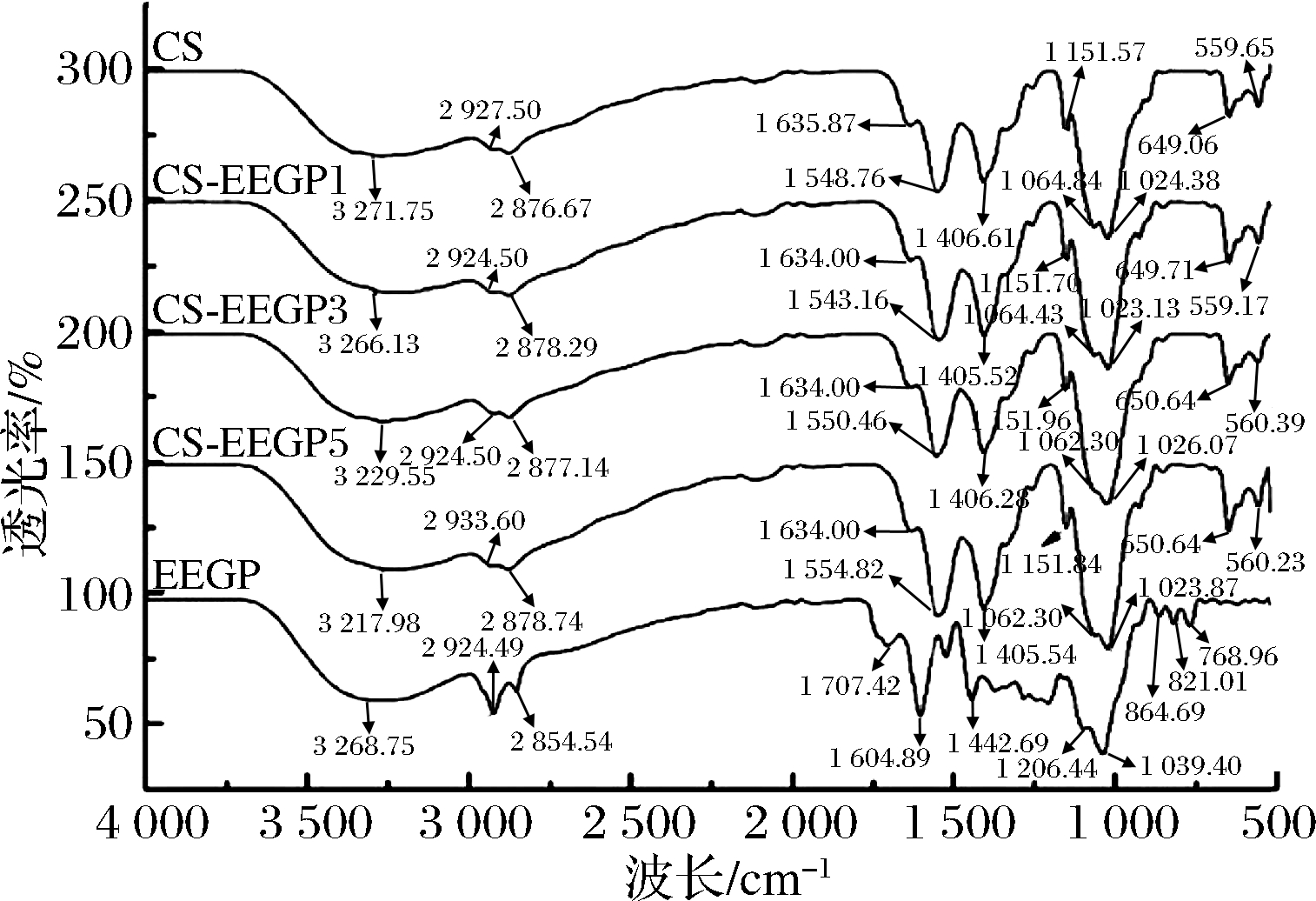
图3 CS膜、CS-EEGP膜和EEGP的FT-IR光谱
Fig.3 FT-IR spectras of CS film, CS-EEGP film and EEGP
2.8 XRD图谱
CS膜和CS-EEGP膜的X射线衍射图谱如图4所示。CS的结晶特征为非结晶、水合结晶和无水结晶[2]。在CS膜的XRD图谱上,CS膜在2θ=8.5°、11.5°、17.4°、18.0°和24.4°处出现5个衍射峰,表明CS薄膜具有半结晶特性。CS薄膜在2θ=8.5°、11.5°处出现衍射峰,这归因于水合物晶体结构,2θ=24.4°处的衍射峰对应于非晶态结构[9]。EEGP的图谱在21.0°左右有一宽峰对应EEGP的非晶态。值得注意的是,随着EEGP浓度的增加,CS-EEGP膜的衍射峰强度明显降低。当EEGP添加量增加到5%时,衍射峰消失并趋于平缓,表明薄膜的结晶度较低。这表明EEGP具有降低CS结晶度的作用。这与CS链与多酚之间新形成的分子间氢键有关。ZHANG等[10]认为结晶度的增加与添加物聚集有关,例如在CS膜中聚集的山竹皮粉展现出更强的衍射能力。这些不同的结果表明富含多酚的CS基膜的结晶性质会受提取物中多酚的含量和组成的影响[28]。

图4 CS膜、CS-EEGP膜和EEGP的XRD图谱
Fig.4 XRD patterns of CS film, CS-EEGP films and EEGP
2.9 膜的抗氧化活性
外界因素诱导产生的游离自由基是导致食品氧化变质的重要因素,因此活性食品包装膜应具备抗氧化能力[10]。EEGP中的多酚以花青素为主,其多羟基结构使其具有较强的供氢能力[10-11]。因此,将EEGP结合到CS膜中制备活性食品包装膜用以保护食品免受氧化损伤,延长食品货架期。CS基膜的自由基清除活性通过DPPH自由基和ABTS阳离子自由基清除率来评估。如图5所示,CS-EEGP膜的DPPH自由基和ABTS阳离子自由基清除能力呈剂量依赖性。随着EEGP含量的增加,CS-EEGP膜对DPPH自由基和ABTS阳离子自由基的清除能力显著提高(P<0.05)。CS膜清除DPPH自由基和ABTS阳离子自由基的能力分别为12.62%和15.91%。与CS膜相比,CS-EEGP5膜清除DPPH自由基和ABTS阳离子自由基的能力分别提高了20.54%和28.92%。CS基膜抗氧化活性的提高主要是由于天然提取物中的多酚能够通过提供苯酚氢清除自由基[24]。MENG等[23]认为DPPH自由基和ABTS阳离子自由基的高清除率与多酚在膜材中的良好释放效果有关。

图5 CS基膜对DPPH和ABTS自由基的清除活性
Fig.5 Scavenging activities of the CS-based films on DPPH and ABTS radicals 注:不同小写字母表示差异显著(P<0.05)
2.10 猪油的POV
图6表示被CS基薄膜包裹的猪油的氧化程度,未包装猪油作为对照组。与对照组相比,CS基膜包裹的猪油POV显著降低(P<0.05)。此外,当CS膜中EEGP的含量从0%增加到3%时,猪油的POV降低。第7天,与对照组和CS膜相比,CS-EEGP3膜的POV分别降低了88.27%和33.93%。这与图2观察到的CS-EEGP3膜结构致密有关,CS-EEGP3膜具有优异的氧阻隔性能,这将防止猪油被活性氧氧化。此外,CS-EEGP3膜释放出的多酚类物质也可减缓猪油的氧化酸败。然而,CS-EEGP5膜并没有表现出更好的延缓猪油氧化的效果。贮存6 d后,CS-EEGP5膜包裹的猪油POV高于CS膜,但明显低于对照组(P<0.05)。这是因为CS-EEGP5膜致密结构的破坏以及CS-EEGP膜加热过程中失水导致的透氧性增加[23]。尽管如此,CS-EEGP5膜的自由基清除能力仍能减缓猪油的氧化降解。MENG等[23]研究了桂皮胶/槐花提取物复合膜得出了与我们相似的结论,即添加天然提取物具有减缓猪油氧化的效果。总的来说,CS-EEGP膜具有良好的阻氧性能和抗氧化能力,在食品包装行业具有较好的应用前景。

图6 CS基膜包裹猪油的POV
Fig.6 POV of lard packed by CS-based films
2.11 膜的抑菌活性
由表4可知,所有膜对枯草芽孢杆菌和金黄色葡萄球菌均表现出抑制作用。CS膜抑菌圈直径最小代表其抑菌能力最弱,而EEGP的引入提高了CS膜的抑菌能力。随着EEGP含量的增加,CS-EEGP膜对枯草芽孢杆菌和金黄色葡萄球菌的抑菌区直径逐渐增大,分别从12.27 mm和11.27 mm增大到13.23 mm和16.83 mm。与CS膜相比,CS-EEGP5 膜对枯草芽孢杆菌和金黄色葡萄球菌的抑菌圈直径显著增加(P<0.05)。CS膜表现出的抗菌特性与CS是一种阳离子多糖有关[10]。其游离的氨基与细胞膜相互作用导致细胞液渗出,细胞死亡。而EEGP中多酚的存在不仅可以增加细胞膜通透性,还可干扰微生物遗传物质合成(如与DNA/RNA结合),从而达到抑制微生物生长[10]。但是,CS-EEGP 膜对大肠杆菌无明显抑制效果(P>0.05),这与3种食源性病原体的细胞结构不同有关。ZHANG等[10]认为革兰氏阳性菌和革兰氏阴性菌在细胞壁结构、细胞生理和代谢方面的差异是造成生物活性膜对革兰氏阳性菌的抗菌能力高于革兰氏阴性菌的原因。总的来说,CS-EEGP5膜对抑制微生物生长具有较好的效果。
表4 CS膜和CS-EEGP膜对3种食源性致病菌的抑菌活性
Table 4 Antimicrobial activity of CS and CS-EEGP films against three foodborne pathogens
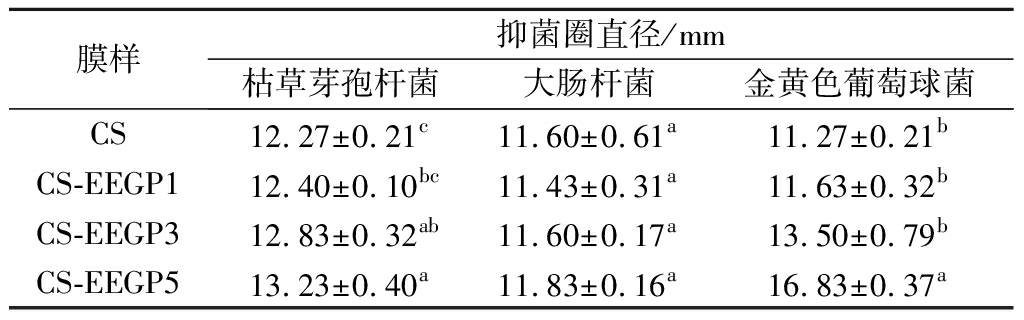
膜样抑菌圈直径/mm枯草芽孢杆菌大肠杆菌金黄色葡萄球菌CS 12.27±0.21c11.60±0.61a11.27±0.21bCS-EEGP112.40±0.10bc11.43±0.31a11.63±0.32bCS-EEGP312.83±0.32ab11.60±0.17a13.50±0.79bCS-EEGP513.23±0.40a11.83±0.16a16.83±0.37a
3 结论
将EEGP引入CS基材制备了活性包装膜。EEGP的加入显著提高了CS膜的厚度和不透明度,降低了CS膜的含水量、水溶性和机械性能。FT-IR光谱表明EEGP和CS之间形成了分子间氢键,这大大降低了CS-EEGP膜的结晶度。此外,CS-EEGP膜致密的微观结构使CS-EEGP3膜具有良好的水蒸气阻隔能力和阻氧能力。同时,EEGP丰富的原花青素使CS-EEGP膜表现出优异紫外可见光阻隔能力、抗氧化和抑菌能力。在贮藏第7天,包裹了CS-EEGP3膜猪油拥有更低的POV。这些结果表明,EEGP的加入可以改善CS膜的物化性能和生物活性。此外,需要进一步评价活性包装膜中活性组分活性作用的时效性,研究其对防止食品的氧化和腐败,延长食品货架期的影响。
[1] CUI H Y, SURENDHIRAN D, LI C Z, et al.Biodegradable zein active film containing chitosan nanoparticle encapsulated with pomegranate peel extract for food packaging[J].Food Packaging and Shelf Life, 2020, 24:100511.
[2] SUN L J, SUN J J, CHEN L, et al.Preparation and characterization of chitosan film incorporated with thinned young apple polyphenols as an active packaging material[J].Carbohydrate Polymers, 2017, 163:81-91.
[3] HASSAN B, CHATHA S A S, HUSSAIN A I, et al.Recent advances on polysaccharides, lipids and protein based edible films and coatings:A review[J].International Journal of Biological Macromolecules, 2018, 109:1 095-1 107.
[4] RIAZ A, LAGNIKA C, LUO H, et al.Chitosan-based biodegradable active food packaging film containing Chinese chive (Allium tuberosum) root extract for food application[J].International Journal of Biological Macromolecules, 2020, 150:595-604.
[5] BI F Y, ZHANG X, BAI R Y, et al.Preparation and characterization of antioxidant and antimicrobial packaging films based on chitosan and proanthocyanidins[J].International Journal of Biological Macromolecules, 2019, 134:11-19.
[6] LIU J, LIU S, WU Q Q, et al.Effect of protocatechuic acid incorporation on the physical, mechanical, structural and antioxidant properties of chitosan film[J].Food Hydrocolloids, 2017, 73:90-100.
[7] 吴丹. 壳聚糖-花色苷复合膜的制备及其性能研究[D].扬州:扬州大学, 2020.
WU D.Preparation and properties of chitosan-anthocyanins composite films[D].Yangzhou:Yangzhou University, 2020.
[8] OJAGH S M, REZAEI M, RAZAVI S H, et al.Development and evaluation of a novel biodegradable film made from chitosan and cinnamon essential oil with low affinity toward water[J].Food Chemistry, 2010, 122(1):161-166.
[9] WANG X C, YONG H M, GAO L, et al.Preparation and characterization of antioxidant and pH-sensitive films based on chitosan and black soybean seed coat extract[J].Food Hydrocolloids, 2019, 89:56-66.
[10] ZHANG X, LIU J, YONG H M, et al.Development of antioxidant and antimicrobial packaging films based on chitosan and mangosteen (Garcinia mangostana L.) rind powder[J].International Journal of Biological Macromolecules, 2020, 145:1 129-1 139.
[11] MONTEIRO G C, MINATEL I O, PIMENTEL A Jr, et al.Bioactive compounds and antioxidant capacity of grape pomace flours[J].LWT, 2021, 135:110053.
[12] ALVES V L C D, RICO B P M, CRUZ R M S, et al.Preparation and characterization of a chitosan film with grape seed extract-carvacrol microcapsules and its effect on the shelf-life of refrigerated Salmon (Salmo salar)[J].LWT, 2018, 89:525-534.
[13] TALADRID D, GONZ LEZ DE LLANO D, ZORRAQU
LEZ DE LLANO D, ZORRAQU N-PE
N-PE A I, et al.Gastrointestinal digestion of a grape pomace extract:impact on intestinal barrier permeability and interaction with gut microbiome[J].Nutrients, 2021, 13(7):2 467.
A I, et al.Gastrointestinal digestion of a grape pomace extract:impact on intestinal barrier permeability and interaction with gut microbiome[J].Nutrients, 2021, 13(7):2 467.
[14] 刘芸, 仇农学, 杨玺玉.葡萄皮渣提取物总酚含量及体外抗氧化活性、抑菌活性[J].食品科学, 2011, 32(1):5-9.
LIU Y, QIU N X, YANG X Y.Assessment of total phenolic content and in vitro antioxidant and antimicrobial activities of ethanol extract from grape residue left after making wine[J].Food Science, 2011, 32(1):5-9.
[15] 郭泽美. 葡萄皮渣多酚对食用油脂抗氧化效果的研究[D].杨凌:西北农林科技大学, 2012.
GUO Z M. The best harvest time of grape cabernet sauvignon and chardonnay in heshuo County, Xinjiang Province[D]. Yangling: Northwest A & F University, 2012.
[16] 彭惠惠, 李吕木.葡萄籽提取物作为肉制品保鲜剂的研究进展[J].食品与发酵工业, 2011, 37(1):128-132.
PENG H H, LI L M.Research progress of grape seed extract application in meat product preservation[J].Food and Fermentation Industries, 2011, 37(1):128-132.
[17] RIAZ A, LEI S C, AKHTAR H M S, et al.Preparation and characterization of chitosan-based antimicrobial active food packaging film incorporated with apple peel polyphenols[J].International Journal of Biological Macromolecules, 2018, 114:547-555.
[18] DE MORAES CRIZEL T, DE OLIVEIRA RIOS A, D ALVES V, et al.Active food packaging prepared with chitosan and olive pomace[J].Food Hydrocolloids, 2018, 74(1):139-150.
[19] 中国国家标准化管理委员会. GB/T 7921—2008 均匀色空间和色差公式[S].北京:中国标准出版社, 2008.
Standardization Administration of China.GB/T 7921—2008 Uniform color space and color difference formula[S].Beijing:China Standards Press, 2008.
[20] 中国国家标准化管理委员会. GB/T 1040—2006 塑料拉伸性能的测定[S].北京:中国标准出版社, 2006.
Standardization Administration of China.GB/T 1040—2006 Plastics-determination of tensile properties[S].Beijing:China Standards Press, 2006.
[21] GUO Y J, CHEN X H, YANG F J, et al.Preparation and characterization of chitosan-based ternary blend edible films with efficient antimicrobial activities for food packaging applications[J].Journal of Food Science, 2019, 84(6):1 411-1 419.
[22] RIAZ A, LAGNIKA C, ABDIN M, et al.Preparation and characterization of chitosan/gelatin-based active food packaging films containing apple peel nanoparticles[J].Journal of Polymers and the Environment, 2020, 28(2):411-420.
[23] MENG F S, ZHANG C J, LI J, et al.Self-assembling crystals of an extract of Flos Sophorae Immaturus for improving the antioxidant, mechanical and barrier properties of a cassia gum film-sciencedirect[J].International Journal of Biological Macromolecules, 2021, 167:1 281-1 289.
[24] LIU Y X, SONG R, ZHANG X H, et al.Enhanced antimicrobial activity and pH-responsive sustained release of chitosan/poly (vinyl alcohol)/graphene oxide nanofibrous membrane loading with allicin[J].International Journal of Biological Macromolecules, 2020, 161:1 405-1 413.
[25] YONG H M, WANG X C, ZHANG X, et al.Effects of anthocyanin-rich purple and black eggplant extracts on the physical, antioxidant and pH-sensitive properties of chitosan film[J].Food Hydrocolloids, 2019, 94:93-104.
[26] ADILAH A N, JAMILAH B, NORANIZAN M A, et al.Utilization of mango peel extracts on the biodegradable films for active packaging[J].Food Packaging and Shelf Life, 2018, 16:1-7.
[27] LIU Y J, CAI Y X, JIANG X Y, et al.Molecular interactions, characterization and antimicrobial activity of curcumin-chitosan blend films[J].Food Hydrocolloids, 2016, 52:564-572.
[28] YUAN G Q, JIA Y N, PAN Y X, et al.Preparation and characterization of shrimp shell waste protein-based films modified with oolong tea, corn silk and black soybean seed coat extracts[J].Polymer Testing, 2020, 81:106235.
[29] ZHANG X, LIU Y P, YONG H M, et al.Development of multifunctional food packaging films based on chitosan, TiO2 nanoparticles and anthocyanin-rich black plum peel extract[J].Food Hydrocolloids, 2019, 94:80-92.
[30] YONG H M, WANG X C, BAI R Y, et al.Development of antioxidant and intelligent pH-sensing packaging films by incorporating purple-fleshed sweet potato extract into chitosan matrix[J].Food Hydrocolloids, 2019, 90:216-224.