长期及过量饮酒会引起人体肝脏的酒精性损伤,其最初表现为酒精性脂肪肝,严重情况下会发展成酒精性肝炎、酒精性肝纤维化和酒精性肝硬化,最终引发肝癌[1]。目前全球约有5.3%的死亡与长期及过量饮酒有关,并且我国酒精性肝损伤的发病率呈逐年上升的趋势,已严重威胁到人类的健康[2]。长期及过量饮酒会显著降低线粒体中乙醛脱氢酶的活力,导致乙醇的代谢产物乙醛在肝脏中不断地累积。乙醛在肝脏中堆积会对肝脏中的线粒体结构和微管系统进行破坏,抑制肝脏中微粒蛋白的分泌与合成,从而导致蛋白和脂质在肝脏中的累积[3]。乙醛还会显著提高肝脏内活性氧(reactive oxygen species,ROS)的水平,ROS会破坏肝脏的氧化还原稳态,引起脂质过氧化,促进肝细胞凋亡,从而导致肝脏损伤[4]。因此,如何能够有效地保护肝脏免受酒精性损伤已成为目前医药和食品领域研究的热点。
姜黄素(curcumin,CUR)是一种从姜科姜黄属植物根茎中提取得到的脂溶性多酚类物质,其分子式为C21H20O6[5]。目前,姜黄素在食品工业中常用于制备香料、色素和抗氧化剂等食品添加剂,广泛应用于糕点、罐头、饮料等食品中。相关研究表明,姜黄素能够有效地调控细胞内的氧化应激反应,能提高细胞内相关抗氧化物质的表达量,能促进机体维持细胞内氧化还原稳态[6]。另外,姜黄素具有很好的护肝效应,可降低酒精、四氯化碳、硫代乙酰胺等各种化学药物引起的肝损伤[7-8]。但是,姜黄素的水溶性及生物利用度极低,这极大地限制了其在酒精性肝损伤防治方面的应用。为此本课题组在前期研究中利用β-环糊精聚合物(β-cyclodextrin polymer, CDP)作为载体,通过超分子化学作用制备得到了水溶性和抗氧化活性良好的CUR/CDP,并发现CUR/CDP对乙醇诱导LO2肝细胞的损伤具有保护作用,能够显著提高乙醇损伤后LO2细胞内谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)、超氧化物歧化酶(superoxide dismutase,SOD)的活力,并且显著降低LO2细胞内MDA和ROS的含量[9-11]。然而,关于其具体的保护作用机制尚未明晰。故在前期研究的基础上,本文通过流式细胞术、Western blot和ROS检测试剂盒考察CUR/CDP改善乙醇诱导LO2肝细胞损伤的作用机制,为其在保护酒精性肝损伤中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
姜黄素超分子包合物,实验室自制;姜黄素标准品,美国Sigma公司;细胞裂解液RAPI、BCA蛋白测试盒和ROS检测试剂盒、SDS-PAGE电泳液(Tris-Gly, Powder)、Western转膜液、TBSTw (TBS with Tween-20)、Western封闭液、Western一抗稀释液、Western二抗稀释液、极超敏ECL化学发光试剂盒、辣根过氧化物酶标记山羊抗大鼠免疫球蛋白G(immunoglobulins G,IgG)(H+L)(HRP-labeled Goat Anti-Rat IgG(H+L)、辣根过氧化物酶标记山羊抗兔IgG(H+L)和BeyoGelTM Plus PAGE预制胶(Tris-Gly, 8%, 10孔),碧云天生物技术有限公司;β-Actin抗体(C4)、p-MDM2抗体(2G2)、cyclin B1抗体(GNS1)、p-ATM抗体(10H11.E12)、p53抗体(DO-1)、γ-H2AX抗体(Ser 139)和p-p38 MAPK抗体(D-8),美国Santa Cruz Biotechnology公司;Phospho-p53 (Ser15),美国Antibody Cell signaling technology公司;重组Anti-p21抗体[EPR362],英国Abcam公司。胎牛血清、PBS、DMEM高糖培养基、0.25%胰蛋白酶溶液和双抗溶液,美国Gibco公司;LO2 细胞,美国ATCC公司;分析纯β-环糊精,山东新大精细化工有限公司;其他化学试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
AUW120电子天平,日本岛津公司;XRDKQ-500DB型数控超声波清洗机,昆山市超声仪器有限公司;Varioskan Flash多功能酶标仪,美国Thermo Fisher Scientific公司;DZF-6050真空干燥箱,上海一恒科学有限公司;HL-6数显恒温水浴锅,常州奥华仪器有限公司;Eppendorf 5810R冷冻离心机,德国Eppendorf公司;FD8508真空冷冻干燥机,韩国ilshin公司;FACS Aria流式细胞仪,美国Waters公司;Tanon 5200全自动化学发光图像分析系统,广州誉维生物科技仪器有限公司;EYELA旋转蒸发仪,日本EYELA公司。
1.3 实验方法
1.3.1 CUR/CDP的制备
CUR/CDP的具体制备方法参考CHEN等[9]的方法进行。称取15.76 g NaOH和20 g β-环糊精,加入32 mL H2O搅拌溶解,在30 ℃下缓慢加入环氧氯丙烷9.64 mL,搅拌24 h后,冷却至室温。经超声功率为80 W超声5 min后,将溶液倒入透析袋中透析至中性,抽滤去除不溶物,经0.45 μm纤维素膜过滤后旋蒸至黏稠状,加入无水乙醇析出白色固体,经过滤、真空干燥即得β-环糊精聚合物。将姜黄素和β-环糊精聚合物按质量比1∶4 研磨混匀,加入50 mL蒸馏水,在120 W下超声5 min后,经磁力搅拌2 d,将溶液抽滤、旋蒸和真空干燥,即得水溶性姜黄素超分子包合物。
1.3.2 细胞培养
LO2细胞经复苏后转移至DMEM高糖培养基(含10%胎牛血清和1%双抗溶液)中,并将细胞培养瓶置于37 ℃、5% CO2的培养箱中培养,待细胞密度长至80%左右时进行传代,取对数生长期的细胞用于后续的实验。
1.3.3 CUR/CDP对乙醇诱导LO2细胞损伤后细胞周期的影响
将密度为2×105 个细胞/mL的LO2细胞接种于6 cm培养皿中培养24 h,经10~80 μg/mL CUR/CDP处理细胞12 h后,去除培养基,加入5 mL 600 mmol/L乙醇培养细胞6 h。然后,细胞经胰酶消化后置于1 000 r/min下离心5 min,弃上清液,加入1 mL 70%冰乙醇,重悬细胞。将细胞悬液置于-20 ℃冰箱中过夜,次日,经1 000 r/min下离心5 min、弃上清液后,加入500 μL PI染料避光染色20 min后用流式细胞仪在激发波长为488 nm下进行检测。
1.3.4 Western blot检测蛋白表达情况
密度为2×105 个细胞/mL的细胞经10~80 μg/mL CUR/CDP处理12 h和5 mL 600 mmol/L乙醇处理6 h后,弃培养基,加入RIPA裂解液冰上孵育 30 min,4 ℃,10 000 r/min 离心30 min,取上清液得到蛋白样品,并用BCA试剂盒测其蛋白浓度。取25 μL 5×蛋白上样缓冲液于100 mL样品中,混匀后于95 ℃下加热5 min。然后,将混合样品经SDS-PAGE后,将其转移至PVDF膜上。PVDF膜经Western封闭液封闭2 h后,用TBST洗膜3次,每次5 min。加入目标蛋白抗体,振荡过夜。次日回收一抗,用TBST洗膜3次,每次5 min。再加入HRP标记的二抗孵育2 h,回收二抗,用TBST洗膜3次,每次 5 min。用ECL试剂盒进行化学发光,在Tanon 5200全自动化学发光仪上进行拍照,以β-actin作为内参。
1.3.5 CUR/CDP预处理对乙醇诱导ROS荧光强度变化的影响
将LO2细胞以10×104个细胞/mL的密度接种于24孔板中,每孔1 mL,培养24 h后,经10~80 μg/mL CUR/CDP培养12 h后用移液器去除培养液,加入1 mL 600 mmol/L乙醇培养6 h后,加入500 μL 浓度为10 μmol/L的DCFH-DA孵育30 min。用PBS洗涤3次,采用荧光倒置显微镜进行观察及拍照。
1.3.6 数据统计与分析
每次实验重复3次,实验数据均以平均值±标准差![]() 表示。实验结果采用SPSS 18.0软件进行统计学分析,采用单因素方差分析方法分析实验数据,差异显著的组间两两比较采用SNK方法,显著性水准为α=0.05[12]。
表示。实验结果采用SPSS 18.0软件进行统计学分析,采用单因素方差分析方法分析实验数据,差异显著的组间两两比较采用SNK方法,显著性水准为α=0.05[12]。
2 结果与分析
2.1 CUR/CDP预处理对乙醇诱导细胞周期变化的影响
本课题组前期研究表明,CUR/CDP对乙醇诱导LO2肝细胞的损伤具有保护作用[10]。为了进一步阐明其相关的保护作用机制,本文采用流式细胞仪对细胞的细胞周期分布进行检测。实验结果如图1、图2所示。由图1可知,空白对照组中细胞内G0/G1期、S期和G2/M期的细胞数目分别为(56.04±0.57)%、(35.13±0.46)%、(8.83±0.46)%。而乙醇处理组中细胞G0/G1期细胞数目从空白对照组的(56.04±0.57)%降低到(39.43±0.60)%,G2/M期的细胞数目从空白对照组的(8.83±0.46)%提高到(21.86±0.13)%。这表明细胞经乙醇处理后能显著诱导细胞发生G2/M期细胞周期阻滞,使得G0/G1期细胞数目显著减少。而经10~80 μg/mL CUR/CDP对细胞进行预处理后,能显著降低乙醇诱导的G2/M阻滞,细胞数量分别从乙醇处理组的(21.86±0.13)%分别下降到(14.11±0.47)%、(11.75±0.32)%、(6.64±0.55)%和(4.76±0.36)%。上述结果表明,CUR/CDP能够通过降低G2/M期细胞数量来改善乙醇诱导的LO2细胞损伤。

a-空白对照组;b-乙醇处理组;c-10 μg/mL CUR/CDP+乙醇组;d- 20 μg/mL CUR/CDP +乙醇组;e- 40 μg/mL CUR/CDP+乙醇组; f- 80 μg/mL CUR/CDP +乙醇组
图1 CUR/CDP预处理对乙醇诱导的细胞周期分布的影响
Fig.1 Effects of CUR/CDP pretreatment on ethanol-induced cell cycle distribution
2.2 CUR/CDP预处理对乙醇诱导细胞周期蛋白cyclin B1及p21蛋白变化的影响
众所周知,细胞周期是指细胞从上一次分裂完成开始到下一次分裂结束的全过程,是机体细胞正常生长中的基本过程,主要由DNA合成以及细胞分裂组成,其可分为G1期、S期、G2期和M期[13]。机体细胞的细胞周期进程会严格受到细胞周期蛋白(cyclin)与相应的细胞周期蛋白依赖性激酶(cyclin-dependent kinase, CDK)复合物的严格调控[14]。cyclin通过与相应的CDK结合形成cyclin-CDK复合物从而将CDK激活,进而推动细胞周期的进程。其中,细胞周期由G2期向M期的转换进程是由cyclin B1-CDK1复合物严格调控的,而CDK1活性需要依赖cyclin B1含量的积累,即只有cyclin B1含量积累到一定程度时,与CDK1结合后激活CDK1,从而cyclin B1-CDK1复合物的活性才会被激活[15]。研究发现,cyclin-CDK复合物的活性会受到CDK抑制剂Cip/Kip家族蛋白如p21等的负向调节,Cip/Kip家族蛋白主要是通过抑制cyclin-CDK复合物的活性将细胞周期阻滞停留在某一时期[16]。p21是一种G2/M期周期蛋白依赖性激酶抑制因子,能够抑制细胞周期蛋白依赖性激酶的活性,阻止其发挥作用,从而引起机体细胞发生G2/M期阻滞[17]。
为了进一步验证流式细胞实验的结果,本研究进一步采用Western blot技术检测了与G2/M阻滞相关的p21和cyclin B1蛋白表达水平。实验结果如图3所示。由图3可知,相比空白对照组,乙醇处理组中p21的蛋白表达量从空白对照组的(60.28±3.99)%升高至(100.00±1.50)%,而细胞周期蛋白cyclin B1的表达量从空白对照组的(100.00±1.50)%降低至(26.01±7.84)%。经不同浓度的CUR/CDP处理后,能够显著下调乙醇诱导的p21蛋白表达量的上升并上调乙醇诱导的细胞周期蛋白cyclin B1表达量的下降。上述结果表明,CUR/CDP能够通过抑制p21蛋白的表达和促进cyclin B1的表达使得G2/M细胞数量减少从而改善乙醇诱导的G2/M细胞周期阻滞。

A-空白对照组;B-乙醇处理组;C-10 μg/mL CUR/CDP+乙醇组; D-20 μg/mL CUR/CDP+乙醇组;E-40 μg/mL CUR/CDP+乙醇组; F-80 μg/mL CUR/CDP+乙醇组(下同)
图2 CUR/CDP预处理对不同细胞周期中细胞含量的影响
Fig.2 Effect of CUR/CDP pretreatment on cell content in different cell cycles 注:不同小写字母间存在显著差异(P<0.05)(下同)
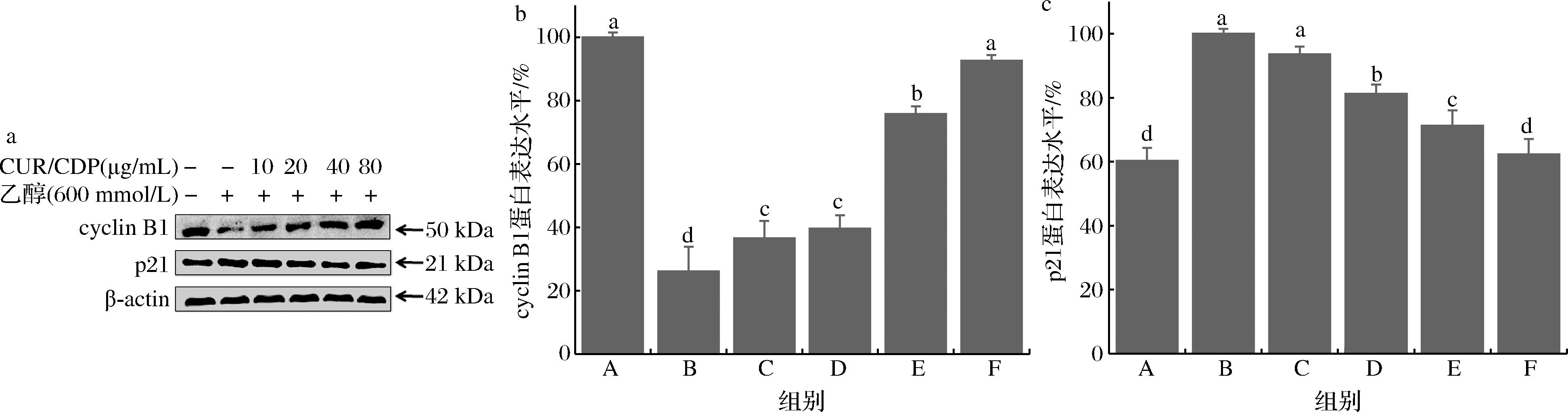
a-不同处理组的cyclinB1和p21蛋白条带;b-不同处理组的cyclin B1蛋白表达水平;c-不同处理组的p21蛋白表达水平
图3 CUR/CDP预处理对乙醇损伤LO2细胞的cyclin B1及p21蛋白表达水平的影响
Fig.3 Effects of CUR/CDP pretreatment on the expression levels of cyclin B1 and p21 proteins in ethanol injured LO2 cells
2.3 CUR/CDP预处理对乙醇诱导DNA损伤及其调控蛋白表达水平的影响
研究发现,当细胞内DNA受到损伤无法及时修复DNA时,会引发细胞周期无法从一个阶段向下一个阶段转变,从而引起细胞周期阻滞[18]。DNA受到损伤后,与DNA关联密切的H2AX会在细胞内发生一系列应激反应,最终导致H2AX的磷酸化形成γ-H2AX。故γ-H2AX被认为是机体组织及细胞中DNA受到损伤的特定标志物之一[19]。此外,细胞内DNA的损伤会引起ATM蛋白磷酸化水平的升高从而诱导细胞发生凋亡或阻滞[20]。故本文运用Western blot进一步检测与DNA损伤相关的γ-H2AX和p-ATM蛋白表达水平。实验结果如图4所示,相比空白对照组,乙醇处理后能显著上调与DNA损伤有关的下游蛋白p-ATM和γ-H2AX的表达量,表明乙醇作用于LO2细胞后细胞内DNA受到损伤导致其下游蛋白表达量的升高。而经不同浓度的CUR/CDP处理后,p-ATM和γ-H2AX的蛋白表达量从乙醇处理组的(100.00±1.50)%和(100.00±1.50)%分别下降到(83.22±1.80)%、(63.47±4.80)%、(47.96±2.32)%、(37.11±2.09)%和(85.40±4.63)%、(73.82±5.44)%、(50.21±1.78)%和(41.90±4.15)%。上述结果表明,经CUR/CDP处理细胞后能减轻细胞内乙醇诱导的DNA损伤。

a-不同处理组的γ-H2AX和p-ATM蛋白条带;b-不同处理组的γ-H2AX蛋白表达水平;c-不同处理组的p-ATM蛋白表达水平
图4 CUR/CDP预处理对乙醇诱导DNA损伤的相关调控蛋白表达水平的影响
Fig.4 Effects of CUR/CDP pretreatment on expression levels of DNA damage-related regulation proteins induced by ethanol
2.4 CUR/CDP预处理对乙醇诱导p53及其上游蛋白表达水平的影响
研究发现,p53是一种肿瘤抑制因子,DNA损伤可以使p53发生磷酸化,磷酸化后的p53能够通过激活p21蛋白抑制cyclin-CDK复合物的活性从而诱导细胞发生细胞周期阻滞[21]。同时,DNA损伤也能导致MDM2含量减少,后者能够催化p53单泛素化和多泛素化导致p53降解,从而诱导p53失活[22]。此外,p53也受到上游蛋白p38MAPK的调控,后者参与了调控细胞周期及诱导细胞凋亡等生理过程,能够诱导细胞发生G2/M细胞周期阻滞[23]。因此,为了进一步验证上述实验结果,本文采用Western blot技术对p53蛋白及其上游蛋白MDM2和p38MAPK的磷酸化水平进行了检测。实验结果如图5所示。相比空白对照组,乙醇处理后能显著上调p-p53和p-p38MAPK的蛋白表达量,同时显著下调p-MDM2蛋白的表达量,表明乙醇作用于LO2细胞后启动了p53信号通路及其上游的相关蛋白,继而引发细胞发生G2/M阻滞。而经不同浓度的CUR/CDP处理后,能够下调乙醇诱导细胞内的p-p53和p-p38MAPK蛋白表达量,分别从乙醇处理组的(100.00±1.50)%和(100.00±1.50)%下降到(92.56±4.37)%、(78.38±8.23)%、(63.07±5.73)%、(48.76±2.63)%和(89.67±3.06)%、(82.72±5.54)%、(69.26±4.71)%、(62.99±3.08)%,呈现出明显地剂量效应。上述结果表明,CUR/CDP通过减轻DNA损伤导致其下游蛋白p-p53和p-p38MAPK的表达水平下调抑制乙醇诱导细胞发生的G2/M阻滞。

a-不同处理组的p-p38MAPK、p-MDM2、p53和p-p53蛋白条带;b-不同处理组的p-p38MAPK蛋白表达水平; c-不同处理组的p-MDM2蛋白表达水平;d-不同处理组的p-53蛋白表达水平;e-不同处理组的p-p53蛋白表达水平
图5 CUR/CDP预处理对p53、p-p53、p-p38MAPK和p-MDM2蛋白表达水平的影响
Fig.5 Effects of CUR/CDP pretreatment on the expression levels of p53, p-p53, p-p38MAPK and p-MDM2 proteins
2.5 CUR/CDP预处理对乙醇诱导ROS荧光强度变化的影响
研究表明,当肝脏受到过量乙醇刺激时,肝细胞内ROS含量会显著增加,从而导致细胞内DNA发生损伤[24]。同时,ROS也能促进p38MAPK的活化从而诱导细胞发生G2/M期细胞周期阻滞[25]。为了验证上述结论,本研究通过检测DCFH-DA在细胞内的荧光强度来反映细胞内ROS的水平。当细胞内 ROS含量增多时,DCFH-DA的绿色荧光强度会增强,当LO2细胞内ROS含量减少时,DCFH-DA的绿色荧光强度会减弱。实验结果如图6所示,与空白对照组相比,乙醇处理组中细胞内DCFH-DA的绿色荧光强度较强,表明乙醇处理细胞后显著提高了细胞内ROS的含量。经10~80 μg/mL CUR/CDP处理后,LO2细胞内DCFH-DA的绿色荧光强度逐渐减弱,这表明CUR/CDP能够显著降低乙醇诱导细胞内ROS的产生,并呈现出剂量效应。上述实验结果表明,活性氧是乙醇诱导细胞发生G2/M阻滞的源头,而姜黄素超分子包合物通过降低细胞内活性氧的含量来改善乙醇诱导的肝细胞损伤。

图6 CUR/CDP预处理对乙醇诱导的ROS荧光强度的影响
Fig.6 Effects of CUR/CDP pretreatment on ROS fluorescence intensity induced by ethanol
2.6 CUR/CDP预处理改善乙醇诱导肝损伤可能涉及的信号通路
基于上述研究结果,本文构建了CUR/CDP改善乙醇诱导LO2肝细胞损伤涉及的信号通路图,如图7所示,乙醇作用LO2肝细胞后,细胞内ROS含量急剧增加,导致细胞内DNA损伤从而引起γ-H2AX、p-ATM蛋白水平的上调和p-MDM2蛋白水平的下调。同时ROS含量的增加也上调了p-p38MAPK蛋白的表达水平。两者的共同作用促进了下游蛋白p53的磷酸化,活化后的p53蛋白能够上调p21蛋白的表达量。后者通过下调cyclin B1蛋白的表达从而抑制cyclin B1-CDK复合物的活性导致细胞发生G2/M细胞周期阻滞。而经CUR/CDP处理后,CUR/CDP从源头上降低了细胞内ROS的含量,从而减弱了DNA的损伤,避免了DNA下游相关蛋白变化引发的G2/M期细胞阻滞,最终改善了乙醇诱导的肝细胞损伤。

图7 CUR/CDP改善乙醇诱导LO2细胞损伤涉及的信号通路图
Fig.7 Signaling pathways involved in CUR/CDP improving injury of LO2 cells induced by ethanol
3 结论
本文通过流式细胞术、Western blot和检测LO2肝细胞内ROS的荧光强度考察CUR/CDP改善乙醇诱导LO2肝细胞损伤的作用机制。实验结果发现,CUR/CDP能够通过降低细胞内G2/M期的细胞数量抑制乙醇诱导的G2/M期阻滞。进一步对其相关蛋白和细胞内ROS含量进行检测发现,CUR/CDP通过降低细胞内ROS含量减轻DNA损伤引发其下游蛋白p-ATM、γ-H2AX、p-p53和p-p38MAPK表达水平的下调抑制乙醇诱导的G2/M期阻滞,最终避免细胞出现肝损伤。上述结果证实,CUR/CDP对乙醇诱导的肝细胞损伤具有保护作用,为其今后的临床应用与开发提供了理论基础和数据参考。
[1] 左军, 唐明哲, 韩淑丽, 等.中医药治疗酒精性肝损伤的研究进展[J].中医药信息, 2017, 34(3):124-128.
ZUO J, TANG M Z, HAN S L, et al.Research progress on treatment of alcoholic liver injury with traditional Chinese medicine[J].Information on Traditional Chinese Medicine, 2017, 34(3):124-128.
[2] World Health Organization.Global status report on alcohol and health 2018[EB/OL].[2020-07-10].https://apps.who.int/iris/handle/10665/274603.
[3] TESCHKE R.Alcoholic liver disease:Alcohol metabolism, cascade of molecular mechanisms, cellular targets, and clinical aspects[J].Biomedicines, 2018, 6(4):106.
[4] LEUNG T M, NIETO N.CYP2E1 and oxidant stress in alcoholic and non-alcoholic fatty liver disease[J].Journal of Hepatology, 2013, 58(2):395-398.
[5] CHEN X, ZOU L Q, NIU J, et al.The stability, sustained release and cellular antioxidant activity of curcumin nanoliposomes[J].Molecules, 2015, 20(8):14 293-14 311.
[6] KENSLER T W, WAKABAYASHI N.Nrf2:Friend or foe for chemoprevention?[J].Carcinogenesis, 2009, 31(1):90-99.
[7] CREMERS N A J, LUNDVIG D M S, VAN DALEN S C M, et al.Curcumin-induced heme oxygenase-1 expression prevents H2O2-induced cell death in wild type and heme oxygenase-2 knockout adipose-derived mesenchymal stem cells[J].International Journal of Molecular Sciences, 2014, 15(10):17 974-17 999.
[8] 张媛媛, 宋理平, 郭辉, 等.姜黄素对四氯化碳诱导鲤肝脏损伤的修复作用[J].广东海洋大学学报, 2020, 40(5):1-11.
ZHANG Y Y, SONG L P, GUO H, et al.Research of curcumin on recovery effect of liver injury in cyprinus carpio induced by carbon tetrachloride[J].Journal of Guangdong Ocean University, 2020, 40(5):1-11.
[9] CHEN J P, QIN X M, ZHONG S Y, et al.Characterization of curcumin/cyclodextrin polymer inclusion complex and investigation on its antioxidant and antiproliferative activities[J].Molecules, 2018, 23(5):1 179.
[10] 范土贵, 陈建平, 高加龙, 等.姜黄素超分子包合物对乙醇诱导LO2细胞损伤的保护作用[J].食品工业科技, 2021,42(18):366-371.
FAN T G, CHEN J P, GAO J L, et al, Protective effect of curcumin/cyclodextrin polymer inclusion complex on LO2 cells damaged by ethanol[J].Science and Technology of Food Industry, 2021,42(18):366-371.
[11] 陈建平, 钟赛意, 秦小明, 等.负载姜黄素β-环糊精功能化纳米银诱导HepG2细胞凋亡机制[J].广东海洋大学学报, 2019, 39(1):78-83.
CHEN J P, ZHONG S Y, QIN X M, et al.Preliminary study on the molecular mechanism of cyclodextrin functional silver nanoparticles-loaded curcumin induced HepG2 cells apoptosis[J].Journal of Guangdong Ocean University, 2019, 39(1):78-83.
[12] 陈文莹, 陈江碧, 周吉发, 等.四种调味蔬菜对红酸汤烹调中全反式番茄红素含量的影响[J].中国调味品,2020, 45(1):67-71.
CHEN W Y, CHEN J B, ZHOU J F, et al.Effect of four seasoning vegetables on the content of all-trans lycopene in cooking process of red sour soup[J].China Condiment, 2020, 45(1):67-71.
[13] MIN A, KIM J E, KIM Y J, et al.Cyclin E overexpression confers resistance to the CDK4/6 specific inhibitor palbociclib in gast ric cancer cells[J].Cancer Letters, 2018, 430:123-132.
[14] RUBIO C, MARTíNEZ-FERN NDEZ M, SEGOVIA C, et al.CDK4/6 inhibitor as a novel therapeutic approach for advanced bladder cancer independently of RB1 status[J].Clinical Cancer Research, 2019, 25(1):390-402.
NDEZ M, SEGOVIA C, et al.CDK4/6 inhibitor as a novel therapeutic approach for advanced bladder cancer independently of RB1 status[J].Clinical Cancer Research, 2019, 25(1):390-402.
[15] ARELLANO M, MORENO S.Regulation of CDK/cyclin complexes during the cell cycle[J].International Journal of Biochemistry & Cell Biology, 1997, 29(4):559-573.
[16] TANE S, IKENISHI A, OKAYAMA H, et al.CDK inhibitors, p21(Cip1) and p27(Kip1), participate in cell cycle exit of mammalian cardiomyocytes[J].Biochemical and Biophysical Research Communications, 2014, 443(3):1 105-1 109.
[17] TEWARI D, LLOYD-JONES K, HIDER R C, et al.HPO iron chelator, CP655, causes the G1/S phase cell cycle block via p21 upregulation[J].Immunity Inflammation and Disease, 2020,8(4):568-583.
[18] 陈建平. 右旋龙脑促进姜黄素类化合物抑制HepG2肝癌细胞增殖的分子机制研究[D].广州:华南理工大学, 2015.
CHEN J P.Molecular mechanism underlying natural borneol-potentiated curcuminoids inhibiting HepG2 human hepatocellular carcinoma cells growth[D].Guangzhou:South China University of Technology, 2015.
[19] OHBA S, JOHANNESSEN T C A, CHATLA K, et al.Phosphoglycerate mutase 1 activates DNA damage repair via regulation of WIP1 activity[J].Cell Reports, 2020,31(2):107518.
[20] MATEI I R, GUIDOS C J, DANSKA J S.ATM-dependent DNA damage surveillance in T-cell development and leukemogenesis:The DSB connection[J].Immunological Reviews, 2006, 209(1):142-158.
[21] STEWART Z A, PIETENPOL J A.P53 signaling and cell cycle checkpoints[J].Chemical Research in Toxicology, 2001, 14(3):243-263.
[22] CHAO C C K.Mechanisms of p53 degradation[J].Clinica Chimica Acta, 2015, 438:139-147.
[23] BUBICI C, PAPA S.JNK signalling in cancer:In need of new, smarter therapeutic targets[J].British Journal of Pharmacology, 2014, 171(1):24-37.
[24] TANG J Y, HE A H, JIA G, et al.Protective effect of selenoprotein X against oxidative stress-induced cell apoptosis in human hepatocyte (LO2) cells via the p38 pathway[J].Biological Trace Element Research, 2018, 181(1):44-53.
[25] LI D W, DAI C S,YANG X Y, et al.GADD45a regulates olaquindox-induced DNA damage and s-phase arrest in human hepatoma G2 cells via JNK/p38 pathways[J].Molecules, 2017, 22(1):124.