刺梨 (Rosa roxburghii Tratt) 为蔷薇科蔷薇属野生植物[1],广泛分布于中国西南部和中南部山区,富含维生素 C、超氧化歧化酶(superoxide dismutase,SOD)、多糖、黄酮、多酚、三萜类化合物等多种活性成分[2],具有抗氧化、防癌、防治重金属毒性、抗衰老、降血脂等多种功效[3-4]。益生性的乳酸菌(lactic acid bacteria,LAB)对人体健康的作用持续受到国内外研究者的广泛关注,研究表明,利用一些益生乳酸菌株发酵果制品,不但具有特殊风味与口感,还提高了果蔬制品的营养价值[5]。但是,目前有关乳酸菌发酵刺梨的研究还鲜有报道。
糖尿病是一种以高血糖为特征的代谢性疾病,由环境、遗传、胰岛素分泌与作用不足等因素共同作用所致,并伴随着肥胖、心血管疾病、肾功能衰竭、高血压、脑梗塞、胰腺炎等并发症,是严重威胁人类健康的第三大疾病。根据国际糖尿病联盟统计,中国-东盟地区糖尿病患病人数位居全球第一位,对于糖尿病的预防和治疗的研究已刻不容缓[6-7]。而肥胖是脂肪过度积蓄导致机体超重的一种慢性代谢类疾病,还会导致其他慢性疾病的发展,如非酒精性脂肪性肝病、二型糖尿病和心血管疾病[8]。
本研究利用前期实验筛选出的发酵刺梨性能较好的3株乳酸菌(副干酪乳杆菌SR10-1、干酪乳杆菌H1和发酵乳杆菌GZSC-1),通过体外抑制α-葡萄糖苷酶活性与葡萄糖延迟透析指数评价3株乳酸菌的菌悬液、胞外分泌物和乳酸菌发酵刺梨汁体外降血糖的能力;以胆酸盐结合能力、抑制胰脂肪酶活性与结合胆固醇胶束的能力来评价体外降血脂的能力。为研究乳酸菌发酵刺梨汁功能特性提供依据,为筛选功能菌株开发发酵型刺梨制品提供数据支撑。
1 材料与方法
1.1 试验材料
刺梨汁:刺梨鲜果经打浆、过滤、超高温瞬时灭菌(ultra-high temperature instantaneous sterilization,UHT)灭菌后无菌灌装,取1 000 g/袋1~2袋备用;副干酪乳杆菌SR10-1(Lactobacillus paracasei SR10-1)(CCTCC NO:M2016527),为课题组前期从侗族发酵酸肉制品中分离得到[9];干酪乳杆菌H1(Lactobacillus casei H1,CCTCC NO:M2016524),由课题组从苗族酸汤中分离鉴定所得优势乳酸菌;发酵乳杆菌(Lactobacillus fermentum GZSC-1),为实验室保藏菌种;透析袋MD34(7 000 D),北京索莱宝科技有限公司。
1.2 试验试剂
α-葡萄糖苷酶(α-glucosidase),上海源叶生物科技有限公司;蒽酮、对硝基苯-α-D-葡萄糖苷、甘氨胆酸钠、牛磺胆酸钠,上海麦克林生化科技有限公司;胃蛋白酶1∶3 000、胰蛋白酶1∶250、胆固醇、卵磷脂(大豆),北京索莱宝科技有限公司;猪胰脂肪酶,上海阿拉丁生化科技股份有限公司;氯化钠、碳酸钠、油酸、磷酸氢二钠、磷酸二氢钠、酚酞、无水乙醇、硫酸、氢氧化钠、盐酸均为分析纯;MRS培养基、MRS肉汤培养基,北京路桥技术股份有限公司。
1.3 仪器与设备
AR223CN电子分析天平,奥豪斯仪器(常州)有限公司;TGL20M台式高速冷冻离心机,上海安亭科学仪器厂;L5S紫外可见分光光度计、雷磁PHS-3C test0205 PH计,上海仪电分析仪器有限公司;数显恒温水浴锅、HPX-9082 MBE 数显电热培养箱、立式灭菌锅BXM-30R,上海博讯实业有限公司医疗设备厂;MB1001 型多功能食品加工机,上海云辉电器有限公司;数字折射计,浙江托普云农科股份有限公司;超净工作台SW-CJ-IFD,苏州苏洁净化设备有限公司。
1.4 试验方法
1.4.1 发酵剂的制备
无菌条件下分别接种副干酪乳杆菌SR10-1、干酪乳杆菌H1和发酵乳杆菌GZSC-1至MRS肉汤培养基中,置于37 ℃分别培养48、24、60 h,然后分别离心收集菌体,用0.85%的生理盐水调整菌液浓度为109 CFU/mL备用。
1.4.2 乳酸菌菌悬液与胞外分泌物的制备
无菌条件下接种乳酸菌至MRS肉汤培养基中,置于37 ℃无菌培养箱培养(SR10-1培养48 h,H1培养24 h,GZSC-1培养60 h),离心收集菌体与上清液,上清液为乳酸菌胞外分泌物;用0.85%的生理盐水调整菌液浓度为109 CFU/mL,即为乳酸菌菌悬液。
1.4.3 乳酸菌发酵刺梨汁的制备
每个菌株按照预实验已优化的发酵工艺制备发酵刺梨汁如下:
(1)副干酪乳杆菌SR10-1发酵刺梨汁的制备
将刺梨汁与水按体积比1∶4混合,加入9.7%(质量分数)白砂糖,接入4.3% SR10-1,于32 ℃发酵64.5 h,离心取上清液,即为SR10-1发酵刺梨汁样品。
(2)干酪乳杆菌H1发酵刺梨汁的制备
将刺梨汁与水按体积比1∶3 混合,加入20%白砂糖,接入5% H1,于25 ℃发酵72 h,离心取上清液,即为H1发酵刺梨汁样品。
(3)发酵乳杆菌GZSC-1发酵刺梨汁的制备
将刺梨汁与水按体积比1∶3 混合,加入15%白砂糖,接入3% GZSC-1,于30 ℃发酵40 h,离心取上清液,即为GZSC-1发酵刺梨汁样品。
1.4.4 体外降血糖活性的测定
1.4.4.1 α-葡萄糖苷酶抑制率的测定
参考KUMAR等[10]的方法略有改动,取100 μL一定浓度的样液,加入50 μL使用pH=7.0 PBS缓冲溶液配制的1 U/mL 的α-葡萄糖苷酶,在37 ℃的条件下孵育15 min,以50 μL 10 g/L的对硝基苯α-D-葡萄糖苷作为底物,混匀后于37 ℃ 进行水浴10 min,最后用100 μL 0.1 mol/L的 Na2CO3终止反应,在405 nm处测量吸光度,记为A1,将不加酶的作为对照,记为A2,不受抑制的酶作为空白,记为A3。以样品的浓度为自变量,α-葡萄糖苷酶抑制率为因变量,进行一次曲线拟合,根据拟合方程计算IC50值,如公式(1)所示:
α-葡萄糖苷酶抑制率![]()
(1)
1.4.4.2 葡萄糖透析延迟指数(glucose dialysis retardation index,GDRI)的测定
参考DAOU等[11]的方法。在10 mL 100 mmol/L 的葡萄糖溶液中加入1 mL样品,在37 ℃ 下恒温连续振荡1 h,之后转移至截留分子量为7 000的透析袋中,将透析袋放入盛有150 mL去离子水的烧杯中,在37 ℃下恒温连续振荡1 h,每隔30 min吸取2 mL样液,使用蒽酮-硫酸法测定葡萄糖含量。样品对空肠营养吸收的的影响用GDRI来表示,计算如公式(2)所示:
(2)
式中:GDRI为葡萄糖透析延迟指数,%;C1为样品中葡萄糖含量,g/L;C2为对照葡萄糖含量,g/L
1.4.4.3 葡萄糖含量的测定
使用蒽酮硫酸法并稍作修改[12],取0.1 g蒽酮放入80%浓硫酸中配制成0.1%蒽酮硫酸溶液,现配现用。取2 mL一定浓度样品于具塞比色管中,加入6 mL 0.1%蒽酮硫酸溶液,混匀后沸水浴显色15 min,之后用冰水浴至室温,于620 nm处测吸光度。取6个具塞比色管,分别加入0.1 g/L葡萄糖溶液0、0.2、0.4、0.6、0.8、1.2 mL,相对应的分别加入蒸馏水 2.0、1.8、1.6、1.4、1.2、0.8 mL,以上述方法测定葡萄糖含量,以吸光度为纵坐标,葡萄糖含量为横坐标绘制标准曲线,样品以标准曲线计算葡萄糖含量。
1.4.5 体外降血脂活性的测定
1.4.5.1 结合胆酸盐能力的测定
根据钱雅雯等[13]方法有所修改。将甘氨胆酸钠分别配制为0.03、0.06、0.09、0.12、0.18、0.24、0.3 mmol/L的标准溶液;将牛磺胆酸钠分别配制为 0.05、0.1、0.15、0.2、0.25、0.3 mmol/L的标准溶液,现配现用。分别取2 mL胆酸盐标准溶液于25 mL具塞试管中,加入60% H2SO4于70 ℃水浴40 min,取出冰浴5 min,387 nm处测定其吸光度,以溶液浓度为横坐标,吸光度为纵坐标,分别绘制甘氨胆酸钠与牛磺胆酸钠的标准曲线图。
取3 mL不同浓度的样品放入三角瓶中,加入3 mL 10 g/L胃蛋白酶与1 mL 0.01 mol/L盐酸,在37 ℃ 恒温振荡箱中振荡1 h,模拟胃部消化;用0.1 mol/L NaOH调节pH至6.3,加入4 mL 10 g/L胰蛋白酶,在37 ℃恒温振荡箱中振荡1 h,模拟肠消化。一份三角瓶加入4 mL 0.4 mmol/L甘氨胆酸钠,另一份加入4 mL 0.5 mmol/L牛磺胆酸钠,于37 ℃下恒温振荡1 h,之后4 000 r/min离心20 min,取上清液2 mL,用硫酸比色法测定胆酸盐含量,计算如公式(3)和公式(4)所示:
(3)
(4)
式中:R1为甘氨胆酸钠结合能力,mmol/mL;N1为甘氨胆酸钠加入量,mmol;N2为甘氨胆酸钠剩余量,mmol;V1为样品加入体积,mL;A为样品稀释倍数;R2为牛磺胆酸钠结合能力,mmol/mL;N3为牛磺胆酸钠加入量,mmol;N4为牛磺胆酸钠剩余量,mmol;V2为样品加入体积,mL。
1.4.5.2 抑制胰脂肪酶活性的测定
根据文献方法[14]稍做修改。在三角瓶中加入2.5 mL 0.025 mol/L PBS(pH=7.4)与1 mL 聚乙烯醇三油酸甘油酯乳化液,在37 ℃生化培养箱中预热10 min,预热后加入1 mL样品在37 ℃放置10 min,之后加入1 mL 100 g/L猪胰脂肪酶(使用pH=7.4,0.025 mol/L PBS溶液配制),放入37 ℃恒温培养箱中反应15 min,反应结束后立刻加入10 mL 95%无水乙醇,终止酶反应,加入酚酞指示剂3滴,使用0.025 mol/L的NaOH溶液滴至微红,空白组不加胰脂肪酶与样品,对照组加样品但是不加胰脂肪酶,使用公式(5)计算脂肪酶活性:
(5)
式中:U为每克胰脂肪酶中所含酶活力,IU;V1为样品组消耗NaOH溶液的体积,mL;V2为空白组消耗NaOH溶液的体积,mL;V3为对照组消耗NaOH溶液的体积,mL;c为NaOH标准溶液的浓度,mol/L;t为加入胰脂肪酶后的反应时间,min;w为胰脂肪酶的添加量,g
测出酶活性之后,利用公式(6)计算其抑制率:
胰脂肪酶酶活抑制率/%
(6)
1.4.5.3 结合胆固醇胶束能力的测定
参照文献[15],将胆固醇、油酸与卵磷脂溶于甲醇中,溶解干燥后加入牛磺胆酸钠、NaCl与15 mmol/L PBS(pH=7.4)缓冲溶液,使1 mL胆固醇胶束中含10 mmol/L牛磺胆酸钠、5 mmol/L胆固醇、5 mmol/L油酸、2.4 mmol/L卵磷脂、132 mmol/L NaCl与15 mmol/L PBS(pH=7.4)缓冲溶液,使胶束溶液于37 ℃保存24 h后即可使用。取3 mL胆固醇胶束放入50 mL锥形瓶中,加入1 mL样品,37 ℃恒温振荡2 h,12 000 r/min离心20 min取上清液,使用试剂盒测定其胆固醇含量,空白组不加入样品,胆固醇结合能力与降解率利用公式(7)和公式(8)计算:
胆固醇结合能力/(μmol·mL-1)
(7)
胆固醇结合率/%
(8)
1.5 数据处理与统计分析
所有试验重复 3 次,结果以平均值±标准差表示。使用SPSS 25.0进行统计分析,并进行方差分析,使用 Origin 2018作图。
2 结果与分析
2.1 乳酸菌发酵刺梨汁体外降血糖活性
2.1.1 对α-葡萄糖苷酶活性的影响
α-葡萄糖苷酶是一种能催化水解纤维素并合成功能性低聚糖类的水解酶,它直接参与了淀粉与糖原的代谢途径,这也是引起餐后血糖升高的重要原因[16]。通过抑制肠黏膜上的α-葡萄糖苷酶活性,使淀粉分解为葡萄糖的速度减缓,减少和延缓小肠对葡萄糖的吸收以降低血糖,常用的α-葡萄糖苷酶抑制剂为阿卡波糖、伏格列波糖[17]。本研究以阿卡波糖为参照药品,通过观察样品对α-葡萄糖苷酶活性的抑制率,分析其体外降血糖的活性。
从表1中可知,SR10-1的菌悬液与胞外分泌物、H1胞外分泌物对α-葡萄糖苷酶有着极强的抑制能力,抑制率达到了(97.89±1.11)%、(94.07±1.56)%、(94.52±2.51)%。H1与GZSC-1菌悬液对α-葡萄糖苷酶活性均小于自己的胞外分泌物,这可能是具有 α-葡萄糖苷酶抑制能力的菌株的胞外分泌物,通过自身代谢物质增强降血糖活性[18],而不同菌株产生该类胞外物质的能力不一。此结果表明SR10-1的菌体与代谢物质在抑制α-葡萄糖苷酶的活性上,都有着很强的降血糖能力。
IC50表示当样品对α-葡萄糖苷酶活性抑制率达到50%时样品的浓度,IC50越小表示抑制α-葡萄糖苷酶活性越强。从表2中可知,刺梨汁在经过SR10-1发酵后,IC50值降低了(33.62±6.56)%,这与表1中的数据相印证。SR10-1具有很强的抑制α-葡萄糖苷酶活性的能力,在利用其发酵刺梨汁后,提升了抑制α-葡萄糖苷酶活性的能力。刺梨汁经过发酵乳杆菌GZSC-1与干酪乳杆菌H1发酵后抑制α-葡萄糖苷酶活性的能力均降低,说明采用不同的乳酸菌发酵刺梨汁对抑制α-葡萄糖苷酶活性存在差异。
表1 三株乳酸菌菌悬液与胞外分泌物对 α-葡萄糖苷酶活性抑制率
Table 1 Inhibition rate of α-glucosidase activity by three strains of lactic acid bacteria suspensions and extracellular secretions
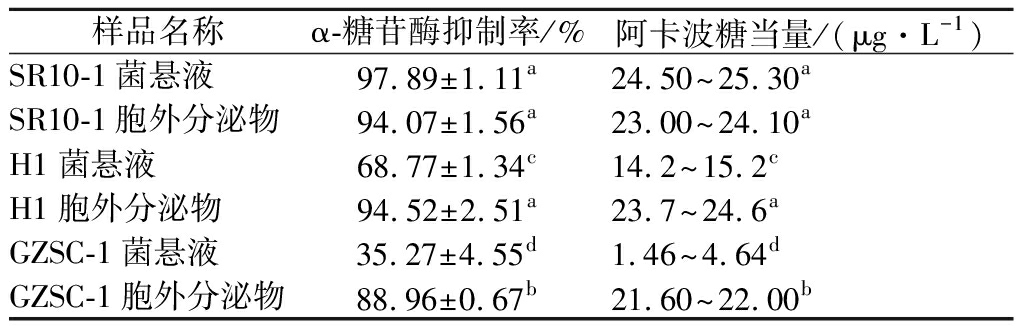
样品名称α-糖苷酶抑制率/%阿卡波糖当量/(μg·L-1)SR10-1菌悬液97.89±1.11a24.50~25.30aSR10-1胞外分泌物94.07±1.56a23.00~24.10aH1菌悬液68.77±1.34c14.2~15.2cH1胞外分泌物94.52±2.51a23.7~24.6aGZSC-1菌悬液35.27±4.55d1.46~4.64dGZSC-1胞外分泌物88.96±0.67b21.60~22.00b
注:表中不同小写字母代表差异显著(P<0.05)(下同)
表2 刺梨汁、乳酸菌发酵刺梨汁、阿卡波糖对 α-葡萄糖苷酶活性抑制率IC50值
Table 2 The scavenging rate IC50 of Rosa roxburghii Tratt juice, lactic acid bacteria fermented Rosa roxburghii Tratt juice, and ascorbic acid on α-glucosidase activity
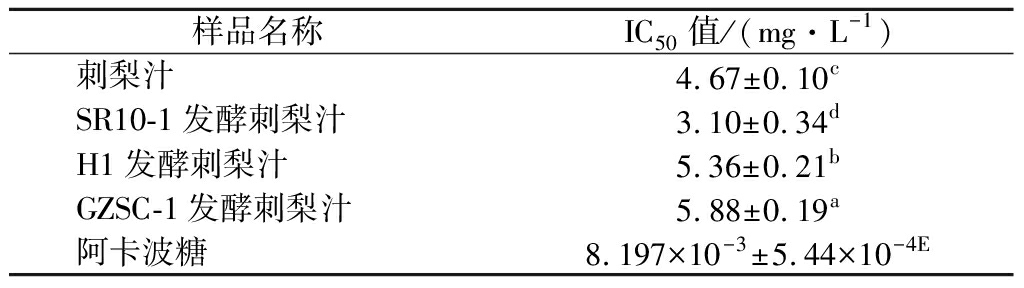
样品名称IC50值/(mg·L-1)刺梨汁4.67±0.10cSR10-1发酵刺梨汁3.10±0.34dH1发酵刺梨汁5.36±0.21bGZSC-1发酵刺梨汁5.88±0.19a阿卡波糖8.197×10-3±5.44×10-4E
2.1.2 乳酸菌发酵刺梨汁对GDRI的影响
GDRI是通过透析的方式,反映葡萄糖在胃肠道延迟吸收的体外指标,用于考察对胃肠道葡萄糖吸收延迟的影响[19]。
在透析30 min后,SR10-1发酵刺梨汁GDRI达到(92.62±4.31)%,显著高于其他样品(P<0.05),其次为GZSC-1发酵刺梨汁(50.50±3.45)%,而刺梨汁的GDRI为41.00%,说明经过SR10-1与GZSC-1发酵后的刺梨汁可提高GDRI。而干酪乳杆菌H1的菌体与代谢物质的GDRI值为2.2%~4.56%,延迟葡萄糖吸收能力较弱,H1发酵刺梨汁对比刺梨汁,GDRI下降了(86.73±1.23)%,这说明发酵菌种不同,对刺梨汁的降血糖能力影响有很大差异。
在透析60 min后,所有样品的GDRI值都显著性下降(P<0.05),这是因为随着透析时间延长,样品对葡萄糖的吸附接近饱和,不能吸附更多的葡萄糖。有研究表明,葡萄糖在胃肠道中的吸附延迟主要是由于纤维黏度与纤维结构所致[20],说明刺梨汁中含有的膳食纤维和不溶性多糖对葡萄糖分子有一定的吸附作用。SR10-1与GZSC-1这2株乳酸菌菌体与代谢产物具有一定吸附葡萄糖的能力,刺梨汁经过SR10-1与GZSC-1发酵后,增加了膳食纤维或胞外多糖的含量,从而提高了吸附葡萄糖的能力,其中SR10-1在发酵刺梨汁后所产生的可溶性纤维较多,不容易在水中分散溶胀,纤维的大颗粒尺寸可以明显增加悬浮液的黏度,进而提高吸附葡萄糖的能力[21]。
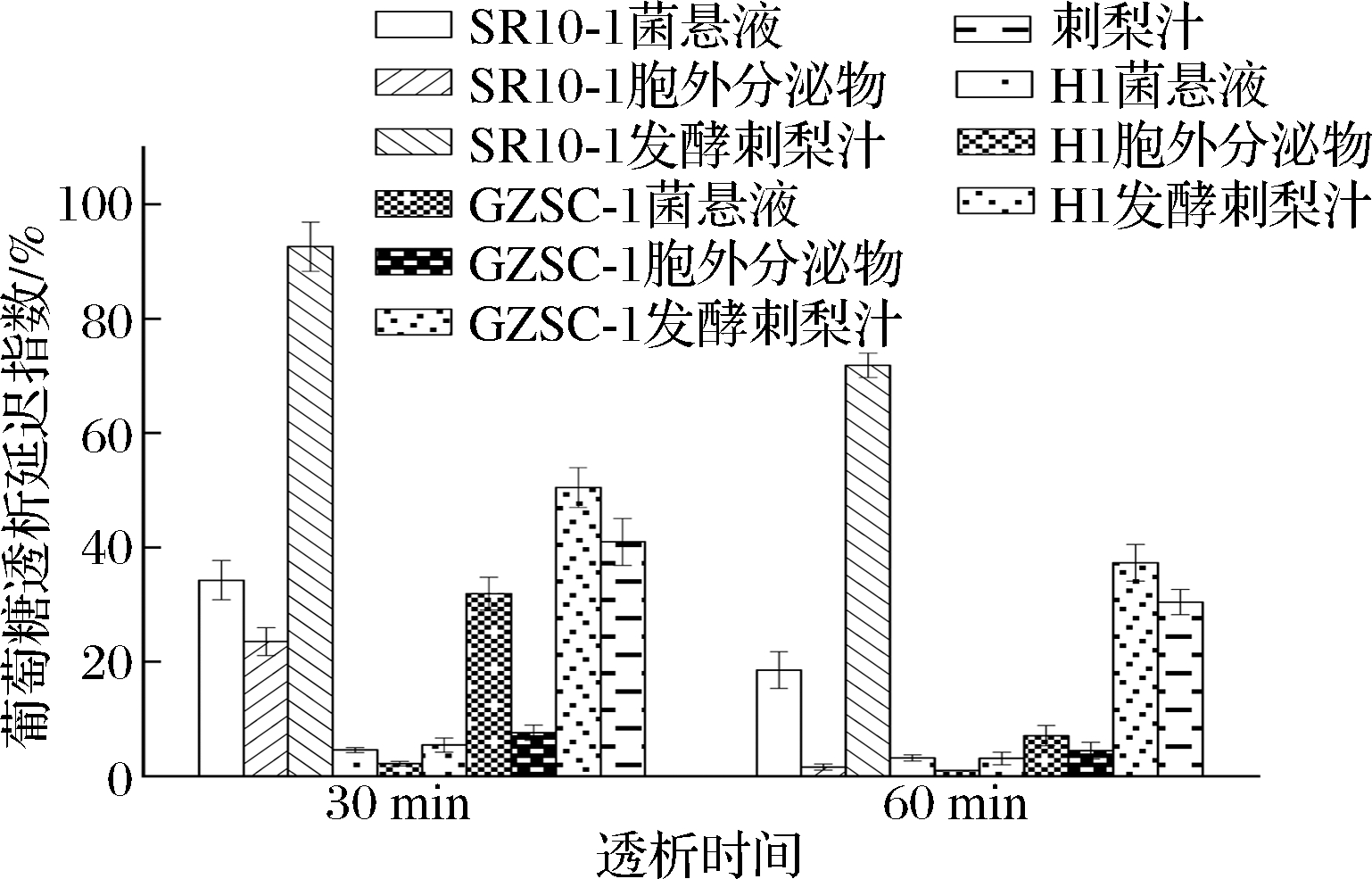
图1 三株乳酸菌菌悬液与胞外分泌物、发酵刺梨汁、 刺梨汁GDRI
Fig.1 The glucose dialysis delay indexes of three strains of lactic acid bacteria suspension and extracellular secretions, fermented Rosa roxburghii Tratt juice, Rosa roxburghii Tratt juice
2.2 乳酸菌发酵刺梨汁体外降血脂活性
2.2.1 结合胆酸盐能力
胆汁酸通常不作为游离胆汁酸存在于人的胆汁中,主要以甘氨酸和牛磺酸的结合物形式存在,体积比为3∶1。胆汁盐(胆汁酸的钠盐)是由肝脏分泌,它是一种强力乳化剂,它在肠道中可以帮助脂肪以及脂溶性的营养物质水解,进而促进机体的消化和吸收。乳化完成后,脂肪酸和甘油酸被小肠下部吸收,胆汁盐被重新吸收回肝脏,形成内部循环。因此,降低肠道中胆酸盐的含量,可以作为表征降血脂的一项直观指标。
图2结果表明,3株乳酸菌对牛磺胆酸钠的结合能力均显著高于甘氨胆酸钠的结合能力(P<0.05)。结合甘氨胆酸钠的能力由高到低的顺序:H1菌悬液>SR10-1菌悬液=GZSC-1菌悬液>H1胞外分泌物>SR10-1胞外分泌物=GZSC-1胞外分泌物,干酪乳杆菌H1在结合甘氨胆酸钠的能力上显著高于副干酪乳杆菌SR10-1与发酵乳杆菌GZSC-1(P<0.05)。结合牛磺胆酸钠的能力由高到低的顺序:H1菌悬液>GZSC-1菌悬液>SR10-1菌悬液>H1胞外分泌物>SR10-1胞外分泌物>GZSC-1胞外分泌物。乳酸菌结合胆酸盐能力可能于其产生的胆盐水解酶,在厌氧条件下催化分离结合态的胆盐为去结合型胆盐有关[22],从而提高胆酸盐结合能力。
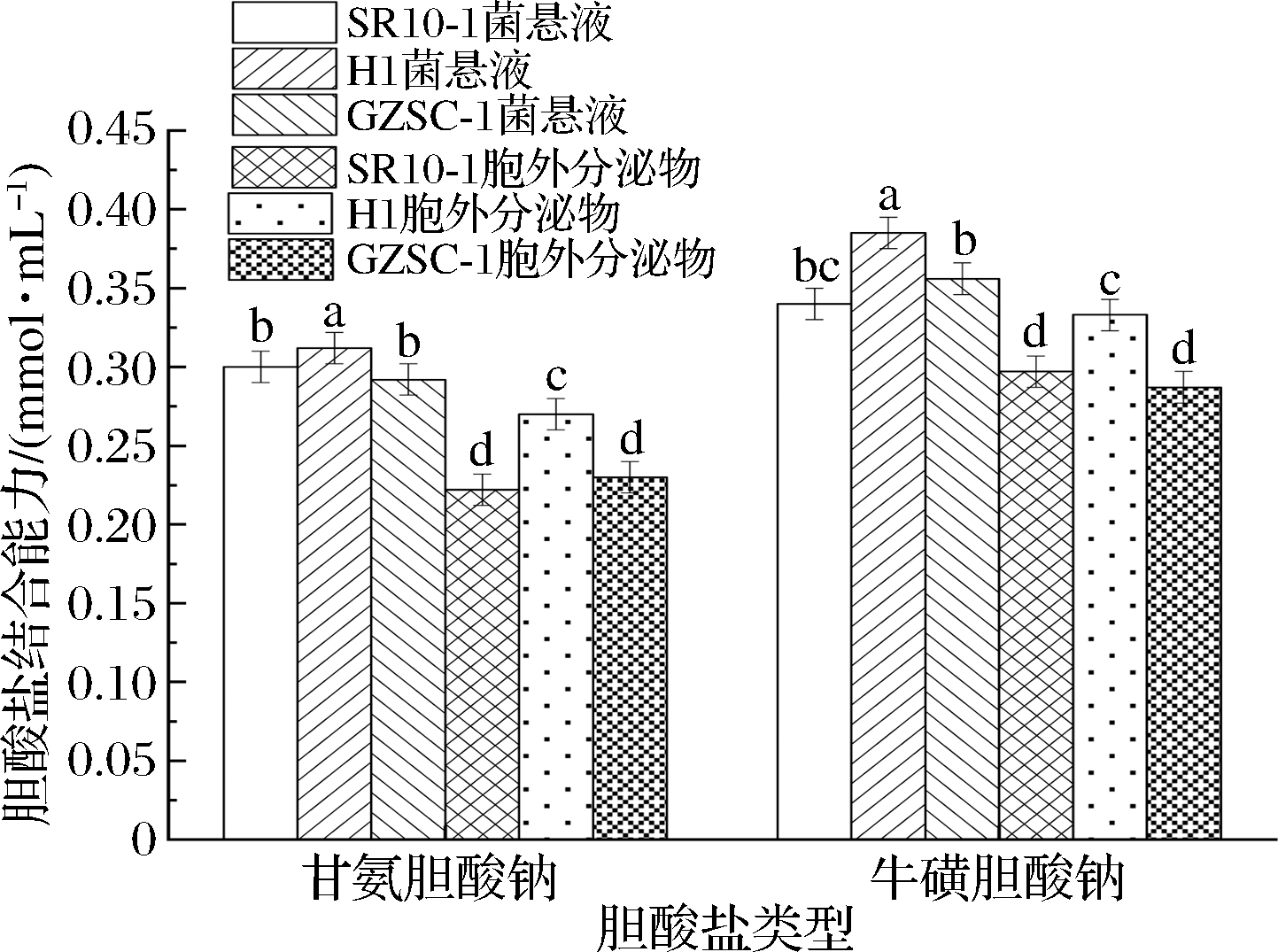
图2 三株乳酸菌菌悬液与胞外分泌物对2种胆酸盐结合能力
Fig.2 The binding ability of three strains of LAB suspensions and extracellular secretions to two cholate saltes 注:图中不同小写字母表示差异显著(P<0.05)(下同)
由图3可知,刺梨汁经过乳酸菌发酵后结合甘氨胆酸钠的能力均显著提高(P<0.05),并且显著高于乳酸菌本身(P<0.05),说明刺梨汁与乳酸菌发酵在结合胆酸盐的能力上有增效作用。其中副干酪乳杆菌SR10-1提升能力最佳,显著强于干酪乳杆菌H1与发酵乳杆菌GZSC-1(P<0.05)。刺梨汁对牛磺胆酸钠没有结合能力,H1和GZSC-1发酵刺梨汁仅为0.02~0.03 mmol/mL,SR10-1发酵刺梨汁结合牛磺胆酸钠能力为(1.10±0.03)mmol/mL。在经过SR10-1发酵后显著提升了刺梨汁结合牛磺胆酸钠的能力(P<0.05),也显著强于H1与GZSC-1发酵刺梨汁(P<0.05)。这与惠洁等[23]研究的荷叶方经发酵后高于发酵前的结合胆酸盐能力结果相似,可能原因为乳酸菌发酵产生胞外多糖有关,从而减少胆盐的吸收[24]。
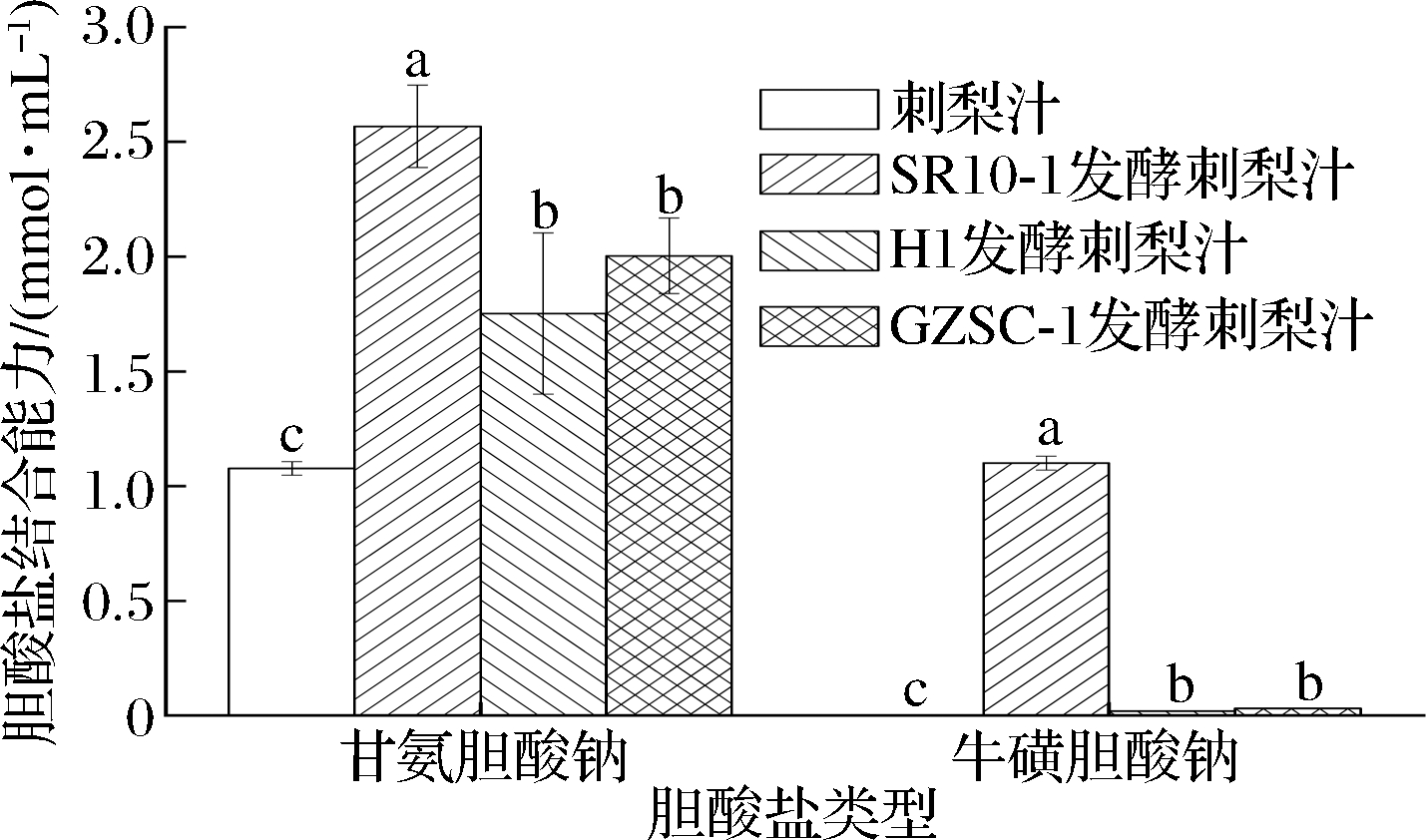
图3 刺梨汁、乳酸菌发酵刺梨汁对2种胆酸盐结合能力
Fig.3 The binding abilities of Rosa roxburghii Tratt juice and LAB fermented Rosa roxburghii Tratt juice to two cholate salts
2.2.2 抑制胰脂肪酶活性
当人体摄入的食物进入肠道后,肠道中的胰脂肪酶(pancreatic lipase,PL)将脂肪分解为单酰甘油与游离的脂肪酸,导致血脂升高。研究表明,通过抑制PL的活性,减少机体对脂肪的消化与吸收,可以有效改善肥胖与高血脂等症状[25],最终达到降血脂的目的。
图4结果表明,3株乳酸菌的菌悬液中,GZSC-1菌悬液抑制胰脂肪酶能力最强,抑制率为(29.2±3.10)%,高于H1菌悬液抑制率(19.24±1.31)%与SR10-1菌悬液的抑制率(10.03±1.45)%。
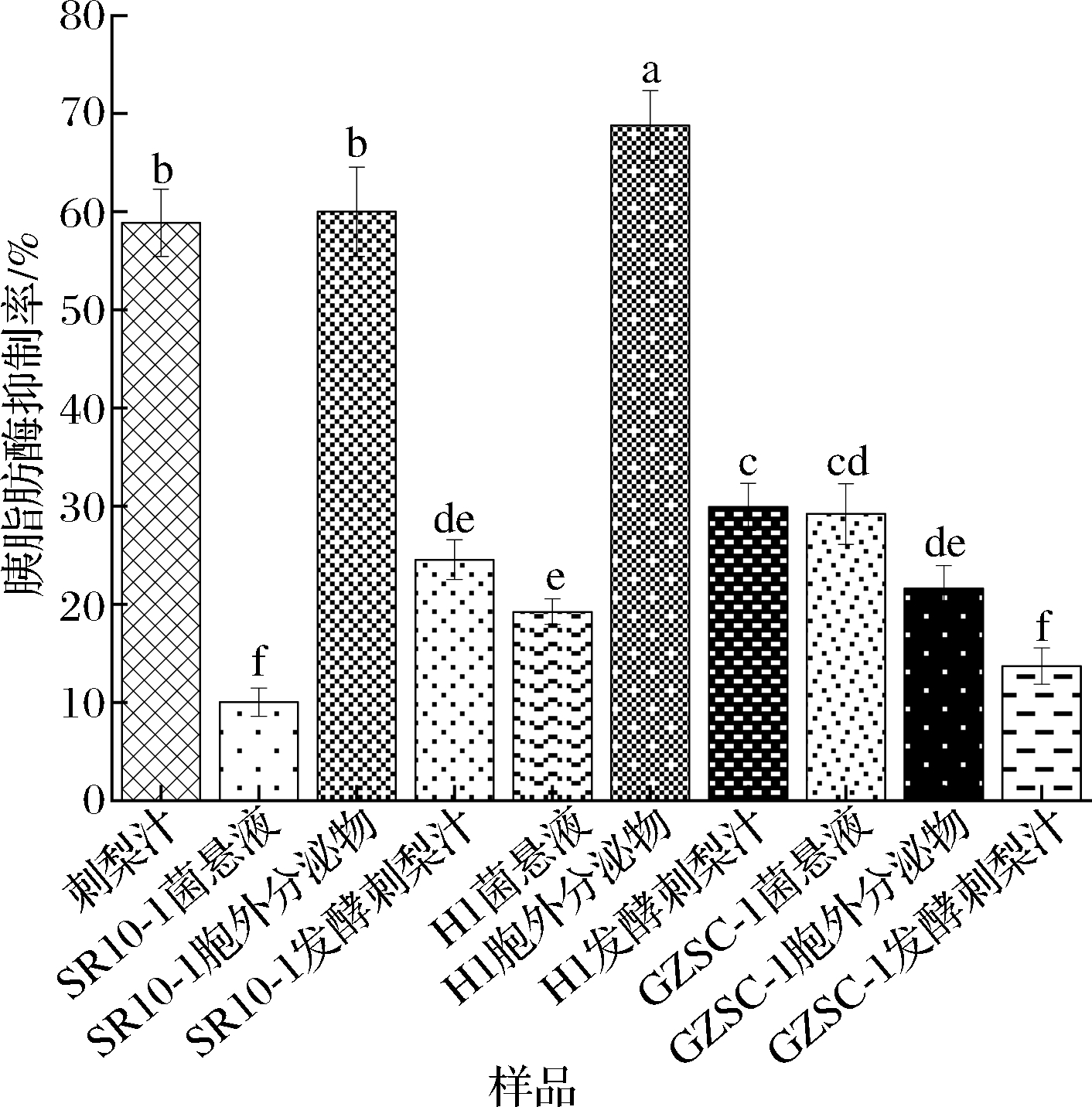
图4 三株乳酸菌菌悬液与胞外分泌物、3株乳酸菌 发酵刺梨汁、刺梨汁对胰脂肪酶抑制率
Fig.4 Inhibition rate of pancreatic lipase on three strains of LAB suspension and extracellular secretions, three strains of LAB fermented Rosa roxburghii Tratt juice and Rosa roxburghii Tratt juice
在3株乳酸菌的胞外分泌物中,H1胞外分泌物抑制胰脂肪酶能力最强,抑制率为(68.79±3.54)%,高于SR10-1胞外分泌物抑制率(60.00±4.54)%与GZSC-1胞外分泌物抑制率(21.60±2.33)%。然而,经过3株乳酸菌发酵后的刺梨汁在胰脂肪酶抑制率上显著低于刺梨汁(P<0.05)。在抑制胰脂肪酶的能力上,刺梨汁抑制率为(58.87±3.44)%,H1发酵刺梨汁抑制率为(29.93±2.40)%,SR10-1发酵刺梨汁抑制率为(24.54±2.01)%,GZSC-1发酵刺梨汁抑制率为(13.70±1.87)%。因此,H1胞外分泌物对抑制胰脂肪酶活性最高,其次为SR10-1胞外分泌物与刺梨汁。
2.2.3 结合胆固醇胶束能力
胆固醇是动物组织和肠腔中含量最丰富的类固醇,是血脂中一项重要的指标。根据流行病学调查数据显示,糖尿病、心脏病、心血管疾病、心梗、慢性肾炎等继发性疾病的发生与血脂中总胆固醇的升高密切相关[26],所以降低血液中胆固醇含量,能够有效地控制相关疾病的发生。
表3结果表明,3株乳酸菌的菌悬液与胞外分泌物中只有SR10-1菌悬液具有结合胆固醇的能力,结合能力为(0.05±0.001)μmol/mL、结合率为(1.12±0.04)%,结合能力较低,其余菌悬液与胞外分泌物均没有降解结合胆固醇的能力。
表3 三株乳酸菌菌悬液与胞外分泌物、3株乳酸菌 发酵刺梨汁、刺梨汁结合胆固醇胶束能力与结合率
Table 3 Three LAB strains suspensions and extracellular secretions, three LAB strains fermented Rosa roxburghii Tratt juice and Rosa roxburghii Tratt juice binding cholesterol micelles and binding rate
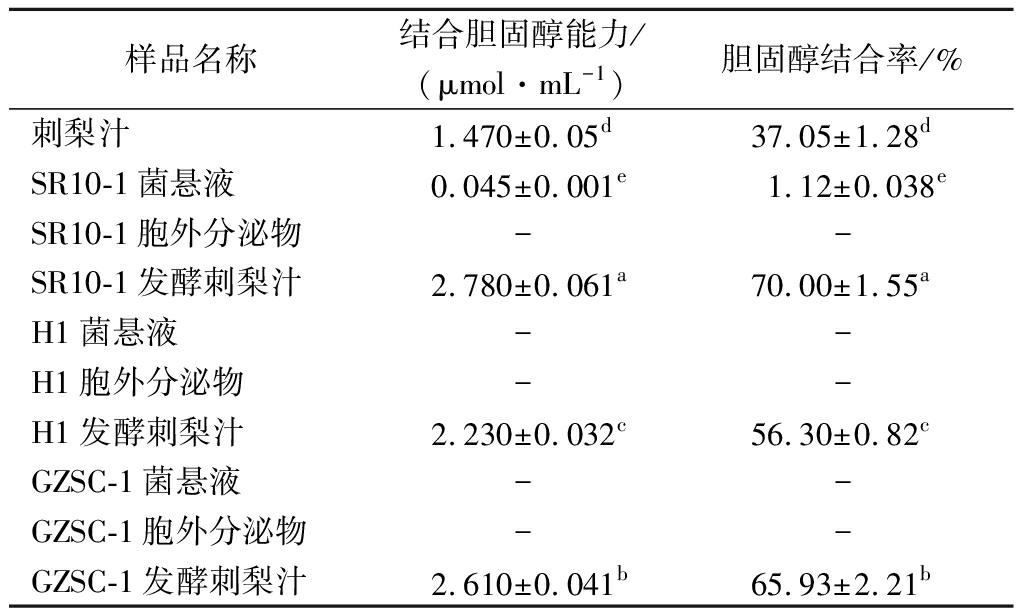
样品名称结合胆固醇能力/(μmol·mL-1)胆固醇结合率/%刺梨汁1.470±0.05d37.05±1.28dSR10-1菌悬液0.045±0.001e1.12±0.038eSR10-1胞外分泌物--SR10-1发酵刺梨汁2.780±0.061a70.00±1.55aH1菌悬液--H1胞外分泌物--H1发酵刺梨汁2.230±0.032c56.30±0.82cGZSC-1菌悬液--GZSC-1胞外分泌物--GZSC-1发酵刺梨汁2.610±0.041b65.93±2.21b
注:“-”代表未检出
但是,在利用乳酸菌发酵刺梨汁后均提升了刺梨汁结合胆固醇的能力,其中副干酪乳杆菌SR10-1发酵后的刺梨汁提升结合胆固醇能力最强,结合胆固醇能力达到(2.78±0.06)μmol/mL,对比刺梨汁,胆固醇结合率提升了33%。其次为发酵乳杆菌GZSC-1发酵刺梨汁,结合胆固醇能力(2.61±0.04)μmol/mL,对比刺梨汁胆固醇结合率提升28.9%。另外,干酪乳杆菌H1发酵刺梨汁,结合胆固醇能力为(2.23±0.03)μmol/mL,对比刺梨汁胆固醇结合率提升了18.8%。胆固醇结合率提升可能原因除了乳酸菌中的胆盐水解酶结合胆盐为游离胆盐后,与胆固醇形成共沉淀之外,也可能通过细胞壁、细胞膜或细胞质吸附胆固醇,亦或者产生酶或某种物质将胆固醇代谢为其他物质,从而降低胆固醇含量[27]。
3 结论
本研究通过体外抑制α-葡萄糖苷酶酶活性与GDRI,胆酸盐结合能力、抑制胰脂肪酶活性与结合胆固醇胶束来评价3株乳酸菌的菌悬液、胞外分泌物及其乳酸菌发酵刺梨汁的体外降血糖、降血脂活性。降血糖能力上,SR10-1菌悬液与胞外分泌物、H1胞外分泌物对α-葡萄糖苷酶有着极强的抑制能力。刺梨汁经乳酸菌发酵后,SR10-1发酵刺梨汁提升了抑制α-葡萄糖苷酶活性的能力(P<0.05)。与其他组相比,SR10-1、H1发酵刺梨汁均能提高GDRI值,以SR10-1发酵刺梨汁最为显著(P<0.05)。降血脂能力上,刺梨汁经过乳酸菌发酵后,结合胆酸盐与胆固醇胶束能力均得到提高,其中SR10-1发酵刺梨汁显著高于其他组(P<0.05)。刺梨汁、SR10-1胞外分泌物、H1胞外分泌物的抑制胰脂肪酶活性显著高于其他组(P<0.05)。综合结果得出:乳酸菌发酵刺梨汁可增强刺梨汁降血糖和降血脂的功效,但不同的乳酸菌株发酵刺梨汁功能活性差异较大,其中副干酪乳杆菌SR10-1发酵刺梨汁降血糖、降血脂综合能力最强,这为乳酸菌发酵刺梨汁的体外功能性评价提供了依据,今后还需运用多组学等手段全面解析乳酸菌发酵刺梨汁活性成分组成与含量,探讨不同菌种发酵特异性,阐明功能强化相关性以及可能存在的协同增效作用,进一步研究其在体内的作用效果和机理。
[1] XU J W, VIDYARTHI S K, BAI W B, et al.Nutritional constituents, health benefits and processing of Rosa roxburghii:A review[J].Journal of Functional Foods, 2019, 60(2):103456.
[2] 付阳洋, 刘佳敏, 卢小鸾, 等.刺梨主要活性成分及药理作用研究进展[J].食品工业科技, 2020, 41(13):328-335;342.
FU Y Y, LIU J M, LU X L, et al.Research progress on main active components and pharmacological effects of Rosa roxburghii Tratt[J].Science and Technology of Food Industry, 2020, 41(13):328-335;342.
[3] 李齐激, 南莹, 秦晶晶, 等.药食两用植物刺梨的化学成分研究[J].中国中药杂志, 2016, 41(3):451-455.
LI Q J, NAN Y, QIN J J, et al.Chemical constituents from medical and edible plants of Rosa roxburghii[J].China Journal of Chinese Materia Medica, 2016, 41(3):451-455.
[4] 刘易伟, 杨舒清.贵州省刺梨发展现状分析[J].食品安全导刊, 2020(6):148.
LIU Y W, YANG S Q.Analysis on development status of Rosa roxburghii in Guizhou Province [J].China Food Safety Magazine, 2020(6):148.
[5] 吴石金, 张嘉琳, 陈彦霖, 等.发酵食品中抗氧化乳酸菌的筛选与鉴定[J].浙江工业大学学报, 2019, 47(6):685-691;698.
WU S J, ZHANG J L, CHEN Y L, et al.Screening and identification of lactic acid bacteria strains with antioxidant activities in fermented food[J].Journal of Zhejiang University of Technology, 2019, 47(6):685-691;698.
[6] 杨宗璐, 柯亭羽.糖尿病并发心血管疾病的研究进展[J].中国老年保健医学, 2021, 19(1):92-94;98.
YANG Z L, KE T Y.A study of diabetes mellitus with cardiovascular disease[J].Chinese Journal of Geriatric Care, 2021, 19(1):92-94;98.
[7] 李意春, 郝二伟, 刘婧曦, 等.中国和东盟国家常用传统药物治疗糖尿病及其并发症药理作用的研究进展[J].中草药,2021, 52(4):1 165-1 176.
LI Y C, HAO E W, LIU J X, et al.Research progress on pharmacological effects of traditional medicines in China and ASEAN countries in treatment of diabetes and its complications[J].Chinese Traditional and Herbal Drugs, 2021, 52(4):1 165-1 176.
[8] TANG C, KONG L Y, SHAN M Y, et al.Protective and ameliorating effects of probiotics against diet-induced obesity:A review[J].Food Research International, 2021, 147:110490.
[9] 张玉龙, 胡萍, 王金龙, 等.产胞外多糖乳酸菌的筛选及抗氧化特性研究[J].中国酿造,2015, 34(10):37-42.
ZHANG Y L, HU P, WANG J L, et al.Isolation of exopolysaccharides-producing lactic acid bacteria and its antioxidant properties[J].China Brewing, 2015, 34(10):37-42.
[10] KUMAR D, GHOSH R, PAL B C.α-Glucosidase inhibitory terpenoids from Potentilla fulgens and their quantitative estimation by validated HPLC method[J].Journal of Functional Foods, 2013, 5(3):1 135-1 141.
[11] DAOU C, ZHANG H.Study on functional properties of physically modified dietary fibres derived from defatted rice bran[J].Journal of Agricultural Science, 2012, 4(9):85.
[12] 温文娟, 刘珊, 黄远丽.苯酚硫酸法与蒽酮硫酸法测定香菇多糖含量比较[J].现代食品, 2020(21):177-179.
WEN W J, LIU S, HUANG Y L.Comparison of phenol sulfuric and anthrone sulfuric method for determination of lentinan[J].Modern Food, 2020(21):177-179.
[13] 钱雅雯, 魏佳, 张政, 等.籽瓜多糖提取工艺的响应面优化及其体外降血脂活性[J].食品工业科技, 2020, 41(2):101-107.
QIAN Y W, WEI J, ZHANG Z, et al.Optimization of polysaccharides extraction from seed melon by response surface methodology and its hypolipidemic effects in vitro[J].Science and Technology of Food Industry, 2020, 41(2):101-107.
[14] 段振. 石榴皮不溶性膳食纤维的提取、体外降血脂活性研究及咀嚼片制备[D].西安:陕西师范大学, 2018.
DUAN Z.Extraction of insoluble dietary fiber from pomegranate peel, study on hypolipidemic activity in vitro and preparation of chewable tablets[D].Xi′an:Shaanxi Normal University, 2018.
[15] 廖坤梅, 白天禾, 陈楚华,等.高良姜粗多糖体外降胆固醇效果研究[J].农产品加工, 2017(10):4-6;17.
LIAO K M,BAI T H,CHEN C H,et al. Research on the effect of cholesterol lowering in vitro of Alpinia officinarum Hance crude polysaccharide [J].Farm Products Processing, 2017(10):4-6;17.
[16] BISSARO B, MONSAN P, FAURÉ R, et al.Glycosynthesis in a waterworld:New insight into the molecular basis of transglycosylation in retaining glycoside hydrolases[J].The Biochemical Journal, 2015, 467(1):17-35.
[17] 姜婷, 李艳芬, 黄伟, 等.从传统中药中筛选α-葡萄糖苷酶抑制剂的研究进展[J].湖南中医杂志, 2020, 36(12):172-175.
JIANG T, LI Y F, HUANG W, et al.Research progress in screening α-glucosidase inhibitors from traditional Chinese medicine[J].Hunan Journal of Traditional Chinese Medicine, 2020, 36(12):172-175.
[18] 刘顺, 谢远红, 张红星, 等.具有潜在降血糖作用乳酸菌的筛选[J].食品工业科技, 2019, 40(16):255-259;273.
LIU S, XIE Y H, ZHANG H X, et al.Screening of lactic acid bacteria with potential hypoglycemic effect[J].Science and Technology of Food Industry, 2019, 40(16):255-259;273.
[19] 龚卫华, 向卓亚, 叶发银, 等.笋壳醋酸木质素对葡萄糖透析延迟指数、发酵特性及酶活力的影响[J].食品与发酵工业, 2017, 43(12):55-60.
GONG W H, XIANG Z Y, YE F Y, et al.Effects of lignin from bamboo shoot shell on the glucose dialysis retardation index, fermentation property and enzyme activity[J].Food and Fermentation Industries, 2017, 43(12):55-60.
[20] ADIOTOMRE J, EASTWOOD M A, EDWARDS C A, et al.Dietary fiber:In vitro methods that anticipate nutrition and metabolic activity in humans[J].The American Journal of Clinical Nutrition, 1990, 52(1):128-134.
[21] SILVA V M, VIOTTO L A.Drying of Rosa roxburghiian lemon residue:Influence of process variables on the evaluation of the dietary fiber produced[J].Ciência E Tecnologia De Alimentos, 2010, 30(2):421-428.
[22] 张旻. 降胆固醇功能乳杆菌的筛选及降解机理研究[D].上海:上海交通大学, 2007.
ZHANG M.Screening of lactobacillus for efficient cholesterol-lowering and study on its mechanisms[D].Shanghai:Shanghai Jiao Tong University, 2007.
[23] 惠洁, 张存莉.荷叶方中药酵素体外降血脂活性研究[J].生物化工, 2021, 7(4):88-89;92.
HUI J, ZHANG C L.Study on in vitro hypolipidemic activity of Chinese herb enzyme of lotus leaf prescription[J].Biological Chemical Engineering, 2021, 7(4):88-89;92.
[24] 王晓君. 降胆固醇乳酸菌体外筛选条件优化的研究[D].青岛:青岛农业大学, 2010.
WANG X J.Study on the optimization of screening conditions of cholesterol-reducing Lactobacillus in vitro[D].Qingdao:Qingdao Agricultural University, 2010.
[25] WILCOX M D, BROWNLEE I A, RICHARDSON J C, et al.The modulation of pancreatic lipase activity by alginates[J].Food Chemistry, 2014, 146(1):479-484.
[26] 顾小江. 总胆固醇、甘油三酯、血糖指标与肥胖症的相关性研究[D].苏州:苏州大学,2020.
GU X J.Study on the correlation between cholesterol, triglyceride, blood glucose and obesity[D].Suzhou:Soochow University, 2020.
[27] 龙峻瑶, 张均伟, 黄丽, 等.六堡茶乳酸菌多样性及其降胆固醇特性分析[J].食品科学, 2021, 42(18):58-64.
LONG J Y, ZHANG J W, HUANG L, et al.Diversity and cholesterol-lowering characteristics of lactic acid bacteria in Liupao tea[J].Food Science, 2021, 42(18):58-64.