魔芋是天南星科草本植物,其主要活性成分为魔芋葡甘露聚糖(konjac glucomannan,KGM),是一种极易溶于水的天然高分子中性杂多糖[1]。研究表明,KGM具有良好的增稠、乳化、胶凝及流变等特性,并具有调节血糖血脂代谢、促进肠道蠕动、降低胆固醇以及减肥益生等诸多生理功能,被广泛用于食品保健和医药卫生等领域[2-3]。其中,KGM的流变行为对于液体食品的增稠、持水与胶凝特性,以及货架期与稳定性评价有着非常关键的作用,其流变特性很大程度上决定了其水溶液的链构象与理化特性,但其流变性能极易受温度及酸碱环境因素影响,从而对食品品质以及感官特性产生不同的影响[4]。因此,如何合理调控其流变特性,成为众多研究者所关注的热点话题。
基于此,一些研究者[5]对KGM的流变特性进行了研究,结果发现KGM在溶液中的流变行为明显受到酸碱度与温度的影响,原因在于多糖的糖苷键对不同酸与热处理条件的敏感性不同。如ZHANG等[6]发现热诱导碱性条件下的KGM能使其脱乙酰化从而改变其流变性,但会形成热不可逆凝胶。同时,MA等[7]和ARANCIBIA等[8]发现酸或热处理能够促进多糖大分子链的分散与解聚,增大分子间距离并减弱氢键作用力,提高其流变性,此外,酸处理还能使大分子结晶区的螺旋结构发生部分水解和重排,从而影响其功能活性[9]。上述研究表明,不同的酸热处理能够更加合理地改变多糖的流变特性,并对其生理活性造成影响,那么是否可以通过不同有机酸与热的协同作用对KGM进行处理,从而达到合理控制其流变行为的目的,仍需要进一步探究。KGM作为增稠剂、膳食纤维补充剂广泛应用于食品加工中,而食品中常添加有机酸调节食品的酸度和口感,改善杀菌条件等。因此,为了探究KGM的酸热稳定性及流变行为规律,实验选取了抗坏血酸、乳酸、苹果酸、柠檬酸作为酸处理剂,测定其在一定的热处理下黏度、相对分子质量、稳态及动态流变学、傅里叶红外光谱(Fourier transform infrared spectrometer,FT-IR)以及扫描电子显微镜(scanning electron microscope,SEM)等指标,综合分析KGM水溶胶流变稳定性的变化,以期丰富调节魔芋流变行为的方式及拓展其相关产品的高值化应用。
1 材料与方法
1.1 材料与试剂
魔芋微粉(纯度>95%),湖北十堰花仙子有限公司;柠檬酸、乳酸、抗坏血酸,苹果酸,皆为分析纯,成都市科隆化学品有限公司。
1.2 仪器与设备
FA2004A型电子分析天平,上海精天电子仪器有限公司;RUPT-10型超纯水处理系统,山东新瑞分析仪器有限公司;SHZ-88型水浴恒温振荡器,江苏常州朗越仪器制造有限公司;NDJ-8S数显黏度计,上海衡平仪器仪表厂;MCR 302流变仪,美国TA公司;Waters 2414凝胶渗透色谱仪(gel permeation chromatograph,GPC),美国Waters公司。
1.3 实验方法
1.3.1 KGM水溶胶的制备
分别准确称取10 g/L的抗坏血酸、乳酸、苹果酸、柠檬酸加入到10 g/L KGM水溶胶中,充分搅拌3 min,将水溶胶置于摇床30 ℃,200 r/min充分振荡1 h,再静置1 h后取出,制备抗坏血酸组、乳酸组、苹果酸组、柠檬酸组的KGM水溶胶溶液。然后,将上述4组水溶胶分为2等份分别进行加热和不加热处理,同时称取等量的蒸馏水代替有机酸进行上述操作并进行加热和不加热处理,作为空白对照。
1.3.2 黏度测定
将1.3.1制备好的各组KGM水溶胶,分别用NDJ-8S黏度计测定,选用4号转子,12 r/min,平行测定6次。在重复性条件下,获得的2次独立测定结果的绝对差值不超过1 000 mPa·s。
1.3.3 相对分子质量测定
采用GPC测定不同酸处理后KGM的相对分子质量大小以及分布情况[10]。检测条件:Ultra-hydrogel TM 500色谱柱(7.8 mm×300 mm),柱温:35 ℃,检测器:30 ℃,进样体积20 μL,流速1 mL/min,流动相为超纯水。样品处理方法:精密称取20 mg多糖,加10 mL超纯水溶解后过0.22 μm滤膜,上机测定。
1.3.4 稳态流变测定
使用MCR 302 TA型流变仪测定经不同酸处理后的10 g/L KGM水溶胶在25 ℃下的流变曲线。测试条件:选用PP 25平板,加载间隙1 mm,剪切速率0.1~100 s-1,频率f=1 Hz,平衡时间t=60 s;测试时在样品周围涂上1层二甲基硅油,防止样品蒸发损失[11]。
1.3.5 动态流变测定
参照JIAN等[12]的方法,并稍作修改。将10 g/L的各组水溶胶,预先进行形变扫描以确定线性黏弹范围。采用振荡模式,设定频率范围1~100 rad/s,应变2.0%,循环水浴控制温度在(25.0±0.1) ℃,测定不同酸处理后KGM水溶胶的流变曲线。
1.3.6 FT-IR测定
参照SILVA等[13]的方法,并做一定修改。将经过冷冻干燥后的不同酸处理组样品,与干燥的KBr以质量比1∶100混合研磨,然后置于FFIR仪下测定,以空气为背景扫描,光谱扫描范围4 000~400 cm-1,分辨率为4 cm-1,扫描次数为32。
1.3.7 SEM测定
分别取适量真空冻干后的样品,贴于导电胶上,经过喷金处理,观察不同酸处理后样品的微观形貌,所选放大倍数为250×、1 000×、3 000×。
1.3.8 数据分析与处理
所有实验数据均用SPSS 17.0进行方差分析,Origin 8.5作图,结果以平均值±标准偏差表示。
2 结果与分析
2.1 黏度数据分析
由图1可知,与对照组相比,4种有机酸热处理KGM水溶胶后,其黏度值均有显著下降,且抗坏血酸、乳酸、苹果酸、柠檬酸对KGM的黏度分别下降了55.20%、70.74%、77.66%、80.52%(P<0.05)。在热处理环境下,柠檬酸因自身具有的三羧基及单羟基基团,从而使得KGM的氢键更易被其破坏,导致该处理组黏度的显著下降[14]。此外,实验结果还表明KGM水溶胶单独在酸或热处理的情况下,其黏度值变化不大,但在酸热的协同作用下,其黏度值下降极为显著。究其原因,可能是由于酸性环境会明显影响KGM在水溶液中的链伸展行为[10],实验中使用不同的有机酸电离产生了不同的酸环境,协同热产生的分散溶胀作用,加剧了KGM水溶胶不同程度的解链与断裂,从而表现出黏度值显著下降的现象[6]。
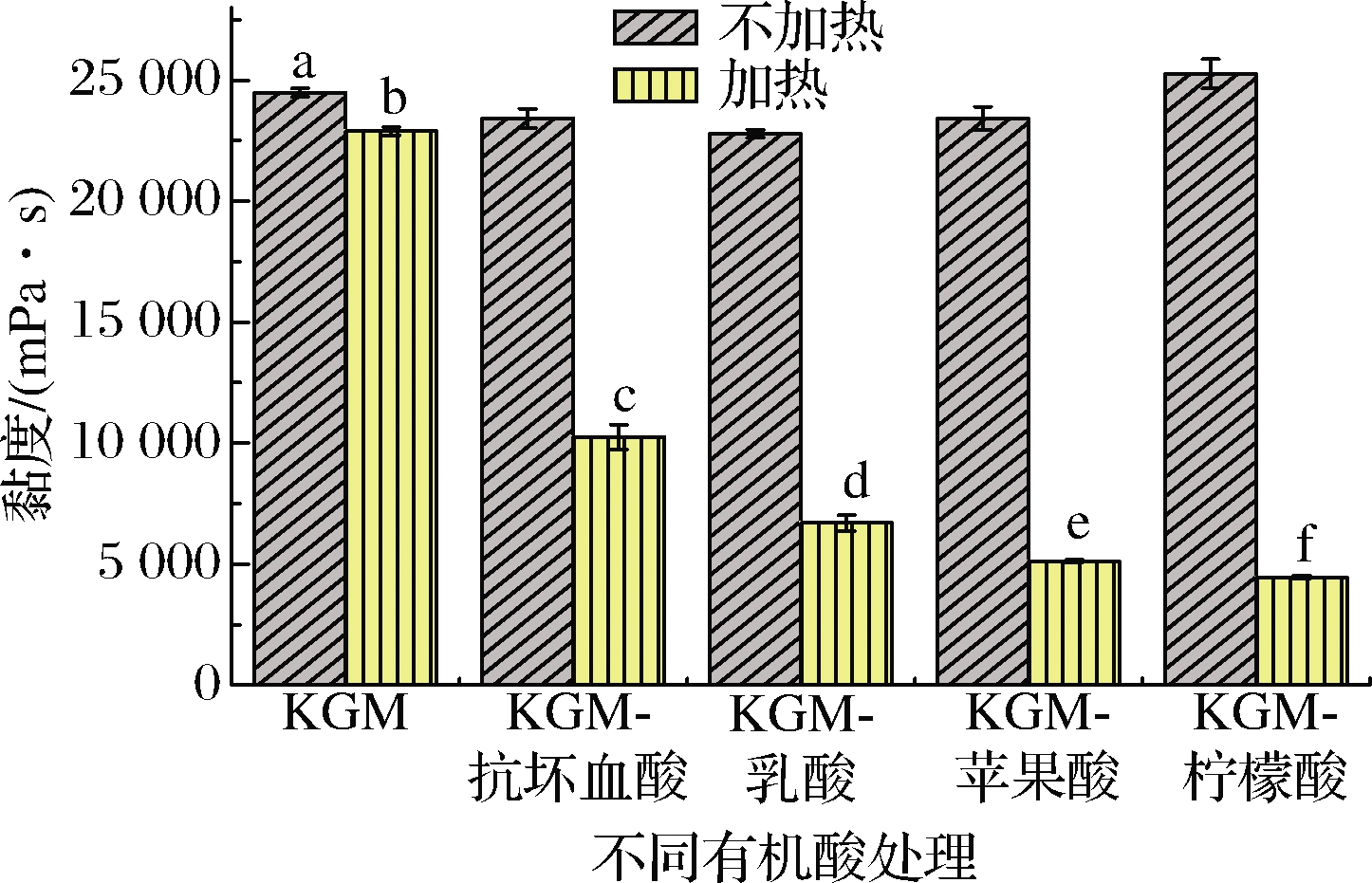
图1 不同有机酸处理KGM的黏度曲线
Fig.1 The viscosity curve of KGM under different organic acids 注:不同小写字母表示差异显著(P<0.05)
2.2 相对分子质量及分布
由表1可知,4种有机酸热处理的KGM与其对照组相比,各组相对分子质量均变小,其中柠檬酸组对KGM水溶胶的热稳定性影响最为显著,相对分子质量下降98.07%,抗坏血酸影响最小,仅为35.67%。由于相对分子质量的大小与物质黏度的大小关系密切,而图1结果也表明柠檬酸热处理能显著降低KGM水溶胶的黏度,其内在的原因可能为柠檬酸的三级电离产生数量不等的H+离子协同热处理,使得KGM的酸水解加剧,导致其相对分子质量变小,此结果与图1各有机酸组的黏度值变化趋势较为吻合。此外,由柠檬酸处理下其多分散系数>2,这表明柠檬酸协同热处理能够显著切断其分子长链,使得KGM降解为低分子质量小片段,从而导致其在溶液中的不均匀分散与低黏度行为[15-16]。
表1 不同有机酸热处理后KGM的相对分子质量以及分布
Table 1 Relative molecular mass and distribution of KGM after different organic acid treatments
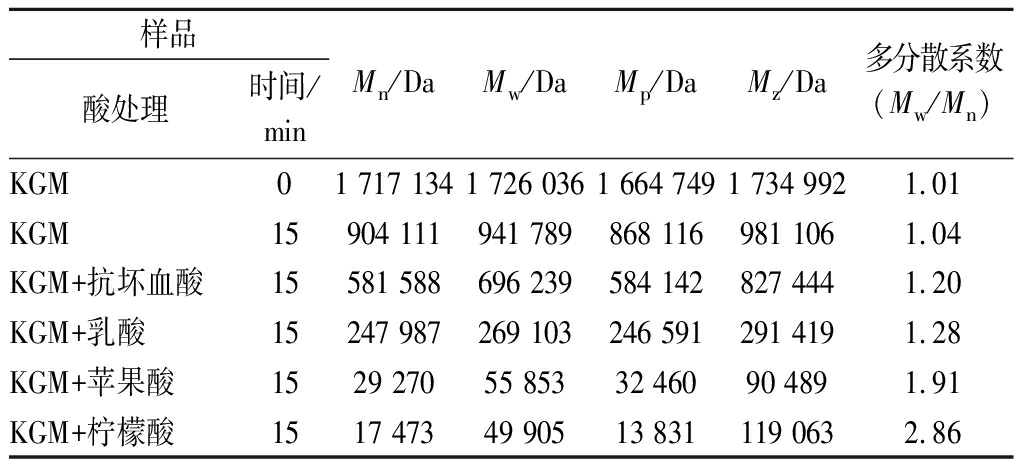
样品酸处理时间/minMn/DaMw/DaMp/DaMz/Da多分散系数(Mw/Mn)KGM01 717 1341 726 0361 664 7491 734 9921.01KGM15904 111941 789868 116981 1061.04KGM+抗坏血酸15581 588696 239584 142827 4441.20KGM+乳酸15247 987269 103246 591291 4191.28KGM+苹果酸1529 27055 85332 46090 4891.91KGM+柠檬酸1517 47349 90513 831119 0632.86
2.3 KGM水溶胶的稳态流变曲线
由图2所示,随着剪切速率的不断增大,4种有机酸热处理后KGM水溶胶的表观黏度呈现逐渐下降的趋势,而剪切应力却逐渐上升,表现出典型的剪切速率与表观黏度呈负相关的非牛顿流体现象,这与先前的研究一致[17]。在同一剪切速率下,其表观黏度及剪切应力均表现为:柠檬酸<苹果酸<乳酸<抗坏血酸,且在低剪切速率(0~10 s-1)下,KGM水溶胶黏度下降较为平缓,而在高剪切速率(50~100 s-1)下,其表观黏度下降较为剧烈,其原因可能是由于低剪切速率下其分子结构间的氢键及分子间作用力能够抵抗低剪切力所带来的结构破坏作用,而在高剪切速率下,分子沿剪切方向流动,剪切破坏力大于分子间作用力,分子间链纠缠被破坏,且在酸热体系下,其链间作用力被削弱,因此表现出较低的表观黏度[18-19]。
由幂律方程tanʒ=KDn可知,相关系数r2在0.938 8~0.989 1,表明该方程能较好地拟合该酸热处理下KGM的流变曲线(表2)。KGM水溶胶经酸热处理后,其稠度系数K不断变小,流动系数n不断增大,其中以柠檬酸热处理组的K值最小,n值最大,流体的假塑性最弱,表现出更类似于牛顿流体的性质,这种弱化的剪切稀释特性表明经酸热处理后KGM分子间的纠缠力逐渐变弱,更加有利于应用于流动延展性强的食品及工业方面[20]。

a-表观黏度;b-剪切应力
图2 不同有机酸热处理KGM水溶胶的流变曲线
Fig.2 The rheological behavior curve of KGM under different organic acids with heat treatment
表2 不同有机酸热处理KGM水溶胶的K值、n值 及相关系数r2
Table 2 The K, n and r2 of KGM gel under different organic acids with heat treatment

处理组稠度系数K/(Pa·s)流动系数n相关系数r2KGM42.293 3±2.970.284 1±0.020.938 8不加热KGM33.861 9±2.370.309 7±0.020.952 1KGM-抗坏血酸17.624 3±1.330.440 7±0.020.980 0KGM-乳酸12.796 2±0.950.488 0±0.020.985 7加热KGM-苹果酸10.593 6±0.760.522 4±0.020.988 8KGM-柠檬酸7.471 0±0.570.547 9±0.020.989 1
2.4 KGM水溶胶的动态流变曲线
由图3-a所示,4种有机酸热处理下KGM水溶胶的储能模量(G′)和耗能模量(G")均随角频率的增大而上升,其G′和G"曲线的交叉点从4.64 rad/s分别后移到29.3、29.3、39.8 rad/s,而柠檬酸热处理后无交叉点,这暗示4种酸热处理会使其微结构发生变化,分子链间的网络纠缠减弱,从而引起其黏弹性力学性能发生转变[21-22]。在低角频率下,不同酸热处理后其G″>G′,表现出类液体行为,原因可能为低频下,分子链在振荡过程中能解缠结,较易形成黏弹性液体,而在高角频率下,G′ >G″,原因为高频下分子链间弛豫时间较短,容易形成临时网络结构,从而其表现出类固体的行为[23]。
由图3-b所示,4种有机酸热处理后KGM水溶胶的损耗因子(G″/G′)随角频率的增大而下降,表明其在酸热处理后,黏弹性能发生转变[24]。角频率为1~10 rad/s时,损耗因子随角频率增大明显下降,且同一角频率下排序为抗坏血酸<乳酸<苹果酸<柠檬酸,以柠檬酸热处理组影响最为明显,此现象说明4种酸中尤其是柠檬酸,能够有效减弱KGM热溶胶的弹性而增强其黏性,使其在酸热处理后表现为流动性更强的液体,该发现可用于改善KGM的延展性,解决相关产品的高黏稠度问题。

a-G′和G″曲线;b-损耗因子曲线
图3 不同有机酸热处理KGM水溶胶的动态流变曲线
Fig.3 The dynamic flow curve of KGM gel under different organic acids with heat treatment
2.5 KGM的FT-IR分析
如图4所示,未经处理的KGM,在3 470 cm-1处的—OH吸收峰宽且峰强度大,说明其分子内及分子间存在大量氢键,在2 915 cm-1处出现糖类的—CH2不对称伸缩振动峰[25]。在1 726 cm-1为分子内乙酰基的—C![]() O伸缩振动,1 653 cm-1处的吸收峰归因于分子内氢键及—OH的弯曲振动,代表了分子内吸附水的存在[26],用来表征β-糖苷键构型及吡喃环的特征峰则分别位于881和802 cm-1[27]。经4种酸热处理后,各组KGM的大分子碳链骨架结构及一级重复单元结构基本保留,且并未产生新的基团[28]。其中,观察到1 653 cm-1处,酸热处理后各组吸收峰略有减弱,而在1 726 cm-1的羰基峰仅抗坏血酸组受到轻微振动,这表明酸热处理仅能弱化氢键作用而不会导致其脱乙酰化,此结果与JIAN等[10]研究发现一致,暗示胶体流变特性的显著差异主要归因于分子间相互作用(吸引或排斥)的改变,而并非不同酸碱度水平下的脱乙酰化作用。
O伸缩振动,1 653 cm-1处的吸收峰归因于分子内氢键及—OH的弯曲振动,代表了分子内吸附水的存在[26],用来表征β-糖苷键构型及吡喃环的特征峰则分别位于881和802 cm-1[27]。经4种酸热处理后,各组KGM的大分子碳链骨架结构及一级重复单元结构基本保留,且并未产生新的基团[28]。其中,观察到1 653 cm-1处,酸热处理后各组吸收峰略有减弱,而在1 726 cm-1的羰基峰仅抗坏血酸组受到轻微振动,这表明酸热处理仅能弱化氢键作用而不会导致其脱乙酰化,此结果与JIAN等[10]研究发现一致,暗示胶体流变特性的显著差异主要归因于分子间相互作用(吸引或排斥)的改变,而并非不同酸碱度水平下的脱乙酰化作用。

图4 不同有机酸热处理下KGM的FT-IR图
Fig.4 The FT-IR spectra of KGM under different organic acids with heat treatment
2.6 KGM水溶胶SEM分析
4种有机酸热处理后,KGM水溶胶的微观形貌如图5所示。未经酸热处理的KGM显示出完整致密的片层薄壁结构(图5-a),其分子内摩擦力高,氢键作用力强,因而表现出极高的黏度与分子质量[29]。仅加热处理后其片层及链间网络结构仍基本保留(图5-b),而经4种酸热处理后,其微观形貌明显发生了不同程度的破坏。其中,抗坏血酸热处理后,其分子链间的网络结构部分发生断裂,但整体网络结构仍较为完整(图5-c);乳酸热处理后,其分子薄壁结构产生皱缩与卷曲,且开始出现较大孔洞(图5-d);苹果酸热处理后,其出现大面积的蜂窝状孔洞结构,且孔洞大小不一(图5-e);而经柠檬酸热处理后,明显可见其内部网络结构崩塌,导致表面片层结构塌陷,且出现许多破碎无序的碎片,分子链间的交联网络结构已基本被破坏(图5-f)。在热处理下,抗坏血酸、乳酸、苹果酸、柠檬酸对其微观形貌的破坏程度依次增大,这与其对黏度及流变行为的影响趋势一致,其原因可能是4种酸的电离度差异产生不同的酸侵蚀环境,协同热处理下的高速分子布朗运动,分子间的氢键及糖苷键被破坏,使得长分子链解缠绕甚至断裂,微观表现出结构卷曲皱缩、蜂窝孔洞与破碎片段,因而极大地影响KGM高分子链在水溶液中的分布状态[15]。

a-KGM;b-KGM-加热;c-KGM-抗坏血酸;d-KGM-乳酸; e-KGM-苹果酸;f-KGM-柠檬酸
图5 不同有机酸热处理下KGM水溶胶的SEM图
Fig.5 SEM of KGM gel under different organic acids with heat treatment 注:数字1~3分别代表放大倍数为250、1 000、3 000
3 结果与讨论
综上,热处理下4种有机酸对魔芋水溶胶的流变行为存在较为显著的影响,但不会破坏其典型的非牛顿流体特性,这能极大地保留其基本的应用特性。其中,抗坏血酸、乳酸、苹果酸、柠檬酸对KGM水溶胶流变特性的影响作用依次增强,这主要表现在经酸热处理后,其表观黏度、G′及G″的明显下降,相对分子质量结果亦表明柠檬酸热处理组的重均分子质量(Mw)下降最为显著(94.70%)。而FT-IR及SEM结果显示,4种有机酸热处理,能不同程度地破坏KGM分子链间的氢键及糖苷键,导致多糖片层薄壁结构出现蜂窝孔洞与无序破碎片段,但不会改变其一级主链结构和重复单元结构。因此,可根据KGM在热处理下不同酸环境的流变特性,合理进行调控利用,以达到改善其相关产品品质,从而拓展其在酸性食品、航空化工、生物医药等领域的深加工应用。
[1] YANG D, YUAN Y, WANG L, et al.A review on konjac glucomannan gels:Microstructure and application[J].International Journal of Molecular Sciences, 2017, 18(11):2 250.
[2] YIN J Y, MA L Y, XIE M Y, et al.Molecular properties and gut health benefits of enzyme-hydrolyzed konjac glucomannans[J].Carbohydrate Polymers, 2020, 237:116117.
[3] ZHU F.Modifications of konjac glucomannan for diverse applications[J].Food Chemistry, 2018, 256:419-426.
[4] QIAO L K, LI Y P, CHI Y Z, et al.Rheological properties, gelling behavior and texture characteristics of polysaccharide from Enteromorpha prolifera[J].Carbohydrate Polymers, 2016, 136:1 307-1 314.
[5] 李金凤, 叶发银, 赵国华.多糖-酚酸缀合物的合成及特性研究进展[J].食品与发酵工业, 2017, 43(2):245-251.
LI J F, YE F Y, ZHAO G H.Synthesis and characterization of polysaccharide-phenolic acid conjugates[J].Food and Fermentation Industries, 2017, 43(2):245-251.
[6] ZHANG T, DE VRIES R, XU X Q, et al.Microstructural changes during alkali- and heat induced gelation of konjac glucomannan[J].Food Hydrocolloids, 2021, 114(2):106552.
[7] MA J Y, LIN Y B, CHEN X L, et al.Flow behavior, thixotropy and dynamical viscoelasticity of sodium alginate aqueous solutions[J].Food Hydrocolloids, 2014, 38:119-128.
[8] ARANCIBIA M Y, L PEZ-CABALLERO M E, G
PEZ-CABALLERO M E, G MEZ-GUILLÉN M C, et al.Antimicrobial and rheological properties of chitosan as affected by extracting conditions and humidity exposure[J].LWT-Food Science and Technology, 2015, 60(2):802-810.
MEZ-GUILLÉN M C, et al.Antimicrobial and rheological properties of chitosan as affected by extracting conditions and humidity exposure[J].LWT-Food Science and Technology, 2015, 60(2):802-810.
[9] NA J H, JEONG G A, PARK H J, et al.Impact of esterification with malic acid on the structural characteristics and in vitro digestibilities of different starches[J].International Journal of Biological Macromolecules, 2021, 174:540-548.
[10] JIAN W J, SIU K C, WU J Y.Effects of pH and temperature on colloidal properties and molecular characteristics of Konjac glucomannan[J].Carbohydrate Polymers, 2015, 134:285-292.
[11] LIANG X P, MA C C, YAN X J, et al.Structure, rheology and functionality of whey protein emulsion gels:Effects of double cross-linking with transglutaminase and calcium ions[J].Food Hydrocolloids, 2020, 102:105569.
[12] JIAN W J, WU H Y, WU L L, et al.Effect of molecular characteristics of Konjac glucomannan on gelling and rheological properties of Tilapia myofibrillar protein[J].Carbohydrate Polymers, 2016, 150:21-31.
[13] DELIX DA SILVA D, OGAWA C Y L, SATO F, et al.Chemical and physical characterization of konjac glucomannan-based powders by FTIR and 13C MAS NMR[J].Powder Technology, 2019, 361:610-616.
[14] SHAN D Y, HSIEH J T, BAI X C, et al.Citrate-based fluorescent biomaterials[J].Advanced Healthcare Materials, 2018, 7(18):1800532.
[15] TANG H B, WANG L, LI Y P, et al.Effect of acidolysis and oxidation on structure and properties of konjac glucomannan[J].International Journal of Biological Macromolecules, 2019, 130:378-387.
[16] CHANDA M, ROY S K.Plastics Technology Handbook[M].Fourth Edition. Raton:CRC Press,2006.
[17] HE P, LUO X G, LIN X Y, et al.The rheological properties of konjac glucomannan (KGM) solution[J].Materials Science Forum, 2012, 724:57-60.
[18] GRAESSLEY W W.The Entanglement Concept in Polymer Rheology[M]. Heidelberg:Springer Berlin Heidelberg, 1974:1-179.
[19] BHANDARI P N, SINGHAL R S, KALE D D.Effect of succinylation on the rheological profile of starch pastes[J].Carbohydrate Polymers, 2002, 47(4):365-371.
[20] WANG C, XU M, LYU W, et al.Study on rheological behavior of konjac glucomannan[J].Physics Procedia, 2012, 33:25-30.
[21] NI X W, CHEN W J, XIAO M, et al.Physical stability and rheological properties of konjac glucomannan-ethyl cellulose mixed emulsions[J].International Journal of Biological Macromolecules, 2016, 92:423-430.
[22] HUANG Q, JIN W P, YE S X, et al.Comparative studies of konjac flours extracted from Amorphophallus guripingensis and Amorphophallus rivirei:Based on chemical analysis and rheology[J].Food Hydrocolloids, 2016, 57:209-216.
[23] DU X Z, LI J, CHEN J, et al.Effect of degree of deacetylation on physicochemical and gelation properties of konjac glucomannan[J].Food Research International, 2012, 46(1):270-278.
[24] WINTER H H, CHAMBON F.Analysis of linear viscoelasticity of a crosslinking polymer at the gel point[J].Journal of Rheology, 1986, 30(2):367-382.
[25] XU Z L, SUN Y M, YANG Y H, et al.Effect of γ-irradiation on some physiochemical properties of konjac glucomannan[J].Carbohydrate Polymers, 2007, 70(4):444-450.
[26] LI J, LI B, GENG P, et al.Ultrasonic degradation kinetics and rheological profiles of a food polysaccharide (konjac glucomannan) in water[J].Food Hydrocolloids, 2017, 70:14-19.
[27] CHEN J G, LIU C H, CHEN Y Q, et al.Structural characterization and properties of starch/konjac glucomannan blend films[J].Carbohydrate Polymers, 2008, 74(4):946-952.
[28] JIN W P, XU W, LI Z S, et al.Degraded konjac glucomannan by γ-ray irradiation assisted with ethanol:Preparation and characterization[J].Food Hydrocolloids, 2014, 36:85-92.
[29] LUO X G, HE P, LIN X Y.The mechanism of sodium hydroxide solution promoting the gelation of konjac glucomannan (KGM)[J].Food Hydrocolloids, 2013, 30(1):92-99.