姜黄素是从姜科植物姜黄等根茎中提取得到的一种二酮、二羟基,带有共轭苯环和双键结构的天然黄色素。姜黄素(curcumin,CurⅠ)、去甲氧基姜黄素(demethoxycurcumin,CurⅡ)、双去甲氧基姜黄素(bidemethoxycurcumin,CurⅢ)3种化合物,统称姜黄素、姜黄色素或姜黄素类化合物,结构见图1[1],其中Cur I的含量约为70%,Cur II约为10%~20%,而CurIII约为10%[2]。姜黄素安全性高,长期以来作为一种常用的天然色素被广泛应用于食品工业,在GB 2760—2014 《食品安全国家标准 食品添加剂使用标准》中也有姜黄和姜黄素作为着色剂在部分食品中添加及使用限量的要求。此外,近年来的研究表明姜黄素具有抗炎、抗氧化、抗肿瘤、抗突变、提高免疫力等多种药理作用和保健功能[3-6],因而使其成为国内外研究的热点。但姜黄素类化合物不稳定,易受温度、光线、湿度、pH等影响[7-8]。
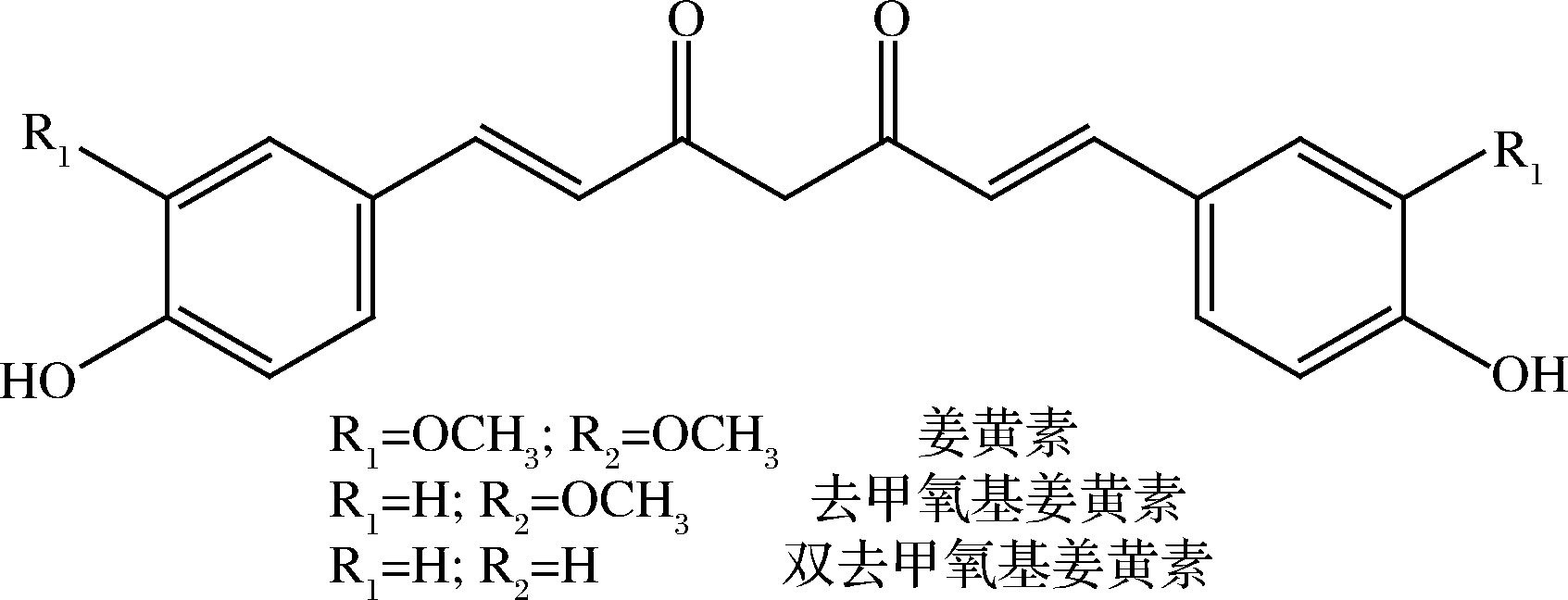
图1 三种姜黄素化合物结构
Fig.1 Structure of three curcuminoids
基于姜黄素诸多药用价值,姜黄素作为动物饲料添加剂[9]已应用于动物饲料中,我国农业农村部第123号公告中明确了姜黄素可应用于肉仔鸡饲料中,并确定了最高添加限量为150 mg/kg,但对于蛋鸡饲料没有规定,应视为不得添加。姜黄素添加于蛋鸡饲料中,可提高蛋鸡抗球虫能力,增加鸡蛋的抗氧化水平,还可降低新鲜和存储鸡蛋的脂质氧化反应,提高鸡蛋的整体质量。此外,姜黄素通过刺激免疫反应和对球虫病的控制方式增加蛋鸡的整体健康。少量食用含姜黄素的鸡蛋,对人体无任何不良反应,但食用含量较高的鸡蛋,也会出现如恶心、腹泻、皮肤过敏症状,碱性燐酸酶、乳酸脱氢酶指数上升,对于易感个体来说,还会增加肾结石的发生。因此,综合姜黄素作为饲料添加剂的应用范围和限量,以及姜黄素使用过量对人体存在危害风险等因素,检测动物源性食品鸡蛋中姜黄素含量非常必要。
关于姜黄素类化合物检测技术文献报道的检测方法较多,有分光光度法[10-11]、高效液相色谱法[12-14]、高效液相串联质谱法[15-16]、薄层扫描法[17]、近红外光谱法[18]、高效毛细管电泳法[19]、反相流动注射化学发光法[20]、极谱催化波法[21]等,检测基质也较为广泛,有中药、保健品及食品等,其中食品包含预加工食品(如冷冻饮品、果冻、腌渍蔬菜等)、粮食制品、水果等。本文以动物源性食品鸡蛋为研究基质,采用操作简单、准确性高、重复性好的测定方法,填补了国内高效液相色谱法测定鸡蛋中姜黄素类化合物含量的技术空白。
本文采用高效液相色谱法测定鸡蛋中3种姜黄素类化合物,通过考察姜黄素类化合物的稳定性,优化样品前处理条件,选择色谱柱、流动相、检测波长等最佳色谱条件,实现鸡蛋中3种姜黄素类化合物的精准含量测定,并对实际样品进行分析,为相关食品安全风险评估提供参考。
1 材料与方法
1.1 材料与试剂
甲醇(色谱纯),德国Merck公司;乙腈(色谱纯),德国Merck公司;甲酸(色谱纯),美国Fisher公司;姜黄素(简称CurⅠ,CAS号:458-37-7,纯度≥98%),德国Dr. Ehrenstorfer公司;去甲氧基姜黄素(简称CurⅡ,CAS号:22608-11-3,纯度≥98%),上海安谱实验科技股份有限公司;双去甲氧基姜黄素(简称CurⅢ,CAS号:33171-05-0,纯度≥98%),上海甄准生物科技有限公司;超纯水由Milli-Q超纯水机制得;实验用鸡蛋购自超市。
1.2 仪器与设备
高效液相色谱仪(带二极管阵列检测器),日本岛津公司;Atlantis T3色谱柱(5 μm,4.6 mm×250 mm),美国Waters公司;3-18K型冷冻离心机,德国Sigma公司;AB204-S型电子天平,德国Mettler Toledo公司;MS3型旋涡混合器,德国IKA公司;SB-800DTD超声清洗仪,中国宁波新芝生物科技股份有限公司;HGC-24型氮吹仪,中国恒奥科技有限公司;Milli-Q超纯水系统,美国Millipore公司。
1.3 实验方法
1.3.1 溶液配制
流动相:取2 mL甲酸,用纯水稀释至1 L,混匀。
姜黄素标准储备溶液:准确称取(精确至0.1 mg)3种姜黄色素标准物质,混合后用甲醇溶解定容至10 mL,以CurⅠ、CurⅡ和CurⅢ分别计,溶液质量浓度各自相当于1 mg/mL。-18 ℃冰箱中避光保存,6个月内含量稳定。
姜黄素标准工作溶液:吸取适量姜黄素标准储备液,用初始流动相配成0.05、0.1、0.5、1、5、10、50、100 μg/mL的标准工作液,-18 ℃避光保存1个月。
1.3.2 样品前处理
称取2.50 g试样(精确至0.01 g)于50 mL离心管中,加入20 mL乙腈,涡旋混匀后,超声提取20 min,加5 mL乙腈饱和正己烷除脂2次,将试样提取液全部转入25 mL容量瓶中,用乙腈定容,混匀后转入干净离心管中,以8 000 r/min离心5 min,取上清液过0.22 μm滤膜,待液相色谱检测。
1.3.3 分析条件
色谱柱:Atlantis T3色谱柱(4.6 mm×250 mm,5 μm);流动相:0.2%(体积分数)甲酸水-乙腈(体积比1∶1);流速1.0 mL/min;进样体积10 μL;柱温35 ℃;二极管阵列检测器:检测波长425 nm。
2 结果与分析
2.1 三种姜黄素化合物稳定性考察
2.1.1 pH对3种姜黄素的影响
为确定姜黄素类化合物溶液稳定性,实验将甲醇溶液分别调节pH至1、3、5、7、9、11后,稀释至标样质量浓度为5 μg/mL的标准溶液,通过测定3种姜黄素的峰面积,来比较pH环境对3种姜黄素的影响,结果见图2。
姜黄素类化合物结构中存在邻甲氧基苯酚结构,由于邻位效应,酸性强于苯酚,化合物苯环上的—OH和—OCH3均为给电子基团,使苯环电子密度增加,碳链上发生亲电反应。当苯环上失去—OCH3后,给电子能力减弱,碳链的亲电反应活性减弱。当溶液pH升高,姜黄素类化合物降解反应成一级动力学过程,降解速率明显加快,姜黄素类化合物的稳定性为双去甲氧基姜黄素≥去甲氧基姜黄素≥姜黄素,且溶液颜色也由黄色转变为红色。因此,在酸性环境下,姜黄素类化合物更稳定。本实验选择pH=5的酸性环境保存姜黄素类化合物标准溶液。

图2 不同pH环境对3种姜黄素的影响
Fig.2 Effects of different pH environment on three curcuminoids
2.1.2 贮存条件的优化
选择最优的贮存温度和贮存时间对热不稳定的姜黄素类化合物至关重要,实验以质量浓度为5 μg/mL 的3种姜黄素混合标准溶液为基础,选择较为稳定的pH=5的酸性环境,比较了室温(25 ℃)、冷藏(4 ℃)及冷冻(-18 ℃)3种温度下目标物的稳定情况。结果发现冷冻条件下,3种姜黄素化合物均很稳定。进一步考察时间发现,在-18 ℃下,30 d内3种姜黄素化合物的峰面积几乎无变化,说明质量浓度较低的姜黄素类化合物在-18 ℃下存放30 d是稳定的,因此选择该条件保存姜黄素类化合物标准溶液,结果见图3。
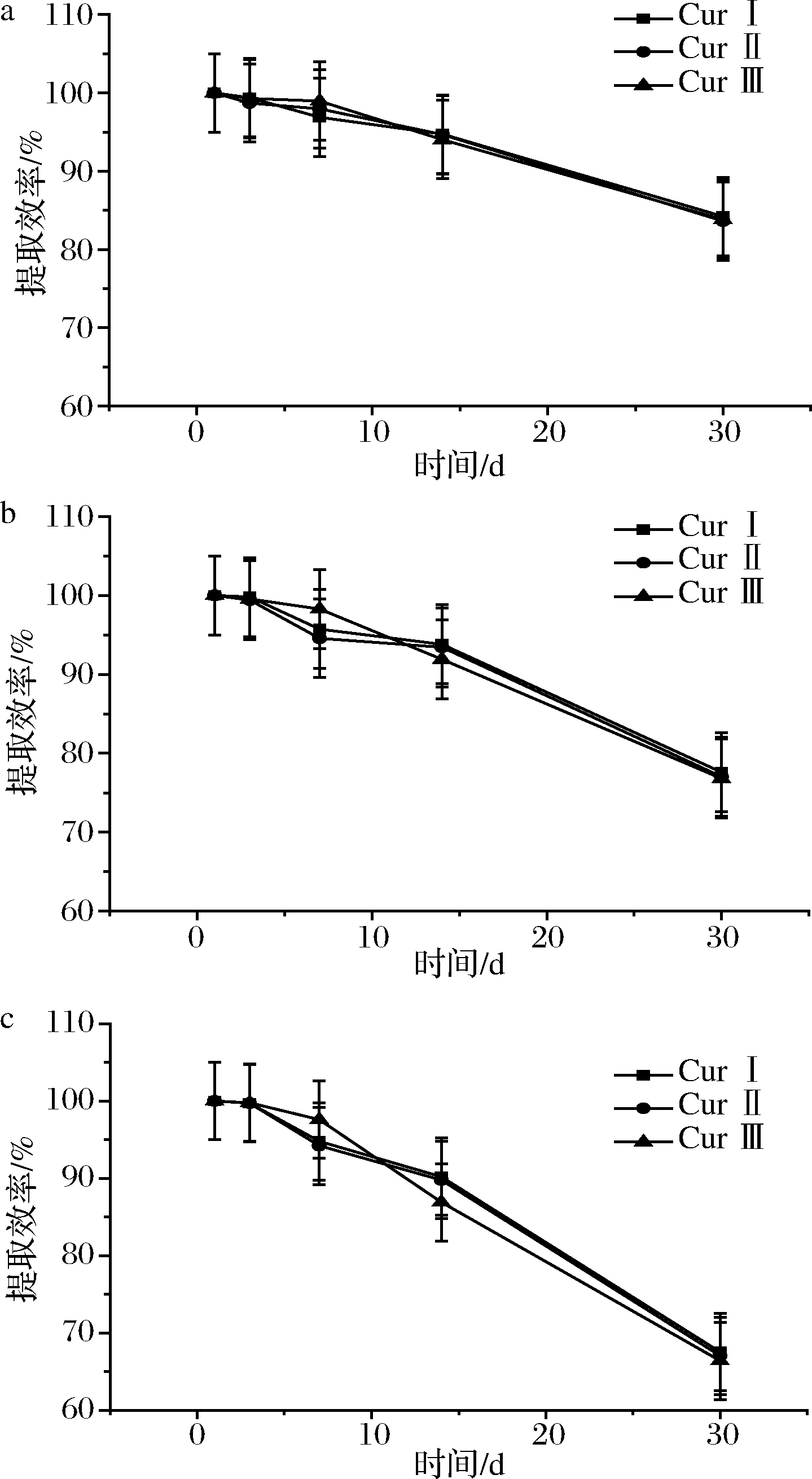
a-冷冻-18 ℃;b-冷藏4 ℃;c-室温25 ℃
图3 不同温度条件下3种姜黄素保存30 d的曲线图
Fig.3 The graphs of the three curcuminoids stored at different temperatures for 30 days
2.2 样品前处理条件优化
2.2.1 提取溶剂的优化
姜黄素类化合物是由2个邻甲氧基化的酚以及1个β-二酮组成,其结构中含有多个酚羟基基团,因此,此类化合物微溶水,易溶于甲醇、乙酸乙酯、丙二醇等有机溶剂和酸、碱性溶液等。本实验选择甲醇和乙腈2种常见溶剂,考察了不同溶剂比例下姜黄素类化合物的溶解度。由图4可知,甲醇和乙腈对3种化合物的提取效果较好。因鸡蛋含有大量蛋白质、磷脂及脂肪等干扰成分,乙腈比甲醇沉淀效果更优,溶液干扰物更少。此外,实验还尝试在提取剂中加入适量甲酸,与甲醇、乙腈的提取效果进行比较,结果无明显差别。为方便实验操作,本实验选择乙腈为提取溶剂。

图4 不同提取溶剂对3种姜黄素提取效率的比较
Fig.4 Comparison of extraction efficiency of three curcuminoids with different extraction solvents
2.2.2 滤膜的选择
滤膜可能对姜黄素类化合物有吸附作用,因此实验中考察了不同滤膜对目标物的影响。由于提取溶剂选用乙腈,测试选择了混合纤维素膜(mixed cellulose membrane,MCM)、聚四氟乙烯膜(polytetrafluoroethylene membrane,PTFE)、尼龙膜(nylon membrane)和聚醚砜膜(polyethersulfone membrane,PES),实验结果见图5。通过实验发现尼龙膜和PES对姜黄素类化合物有很大的吸附作用,严重影响目标物含量的测定。PTFE对Cur III有吸附,影响定量结果,MCM对样品处理溶液有很好的过滤效果,并且对3种目标化合物均无吸附作用,因此本实验采用MCM作为过滤膜。
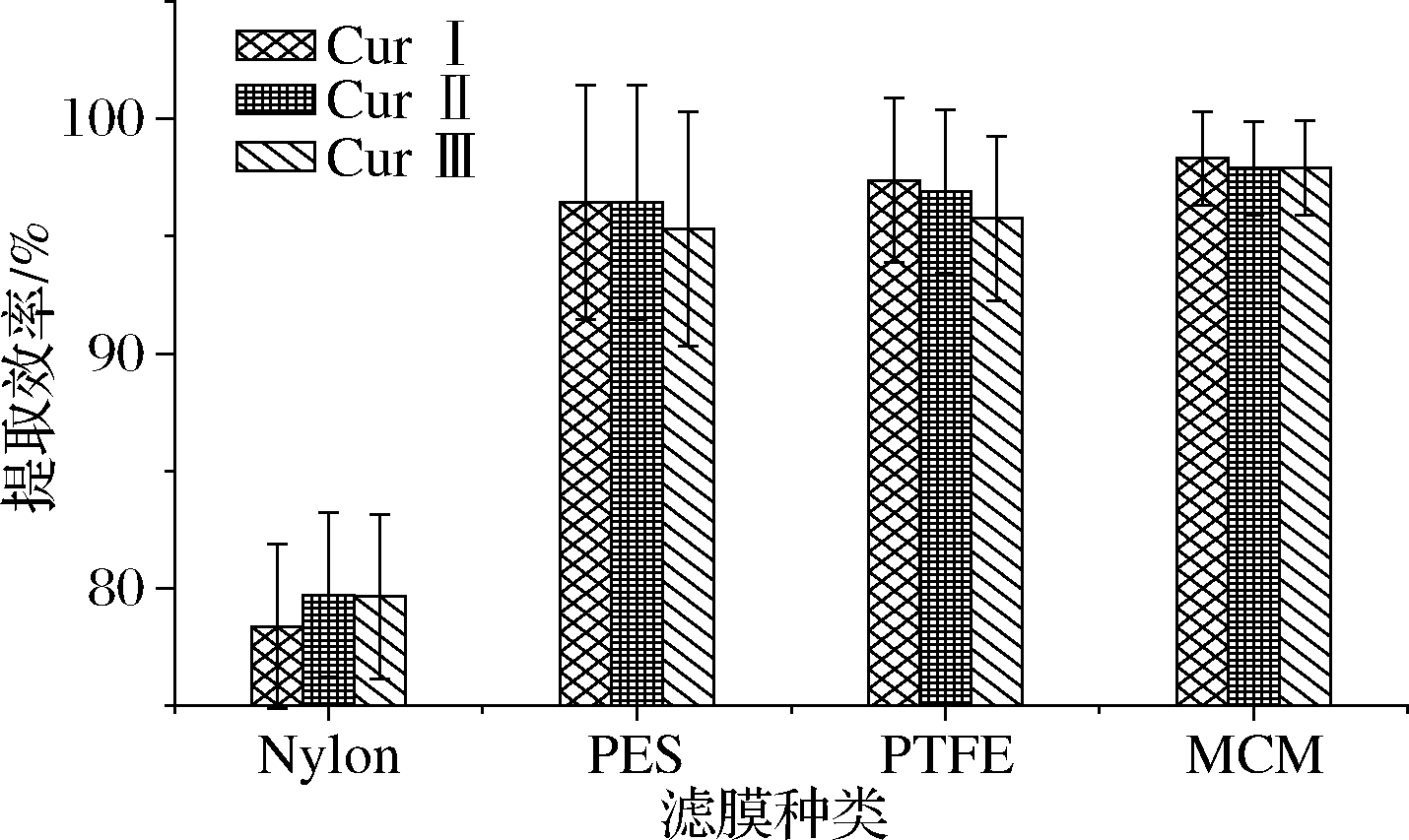
图5 不同滤膜对3种姜黄素滤过效果比较
Fig.5 Comparison of filtration effect of three curcuminoids with different filter membranes
2.3 色谱条件的优化
2.3.1 色谱柱的选择
色谱柱在液相色谱分离中起着至关重要的作用,因此本实验选择了YMC Carotenoid(4.6 mm×250 mm,5 μm)、Waters Symmetry Shield RP18(4.6 mm×250 mm,5 μm)、Waters Xbridge C18(4.6 mm×250 mm,5 μm)、Waters Atlantis T3(4.6 mm×250 mm,5 μm)4种类型的色谱柱,对3种姜黄素类化合物的色谱保留行为进行比较(图6)。结果发现YMC Carotenoid色谱柱针对同分异构体分离效果好,在分离3种姜黄素化合物时,保留过强,分离效果差。在Waters Symmetry Shield RP18、Waters Xbridge C18和Waters Atlantis T3三种色谱柱上,3种姜黄素化合物均能有效分配和分离,其中Waters Symmetry Shield RP18和Waters Xbridge C18保留性能强,3种姜黄素类化合物峰形存在拖尾现象,影响定量结果。综合考虑分离效果和定量准确性,采用Atlantis T3色谱柱分离姜黄素类化合物,保留时间和分离度效果均为最好,且峰形对称定量准确,故最终选择Waters Atlantis T3色谱柱作目标物结果分析柱。
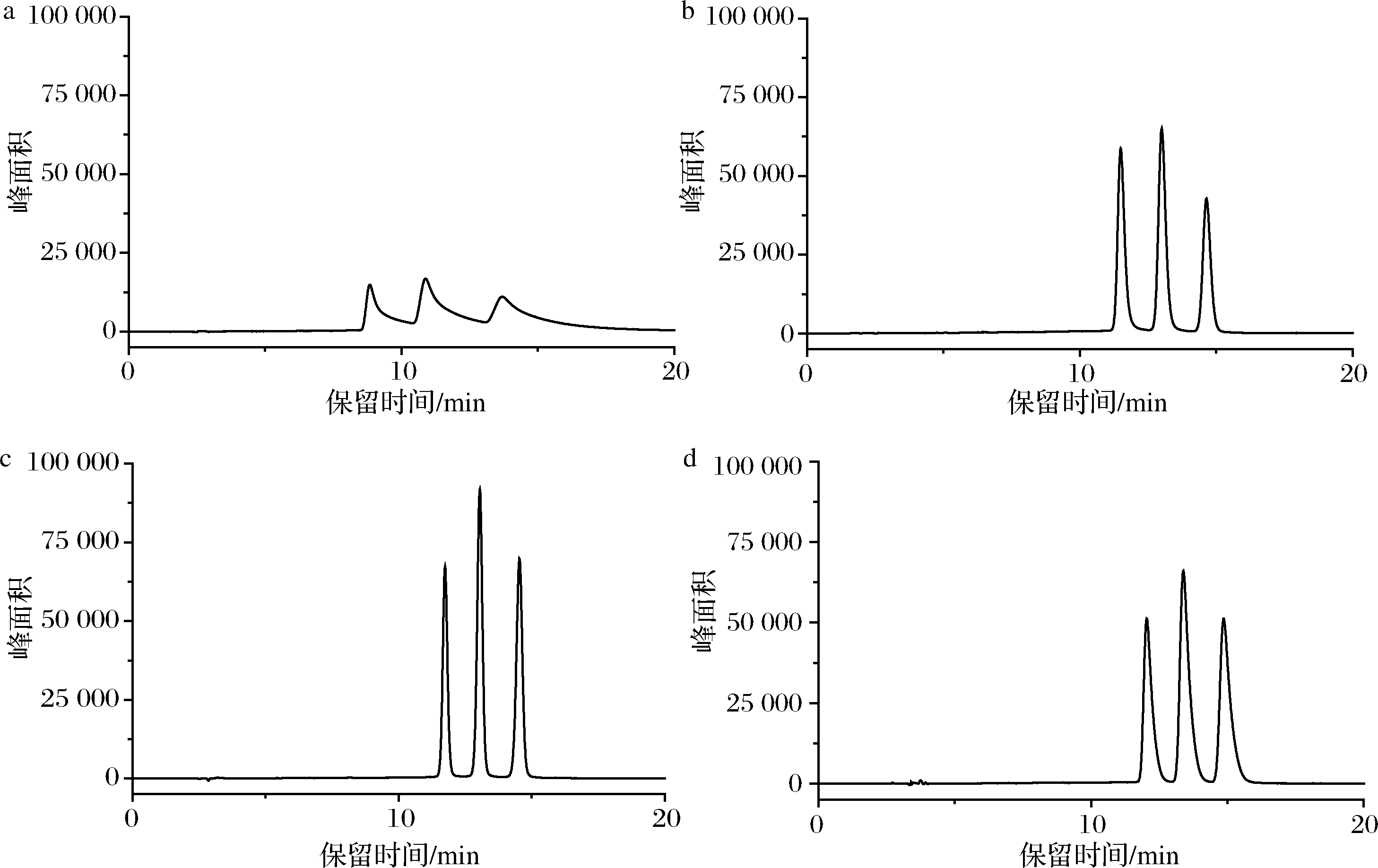
a-YMC Carotenoid色谱柱;b-Symmetry Shield RP18色谱柱;c-Atlantis T3色谱柱;d-Xbridge C18色谱柱
图6 不同色谱柱分离3种姜黄素的色谱图
Fig.6 Chromatography of separation of three curcuminoids from different columns
2.3.2 流动相的优化
姜黄素类化合物属于多酚类化合物,分子两端均有羟基,存在共轭苯环,会将氢氧键上的电子吸向氧一侧,产生吸电子效应,导致氢更容易解离,在色谱分析中会影响分离效果。实验比较了甲醇-乙酸铵、乙腈-乙酸铵、乙腈-水、乙腈-甲酸水等流动相条件,发现采用甲醇-乙酸铵条件,3种目标物不能分离,而应用乙腈-乙酸铵和乙腈-水流动相条件时,3种姜黄素色谱峰较宽,拖尾严重,分离度低;当加入甲酸后,目标峰保留时间增加,分离度提高,改善峰型,且酸度的不同对分离度的影响程度也不同。其原因可能是酸性条件改变了姜黄素中的共轭体系,抑制姜黄素在溶剂中解离,使目标峰峰型得到改善,柱效增加,样品分离度也明显提高。本文采用含0.2%甲酸水-乙腈溶液为流动相,将3种姜黄素类化合物完全分离。
2.3.3 检测波长的选择
试验采用紫外/二极管阵列检测器进行全波长扫描(扫描范围180~800 nm),CurⅠ、CurⅡ和CurⅢ 3种化合物的最大吸收波长在420 nm附近,由于3种物质中姜黄素含量占比最大,因此选择姜黄素的最大吸收波长425 nm为最佳检测波长(图7)。
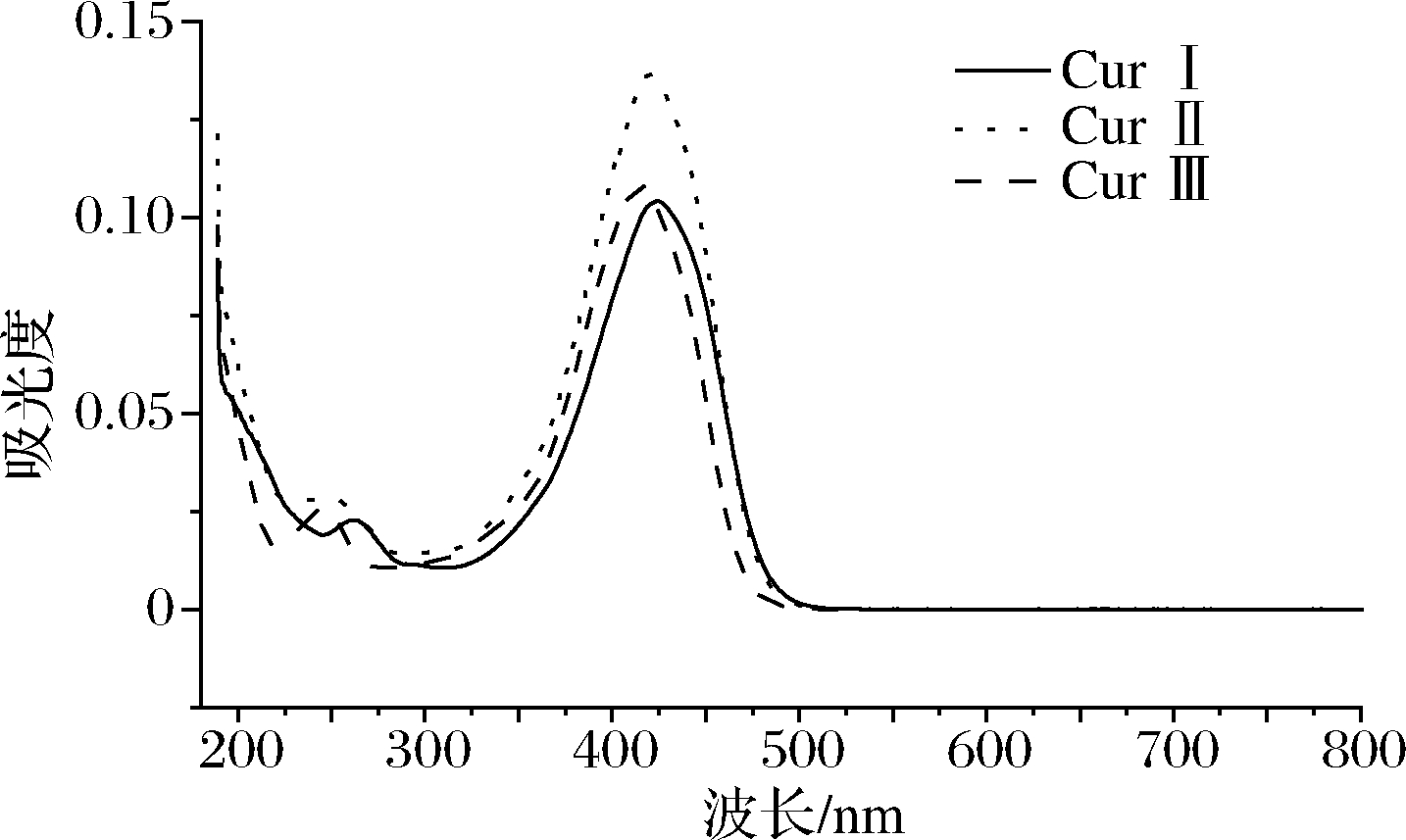
图7 三种姜黄素的光谱图
Fig.7 Spectral diagram of three curcuminoids
2.4 方法学评价
2.4.1 线性范围和检出限
将质量浓度分别为0.05、0.1、0.5、1、5、10、50、100 μg/mL的3种姜黄素混合标准工作液注入液相色谱仪,按1.5分析条件进行分析。以峰面积(Y)为纵坐标,对应的质量浓度(X)为横坐标,绘制标准曲线,以3倍信噪比确定检出限,以10倍信噪比S/N确定定量限(表1)。
表1 三种姜黄素化合物线性关系与检出限、定量限
Table 1 Linear relationship, detection limit, and quantitative limit of three curcuminoids
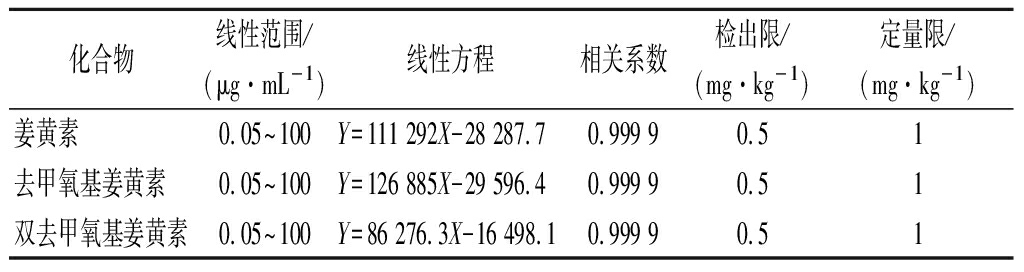
化合物线性范围/(μg·mL-1)线性方程相关系数检出限/(mg·kg-1)定量限/(mg·kg-1)姜黄素 0.05~100Y=111 292X-28 287.70.999 90.51去甲氧基姜黄素 0.05~100Y=126 885X-29 596.40.999 90.51双去甲氧基姜黄素0.05~100Y=86 276.3X-16 498.10.999 90.51
2.4.2 加标回收率和精密度
分别以低(1 mg/kg)、中(100 mg/kg)、高(500 mg/kg)3水平向空白样品中进行标准添加试验,每个浓度水平平行测定6次,考察方法的回收率与精密度,结果见表2。方法的平均回收率为85%~101%,精密度为0.34%~4.16%,表明方法的精密度和准确度良好。
表2 添加回收率与精密度(n=6)
Table 2 Recovery and RSD for the determination of neotame (n=6)

样品检出值/(mg·kg-1)加标量/(mg·kg-1)回收率/%RSD/%1853.59山鸡蛋ND∗100873.88500974.161962.40草鸡蛋ND∗100980.345001002.2111012.07柴鸡蛋ND∗1001002.26500991.24
注:ND*表示未检出
2.5 实际样品检测
应用本方法对市售的鸡蛋50批次进行3种姜黄素类化合物的检测分析,包括山鸡蛋、草鸡蛋、柴鸡蛋等样品,结果均未检出。
3 结论
本研究系统考察了3种姜黄素类化合物的稳定性,包括pH、贮存温度、贮存时间等条件,优化了前处理方法对3种姜黄素提取、净化和滤过效果的影响,并优化了色谱条件,建立了高效液相色谱法测定鸡蛋中3种姜黄素类化合物的分析方法。方法简单易行,结果稳定、可靠、准确,适用于批量鸡蛋样品中3种姜黄素类化合物的测定,可为相关产品质量控制和风险评估提供技术支持。
[1] 秦晓燕, 龚菊梅, 陈卫东.总姜黄素3种单体高纯度同时分离方法[J].安徽中医学院学报, 2012, 31(1):73-77.
QIN X Y, GONG J M, CHEN W D.Simultaneous separation of three high purity monomers from curcuminoids[J].Journal of Anhui Traditional Chinese Medical College, 2012, 31(1):73-77.
[2] 史晶晶, 冯素香, 郝蕊, 等.姜黄提取物中姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素的含量测定[J].中医学报, 2015, 30(6):853-855.
SHI J J, FENG S X, HAO R, et al.Demethoxycurcumin and bisdemethoxycurcumin in Curcuma longa L.extractive[J].China Journal of Chinese Medicine, 2015, 30(6):853-855.
[3] MITO S, WATANABE K, HARIMA M, et al.Curcumin ameliorates cardiac inflammation in rats with autoimmune myocarditis[J].Biological & Pharmaceutical Bulletin, 2011, 34(7):974-979.
[4] WILKEN R, VEENA M S, WANG M B, et al.Curcumin:A review of anti-cancer properties and therapeutic activity in head and neck squamous cell carcinoma[J].Molecular Cancer, 2011, 10:12.
[5] VALKO M, LEIBFRITZ D, MONCOL J, et al.Free radicals and antioxidants in normal physiological functions and human disease[J].The International Journal of Biochemistry & Cell Biology, 2007, 39(1):44-84.
[6] 袁鹏, 陈莹, 肖发, 等.姜黄素的生物活性及在食品中的应用[J].食品工业科技, 2012, 33(14):371-375.
YUAN P, CHEN Y, XIAO F, et al.The bioactivities of curcumin and its application in foods[J].Science and Technology of Food Industry, 2012, 33(14):371-375.
[7] 韩刚, 霍文, 李秋影, 等.姜黄素的稳定性研究[J].中成药, 2007, 29(2):291-293.
HAN G, HUO W, LI Q Y, et al.Study on the stability of curcumin[J].Chinese Traditional Patent Medicine, 2007, 29(2):291-293.
[8] 王雪梅, 陈利华, 施文婷.姜黄素类化合物的光稳定性研究[J].安徽大学学报(自然科学版), 2012, 36(3):73-78.
WANG X M, CHEN L H, SHI W T.Study on the photo-stability of curcuminoid[J].Journal of Anhui University (Natural Science Edition), 2012, 36(3):73-78.
[9] 刘永涛, 李乐, 徐春娟, 等.超高效液相色谱同时测定渔用饲料中双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素[J].中国渔业质量与标准, 2016, 6(5):60-64.
LIU Y T, LI L, XU C J, et al.Simultaneous determination of bisdemethoxycurcumin, demethoxycurcumin and curcumin in fishery feed by UPLC[J].Chinese Fishery Quality and Standards, 2016, 6(5):60-64.
[10] 黄燕芬, 洪行球.分光光度法测定总姜黄素的含量及方法学考察[J].浙江中医学院学报, 1999, 23(6):24-25;70.
HUANG Y F, HONG X Q.Measuring the total contents of curcumin with spectrophotometry and methodological observation[J].Journal of Zhejiang College of TCM, 1999, 23(6):24-25;70.
[11] 严建伟, 鲍慰文, 梁炳圻, 等.荧光分光光度法测定姜黄制剂中的姜黄素[J].中国现代应用药学, 1998, 15(2):44-45.
YAN J W, BAO W W, LIANG B Q, et al.Determination of curcumin in Curcuma longa L.of perparation by spectrophotofluorimetry[J].Chinese Journal of Modern Applied Pharmacy, 1998, 15(2):44-45.
[12] JADHAV B K, MAHADIK K R, PARADKAR A R.Development and validation of improved reversed phase-HPLC method for simultaneous determination of curcumin, demethoxycurcumin and bis-demethoxycurcumin[J].Chromatographia, 2007, 65(7-8):483-488.
[13] SIMONOVSKA B, VOVK I, GLAVNIK V, et al.Effects of extraction and high-performance liquid chromatographic conditions on the determination of lutein in spinach[J].Journal of Chromatography A, 2013, 1 276:95-101.
[14] 夏春. 高效液相色谱法测定食品中的姜黄素[J].化学分析计量, 2011, 20(1):54-55.
XIA C.Determination of the curcumin in food by HPLC[J].Chemical Analysis and Meterage, 2011, 20(1):54-55.
[15] 李伟, 肖红斌, 王龙星, 等.高效液相色谱-串联质谱法分析姜黄中微量的姜黄素类化合物[J].色谱, 2009, 27(3):264-269.
LI W, XIAO H B, WANG L X, et al.Analysis of minor curcuminoids in Curcuma longa L.by high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography, 2009, 27(3):264-269.
[16] VIJAYA SARADHI U V R, LING Y H, WANG J, et al.A liquid chromatography-tandem mass spectrometric method for quantification of curcuminoids in cell medium and mouse plasma[J].Journal of Chromatography B, 2010, 878(30):3 045-3 051.
[17] 吴桂碧. 薄层扫描法测定定姜黄中姜黄素的含量[J].华西药学杂志, 1995,10(3):172-174.
WU G B.Determination of curcumin in Curcuma by TLC-scanning densitometry[J].West China Journal of Pharmaceutcal Sciences, 1995,10(3):172-174.
[18] TANAKA K, KUBA Y, SASAKI T, et al.Quantitation of curcuminoids in Curcuma rhizome by near-infrared spectroscopic analysis[J].Journal of Agricultural and Food Chemistry, 2008, 56(19):8 787-8 792.
[19] 刘保启, 胡孝忠, 王玉春, 等.高效毛细管电泳法测定姜黄中姜黄素类化合物[J].分析测试学报, 2004, 23(1):109-111.
LIU B Q, HU X Z, WANG Y C, et al.HPCE determination of curcumins in Curcuma longa L.[J].Journal of Instrumental Analysis, 2004, 23(1):109-l11.
[20] THONGCHAI W, LIAWRUANGRATH B, LIAWRUANGRATH S.Flow injection analysis of total curcuminoids in turmeric and total antioxidant capacity using 2,2′-diphenyl-1-picrylhydrazyl assay[J].Food Chemistry, 2009, 112(2):494-499.
[21] 程司, 刘智广, 曹云新, 等.姜黄素的化学测定的新方法[J].第四军医大学学报, 2000(2):241-243.
CHENG S K, LIU Z G, CAO Y X, et al.New method in the determination of curcumin by electrochemistry[J].Journal of the Fourth Military Medical University, 2000(2):241-243.