水产品因富含蛋白质、不饱和脂肪酸和维生素,营养价值高,味道鲜美等特点深受消费者喜爱。近年我国水产品需求量持续上升,根据《2020中国渔业统计年鉴》统计显示,2019年我国水产养殖总量达到6 480.36万t[1]。但与此同时,水产品质量安全问题逐渐成为民众关注的敏感话题[2]。水产品安全问题主要集中于运输环节,为减少水产品在运输过程中鲜活度的损失,主要采用渔用麻醉剂对其进行保活。常见的渔用麻醉剂有10余种,其中三卡因是美国药物管理局(Food and Drug Administration, FDA)唯一批准可用于水产品的麻醉剂,因其在鱼体中代谢快,对鱼保活率高等优势已被广泛应用于活鱼的长途运输[3]。但是,水产品中残留的三卡因长期被人体摄入后,会对人体造成过敏、造血紊乱甚至致癌等危害[4]。如汤保贵等[5]研究报道三卡因具有Ⅲ级毒性;刘伟等[6]研究报道了三卡因质量浓度大于60 mg/L时,会导致鱼体处于亚健康状态。因此,为保证水产品的食用安全性,部分国家对三卡因有严格的限制标准,美国要求采用三卡因麻醉的水产品需经21 d休药期才能出售,允许最大残留限量为1 μg/mL;加拿大要求其休药期为5 d[7]。
三卡因的使用方法中,主要采用药液浸泡对长途运输中的鱼类进行麻醉保活。部分研究学者就三卡因对不同水产品麻醉效果进行了研究。如李宁等[8]研究了不同质量浓度三卡因对大口黑鲈鱼的麻醉效果,发现模拟运输中三卡因的最适浓度为50~60 mg/L;采用55 mg/L的三卡因药浴麻醉8 h,其残留量达到36.24 mg/kg,复苏3 d其残留量为1.12 mg/kg。郝长杰等[9]研究了三卡因对暗纹东方鲀幼鱼的麻醉效果,发现随着三卡因质量浓度的升高,幼鱼的麻醉时间逐渐缩短,复苏时间延长,三卡因对暗纹东方鲀的有效麻醉质量浓度为120~140 mg/L。由此可见,无论是水产品运输的水体,还是复苏后的鱼肉基质均有高浓度的三卡因。我国对三卡因在水产品中的使用没有明确的规定,尚无相应的检测标准,当前渔用麻醉剂滥用现象比较多。在经济利益的驱使下,有商家未经休药期就将水产品进行出售。试纸法主要用于目标物的快速筛查和初步分析,三卡因快速检测试剂盒能够让相关部门快速了解污染情况。但国内市场目前没有三卡因快检试剂盒,现有的三卡因检测方法主要是仪器分析方法,包括高效液相色谱法(high performance liquid chromatography, HPLC)[10]、液相色谱串联质谱法(liquid chromatography tandem mass spectrometry, LC-MS/MS)[11]以及气相色谱串联质谱(gas chromatography mass spectrometry, GC-MS/MS)[12-13]。而这些仪器分析法的样本前处理复杂、耗时长,且对操作人员的技术要求高,难以满足现场大批量快速筛查和检测要求。由此可见,我国水产品中麻醉剂三卡因残留检测研究较少,尤其在渔用麻醉剂的快速检测技术方面急需加强。
本研究构建的试纸条可用于水体以及鱼肉基质中三卡因快速检测。其中,磁性微球由超顺磁性纳米材料和高分子材料构成,其表面修饰有羧基,能够与蛋白形成牢固的共价结合,不受外界温度、湿度影响;由于具有超顺磁性,在磁场作用下,标记操作简单。此外,磁场具有穿透性强、背景干扰低的特点,以超顺磁性纳米材料标记的试纸条,可以通过磁信号分析仪捕捉硝酸纤维素膜(introcellulose,NC膜)从表面到底部的近90%信号,从而在实现复杂的反应体系中也能够进行高灵敏度的定量检测[14]。本研究以合成的3-氨基苯甲酸(半抗原)-BSA偶联复合物作为抗原包被到试纸条的检测线上,以磁性纳米探针作为检测标记物,在自主优化设计基础上开发了基于磁性纳米探针的三卡因快速检测试纸条,并和经典的HPLC法进行对比,对试纸条的检测性能进行了评价,旨在解决我国缺乏三卡因快速检测方法问题,为今后政府部门对渔用麻醉剂的实时监管提供参考,为开发三卡因快检试剂盒提供技术支撑。
1 材料与方法
1.1 材料与试剂
丙泊酚、N,N-二甲基苯胺、布比卡因、苯佐卡因,上海源叶生物科技有限公司;利多卡因,上海国药集团化学试剂有限公司;丁香酚,德国CNW公司;苯氧乙醇,BePure标准品有限公司;三乙胺、氯甲酸异丁酯、乙腈,上海麦克林生物科技有限公司;吐温-20、牛血清蛋白(bovine albumin,BSA)、2-吗啉乙磺酸(2-morpholinoethanesulfonic acid,MES),上海生工生物工程技术服务有限公司;三卡因标准品,德国LGC公司;三卡因抗体,无锡迪腾敏生物科技有限公司;3-氨基苯甲酸、1-乙基-3-二甲基氨基丙基碳酰二亚胺盐酸盐[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC]、N-羟基琥珀酰亚胺(N-hydroxy succinimide,NHS),美国Sigma公司;羊抗鼠IgG、吸水垫、硝酸纤维素膜(CN140)、结合垫、样本垫、覆膜、底板,上海捷宁生物科技有限公司;超顺磁性纳米材料 (PM3-020,180 nm,棕褐色),上海奥润微纳新材料科技有限公司;均质子、QuEChERS 净化管,逗点生物有限公司;TMB显色液,上海泛柯实业有限公司;羊抗鼠IgG-HRP,上海威奥生物科技有限公司。
1.2 仪器与设备
Bio-Tek酶标仪,美国伯腾仪器有限公司;切条机,上海捷宁生物科技有限公司;HS-3垂直混合器,宁波新芝生物科技股份有限公司;KQ400-KDE超声清洗器,昆山市超声仪器有限公司;恒温培养箱,上海一恒科学仪器有限公司;磁性分析仪MICAD-F1,自研;磁力架,上海奥润微纳新材料科技有限公司;QL-901 漩涡振荡器,海门其林贝尔仪器制造有限公司。
1.3 实验方法
1.3.1 3-氨基苯甲酸-BSA抗原的制备与表征
将6 mg 3-氨基苯甲酸溶于500 μL N,N-二甲基苯胺,以体积比100∶1加入三乙胺,垂直混合(4 ℃,15 min),加入3 μL氯甲酸异丁酯,垂直混合(4 ℃,1 h),再加1.4 mL BSA(2.5 mg/mL),垂直混合(4 ℃,过夜),用10 mmol/L PBS(pH 7.2)透析72 h后于-20 ℃保存备用。分别对2 mg/mL BSA、3-氨基苯甲酸和 3-氨基苯甲酸-BSA抗原进行紫外光谱扫描,观察吸收峰位置。
1.3.2 间接竞争酶联免疫吸附试验
参考胥传来等[15]方法,以碳酸盐[CBS(Na2CO3和NaHCO3),50 mmol/L,pH 9.6]为包被缓冲液,10 μg/mL 3-氨基苯甲酸-BSA抗原作为包被抗原4 ℃过夜反应。以50 g/L脱脂奶粉(200 μL/孔)作为封闭溶液,37 ℃反应2 h。0.5~2 700 ng/mL三卡因标准溶液先与三卡因单抗(1∶25 000,体积比)混合均匀(37 ℃预孵育1 h)后于加入酶标孔中37 ℃孵育1 h。充分洗涤后加入羊抗鼠IgG-HRP(用PBS以体积比1∶2 500稀释)37 ℃孵育1 h,最后加入TMB显色液25 ℃显色15 min,加入2 mol/L硫酸终止反应,用酶标仪检测450 nm处吸光度值。
1.3.3 磁性纳米探针的制备
参考LIU等[16]方法,将500 g/L EDC和250 g/L NHS以体积比1∶2加入含有1 mg 磁性纳米材料的MEST缓冲液[含有0.05%(体积分数)吐温-20的MES缓冲液,10 mmol/L,pH=5.0],垂直混合(25 ℃,30 min),加入20 μg 三卡因单抗,垂直混合(25 ℃,3 h),随后加入0.5 mL 10 g/L BSA,垂直混合(25 ℃,30 min),最后将探针置于1 g/L BSA、0.1g/L NaN3的BST[含0.05%吐温(体积分数)-20的硼酸盐缓冲液,5 mmol/L,pH 9.0]溶液中保存备用。
1.3.4 三卡因试纸条的构建
首先将0.5 mg/mL的3-氨基苯甲酸-BSA抗原、0.5 mg/mL羊抗鼠IgG以1 μL/cm的速度分别喷涂在NC膜的检测线(T线)和质控线(C线)上,37 ℃下干燥2 h;然后把NC膜、样品垫、结合垫、吸水垫及聚氯乙烯底板依次组装,裁切成5 mm宽的试纸条密封干燥保存。
1.3.5 三卡因试纸条的样品检测和结果判定
将待测样品、磁性纳米探针和层析液[含有5%(体积分数)吐温-20、200 g/L BSA的PBS缓冲液]以体积比100∶4∶15混合均匀后滴加于样品垫上,静置(倾斜10度)5~10 min后肉眼观察T线和C线显色情况,以PBS缓冲液代替样品的混合溶液作为阴性对照。检测结束后,C线颜色明显,样品的T线颜色明显浅于阴性对照甚至完全消失的为阳性结果,而样品的T线颜色与阴性对照接近或更深的则为阴性;如果检测时C线未显色表示该试纸条无效。反应20 min后采用磁性分析仪检测试纸条T、C线上的磁信号值,绘制三卡因的定量标准曲线。采用公式(1)判定检测结果。
(1)
式中:S,仪器检测到的磁信号值;B,检测样本的T/C线的磁信号比值;B0,阴性对照的T线和C线的磁信号比值。当B/B0≥0.8时为阴性,0.3≤B/B0<0.8为弱阳性,B/B0<0.3为强阳性结果。
1.3.6 检测性能评价
特异性:以10 μg/mL的三卡因、布比卡因、苯佐卡因、利多卡因、丁香酚、苯氧乙醇、丙泊酚7种常见渔用麻醉剂为样品进行试纸条检测,以PBS缓冲液代替样品的混合溶液作为阴性对照。
灵敏度:采用0~500 μg/mL系列质量浓度三卡因溶液进行试纸条检测,以肉眼观察到T线消失时的三卡因浓度作为试纸条定性检出限,每个浓度设置3个平行,以阴性样本B/B0值的平均值减去三倍标准差对应的浓度作为检出限。
重现性和稳定性:分别采用同一批次和不同批次的试纸条检测0.5、1.0、5.0 μg/mL三卡因,根据检测结果评价试纸条的重现性。利用高温加速试验原理[17],将试纸条存放于60 ℃烘箱,每隔1 d检测1次0.5、1.0、5.0 μg/mL三卡因样品,持续5 d,根据检测结果判断试纸条的稳定性。
1.3.7 人工污染样品检测和方法学验证
采集校园内不同的鱼塘水作为稀释溶液,分别制备0.5、1.0、5.0 μg/mL三卡因人工污染水体。此外,将草鱼洗净,取部分鱼肉样品于组织匀浆机搅碎混匀,放置-20 ℃冰箱保存备用。取5 g匀浆后的鱼肉于50 mL离心管,加入三卡因标准品进行混合,加入500 μL 去离子水和一粒均质子涡旋振荡5 min,涡旋混匀后加入1 mL乙腈振荡提取(25 ℃,10 min),随后加入1 g MgSO4涡旋振荡30 s,离心收集上清(4 ℃,4 000 r/min,5 min),过净化管小柱净化,收集流出液,60 ℃氮吹至近干,加入PBS定容至2.5 mL,制备0.5、1.0、5.0 μg/mL三卡因人工污染鱼肉提取液。过0.22 μm膜,收集滤液作为样品,分别用HPLC和试纸条进行检测,依据定量结果计算回收率。
2 结果与分析
2.1 3-氨基苯甲酸-BSA抗原的鉴定
3-氨基苯甲酸-BSA分子结构与三卡因相似,且末端有直接与载体蛋白偶联的羧基,与载体偶联后仍保留基本结构不变[18],因此本研究以3-氨基苯甲酸为半抗原,利用三乙胺/氯甲酸异丁酯混合酸酐法把BSA和3-氨基苯甲酸偶联制备3-氨基苯甲酸-BSA复合物,以此作为ELISA和试纸条T线的包被抗原。紫外吸收光谱结果(图1-a)显示,3-氨基苯甲酸在220~260及305 nm处有多个特征吸收峰,BSA则在280 nm附近有特征吸收峰,与BSA相比,3-氨基苯甲酸-BSA复合物在260~320 nm处的吸收峰较宽;与3-氨基苯甲酸相比,3-氨基苯甲酸-BSA复合物220~260 nm处的吸收峰形状发生改变,由此可见,3-氨基苯甲酸-BSA复合物的这些紫外吸收峰改变可能是BSA和3-氨基苯甲酸的偶联所致。为了进一步评价3-氨基苯甲酸-BSA是否偶联成功,本研究以10 μg/mL 3-氨基苯甲酸-BSA作为包被抗原,采用三卡因的特异性单抗进行竞争性ELISA检测,结果如图1-b所示,呈现一个典型的“S”型竞争曲线,表明3-氨基苯甲酸-BSA与抗体间存在特异性反应,经计算抗体的IC50值为32.12 ng/mL。沈心怡[19]采用间接竞争ELISA方法评价丁香酚、三卡因抗体的质量,测得IC50值分别为42.844、43.399 ng/mL,证明抗体的灵敏度较高,且包被抗原与抗体之间具有较强的亲和力和特异性。本研究得到的IC50较之更小,由此可见,合成的3-氨基苯甲酸-BSA抗原可用于免疫层析试纸条检测。
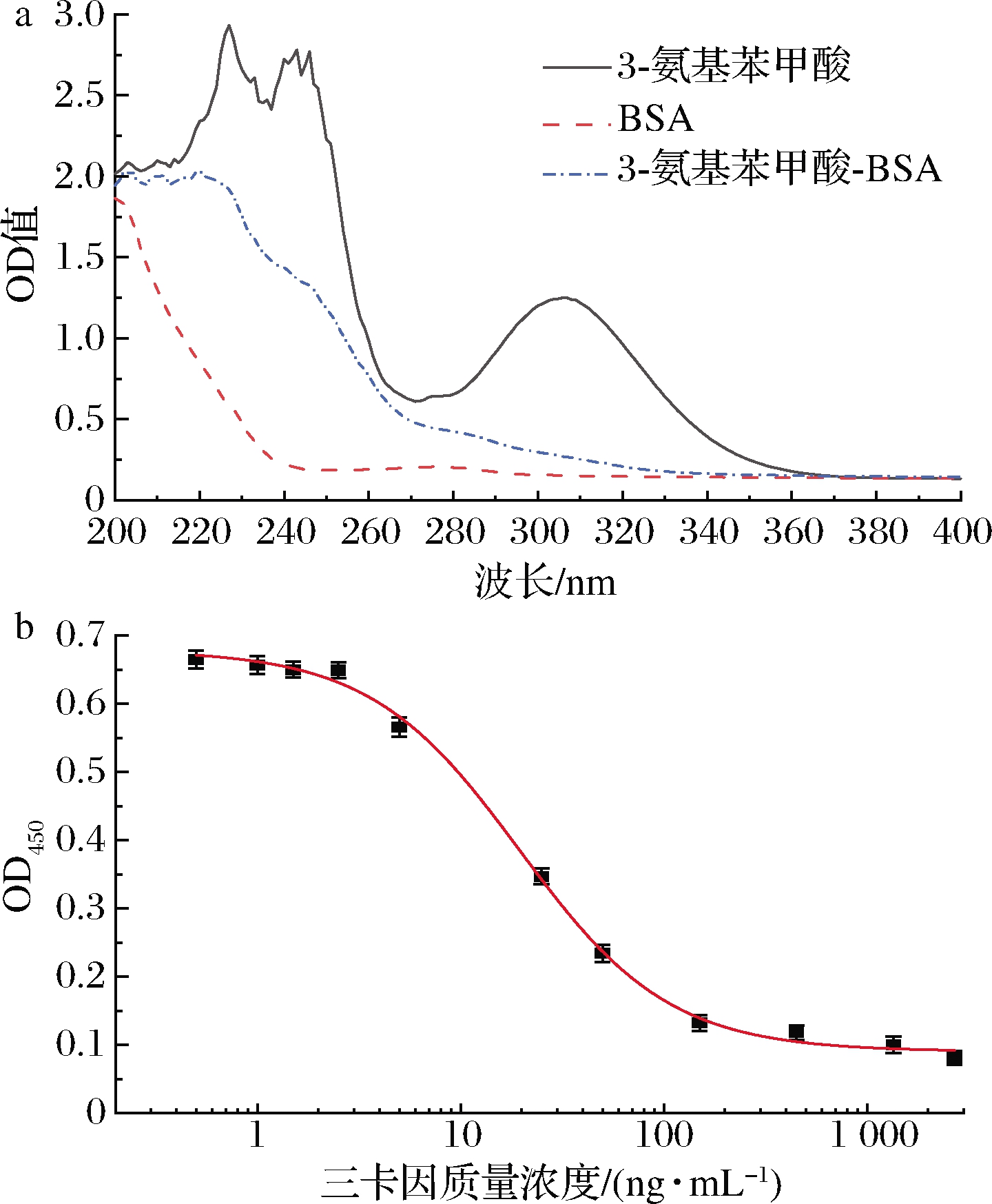
a-紫外吸收光谱图;b-竞争ELISA抑制曲线
图1 三卡因完全抗原的紫外吸收光谱和竞争ELISA曲线图
Fig.1 The UV absorption spectrum and competitive ELISA curve of tricaine complete antigen
2.2 基于磁性纳米探针的三卡因层析检测原理
三卡因的检测试纸条结构如图2所示,由样品垫、结合垫、NC、吸水垫组成,T线包被3-氨基苯甲酸-BSA抗原,C线包被羊抗鼠IgG。若样品中无三卡因时,磁纳米探针与T线上的3-氨基苯甲酸-BSA抗原发生特异性反应从而停留在T线上,而C线上的羊抗鼠IgG和探针表面的三卡因单抗也存在特异性反应,因而试纸条的T线和C线都可以通过肉眼观察到颜色,用磁信号仪检测时可以看到T和C线处均有吸收峰,检测结果为阴性(图2,右上)。当样品中三卡因浓度逐渐增加时,被T线捕获的磁性纳米探针则越来越少,T线显色减弱,颜色越浅,相应的磁信号吸收峰变小(图2,右下),其检测结果为阳性。

图2 磁性免疫层析试纸条定量检测三卡因的原理图
Fig.2 Schematic of magnetic immunochromatographic test strip for quantitative detection of tricaine
2.3 特异性
本研究选用了三卡因、布比卡因、苯佐卡因、利多卡因、丁香酚、苯氧乙醇、丙泊酚7种常见的渔用麻醉剂评价所开发试纸条的检测特异性,检测结果如图3所示。由图3-a可知,仅三卡因的检测试纸条,在T线处的检测限肉眼几乎不可见,而丁香酚、布比卡因等其他6种麻醉剂的T线处颜色与阴性对照几乎一致,表明磁性纳米探针表面的三卡因单抗仅与三卡因有特异性反应,与其他麻醉剂无交叉反应。此外,依据试纸条的T线和C线的定量检测结果,三卡因样品的B/B0<0.2,为强阳性结果(图3-b);而其他6种麻醉剂的B/B0均大于0.9,与阴性样品接近(图3-b),为阴性结果。由此可见,定量结果与定性观察到的结果相吻合。三卡因与苯佐卡因互为同分异构体[20],而本试纸条对苯佐卡因无交叉反应,表明该试纸条具有良好的特异性,检测时不受其他渔用麻醉剂的干扰,具有较好的应用前景。

a-定性结果;b-定量结果
图3 三卡因试纸条特异性检测
Fig.3 SpeciffiIcity of tricaine test strip
2.4 灵敏度
采用三卡因试纸条分别检测PBS和鱼肉基质和水体中的三卡因标准品,其定性和定量检测结果见图4。由图4可知,T线颜色随着三卡因质量浓度的增加而逐渐变浅,当PBS缓冲液(图4-a)、鱼肉基质(图4-b)和水体(图4-c)中的三卡因质量浓度达到2.5 μg/mL (鱼肉基质1.25 μg/g)时,T线颜色很浅,而5.0 μg/mL(鱼肉基质2.5 μg/g)时则几乎肉眼不可见。以T线消失时的质量浓度作为定性检出限,因此鱼肉基质5.0 μg/mL(相当于2.5 μg/g)可作为试纸条的定性检出限。采用磁性免疫层析分析仪测定T、C线的磁信号强度,通过数据拟合表明,所建立的三卡因快速检测方法对PBS缓冲液、鱼肉基质、水体样本的标准曲线如公式(2)~公式(4)所示:
(2)
(3)
(4)
式中:Y,检测样本的T/C线的磁信号比值与阴性对照的T线和C线的磁信号比值的比值(B/B0);X,三卡因质量浓度,μg/mL。
根据B/B0值与三卡因加标浓度绘制标准曲线(图4-d),检出限采用公式计算得出[21]。由图4-d可知,3个曲线基本一致,表明鱼肉基质对试纸条的检测干扰较小。经计算,该试纸条对PBS稀释三卡因的检出限为0.131 μg/mL,对鱼肉基质中三卡因的检出限为0.150 μg/mL(相当于0.075 μg/g),对水体中三卡因的检出限为0.141 μg/mL,仅为美国FDA规定的水产品中三卡因最大残留量(1 μg/mL)的1/6。
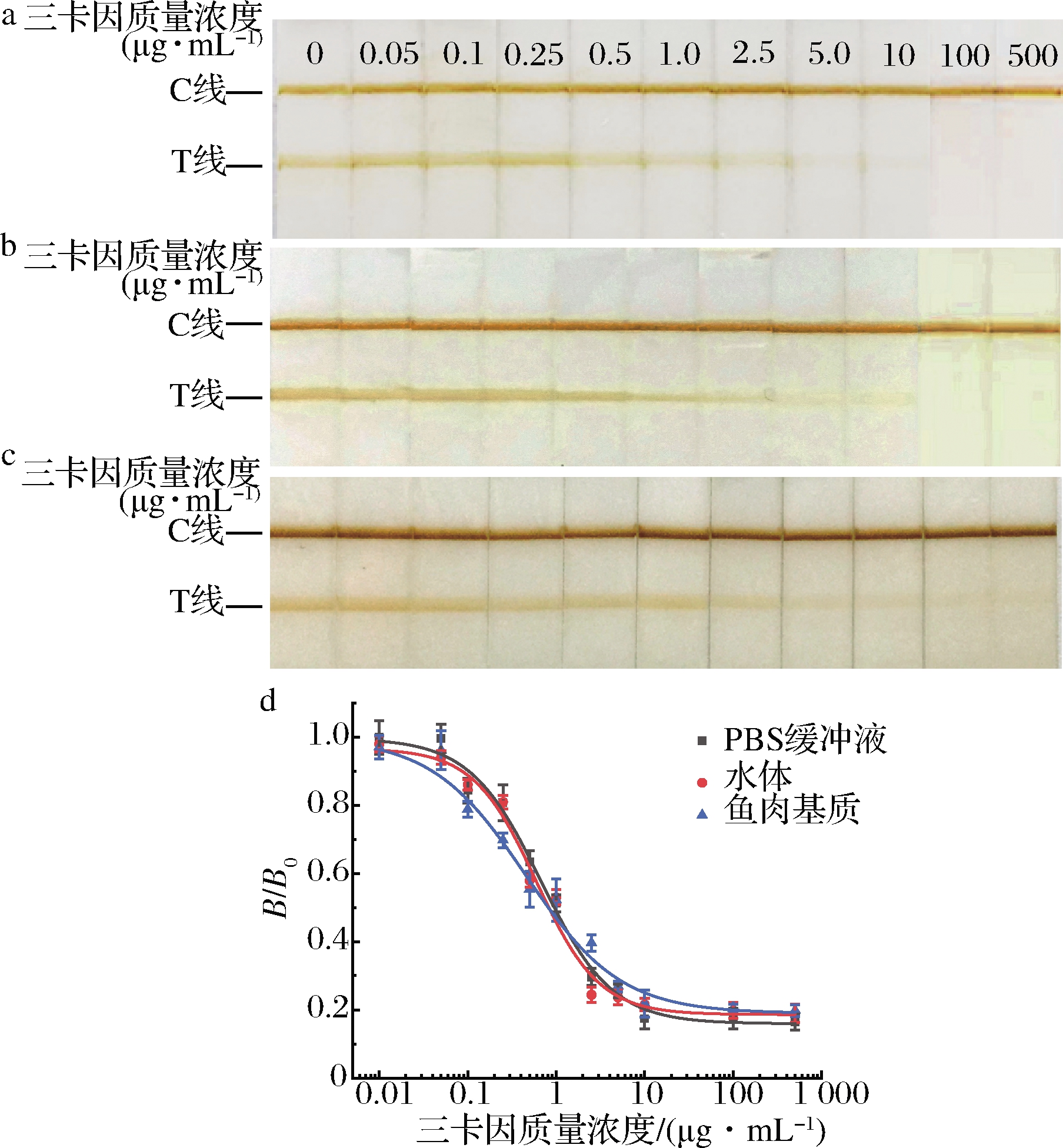
a-PBS缓冲液;b-鱼肉基质;c-水体;d-定量标准曲线
图4 三卡因试纸条灵敏度检测
Fig.4 Sensitivity of tricaine test strip
通常水产品运输水体和鱼肉基质中三卡因的浓度要远远大于该试纸条的检出限,如王文豪等[22]研究发现适合麻醉大口黑鲈鱼的三卡因剂量为70 mg/L,最适的运输质量浓度为50 mg/L。李宁等[8]采用50 mg/L三卡因对大口黑鲈鱼进行麻醉,发现复苏8 h鱼肉基质中三卡因残留量高达36.24 mg/kg。尽管仪器分析法灵敏度高,由于耗时长、操作繁琐、场地受限等问题难以满足三卡因现场检测需求。刘海新等[13]建立了鱼肉中三卡因残留的GC-MS检测方法,方法检出限为2.5 μg/kg,但鱼肉样品测定前需要经乙腈提取、氮吹浓缩、盐酸溶液引导三卡因电离、固相萃取柱净化等处理,从样品处理到检测完成所用时间大于3 h,操作繁琐。刘春新等[23]建立了鱼血和鱼肝中三卡因的HPLC检测方法,样品经匀浆、高速离心、0.45 μm膜过滤处理后上样检测,使用鱼血(稀释倍数30 mg/mL)和鱼肝(稀释倍数30 mg/mL)匀浆液制备质量浓度为10、20、40、80、100 μg/mL的三卡因,成功建立了三卡因的工作标准曲线,但回收率较低,其中鱼血中回收率低至80%,鱼肝中回收率低至66.66%,说明基质效应对该方法的影响较大。而本研究建立的试纸条法,鱼肉基质干扰较小,从样品处理到检测仅需约40 min,且操作简单,无需大型仪器,成本低廉,适合于水产品中残留三卡因的现场快速筛查和检测。
2.5 准确性评价
分别采用三卡因试纸条和HPLC检测三卡因人工污染水体和鱼肉基质(n=3),结果见表1。试纸法与HPLC对三卡因各浓度的检测结果比较接近,表明试纸法与HPLC具有良好的一致性。试纸法对水体和鱼肉基质中三卡因的加标回收率81.56%~113.59%,但是鱼肉基质各样品检测值的CV值明显高于水体组样品,由此可见,在可接受范围内鱼肉基质对试纸条的检测存在干扰。鱼肉基质加标三卡因样品5.0 μg/mL(相当于2.5 μg/g)的试纸条回收率最低,为(81.56±4.98)%,且样本间的变异系数CV较高(6.1%),表明检测高浓度三卡因麻醉剂时,鱼肉基质对试纸条的检测结果干扰相对较大。HPLC分析方法因为其通过色谱柱分离富集,减少了基质带来干扰。尽管仪器分析法准确性高,但在检测效率上是远远低于试纸法。黎智广等[24]采用HPLC-MS/MS检测水产品中的三卡因,样品需要提取、氮吹、过膜等前处理步骤,时长约3 h,样品检测还需15 min以上。本研究建立的试纸法样品前处理操作简单(约40 min),可在5~10 min实现定性检测,20 min实现准确定量检测,大大缩短了检测时间,且操作简单,能够有效提高检测效率。
表1 试纸法与HPLC法对三卡因人工污染水体和鱼样的检测结果
Table 1 Test results of tricaine by test strip and HPLC in artificially contaminated water and fish samples
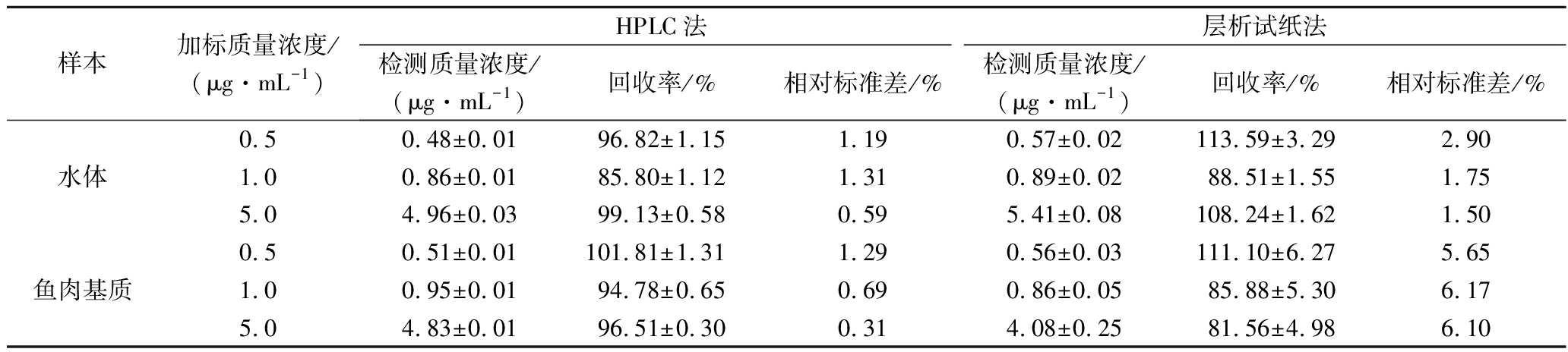
样本加标质量浓度/(μg·mL-1)HPLC法层析试纸法检测质量浓度/(μg·mL-1)回收率/% 相对标准差/%检测质量浓度/(μg·mL-1) 回收率/% 相对标准差/%0.50.48±0.0196.82±1.151.190.57±0.02113.59±3.292.90水体1.00.86±0.0185.80±1.121.310.89±0.0288.51±1.551.755.04.96±0.0399.13±0.580.595.41±0.08108.24±1.621.500.50.51±0.01101.81±1.311.290.56±0.03111.10±6.275.65鱼肉基质1.00.95±0.0194.78±0.650.690.86±0.0585.88±5.306.175.04.83±0.0196.51±0.300.314.08±0.2581.56±4.986.10
2.6 重现性和稳定性
三卡因试纸条的检测重现性主要采用批内和批间实验进行评价,本研究在检测线性范围内,以PBS为稀释溶液,选择了低、中、高加标浓度(0.5、1.0、5.0 μg/mL)进行试纸条检测。由表2可知,来自同一批次(批内)及不同批次(批间)的试纸条对三卡因的检测浓度与其加标浓度基本一致,不同浓度加标样品对应的批内差异(CV<5%)略小于批间差异(CV<6%),该结果与WANG等[25]对试纸条重现性检测的结论一致。各浓度的同一批次检测结果,其回收率为89.2%~112%,且变异系数较低(CV<5%),表明本研究所构建的试纸条具有较好的重现性。采用高温加速实验对试纸条的稳定性进行分析,结果见表2,随着高温保存时间的延长,试纸条对低、中和高浓度三卡因的检测结果并未发生明显变化,试纸条在60 ℃保存5 d后,其B/B0的变异系数CV值仍小于8%,表明试纸条稳定性很好。徐晓巍等[26]基于磁纳米探针构建了乙肝快速检测试纸条,并进行了37 ℃高温加速实验检测试纸条稳定性,结果表明,该试纸条可在37 ℃下稳定保存3周,相当于25 ℃下可保存半年。根据Arrhenius方程,试纸条在干燥环境下60 ℃贮存1 d相当于25 ℃贮存1个月[17]。由此推测该试纸条25 ℃下至少可保存5个月,将其密封保存至4 ℃下,可保存更长时间。
表2 试纸条重现性和稳定性检测(n=5)
Table 2 Reproducibility and stability test of tricaine test strip (n=5)

加标浓度/(μg·mL-1)批内检测批间检测第1天第5天检测质量浓度/(μg·mL-1)相对标准差/%检测质量浓度/(μg·mL-1)相对标准差/%检测质量浓度/(μg·mL-1)相对标准差/%检测质量浓度/(μg·mL-1) 相对标准差/%0.50.56±0.023.990.54±0.035.570.51±0.024.390.54±0.046.901.00.93±0.032.980.93±0.044.141.05±0.043.591.04±0.087.905.04.46±0.224.905.28±0.275.034.32±0.214.825.10±0.367.08
3 讨论
三卡因是长途运输活鱼常用的一种渔用麻醉剂,尽管其应用于水产品麻醉中具有很大优势,但被人体大量摄入后会对人体造成不良反应。据研究调查结果表明,水产品长途运输过程中三卡因有效麻醉浓度较高、运输时间(持续麻醉时间)较长,进而导致水产品中残留有大量的三卡因。如陈永平等[27]对三卡因在草鱼、花鲈、鲫鱼组织中的富集和消除进行探究,采用50 mg/L的三卡因对质量约100 g的3种鱼进行浸泡,发现浸泡3 h时三卡因在草鱼血液、肌肉和肝胰脏的残留量分别为2.341 μg/mL、1 275 μg/kg、2 130 μg/kg;花鲈鱼中的残留量分别为1.856 μg/mL、1 467 μg/kg、1 717 μg/kg;鲫鱼中的残留量分别为2.382 μg/mL、1 241 μg/kg、1 962 μg/kg。复苏8 h后,草鱼肌肉和肝胰脏残留三卡因含量为120 μg/kg和482 μg/kg;花鲈鱼中残留量为244 μg/kg和334 μg/kg;鲫鱼中残留量为132 μg/kg和504 μg/kg。由此可见,复苏后的鱼体内还残留有大量的三卡因,而本研究构建的三卡因快速检测试纸条检测限为75 μg/kg,可实现运输水体中和鱼肉组织中三卡因的快速筛查和初步分析,使相关部门快速了解麻醉剂污染情况。仪器检测方法在检测灵敏度上的确占有优势,但对仪器设备和操作人员的技术能力依赖性较强,耗时长,所以不适用于渔业基层监管部门的现场监管。如表3所示,HPLC-MS/MS及GC-MS/MS等仪器方法是目前三卡因的主要检测手段,其中,HPLC-MS/MS法的检出限达1.0 μg/kg,但检测时间大于90 min,且样品的前处理需要经过提取、离心、旋转蒸发、净化等多次操作,过程较为复杂,无法满足快速检测的需求。GC-MS/MS法的检出限达2.0 μg/kg,由于前处理需要经过重复提取、离心、净化、氮吹、过膜等步骤,整个检测时长大于120 min,这导致仪器分析无法应用于现场快速检测。本研究利用磁性纳米材料标记三卡因单抗,构建了可准确检测鱼肉基质和水体中三卡因的试纸条检测方法,且水体无需进行特殊的前处理,只需肉眼观察T线和C线的颜色即可在5~10 min 内实现三卡因的快速定性检测,定量检出限低至0.141 μg/mL,且操作简单、成本低,可进行现场大规模检测,采用本研究开发的试纸条检测鱼肉基质中三卡因,其结果为阳性表示鱼肉中三卡因残留量较高,污染程度较高,对监管部门具有示警作用。
表3 三卡因检测方法比较
Table 3 Comparison of different detection methods of tricaine
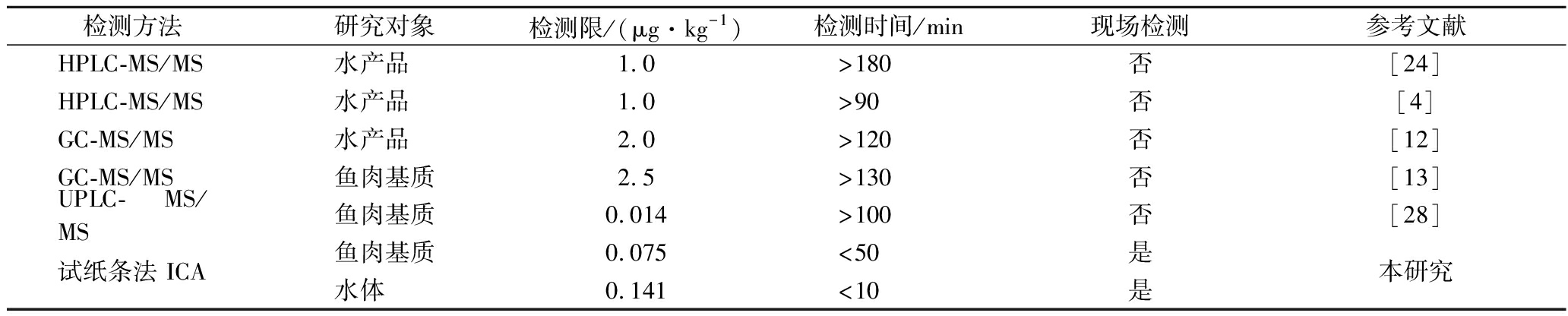
检测方法研究对象检测限/(μg·kg-1)检测时间/min现场检测参考文献HPLC-MS/MS水产品 1.0>180否 [24]HPLC-MS/MS水产品 1.0>90否 [4]GC-MS/MS水产品 2.0>120否 [12]GC-MS/MS鱼肉基质2.5>130否 [13]UPLC- MS/MS鱼肉基质0.014>100否 [28]试纸条法 ICA鱼肉基质0.075<50是 本研究水体 0.141<10是
4 结论
本研究将磁性纳米探针与层析检测技术相结合,建立了一种渔用麻醉剂三卡因的快速定性和定量检测试纸条。该试纸条可在5~10 min内实现水体和鱼肉基质中三卡因的定性检测,其检出限为0.141 μg/mL和0.150 μg/mL(相当于0.075 μg/g),仅为美国对水产品中三卡因最大残留量要求(1 μg/mL)的1/6,可对水产品在运输过程中及出售前水体中的三卡因进行初步快速分析,对苯佐卡因、利多卡因、丁香酚、苯氧乙醇、丙泊酚等常见渔用麻醉剂无交叉反应,特异性高。此外,该试纸条具有较好的稳定性(25 ℃下可保存半年),操作简便,不仅为国内市场三卡因快速检测试剂盒的缺乏提供参考价值,还实现了鱼肉基质和水体中三卡因的现场快速筛查与检测,为今后水产品及水体中三卡因的监控提供了技术支撑,保障鲜活水产品的质量安全。
[1] 罗茵. 《2020中国渔业统计年鉴》出版广东水产品总产量首次全国第一[J].海洋与渔业, 2020(6):12-13.
LUO Y.2020 China Fishery Statistical Yearbook published for the first time in Guangdong, the total output of aquatic products ranks first in the country[J].Ocean and Fishery, 2020(6):12-13.
[2] 张卫兵. 中国水产品质量安全事件10年回顾与思考[J].中国卫生标准管理, 2010, 1(5):57-61.
ZHANG W B.Review and thinking of china′s aquatic product quality and safety incidents[J].China Health Standard Management, 2010, 1(5):57-61.
[3] WEBER R A, PELETEIRO J B, MART N L O G, et al.The efficacy of 2-phenoxyethanol, metomidate, clove oil and MS-222 as anaesthetic agents in the Senegalese sole (Solea senegalensis Kaup 1858)[J].Aquaculture, 2009, 288(1):147-150.
N L O G, et al.The efficacy of 2-phenoxyethanol, metomidate, clove oil and MS-222 as anaesthetic agents in the Senegalese sole (Solea senegalensis Kaup 1858)[J].Aquaculture, 2009, 288(1):147-150.
[4] 朱敏, 孙伟红, 邢丽红, 等.液相色谱-串联质谱法测定水产品中麻醉剂MS-222残留[J].分析试验室, 2012, 31(6):59-62.
ZHU M, SUN W H, XING L H, et al.Determination of MS-222 residues in aquactic products by liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analysis Laboratory, 2012, 31(6):59-62.
[5] 汤保贵, 张健东, 陈刚.MS-222对尼罗罗非鱼的急性毒性及血液指标的影响[C].2010年中国水产学会学术年会论文摘要集.西安:中国水产学会,2010.
TANG B G, ZHANG J D, CHEN G.The effect of MS-222 on the acute toxicity and blood indexes of Nile tilapia[C].2010 Annual Conference of Chinese Fisheries Society.Xi′an:China Society of Fisheries,2010.
[6] 刘伟, 陈再忠.麻醉剂MS-222对金鱼体内AKP、CAT和ACP活性的影响[J].上海海洋大学学报, 2010, 19(3):327-332.
LIU W, CHEN Z Z.Effects of the anesthetic MS-222 on the activities of AKP, CAT and ACP in goldfish[J].Journal of Shanghai Ocean University, 2010, 19(3):327-332.
[7] 吕书为, 雷红涛,孙明远.鱼用麻醉剂安全性研究进展[J].食品科学,2012,33(1):267-270.
LYU S W,LEI H T,SUN M Y.Research progress in safety of fish anesthetics[J].Food Science, 201,33(1):267-270.
[8] 李宁,白婵,熊光权,等.丁香酚和三卡因甲磺酸盐在大口黑鲈中代谢残留的比较[J].现代食品科技,2020,36(3):56-64;71.
LI N, BAI C, XIONG G Q, et al.Comparision of metabolic residues of eugenol and tricaine methanesulfonate (MS-222) in large mouth bass[J].Modern Food Science and Technology,2020,36(3):56-64;71.
[9] 郝长杰,庄平,赵峰, 等.MS-222和丁香酚对暗纹东方鲀幼鱼麻醉效果的比较研究[J].海洋渔业,2019,41(5):546-554.
HAO C J, ZHUANG P, ZHAO F, et al.Comparative study on anesthetic effect of MS-222 and clove oil on juvenile Takifugu obscurus[J].Marine Fisheries, 2019,41(5):546-554.
[10] 任洁, 韩育章, 何静, 等.鱼体组织中MS-222的高效液相色谱分析方法[J].水利渔业, 2000,21(5):6-8.
REN J, HAN Y Z, HE J, et al.Analytical method of MS-222 in fish body tissues by high performance liquid chromatography[J].Journal of Hydroecology, 2000,21(5):6-8.
[11] 郑向华, 孙婷, 陈燕, 等.固相萃取-液相色谱串联质谱法同时测定水产品中3种鱼用麻醉剂残留量[J].食品科技, 2020, 45(4):333-337.
ZHENG X H, SUN T, CHEN Y, et al.Determination of three residues of anaesthetic for fish in aquatic products by solid-phase extraction with liquid chromatography tandem mass spectrometry[J].Food Science and Technology, 2020,45(4):333-337.
[12] 翟纹静, 朱振华, 王莉莉, 等.用三重四级杆气质联用仪测定水产品中多种麻醉剂[J].大连海洋大学学报, 2018, 33(6):769-774.
ZHAI W J, ZHU Z H, WANG L L, et al.Detection of anesthetic residues in aquatic products by gas chromatography-tandem mass spectrometry[J].Journal of Dalian Ocean University, 2018, 33(6):769-774.
[13] 刘海新, 张农, 余颖, 等.气相色谱-质谱法检测鱼肉中MS-222残留[J].福建水产, 2013, 35(6):441-447.
LIU H X, ZHANG N, YU Y, et al.Studies on detecting MS-222 residues in fish meat by GC-MS[J].Journal of Fisheries Research, 2013, 35(6):441-447.
[14] 王策, 刘晓婷, 王成彬.基于超顺磁性磁珠的免疫层析技术的应用[J].临床检验杂志(电子版), 2015, 4(2):859-866.
WANG C, LIU X T, WANG C B.Application of immunochromatographic technology based on superparamagnetic magnetic beads[J].Clinical Laboratory Journal(Electronic Edition), 2015, 4(2):859-866.
[15] 胥传来,沈心怡,匡华,等.一株分泌三卡因单克隆抗体的杂交瘤细胞株HOT及其应用:中国, CN110747173A[P].2020-02-04.
XU C L, SHEN X Y, KUANG H, et al.A hybridoma cell line HOT secreting tricaine monoclonal antibody and its application:China, CN110747173A[P].2020-02-04.
[16] LIU Y, ZHANG Z, WANG Y, et al.A highly sensitive and flexible magnetic nanoprobe labeled immunochromatographic assay platform for pathogen Vibrio parahaemolyticus[J].International Journal of Food Microbiology, 2015, 211:109-116.
[17] 龚云飞, 陈宗伦, 奚茜, 等.三聚氰胺胶体金免疫层析试纸条的研制[J].生物工程学报, 2012, 28(7):887-898.
GONG Y F, CHEN Z L, XI X, et al.Colloidal gold immunochromatographic strip for rapid detection of melamine[J].Chin J Biotech, 2012, 28(7):887-898.
[18] 宋娟, 王榕妹, 王悦秋, 等.半抗原的设计、修饰及人工抗原的制备[J].分析化学, 2010, 38(8):1 211-1 218.
SONG J, WANG R M, WANG Y Q, et al.Hapten design, modification and preparation of artificial antigens[J].Chinese Journal of Analytical Chemistry, 2010,38(8):1 211-1 218.
[19] 沈心怡. 鱼肉中四种渔药残留免疫快速检测方法研究[D].无锡:江南大学, 2020.
SHEN X Y.Rapid Immunoassay for the detection of four fishery drug residues in fish[D].Wuxi:Jiangnan University, 2020.
[20] 高平, 杨曦, 莫彩娜, 等.通过式固相萃取净化/高效液相色谱-串联质谱法快速测定水产品中6种麻醉剂残留[J].分析测试学报, 2019, 38(9):1 059-1 065.
GAO P, YANG X, MO C N, et al.Rapid determination of six anesthetics residues in aquatic products by high performance liquid chromatography-tandem mass spectrometry with pass-through solid phase extraction[J].Journal of Instrumental Analysis, 2019, 38(9):1 059-1 065.
[21] WU Y, ZHOU Y, HUANG H, et al.Engineered gold nanoparticles as multicolor labels for simultaneous multi-mycotoxin detection on the immunochromatographic test strip nanosensor[J].Sensors and Actuators B:Chemical, 2020, 316:128107.
[22] 王文豪,董宏标,孙永旭,等.MS-222和丁香酚在大口黑鲈幼鱼模拟运输中的麻醉效果[J].南方水产科学,2018,14(6):52-58.
WANG W H, DONG H B, SUN Y X, et al.Anesthetic effects of MS-222 and eugenol in simulated transportation of juvenile largemouth bass (Micropterus salmoides)[J].South China Fisheries Science,2018,14(6):52-58.
[23] 刘春新, 强世伟, 崔冶建, 等.高效液相色谱法测定鱼体中鱼用麻醉剂的浓度[J].中南民族学院学报(自然科学版), 1998,17(3):15-18.
LIU C X, QIANG S W, CUI Y J, et al.Determination of anaesthetic for fish in fish using high performance liquid chromatographic method[J].Journal of South-Central University for Nationalities(Natural Science Edition), 1998,17(3):15-18.
[24] 黎智广, 杨宏亮, 王旭峰, 等.高效液相色谱-串联质谱测定水产品中三卡因残留[J].中国渔业质量与标准, 2016, 6(1):53-57.
LI Z G, YANG H L, WANG X F, et al.High performance liquid chromatography-tandem mass spectrometry determination of MS-222 residues in aquatic products[J].Chinese Fishery Quality and Standards, 2016, 6(1):53-57.
[25] WANG W, LIU L, XU L, et al.Gold-nanoparticle-based multiplexed immunochromatographic strip for simultaneous detection of staphylococcal enterotoxin A, B, C, D, and E[J].Particle and Particle Systems Characterization, 2016, 33(7):388-395.
[26] 徐晓巍, 崔正权, 卢瑛, 等.基于磁性纳米探针的乙肝前S1抗原的快速磁性免疫层析方法的建立[J].生物学杂志, 2016, 33(1):98-103.
XU X W, CUI Z Q, LU Y, et al.Establishment of HBV rapid magnetic immunochromatographic method based on magnetic nanoprobe for Pre-S1 antigen[J].Journal of Biology, 2016, 33(1):98-103.
[27] 陈永平,韩现芹,陈建,等.MS-222在草鱼、花鲈、鲫鱼组织中的富集与消除[J].水产科学,2019,38(4):527-532.
CHEN Y P, HAN X Q, CHEN J, et al.Accumuiation and elimination dynamics of anesthetic MS-222 in tissues of grass carp,bass and crucian carp[J].Fisheries Science, 2019,38(4):527-532.
[28] 刘平, 辛爽英, 范赛, 等.超高效液相色谱-串联质谱法同时检测鱼肉中5种渔用麻醉剂残留[J].卫生研究, 2019, 48(4):640-645;650.
LIU P, XIN S Y, FANS, et al.Simultaneous detection of five fishery anesthetics residues in fish by ultra performance liquid chromatography-tandem mass spectrometry[J].Journal of Hygiene Research, 2019, 48(4):640-645;650.