美拉德反应是指还原糖类等羰基化合物和氨基化合物之间的反应,其除了会赋予食品独特的风味和诱人的色泽,还会产生糖基化终末产物(advanced glycation endproducts,AGEs)等有害物质[1]。AGEs 在食品中广泛存在并通过摄入的食品积累在体内,有研究表明食品中羧甲基赖氨酸[Nε-(carboxymethyl)lysine,CML]、羧乙基赖氨酸[Nε-(carboxyethyl)lysine,CEL]是体内AGEs 的主要来源[2],AGEs 的积累会使人体产生氧化应激反应,对糖尿病、肾病、动脉粥样硬化、阿尔兹海默症等疾病的诱发有着重要影响[3]。相对于低 AGEs 含量的饮食,摄取 AGEs 含量较高的食物容易引起实验动物肾病的发生[4]。因此检测与限制调控食品中的AGEs对于保障食品安全具有重要意义。目前报道的检测方法主要为酶联免疫法(enzyme-linked immunosorbent assay,ELISA)[5]、荧光检测法[6]、气相色谱-质谱联用法(GC-MS)[7]、液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)[8]。ELISA准确度低,多用于检测总的AGEs含量;荧光检测法则一般用于能够自发荧光的AGEs的检测;GC-MS需要在测试前将样品进行复杂的衍生化;LC-MS/MS则需要复杂的前处理,需要使用固相萃取小柱对AGEs进行净化[9],单次进样需要进行长时间的色谱分离,费时费力。
实时直接分析质谱(direct analysis in real time mass spectrometry,DART-MS)是一种开放式离子化质谱技术[10], 其主要结构包括DART离子源、轨道式进样器及质谱(图1)。该技术优点在于,对样品前处理要求较低、不需要色谱分离,因此能够对样品进行高通量检测[11]。近年来,DART-MS已经广泛应用于食品领域[12]。本研究以水煮牦牛肉为研究模型,拟建立一种基于DART-MS/MS技术的CML和CEL高通量快速检测方法,并考察外源性抗氧化食品原料苦荞、藤椒对牦牛肉水煮过程中CML、CEL生成的影响。研究结果将为食品中CML和CEL高通量快速检测、开发高品质牦牛肉产品提供理论依据。
1 材料与方法
1.1 材料与试剂
牦牛肉,四川省溜溜牛食品有限公司;苦荞粉、藤椒粉,市售。
CML标准品(纯度98%,加拿大TRC公司);芦丁标准品(纯度98%),成都普瑞法科技开发有限公司;甲醇(色谱级),上海易恩化学技术有限公司;正己烷、NaNO2、AlCl3·6H2O,成都市科隆化学品有限公司;高纯N2、高纯He,成都泰竽工业气体有限公司。

图1 DART-MS检测系统
Fig.1 DART-MS determination system
1.2 仪器与设备
DART离子源,美国Ionsense公司;SCIEX 3500 三重四级杆质谱仪,美国AB SCIEX公司。
1.3 实验方法
1.3.1 标准溶液的制备
精确称取CML标准品,用甲醇溶解、稀释配制成质量浓度分别为50.0、30.0、20.0、10.0、5.0、1 μg/mL 的CML标准溶液[13-14]。
1.3.2 牦牛肉样品的准备
将50 g牦牛肉均匀切成1 cm3大小的块,加入200 mL冷水中进行煮制,煮制时分别加入牦牛肉质量0%(对照组)、10%、30%和50%的苦荞粉或藤椒粉,12 min后取出。每组3个平行。
1.3.3 牦牛肉中CML与CEL的提取
参考ZHANG等[15]和HEGELE等[16]的研究:取煮制后的牦牛肉5 g剁碎,将剁碎后的牦牛肉样品放于50 mL离心管中,加入20 mL预冷后的20 g/L三氯乙酸水溶液,除去蛋白沉淀。将上清液采用正己烷脱除油脂,将下清液置于真空离心浓缩机进行浓缩干燥,加入2 mL甲醇水溶液(体积比8∶2)复溶,经0.22 μm 微孔有机滤膜过滤后装入样品瓶中,备用。
1.3.4 苦荞、藤椒总黄酮的测定
根据REMIREZ等[17]的研究方法略作修改后测定苦荞粉和藤椒粉中的黄酮含量。结果以毫克芦丁当量每100g干物质(mg RE/100g DW)计。
1.3.5 质谱条件
DART SVP离子源条件:采用高纯He为工作气体;DART离子源与质谱仪距离2 cm,进样针移动速度为0.6 mm/s;进样体积1 μL。质谱条件:正离子扫描模式,去簇电压40 V,碰撞能量20 V。
1.4 计算方法
1.4.1 基质效应的计算
通过公式(1)计算牦牛肉样品中CML的基质效应。
基质效应![]()
(1)
1.5 数据处理
实验数据采用SPSS统计软件进行分析,使用GraphPad Prism 8进行绘图。
2 结果与分析
2.1 CML和CEL的二级质谱裂解行为及定量离子对选择
预试验表明,CML、CEL均在正离子模式下才有信号,因此,本研究均采用质谱正离子模式进行测试。为了降低CML、CEL的检出限,需要对CML、CEL二级质谱裂解行为进行研究,选择合适的定量检测离子对[多反应监测模式(multiple reaction monitoring,MRM)]。对牦牛肉样品中CML、CEL分别进行二级质谱扫描,其二级质谱图见图2。
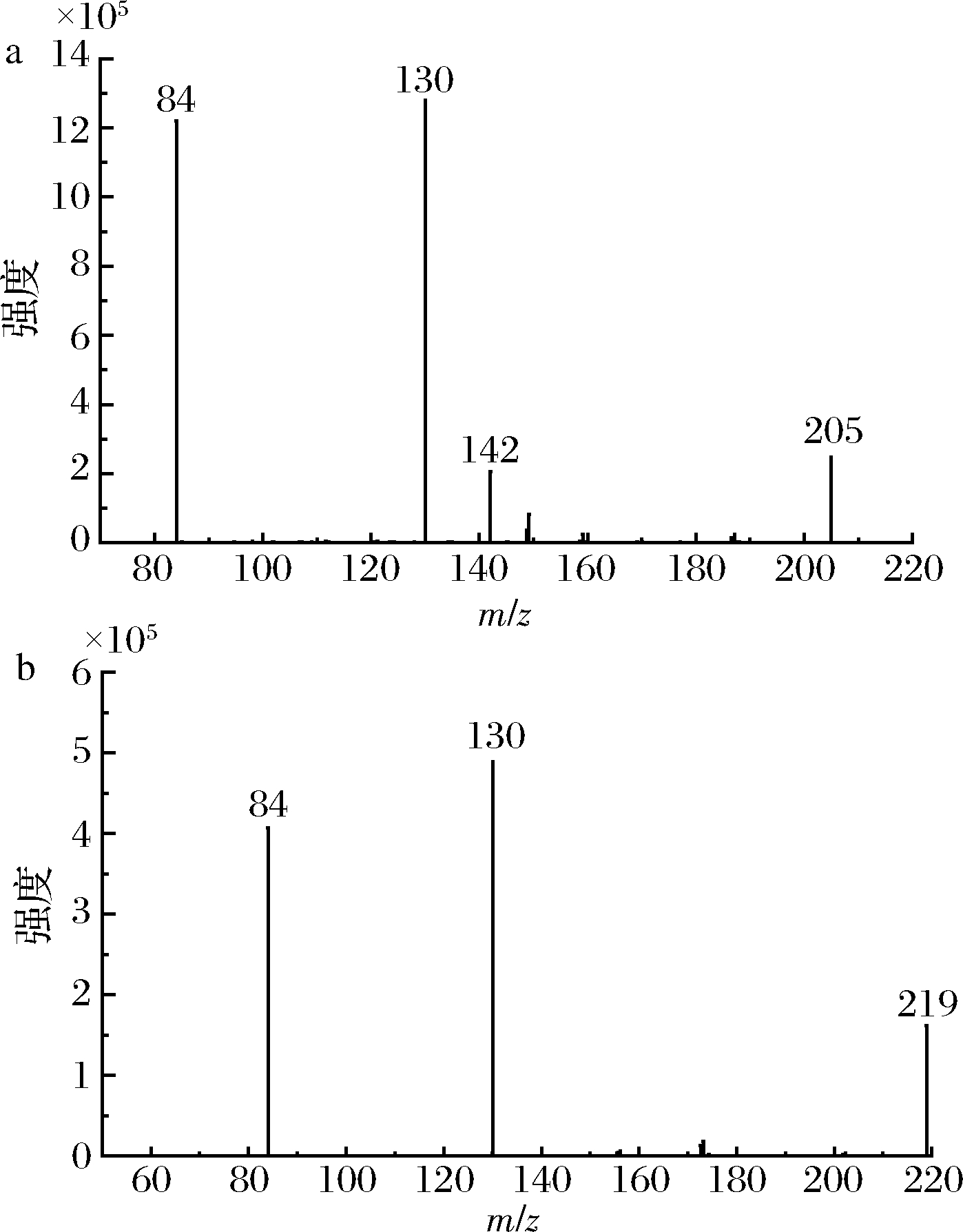
a-CML二级质谱图;b-CEL二级质谱图
图2 牦牛肉样品中CML、CEL的二级质谱图
Fig.2 DART-MS/MS fragments of CML and CEL
由于CML与CEL仅仅相差1个—CH2结构,其二级质谱裂解规律非常类似。本文仅以CML的二级质谱裂解规律为例进行解析。如图2和图3所示,CML的分子离子峰为m/z 205。碎片m/z 130是m/z 205经历氢重排后,脱去1个氨基乙酸基团形成的;碎片m/z 84是由m/z 130脱去1个—HCOOH形成;m/z 142 是由m/z 205依次脱去—H2O、—CO,电子迁移形成双键后脱去—NH3形成。由于碎片m/z 130为最强信号峰,因此CML选择205~130为定量离子对,CEL选择219~130为定量离子对。
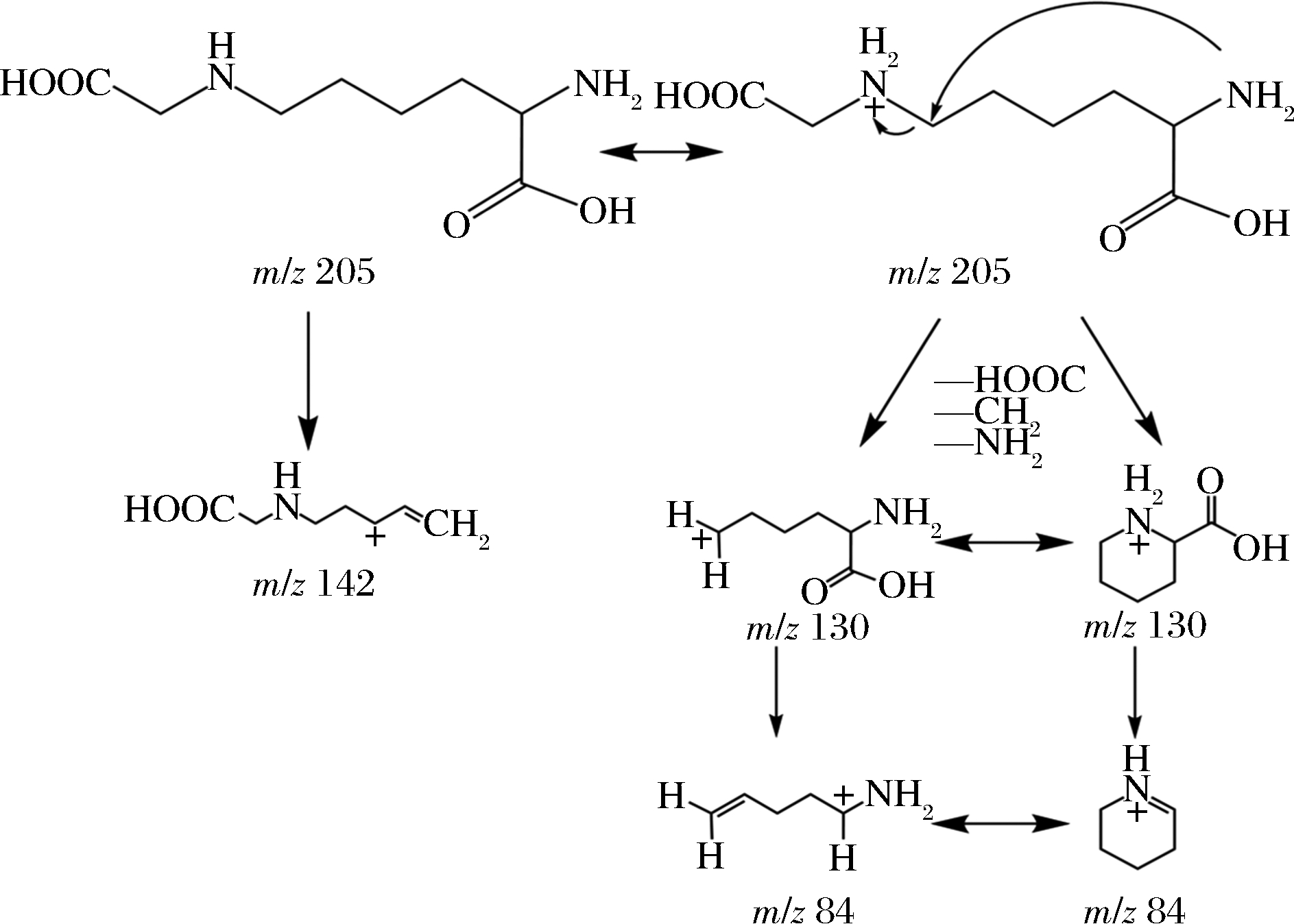
图3 样品中CML二级质谱裂解规律
Fig.3 DART-MS/MS cracking law of CML
2.2 DART-MS条件优化
在DART-MS测试样品的过程中,解析气体的温度会显著影响待测样品组分的电离效率[18]。因此,本研究考察了解析气体的温度对CML一级母离子(m/z 205)响应强度的影响。如图4-a所示,随着气体温度从 300 ℃逐渐升至 450 ℃时,CML响应强度逐渐升高;当温度升至 500 ℃时,CML的响应强度开始下降。因此,选用450 ℃为解析气体的最优温度。
栅网电极电压能够减少空气中的杂质离子,可以减少质谱图上的背景干扰[19]。本研究考察了100~300 V的栅网电极电压对待测组分响应强度的影响。如图4-b所示,CML的响应强度在150 V时信号强度最大,随后CML母离子响应强度逐渐降低。因此,选择150 V为最优的栅网电极电压。
去簇电压的大小会显著影响CML(m/z 205)母离子的响应强度。本实验考察了10~50 V 去簇电压对m/z 205离子响应强度。如图4-c所示,随着去簇电压的增加,CML的响应强度先增大后减小,当去簇电压为40 V时,CML母离子峰的响应强度最高。因此,选择40 V为实验的去簇电压。
质谱的碰撞能量也能显著影响CML(m/z 205)二级碎片离子的信号强度。因此,选择合适的碰撞能量值对目标物的定量分析有着十分关键的作用。本研究采用m/z 130作为CML的定量离子,以二级碎片离子m/z 130的响应强度作为指标对碰撞能量值进行优化。如图4-d所示,随着CE值的增大,m/z 130的响应强度先增大后减小;相较于碰撞能量值为15 V时,碰撞能量值为20 V时,二级碎片离子的峰形更佳,且母离子碎裂更加充分,综合考虑,选择20 V作为CML定量分析的碰撞能量。
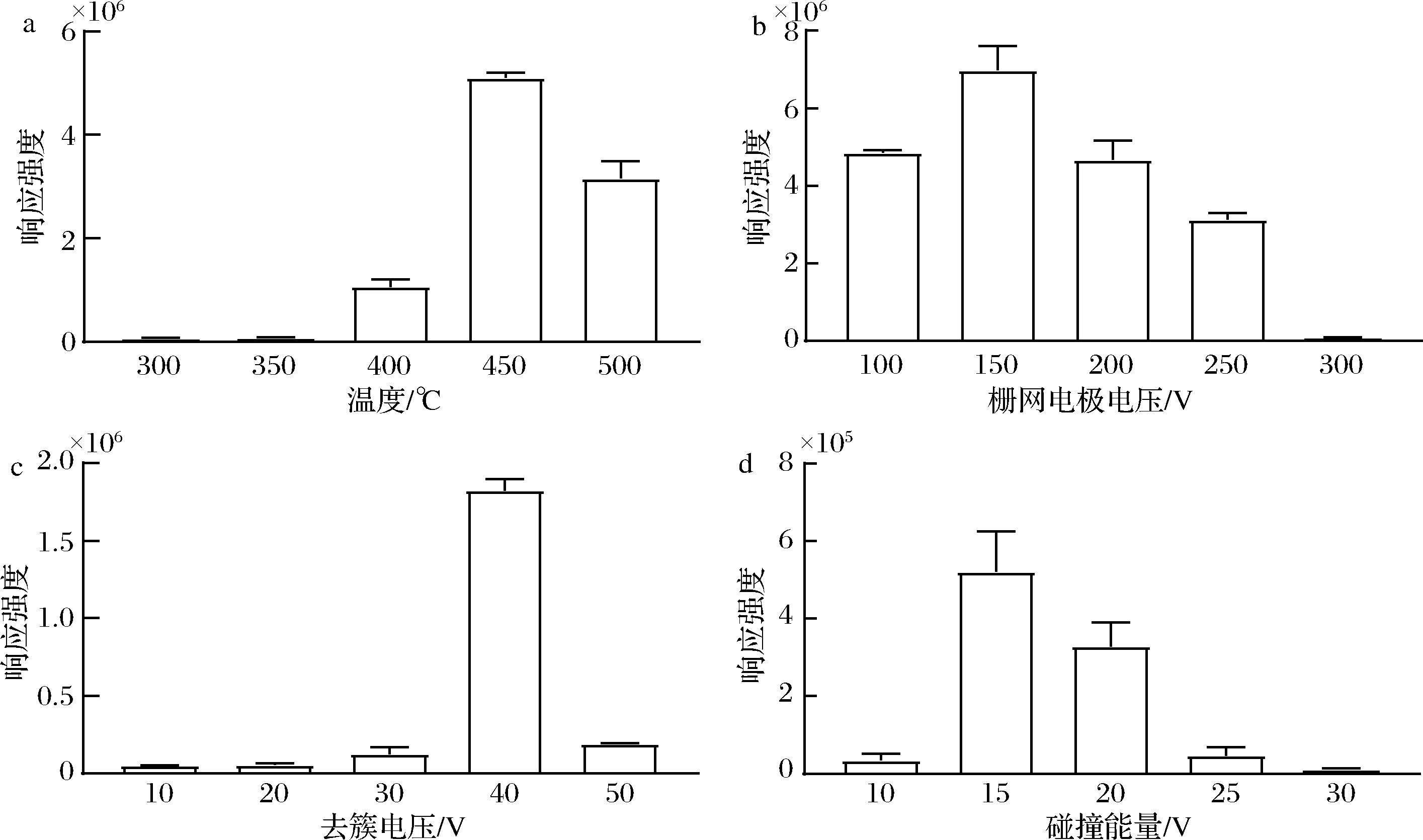
a-温度;b-栅网电极电压;c-去簇电压;d-碰撞能量
图4 基于DART-MS测定CML的测试条件优化
Fig.4 Optimization of test conditions for CML determination based on DART-MS
采用优化好的质谱条件对CML标准品进行测试,采用MRM模式,以m/z 205~m/z 130作为定量离子对,如图5所示,在2 min内即可完成8次平行样品的测定。由于CML与CEL属于同系物,其理化性质非常相近,采用传统超高效液相色谱-串联质谱(ultra-performance liquid chromatography/tandem mass spectrometry,UPLC-MS/MS)方法检测,色谱分离需要 10 min以上,而 DART-MS/MS方法无色谱分离过程,在常压下能够直接进样,可以大幅缩短分析时长。
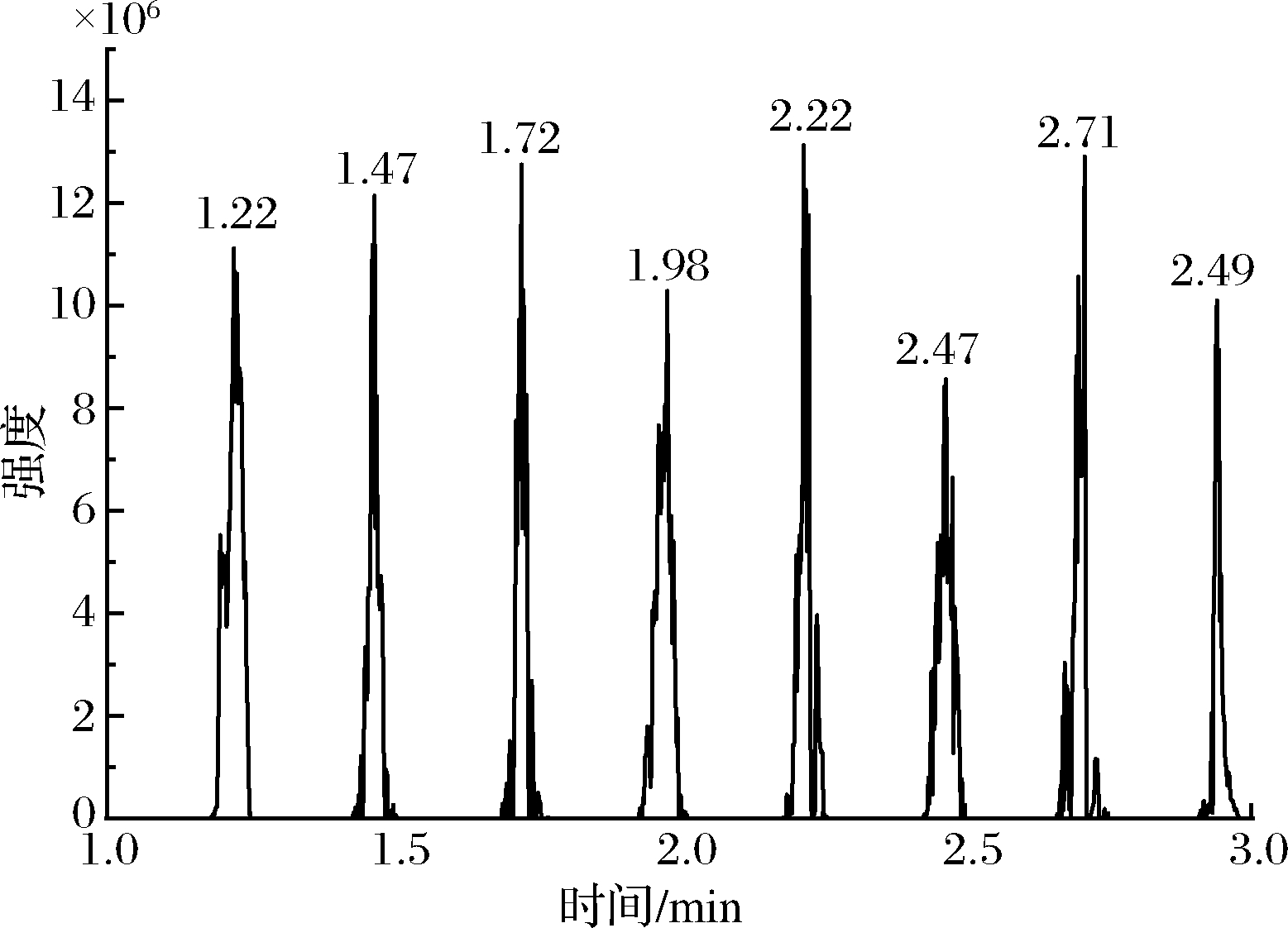
图5 CML 8次平行进样的总离子流图
Fig.5 Total ion chromatography diagram of eight parallel injections of CML
2.3 方法学验证
2.3.1 线性方程、相关系数、检出限(detection limit,LOD)及定量限(quantification limit,LOQ)
如图6所示,以峰面积为纵坐标,CML质量浓度为横坐标进行线性回归分析,得到标准曲线和相关系数R2。CML在 1~50 μg/mL,R2为0.996 3,表明线性关系良好。LOD为0.1 μg/g,LOQ为0.5 μg/g。这表明本方法能有效地对CML进行检测,具有良好的灵敏度。
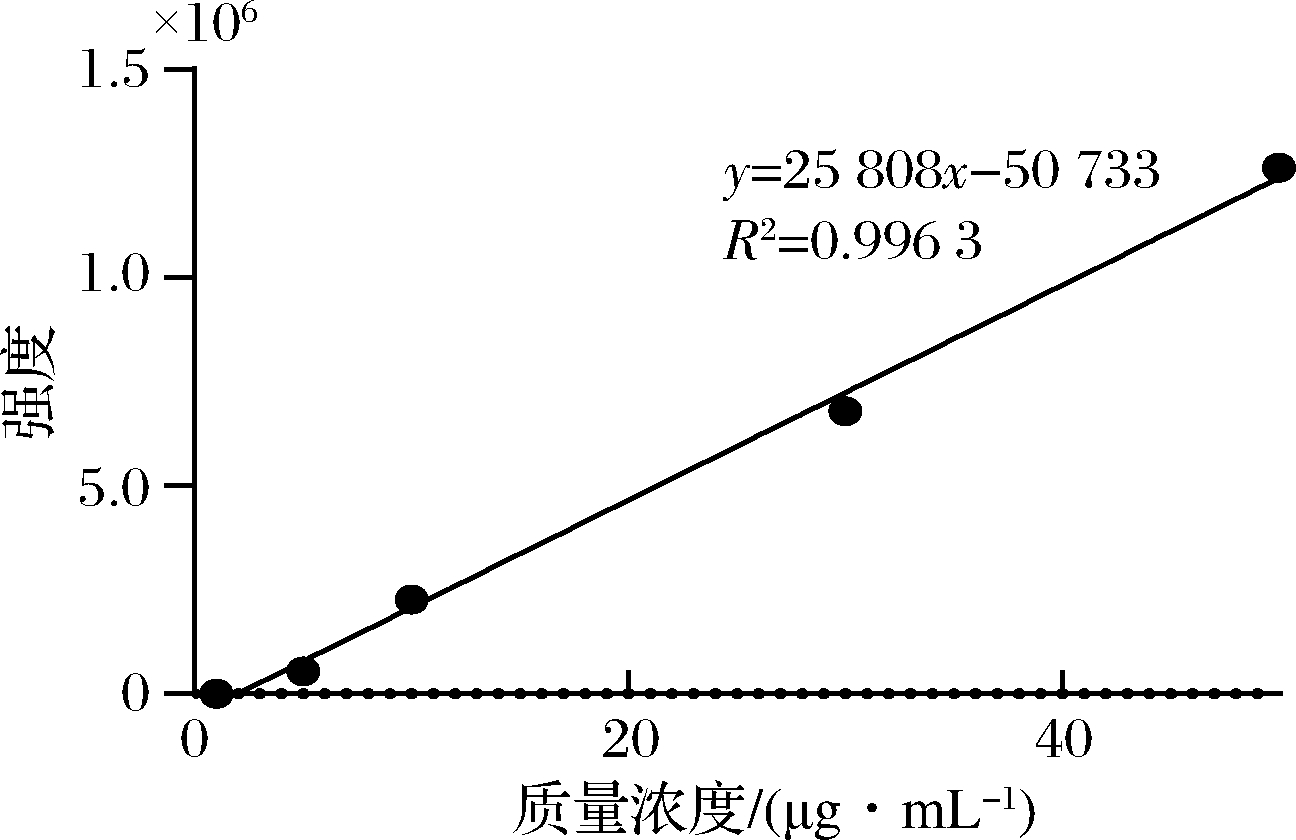
图6 CML标准曲线
Fig.6 Standard curve of CML by DART-MS
2.3.2 基质效应
基质效应是指样品中除目标组分以外的组分在电离过程中,对目标成分可能产生离子增强或者抑制效应[20]。基质效应在定量分析中可能会严重影响待测物的精密度和准确性,因此需要研究 DART-MS 方法测定CML的基质效应。
由于缺少商业化的空白基质(不含CML的牦牛肉),因此本研究采用自由态AGEs的提取液直接溶解CML标准品,然后使用样品提取溶液对其进行连续稀释。最终牦牛肉中CML加标质量浓度为8.17~53.17 μg/mL,具体见表1。
表1 方法的线性参数、基质效应、检出限及定量限
Table 1 Linear parameters,matrix effect,detection limit and quantification limit of the method
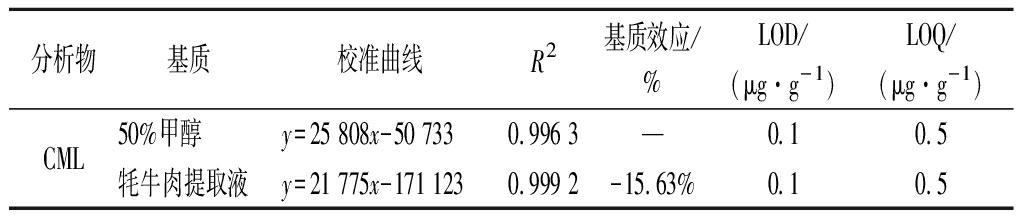
分析物基质校准曲线R2基质效应/%LOD/(μg·g-1)LOQ/(μg·g-1)CML50%甲醇y=25 808x-50 7330.996 3—0.10.5牦牛肉提取液y=21 775x-171 1230.999 2-15.63%0.10.5
当|基质效应|≤ 20 时,可以认为基质效应较弱[21]。由表1可知,牦牛肉中CML的基质效应为-15.63%,表明牦牛肉中的基质对CML含量有轻微抑制作用,但是影响不显著,可以直接采用CML的标准曲线进行定量分析。
2.3.3 回收率与精密度
在样品中添加50、20、5 μg/g 3个质量分数的目标分析物(表2),每个添加量平行测定5次,分别测定加标回收率和精密度。精密度用相对标准偏差(relative standard deviation,RSD)表示。结果如表2所示,整体上CML的平均回收率为100.77%~117.36%,RSD为8.22%~9.87%。因此,DART-MS 方法的准确性和稳定性较好,可用于快速检测样品中CML的含量。
表2 方法的加标回收率与精密度(n=5)
Table 2 Results of standard recovery rate and precision of the method

目标物加标量/(μg·g-1)平均回收率/%RSD/%50100.778.22CML20106.059.005117.369.87
2.3.4 苦荞和藤椒对牦牛肉中CML、CEL生成的影响
苦荞和藤椒中含有多种黄酮类物质,具有较强的抗氧化活性,总黄酮含量与抗氧化活性成正相关。本文采用的苦荞粉中总黄酮含量为142.23 mg RE/100g DW,藤椒中总黄酮含量604.86 mg RE/100g DW。由于CML与CEL结构近似,采用上述建立的 DART-MS/MS快检方法对牦牛肉样品中的CEL含量进行估测(以CML计)。实验结果如图7所示,加入苦荞粉煮制后的牦牛肉中的CML和CEL含量逐渐降低,对比空白样,添加牦牛肉质量50%的苦荞粉煮制后,样品中CML含量降低7.72%,CEL含量下降1.46%,具有显著性差异;而加入牦牛肉质量50%藤椒粉煮制后的牦牛肉CML含量相较于空白样品降低了14.51%,CEL含量却增加7.35%,差异极显著,这可能是由于藤椒中富含苏氨酸,在AGEs生成过程中参与了CEL前体物质丙酮醛的生成,导致CEL含量增多。前人研究也发现,在蛋白质糖化早期,木犀草素等黄酮成分能够抑制AGEs形成[22]。苦荞、花椒中均含有多种黄酮类物质[23-24],这可能是加入苦荞粉后牦牛肉中CML、CEL均显著下降的原因。
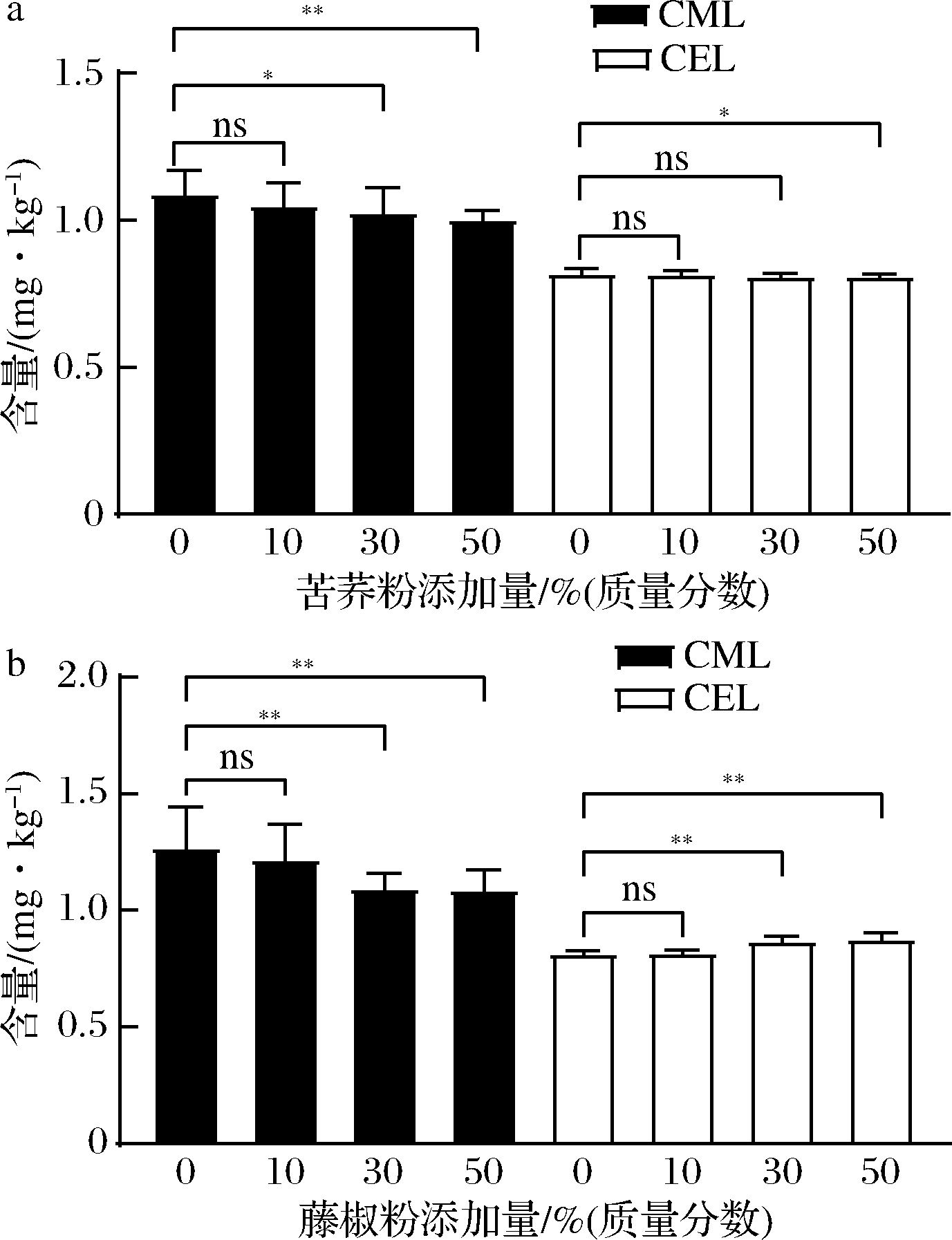
a-苦荞粉添加量;b-藤椒粉添加量
图7 苦荞粉、藤椒粉添加量对AGEs的影响
Fig.7 Effect of tartary buckwheat and zanthoxylum schinifolium powder on AGEs 注:ns表示无显著差异(P>0.05);*表示差异显著(P<0.05); **表示差异极显著(P<0.01)
3 结论
与UPLC-MS/MS方法相比,DART-MS方法操作简单,结果准确,单次样品测定时间小于30 s,能大幅缩短分析时长,并且不使用流动相,具有环保的优点。消减工艺研究结果表明,苦荞可以同时有效减少牦牛肉在煮制过程中CML和CEL的生成;藤椒能有效减少牦牛肉在煮制过程中CML含量,但却增加了CEL含量,其具体机制有待进一步研究。
[1] 曾稳稳, 刘玉环, 阮榕生, 等.美拉德反应所引起的食品安全问题的研究进展[J].食品工业科技, 2011, 32(7):447-450;454.
ZENG W W, LIU Y H, RUAN R S, et al.Research progress in food safety issue caused by Maillard reaction[J].Science and Technology of Food Industry, 2011, 32(7):447-450;454.
[2] URIBARRI J, WOODRUFF S, GOODMAN S, et al.Advanced glycation end products in foods and a practical guide to their reduction in the diet[J].Journal of the American Dietetic Association, 2010, 110(6):911-916.e12.
[3] WU C H, HUANG S M, LIN J A, et al.Inhibition of advanced glycation endproduct formation by foodstuffs[J].Food Function, 2011, 2(5):224-234.
[4] ZHENG F, HE C J, CAI W J, et al.Prevention of diabetic nephropathy in mice by a diet low in glycoxidation products[J].Diabetes/Metabolism Research and Reviews, 2002, 18(3):224-237.
[5] GOLDBERG T, CAI W J, PEPPA M, et al.Advanced glycoxidation end products in commonly consumed foods[J].Journal of the American Dietetic Association, 2004, 104(8):1 287-1 291.
[6] 江国荣, 朱荃, 张露蓉, 等.HPLC-FIA法检测糖基化终末产物方法的建立[J].抗感染药学, 2007, 4(2):66-68.
JIANG G R, ZHU Q, ZHANG L R, et al.Establishment of an analyzing approach for advanced glycation end products formed in vitro by flow injection assay[J].Anti-Infective Pharmacy, 2007, 4(2):66-68.
[7] CHARISSOU A, AIT-AMEUR L, BIRLOUEZ-ARAGON I.Evaluation of a gas chromatography/mass spectrometry method for the quantification of carboxymethyllysine in food samples[J].Journal of Chromatography A, 2007, 1 140(1-2):189-194.
[8] 孙晓华, 赖克强, 黄轶群, 等.高效液相色谱-串联质谱法测定油条中羧甲基赖氨酸[J].食品工业科技, 2014, 35(11):298-301;323.
SUN X H, LAI K Q, HUANG Y Q, et al.High performance liquid chromatography-tandem mass spectrometry method for the determination of Nε-(carboxymethyl) lysine in fried bread sticks[J].Science and Technology of Food Industry, 2014, 35(11):298-301;323.
[9] NIQUET-LéRIDON C, TESSIER F J.Quantification of Nε-carboxymethyl-lysine in selected chocolate-flavoured drink mixes using high-performance liquid chromatography-linear ion trap tandem mass spectrometry[J].Food Chemistry, 2011, 126(2):655-663.
[10] CODY R B, LARAMÉE J A, DURST H D.Versatile new ion source for the analysis of materials in open air under ambient conditions[J].Analytical Chemistry, 2005, 77(8):2 297-2 302.
[11] 张佳玲, 霍飞凤, 周志贵, 等.实时直接分析质谱的原理及应用[J].化学进展, 2012, 24(1):101-109.
ZHANG J L, HUO F F, ZHOU Z G, et al.The principles and applications of an ambient ionization method—Direct analysis in real time (DART)[J].Progress in Chemistry, 2012, 24(1):101-109.
[12] RYDLOV L, PRCHALOV
L, PRCHALOV J,
J, ![]() T, et al.Evaluation of cocoa products quality and authenticity by DART/TOF-MS[J].International Journal of Mass Spectrometry, 2020, 454:116358.
T, et al.Evaluation of cocoa products quality and authenticity by DART/TOF-MS[J].International Journal of Mass Spectrometry, 2020, 454:116358.
[13] 尉立刚. 肉制品中羧甲基赖氨酸和羧乙基赖氨酸的生成机理及影响因素研究[D].无锡:江南大学, 2016.
YU L G.Mechanism and influencing factors of Nε-carboxy-methyl-lysine and Nε-carboxyethyl-lysine formation in meat products[D].Wuxi:Jiangnan University, 2016.
[14] 朱玉洁. UPLC-MS/MS分析食物煎炸过程中2种晚期糖基化终末产物的研究[J].粮食与油脂, 2019, 32(7):88-91.
ZHU Y J.Analysis of two advanced glycosylation end products in fried foods by UPLC-MS/MS during frying process[J].Cereals & Oils, 2019, 32(7):88-91.
[15] ZHANG G, HUANG G W, XIAO L, et al.Determination of advanced glycation endproducts by LC-MS/MS in raw and roasted almonds (Prunus dulcis)[J].Journal of Agricultural and Food Chemistry, 2011, 59(22):12 037-12 046.
[16] HEGELE J, BUETLER T, DELATOUR T.Comparative LC-MS/MS profiling of free and protein-bound early and advanced glycation-induced lysine modifications in dairy products[J].Analytica Chimica Acta, 2008, 617(1-2):85-96.
[17] RAMIREZ J E, ZAMBRANO R, ![]() B, et al.Anthocyanins and antioxidant capacities of six Chilean berries by HPLC-HR-ESI-ToF-MS[J].Food Chemistry, 2015, 176:106-114.
B, et al.Anthocyanins and antioxidant capacities of six Chilean berries by HPLC-HR-ESI-ToF-MS[J].Food Chemistry, 2015, 176:106-114.
[18] NILLES J M, CONNELL T R, DURST H D.Thermal separation to facilitate direct analysis in real time (DART) of mixtures[J].Analyst, 2010, 135(5):883-886.
[19] CHERNETSOVA E S, MORLOCK G E, REVELSKY I A.DART mass spectrometry and its applications in chemical analysis [J].Russian Chemical Reviews, 2011, 80(3):235-255.
[20] TANG L, KEBARLE P.Dependence of ion intensity in electrospray mass spectrometry on the concentration of the analytes in the electrosprayed solution[J].Analytical Chemistry, 1993, 65(24):3 654-3 668.
[21] ![]() P.Clean-up and matrix effect in LC-MS/MS analysis of food of plant origin for high polar herbicides[J].Food Chemistry, 2017, 230:524-531.
P.Clean-up and matrix effect in LC-MS/MS analysis of food of plant origin for high polar herbicides[J].Food Chemistry, 2017, 230:524-531.
[22] WU C H, YEN G C.Inhibitory effect of naturally occurring flavonoids on the formation of advanced glycation endproducts[J].Journal of Agricultural and Food Chemistry, 2005, 53(8):3 167-3 173.
[23] REN Q, WU C S, REN Y, et al.Characterization and identification of the chemical constituents from Tartary buckwheat (Fagopyrum tataricum Gaertn) by high performance liquid chromatography/photodiode array detector/linear ion trap FTICR hybrid mass spectrometry[J].Food Chemistry, 2013, 136(3-4):1 377-1 389.
[24] LEE L S, CHOI E J, KIM C H, et al.Contribution of flavonoids to the antioxidant properties of common and Tartary buckwheat[J].Journal of Cereal Science, 2016, 68:181-186.