蜂王幼虫,也称蜂王胎,是蜜蜂受精卵消化吸收工蜂分泌的新鲜蜂王浆后生长而成的幼虫,是蜂王浆加工的副产品,其冻干粉中含有约50%的粗蛋白和人体必须氨基酸,同时含有丰富的维生素、矿物质、生物活性酶等成分,具有极高的营养价值[1]。研究证实,蜂王幼虫具有抗衰老[2]、抗氧化[3]、提高免疫力[4]等功效,作为一种昆虫食品,其在保健和功能食品行业具有重要的开发应用价值和广阔的市场前景。开展蜂王幼虫功能组分挖掘及研究,对于促进蜂王幼虫新资源功能性产品的开发与应用具有重要意义。
烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)是烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)合成的重要前体物质,其功能作用通过体内转化为NAD+实现[5-6],主要包括参与多种疾病的预防,如Ⅱ型糖尿病、肥胖症和心力衰竭等,是医药、功能性食品、化妆品等行业的珍贵原料[7-9]。2016年,代谢领域研究最有影响的刊物《Cell Metabolism》报道给实验鼠补充饲喂NMN可有效减轻小鼠与年龄相关的生理衰退,在没有任何明显毒性或有害影响的情况下,NMN可抑制与年龄相关的体重增加,可增强能量代谢,促进体力活动,改善胰岛素敏感性和血脂水平,并改善眼功能和其他病理性疾病,证明了NMN在抗衰老方面的巨大潜力[9-10]。食品或功能产品中NMN的准确测定方法是监测产品中NMN含量和评价其功能的关键。已有研究表明,蜂王幼虫富含核苷酸类物质,而核苷酸类物质是蜂王幼虫正常生长发育的必要物质之一[11],但尚无关于蜂王幼虫中NMN的研究报道。
因此,为了快速准确测定蜂王幼虫中NMN的含量,本文优化了NMN的提取方法,建立了超高效液相色谱-串联质谱法(ultra-high performance liquid chromatographic tandem mass spectrometry,UHPLC-MS/MS)测定蜂王幼虫中NMN的分析方法。应用方法测定实际蜂王幼虫样品中NMN的含量,并研究其在不同贮存条件下的稳定性,以期为蜂王幼虫NMN含量分析和功能应用,以及蜂王幼虫产品的质量控制提供技术支撑。
1 材料与方法
1.1 材料与试剂
1 mL离心管、50 mL离心管,康宁生命科学(吴江)有限公司;甲酸铵、甲酸,赛默飞世尔科技(中国)有限公司;乙醇、甲醇:色谱纯,美国MREDA公司;蜂王幼虫LDH1和蜂王幼虫LDH2、蜂王幼虫冻干粉LDH-P1,老滇凰原料基地蜂场;其他幼虫样品S1~S9,浙江蜂场随机取样;烟酰胺单核苷酸标准品:纯度>95%,上海源叶生物科技有限公司。
1.2 仪器与设备
6495 Agilent超高效液相色谱串联质谱仪,美国Agilent公司;高速离心机,湖南湘仪有限公司;涡旋混匀器,美国Scientific Industries公司;十万分之一分析天平,上海梅特勒-托利多仪器有限公司。
1.3 实验方法
1.3.1 标准工作溶液的配制
精密称取NMN标准品适量,用蒸馏水配成1 mg/mL的标准储备液。将储备液稀释成质量浓度分别为50、100、250、500和1 000 ng/mL的标准工作溶液。
1.3.2 样品前处理
准确称取新鲜蜂王幼虫样品5 g或冻干粉1 g于50 mL 离心管中,加入15 mL乙醇,涡旋混合2 min,后加入15 mL蒸馏水,涡旋混合5 min,转移至50 mL容量瓶,蒸馏水定容。取出适量溶液,在8 000 r/min离心4 min,取上清液用蒸馏水稀释至原质量浓度的1/50,后经0.22 μm尼龙滤膜过滤,待上机检测。
1.3.3 色谱条件
色谱柱:Waters X Select HSS T3(2.1 mm×100 mm,2.5 μm);流动相A为5 mmol/L甲酸铵水溶液(含0.4%甲酸,体积分数),流动相B为甲醇;洗脱程序:0~3 min,0% B;3~4 min,0% B~90% B;4~8 min,90% B;8~10 min, 90% B~0% B;柱温:40 ℃,进样量:1 μL,流速:0.2 mL/min。
1.3.4 质谱条件
离子源:离子漏斗,电喷雾离子源(electron spray ionization,ESI),正离子模式;扫描方式:多反应监测(multiple reaction monitoring,MRM);干燥气温度220 ℃;干燥气流速15 L/min;雾化器压力40 psi;鞘气温度350 ℃;鞘气流速12 L/min;毛细管电压3 500 V;喷嘴电压500 V。
1.3.5 蜂王幼虫中NMN的稳定性研究
用1.3.2的提取方法、1.3.3的色谱条件和1.3.4的质谱条件,测定-18、4 ℃和常温条件下贮存0、1、2、3、4、5、6、7 d的蜂王幼虫和蜂王幼虫冻干粉中NMN的含量。
2 结果与分析
2.1 样品提取条件的优化
蜂王幼虫中含有大量的蛋白质,会影响NMN的提取和测定,因此,在提取NMN前,需先进行蛋白质的沉淀。本实验分别对比了甲醇、乙醇和乙腈对蛋白质沉淀能力,结果表明,乙醇可以有效沉淀蜂王幼虫样品中的蛋白质。图1展示了NMN的结构式,可见其分子中包含2个裸露的—OH,亲水性强,因此,选择水为NMN的提取溶剂最合适。另外,通过比较实验发现当乙醇和水的体积比为1∶1时,沉淀蛋白和提取效果最佳。实际样品中NMN含量较高,在上机分析前需要将提取液进一步稀释(1/50~1/100)倍,此步骤可以明显降低基质影响,实现样品中NMN的准确测定。
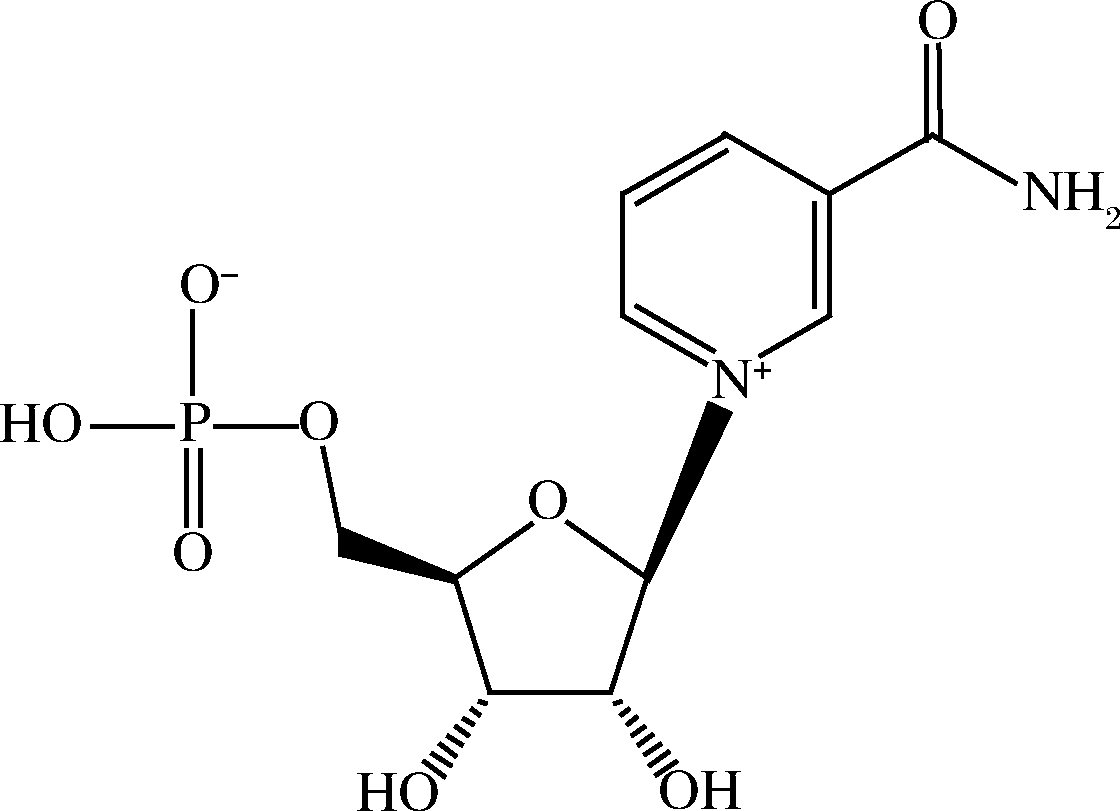
图1 NMN的结构式
Fig.1 The chemical structural of NMN
2.2 色谱与质谱条件的优化
为优化分离,本实验对比了不同体积分数甲酸铵水溶液、甲酸-甲酸铵水溶液、不同体积比的甲醇、乙腈组成的流动相以及4种色谱柱:Agilent Infinitylab Poroshell 120 HILIC-Z(2.1 mm×100 mm, 2.7 μm)(下文简称HILIC-Z)、Halo AQ-C18(2.1 mm×50 mm, 2 μm)(下文简称AQ-C18)、Agilent Infinitylab Poroshell 120 HILIC-OH5(2.1 mm×100 mm, 2.7 μm)(下文简称HILIC-OH5)和Waters X Select HSS T3(2.1 mm×100 mm, 2.5 μm)(下文简称HSS T3)的分离效果,根据NMN的分离度、响应值和色谱峰型,选择最佳的分离条件。结果发现,水相中加入甲酸和甲酸铵,不仅能提高NMN的响应值,还能改善峰型,甲醇为流动相时响应比乙腈更高。HILIC-Z分离时,峰型较差,AQ-C18 和HILIC-OH5对NMN的保留能力弱,且与基质无法有效分离,HSS T3分离时,峰型尖锐对称,无拖尾现象。因此,选择含0.4%甲酸的5 mmol/L甲酸铵水溶液-甲醇溶液为流动相,选择HSS T3为分离色谱柱。图2为NMN标准溶液的色谱图。

图2 NMN标准溶液色谱图
Fig.2 Chromatogram of the NMN standard solution
NMN结构上包含1个伯胺,容易生成[M+H]+离子,故选择电喷雾正离子(ESI+)扫描方式,根据[M+H]+离子找到准分子离子峰,进一步对NMN的[M+H]+离子进行子离子扫描,优化碰撞能量、驻留时间及离子加速电压,在MRM模式下选取响应高,离子比稳定的离子作为监测离子对,优化得到离子对与文献报道一致[12],可以满足NMN的准确定性和定量。具体质谱条件优化结果见表1。
表1 NMN的保留时间及质谱分析条件
Table 1 Retention time of NMN and its MS/MS acquisition settings
保留时间/min离子对(m/z)传输电压/V碰撞能量/eV驻留时间/ms加速电压/V2.12335>12338082003
2.3 线性范围、检出限(limits of detection,LOD)、定量限(limits of quantitation,LOQ)
采用优化后的参数进行UHPLC-MS/MS方法学研究,以NMN的峰面积为纵坐标(Y),对应质量浓度为横坐标(X)绘制标准曲线,结果表明,NMN标准品在50~1 000 ng/mL呈现良好的线性关系。根据信噪比确定LOD(S/N=3)以及LOQ(S/N=10)分别为11.2 μg/kg和37.4 μg/kg。
2.4 NMN提取液稳定性实验
称取样品,用1.3.2的方法制备提取液,按照1.3.3的色谱条件和1.3.4的质谱条件,分别在0、3、6、18、24 h测定NMN的含量,并计算降解率,测定结果见表2。
表2 提取液的降解率 单位:%
Table 2 Degradation rate of extracting solution

时间/h降解率RSD0//31.760.5262.570.67182.820.36244.870.27
注:/表示无数据
结果表明,NMN提取液在24 h 后的降解率为4.87%,供试样品溶液在24 h内稳定,样品在提取完成后应在24 h内测定完成。
2.5 回收率实验
由表3可知,在20、40和80 μg/g 3个添加水平下,NMN的添加回收率在109.9%~111.2%,RSD在0.87%~3.31%,说明建立的方法具有很好的准确度和精密度,可以满足蜂王幼虫中NMN的准确测定。
表3 NMN加标回收率
Table 3 Standard recovery of NMN
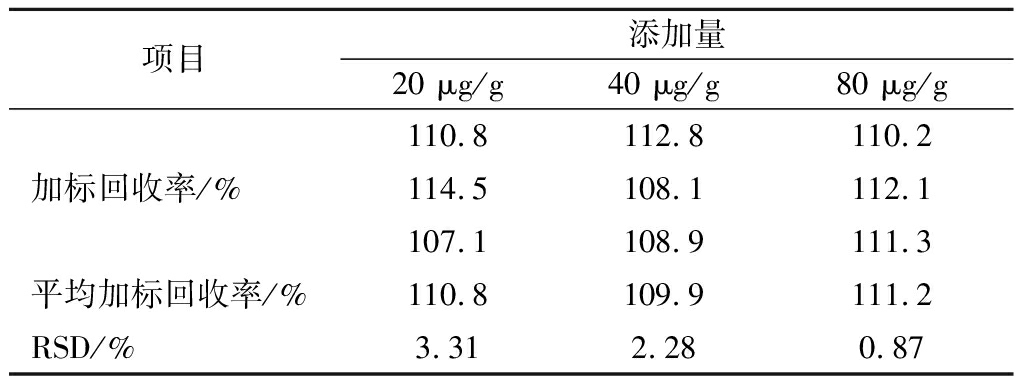
项目添加量20 μg/g40 μg/g80 μg/g110.8112.8110.2加标回收率/%114.5108.1112.1107.1108.9111.3平均加标回收率/%110.8109.9111.2RSD/%3.312.280.87
2.6 实际样品含量测定
按照上述优化方法对蜂王幼虫和蜂王幼虫冻干粉进行检测,图3为样品的总离子流图(total ion chromatography,TIC),图4为样品中NMN的MRM图谱。蜂王幼虫和蜂王幼虫冻干粉中NMN的含量见表4。
图3 样品的TIC图
Fig.3 TIC chromatogram of sample

图4 样品中NMN的MRM图谱
Fig.4 MRM chromatogram of NMN in sample
表4 蜂王幼虫和蜂王幼虫冻干粉中NMN含量
Table 4 NMN content of queen bee larva and frozen dry powder of queen bee larva

样品编号含量/ (μg·g-1)样品编号含量/ (μg·g-1)LDH-165.8±0.6S437.0±0.4LDH-262.5±0.5S542.3±0.5LDH-P178.0±0.9S649.0±0.6S137.5±0.4S748.4±0.5S248.1±0.5S846.2±0.3S342.7±0.5S940.1±0.6
由表4可知,蜂王幼虫和蜂王幼虫冻干粉中均含有NMN。其中,蜂王幼虫冻干粉中NMN含量更高,为78.0 μg/g,LDH1和LDH2样品(试验蜂场)中NMN含量分别为65.8 μg/g和62.5 μg/g,随机蜂场采集的样品S1~S9中NMN的含量为37.0~49.0 μg/g。蜂王幼虫和蜂王幼虫冻干粉样品中NMN的含量差异可能与蜂种、饲养方式、饲料类型以及幼虫的采集和贮存条件相关。
与文献报道的其他食品中NMN含量(0.1~3.3 μg/g)相比[13],蜂王幼虫中NMN的含量高出普通食品10~80倍,可以作为补充NMN的食品或功能产品资源。此外,NMN可能对蜂王幼虫正常发育起重要作用[14],其含量也可能影响蜂王健康和寿命,相关的研究还需要进一步开展。
2.7 蜂王幼虫NMN的稳定性测定
为确定蜂王幼虫中NMN在贮存期内的降解情况,分别于0、1、2、3、4、5、6、7 d,测定-18、4 ℃和常温条件贮存的蜂王幼虫和蜂王幼虫冻干粉中NMN含量,结果见表5。
表5 蜂王幼虫和蜂王幼虫冻干粉在不同贮存条件下 NMN的降解率
Table 5 NMN degradation rate of queen bee larva and frozen dry powder of queen bee larva with different storage condition
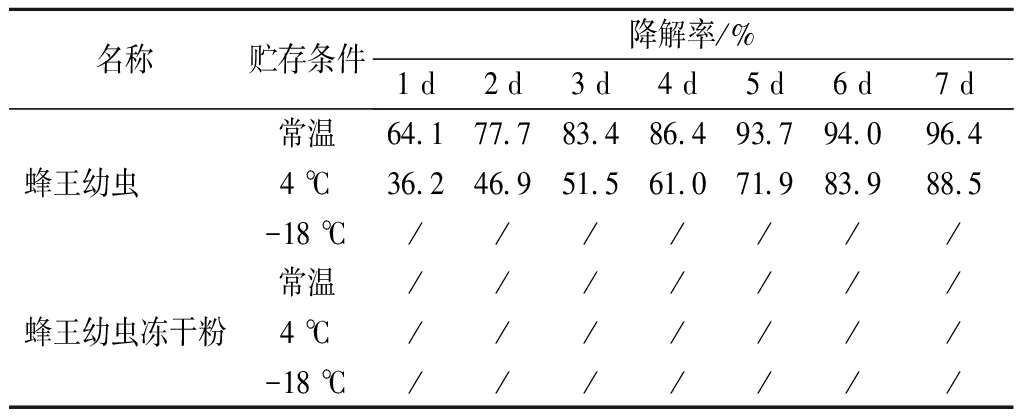
名称贮存条件降解率/%1 d2 d3 d4 d5 d6 d7 d常温64.177.783.486.493.794.096.4蜂王幼虫 4 ℃36.246.951.561.071.983.988.5-18 ℃///////常温///////蜂王幼虫冻干粉4 ℃///////-18 ℃///////
注:/表示无明显降解
由表5可知,蜂王幼虫在常温保存时,随着时间的延长NMN出现快速降解,在第7天降解率达到96.4%;在4 ℃保存时,降解速率较常温要慢,但在第7天仍可达到了88.5%;在-18 ℃保存时,蜂王幼虫中的NMN在7 d内未降解。蜂王幼虫冻干粉在常温、4和-18 ℃保存,7 d内均未降解。说明常温和非冷冻条件(4 ℃)不利于蜂王幼虫中NMN的保存,低温或冻干可有效控制蜂王幼虫中NMN的降解。蜂王幼虫中NMN的降解可能与NMN腺苷酰转移酶的作用有关,在适当条件下,将NMN转化为NAD。冻干粉或-18 ℃低温保存可以抑制蜂王幼虫中的腺苷酰转移酶发挥作用,从而使其无法将NMN转化为NAD。已有研究报道,由于NAD的分子质量较大,无法通过口服摄取至细胞内,而NMN可有效补偿随年龄增长带来的体内NAD含量下降[9]。合理的保存和加工方法可保护蜂王幼虫中NMN不被降解,对于保持蜂王幼虫及其产品的品质和功能活性具有重要意义。
稳定性实验发现,蜂王幼虫NMN极易降解,所以在采集蜂王幼虫样品后,应该将其及时冷冻或制成冻干粉以减少NMN的降解。作为重要的功能组分,NMN也可以作为蜂王幼虫及其产品新鲜度和品质评价的潜在指标。
3 结论
论文通过优化蜂王幼虫中NMN的提取方法和分析条件,建立了UHPLC-MS/MS方法,并对蜂王幼虫及其冻干粉样品中NMN的含量进行测定。方法快速简单,灵敏度高,在3个质量浓度添加水平下,平均回收率为109.9%~111.2%,方法的RSD为0.87%~3.31%,可以实现蜂王幼虫中NMN的准确测定。应用建立的方法,测定了蜂王幼虫和蜂王幼虫冻干粉样品中NMN的含量,并连续测定7 d不同贮存条件下NMN的含量变化。实际样品中均检出NMN,新鲜蜂王幼虫的NMN含量为37.0~65.8 μg/g,蜂王幼虫冻干粉中NMN的含量为78.0 μg/g。与文献报道其他产品相比,蜂王幼虫中NMN含量远高于其他常见的食品,可以作为重要的NMN补充食物来源。贮存试验结果显示,在常温或4 ℃条件下,蜂王幼虫中的NMN快速降解,蜂王幼虫样品应该在采集后-18 ℃冷冻贮存或加工为蜂王幼虫冻干粉,以有效保护NMN不被降解。作为重要的功能成分,NMN也可作为蜂王幼虫及其产品的功能性或新鲜度的潜在评价指标,用于产品的质量控制。本研究建立的方法也为蜂王幼虫产品的进一步开发利用以及NMN在蜂王发育过程中的作用研究提供重要的技术支撑。
[1] MATSUOKA T, KAWASHIMA T, NAKAMURA T, et al.Isolation and characterization of proteases that hydrolyze royal jelly proteins from queen bee larvae of the honeybee, Apis mellifera[J].Apidologie, 2012, 43(6):685-697.
[2] 倪彬, 陈丰, 刘建伟, 等.蜂王幼虫粉延缓衰老和抗应激能力的实验研究[J].营养学报, 2002, 24(4):398-400.
NI B, CHEN F, LIU J W, et al.The experimental study on the anti-aging and anti-stress capacities of queen bee larva[J].Acta Nutrimenta Sinica, 2002, 24(4):398-400.
[3] DONG D Y, DONG M Y, LIU K M, et al.Antioxidant activity of queen bee larvae processed by enzymatic hydrolysis[J].Journal of Food Processing and Preservation, 2018, 42(2):e134961.
[4] 周瑞华, 裴银辉, 刘学义, 等.蜂王幼虫对小鼠免疫功能的影响及机理探讨[J].食品科学, 1999,20(11):11-13.
ZHOU R H, PEI Y H, LIU X Y, et al.The Influence and mechanism of immunify function of queenbee bood of mice[J].Food Science, 1999, 20(11):11-13.
[5] RAJMAN L, CHWALEK K, SINCLAIR D A.Therapeutic potential of NAD-boosting molecules:The in vivo evidence[J].Cell Metabolism, 2018, 27(3):529-547.
[6] OKABE K, YAKU K, TOBE K, et al.Implications of altered NAD metabolism in metabolic disorders[J].Journal of Biomedical Science, 2019, 26(1):34.
[7] LI C, ZHOU Y N, RYCHAHOU P, et al.SIRT2 contributes to the regulation of intestinal cell proliferation and differentiation[J].Cellular and Molecular Gastroenterology and Hepatology, 2020, 10(1):43-57.
[8] ZHANG R L, SHEN Y Y, ZHOU L, et al.Short-term administration of nicotinamide mononucleotide preserves cardiac mitochondrial homeostasis and prevents heart failure[J].Journal of Molecular and Cellular Cardiology, 2017, 112:64-73.
[9] MILLS K F, YOSHIDA S, STEIN L R, et al.Long-term administration of nicotinamide mononucleotide mitigates age-associated physiological decline in mice[J].Cell Metabolism, 2016, 24(6):795-806.
[10] 孟辰笑凝, 郭中原, 李春, 等.定量核磁共振法测定β-烟酰胺单核苷酸的含量[J].中国药学杂志, 2021, 56(2):135-139.
MENG C X N, GUO Z Y, LI C, et al.Determination of nicotinamide mononucleotide by quantitative nuclear magnetic resonance method[J].Chinese Pharmaceutical Journal, 2021, 56(2):135-139.
[11] 岳兵. 蜂王幼虫酶解物成分分析及活性评价[D].北京:中国农业科学院, 2010.
YUE B.The hydrolysate component analysis and activity evaluation of queen bee larva[D].Beijing:Chinese Academy of Agricultural Sciences, 2010.
[12] REDEUIL K, VULCANO J, PRENCIPE F P, et al.First quantification of nicotinamide riboside with B3 vitamers and coenzymes secreted in human milk by liquid chromatography-tandem-mass spectrometry[J].Journal of Chromatography B, Analytical Techologies in the Biomedical and Life Science, 2019, 1 110-1 111:74-80.
[13] UMMARINO S, MOZZON M, ZAMPORLINI F, et al.Simultaneous quantitation of nicotinamide riboside, nicotinamide mononucleotide and nicotinamide adenine dinucleotide in milk by a novel enzyme-coupled assay[J].Food Chemistry, 2017, 221:161-168.
[14] CHO I K, CHANG C L, LI Q X.Nicotinamide in relation to dietary nicotinic acid and nine other vitamins and larval development of Ceratitis capitata (Diptera:Tephritidae)[J].Journal of Agricultural and Food Chemistry, 2005, 53(18):7 307-7 311.