蛋白质是重要的营养物质,是人体必需氨基酸和能量的来源,除了基本的营养外,利用食物蛋白还可以产生活性肽来促进机体健康。免疫调节活性肽作为活性肽的其中一类,具有增强机体免疫,提高机体对外来病原体抵抗能力等生物功能[1]。
海洋蕴藏巨大的生物资源,拥有丰富多样的物种以及独特的化学物质。鱼类、贝类、软体动物、甲壳类动物等海洋生物及其副产物是优质蛋白质的丰富来源。从海洋生物来源的多肽具有抗氧化、调节血压、抗菌、抗癌、增强免疫等功能。例如,从发酵鱼露[2]中获得了具有较强抗氧化活性的两个肽段;大眼金枪鱼鱼头蛋白[3]小于1 kDa组分对羟自由基、超氧阴离子等有较好的清除能力;此外,金枪鱼骨架蛋白[4]中分离得到一种有效的血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制肽;对牡蛎[5]进行酶解,从其酶解液中分离到一种新型的富含半胱氨酸的抗菌肽CgPep33,对革兰氏阳性和革兰氏阴性细菌及真菌具有抗菌活性。一些研究报道了海洋生物水解物的抗癌活性。南亚野鲮[6]和鳞半鳍凤尾鱼[7]水解液已被证明可显著抑制Caco-2、DU-145前列腺癌、1299肺癌、109食道癌的增殖以及PC-3癌细胞。可见,这些海洋源生物活性成分功能多样,在功能性食品和药物研发方面具有潜在应用前景。此外,同一生物体不同部位可以制备不同功能活性的多肽,这有利于原料的高效利用。
随着研究方向不断拓展,人们把目光投向了海洋生物免疫调节活性肽。本文对目前免疫调节多肽的海洋生物资源种类、活性功能、分离和纯化以及结构鉴定等方面进行概括,并浅显分析了免疫调节活性肽结构与活性的关联,以期为海洋生物免疫调节活性肽的发掘和产品开发提供参考。
1 海洋生物免疫活性肽的来源
1.1 贝类
目前,我国拥有较大养殖潜力的贝类约占总贝类的16.67%,产量较大的主要包括牡蛎、蛤蜊、扇贝、蛏和贻贝等[8]。在传统加工食品中,贝类的加工产品主要是制成冻干品、干制品、罐头、调味品等。在功能性食品和医药领域中,海洋贝类具有很大的开发潜力,利用酶水解贝肉中蛋白质可以产生大量的多肽、氨基酸等营养功能成分,形成一些具有特殊生物功能的活性肽。
张彩梅等[9]研究发现,扇贝多肽可显著提高免疫力低下小鼠NK细胞杀伤活力,并增强腹腔巨噬细胞吞噬功能。叶盛旺等[10]选用青蛤肉为原料,对经筛选得到增殖活性最高的组分进行免疫调节作用研究,结果显示,其对RAW264.7细胞的生长与增殖具有明显的促进作用,且显著增强巨噬细胞的吞噬以及细胞因子分泌能力。KIM等[11]研究贻贝可食用部分的酶解物,结果表明,高分子质量肽片段(>5 kDa)通过调节促炎因子对脂多糖(lipopolysaccharide,LPS)刺激的RAW264.7巨噬细胞具有抗炎作用。WANG等[12]研究了牡蛎水解物发现其对BALB/c小鼠可移植肉瘤S180的生长有明显的抑制作用,且呈剂量依赖性。同时,荷瘤小鼠的胸腺和脾脏重量系数、NK细胞活性、淋巴细胞脾脏增殖和巨噬细胞吞噬率均显著升高。
1.2 鱼类
海洋鱼类蛋白质含量高达80%~90%[13],且在氨基酸组成和结构功能与陆地生物存在较大差异,预示其蕴藏着结构特别、功能特异的活性肽物质。
纪丽娜[14]从金枪鱼头酶解物中筛选出具备免疫调节活性的组分,在一定的剂量范围内该酶解物可促进巨噬细胞的增殖且无细胞毒性。袁学文等[15]研究了远东拟沙丁鱼蛋白提取肽的免疫活性,发现远东拟沙丁鱼低聚肽可以增强正常小鼠免疫力。CHALAMAIAH等[16]采用胰蛋白酶和胃蛋白酶分别酶解南亚野鲮鱼卵蛋白,结果表明,胰蛋白酶酶解产物对小鼠脾脏中的CD4+和CD8+T细胞有刺激作用,而胃蛋白酶水解物也可对巨噬细胞的吞噬功能以及NK细胞的细胞活性起到增强作用。HOU等[17]从鳕鱼骨架中提取了具有免疫活性的多肽。YANG等[18]研究了鲑鱼胶原蛋白水解物,发现其可增加脾脏的抗炎因子分泌,通过增加CD4+T免疫细胞保护脾细胞。
1.3 无脊椎动物
海参作为拥有悠久历史海洋无脊椎动物,种类多且分布广泛。除具有抗氧化、降血压、抗肿瘤以及调节血糖等生理功效,海参肽的免疫调节功能也已得到证实。卢连华等[19]研究结果显示,海参肽对小鼠迟发型变态反应具有促进作用,Con A诱导的脾淋巴细胞增殖能力明显增强。何丽霞等[20]发现从海参中提取的寡肽显著提高小鼠细胞免疫、体液免疫、巨噬细胞吞噬功能及NK细胞活性(P<0.05),且与乳清蛋白相比,效果更优。
1.4 其他海洋生物
在苛刻的海洋环境条件下,海洋微生物产生了耐高压、耐低温、厌氧、嗜盐等特性。也因此,海洋微生物在免疫调节、抗氧化、抗菌等方面,较之于陆地微生物,具有独特生物活性。研究表明,海洋微生物具有特殊的免疫活性能参与自身免疫病的调控。CIAN等[21]从一种红色海藻中获得富含Aps、Ala和Glu的蛋白酶解物,对大鼠脾淋巴细胞有促分裂作用且可增强脾细胞、巨噬细胞和淋巴细胞中IL-10的分泌,抑制巨噬细胞中TNF-α和其他促炎细胞因子的产生。另外,有研究者从海洋哺乳动物体中分离出具有免疫调节的活性肽。郭昱等[22]研究了鲨鱼肽对小鼠免疫性肝损伤的保护作用,并探究其免疫调节活性,发现鲨鱼肽能有效诱导外周血单个核细胞(peripheral blood mononuclear cell,,PBMC)分泌IFN-γ,抑制TNF-β的表达。
2 海洋生物免疫活性肽的制备方法
2.1 酶解法
酶解法条件温和,操作过程安全可控,已成为制备活性肽广泛使用的手段。常用蛋白水解酶包括三大类,即动物蛋白酶、植物蛋白酶和微生物蛋白酶。蛋白酶的作用具有专一性,每种酶都有其专一的酶切位点,因此根据不同底物选用不同的蛋白酶,以此从目标蛋白质中获得所需肽段[23],如表1所示。
表1 常用蛋白水解酶
Table 1 Proteolytic enzymes of different origin
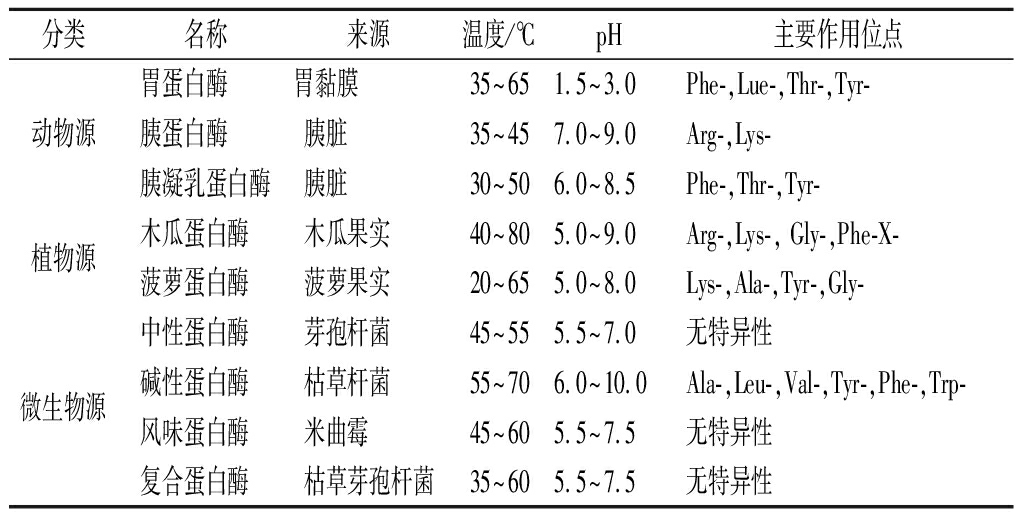
分类名称来源温度/℃pH主要作用位点胃蛋白酶 胃黏膜 35~651.5~3.0Phe-,Lue-,Thr-,Tyr-动物源胰蛋白酶 胰脏 35~457.0~9.0Arg-,Lys-胰凝乳蛋白酶胰脏 30~506.0~8.5Phe-,Thr-,Tyr-植物源木瓜蛋白酶 木瓜果实 40~805.0~9.0Arg-,Lys-, Gly-,Phe-X-菠萝蛋白酶 菠萝果实 20~655.0~8.0Lys-,Ala-,Tyr-,Gly-中性蛋白酶 芽孢杆菌 45~555.5~7.0无特异性微生物源碱性蛋白酶 枯草杆菌 55~706.0~10.0Ala-,Leu-,Val-,Tyr-,Phe-,Trp-风味蛋白酶 米曲霉 45~605.5~7.5无特异性复合蛋白酶 枯草芽孢杆菌35~605.5~7.5无特异性
邓志程等[24]利用胰蛋白酶与胰凝乳蛋白酶的复合酶酶解马氏珠母贝全脏器,多肽得率达55%以上。HOU等[17]用胰蛋白酶酶解阿拉斯加鳕鱼,在pH 8.0,50 ℃条件下水浴4.8 h,发现水解度为15%~18%时所得产物活性最高。叶盛旺等[10]利用胃蛋白酶制备青蛤多肽,条件为料液比1∶10(g∶mL)、加酶量1 600 U/g,于pH 2.0,42 ℃酶解8 h,获得产物具有体外免疫调节作用。胡旭阳等[25]采用5种不同的蛋白酶水解日本黄姑鱼鱼肉蛋白,最终得到料液比1∶11(g∶mL)、pH 6,59 ℃酶解5.4 h为最佳酶解工艺条件,细胞实验得到小鼠巨噬RAW264.7增殖率为(61.8%±0.5)%。王敏等[26]以鲍鱼浆为底物,水浴加热至50 ℃,调节pH至7.0,酶添加量为4%,风味蛋白酶与中性蛋白酶以质量比3∶2复配,酶解4 h,制得鲍鱼水解肽(纯度≥90%)。结果显示鲍鱼水解物对LPS诱导MH-S细胞分泌IL-1β、IL-6、TNF-α活性具有抑制作用。蔡本利等[27]以金枪鱼为原料,酶解条件为料水比1∶3(g∶mL)、加入1 400 IU/g原料的中性蛋白酶与1 100 IU/g原料的木瓜蛋白酶、温度50 ℃,酶解2.5 h,所得金枪鱼头酶解液显著提高了小鼠的脾淋巴细胞转化能力及抗体细胞形成能力。
2.2 其他制备技术
DUARTE等[28]利用酵母发酵太平洋无须鳕鱼蛋白,探讨发酵物的免疫活性,发现小鼠腹腔巨噬细胞吞噬能力得到显著提升, IL-4、IL-6和IL-10细胞数量也明显增加。人工合成法包括化学合成法和基因重组法,适于大分子活性肽的制备。直接提取法即采用有机溶剂(如乙醇,丙酮等)萃取。蒋定文等[29]采用盐溶液抽提、超滤、乙醇沉淀等步骤,从海洋星虫制备提取物,实验结果表明,该提取物具有免疫调节作用。然而直接提取法多用于内源性海洋生物活性肽,不足之处是存在溶剂残留的风险。
3 海洋生物免疫活性肽分离纯化技术
蛋白质初步分解得到的产物往往是包含不同分子大小的肽段,需要进一步的分离纯化才能获得高纯度的目标活性肽分子。蛋白质水解物通常含有不同肽的混合物。肽的大小、电荷或极性的分馏通常是相当困难的,这使得肽的后续鉴定具有挑战性。
目前,最常用的分离纯化技术是膜技术和色谱技术。通常步骤是利用超滤进行初次分离,根据分子质量大小筛选活性较高的肽段组分,经离子交换色谱或凝胶色谱对超滤所得高活性组分进行二次分离,利用高效液相色谱或反高效液相色谱对目标组分进行纯化。
3.1 膜分离技术
膜分离技术利用大小不同的微孔,通过压力实现选择性分离。大分子被截留在膜表面,小分子透过微孔进入膜的另一侧。最常用到的是超滤膜(0.005~0.1 μm),根据膜孔径大小可分为:<1、3、5、10 kDa,或辅助以无机陶瓷膜进行多肽提取物的除杂及分离。由于采用膜分离过程中不会引起待测物的相变及化学变化,保护了其原有特性,并且操作简单、选择性高、耗能低,在活性肽分离提取中应用十分广泛。
袁学文等[15]对远东拟沙丁鱼酶解液先经陶瓷膜(孔径0.2 μm)过滤,再由5 kDa超滤膜超滤,得到在1 kDa以下组分低聚肽,具有增强正常小鼠免疫功能。李婉等[30]对香港牡蛎进行研究,利用200 μm陶瓷膜过滤装置除去牡蛎酶解液中杂质,然后将滤液经超滤膜进行分级处理,得到4个不同分子质量组分,各超滤组分质量浓度为0.25~4.0 mg/mL,其体外免疫活性强度与浓度呈相关性。丁霈希等[31]利用<3 kDa超滤膜对等边浅蛤肉酶解产物进行分离,得到两个组分(<3 kDa和>3 kDa),通过细胞实验和动物实验结果表明,<3 ku组分具有一定的免疫调节效果。
3.2 凝胶层析
凝胶层析根据多肽分子质量大小进行分离。常用的是葡聚糖凝胶G-25和G-10,G-25适用分子质量较大的肽,G-10除分离多肽外还可以用于样品脱盐。凝胶层析分离技术操作较为简单,且不易引起样品失活。
纪丽娜[14]对金枪鱼头蛋白酶解液进行超滤分离得到了10~5 kDa的酶解液(TIP),然后又经葡聚糖凝胶Sephadex G-25进行进一步分离,选择柱规格2.6 cm×60 cm,流速0.5 mL/min,上样量质量浓度20 mg/mL,上样量5 mL,此条件下TIP可以分为5个组分。何小庆[32]利用Sephadex G-25凝胶层析对波纹巴非蛤的酶解物进行二次分离,得到P2(757~2 856 Da)和P3(634~1 229 Da)组分,可以显著提高淋巴细胞的增殖活性。
3.3 离子交换层析
离子交换色谱的分离是根据分离组分带电荷离子与可交换离子发生可逆转化,达到交换平衡,最终实现分离。根据交换粒子电负性不同,分为阳、阴离子交换色谱柱两种。对于极性多肽分子有较好分离效果,且可反复使用。但是被分离物容易受到酸、碱以及离子强度等环境的影响。
离子交换色谱法多与膜技术、凝胶色谱法、反相液相色谱法结合使用。邓志程等[24]利用凝胶柱层析和强阴离子交换色谱从马氏珠母贝酶解产物中筛选出2个具有免疫活性的肽段。冯晓梅等[33]联合使用Sephadex G-25凝胶色谱、离子交换色谱对酶解产物进行分离,再由C18反相高效液相色谱(reversed-phase high-performance liquid chromatography,RP-HPLC)纯化,得到高纯度活性肽。XU等[34]将超滤分离的得到活性最高的组分(<1 kDa)经DEAE-Sepharose Fast Flow进一步分离,获得5个主峰。
3.4 高效液相色谱
高效液相色谱根据混合物的组分在流动相和固定相之间分配系数的不同达到分离目的。当流动相携带组分与固定相中发生相互移动时,混合物中组分逐渐分离。高效液相色谱法主要应用于分子质量<5 000 Da,尤其是低于1 000 Da的多肽的分离与纯化。
NGUYEN等[35]采用Superdex Peptide10/300 GL GFC柱,结合反向高效液相色谱技术对黄鳍金枪鱼酶解产物进行了有效的分离纯化。高效液相色谱还可与其他分析技术手段联用以鉴定多肽结构,左爱华等[36]使用高效液相色谱-串联质谱技术对海参低聚肽进行了结构分析。
3.5 RP-HPLC
RP-HPLC是以非极性载体作为固定相,以极性强的溶剂为流动相的一种液相色谱分离技术。它的分辨率比其他分离方法更高效,应用范围广。常用于分离纯化分子质量<5 000 Da的多肽组分。
ZHENG等[37]采用凝胶色谱和RP-HPLC技术对马尾藻蛋白酶解物进行分离纯化,得到了12个主要成分。LEE等[38]利用RP-HPLC纯化菲律宾蛤仔肽,获得了一个10肽。牛瑞等[39]利用RP-HPLC对经过超滤、凝胶过滤层析、阴离子交换层析分离后得到的鳕鱼蛋白水解物进行纯化,得到高纯度的鳕鱼多肽。RP-HPLC也用于多肽结构鉴定。任娇艳等[40]酶解制备柴鱼蛋白肽,用基质辅助激光解吸电离飞行时间串联质谱法(matrix-associated laser dissociation/ionization time of flight massspectrometry,MALDI-TOF-MS)和RP-HPLC对分离组分进行结构鉴定。
4 结构鉴定技术
目前,质谱分析技术(MS)是生物活性肽的氨基酸序列测定的主要手段。它通过测定样品粒子的质荷比来进行成分分析和结构鉴定。可用于蛋白质的表征和测序。在整个电离过程中,软电离使待分析多肽分子的内部能量保持在较低状态,确保了分子骨架结构的完整性。分析多肽结构常用的质谱方法主要有3种,分别是快速原子轰击质谱(continuous flow-fast atom bombardment,FAB-MS)、电喷雾质谱(electrospray ionization massspectrometry,ESI-MS)以及MALDI-TOF-MS。
4.1 快速原子轰击质谱技术
快原子轰击利用一束惰性原子快速射击存在于液态基质中样品而使样品电离,得到的样品离子溅出进入质谱分析器,通过分析分子质量信息的准分子离子峰和化合物结构信息的碎片峰,可获知待测目标物的分子质量和结构信息。该技术可测定N端有封闭基团的多肽氨基酸序列[41]。
4.2 电喷雾质谱技术
电喷雾质谱采用的是电喷雾源的离子源,通过测定样品组分的质量电荷比,检测样品组分的分子质量。由于它采用的是电喷雾源离子源,一定电压条件下不会导致样品分子产生碎片。在测定过程中样品以溶液的形式导入,因此ESI-MS可以与具有高分离效能的RP-HPLC联用,可以在线检测出HPLC上分离出的每一个肽段的分子质量,扩大了质谱在蛋白质和肽领域中的应用[42]。CHI等[43]采用蛋白/多肽测序仪和ESI-MS分析鉴定了从血蚶中得到的两个免疫调节肽的氨基酸序列,分别为Trp-Pro-Pro和Gln-Pro。XU等[34]使用ESI-MS测定最终纯化肽的分子质量,用N-末端氨基酸测序法确定中华小公鱼免疫调节肽的氨基酸序列为Tyr-Val-Met-Arg-Phe,分子质量为715.4 Da。
4.3 基质辅助激光解吸电离飞行时间质谱技术
MALDI-TOF-MS是最常用的多肽质谱鉴定方法。其工作原理是利用激光作用于样品与一种化学基质(含在特定波长下吸光的发光基团)形成的混合物,混合物吸收光子而被激活,变成气态,由于多肽吸收单一光子,故而携带单一电荷,然后形成的离子直接进入质量分析仪,基于质量/电荷与飞行时间形成质谱图。在准确测定样品分子质量的同时还可测定其序列结构[44]。AHN等[45]利用飞行时间液相色谱/串联质谱对鲑鱼胸鳍副产物胃蛋白酶水解的抗炎肽进行了鉴定,鉴定结果为一个三肽。为便于理解及参考应用,将分离纯化技术与质谱鉴定技术进行整理归纳,如图1所示。
5 构效关系
多肽的生物活性与其分子质量,氨基酸组成及构象有着密切联系。小分子质量组分比大分子质量组分往往表现出更高的活性。根据已有海洋生物免疫活性肽的结构研究总结见表2。分析发现免疫调节肽多为含2~5氨基酸的短肽,分子大小通常<1 000 Da,可能是由于小分子的肽更利于机体吸收利用。据报道Val、Leu、Pro、Phe和其他疏水性氨基酸,以及Glu和Tyr负电荷氨基酸是免疫调节肽的常见残基,对其免疫调节活性非常重要。此外有研究表明,免疫调节肽通过与靶细胞表面上的特异性受体结合来调节先天性和适应性免疫应答,带有正电荷的较长疏水性肽具有更大的刺激小鼠脾细胞增殖的潜力。
6 展望
随着地球人口的增多与迁移、气候的变化,陆地资源日益匮乏,人类迫切需要开发海洋资源。目前,人们已从很多海洋生物的机体中,如海洋藻类、海洋甲壳类、海洋无脊椎动物,提取到多种具有增强免疫功能的多糖类物质(孔石莼多糖、甲壳多糖、海参多糖等)。此外,来自海洋鱼类(鳕鱼、鲑鱼、沙丁鱼等)、贝类(青蛤、牡蛎、扇贝及贻贝等)、节肢动物(南极磷虾、蟹等)以及海洋藻类(如螺旋藻、马尾藻)等的一些活性肽也是机体重要的免疫活性物质。虽然海洋生物资源众多,但如何对其进行更高效率的提取和分离纯化,是研究活性肽潜在价值的关键。海洋多肽的免疫作用有待更多的发掘。相信随着酶工程、基因工程、分离纯化技术的不断提改进和提升,海洋源活性物质及其衍生产品作为天然免疫调节剂的研究将更加完善,并且应用于新药物和保健食品的研发。

图1 免疫调节活性肽研究中常用分离纯化及结构鉴定技术
Fig.1 Isolation, purification and structural identification of immunoregulatory peptides
表2 海洋生物免疫活性肽
Table 2 Marine biological Immunomodulating peptide
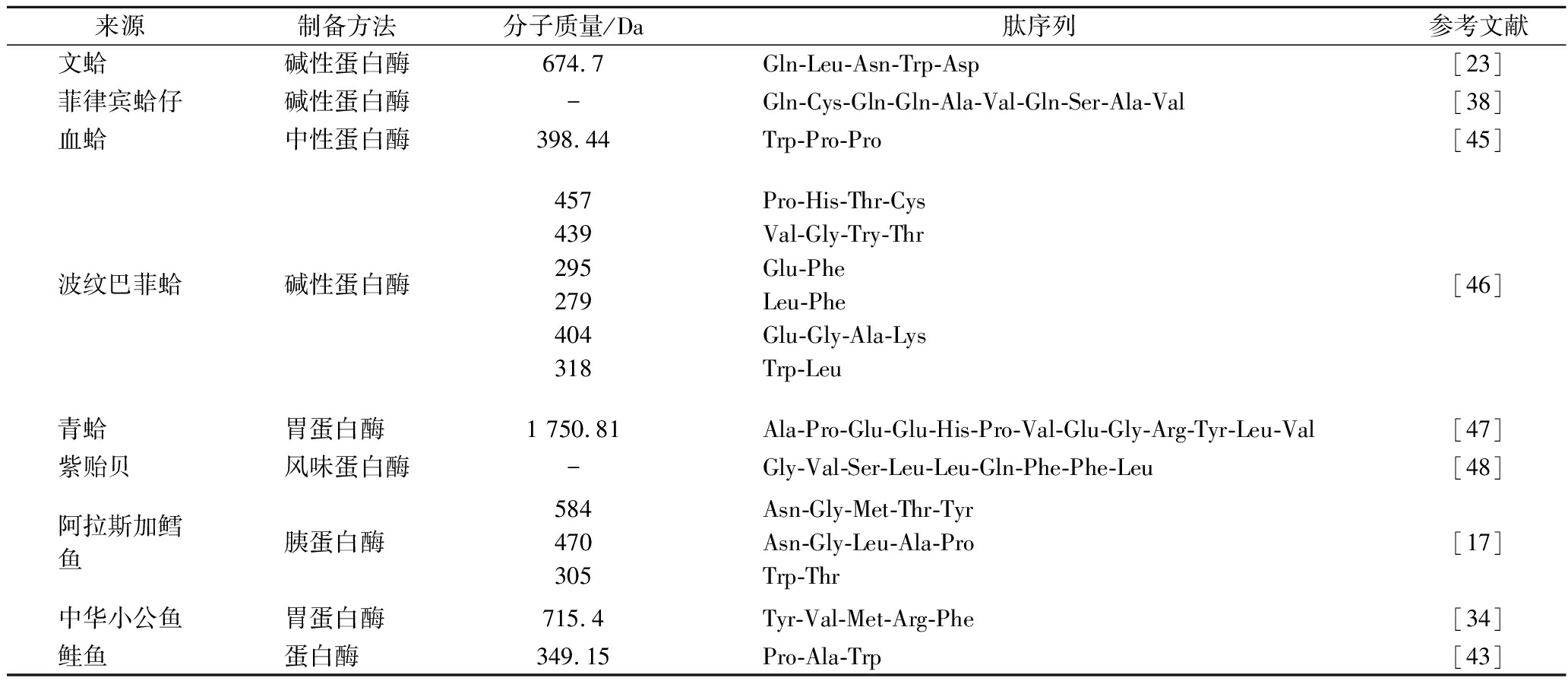
来源制备方法分子质量/Da肽序列参考文献文蛤碱性蛋白酶674.7Gln-Leu-Asn-Trp-Asp[23]菲律宾蛤仔碱性蛋白酶-Gln-Cys-Gln-Gln-Ala-Val-Gln-Ser-Ala-Val[38]血蛤中性蛋白酶398.44Trp-Pro-Pro[45]波纹巴菲蛤碱性蛋白酶457439295279404318Pro-His-Thr-CysVal-Gly-Try-ThrGlu-PheLeu-PheGlu-Gly-Ala-LysTrp-Leu[46]青蛤胃蛋白酶1 750.81Ala-Pro-Glu-Glu-His-Pro-Val-Glu-Gly-Arg-Tyr-Leu-Val[47]紫贻贝风味蛋白酶-Gly-Val-Ser-Leu-Leu-Gln-Phe-Phe-Leu[48]阿拉斯加鳕鱼胰蛋白酶584470305Asn-Gly-Met-Thr-TyrAsn-Gly-Leu-Ala-ProTrp-Thr[17]中华小公鱼胃蛋白酶715.4Tyr-Val-Met-Arg-Phe[34]鲑鱼蛋白酶349.15Pro-Ala-Trp[43]
注:“-”代表文献未提及
[1] 刘铭, 刘玉环, 王允圃, 等.制备、纯化和鉴定生物活性肽的研究进展及应用[J].食品与发酵工业, 2016, 42(4):244-251.
LIU M, LIU Y H, WANG Y P, et al.Research progress on production, purification and identification of bioactive peptides and its challenges in application[J].Food and Fermentation Industries, 2016, 42(4):244-251.
[2] CHOKSAWANGKARN W, PHIPHATTANANUKOON S, JARESITTHIKUNCHAI J, et al.Antioxidative peptides from fish sauce by-product:Isolation and characterization[J].Agriculture and Natural Resources,2018,52(5):460-466.
[3] 杨萍, 柯虹乔, 章超桦, 等.大眼金枪鱼头蛋白酶解物1ku超滤组分的抗氧化活性及其理化性质[J].水产学报, 2012, 36(8):1 297-1 303.
YANG P, KE H Q, ZHANG C H, et a1.Antioxidant activity and physicochemical properties of 1 ku fraction by ultrafiltration of bigeye tuna (Thunnus obesus) head protein hydrolysate[J].Journal of Fisheries of China, 2012, 36(8):1 297-1 303.
[4] LEE S H, QIAN Z J, KIM S K.A novel angiotensin I converting enzyme inhibitory peptide from tuna frame protein hydrolysate and its antihypertensive effect in spontaneously hypertensive rats[J].Food Chemistry,2010,118(1):96-102.
[5] LIU Z Y, DONG S Y, XU J, et al.Production of cysteine-rich antimicrobial peptide by digestion of oyster (Crassostrea gigas) with alcalase and bromelin[J].Food Control, 2008, 19(3):231-235.
[6] CHALAMAIAH M, JYOTHIRMAYI T, DIWAN P V, et al.Antiproliferative, ACE-inhibitory and functional properties of protein hydrolysates from rohu (Labeo rohita) roe (egg) prepared by gastrointestinal proteases[J].Journal of Food Science and Technology, 2015, 52(12):8 300-8 307.
[7] SONG R,WEI R B, LUO H Y, et al.Isolation and identification of an antiproliferative peptide derived from heated products of peptic hydrolysates of half-fin anchovy (Setipinna taty)[J].Journal of Functional Foods,2014,10:104-111.
[8] 王波, 韩立民.我国贝类养殖发展的基本态势与模式研究[J].中国海洋大学学报(社会科学版),2017(3):5-12.
WANG B, HAN L M.A Study on the basic situation and pattern of shellfish breeding in China[J].Journal of Ocean University of China (Social Sciences),2017(3):5-12.
[9] 张彩梅, 刘晓萍, 张红梅, 等.扇贝多肽对小鼠非特异性免疫功能的调节作用[J].中国海洋药物,2006,25(5):38-40.
ZHANG C M, LIU X P, ZHANG H M, et al.Effect of PCF on the nonspecific immunity in mice[J].Chinese Journal of Marine Drugs,2006,25(5):38-40.
[10] 叶盛旺, 杨最素, 李维, 等.青蛤酶解多肽对RAW264.7巨噬细胞的免疫调节作用[J].食品科学,2019,40(7):185-191.
YE S W, YANG Z S, LI W, et al. Immunomodulatory effects of peptides from enzymatic hydrolysate of cyclina sinensis on RAW264.7 macrophages[J].Food Science,2019,40(7):185-191.
[11] KIM Y S, AHN C B, JE J Y.Anti-inflammatory action of high molecular weight mytilus edulis hydrolysates fraction in LPS-induced RAW264.7 macrophage via NF-κB and MAPK pathways[J].Food Chemistry,2016,202:9-14.
[12] WANG Y K, HE H L, WANG G F, et al.Oyster(Crassostrea gigas) hydrolysates produced on a plant scale have antitumor activity and immunostimulating effects in BALB/c mice[J].Marine Drugs,2010,8(2):255-268.
[13] 陈利梅, 周文化.我国海洋食品工业的现状及对其发展的思考[J].食品与药品,2005,7(7):22-25.
CHEN L M, ZHOU W H.Status and ideas on the development of marine food[J].Food and Drug,2005,7(7):22-25.
[14] 纪丽娜. 金枪鱼头酶解物免疫活性肽的分离及对小鼠腹腔巨噬细胞功能的影响[D].湛江:广东海洋大学, 2012.
JI L N.Studies on separation of immune activity from tuna head hydrolysates and its effect on mouse peritioneal macrophages[D].Zhanjiang: Guangdong Ocean University,2012.
[15] 袁学文, 王炎冰.远东拟沙丁鱼低聚肽化学组成及其增强免疫力功能评价[J].食品与发酵工业,2018,44(4):104-110.
YUAN X W, WANG Y B.Chemical composition of oligopeptide from Sardinops agax and its immunoregulatory activity evaluation[J].Food and Fermentation Industries,2018,44(4):104-110.
[16] CHALAMAIAH M, HEMALATHA R F, JYOTHIRMAYI T, et al.Immunomodulatory effects of protein hydrolysates from rohu (Labeo rohita) egg (roe) in BALB/c mice[J].Food Research International, 2014, 62(8):1 054-1 061.
[17] HOU H, FAN Y, LI B F, et al.Preparation of immunomodulatory hydrolysates from Alaska pollock frame[J].Journal of the Science of Food and Agriculture,2012,92(15):3 029-3 038.
[18] YANG R Y, PEI X R, WANG J B, et al.Protective effect of a marine oligopeptide preparation from Chum Salmon (Oncorhynchus keta) on radiation-induced immune suppression in mice[J].Journal of the Science of Food Agriculture, 2010, 90(13):2 241-2 248.
[19] 卢连华, 周景洋, 颜燕, 等.海参肽对小鼠免疫调节及抗疲劳能力的影响[J].山东医药,2009,49(25):35-37.
LU L H, ZHOU J Y, YAN Y, et al.Effects of sea cucumber peptide on the immune regulation and anti-fatigue ability of mice[J].Shandong Medicine Journal,2009,49(25):35-37.
[20] 何丽霞, 陈启贺, 刘睿, 等.海参寡肽免疫调节作用及机制研究[J].科技导报,2016,34(11):42-47.
HE L X, CHEN Q H, LIU R, et al.Sea cucumber oligopeptides:Immunomodulatory effects and its mechanism[J].Science & Technology Review,2016,34(11):42-47.
[21] CIAN R E, L PEZ-POSADAS R, DRAGO S R, et al.A porphyra columbina hydrolysate upregulates IL-10 production in rat macrophages and lymphocytes through an NF-κB, and p38 and JNK dependent mechanism[J].Food Chemistry, 2012, 134(4):1 982-1 990.
PEZ-POSADAS R, DRAGO S R, et al.A porphyra columbina hydrolysate upregulates IL-10 production in rat macrophages and lymphocytes through an NF-κB, and p38 and JNK dependent mechanism[J].Food Chemistry, 2012, 134(4):1 982-1 990.
[22] 郭昱, 吴梧桐, 巫冠中.鲨肝肽对小鼠免疫性肝损伤的保护作用及免疫调节作用[J].中国新药杂志,2001,10(1):29-31.
GUO Y, WU W T, WU G Z.The liver-protective and immunomodulative effect of Shahepatide in mice with immune liver injury[J].Chinese Journal of New Drugs,2001,10(1):29-31.
[23] CARRASCO-CASTILLA J, HERN NDEZ-
NDEZ- LVAREZ A J, JIMÉNEZ-MART
LVAREZ A J, JIMÉNEZ-MART NEZ C, et al.Use of proteomics and peptidomics methods in food bioactive peptide science and engineering[J].Food Engineering Reviews, 2012, 4(4):224-243.
NEZ C, et al.Use of proteomics and peptidomics methods in food bioactive peptide science and engineering[J].Food Engineering Reviews, 2012, 4(4):224-243.
[24] 邓志程, 张迪, 吉宏武, 等.马氏珠母贝免疫活性肽的纯化与鉴定[J].广东海洋大学学报,2017,37(4):78-86.
DENG Z C, ZHANG D, JI H W, et al.Purification and identification of immunomodulating peptides from enzymatic hydrolysates of pinctada martensi[J].Journal of Guangdong Ocean University,2017,37(4):78-86.
[25] 胡旭阳, 李维, 孔祥东, 等.响应面法优化日本黄姑鱼鱼肉免疫活性肽的提取工艺[J].食品工业科技,2019,40(17):173-178.
HU X Y, LI W, KONG X D, et al.Optimization of extraction technology of immunologically active peptides from Nibea Japonica by response surface methodology[J].Science and Technology of Food Industry,2019,40(17):173-178.
[26] 王敏, 卢赛, 张曾亮, 等.鲍鱼水解肽的抗氧化、抗炎及免疫调节作用[J].食品工业科技,2021,42(5):282-288.
WANG M, LU S, ZHANG Z L, et al.Antioxidant,anti-inflammatory and immunomodulatory effects of abalone hydrolytic peptide[J].Science and Technology of Food Industry,2021,42(5):282-288.
[27] 蔡本利, 洪鹏志, 杨萍, 等.黄鳍金枪鱼头蛋白酶解液对小鼠免疫功能的调节作用[J].天然产物研究与开发,2007,19(5):791-795.
CAI B L, HONG P Z, YANG P, et al.Effect of enzyme hydrolyzed protein of tuna head on immune function of mice[J].Natural Product Research and Development,2007,19(5):791-795.
[28] DUARTE J, VINDEROLA G, RITZ B, et al.Immunomodulating capacity of commercial fish protein hydrolysate for diet supplementation[J].Immunobiology, 2006, 211(5):341-350.
[29] 蒋定文, 沈先荣, 贾福星, 等.海洋星虫提取物的营养分析及免疫调节作用的初步观察[J].中国生化药物杂志, 2004,24(2):96-97.
JIANG D R, SHEN X R, JIA F X, et al.Nutrient analysis and immune regulation study on extract of sipunculidae[J].Chinese Journal of Biochemical Pharmaceutics, 2004,24(2):96-97.
[30] 李婉, 曹文红, 章超桦, 等.牡蛎酶解产物的组成特点及其体外免疫活性[J].食品工业科技, 2017,38(16):35-42.
LI W, CAO W H, ZHANG C H, et al. Composition characteristics of oyster enzymatic hydrolysate and its immune activity in vitro[J].Science and Technology of Food Industry, 2017,38(16):35-42.
[31] 丁霈希, 章超桦, 高加龙, 等.等边浅蛤肉酶解产物超滤组分免疫调节作用[J].广东海洋大学学报,2020,40(3):114-121.
DING P X, ZHANG C H, GAO J L, et al.Immunomodulatory effects of the ultrafiltration fractions of enzymatic hydrolysates from the edible part of Gomphina aequilatera[J].Journal of Guangdong Ocean University,2020,40(3):114-121.
[32] 何小庆. 波纹巴非蛤活性肽的酶法制备及其免疫活性的研究[D].湛江:广东海洋大学,2014.
HE X Q.Enzymatic preparation and immunocompetence research of Paphia undulata peptides[D].Zhanjiang:Guangdong Ocean University,2014.
[33] 冯晓梅, 韩玉谦, 赵志强, 等.牡蛎酶解产物中多肽的分离纯化及其结构研究[J].中国海洋药物,2009,28(2):1-5.
FENG X M, HAN Y Q, ZHAO Z Q, et al.Study of isolation, preparation and structure identification of peptides from hydrolyzates of oyster[J].Chinese Journal of Marine Drugs,2009,28(2):1-5.
[34] XU B G, YE L, TANG Y P, et al.Preparation and purification of an immunoregulatory peptide from Stolephorus chinensis of the East Sea of China[J].Process Biochemistry 2020, 98:151-159.
[35] NGUYEN H T M, SYLLA K S B, RANDRIAMAHATODY Z, et al.Enzymatic hydrolysis of yellowfin tuna(Thunnus albacares) by-products using protamex protease[J].Food Technology and Biotechnology, 2011, 49(1):48-55.
[36] 左爱华, 王祖哲, 马普, 等.海参低聚肽的高通量HPLC-MS/MS分析鉴定和活性筛选[J].食品工业科技,2020,41(3):1-5;11.
ZUO A H, WANG Z Z, MA P, et al.Analysis, Identification and activity screening of apostichopus japonicus oligopeptides by high throughput of HPLC-MS/MS[J].Science and Technology of Food Industry,2020,41(3):1-5;11.
[37] ZHENG Y J, ZHANG Y F, SAN S.Efficacy of a Novel ACE-inhibitory peptide from Sargassum maclurei in hypertension and reduction of intracellular endothelin-1[J].Nutrients, 2020, 12(3):653-668.
[38] LEE S J, KIM E K, KIM Y S, et al.Purification and characterization of a nitric oxide inhibitory peptide from Ruditapes philippinarum[J].Food and Chemical Toxicology, 2012, 50(5):1 660-1 666.
[39] 牛瑞, 于建生.鳕鱼多肽的抗氧化活性及其分离纯化[J].食品与生物技术学报,2010,29(4):562-566.
NIU R, YU J S.Antioxidant activity and purification of pollock peptides[J].Journal of Food Science and Biotechnology,2010,29(4):562-566.
[40] 任娇艳, 张榕, 杨继国, 等.柴鱼蛋白肽的酶法制备、分离纯化及结构鉴定[J].现代食品科技,2015,31(9):155-161.
REN J Y, ZHANG R, YANG J G, et al.Enzymatic preparation, separation, and structural identification of bonito protein hydrolysates[J].Modern Food Science & Technology,2015,31(9):155-161.
[41] 蔡康鹏, 蔡水淋, 吴靖娜, 等.海洋贝类活性肽研究进展[J].渔业研究,2016,38(2):157-164.
CAI K P, CAI S H, WU J G, et al.Functional and bioactive properties of marine shellfish derived peptides:A review[J].Journal of Fisheries Research,2016,38(2):157-164.
[42] HERN NDEZ-LEDESMA B, QUIR
NDEZ-LEDESMA B, QUIR S A, AMIGO L, et al.Identification of bioactive peptides after digestion of human milk and infant formula with pepsin and pancreatin[J].International Dairy Journal,2007,17(1):42-49.
S A, AMIGO L, et al.Identification of bioactive peptides after digestion of human milk and infant formula with pepsin and pancreatin[J].International Dairy Journal,2007,17(1):42-49.
[43] CHI C F, HU F Y, WANG B, et al.Antioxidant and anticancer peptides from the protein hydrolysate of blood clam (Tegillarca granosa) muscle[J].Journal of Functional Foods,2015,15:301-313.
[44] 李建杰,叶磊,荣瑞芬.生物活性肽的酶法制备及分离鉴定研究进展[J].食品研究与开发,2012,33(2):195-199.
LI J J, YE L, RONG R F.Research advances on enzymatic preparation and separation identification of bioactive peptides[J].Food Research and Development,2012,33(2):195-199.
[45] AHN C B,CHO Y S,JE J Y.Purification and anti-inflammatory action of tripeptide from salmon pectoral fin byproduct protein hydrolysate[J].Food Chemistry, 2015,168:151-156.
[46] HE X Q, CAO W H, PAN G K, et al.Enzymatic hydrolysis optimization of Paphia undulata and lymphocyte proliferation activity of the isolated peptide fractions[J].Journal of the Science of Food and Agriculture,2015, 95(7):1 544-1 554.
[47] LI W, YE S W, ZHANG Z W, et al.Purification and characterization of a novel pentadecapeptide from protein hydrolysates of Cyclina sinensis and its immunomodulatory effects on RAW264.7 cells[J].Marine Drugs,2019,17(1):30-46.
[48] KIM E K, KIM Y S, HWANG J W, et al.Purification of a novel nitric oxide inhibitory peptide derived from enzymatic hydrolysates of Mytilus coruscus[J].Fish and Shellfish Immunology,2013,34(6):1 416-1 420.