3D打印技术又称为“增材制造”技术,是一种新颖的快速成型技术,陕西省把培育发展3D打印产业集群列入了“十四五”规划中。通过3D打印技术打印出的产品形状由计算机辅助设计软件来控制,从理论上来讲可以得到任何形状的产品[1]。基于这一特点,3D打印技术在医药、航天、工业等领域均得到了应用[2]。
蛋白质是人类生命活动中不可缺少的八大营养素之一,不少学者都将其作为打印油墨应用于3D打印食品和组织工程领域中。这是因为蛋白质作为打印油墨不仅能丰富打印材料中的氨基酸组成,提高打印产品的营养特性[3],还对打印油墨的可打印性起到了改善作用。例如,在含有酪蛋白酸钠的打印油墨中加入适量的牛奶浓缩蛋白,能够增强酪蛋白酸钠缠结状的分散网络结构,促进凝胶结构的形成[4]。在食品领域中,蛋白质油墨以乳制品最为常见,这可能与乳制品中蛋白质含量丰富且乳品种类多样(生乳、奶粉、奶酪)有关。在组织工程领域中,蛋白质油墨以明胶的应用最为广泛,这可能是因为明胶可以为细胞提供营养且细胞在明胶上具有较好的附着性[5]。3D打印技术的打印类型多样,应用最广泛的有热熔/空气挤出,选择性激光烧结,粘合剂喷射和喷墨打印[6]。在基于蛋白质原料的3D打印技术中,热熔/空气挤出技术最为常见,这与部分蛋白质具有良好的凝胶特性(如明胶[7])和可以改善混合打印油墨流动性(如蛋黄蛋白[8])的性质有关。
目前,国内外已有较多关于3D打印技术类型、3D打印油墨类型的相关总结,但有关蛋白质材料的类型(质构调整型蛋白质、组织框架型蛋白质、营养补充型蛋白质)、影响因素(流变学性质、机械参数)和应用领域(食品、组织工程领域)的研究性综述还尚未见探讨。因此,本文从3D打印蛋白质类型、影响因素和应用上进行了概括与探讨,旨在为蛋白质在3D打印领域更广泛、更成熟的应用提供理论支持与借鉴。
1 基于适用方向的3D打印蛋白质类型
蛋白质在油墨体系中起着不同的作用(表1),因此本文基于蛋白质的适用方向将其分为质构调整型蛋白质、组织框架型蛋白质和营养补充型蛋白质三类。
表1 用于3D打印的蛋白质材料
Table 1 Protein materials for 3D printing.

应用领域蛋白质材料材料中蛋白质含量油墨中蛋白质材料占比蛋白质在油墨体系中的作用打印效果参考文献黄粉虫幼虫 54.2%20%增加必需氨基酸的总量、减少水分流失[9]蛋黄蛋白 34.1%33%降低黏度,增加流动性[8]大豆分离蛋白92.1%20%丰富氨基酸组成[3]明胶 -10%增强机械强度、提高弹性、耐嚼性蛋清蛋白 80%5%热诱导形成可食凝胶、改善硬度及弹性[10]鱼糜 --作为黏性结构剂[11]鱼胶原蛋白 -1%提高黏度[12]食品领域 半脱脂奶粉 37%60%提高黏度[13]乳清分离蛋白97.8%10%软化油墨,利于挤出并分层[14]全脂牛奶 --丰富打印产品中蛋白质含量,提高营养[15]牛奶浓缩蛋白81.8%20%增加黏度,促进凝胶结构、蛋白质网络的形成[4]乳清分离蛋白97.8%5%增加流动性[16]明胶 -0.5%作为乳液稳定剂,增加乳液稳定性[17]牛明胶 -10%结构支撑[18]明胶 -20%结构支撑、为细胞提供营养[19]组织工程领域明胶 -10%结构支撑[20]丝素蛋白 -5%支持软骨细胞分化[5]明胶 -30%增强细胞附着力
注:“-”代表该项数据在相关文献未被报道
1.1 质构调整型蛋白质
可打印性是3D打印技术中打印材料需要具备的重要特征之一,它不仅要求打印材料能从喷嘴中顺利挤出,还要求打印产品可以在打印平台上良好支撑。3D打印通常可采用黄原胶[21]、淀粉[13]、面粉[22]等大分子增塑材料,但单一材料往往不具备优异的可打印性。例如,用15%的淀粉打印出的产品自支撑性较差,产品底部会随着时间推移而逐渐流动,这对产品的精度造成了负面影响[13]。为了提高油墨的可打印性,可以加入蛋白质来对油墨的流变性、黏弹性进行改善。改善后的混合油墨更适合挤压,并能在后处理过程中保持目标形状。基于此我们把能改善油墨可打印性的蛋白质称作为质构调整型蛋白质。当挤出的油墨在平台上难以自支撑时,可以向油墨中加入牛奶浓缩蛋白,以增加油墨的机械强度,这是因为牛奶浓缩蛋白质颗粒膨胀后会聚集形成质地较硬的网状结构。LIU等[4]将含有不同比例牛奶浓缩蛋白的3D打印产品放置了4 h后,发现产品的强度和稳定性在一定范围(15%~25%)内随着牛奶浓缩蛋白含量的增加而增强,但是当牛奶浓缩蛋白含量超过30%时有所下降(图1)。当油墨从喷嘴中挤出困难或黏附性不佳时,可以加入蛋黄蛋白[8]或者乳清分离蛋白[14, 16]来对油墨的流动性进行改善。例如,LIU等[14]通过对含有乳清分离蛋白、牛奶浓缩蛋白和黄原胶的混合油墨研究后发现,随着混合油墨中乳清分离蛋白比例的增加,油墨的硬度从269.11 g显著降低至72.38 g,黏附性从4.08 g·s显著增加至101.94 g·s。这表明乳清分离蛋白不仅可以对油墨质地进行软化还可以增加油墨的黏附性,有利于油墨从喷嘴挤出并形成连续沉积层。
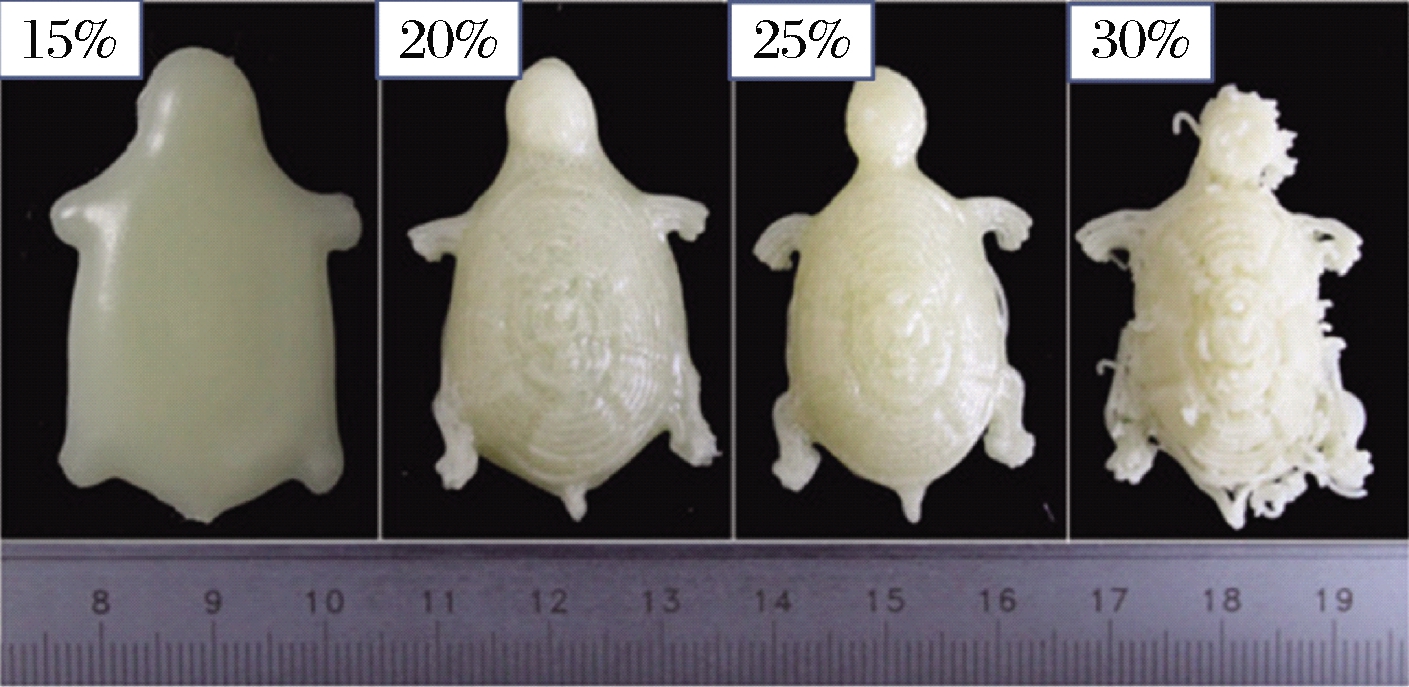
图1 牛奶浓缩蛋白对油墨可打印性的影响
Fig.1 Effect of milk protein concentrate on printability of inks
1.2 组织框架型蛋白质
组织框架型蛋白质是指在不添加其他成分的情况下即可独立作为打印油墨挤压、成型的蛋白质。这类蛋白质具有较好的凝胶特性,因此可以直接形成3D打印产品的组织结构。明胶和胶原蛋白是现阶段研究中发现的组织框架型蛋白质。明胶是一种非碳水化合物水凝胶,由动物皮肤、结缔组织和骨骼中的胶原蛋白部分水解而成。它有良好的膨胀性和凝胶性,可容纳大量水分,具有独特的“口中融化”质地,可为消费者提供独特的口感和风味感知[23]。COHEN等[24]的研究表明,仅使用质量分数为1%的明胶即可打印出可自撑的3D打印产品,4%的明胶打印出来的产品质地比较坚硬,口感近似巧克力或者蘑菇。组织框架型蛋白质在3D打印中除了单独作为打印油墨外,更多的是作为主体结构物质(塑形成分)与其他原料混合制成打印油墨。CHEN等[3]研究发现,在大豆分离蛋白质中添加明胶可以显著提高3D打印材料的硬度、弹性和咀嚼性,其值分别是对照组(未加明胶)的13.95倍、1.15倍和15.03倍;此外,SEVERINI等[12]设计了一款含有胡萝卜、西兰花、梨等果蔬的3D打印材料,为了使其能从喷嘴中成功挤出结构,加入了1%的鱼胶原蛋白来增加油墨黏度。这说明在混合油墨中添加明胶、胶原蛋白等组织框架型蛋白质能提升打印油墨的可打印性,并保持打印产品的结构稳定。
1.3 营养补充型蛋白质
蛋白质是维持人类生命活动的基础物质,将蛋白质应用于3D打印中可以丰富油墨的营养。大豆分离蛋白具有较高的消化利用率,牛奶蛋白具有优异的蛋白质生物价;在3D打印油墨中氨基酸组成不均匀或者缺乏蛋白质时添加大豆分离蛋白[3]或牛奶[15]可以丰富混合油墨的氨基酸组成及蛋白质含量,从而提高打印食品的营养价值。此外,一些低值但氨基酸组成平衡的蛋白质也是营养补充型蛋白质的理想来源,如昆虫蛋白。可食性昆虫是一种富含蛋白和微量元素的新型食物来源,推动可食性昆虫进入人类餐桌是解决世界粮食供应短缺的一种潜在解决方案。然而昆虫的形态悚然,人们在食用时无法克服恐惧心理,这阻碍了其被摆上餐桌。3D打印技术能够改变可食性昆虫的外观,增加其在人群中的可接受度。SEVERINI等[9]以小麦粉为结构剂,在其中加入了黄粉虫幼虫(蛋白质含量54.2%),设计了一款中空的柱状3D打印产品,这能很好地减轻食用者的心理负担(图2)。此外,通过对打印材料组分性质和后处理过程中尺寸的变化分析发现,黄粉虫幼虫不仅可以改善面团的氨基酸组成(必需氨基酸增加了8.8%),还可以减少烘烤过程中产品的水分流失。

图2 3D打印前后黄粉幼虫外观变化
Fig.2 Changes in the appearance of yellow powder larvae before and after 3D printing
2 3D打印蛋白质的影响因素
2.1 打印材料流变性
3D打印技术类型多样,最常见的有热熔/空气挤出,选择性激光烧结,粘合剂喷射和喷墨打印[6]。在实际应用中,打印技术的选择和打印材料自身特性有关。流动性好、易于凝固的打印材料(如面团、蔬菜泥)适合热熔/空气挤出技术,熔点较低的打印材料(糖、脂肪为主的打印基质)则更适合使用选择性激光烧结技术[25]。蛋白质油墨具有一定的流动性,因此在目前的研究中常选用热熔/空气挤出技术来对蛋白质油墨进行打印。基于挤压式的3D打印蛋白质技术效果的好坏一定程度上取决于油墨流动性是否适当,性质适当的打印材料能够从打印喷嘴中成功挤出并以设计好的结构沉积在打印平台上[14]。3D打印蛋白质的油墨在打印过程中是半固态的,适用于打印的油墨应该具有适当的黏度和弹性,良好的假塑性(体现在表观黏度随剪切速率的增加而降低)。因此打印油墨在打印过程中的流变性质是判断其是否可用于3D打印的重要指标之一。油墨中蛋白质的性质、含量以及打印过程中的温度都会对打印油墨的流变性造成影响。
2.2.1 蛋白质含量
蛋白质含量的高低会对打印油墨的流变性造成影响。牛奶浓缩蛋白、脱脂奶粉、明胶的加入可以增加油墨的机械强度;蛋黄蛋白、乳清分离蛋白则可以增加油墨的流动性,使混合油墨更易于从喷嘴中挤出。BORAN等[26]将明胶制成3D打印油墨,且发现油墨的强度和黏度主要受明胶浓度影响。ZHANG等[22]比较了面团中蛋白质含量(7.2%和12%)对油墨流变性质的影响,结果表明随着蛋白质含量的增加,打印油墨的储能模量G′和损耗模量G″均增加,在1 Hz时其复数黏度也增加,这可能是因为较高的蛋白质含量有利于连续面筋网络的形成。LIU等[10]研究发现,在含有明胶、玉米淀粉和蔗糖的复杂混合物系统加入质量分数为5%的蛋清蛋白,可以改善打印油墨的硬度和弹性,有利于打印油墨从喷嘴中及时挤出;同时也提高了打印油墨的黏度,有助于在打印过程中保持所需的形状。
2.2.2 蛋白质性质
蛋白质拥有高级的空间结构,例如胶原蛋白具有由3条α-链共价交联的三螺旋结构。当蛋白质作为打印油墨的主要成分时,加入电解质成分、酶等外源物质或者使用微波处理等物理手段能使蛋白质性质改变,从而达到改善打印油墨的流变性质的效果。NaCl是食品体系中常见的物质,在具有高黏度的鱼糜中添加1.5 g/100g的NaCl能改变鱼糜浆液的流变性质(降低G′和G″),有利于打印材料挤出,并使打印产品具有光滑的表面结构。这可能是因为NaCl导致了鱼糜中肌球蛋白尾部发生变性,诱导分子间作用力和分子内作用力的重新分配,从而增加了鱼糜的流动性[27]。转谷氨酰酶作为一种食品添加剂在肉类工业中十分常见,它可以通过催化蛋白质分子间形成共价键来提高蛋白质基油墨的G′(增加弹性)、降低其对频率的依赖性,从而增强油墨热稳定性。例如,DU等[17]用明胶和大豆油制备凝胶状乳液,并添加TG酶来提高凝胶乳液的热稳定性。结果表明,TG酶交联后的乳液凝胶在121 ℃下加热20 min后仍保持良好的自支撑能力,这有助于打印出的产品在后加工过程中的结构稳定。此外,采用低功率的微波对油墨进行预处理则也可以提高打印油墨的黏度,且黏度会随着微波功率的增大而进一步增大[28]。
2.2.3 打印温度
温度与打印材料的流变性质联系尤为紧密,这在3D打印巧克力的研究中已充分体现。在3D打印蛋白质的油墨中,明胶的流变性质受温度的影响较大。温度决定着明胶处于溶胶的状态还是凝胶的状态,因此打印过程中的控制温度对明胶产品的呈现极为重要。在低于胶凝温度的温度下,G′>G″,这表明该混合物表现为弹性结构主导的固体,此时的3D打印产品结构更明确,材料的扩散更少[29]。
2.2 打印机械参数
3D打印过程中的打印机械参数也会对最终产品的品质好坏造成影响。表2总结了3D打印蛋白质的机械参数。由表2可知,喷嘴移动速度的常用参数为10~70 mm/s;喷嘴直径通常为0.84~2.00 mm;挤出速度的常用参数为0.003~0.005 mm3/s。喷嘴移动速度是打印产品轮廓并填充时喷嘴的移动速度,其快慢会对产品最终呈现造成影响[30]。打印过程中喷嘴移动速度太快,可能会导致产品挤出的长丝浆料发生拖曳而断裂;打印过程中喷嘴移动速度太慢,可能会导致浆料因为流动不稳定而形成线圈[11](图3)。喷嘴直径的大小决定了打印产品的精度[31],喷嘴直径越小,打印样品的细化程度越高,样品质量也越高。例如,ANUKIRUTHIKA等[8]比较了2种规格的喷嘴直径(0.84 mm和1.22 mm)对鸡蛋清、鸡蛋黄打印产品质量的影响。结果表明,使用直径为0.84 mm喷嘴打印的产品具有更好的涂层细节和更高的精度。然而,较小的喷嘴直径在提高打印产品的分辨率的同时会增加打印的时间和进料的压力。因此,在实际操作时应当选择适宜大小的喷嘴直径才能在打印效率和产品精度之间取得良好的平衡。挤出速度通过影响蛋白质在油墨中的分布来对油墨质地造成影响。TOHIC等[32]通过比较未处理的奶酪、融化处理的奶酪和经3D打印以不同挤出速率(4 mL/min或12 mL/min)挤出的融化奶酪的激光扫面共聚焦结果发现,与未经处理的奶酪相比,融化处理和挤压处理会破坏奶酪中蛋白质与脂肪的分布均匀性,且剪切速率越大对奶酪中蛋白质和脂肪分布的破坏越剧烈(图4)。此外,喷嘴高度也是保证成功打印的机械指标之一,在打印时其值不应低于临界喷嘴高度。这是因为,当喷嘴高度低于临界喷嘴高度时,浆料会因为来不及沉积而挤压在喷嘴与打印产品之间[33]。临界喷嘴高度可由公式(1)计算[34]:
(1)
式中:hc是喷嘴的临界高度,mm;Vd是挤出速度,cm3/s;Vn是喷嘴移动速度,mm/s;Dn是喷嘴直径,mm。目前,已发表论文中对3D打印时喷嘴高度报道较少,因此无法总结出其常用的参数范围。
表2 3D打印蛋白质过程的机械参数
Table 2 The mechanical parameters of 3D printed protein.
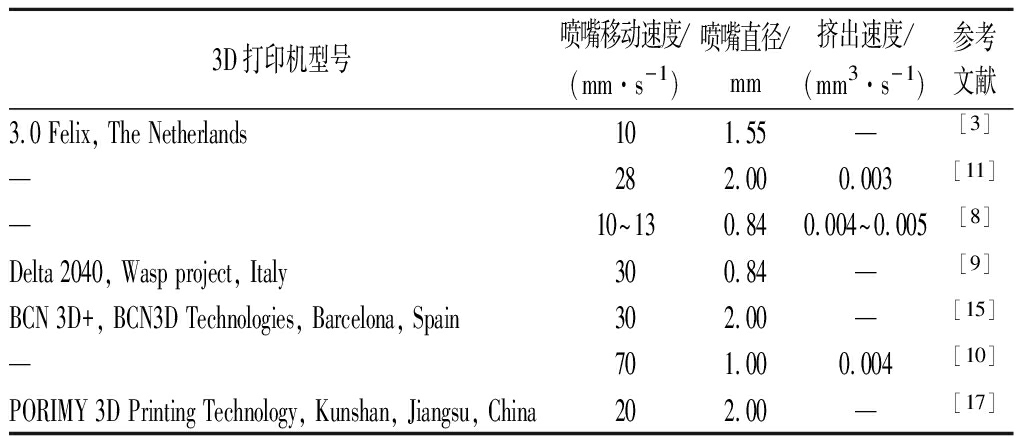
3D打印机型号喷嘴移动速度/(mm·s-1)喷嘴直径/mm挤出速度/(mm3·s-1)参考文献3.0 Felix, The Netherlands101.55—[3]—282.000.003[11]—10~130.840.004~0.005[8]Delta 2040, Wasp project, Italy300.84—[9]BCN 3D+, BCN3D Technologies, Barcelona, Spain302.00—[15]—701.000.004[10]PORIMY 3D Printing Technology, Kunshan, Jiangsu, China202.00—[17]
注:“-”代表该项数据在相关文献未被报道

图3 喷嘴移动速度对打印效果的影响
Fig.3 Effect of nozzle moving speed on printing result.

图4 尼罗红(脂质)和固绿FCF(蛋白质)溶液染色的 奶酪样品共聚焦激光扫描显微图
Fig.4 CLSM of cheese sample stained with Nile Red and Fast Green FCF solution
3 3D打印蛋白质技术的潜在应用领域
3.1 食品领域
蛋白质作为一种人类生存不可或缺的营养元素,是3D打印食品技术的主要打印原料之一,以蛋白质为原料的3D打印技术在食品领域有广泛应用。使用3D打印技术打印出的食品较传统食品有以下三点优势:(1)3D打印可以根据不同人群的营养需求制定特定配方。幼儿时期饮食的营养均衡性对其生长发育至关重要,然而先天食物偏爱(甜味食品)导致部分幼儿对蔬果肉蛋的摄入有着排斥心理而拒绝食用,同时强迫幼儿食用反而会加重其对该食物的逆反心理,从而导致其无法获得满足健康生长所必需的营养素。3D打印蛋白质技术可通过改变打印油墨的配方来实现食品的私人订制,从而改善了营养摄入不均衡的问题。(2)3D打印蛋白质技术可以提高消费者的消费体验。老年人由于咀嚼能力下降,日常饮食以湿软食品为主,此类食品外观普通且缺乏多样性,从而大大降低了老年群体的食用感官体验。3D打印蛋白质技术可以对食品的外观进行改良,打印出形状丰富的食品,为咀嚼困难人群提供更加具有视觉吸引力的食品,提高其生活质量。KOUZANI等[35]使用金枪鱼(蛋白质来源)、南瓜和甜菜制成3D打印油墨,打印出了适合老年人食用鱼状食物。打印出的鱼状食物相较于单一的泥状食物,在视觉感官上得到了有效改善,从而减轻了长期食用单一流食而带来的厌倦感;通过品尝打印前的泥状油墨及打印后的鱼状产品发现,打印前后的味道基本上没有区别,这意味着3D打印并不会给食材风味带来不良影响。(3)3D打印蛋白质技术的应用还可缓解世界蛋白质来源不足的危机[9]。通过3D打印技术改变具有丰富蛋白质的昆虫形态,使之成为人们接受度更高的食品,是缓解世界蛋白质来源不足危机的一个方式。
3.2 组织工程领域
除了食品领域,天然可打印蛋白质在医疗领域作为生物打印材料而被广泛应用。生物打印技术是将细胞与水凝胶混合制成打印油墨,通过3D打印机来制造出模拟组织结构的技术;与传统的模拟组织工程技术(直接将细胞接种在生物材料表面)相比,生物打印技术不但可以为细胞提供合适的细胞外基质,促进细胞的生长转化,还可以从微米级别上精确地控制人造器官中细胞的分布[36]。明胶、胶原蛋白等蛋白质材料是广泛用于生物打印的天然油墨,这是因为它们既能作为细胞外基质的重要组分,又能在保持结构稳定中发挥重要作用。明胶具有良好的凝胶性能和生物相容性[37],是一种天然衍生的水凝胶,不但可以弥补天然水凝胶可调性有限、易出现疾病转移的缺陷,还可以解决合成水凝胶缺乏生物功能的问题[38]。胶原蛋白是动物结缔组织中的主要成分之一,具有多种类型,在生物打印中应用频率最高的是I型胶原蛋白。这是因为I型胶原蛋白具有良好的自组装能力,能够形成纤维状水凝胶。然而,I型胶原蛋白在生理温度(约37 ℃)下形成凝胶的时间较长(约30 min),这会对打印油墨中细胞的均一性造成不良影响,因此现有报道通常将其掺入其他水凝胶中混合使用[39]。此外,纯明胶在生理温度(约37 ℃)下会形成低黏度的溶液,稳定性较差,这成为其在生物打印中应用的一个弊端。把明胶交联后再进行生物打印可以提高油墨的稳定性[40]。目前常用的交联方法有化学交联、酶交联和光交联。WANG等[19]以肝细胞和明胶水凝胶作为打印油墨,通过在戊二醛溶液中化学交联后,打印出了一个由38层肝细胞和明胶混合物叠加而成的高空间结构。经体外培养45 d后,打印出的3D结构仍然非常完整且嵌入支架中的肝细胞存活率高达90%,这说明经交联后3D打印出来的类肝脏结构体机构稳定,且能在较长时间内维持肝脏的功能。RAVEENDRAN等[20]将明胶与甲基丙烯酸基团官能化后,使用细胞相容性光引发剂来促进其快速光交联,并与牙周膜细胞混合制成打印墨水进行生物打印,结果表明打印得到组织能在生理温度(约37 ℃)下保持稳定,并且组织中的牙周膜细胞在14 d内有较高的生长水平。
4 展望
就现阶段对3D打印蛋白质的研究现状与进展来看,仍需要从以下几个方面对其进行深入研究。
(1)3D打印蛋白质技术对打印产品质构特性的可调控研究。食品合成生物学是目前食品领域的前沿技术,3D打印技术作为一种重组工具,是将食品组分重组为食品的重要环节。不同的食品拥有不同的质构特性,尤其是蛋白质类食品。然而,目前3D打印蛋白质技术调控食品质构特性的能力不足,仅有通过调整打印参数来优化产品精细化程度的报道。因此可以从喷嘴形状、喷射力学等方面对3D打印设备进行设计,从而充分调控蛋白质基3D打印产品的质构特性(如硬度、弹性),这将是蛋白质基油墨相较于其他成分应用于3D打印中的一大优势。
(2)蛋白质与其他大分子物质的界面互作与油墨适印性的研究。蛋白质具有两亲性(亲水亲油),因此能自发转移至油-水界面形成吸附层,以维持界面的稳定;两亲性质赋予了蛋白质良好的乳化特性。如研究所知,以蛋白质为基质的乳液凝胶是3D打印蛋白质油墨的良好来源,目前已有将乳液凝胶应用于3D打印中的相关报道。研究发现,蛋白质与其他大分子材料间(如多糖)的交互作用(如形成氢键、离子键)可以有效提高乳液的稳定性,而3D打印油墨的稳定性是评价油墨适印性的重要指标之一,目前使用蛋白质与其他大分子物质界面互作以提高油墨稳定性的研究尚未见报道。
(3)建立一种通用的能够评价蛋白质基油墨是否适用于3D打印的评价方法。流变特性(G′、G″)和质构特性(硬度)是现阶段研究中常用的评价蛋白质基油墨是否适用于3D打印的指标。然而,这种评价方法是非常局限的,这是因为能够从喷嘴挤出且自撑的打印油墨A的G′、G″和硬度值的范围仅仅适用于打印油墨A本身。打印油墨B在这个区间范围的3D打印效果往往是不尽人意的;此外,能够从喷嘴挤出且自撑的打印油墨A和打印油墨B的G′、G″和硬度值范围甚至可能相差几个数量级。因此,未来需要寻找一种可以概括多种蛋白质基油墨可打印性的评价方法。目前,已出现用相位角及弛豫指数(相位角在3°~15°且弛豫指数在0.03~0.13)来判断水凝胶适印性的相关报道,这为建立蛋白质基油墨适印性的评价方法提供了良好的思路。
(4)升级打印机功能,赋能3D打印蛋白质技术市场化、成熟化发展。随着现代社会生活节奏的加快及生活水平的提高,方便快捷且新颖的烹饪方式更能吸引消费者的目光。目前蛋白基油墨在3D打印方面的研究更多的是利用蛋白质油墨自身的流变学特性,因此打印后的产品需要进行热处理加工等一系列繁琐过程,过于复杂的加工过程不符合当代消费者的生活习惯。其次,现有报道中通过3D打印技术打印出的产品完全可以通过模具积压生产来取代。这成为了限制3D打印技术在消费市场中推广流通的弊端之一。开发一款兼具挤压成型及熟化加工一体化的3D打印机设备将有效解决这一问题,因此升级3D打印机功能是将科研成果转化为实践应用的有效手段之一。此外,很多蛋白具有热处理后变性成形的特性(如蛋清蛋白),目前大多数食品3D打印装备具有喷嘴加热功能,但如果在蛋白质材料打印时采用,非常容易堵塞喷嘴。因此,将瞬时加热技术应用于3D打印装备改进中,可以更好地促进蛋白质在3D打印领域中应用。
(5)4D打印蛋白质技术的开发。4D打印技术是指随着时间的推移,打印产品可以通过温度、湿度、酸碱环境等外界因素的变化来对感官特性和功能特性进行改变。4D打印技术是3D打印技术基础上的发展,相较于3D打印技术增加了时间维度。目前已有将花青素应用于4D打印食品中的研究,使得打印出的产品可以根据时间的推移而发生颜色变化,这极大地增强了消费者的感官体验。对温度、酸碱环境敏感的蛋白质材料(如明胶)是潜在的打印油墨来源,在4D打印技术上具有一定的应用潜力,有待科研人员进一步探索,以期蛋白质材料在增材制造市场上更广泛的应用。
[1] YANG F, ZHANG M, BHANDARI B.Recent development in 3D food printing[J].Critical Reviews in Food Science and Nutrition, 2017,57(14):3 145-3 153.
[2] 潘燕墨, 孙钦秀, 刘书成, 等.小麦淀粉改善虾肉糜物料特性及其3D打印适应性[J].食品与发酵工业, 2021,47(12):63-69.
PAN Y M, SUN Q X, LIU S C, et al.Wheat starch improves the material properties of shrimp surimi and its 3D printability[J].Food and Fermentation Industries,2021,47(12):63-69.
[3] CHEN J W, MU T H, GOFFIN D, et al.Application of soy protein isolate and hydrocolloids based mixtures as promising food material in 3D food printing[J].Journal of Food Engineering, 2019,261:76-86.
[4] LIU Y W, YU Y, LIU C S, et al.Rheological and mechanical behavior of milk protein composite gel for extrusion-based 3D food printing[J].LWT, 2019,102:338-346.
[5] DAS S, PATI F, CHAMEETTACHAL S, et al.Enhanced redifferentiation of chondrocytes on microperiodic silk/gelatin scaffolds:Toward tailor-made tissue engineering[J].Biomacromolecules, 2013,14(2):311-321.
[6] NACHAL N, MOSES J A, KARTHIK P, et al.Applications of 3D printing in food processing[J].Food Engineering Reviews, 2019,11(3):123-141.
[7] DAI H J, LI X Y, DU J, et al.Effect of interaction between sorbitol and gelatin on gelatin properties and its mechanism under different citric acid concentrations[J].Food Hydrocolloids, 2020,101:105557.
[8] ANUKIRUTHIKA T, MOSES J A, ANANDHARAMAKRISHNAN C.3D printing of egg yolk and white with rice flour blends[J].Journal of Food Engineering, 2020,265:109691.
[9] SEVERINI C, AZZOLLINI D, ALBENZIO M, et al.On printability, quality and nutritional properties of 3D printed cereal based snacks enriched with edible insects[J].Food Research International, 2018,106:666-676.
[10] LIU L L, MENG Y Y, DAI X N, et al.3D printing complex egg white protein objects:Properties and optimization[J].Food and Bioprocess Technology, 2019,12(2):267-279.
[11] WANG L, ZHANG M, BHANDARI B, et al.Investigation on fish surimi gel as promising food material for 3D printing[J].Journal of Food Engineering, 2018,220:101-108.
[12] SEVERINI C, DEROSSI A, RICCI I, et al.Printing a blend of fruit and vegetables.New advances on critical variables and shelf life of 3D edible objects[J].Journal of Food Engineering, 2018,220:89-100.
[13] LILLE M, NURMELA A, NORDLUND E, et al.Applicability of protein and fiber-rich food materials in extrusion-based 3D printing[J].Journal of Food Engineering, 2018,220:20-27.
[14] LIU Y W, LIU D S, WEI G M, et al.3D printed milk protein food simulant:Improving the printing performance of milk protein concentration by incorporating whey protein isolate[J].Innovative Food Science & Emerging Technologies, 2018,49:116-126.
[15] MART NEZ-MONZ
NEZ-MONZ J, C
J, C RDENAS J, GARCíA-SEGOVIA P.Effect of temperature on 3D printing of commercial potato puree[J].Food Biophysics, 2019,14(3):225-234.
RDENAS J, GARCíA-SEGOVIA P.Effect of temperature on 3D printing of commercial potato puree[J].Food Biophysics, 2019,14(3):225-234.
[16] LIU Y W, ZHANG W J, WANG K, et al.Fabrication of gel-like emulsions with whey protein isolate using microfluidization:Rheological properties and 3D printing performance[J].Food and Bioprocess Technology, 2019,12(12):1 967-1 979.
[17] DU J, DAI H J, WANG H X, et al.Preparation of high thermal stability gelatin emulsion and its application in 3D printing[J].Food Hydrocolloids, 2021,113:106536.
[18] POURCHET L J, THEPOT A, ALBOUY M, et al.Human skin 3D bioprinting using scaffold-free approach[J].Advanced Healthcare Materials, 2017,6(4):1601101.
[19] WANG X H, YAN Y N, PAN Y Q, et al.Generation of three-dimensional hepatocyte/gelatin structures with rapid prototyping system[J].Tissue Engineering, 2006,12(1):83-90.
[20] RAVEENDRAN N T, VAQUETTE C, MEINERT C, et al.Optimization of 3D bioprinting of periodontal ligament cells[J].Dental Materials, 2019,35(12):1 683-1 694.
[21] LI J, WU Y, MA Y, et al.Effects of addition of hydrocolloids on the textural and structural properties of high-protein intermediate moisture food model systems containing sodium caseinate[J].Food and Function, 2017,8(8):2 897-2 904.
[22] ZHANG L, LOU Y M, SCHUTYSER M A I.3D printing of cereal-based food structures containing probiotics[J].Food Structure, 2018,18:14-22.
[23] GODOI F C, PRAKASH S, BHANDARI B R.3D printing technologies applied for food design:Status and prospects[J].Journal of Food Engineering, 2016,179:44-54.
[24] COHEN D L, LIPTON J I, CUTLER M, et al.Hydrocolloid printing:A novel platform for customized food production[C]Solid Freeform Fabrication Symposium.Austin:TX, 2009:807-818.
[25] SUN J, ZHOU W B, HUANG D J, et al.An overview of 3D printing technologies for food fabrication[J].Food and Bioprocess Technology, 2015,8(8):1 605-1 615.
[26] BORAN G, MULVANEY S J, REGENSTEIN J M.Rheological properties of gelatin from silver carp skin compared to commercially available gelatins from different sources[J].Journal of Food Science, 2010,75(8):E565-E571.
[27] TAHERGORABI R, JACZYNSKI J.Physicochemical changes in surimi with salt substitute[J].Food Chemistry, 2012,132(3):1 281-1 286.
[28] FAN H Z, ZHANG M, LIU Z B, et al.Effect of microwave-salt synergetic pre-treatment on the 3D printing performance of SPI-strawberry ink system[J].LWT-Food Science and Technology, 2020,122:109004.
[29] WARNER E L, NORTON I T, MILLS T B.Comparing the viscoelastic properties of gelatin and different concentrations of kappa-carrageenan mixtures for additive manufacturing applications[J].Journal of Food Engineering, 2019,246:58-66.
[30] ATTALLA R, LING C, SELVAGANAPATHE P.Fabrication and characterization of gels with integrated channels using 3D printing with microfluidic nozzle for tissue engineering applications[J].Biomedical Microdevices, 2016,18(1):17.
[31] VOGELER F, VERHEECKE W, VOET A, et al.An initial study into Aerosol Jet® printed interconnections on extrusion based 3D printed substrates[J].![]() Vestnik—Journal of Mechanical Engineering, 2013,59(11):689-696.
Vestnik—Journal of Mechanical Engineering, 2013,59(11):689-696.
[32] LE TOHIC C, O'SULLIVAN J J, DRAPALA K P, et al.Effect of 3D printing on the structure and textural properties of processed cheese[J].Journal of Food Engineering, 2018,220:56-64.
[33] WANG J W, SHAW L L.Rheological and extrusion behavior of dental porcelain slurries for rapid prototyping applications[J].Materials Science and Engineering:A, 2005,397(1):314-321.
[34] HAO L, MELLOR S, SEAMAN O, et al.Material characterisation and process development for chocolate additive layer manufacturing[J].Virtual and Physical Prototyping, 2010,5(2):57-64.
[35] KOUZANI A Z, ADAMS S, WHYTE D J, et al.3D printing of food for people with swallowing difficulties[J].KnE Engineering,2017,2(2):23.
[36] MANDRYCKY C, WANG Z J, KIM K Y, et al.3D bioprinting for engineering complex tissues[J].Biotechnology Advances, 2016,34(4):422-434.
[37] FENG X, DAI H J, MA L, et al.Food-grade gelatin nanoparticles:Preparation, characterization, and preliminary application for stabilizing pickering emulsions[J].Foods, 2019,8(10):479.
[38] MELCHELSAB F P W, DOMINGOSC M A N, KLEINA T J, et al.Additive manufacturing of tissues and organs[J].Progress in Polymer Science, 2012,37(8):1 079-1 104.
[39] UNAGOLLA J M, JAYASURIYA A C.Hydrogel-based 3D bioprinting:A comprehensive review on cell-laden hydrogels, bioink formulations, and future perspectives[J].Applied Materials Today, 2020,18:100479.
[40] PANWAR A, TAN L P.Current status of bioinks for micro-extrusion-based 3D bioprinting[J].Molecules, 2016,21(6):685.