拟除虫菊酯是从野菊花中提取的天然除虫菊酯的合成衍生物,由菊花酸酯以及其酸和醇的卤化衍生物所组成[1]。拟除虫菊酯杀虫剂都含有酸基、中心酯键和醇基,其中酸基含有2个手性碳,因此拟除虫菊酯通常以立体异构化合物(反式和顺式)的形式存在[2]。拟除虫菊酯的毒性与其结构有关,顺式异构体通常比反式异构体毒性更大。根据在大鼠体内的毒性信号,将拟除虫菊酯分为Ⅰ型和Ⅱ型,其结构见表1,主要差别是Ⅱ型菊酯类农药的醇基α碳上连着氰基。然而,某些拟除虫菊酯(如氰菊酯、氟菊酯)却无法进行这样的分类,它们会同时产生这2种毒性信号[3-4]。拟除虫菊酯类农药进入人体后会快速代谢,发生酯键断裂和氧化作用生成cis/trans-3-(2,2-二氯苯乙烯基)-2,2-二甲基环丙基-1-羧酸和3-苯氧基苯甲醇,3-苯氧基苯甲醇进一步氧化成3-苯氧基苯甲酸(3-phenoxybenzoic acid, 3-PBA)[5]。
表1 拟除虫菊酯分类
Table 1 Classification of pyrethroids

拟除虫菊酯分类结构通式常见拟除虫菊酯典型食物限量标准/(mg·kg-1)欧盟标准中国标准Ⅰ型拟除虫菊酯联苯菊酯番茄 0.30.5氯菊酯黄瓜 0.050.5Ⅱ型拟除虫菊酯氰戊菊酯马铃薯0.020.05高效氯氟氰菊酯马铃薯0.010.02甲氰菊酯花椰菜0.011.0溴氰菊酯胡萝卜0.020.2氯氰菊酯茄子 0.50.5氟氰戊菊酯山药 0.010.05
菊酯类农药是一种神经毒剂,Ⅰ型和Ⅱ型拟除虫菊酯具有不同的神经毒性,其原理主要是对电压门控钠离子通道造成干扰。研究表明,拟除虫菊酯类农药属于内分泌干扰物,可通过饮食摄入进入人体[6]。具有生殖毒性、神经毒性、免疫系统毒性,甚至会导致肿瘤发生[7]。3-PBA是一种结构稳定、难以降解的雌激素类物质,会导致拟除虫菊酯类农药生物矿化作用受阻,从而阻止了拟除虫菊酯类农药完全转化为无毒小分子物质,危及人体健康[8]。因此,我国制定并颁布实施了一系列关于拟除虫菊酯类农药安全使用和残留限量检测标准。GB 27779—2011《卫生杀虫剂安全使用准则 拟除虫菊酯类》规定了卫生杀虫剂拟除虫菊酯的安全使用准则,如规定溴氰菊酯、氯氰菊酯和氯菊酯等不宜在桑园、鱼塘、河流、养蜂场等处及其周围使用,使用时要采取一般防护措施。我国最新国家标准GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》规定联苯菊酯在根茎类和薯芋类蔬菜中的最大残留限量为0.05 mg/kg,氟氰戊菊酯在梨、苹果中的最大残留限量为0.5 mg/kg等;欧盟标准EU441/2012规定联苯菊酯在番茄中的最大残留量为0.3 mg/kg,马铃薯中氰戊菊酯和高效氯氟氰菊酯的最大残留量分别为0.02和0.01 mg/kg等。
目前,检测拟除虫菊酯及其代谢物的方法有很多。传统检测方法有气相色谱法[9]、高效液相色谱法[10],色谱和质谱联用技术[11]等,但是这些仪器分析方法所需要的仪器昂贵,样品前处理复杂,且检测时间长,不能满足现场检测的要求。应用免疫学检测技术来进行农残检测可以弥补传统分析方法的不足,实现低成本、高通量的现场快速检测。因此,近些年来免疫学分析方法迅猛发展,为拟除虫菊酯及其代谢物的检测带来了福音。本文将在解析当前拟除虫菊酯类农药半抗原和抗体制备方法的基础上,就免疫检测新方法在拟除虫菊酯检测中的应用现状进行综述,并简要介绍该方法在食品安全快速检测中的应用。
1 半抗原的设计合成
1.1 常规设计思路
拟除虫菊酯类农药相对分子质量小于1 000,单独存在时不具有免疫原性,需要与载体蛋白结合后才可以作为免疫原。由于大部分拟除虫菊酯类农药没有能与蛋白质结合的活性基团,需要对其结构进行改造或合成其结构类似物,再与蛋白质偶联形成人工抗原。从结构上看拟除虫菊酯类农药分子有3个连接载体蛋白的结合位点,分别为环丙烷基衍生物结合位点,—H(Ⅰ型)或—CN(Ⅱ型)和3-苯氧苯基衍生物结合位点。按照结合位点设计合成半抗原有以下4种途径[12],如图1-A所示。(1)在菊酯的环丙烷部位接上连接臂:其中采用氧化拟除虫菊酯环丙烷部位的烯基团为羧酸的方法是制备半抗原较常用的方法。HUA等[13]用高锰酸钾将联苯菊酯分子中环丙烷上的双键氧化为羧基;(2)将菊酯的R2位点上的氰基水解为羧酸作为连接位点,再连接含有—NH2的多碳化合物或氨基酸。张献忠[14]合成溴氰菊酯并将R2位点上的氰基转化为羧基合成了半抗原;(3)将连接臂设计在苯醚基末端,有3种方式:一是直接在苯氧苯基对位上衍生出3碳的羧酸;二是直接在苯氧苯基对位上衍生出一个—NH2;三是将苯氧基由某种羧酸取代,形成末端如苯氧乙酸的结构;(4)将菊酯分解成菊酸或苯氧苯甲酸,将其作为半抗原。SONG等[15]将氰戊菊酯分解成2-(4-氯苯)-3-甲基丁酸,再和氨基己酸甲酯酸化合成半抗原;LU等[16]利用拟除虫菊酯代谢物苯氧苯甲酸合成半抗原3-(3-苯氧基-过氧化苯甲酰胺)-丙酸。关于拟除虫菊酯半抗原设计合成的报道如表2所示。
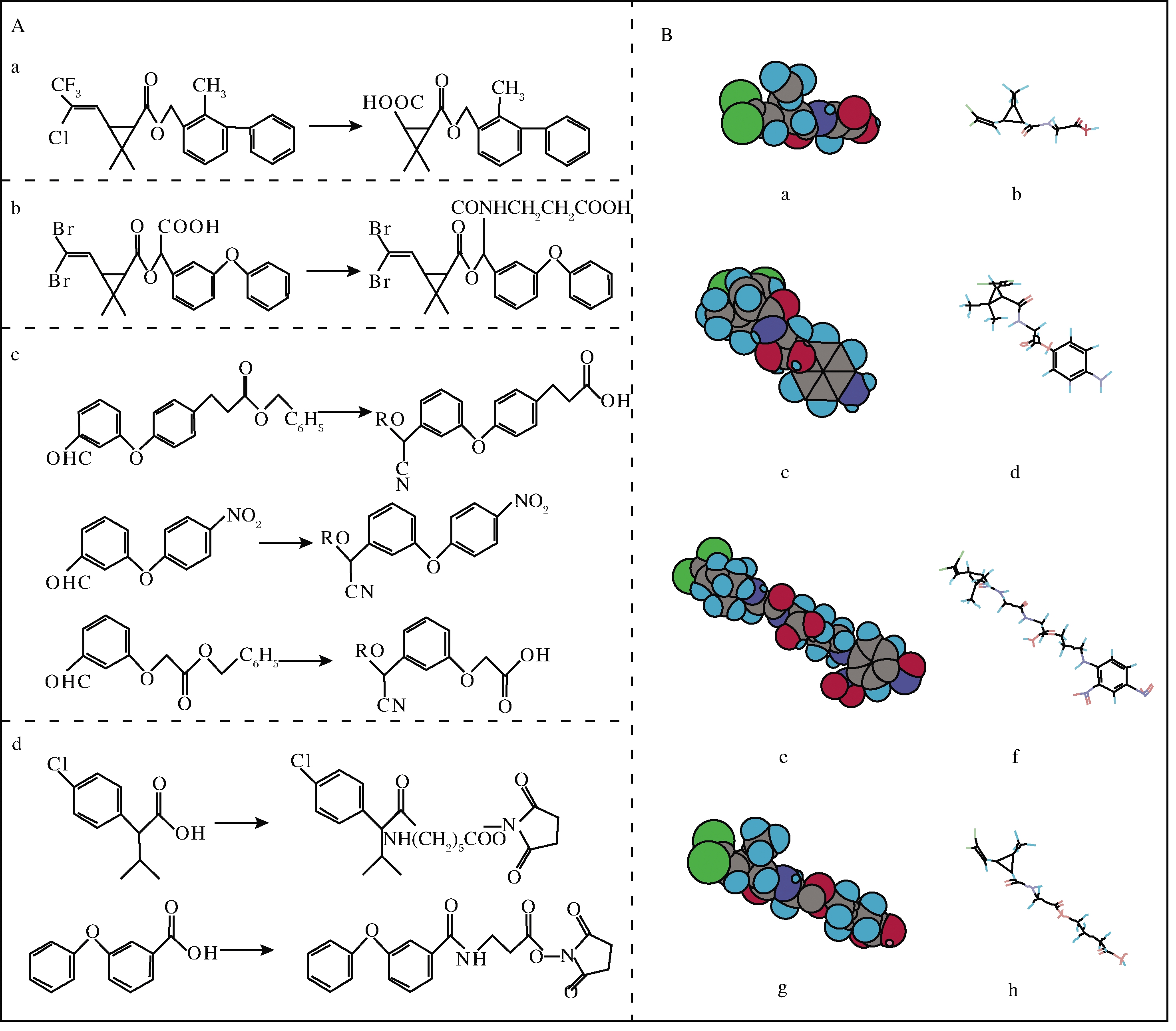
A-拟除虫菊酯合成半抗原四种常规途径;B-氯菊酯代谢物半抗原分子建模
图1 拟除虫菊酯半抗原的设计合成
Fig.1 The design and synthesis of pyrethroid haptens
表2 拟除虫菊酯半抗原的设计合成
Table 2 Design and synthesis of pyrethroid haptens
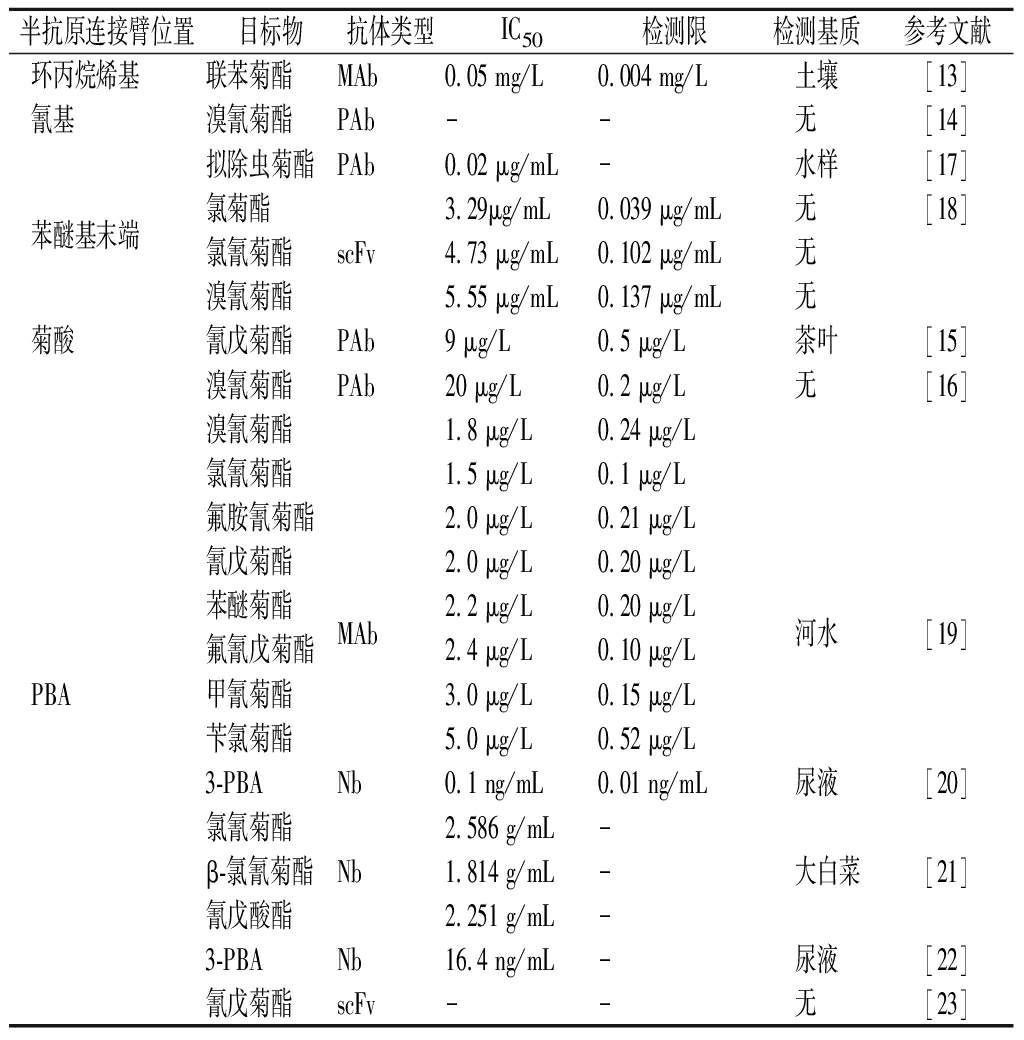
半抗原连接臂位置目标物抗体类型IC50检测限检测基质参考文献环丙烷烯基联苯菊酯MAb0.05 mg/L0.004 mg/L土壤[13]氰基溴氰菊酯PAb--无 [14]拟除虫菊酯PAb0.02 μg/mL-水样[17]苯醚基末端氯菊酯3.29μg/mL0.039 μg/mL无 [18]氯氰菊酯scFv4.73 μg/mL0.102 μg/mL无 溴氰菊酯5.55 μg/mL0.137 μg/mL无 菊酸氰戊菊酯PAb9 μg/L0.5 μg/L茶叶[15]溴氰菊酯PAb20 μg/L0.2 μg/L无 [16]溴氰菊酯1.8 μg/L0.24 μg/L氯氰菊酯1.5 μg/L0.1 μg/L氟胺氰菊酯2.0 μg/L0.21 μg/L氰戊菊酯2.0 μg/L0.20 μg/L苯醚菊酯MAb2.2 μg/L0.20 μg/L河水[19]氟氰戊菊酯2.4 μg/L0.10 μg/LPBA甲氰菊酯3.0 μg/L0.15 μg/L苄氯菊酯5.0 μg/L0.52 μg/L3-PBANb0.1 ng/mL0.01 ng/mL尿液[20]氯氰菊酯2.586 g/mL-β-氯氰菊酯Nb1.814 g/mL- 大白菜[21]氰戊酸酯2.251 g/mL-3-PBANb16.4 ng/mL-尿液[22]氰戊菊酯scFv--无 [23]
注:-表示没有数据(下同);MAb代表单克隆抗体;PAb代表多克隆抗体;scFv代表单链抗体;Nb代表纳米抗体;IC50半数抑制浓度( median inhibition concentration);无表示只做标准品,没有做样品。
1.2 计算机模拟辅助设计策略
上述半抗原设计方法是基于对抗体结合位点和抗原表位的分子结构以及发挥作用的分子间结合力的理解而预测的,设计的结果需通过动物实验进行测试,其方法具有不确定性且耗时较长。近年来,为了以更快速和更经济的方式获得亲和力和特异性高的抗体,也有研究者利用计算机辅助分子建模(computer aided molecular modeling, CAMM)预测半抗原的结构,利用CAMM可以得到分子结构和生物活性等信息,而这些分子结构和生物活性是很难或不可能获得的。在大多数研究中,通过设计了几个候选半抗原,再利用CAMM对其进行优化,并计算价态和电荷。优化后选择结构和电荷与目标分析物最接近的半抗原作为免疫半抗原。一般情况下,通过此方法获得的抗体对目标分析物具有较高的敏感性和特异性,与其他类似物的交叉反应性较低[24]。AHN等[25]设计合成了氯菊酯代谢物的4种不同类型的免疫半抗原,并借助化学办公软件研究合成半抗原的几何结构,选择几何形状与分析物相匹配的半抗原进行免疫。实验证明,将与目标分析物的几何结构相似的半抗原进行偶联,免疫产生的抗体特异性更高,如图1-B所示。HUANG等[26]通过计算机模拟10种拟除虫菊酯的3D模型,发现特定三维构象对分子印迹聚合物的识别能力有重要影响。因此,使用分子建模技术可以辅助半抗原设计,以开发灵敏的免疫分析方法。
2 抗体制备与鉴定
拟除虫菊酯类农药抗体的制备途径主要有:应用合成的人工抗原免疫大白兔产生多克隆抗体;利用人工抗原免疫小鼠,提取出其脾细胞与骨髓瘤细胞融合,筛选出高特异性的单克隆抗体;结合噬菌体展示技术获得的重组抗体;通过分子印迹技术获得的仿生抗体。
2.1 传统多/单克隆抗体
多克隆抗体制备简单、研制成本低,但由于免疫动物的个体差异而特异性、亲合性不稳定,容易产生批间差异。张献忠[14]合成了溴氰菊酯的4种人工抗原,免疫动物获得多克隆抗体,并建立了溴氰菊酯免疫亲和色谱-高效液相色谱检测方法。ZHANG等[17]制备了拟除虫菊酯杀虫剂的4种多克隆抗体,并获得了对Ⅰ和Ⅱ拟除虫菊酯杀虫剂均有同等高敏感性的最佳抗体包被组合,IC50为0.02 μg/mL,并用于水样中拟除虫菊酯杀虫剂的检测。单克隆抗体具有特异性强、性质均一等优点,易于大量生产。与多克隆抗体相比,单克隆抗体具有更强的识别特异性, 且这种特异性可人为筛选。HUA等[13]建立了一种灵敏的单克隆抗体酶联免疫吸附法,用于检测土壤化学屏障中的联苯菊酯。其检出限和IC50分别为0.004 mg/L和0.05 mg/L,与基于多克隆抗体的ELISA相比,敏感性提高了40倍。WANG等[19]利用单克隆抗体建立了一种灵敏、广泛的选择性直接竞争酶联免疫吸附法,用于拟除虫菊酯的检测,通过对添加拟除虫菊酯的河流水样进行分析,回收率为74%~108%。
2.2 重组抗体
重组抗体是继多克隆抗体和单克隆抗体之后的第3代抗体,小分子重组抗体一般包括Fab、Fv和scFv等,如图2-A所示。与传统抗体相比,重组抗体更稳定、亲和力更高,抗体制备周期短适合大规模生产,可实现分子水平的定向改造。吴元元等[18]利用基因工程技术制备了拟除虫菊酯类农药可溶性单链可变区抗体,并通过实验证明,scFv抗体对氯菊酯、氯氰菊酯、溴氰菊酯均有较高特异性,IC50分别为3.29、4.72、5.55 μg/mL。常继辰[23]利用噬菌体抗体库技术和基因工程技术,制备了拟除虫菊酯单链抗体,结果表明所得单链抗体对氰戊菊酯具有一定的结合活性。
2.3 纳米抗体
纳米抗体是由骆驼科动物缺失轻链的天然重链抗体的可变区(variable domain of heavy chain of heavy chain antibody,VHH)组成的单域抗体,其可变区的相对分子质量约为15 kDa,如图2-B所示。与传统抗体相比,纳米抗体具有相对分子质量小、亲和力高、稳定性高、溶解性好、免疫原低、穿透力强、人源化简单等优势[27-28]。KIM等[20]以拟除虫菊酯杀虫剂的主要代谢物3-PBA为目标建立了基于VHHs的免疫分析。其构建了噬菌体VHH文库,通过与3-PBA竞争性结合筛选出7个VHH克隆。实验结果显示其IC50为1.4 ng/mL,检测限为0.1 ng/mL,这表明利用免疫羊驼的序列和噬菌体展示技术进行抗体选择特异性和敏感性高。ZHAO等[21]利用噬菌体文库分离出一种广谱特异性纳米抗体用于检测拟除虫菊酯,结果表明,氯氰菊酯、β-氯氰菊酯和氰戊酸酯的IC50分别为2.586、1.814、2.251 g/mL,该方法克服了用人工抗原免疫动物制备抗体的局限性。WANG等[22]利用基因重组技术获得纳米抗体,基于此将其应用于荧光偏振免疫分析技术,对拟除虫菊酯的代谢物3-PBA进行了检测。

A-传统抗体、重组抗体和纳米抗体结构图;B-VH与VHH序列比较图
图2 纳米抗体结构图
Fig.2 Structure of nanoantibody
2.4 仿生抗体
分子印迹技术是指合成的聚合物与目标分子通过共价、非共价或半共价相互作用特异性结合的技术[29],通过分子印迹技术得到的仿生抗体稳定性好、特异性高。季芯羽等[30]制备了一种分子印迹荧光传感器用于菊酯类农药代谢物间苯氧基苯甲醛的选择性测定,其检出限为0.267 μmol/L。HUANG等[19]合成了一种能识别10种拟除虫菊酯的双假模板分子印迹聚合物,用于检测鸡肉样品中的拟除虫菊酯,检测限为0.3~6.0 pg/mL。CAI等[31]合成了拟除虫菊酯的分子印迹微球和荧光示踪剂,用于测定羊肉和牛肉样品中10种拟除虫菊酯,检出限为6.4~17 ng/mL。
3 新型免疫学检测方法
鉴于免疫学分析方法可以弥补传统分析方法的不足,因此许多拟除虫菊酯已经建立了新型免疫学检测方法,关于拟除虫菊酯及其代谢物的新型免疫检测方法研究概况见表3。
表3 拟除虫菊酯及其代谢物的新型免疫学检测方法
Table 3 Novel immunological assays for pyrethroids and their metabolites

检测方法检测基质目标物检测限回收率/%参考文献侧流免疫层析技术无a氯菊酯1 ng/mL -[32]荧光免疫法河水高氰戊菊酯0.1 nmol/L -[33]蔬菜氰戊菊酯 -72.5%~112.7%[34]溴氰菊酯 -53.75%~122.83%鱼氯氰菊酯1.2 μg/kg82.7%~92.4%[35]水样三氟氯氰菊酯9.17 nmol/L -[36]高效氟氯氰菊酯10.11 nmol/L -氟胺氰菊酯12.145 nmol/L -免疫传感器法海水溴氰菊酯4.7 μg/ L -[37]茶叶氰戊酸酯0.80 μg/L103%[38]尿3-PBA0.64 pg/mL94.8%~102%[39]水果、蔬菜、茶叶甲氰菊酯1.47 μg/L82.1%~120.8%[40]水果、蔬菜、谷物甲氰菊酯0.13 ng/mL70.1%~119.1%[41]
注:无a表示没做样品,只做标准品
3.1 侧流免疫层析技术
免疫层析技术的原理是以条状纤维膜为固相,通过吸水垫的毛细管虹吸效应,使样品中待测抗原或抗体与层析膜上对应的受体(抗体或抗原)发生高特异、高亲和性的免疫反应,形成的免疫复合物被截留在检测带,通过酶促反应显色或着色标记物显色,快速得到可视化结果。随着研究的深入,除了常见的胶体金之外,研究者也开发出新的灵敏度更高的标记物。COSTA等[32]制备了一种抗体门控指标释放材料,将其固定在试纸条上,与智能手机读数相结合,用于检测拟除虫菊酯。所用的传感材料结构及其工作原理和试纸条的结构(图3)。这种传感材料有许多优势,例如孔径大小更适应抗体,局部半抗原连接和聚乙二醇功能化,有助于微米大小的支架颗粒可以在不影响动力学或空白释放的情况下使用。此外,使用聚乙二醇玻璃纤维膜、3D打印支架和智能手机,可以在2 min内检测到分析物,检测限降低到1 ng/mL,此方法适合于其他的分析物和各种现场分析。

A-传感材料结构;B-试纸条组成结构及检测原理;C-侧流免疫检测结合手机读数
图3 检测拟除虫菊酯的侧流免疫层析技术原理图
Fig.3 The schematic diagram of side-flow immunochromatography for the detection of pyrethroids
3.2 荧光免疫法
随着世界各国对拟除虫菊酯残留限量标准越来越严格,迫切需要提高免疫学检测技术的灵敏度,因此科研工作者开发出了更加灵敏的荧光免疫分析法。荧光免疫分析法在高特异性免疫学反应的基础上,结合了荧光技术的灵敏性,具有灵敏度高、准确性好,易实现高通量、自动化检测等优势。其原理是当制备好的荧光探针在发生特异性的免疫反应后,其荧光强度或与待测物质的量相关,或因大小、距离的变化而发生改变[42](图4)。目前在拟除虫菊酯及其代谢物的检测中常用的荧光标记物有荧光素、量子点、荧光纳米颗粒等。
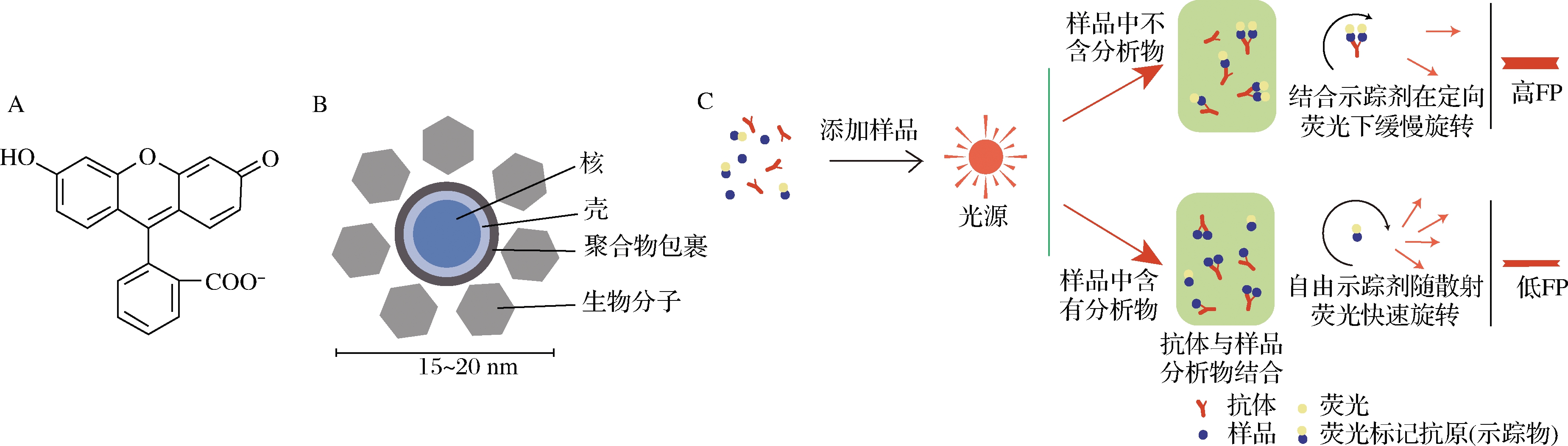
A-荧光素结构式;B-量子点结构;C-荧光免疫法原理
图4 荧光免疫法
Fig.4 Fluorescence immunoassay
荧光素[43]是常见的有机染料小分子,具有水溶性好、量子产率高、摩尔吸光系数高、无毒和成本低等优点。FENG等[33]以罗丹明染料的激光诱导荧光作为标记,采用微滴荧光猝灭竞争性免疫分析法对河水中的高氰戊菊酯进行检测。研究表明,高氰戊菊酯与罗丹明的结合物显示出与纯罗丹明类似的荧光,加入高氰戊菊酯抗体后,荧光减弱。再将含有高氰戊菊酯的样品加入到微滴中时,会使荧光信号恢复,检测下限为0.1 nmol/L。
量子点是1~10 nm的半导体晶体,通常由硅、硒化镉、砷化铟或硫化镉等材料组成,被光源照射后会产生特定的颜色[44]。刘景坤[34]制备出碲化镉量子点,建立新型荧光标记免疫检测技术对蔬菜中的氰戊菊酯进行检测,线性范围为0.06~3.83 μg/mL。XIAO等[35]制备了具有自定义选择性人工识别位点量子点的分子印迹二氧化硅层,建立了基于量子点的酶联免疫吸附方法对鱼中的氯氰菊酯进行检测。实验结果表明其检测下限为1.2 μg/kg。
为了提高拟除虫菊酯及其代谢物的检测灵敏度,近年来也有研究通过采用新型材料如荧光纳米颗粒分离和标记抗体。纳米材料的尺寸极小,其具有许多优良的生物学和理化特性,如良好的生物相容性、表面效应、量子尺寸效应等,因此在生物领域内被广泛使用[45]。邱浩[36]将窄发射谱和高荧光量子产率的有机染料作为荧光团,以纳米SiO2颗粒为载体,在表面包覆印迹层,制备了一种荧光印迹复合材料用于检测环境中的三氟氯氰菊酯、高效氟氯氰菊酯和氟胺氰菊酯。
3.3 免疫传感器法
免疫传感器技术是将免疫检测技术和传感技术相结合的一种新型生物传感器技术,分为非标记性免疫传感器和标记性免疫传感器(图5)。非标记性免疫传感器是利用待测的抗原或抗体能够与固定在传感器表面的识别元件发生特异性结合并形成稳定的复合物,再通过换能器将免疫反应的变化转化为光电信号,光电信号经过记录和处理后可实现对待测物的定量检测。标记性免疫传感器则是采用酶、荧光试剂、同位素、金属标记物等本身可使免疫反应产生信号的标记物来实现定量检测待测物[46]。FRUHMANN等[37]开发了安培免疫传感器在海水不进行任何预处理的情况下检测溴氰菊酯,检测下限为4.7 μg/L。WANG等[38]开发了非标签阻抗法免疫传感器对茶叶中氰戊酸酯进行检测,通过壳聚糖与玻碳电极上改性的戊二醛交联,将氰戊菊酯抗体固定在电极上,用电子转移电阻的增大来测定氰戊酸酯的含量, 检出限为0.80 μg/L。

A-免疫传感器工作原理;B-标记型免疫传感器检测原理示意图;C-非标记型免疫传感器;D-用于检测3-PBA的纳米电化学免疫传感器的 制备工艺及传感机理
图5 免疫传感器原理图
Fig.5 The schematic diagram of immunosensor
将传感器与纳米材料联合可以显著提高检测的灵敏度和特异性。EL-MOGHAZY等[39]制备了一种新型的超灵敏纳米体电化学免疫分析法,用于检测尿液中拟除虫菊酯代谢物3-PBA。通过采用丝网印刷电极将游离的3-PBA与3-PBA-BSA偶联物共价固定在柠檬酸修饰的尼龙纳米纤维上,通过直接竞争与碱性磷酸酶包埋的纳米体结合,实现了对人尿中3-PBA的检测,检出限为0.64 pg/mL。
近年来,在免疫传感技术中,免疫芯片发展迅速。免疫芯片是将高特异性的免疫反应与电子芯片技术相结合的一种高通量、高特异性的新型生物检测技术[47]。免疫芯片技术主要采用微阵列点样法将抗原抗体固定于玻片、硅胶板或多孔板上,使其高度集成,然后进行免疫反应[48]。赵颖等[40]以载玻片为固相载体,将包被抗原共价结合固定在载体上,以胶体金为标记材料,单克隆抗体为识别元件,用银增强试剂放大信号,建立了甲氰菊酯等10种常见农药多残留的免疫芯片检测方法。兰美静[41]以硝酸纤维素膜为载体,抗原为捕获探针,胶体金为标记材料,制备了可同时检测甲氰菊酯等9种常见农药的可视化免疫芯片。
4 应用现状及展望
在拟除虫菊酯类农药及其代谢物半抗原设计上,由于拟除虫菊酯农药大多有手性碳原子和多种光学异构体,抗原决定簇较多,这对拟除虫菊酯单抗的制备造成了一定的困难。因此在设计拟除虫菊酯半抗原结构时,可结合计算机辅助分子建模预测半抗原的结构,设计出具有光活性的半抗原。其次,拟除虫菊酯结构相似性高,且部分拟除虫菊酯类农药具有多种光学异构体,因此存在抗体间交叉率较高的问题,为了提高抗体的特异性,在设计半抗原时应突出其与其他拟除虫菊酯不同的结构,解决交叉反应的问题。
抗体制备及筛选是免疫学检测技术的核心,通过传统方法免疫动物获得的单/多克隆抗体生产周期长,筛选出的抗体适应性较差,并不能适用于所有的免疫检测技术。相对与传统抗体,基因工程抗体制备周期短,操作简化,可以实现分子水平定向改造和抗体的多功能化;而仿生抗体重点解决了特异性和稳定性问题,在前处理应用方面有应用前景,是未来抗体制备的发展方向。因此可使用基因工程抗体、仿生抗体等代替传统抗体用于食品中的拟除虫菊酯类农药及其代谢物的检测。
免疫学检测技术具有快速、敏感性和特异性强等特点,在农药残留方面的检测得到了广泛的应用。随着拟除虫菊酯类农药越来越多地被应用到农业和家庭杀虫,应用免疫学方法对其进行定性和半定量检测,从而实现对拟除虫菊酯的控制和评估显得尤为重要。进一步提高检测的灵敏度是利用免疫技术检测拟除虫菊酯类农药及其代谢物的未来发展趋势。随着生物技术和纳米材料的发展,可应用新型的标记材料如脂质[49]、铁氧化壳硅核磁性纳米复合材料[50]等,实现对拟除虫菊酯及其代谢物进行高通量检测,也可结合多种标记材料制成新型多功能材料来标记目标分子,以提高其检测灵敏度。随着免疫学技术发展不断深入和完善,免疫学技术将在拟除虫菊酯类农药及其代谢物的快速检测方面得到更加广泛的应用,为人类的公共卫生、营养健康与疾病预防作出更大的贡献。
[1] CHRUSTEK A, ![]() I, DZIEMBOWSKA I, et al.Current research on the safety of pyrethroids used as insecticides[J].Medicina, 2018, 54(4):61.
I, DZIEMBOWSKA I, et al.Current research on the safety of pyrethroids used as insecticides[J].Medicina, 2018, 54(4):61.
[2] COSTA L G.The neurotoxicity of organochlorine and pyrethroid pesticides[J].Handbook of Clinical Neurology, 2015, 131:135-148.
[3] SODERLUND D M, CLARK J M, SHEETS L P, et al.Mechanisms of pyrethroid neurotoxicity:Implications for cumulative risk assessment[J].Toxicology, 2002, 171(1):3-59.
[4] RAY D E, FRY J R.A reassessment of the neurotoxicity of pyrethroid insecticides[J].Pharmacology & Therapeutics, 2006, 111(1):174-193.
[5] KIM H J, AHN K C, MA S J, et al.Development of sensitive immunoassays for the detection of the glucuronide conjugate of 3-phenoxybenzyl alcohol, a putative human urinary biomarker for pyrethroid exposure[J].Journal of Agricultural and Food Chemistry, 2007, 55(10):3 750-3 757.
[6] 唐宇梅, 曾运婷.拟除虫菊酯:毒性和健康风险[J].中国科技信息, 2019(S1):111-112.
TANG Y M, ZENG Y T.Toxicity and health risks of pyrethroids[J].Science and Technology Information, 2019(S1):111-112.
[7] 刘凤海, 荣胜忠, 牛莹莹, 等.拟除虫菊酯类农药残留检测的研究进展[J].环境与健康杂志, 2018, 35(8):741-744.
LIU F H, RONG S Z, NIU Y Y, et al. Determination of synthetic pyrethriods pesticide residue: A review of recent studies[J]. Journal of Environment and Health, 2018, 35(8):741-744.
[8] 邓维琴, 刘书亮, 姚开.微生物降解3-苯氧基苯甲酸的研究进展[J].微生物学报, 2015, 55(9):1 081-1 088.
DENG W Q, LIU S L, YAO K. Microbial degradation of 3-phenoxybenzoic acid-A review[J]. Acta Microbiologica Sinica, 2015, 55(9):1 081-1 088.
[9] 杜付然. 气相色谱法测定地表水中拟除虫菊酯类农药残留[J].化学分析计量, 2020, 29(1):71-74.
DU F R.Determination of pyrethroid pesticide residues in surface water by gas chromatography[J].Chemical Analysis and Meterage, 2020, 29(1):71-74.
[10] 于玲, 董丽丽.分散固相萃取-超声辅助分散液液微萃取/高效液相色谱法测定土壤中溴氰菊酯残留[J].分析科学学报, 2016, 32(2):218-222.
YU L, DONG L L.Determination of deltamethrin residues in soil by dispersive solid phase extraction and ultrasound-assisted dispersive liquid-liquid microextraction coupled with high performance liquid chromatography[J].Chinese Journal of Analytical Science, 2016, 32(2):218-222.
[11] MOLONEY M, TUCK S, RAMKUMAR A, et al.Determination of pyrethrin and pyrethroid residues in animal fat using liquid chromatography coupled to tandem mass spectrometry[J].Journal of Chromatography B, 2018,1 077-1 078:60-70.
[12] 唐建设, 张敏, 陆贻通.拟除虫菊酯类农药免疫分析人工抗原研究进展[J].科技通报, 2007,23(6):835-841.
TANG J S, ZHANG M, LU Y T. The progress of synthesis methods of pyrethroids immunogene[J]. Bulletin of Science and Technology, 2007, 23(6):835-841.
[13] HUA X D, LIU X F, YIN W, et al.A sensitive monoclonal antibody-based enzyme-linked immunosorbent assay for the detection of bifenthrin in a chemical soil barrier[J].Science of The Total Environment, 2015,502:246-251.
[14] 张献忠. 溴氰菊酯农药残留免疫检测技术研究[D].北京:中国农业科学院, 2008.
ZHANG X Z.Research on the immunoassay technology for the deltamethrin residue[D].Beijing:Chinese Academy of Agricultural Sciences, 2008.
[15] SONG Y, LU Y, LIU B, et al.A sensitivity-improved enzyme-linked immunosorbent assay for fenvalerate:A new approach for hapten synthesis and application to tea samples[J].Journal of the Science of Food and Agriculture,2011, 91(12):2 210-2 216.
[16] LU Y, XU N, ZHANG Y, et al.Development of general immunoassays for pyrethroids:A new approach for hapten synthesis using pyrethroid metabolite analogue and application to food samples[J].Food and Agricultural, 2010, 21(1):27-45.
[17] ZHANG Q, ZHANG W, WANG X P, et al.Immunoassay development for the class-specific assay for types I and Ⅱ pyrethroid insecticides in water samples[J].Molecules, 2010,15(1):164-177.
[18] 吴元元, 金朵, 付骋宇, 等.拟除虫菊酯类农药单链可变区抗体的制备、鉴定及其特异性分析[J].食品安全质量检测学报, 2017, 8(2):386-393.
WU Y Y, JIN D, FU C Y, et al. Preparation, characterization and specificity analysis of single-chain fragment variable antibody against pyrethroid pesticides[J]. Journal of Food Safety & Quality, 2017, 8(2):386-393.
[19] WANG J P, YU G C, SHENG W, et al.Development of an enzyme-linked immunosorbent assay based a monoclonal antibody for the detection of pyrethroids with phenoxybenzene multiresidue in river water[J].Journal of Agricultural & Food Chemistry, 2011, 59(7):2 997-3 003.
[20] KIM H J, MCCOY M R, MAJKOVA Z, et al.Isolation of alpaca anti-hapten heavy chain single domain antibodies for development of sensitive immunoassay[J].Analytical Chemistry, 2012, 84(2):1 165-1 171.
[21] ZHAO Y Y, LIANG Y, LIU Y, et al.Isolation of broad-specificity domain antibody from phage library for development of pyrethroid immunoassay[J].Analytical Biochemistry, 2016, 502:1-7.
[22] WANG Y L, LI Z F, BARNYCH B, et al. Investigation of the small size of nanobodies for a sensitive fluorescence polarization immunoassay for small molecules: 3-phenoxybenzoic acid, an exposure biomarker of pyrethroid insecticides as a model[J]. Journal of Agricultural and Food Chemistry, 2019, 67(41):11 536-11 541.
[23] 常继辰. 拟除虫菊酯噬菌体抗体库构建及基因工程抗体制备[D].天津:天津科技大学, 2014.
CHANG J C.Construction of phage antibody library specific for pyrethroids and preparation of genetically engineered antibody[D].Tianjin:Tianjin University of Science and Technology, 2014.
[24] XU Z L, SHEN Y D, BEIER R C, et al.Application of computer-assisted molecular modeling for immunoassay of low molecular weight food contaminants:A review[J].Analytica Chimica Acta, 2009, 647(2):125-136.
[25] AHN K C, WATANABE T, GEE S J, et al.Hapten and antibody production for a sensitive immunoassay determining a human urinary metabolite of the pyrethroid insecticide permethrin[J].Journal of Agricultural & Food Chemistry, 2004, 52(15):4 583-4 594.
[26] HUANG J J, LIU J, LIU J X, et al.A microtitre chemiluminescence sensor for detection of pyrethroids based on dual-dummy-template molecularly imprinted polymer and computational simulation[J].Luminescence, 2020, 35(1):120-128.
[27] 王兰东, 冯东晓, 张淑敏.纳米抗体研究进展[J].生物技术通讯, 2016, 27(3):453-458.
WANG L D, FENG D X, ZHANG S M. Research progress of nanobody[J]. Letters in Biotechnology, 2016, 27(3):453-458.
[28] 刘静, 胡耀中, 黄鹤.纳米抗体用于肿瘤诊断与治疗的研究进展[J].化学工业与工程, 2013, 30(4):29-35;54.
LIU J, HU Y Z, HUANG H. Research progress of nanobodies in diagnosis and therapy of tumor[J]. Chemical Industry and Engineering, 2013, 30(4):29-35; 54.
[29] ERTÜRK G, MATTIASSON B.Molecular imprinting techniques used for the preparation of biosensors[J].Sensors, 2017, 17(2):288.
[30] 季芯羽, 叶泰, 袁敏, 等. 菊酯类农药代谢物分子印迹荧光传感器的制备及应用[J]. 分析测试学报, 2019, 38(12):1 487-1 492.
JI X Y, YE T, YUAN M, et al. Preparation and application of a molecularly imprinted fluorescence sensor for pyrethroid pesticide metabolite[J]. Journal of Instrumental Analysis, 2019, 38(12):1 487-1 492.
[31] CAI Y, HE X, CUI P L, et al.Molecularly imprinted microspheres based multiplexed fluorescence method for simultaneous detection of benzimidazoles and pyrethroids in meat samples[J].Food Chemistry, 2020, 319:126539.
[32] COSTA E, CLIMENT E, AST S, et al.Development of a lateral flow test for rapid pyrethroid detection using antibody-gated indicator-releasing hybrid materials[J].The Analyst, 2020, 145(10):3 490-3 494.
[33] FENG J, SHAN G M, HAMMOCK B D, et al.Fluorescence quenching competitive immunoassay in micro droplets[J].Biosensors and Bioelectronics, 2003, 18(8):1 055-1 063.
[34] 刘景坤. 农产品中氰戊菊酯农药残留免疫检测技术研究[D].北京:中国农业科学院, 2012.
LIU J K.Immunoassay research for fenvalerate residue in agro-product[D].Beijing:Chinese Academy of Agricultural Sciences, 2012.
[35] XIAO T T, SHI X Z, JIAO H F, et al.Selective and sensitive determination of cypermethrin in fish via enzyme-linked immunosorbent assay-like method based on molecularly imprinted artificial antibody-quantum dot optosensing materials[J].Biosensors and Bioelectronics, 2016,75:34-40.
[36] 邱浩. 硅基荧光表面印迹复合材料的制备及其靶向检测环境中拟除虫菊酯的研究[D]. 镇江: 江苏大学, 2017.
QIU H. Preparation of the silicon-based fluorescent surface imprinted composite materials and research on target detection of pyrethroids in the environment[D]. Zhenjiang: Jiangsu University, 2017.
[37] FRUHMANN P, SANCHIS A, MAYERHUBER L, et al.Immunoassay and amperometric biosensor approaches for the detection of deltamethrin in seawater[J].Analytical & Bioanalytical Chemistry, 2018, 410(23):5 923-5 930.
[38] WANG M R, KANG H M, XU D, et al.Label-free impedimetric immunosensor for sensitive detection of fenvalerate in tea[J].Food Chemistry, 2013, 141(1):84-90.
[39] EL-MOGHAZY A Y, HUO J Q, AMALY N, et al.An innovative nanobody-based electrochemical immunosensor using decorated nylon nanofibers for point-of-care monitoring of human exposure to pyrethroid insecticides[J].ACS Applied Materials & Interfaces, 2020, 12(5):6 159-6 168.
[40] 赵颖, 王双节, 柳颖, 等.毒死蜱等10种农药多残留快速检测芯片研究[J].分析化学, 2019, 47(11):1 759-1 767.
ZHAO Y, WANG S J, LIU Y, et al.Immunochip assay for multi-residue rapid detection of ten kinds of common pesticides[J].Chinese Journal of Analytical Chemistry, 2019, 47(11):1 759-1 767.
[41] 兰美静. 农药多残留免疫芯片-纳米金增敏型检测体系构建[D]. 杭州: 浙江大学, 2015.
LAN M J. Establishment of an immunochip for multi-pesticides determination based on colloidal gold enhancement[D]. Hangzhou: Zhejiang University, 2015.
[42] 左晓维, 雷琳, 刘河冰, 等.荧光免疫分析法检测食品中黄曲霉毒素的研究进展[J].食品与发酵工业, 2019,45(1):236-245.
ZUO X W, LEI L, LIU H B, et al. Research progress on detecting aflatoxins in foods using fluorescence immunoassay[J]. Food and Fermentation Industries, 2019, 45(1):236-245.
[43] ZHENG H, ZHAN X Q, BIAN Q N, et al.Advances in modifying fluorescein and rhodamine fluorophores as fluorescent chemosensors[J].Chemical Communications, 2013, 49(5):429-447.
[44] JAHANGIR M A, GILANI S J, MUHEEM A, et al.Quantum dots:Next generation of smart nano-systems[J].Pharmaceutical Nanotechnology, 2019, 7(3):234-245.
[45] 王馨, 胡文忠, 陈晨, 等.纳米材料在食源性致病菌检测中的应用[J].食品与发酵工业, 2016, 42(6):243-247.
WANG X, HU W Z, CHEN C, et al.Application of nanomaterials in detection of foodborne pathogenic bacteria[J].Food and Fermentation Industries, 2016, 42(6):243-247.
[46] 朱小钿, 张燕, 彭宏威, 等.免疫传感器在食品安全检测中的应用[J].食品安全质量检测学报, 2019, 10(3):626-632.
ZHU X T, ZHANG Y, PENG H W, et al.Application of immunosensors in food safety detection[J].Journal of Food Safety and Quality, 2019, 10(3):626-632.
[47] 曲信芹, 凌红丽, 蒋贻海, 等.免疫芯片技术在兽药残留检测中的应用[J].中国动物检疫, 2015, 32 (10):21-24.
QU X Q, LING H L, JIANG Y H, et al. Application of immunochips in veterinary drug residue detection[J]. China Animal Health Inspection, 2015, 32(10):21-24.
[48] 张煜超, 王芳芳, 李周敏, 等.小分子药物人工抗原的合成与鉴定研究进展[J].药物分析杂志, 2014, 34(6):947-951.
ZHANG Y C, WANG F F, LI Z M, et al. Research progress of artificial antigen synthesis and identification for micromolecule drug[J]. Chinese Journal of Pharmaceutical Analysis, 2014, 34(6):947-951.
[49] SHRIVER-LAKE L C, GOLDMAN E R, DEAN S N, et al.Lipid-tagged single domain antibodies for improved enzyme-linked immunosorbent assays[J].Journal of Immunological Methods, 2020, 481-482:112790.
[50] NISTLER A, NIESSNER R, SEIDEL M.Magnetic nanocomposites:Versatile tool for the combination of immunomagnetic separation with flow-based chemiluminescence immunochip for rapid biosensing of Staphylococcal enterotoxin B in milk[J].Analytical and Bioanalytical Chemistry, 2019, 411(19):4 951-4 961.