人乳寡糖(human milk oligosaccharide, HMO)是在母乳中占比仅次于乳糖和脂类的固体物质,也是母乳区别于牛、羊奶的独特成分。临床和流行病学研究数据表明,喂养母乳可以预防感染、维持免疫稳态和培育健康的肠道微生物菌群[1]。最新报道指出这些作用可能使HMO在新型冠状病毒肺炎感染过程中作为受体诱饵、免疫调节剂、黏膜信号剂和益生元,对新型冠状病毒肺炎的治疗有积极效果[2]。其中,2′-岩藻糖基乳糖(2′-fucosyllactose, 2′-FL)是由乳糖和L-岩藻糖结合而成的三糖,是HMO中含量最多的组分[3]。大量研究证实2′-FL有助于提高婴幼儿免疫力、调节肠道菌群、促进大脑发育等作用[4-6],是新一代的母乳概念配方奶粉添加剂,有着巨大的市场潜力。2′-FL可通过化学和生物合成方法获得,其中生物合成方法更加绿色环保,反应副产物少,有利于规模化推广应用。
截止目前,2′-FL的生物合成分别由大肠杆菌[7-8]、酿酒酵母[9-10]、解脂耶氏酵母[11]、枯草芽胞杆菌[12]等底盘微生物实现。大肠杆菌作为基因工程操作成功率最高的模式生物,一直是研究的热点。它主要通过从头合成途径和补救合成途径生产GDP-L-岩藻糖,在外源α-1,2-岩藻糖基转移酶的作用下生成产物,如图1所示。然而由于从头合成途径较长,涉及基因较多,研究具有一定难度;而通过研究补救途径探索2′-FL合成的影响因素更为方便。该途径中岩藻糖到2′-FL的摩尔转化率是影响生产成本的关键因素,WAN等[13]通过敲除Escherichia coli BL21(DE3)菌株的多个基因(lacZ、fucI、fucK、araA、rhaA和wcaJ),阻止底物和关键中间体的降解和分流;将Fkp和FutC2通过短肽对(RIAD-RIDD)在体内形成自组装多酶复合物,过表达gsk和gmk从而平衡代谢过程中的辅因子以及氧化还原通量,最终在补料分批发酵64 h后胞外2′-FL累积量达到30.5 g/L,转化率为0.66 mol/mol岩藻糖。其次,提高底物摄入和产物由胞内运出的效率,也会对2′-FL的产量提升有促进作用,而促进物质转运的蛋白均为膜结合,在高拷贝数质粒上表达会对宿主造成细胞毒性。首尔大学的PARK等[14]通过对宿主本底的乳糖操纵子进行编辑,使得乳糖转运蛋白LacY可正常工作但不对宿主产生影响。最后,作为反应最终步骤的α-1,2-岩藻糖基转移酶的选择和可溶表达也是提高转化率的重要手段,为了提高α-1,2-岩藻糖基转移酶的可溶性表达,CHIN等[15]在从头合成途径中将FucT2蛋白的N端加上3个天冬氨酸,使得2′-FL产量提升到了6.4 g/L。尽管有研究表明可利用低温促进FucT2的可溶性表达,但菌体生长和产物合成水平也会降低[16]。融合标签的使用也提高了α-1,2-岩藻糖基转移酶的可溶性表达,例如three aspartate tag[15]和SUMO标签[11]的使用具有一定效果。
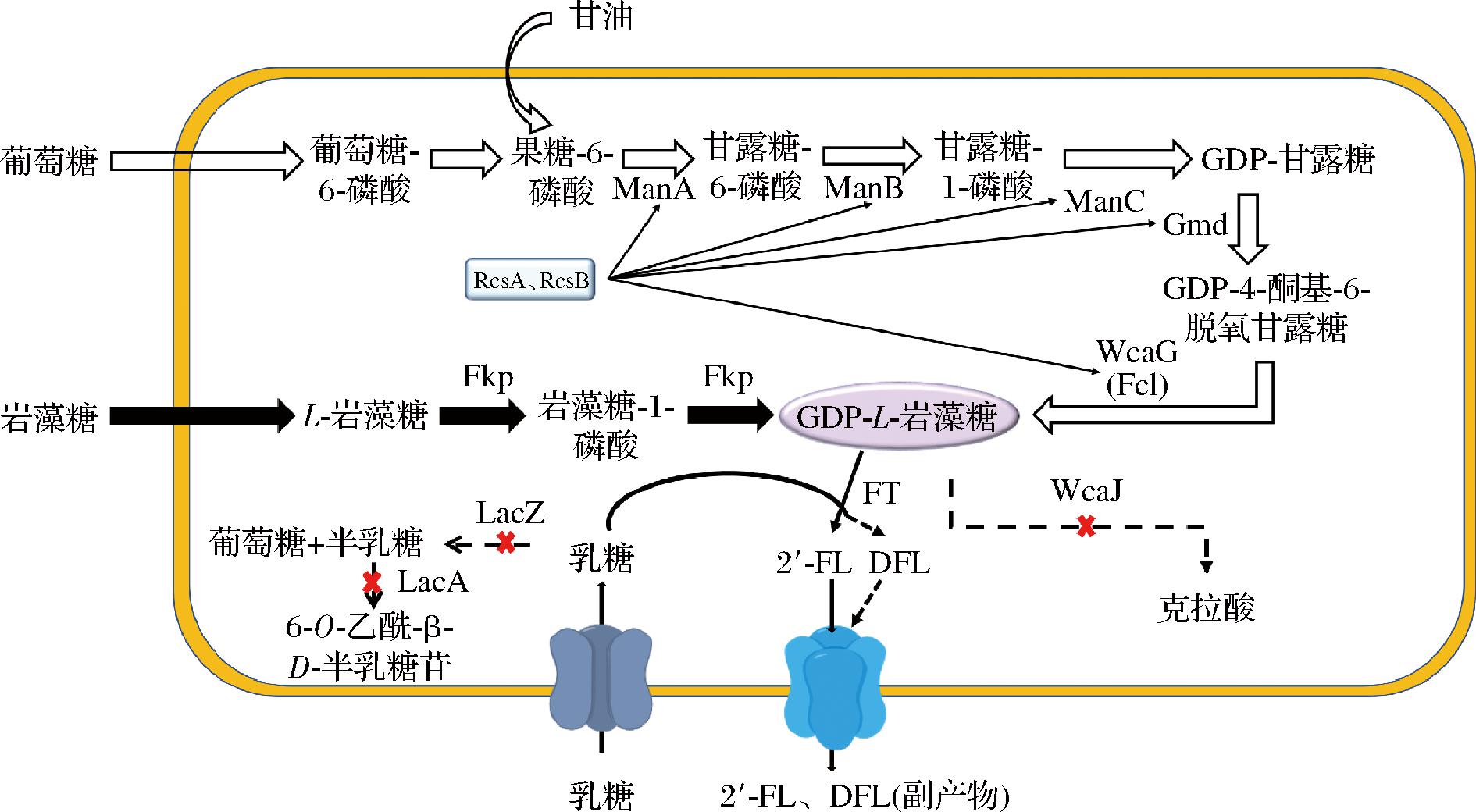
图1 重组大肠杆菌合成2′-FL的代谢途径
Fig.1 Metabolic pathway for 2′-FL synthesis in recombinant E.coli strains
注:白色箭头:从头合成途径;黑色箭头:补救途径;DFL:双岩藻糖基乳糖(difucosyllactose)
本研究以不同株系的大肠杆菌JM109(DE3)、BL21(DE3)、C41(DE3)作为底盘微生物,通过CRISPR-Cas9系统对它们进行基因编辑(敲除lacZ、wcaJ、lacA基因)使得底物和中间体不被分支途径消耗,利用质粒对Fkp酶和不同来源的α-1,2-岩藻糖基转移酶共表达从而搭建出补救途径。通过分析不同重组菌株发酵液中2′-FL的含量,并对底物和产物转运蛋白进行表达调控,最终通过发酵条件优化在摇瓶中进一步提高了2′-FL在胞外的累积,质量浓度达到2.67 g/L,2′-FL的摩尔转化率达到0.82 mol/mol岩藻糖,为2′-FL的生物合成研究提供了借鉴。
1 材料与方法
1.1 质粒与菌株
本实验所使用菌株和质粒见表1。
表1 质粒和菌株信息
Table 1 Plasmids and strains used in this study

质粒/菌株描述质粒pUC19For gene expression, AmpicilinpACYCDuet-1For gene expression, ChloramphenicolpRSFDuet-1For gene expression, KanamycinpEcCasFor gene knockout, KanamycinpEcgRNAFor gene knockout, SpectinomycinpRSF-FpRSFDuet-1 containing fkp in MCS1pRSF-F-TpRSFDuet-1 containing fkp in MCS1 and fucT in MCS2pRSF-F-BpRSFDuet-1 containing fkp in MCS1 and wcfB in MCS2pRSF-F-LpRSFDuet-1 containing fkp in MCS1 and wbgL in MCS2pRSF-F-SUMOTpRSFDuet-1 containing fkp in MCS1 and SUMO-fucT in MCS2pACYC-YpACYCDuet-1 containing lacY in MCS1pACYC(Plac)-YReplace T7 promoter of pACYC-Y MCS1 with lac promoterpACYC(Plac)-YTpACYC(Plac)-Y containing RBS sequence plus tpyb after lacYpACYC(Plac)-YSpACYC(Plac)-Y containing RBS sequence plus setA after lacY菌株E.coli DH5α克隆宿主E.coli JM109(DE3)表达宿主E.coli BL21(DE3)表达宿主E.coli C41(DE3)表达宿主JM-V1JM109(DE3) harboring pRSF-F-TJ1-V1JM109(DE3) ΔwcaJ harboring pRSF-F-TJ2-V1JM109(DE3) ΔlacA harboring pRSF-F-TJ2-V2JM109(DE3) ΔlacA harboring pRSF-F-BJ2-V3JM109(DE3) ΔlacA harboring pRSF-F-LJ2-V4JM109(DE3) ΔlacA harboring pRSF-F-SUMOTJ2-V5JM109(DE3) ΔlacA harboring pRSF-F-SUMOT and pACYC-YJ2-V6JM109(DE3) ΔlacA harboring pRSF-F-SUMOT and pACYC(Plac)-YJ2-V7JM109(DE3) ΔlacA harboring pRSF-F-SUMOT and pACYC(Plac)-YT
续表1

质粒/菌株描述J2-V8JM109(DE3) ΔlacA harboring pRSF-F-SUMOT and pACYC(Plac)-YSBL-V1BL21(DE3)harboring pRSF-F-TB1-V1BL21(DE3) ΔlacZ harboring pRSF-F-TB2-V1BL21(DE3) ΔlacZ ΔwcaJ harboring pRSF-F-TB3-V1BL21(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-TB3-V2BL21(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-BB3-V3BL21(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-LB3-V4BL21(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-SUMOTB3-V5BL21(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-SUMOT and pACYC-YB3-V6BL21(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-SUMOT and pACYC(Plac)-YB3-V7BL21(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-SUMOT and pACYC(Plac)-YTB3-V8BL21(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-SUMOT and pACYC(Plac)-YSC41-V1C41(DE3)harboring pRSF-F-TC1-V1C41(DE3) ΔlacZ harboring pRSF-F-TC2-V1C41(DE3) ΔlacZ ΔwcaJ harboring pRSF-F-TC3-V1C41(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-TC3-V2C41(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-BC3-V3C41(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-LC3-V4C41(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-SUMOTC3-V5C41(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-SUMOT and pACYC-YC3-V6C41(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-SUMOT and pACYC(Plac)-YC3-V7C41(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-SUMOT and pACYC(Plac)-YTC3-V8C41(DE3) ΔlacZ ΔwcaJ ΔlacA harboring pRSF-F-SUMOT and pACYC(Plac)-YS
1.2 底盘微生物的选择和改造
1.2.1 对底盘微生物的分析
JM109(DE3)是缺失乳糖水解能力的大肠杆菌[15],这有助于其合成2′-FL。BL21(DE3)是广泛使用的表达宿主,研究表明经改造的BL21(DE3)具备从头途径合成2′-FL的能力;C41(DE3)菌株来源于BL21(DE3),该菌株多个基因发生突变,尤其大幅降低了T7 RNA聚合酶的转录水平,在很大程度上解决了外源蛋白表达形成包涵体的难题;目前已有研究将C41(DE3)作为2′-FL从头合成途径的宿主[8],但补救途径合成2′-FL的情况未见报道。
1.2.2 底盘微生物的改造
由于大肠杆菌本身存在多条分支代谢途径会对合成底物和中间体产生消耗,严重影响了产物合成。本研究采用CRISPR-Cas9作为基因编辑工具对宿主相关基因lacZ、wcaJ、lacA进行敲除,以BL21(DE3)菌株敲除lacZ基因为例,所使用引物见表2。首先通过CHOPCHOP(https://chopchop.cbu.uib.no/)在线设计N20序列,合成引物lacZ-N20-F/R后加入包含T4 DNA连接酶缓冲液的反应体系中。将PCR反应程序设定为95 ℃解链5 min,梯度退火即可获得lacZ-N20双链DNA。将其稀释后与pEcgRNA载体混合,加入Bsa I酶和T4 DNA连接酶37 ℃反应1 h。将反应物转化至DH5α感受态细胞,即可得到携带lacZ靶点的pEcgRNA-lacZ-N20重组质粒。以BL21(DE3)的基因组DNA为模板,分别PCR得到lacZ基因上下游的同源臂片段u-lacZ和d-lacZ,再经重叠PCR获得同源臂片段u/d-lacZ并纯化回收;将100 ng的pEcgRNA-lacZ-N20重组质粒和400 ng的u/d-lacZ片段混合,电转化至含有pEcCas载体的BL21(DE3)感受态细胞中,涂布LB平板(含50 mg/L卡那霉素和50 mg/L壮观霉素)在37 ℃过夜培养;挑取平板单菌落使用PCR鉴定敲除是否成功,电转化和质粒消除等实验步骤详见参考文献[17]。
表2 本研究中使用的引物
Table 2 Primers used in this study

注:WT-野生型;OP-密码子优化;下划线表示酶切位点。
引物序列 (5′→3′)fucT2(WT)-FAAGAAGGAGATATACATATGATGGCTTTTAAGGTGGTGCAAfucT2(WT)-RGTTTCTTTACCAGACTCGAGTTAAGCGTTATACTTTTGGGATTTCAwcfB(WT)-FAAGAAGGAGATATACATATGATGTTATATGTAATTTTACGTGGACGATTwcfB(WT)-FGTTTCTTTACCAGACTCGAGTTACATATTCTTCTTTCTTTTCCATATTAATCwbgL(WT)-FAAGAAGGAGATATACATATGATGTCTATTATAAGATTACAAGGCGGAwbgL(WT)-RGTTTCTTTACCAGACTCGAGTTAACACGAGCTATGTTTATCCACGfucT2(OP)-FAAGAAGGAGATATACATATGATGGCGTTCAAAGTTGTTCAGATfucT2(OP)-RGTTTCTTTACCAGACTCGAGTTACGCGTTGTATTTCTGAGATTTAAwcfB(OP)-FAAGAAGGAGATATACATATGATGCTGTATGTTATCCTGCGCGwcfB(OP)-FGTTTCTTTACCAGACTCGAGTTACATATTCTTTTTACGTTTCCAAATCwbgL(OP)-FAAGAAGGAGATATACATATGATGAGCATTATCCGTCTGCAGGwbgL(OP)-RGTTTCTTTACCAGACTCGAGTTAACAACTGCTATGCTTATCAACATTAASUMO-fucT2-STATAAGAAGGAGATATACATATGTCGGACTCAGAAGTCAATCAASUMO-fucT2-ATGAACAACTTTGAACGCCATACCACCAATCTGTTCTCTGTGAGClacY-FCTTTAATAAGGAGATATACCATGGGCTACTATTTAAAAAACACAAACTTTTGGlacY-RCCGAGCTCGAATTCGGATCCTTAAGCGACTTCATTCACCTGACGlacZ-N20-FTAGTCAGCTGGCGTAATAGCGAAGlacZ-N20-RAAACCTTCGCTATTACGCCAGCTGwcaJ-N20-FTAGTCAATGCATCGTTAATCTCTAwcaJ-N20-RAAACTAGAGATTAACGATGCATTGlacA-N20-FTAGTTACCGGAAAAAAGACTTCGTlacA-N20-RAAACACGAAGTCTTTTTTCCGGTAPlac-FCAACCGCACCTGTGGCGCCGGTGTTTACACTTTATGCTTCCGGCTCPlac-RTTAAACAAAATTATTTCTAGATTGTTATCCGCTCACAATTCCA
1.3 补救途径的构建和优化
1.3.1 2′-FL生产菌株的构建
委托通用生物公司全合成脆弱拟杆菌(Bacteroides fragilis)来源的fkp编码基因,并克隆到了pRSF-Duet-1载体MCS1区域的NcoI-BamH I处,获得重组质粒pRSF-F。使用Nde I和Xho I对pRSF-F进行双酶切,通过试剂盒ClonExpress II One Step Cloning Kit(南京诺唯赞生物科技公司)将线性化的质粒和α-1,2-岩藻糖基转移酶基因连接(引物见表2),通过测序验证是否正确并转化至相应感受态细胞获得2′-FL的生产菌株。
1.3.2 岩藻糖基转移酶的选择
委托通用生物公司全合成野生型或按照大肠杆菌密码子偏好性优化的幽门螺杆菌(Helicobacter pylori 26695)来源的fucT2、脆弱拟杆菌(Bacteroides fragilis)来源的wcfB、大肠杆菌O126来源的wbgL 3种岩藻糖基转移酶编码基因。使用对应引物(如表2所示)进行PCR,所得片段经纯化后连接到使用Nde I和Xho I双酶切的pRSF-F载体上,再转化大肠杆菌感受态细胞。比较携带不同来源岩藻糖基转移酶菌株的生产能力,同时通过添加助溶标签SUMO来提高FucT的可溶性[11]。
1.3.3 转运蛋白的表达优化
LacY是一种膜结合蛋白,过量表达会带来细胞毒性。本研究首先选用拷贝数较低的pACYCDuet-1载体进行表达,以lacY-F/R为引物从E.coli BL21(DE3)中扩增出lacY基因,连接到pACYCDuet-1载体的多克隆位点MCS1处(NcoⅠ和BamHⅠ位点之间),得到重组质粒pACYC-Y。为进一步降低表达量,以pUC19质粒为模板扩增出Lac启动子片段来替换pACYC-Y上MCS1位点原有的T7启动子,获得重组质粒pACYC(Plac)-Y。糖转运蛋白编码基因tpyb由通用生物公司合成并组装在lacY基因的终止密码子之后,两基因之间通过RBS序列连接得到重组质粒pACYC(Plac)-YT。使用同样的方法可以获得携带有糖转运蛋白编码基因setA的重组质粒pACYC(Plac)-YS。所得质粒均经过测序验证后转化至相应宿主,通过细胞干重(dry cell weight, DCW)和2′-FL产量来比较转运蛋白表达的影响。
1.4 摇瓶发酵条件优化
将平板单菌落挑取至含有对应抗生素的5 mL LB液体培养基,于37 ℃培养过夜。吸取1 mL菌液接种于50 mL含10 g/L甘油的LB培养基中,37 ℃培养至菌体OD600值达到0.6~0.8时添加0.1 mmol/L的异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG)诱导重组质粒表达。此时各加入2 g/L的L-岩藻糖和乳糖,25 ℃继续培养48 h并定时取样,通过HPLC检测2′-FL的含量。分别考察了不同表达温度(20、25、30、35、37 ℃),不同IPTG浓度(0.2、0.4、0.6、0.8、1.0 mmol/L),不同乳糖添加量(1、3、5、7、9 g/L)对发酵合成2′-FL的影响。
1.5 分析方法
生物量的测定方法:发酵液离心弃上清液,烘干称重得到DCW数据。甘油、L-岩藻糖、乳糖、2′-FL在发酵液中的浓度通过HPLC测定,取1 mL发酵液,12 000 r/min离心1 min,将上清液用0.22 μm水系滤膜过滤后使用安捷伦HPLC系统和Carbohydrate Analysis(Rezex ROA-Organic Acid H+)色谱柱对样品进行分析,其中流动相为0.5 mmol/L硫酸溶液,流速0.6 mL/min,柱温60 ℃,进样量20 μL。
2 结果与分析
2.1 宿主选择及基因敲除对2′-FL合成的影响
含有β-半乳糖苷酶的大肠杆菌可将乳糖水解成葡萄糖和半乳糖并用于细胞生长,而不是和GDP-L-岩藻糖结合为2′-FL。如图2所示,含有补救途径但不能水解乳糖的JM-V1菌株可合成0.53 g/L的2′-FL,而可水解乳糖的菌株BL-V1和C41-V1分别只能合成0.23、0.05 g/L的2′-FL。我们通过CRISPR-Cas9系统敲除了编码β-半乳糖苷酶的基因lacZ,敲除后的B1-V1和C1-V1菌株相比敲除前产量提高约2倍。GDP-L-岩藻糖是大肠杆菌克拉酸合成途径的重要中间体[18],克拉酸合成会造成GDP-L-岩藻糖的大量消耗,因此需要敲除其合成途径的关键基因wcaJ。敲除后得到了菌株J1-V1、B2-V1、C2-V1,2′-FL产量分别为0.21、0.62、0.15 g/L。值得注意的是J1-V1的生物量和产量较出发菌株下降60%,即wcaJ的敲除对菌体生长产生显著的负面影响,说明该基因对JM109(DE3)有较为重要的作用而不宜被敲除。而B2-V1与出发菌株相比产量提升2.67倍,DCW相较之前略微下降。C2-V1产量仍较低,这可能是由于该菌株对T7启动子的转录能力较弱导致。在上述工作的基础上我们进一步将β-半乳糖苷乙酰基转移酶基因(lacA)进行敲除并构建出J2-V1、B3-V1、C3-V1菌株,以期能进一步提高乳糖的利用率。由图2可知,敲除lacA的菌株2′-FL产量均得到进一步提高,其中J2-V1菌株产量最高达到0.86 g/L,是出发菌株的1.61倍。以上结果表明,在3株候选菌株中lacZ和lacA基因的敲除均使得2′-FL胞外浓度提升;wcaJ的敲除对JM109(DE3)影响很大,导致菌株无法正常生长,但该基因对BL21(DE3)及C41(DE3)的生物量却无显著影响。
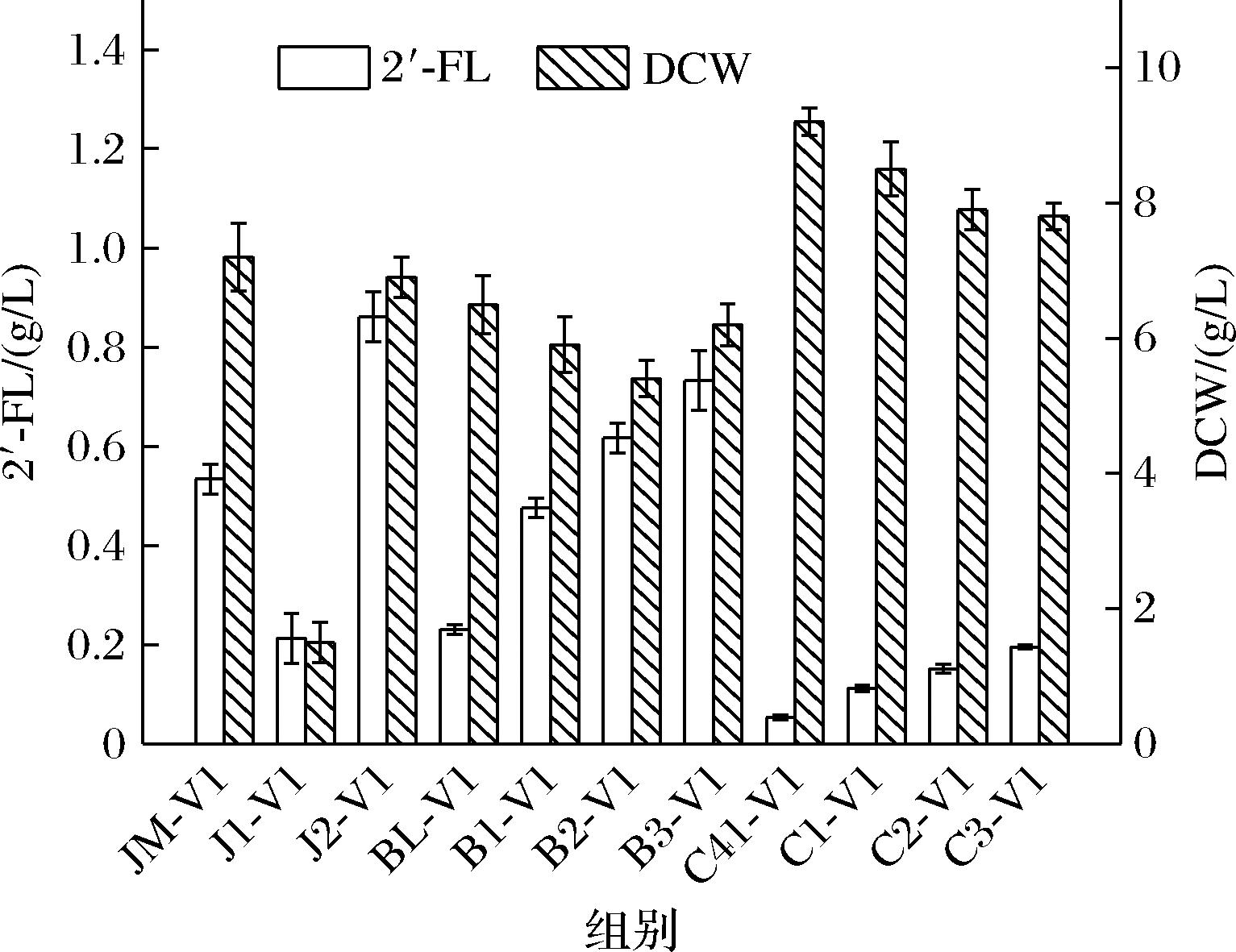
图2 不同重组菌株的2′-FL产量
Fig.2 Production of 2′-FL in different recombinant strains
2.2 岩藻糖基转移酶的选择与优化
岩藻糖基转移酶作为关键酶催化2′-FL合成的最后一步反应,它的表达以及活力高低对于产量是至关重要的。对不同来源的α-1,2-岩藻糖基转移酶(FucT2、WcfB、WbgL)编码基因进行密码子优化,再与双功能酶Fkp一起克隆到pRSFDuet-1载体上,分别转化JM109(DE3)ΔlacA、BL21(DE3)ΔlacZΔwcaJΔlacA、C41(DE3)ΔlacZΔwcaJΔlacA等菌株。经摇瓶发酵后测定胞外2′-FL的浓度发现脆弱拟杆菌来源的wcfB在3个宿主中产量均较低,密码子优化也没有提升其生产性能(图3-a)。WbgL源于致病型大肠杆菌E.coli O126,仍含有约41%的稀有密码子,经密码子优化后2′-FL在表达宿主中产量得到了进一步的提升,其中J2-V3提高了5.1%,产量为0.84 g/L;B3-V3提升了7.7%,产量为0.62 g/L。来源于幽门螺杆菌的fucT2密码子优化前后虽未有较明显提升,但与WcfB和WbgL相比产量最高,因此含有fucT的J2-V1和B3-V1是首选的2′-FL生产菌株。
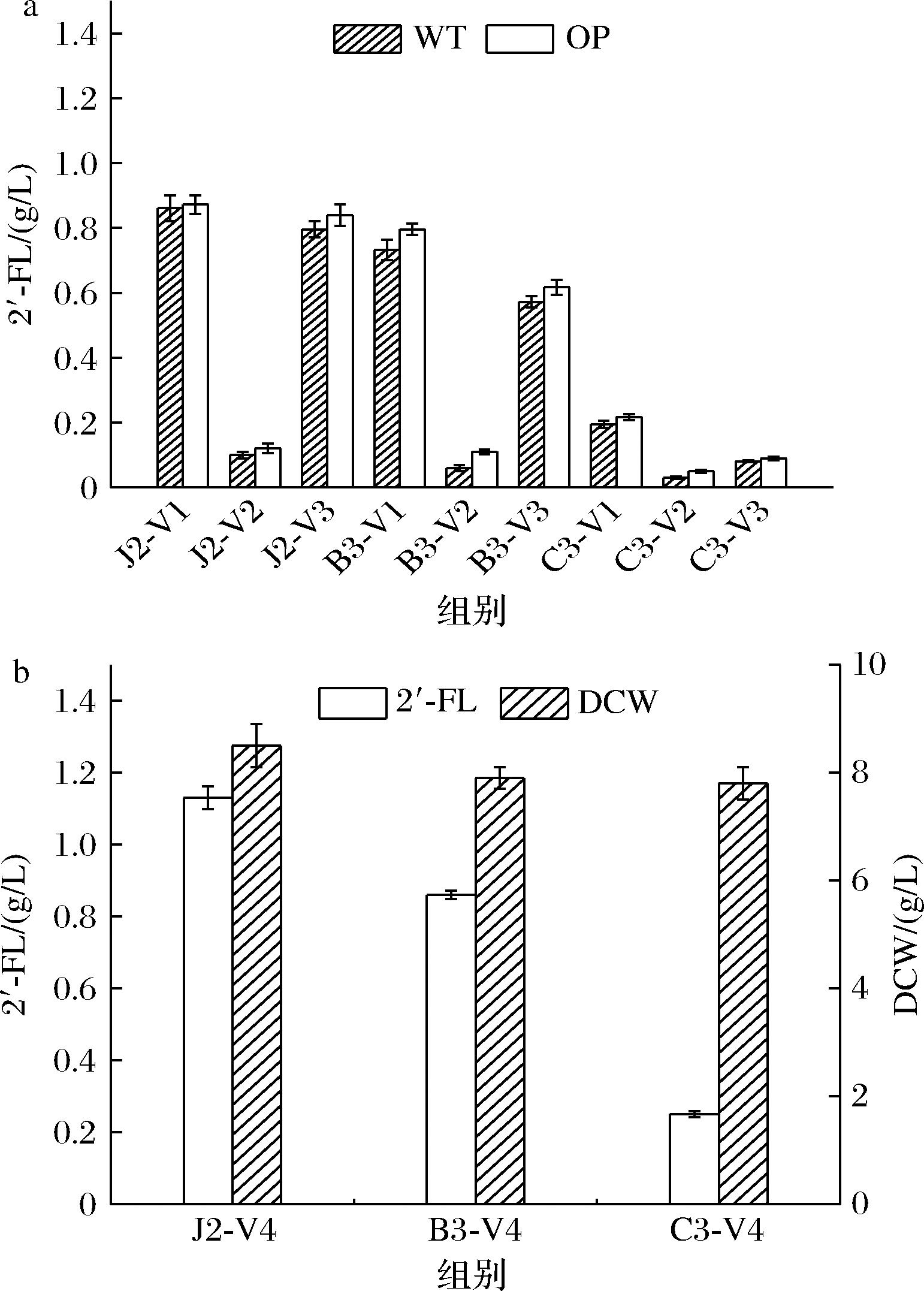
a-不同来源岩藻糖基转移酶基因密码子优化对2′-FL合成的影响(WT:原始基因序列,OP:经过密码子优化的序列);b-fucT2连接SUMO标签对2′-FL产量的影响
图3 α-1,2-岩藻糖基转移酶对2′-FL产量的影响
Fig.3 Effect of α-1,2-fucosyltransferase on the production of 2′-FL
在本研究的后续实验中,我们将密码子优化的fucT2作为选定的α-1,2-岩藻糖基转移酶编码基因。由于该酶在大肠杆菌中的可溶性较差,参考HOLLANDS等[11]的工作将fucT基因与SUMO标签融合表达。通过测定J2-V4,B3-V4,C3-V4的胞外2′-FL浓度,我们发现带有标签的相应菌株产量均获提升,其中J2-V4产量为1.13 g/L(图3-b),表明该标签的使用对FucT2的可溶性表达起到促进作用。
2.3 转运蛋白的过表达
为进一步提高乳糖在胞内的利用率,过表达乳糖透过酶LacY来增强乳糖向胞内的转运。由于LacY是一个膜蛋白,大量表达具有细胞毒性,因此选择了拷贝数很低的pACYCDuet-1表达载体。发酵结束后测定生物量发现表达LacY的菌株J2-V5、B3-V5与对照组相比均下降了2/3左右,产物合成也被抑制(图4-a),而C3-V5的生物量也下降了1/2。为降低lacY表达的细胞毒性,将pACYCDuet-1上的T7强启动子替换为Lac启动子,得到新菌株J2-V6、B3-V6、C3-V6。经发酵验证更换启动子后LacY的表达不仅没有对菌体生长造成毒害,还如预期对2′-FL的合成起到了促进作用。如图4-b所示,J2-V6相较没有过表达LacY的J2-V4产量提升了47.7%,2′-FL的胞外质量浓度为1.67 g/L,B3-V6的2′-FL胞外质量浓度也提升至1.47 g/L,C3-V6产量也有提高但远低于J2-V6和B3-V6。为促进胞内2′-FL分泌到胞外,过表达伯氏耶尔森菌(Yersinia bercovieri)的糖转运蛋白Tpyb或大肠杆菌来源的的糖转运蛋白SetA。结果如图4-b所示,过表达Tpyb(V7菌株)或SetA(V8菌株)后胞外2′-FL浓度提高且在不同宿主内SetA的转运效果均优于Tpyb,其中浓度最高的J2-V8达到2.21 g/L,生物量未受明显影响。
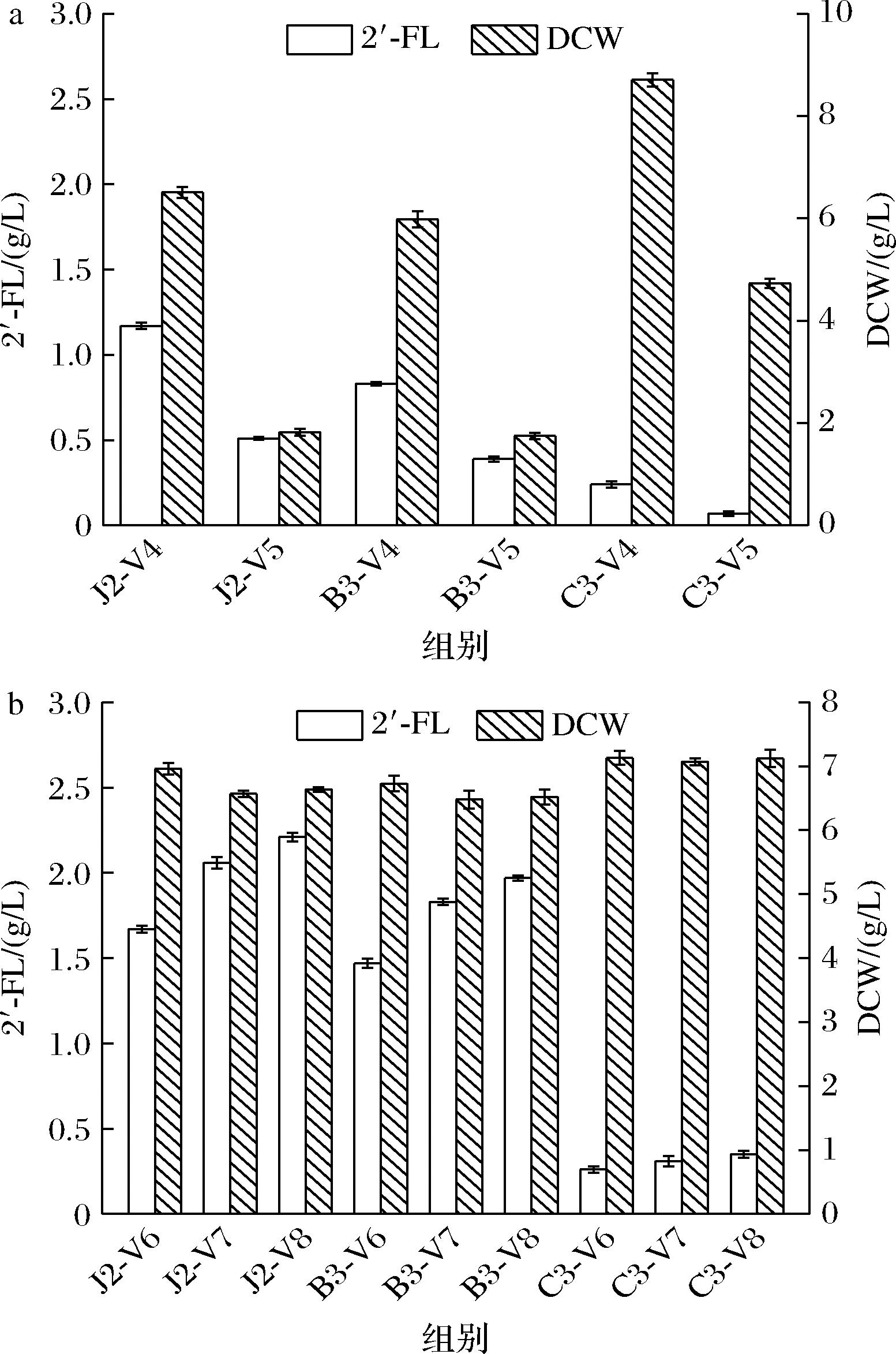
a-T7启动子过表达lacY对2′-FL合成的影响;b-Lac启动子过表达lacY、tpyb、setA对2′-FL合成的影响
图4 糖转运蛋白对2′-FL的产量的影响
Fig.4 Effect of sugar transporter on the 2′-FL production
2.4 发酵条件优化
通过前期的菌株构建和途径优化工作,我们获得了可用于补救途径生产2′-FL的重组菌株J2-V8。进一步对诱导温度、诱导剂浓度以及乳糖的添加量进行了优化,测定了发酵条件下2′-FL的胞外浓度。由图5-a可知,IPTG为0.2 mmol/L时,2′-FL产量最高,达到2.27 g/L。当IPTG浓度超过0.6 mmol/L后产量反而下降,这可能是由于过表达导致了胞内代谢不平衡,故0.2 mmol/L应为最适的诱导剂浓度。诱导温度不仅会影响蛋白表达折叠也决定了菌体的生长速度,温度过低,宿主生长较差不利于产物生成,温度过高菌体生长过快,易引起蛋白质错误折叠而形成包涵体。如图5-b所示,分别测定了20、25、30、35、37 ℃下菌株合成2′-FL的差异,结果表明25 ℃时最优,2′-FL胞外质量浓度为2.3 g/L,转化率为0.71 mol/mol L-岩藻糖。
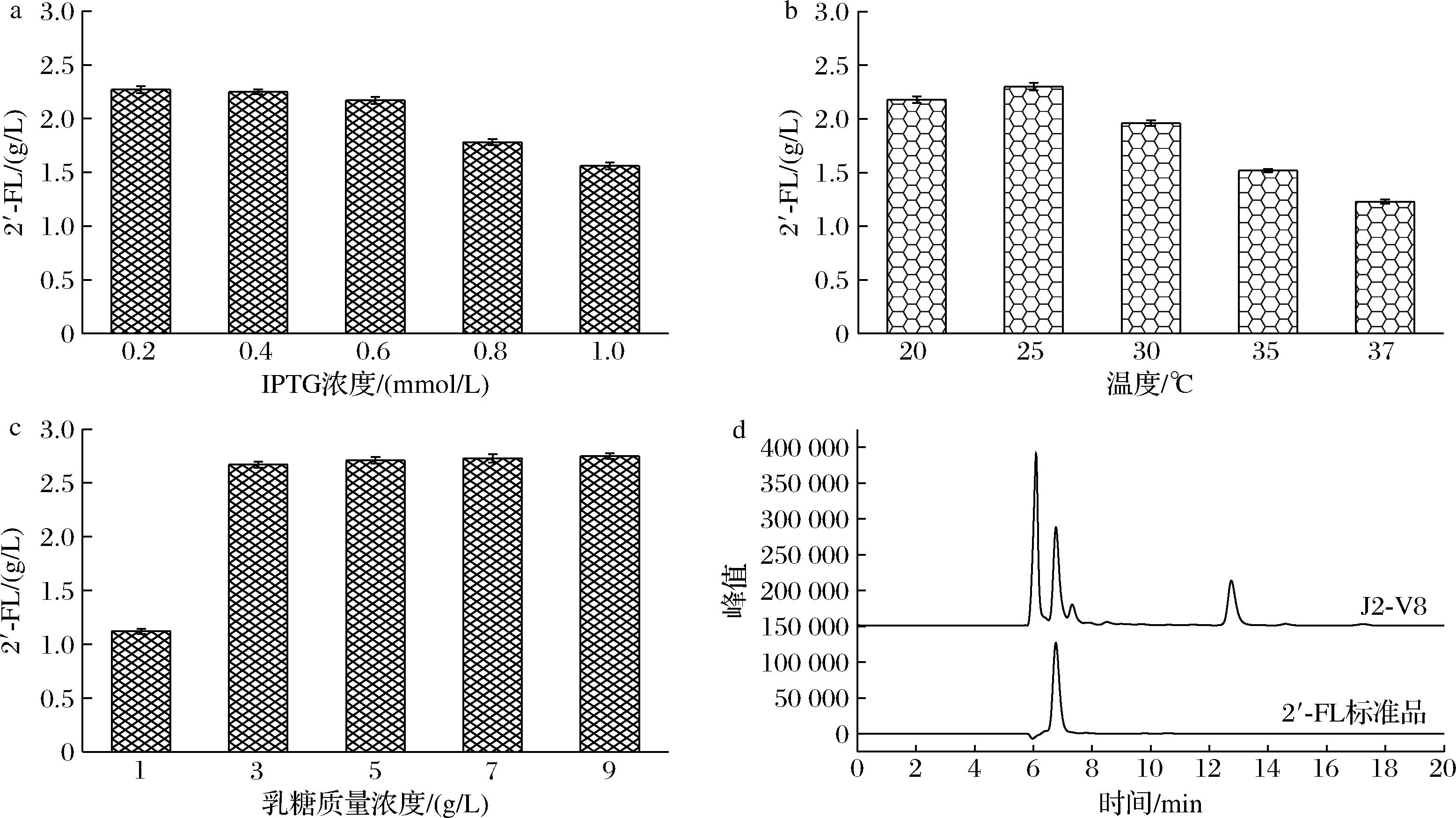
a-不同IPTG浓度的影响;b-不同表达温度的影响;c-不同乳糖添加量的影响;d-HPLC检测J2-V8菌株发酵液中的2′-FL含量
图5 不同发酵条件对2′-FL产量的影响
Fig.5 Effect of different fermentation conditions on 2′-FL production
由于乳糖浓度可能对2′-FL合成产生影响,本研究中我们采用终质量浓度为1、3、5、7、9 g/L的乳糖作为底物摇瓶发酵。分析图5-c可得,当乳糖由1 g/L提升至3 g/L时,产量大幅提升,此时2′-FL的胞外质量浓度达到2.67 g/L,转化率为0.82 mol/mol岩藻糖。当乳糖质量浓度高于3 g/L时产量不再明显提升,乳糖转运已经达到饱和,因此将终质量浓度3 g/L乳糖作为最适添加浓度。利用HPLC检测发酵液中2′-FL含量如图5-d所示大肠杆菌通过补救途径生产2′-FL的相关实验数据比较如表3所示。
表3 补救途径合成2′-FL的结果比较
Table 3 Comparison of 2′-FL Production via salvage pathway

注:N.A.表示未提及。
菌株培养方法产量/(g/L)转化率/(mol/mol岩藻糖)生产率/[g/(L·h)]敲除基因参考文献BL21(DE3)Flask2.60.65N.A.Fed-batch30.50.660.48lacZ, fucI, fucK, araA, rhaA, wcaJ[13]BL21 star(DE3)Flask4.10.670.07Fed-batch47.00.520.60lacZ, fucI, fucK, araA, rhaA[19]BL21 star (DE3)Flask2.10.630.03Fed-batch23.10.360.39lacZ, fucI, fucK[20]BL21(DE3)Flask1.4N.A.0.01lacZ, wcaJ[21]JM109(DE3)Flask2.70.820.06lacZ本研究
3 结论
本研究构建了利用补救途径合成2′-FL的重组大肠杆菌菌株,通过筛选不同来源的α-1,2-岩藻糖基转移酶基因并经过密码子优化,添加SUMO标签促进了酶的可溶性表达。通过替换弱启动子对乳糖转运蛋白LacY和产物运出蛋白Tpyb及SetA进行了过表达试验,获得1株2′-FL胞外质量浓度为2.21 g/L的重组大肠杆菌J2-V8。在摇瓶水平进行发酵优化,得到最优发酵条件:诱导剂IPTG浓度为0.2 mmol/L,诱导温度25 ℃,诱导同时加入2 g/L的L-岩藻糖和3 g/L乳糖。通过HPLC测定48 h时发酵液中2′-FL质量浓度提高到2.67 g/L,转化率为0.82 mol/mol L-岩藻糖。L-岩藻糖作为发酵过程中成本较高的底物,通过LacY和SetA的表达增强了乳糖向胞内的输入以及2′-FL向胞外的输出,有助于充分利用L-岩藻糖合成产物,可为2′-FL的生物合成深入研究提供一定借鉴。
[1] HORTA B L.Breastfeeding:Investing in the future[J].Breastfeeding Medicine, 2019, 14(S1):S11-S12.
[2] CHUTIPONGTANATE S, MORROW A L, NEWBURG D S.Human milk oligosaccharides:Potential applications in COVID-19[J].Biomedicines, 2022, 10(2):346.
[3] HEGAR B, WIBOWO Y, BASROWI R W, et al. The role of two human milk oligosaccharides, 2′-fucosyllactose and lacto-N-neotetraose, in infant nutrition[J].Pediatric Gastroenterology Hepatology &Nutrition, 2019, 22(4):330-340.
[4] ZEHRA S, KHAMBATI I, VIERHOUT M, et al.Human milk oligosaccharides attenuate antigen-antibody complex induced chemokine release from human intestinal epithelial cell lines[J].Journal of Food Science, 2018, 83(2):499-508.
[5] HICKEY R M.The role of oligosaccharides from human milk and other sources in prevention of pathogen adhesion[J].International Dairy Journal, 2012, 22(2):141-146.
[6] FACINELLI B, MARINI E, MAGI G, et al.Breast milk oligosaccharides:Effects of 2′-fucosyllactose and 6′-sialyllactose on the adhesion of Escherichia coli and Salmonella fyris to Caco-2 cells[J].The Journal of Maternal-Fetal &Neonatal Medicine, 2019, 32(17):2950-2952.
[7] HUANG D, YANG K X, LIU J, et al.Metabolic engineering of Escherichia coli for the production of 2′-fucosyllactose and 3-fucosyllactose through modular pathway enhancement[J].Metabolic Engineering, 2017, 41:23-38.
[8] NI Z J, LI Z K, WU J Y, et al.Multi-path optimization for efficient production of 2′-fucosyllactose in an engineered Escherichia coli C41 (DE3) derivative[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:611900.
[9] LIU J J, KWAK S, PATHANIBUL P, et al.Biosynthesis of a functional human milk oligosaccharide, 2′-fucosyllactose, and L-fucose using engineered Saccharomyces cerevisiae[J].ACS Synthetic Biology, 2018, 7(11):2529-2536.
[10] YU S, LIU J J, YUN E J, et al.Production of a human milk oligosaccharide 2′-fucosyllactose by metabolically engineered Saccharomyces cerevisiae[J].Microbial Cell Factories, 2018, 17(1):1-10.
[11] HOLLANDS K, BARON C M, GIBSON K J, et al. Engineering two species of yeast as cell factories for 2′-fucosyllactose[J].Metabolic Engineering, 2019, 52:232-242.
[12] DENG J Y, GU L Y, CHEN T C, et al.Engineering the substrate transport and cofactor regeneration systems for enhancing 2′-fucosyllactose synthesis in Bacillus subtilis[J].ACS Synthetic Biology, 2019, 8(10):2418-2427.
[13] WAN L, ZHU Y Y, CHEN G, et al.Efficient production of 2′-fucosyllactose from L-fucose via self-assembling multienzyme complexes in engineered Escherichia coli[J].ACS Synthetic Biology, 2021, 10(10):2488-2498.
[14] PARK B S, CHOI Y H, KIM M W, et al.Enhancing biosynthesis of 2′-fucosyllactose in Escherichia coli through engineering lactose operon for lactose transport and α-1, 2-fucosyltransferase for solubility[J].Biotechnology and Bioengineering, 2022, 119(5):1264-1277.
[15] CHIN Y W, KIM J Y, LEE W H, et al.Enhanced production of 2′-fucosyllactose in engineered Escherichia coli BL21 star(DE3) by modulation of lactose metabolism and fucosyltransferase[J].Journal of Biotechnology, 2015, 210:107-115.
[16] LEE A R, LI L, SHIN S Y, et al.Soluble expression of the fucosyltransferase gene from Helicobacter pylori in Escherichia coli by co-expression of molecular chaperones[J].Microbiology and Biotechnology Letters, 2015, 43(3):212-218.
[17] LI Q, SUN B B, CHEN J, et al.A modified pCas/pTargetF system for CRISPR-Cas9-assisted genome editing in Escherichia coli[J].Acta Biochimica et Biophysica Sinica, 2021, 53(5):620-627.
[18] CHEN Q, WU H Y, JI M H, et al. Engineering a colanic acid biosynthesis pathway in E.coli for manufacturing 2′-fucosyllactose[J].Process Biochemistry, 2020, 94:79-85.
[19] JUNG S M, CHIN Y W, LEE Y G, et al.Enhanced production of 2′-fucosyllactose from fucose by elimination of rhamnose isomerase and arabinose isomerase in engineered Escherichia coli[J].Biotechnology and Bioengineering, 2019, 116(9):2412-2417.
[20] CHIN Y W, SEO N, KIM J H, et al. Metabolic engineering of Escherichia coli to produce 2′-fucosyllactose via salvage pathway of guanosine 5′-diphosphate (GDP)-L-fucose[J].Biotechnology and Bioengineering, 2016, 113(11):2443-2452.
[21] 李晨晨, 李梦丽, 江波, 等.2′-岩藻糖基乳糖的生物合成菌株构建及发酵条件研究[J].食品与发酵工业, 2021, 47(3):10-17.LI C C, LI M L, JIANG B, et al.Strain development and fermentation optimization for biosynthesis of 2′-fucosyllactose[J].Food and Fermentation Industries, 2021, 47(3):10-17.