辣木(Moringa oleifera),又名鼓槌树[1-2]。广泛栽种于非洲、亚洲及拉丁美洲热带、亚热带地区[3]。目前,云南、广东、海南及福建等省大量栽培。辣木富含蛋白质、维生素A、叶酸、钙、铁、硒等营养素,及类胡萝卜素、酚类、黄酮类、植物甾醇、生物碱、有机酸类等功能成分。因此,辣木拥有“奇迹树”和“母亲最好的朋友”等美称[4]。已有研究表明,辣木具有抗氧化、降血糖、降血脂、降血压、抗癌、抗炎、抗衰老、调节肠道功能、调节睡眠质量等功效[5-7]。
固态发酵是在基本无游离水的固体基质上进行的发酵过程[8]。固态发酵可以提高副产物的营养价值[9],且具有操作简单、成本低、废水产量低和生产效率高[10-11]等优点。在发酵过程中,微生物可以分泌降解底物分子所需的酶[10],因此,固态发酵是生产生物活性物质的一种经济有效的方法[9,12]。目前,利用固态发酵来提高物质的营养价值或生物活性已成为当前的研究热点。
本研究以辣木叶为研究对象,以植物乳杆菌(Lactobacillus plantarum)为发酵菌种,探究辣木叶发酵前后蛋白质、黄酮、多糖、多酚的含量变化,测定其抗氧化能力,并利用超高效液相色谱高分辨质谱(ultra high performance liquid chromatography-orbitrap exploris-mass spectrometry,UHPLC-OE-MS)技术深入探讨辣木叶发酵前后物质成分的变化,以期为乳酸菌发酵辣木叶的代谢物鉴定提供理论依据,为开发相关辣木叶功能食品提供理论参考。
1 材料与方法
1.1 材料与试剂
辣木叶,云南红河谷辣木产业有限公司;植物乳杆菌CICC 194165,中国工业微生物菌种保藏管理中心。
甲醇、乙酸(色谱纯),美国Fisher Chemical公司;福林-酚试剂、没食子酸(分析纯),上海源叶生物科技有限公司。
1.2 仪器与设备
400Y粉碎机,铂欧五金制品有限公司;LRH-250智能生化培养箱,郑州生元仪器有限公司;FD-1A-50冷冻干燥机,上海比朗仪器制造有限公司;Vanquish超高效液相、Orbitrap Exploris120高分辨质谱仪,美国赛默飞公司。
1.3 实验方法
1.3.1 样品制备
取50 g干辣木叶粉,于121 ℃灭菌15 min,冷却后将辣木叶粉转移到发酵盘中,加入30 mL无菌水,调整初始含水量为60%,接种量5% 3×108 CFU/mL的植物乳杆菌菌液,搅拌均匀,38 ℃发酵10 d。发酵结束后将辣木叶粉冻干,-20 ℃下保存备用。
1.3.2 蛋白质含量测定
参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》进行测定。
1.3.3 黄酮含量的测定
以芦丁为标准品,绘制标准曲线[2]。称0.5 g辣木叶粉,加体积分数60%乙醇30 mL,超声30 min,离心后用乙醇定容至25 mL。取0.5 mL,加0.3 mL 50 g/L NaNO2溶液,0.3 mL 100 g/L Al(NO3)3溶液,4 mL 40 g/L NaOH溶液,15 min后定容至10 mL。于510 nm测定吸光度,计算总黄酮含量,如公式(1)所示,单位为mg/GAE 100 g。
黄酮含量![]()
(1)
式中:ρ,黄酮质量浓度,mg/mL;V1,提取液总体积, mL;V2,吸取提取液体积, mL;m,辣木叶质量,g。
1.3.4 多酚含量测定
以没食子酸为标准品,绘制标准曲线。分别取0.8、1.6、2.4、3.2、4.0、6.0 mL没食子酸标准品于试管中,取1 mL 10 mg/mL的辣木叶醇溶样品于试管中,加入2 mL 70 g/L的NaHCO3溶液,随后加入1 mL福林酚溶液,于765 nm处测定吸光度,如公式(2)所示:
多酚含量![]()
(2)
式中:ρ,多酚质量浓度,mg/mL;V1,稀释体积, mL;V2,样品体积, mL;V3,取样体积, mL;m,样品质量, g。
1.3.5 多糖含量的测定
参考郭刚军等[2]的方法并加以修改。分别配制0、0.02、0.04、0.06、0.08、0.10 mg/mL葡萄糖标准溶液。取1 mL葡萄糖溶液,加0.2 mL苯酚和2.5 mL硫酸,静置30 min,于490 nm处测定吸光度,绘制标准曲线。配制0.1 mg/mL辣木粗多糖溶液,依据标准曲线计算辣木叶多糖含量,如公式(3)所示:
多糖含量![]()
(3)
1.3.6 抗氧化活性测定
1.3.6.1 DPPH自由基和ABTS阳离子自由基清除率测定
取0.5 g辣木叶于锥形瓶中,加入体积分数60%乙醇15 mL,超声30 min,离心过滤,用体积分数60%乙醇定容至25 mL。取1 mL提取液,再加3 mL DPPH溶液,30 min后于517 nm测定吸光度。将7 mmol/L ABTS溶液与40 mmol/L K2S2O8溶液混合定容至50 mL,静置12~16 h。ABTS阳离子自由基工作液在734 nm处吸光值要求为0.70±0.02。将0.5 mL 1 mg/mL的提取物与4 mL ABTS溶液混合,于734 nm处测定吸光度。
1.3.7 代谢物提取
将20 mg样品置于1 000 μL提取液(甲醇∶水=3∶1,体积比)中。在35 Hz下均质4 min,在冰水浴中超声5 min。然后在-40 ℃孵育1 h,离心后将上清液转移到进样瓶中上机分析。
1.3.8 代谢物检测
A相为水相,B相为乙腈。样品盘温度4 ℃,进样体积2 μL。护套气体流速50 Arb,Aux气体流速15 Arb,毛细管温度320 ℃,MS/MS分辨率15 000,喷雾电压3.8 kV(正)或-3.4 kV(负)。
1.4 数据统计与分析
采用SPSS 19.0软件进行统计分析;运用Orbitrap Exploris对样本中的代谢物进行检测,然后对代谢物进行鉴定。根据P<0.05,变量重要性投影(variable importance in project,VIP)>1,进行差异代谢物筛选,将差异代谢物通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)进行注释解析,分析差异代谢物通路。
2 结果与分析
2.1 辣木叶发酵前后营养及功能成分含量的变化
由图1-a可知,辣木叶经植物乳杆菌发酵10 d后蛋白质含量显著增加(P<0.05)。蛋白质含量从发酵前的44.92 g/100 g增加到了52.16 g/100 g。与发酵前相比,蛋白质含量提高了16.12%。此结果与郭刚军等[2]研究结果一致,他们采用酵母发酵自制辣木叶茶,发现发酵过程中蛋白质随发酵时间延长而增加。由图1-b可知,未发酵辣木叶中黄酮含量为10.74 mg/g,发酵10 d后黄酮含量为10.97 mg/g,提高了2.1%,未达到统计学差异。由图1-c可知,发酵前辣木叶中多酚含量为45.64 mg/g,发酵后提升到53.10 mg/g,比发酵前提高了16.35%。在发酵过程中,辣木叶中多酚含量逐渐升高,最后趋于平稳。这与张云娟等[12]对辣木叶经毛霉固态发酵后多酚含量升高的结果一致。由图1-d可知,发酵到第10天,辣木叶多糖含量从23.56%提高到33.45%,比发酵前显著提高(P<0.05)。植物乳杆菌发酵过程中产生的纤维素酶,将辣木纤维素分解为多糖,进而增高了辣木叶多糖含量。

a-蛋白质;b-黄酮;c-多酚;d-多糖
图1 辣木叶发酵前后营养及功能成分含量变化
Fig.1 Contents of nutritional and functional component of M. oleifera leaves before and after fermentation
注:****表示差异极显著(P<0.01);*表示差异显著(P < 0.05)。
2.2 辣木叶发酵前后抗氧化能力变化
由图2-a可知,发酵10 d后辣木叶的ABTS阳离子自由基清除率比发酵前略有升高,ABTS阳离子自由基清除率从70.60%上升到71.10%,但差异不显著。由图2-b可知,发酵10 d后,辣木叶DPPH自由基清除率虽然略有下降,从43.90%降低至38.50%,同样差异不显著。
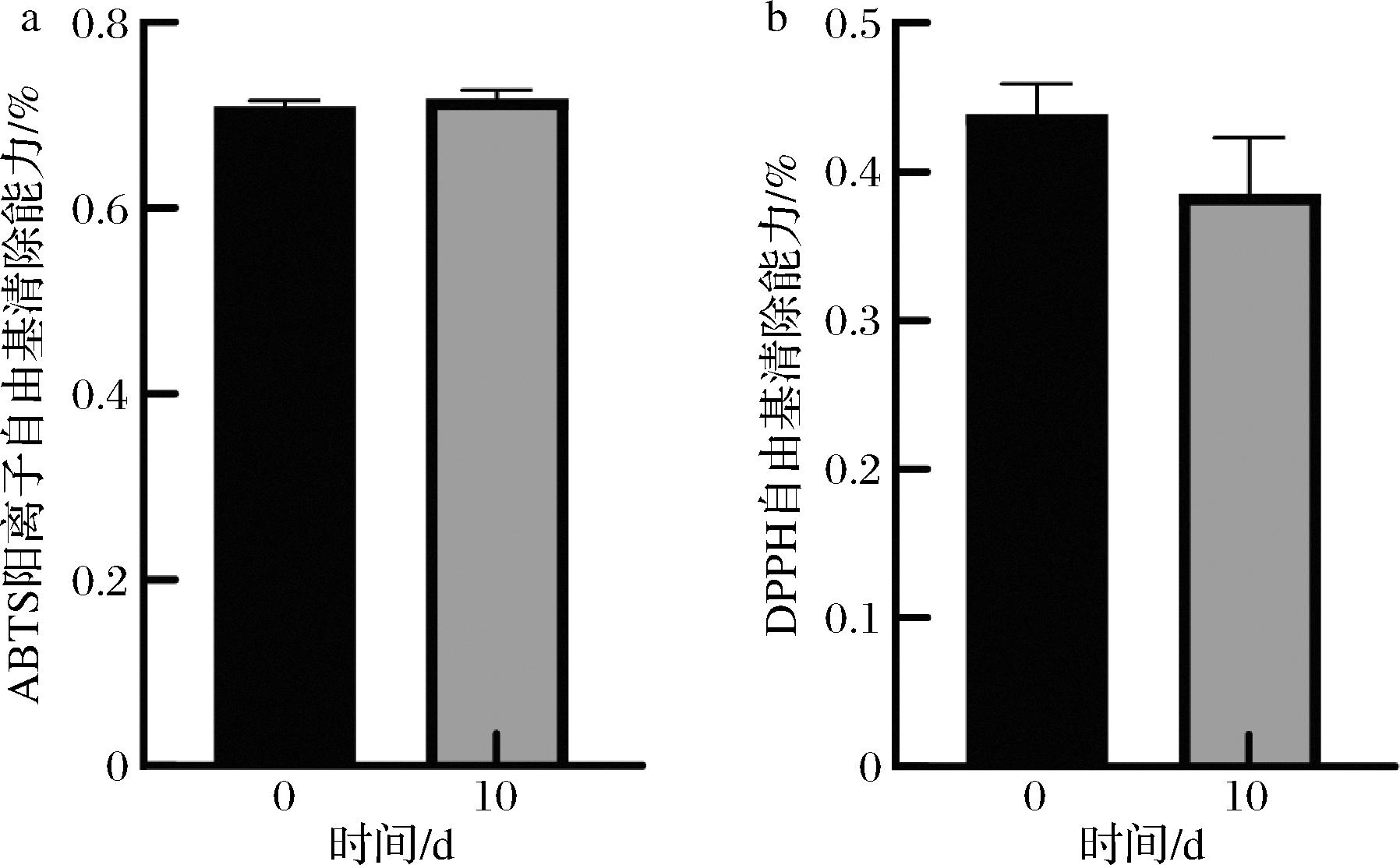
a-ABTS阳离子自由基清除率;b-DPPH自由基清除率
图2 辣木叶发酵前后对ABTS阳离子自由基和DPPH自由基清除率
Fig.2 Scavenging rate of ABTS cation radicals and DPPH radicals of M. oleifera leaves before and after fermentation
2.3 代谢物多维统计分析
2.3.1 辣木叶发酵前后代谢物主成分分析(principal component analysis,PCA)
PCA可以反映辣木叶发酵前后代谢物的变化程度,采用UHPLC-OE-MS对发酵辣木叶的代谢物进行检测分析。在正、负离子模式下PC1和PC2累计贡献率分别是64.7%和67.5%,从PCA得分图(图3-a、图3-b)可知,样本全部处于95%置信区间内,表明实验重现性好,样本点分布越远,表明整体代谢水平差异越大。在研究中,未发酵与发酵的辣木叶中代谢物可以明显区分开,表明未发酵和发酵后的辣木叶代谢物具有显著差异。

a-正离子模式PCA得分图;b-负离子模式PCA得分图;c-正离子模式OPLS-DA得分图;d-负离子模式OPLS-DA得分图;e-正离子模式代谢产物置换图;f-负离子模式代谢产物置换图
图3 辣木叶未发酵组与发酵组的PCA得分图、OPLS-DA得分图及代谢产物的置换检验图
Fig.3 PCA score, OPLS-DA score and permutation plot test of OPLS-DA model of unfermented and fermented groups of M. oleifera leaves
2.3.2 辣木叶发酵前后代谢物的正交偏最小二乘-判别分析(orthogonal partial least square discriminant analysis,OPLS-DA)
对模型质量进行检验(图3-c、图3-d);将验证得到的R2Y和Q2对模型有效性进行评判;本研究中,样本间横向距离远,样本组间差异大,组内重复性好。
为避免模型出现过度拟合现象,通过置换检验对模型有效性做进一步检验。本研究置换检验结果如图3-e、图3-f所示。本研究正负离子模式下置换检验模型分别为R2Y=0.98、Q2=-0.28;R2Y=0.99、Q2=-0.29,表明原模型不存在过拟合现象。
2.4 辣木叶发酵前后差异代谢物筛选
根据t检验的P<0.05,同时结合OPLS-DA模型获得的VIP>1,进行差异代谢物的筛选,获得物质的火山图(图4),火山图可以直观展示组间代谢物差异的整体分布情况。

图4 辣木叶未发酵组与发酵组的代谢物火山图
Fig.4 Volcano plot of metabolite between unfermented and fermented groups of M. oleifera leaves
注:down-regulated表示显著上调的代谢物;not significant表示显著下调的代谢物;up-regulated表示非显著差异的代谢物
2.5 差异代谢物聚类分析
将发酵前后辣木叶中显著差异的代谢物进行归一化处理,选取相对含量较高的前40个代谢物绘制聚类热图。由图5可知,在辣木叶发酵前后共检测到
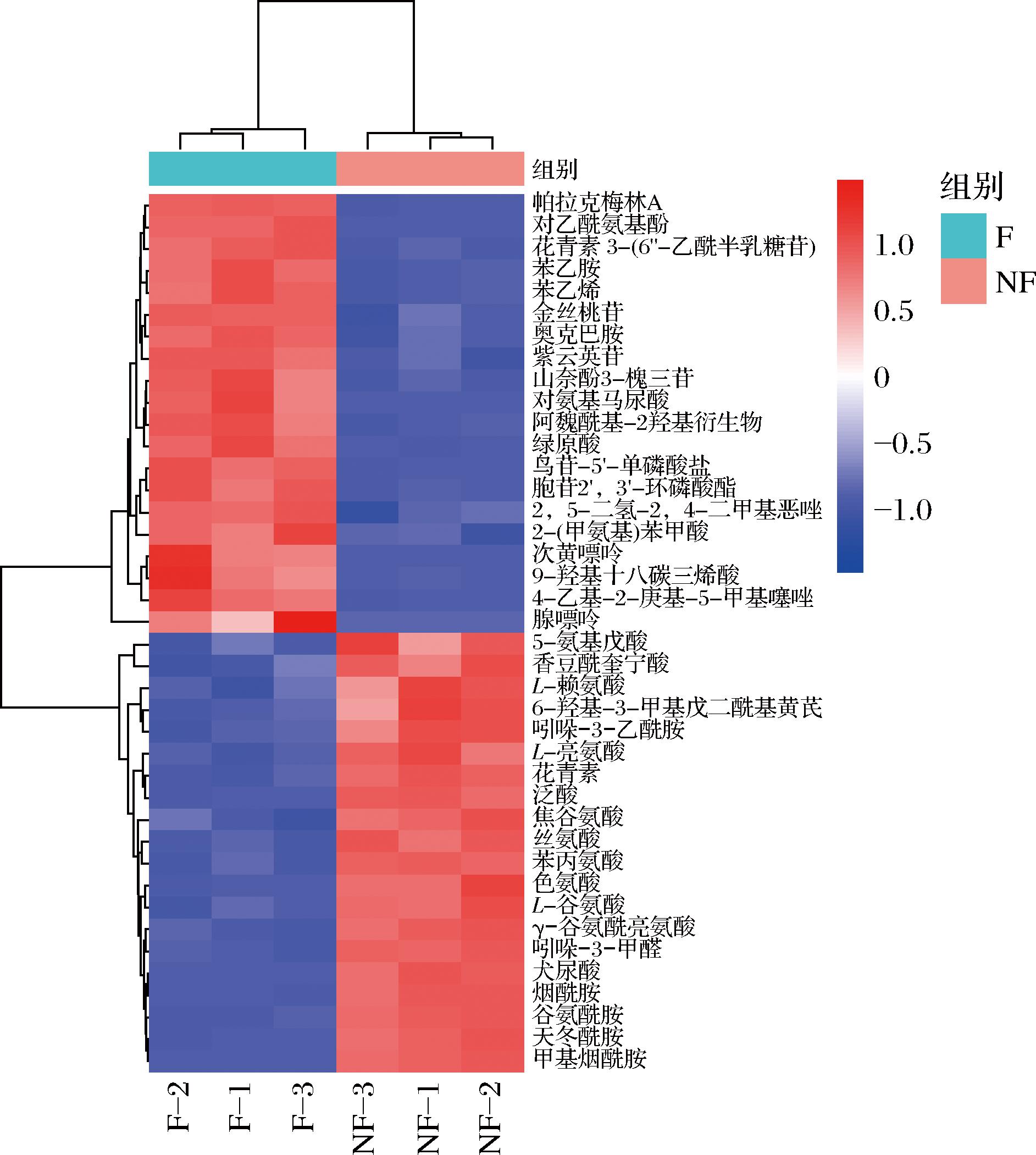
图5 辣木叶未发酵组与发酵组差异代谢物的聚类热图
Fig.5 Heatmap of hierarchical clustering analysis between unfermented and fermented groups of M.oleifera leaves
565种代谢物,主要集中在氨基酸及黄酮类。具有显著差异的物质有96种,其中52种代谢物显著增加,44种显著降低。显著降低的物质包括L-赖氨酸、L-色氨酸、L-谷氨酸、L-亮氨酸、烟酰胺等。结果表明,发酵组中的腺嘌呤、绿原酸、对乙酰氨基酚、次黄嘌呤、紫云英苷、金丝桃苷含量均高于未发酵组。绿原酸为多酚类化合物,具有抗菌消炎、清热解毒的作用[13],还具有抗肝损伤、增强机体免疫功能[14-15]。金丝桃苷具有抗炎[16]、抗氧化[17]、抗癌、抗纤维化[18]等作用,对心脑缺血、肝纤维化和心力衰竭[19]等疾病有治疗效果。紫云英苷是黄芪、辣木叶等多种天然植物黄酮类化合物之一。研究表明,紫云英苷具有抗炎、抗氧化、抗肿瘤等功效[20]。从总体来看,发酵10 d后的辣木叶中黄酮类物质和苯丙素类化合物相对含量显著提高,黄酮类化合物属植物次生代谢产物,在植物体内大部分与糖结合成苷类或碳糖基的形式存在,部分以游离形式存在。此外,在鉴定出的96种差异性代谢物中,发酵辣木叶中烟酰胺、L-色氨酸相对含量低于未发酵辣木叶。烟酰胺参与蛋白质的新陈代谢,可改善人类营养。色氨酸在体内能转变为5-羟色胺、烟酸,人体缺乏色氨酸会引起一般低蛋白症,心肌纤维化等病症。
2.6 差异代谢物的代谢通路分析
通过KEGG数据库对差异代谢物的代谢通路进行分析。结果表明,辣木叶发酵后的差异代谢物共参与69条代谢通路,分别为氨基酸代谢、脂质代谢、跨膜运输、其他氨基酸代谢等。以影响值>0.2为筛选依据,得到5条关键代谢通路(图6),分别为苯丙氨酸代谢、黄酮和黄酮醇的生物合成、异喹啉生物碱的生物合成、丙氨酸精氨酸脯氨酸代谢、天冬氨酸谷氨酸代谢。这5条代谢途径与氨基酸类、黄酮类物质的代谢和生物碱类等物质的生物合成有关,其中苯丙氨酸代谢的气泡颜色最深、气泡相对较大。苯丙氨酸属芳香族氨基酸,在体内经苯丙氨酸羟化酶催化后氧化成酪氨酸,并与酪氨酸一同合成重要的神经递质和激素,参与机体糖代谢和脂肪代谢。由此可见,植物乳杆菌发酵对辣木叶中氨基酸类物质的影响最显著。
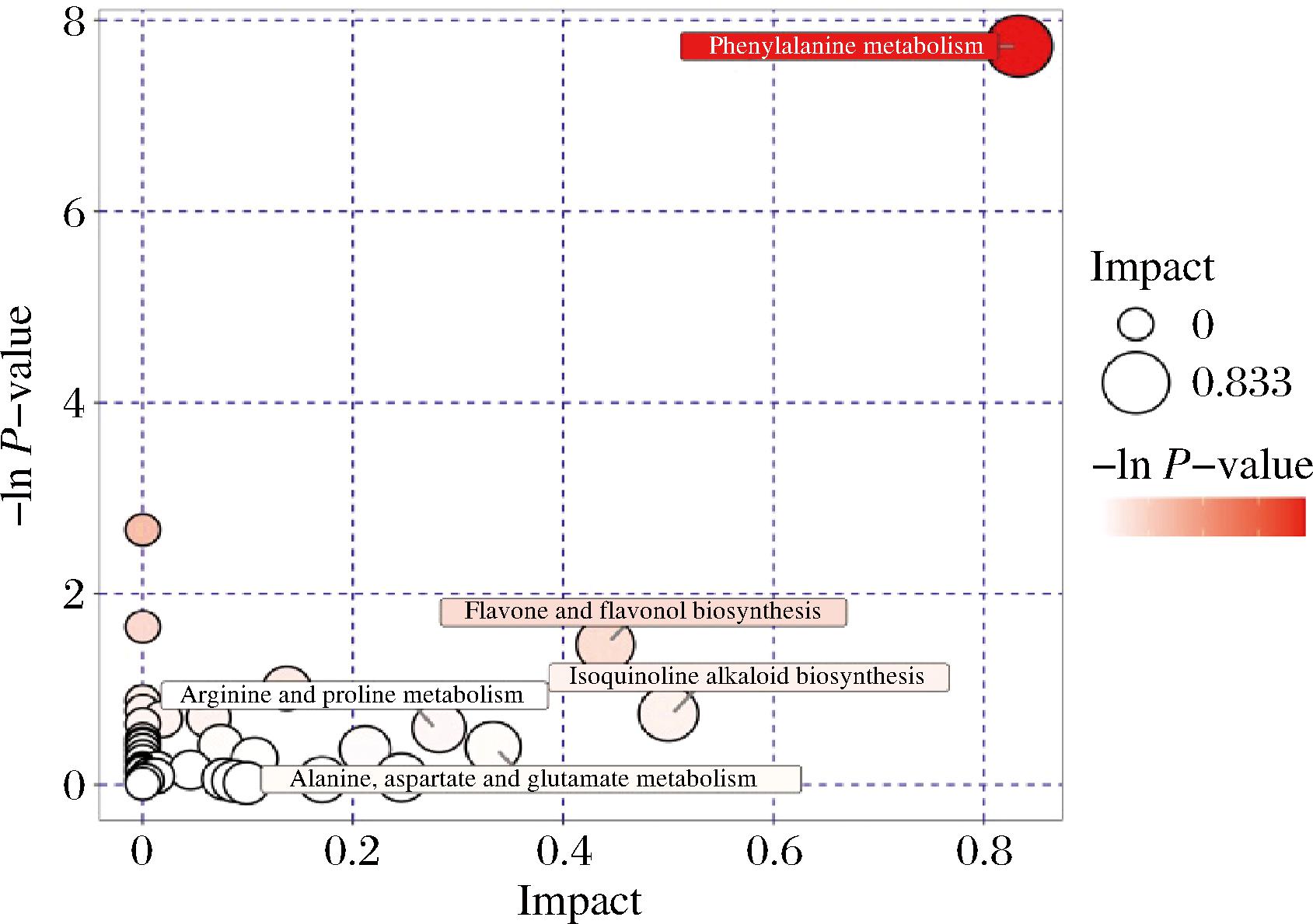
图6 辣木叶未发酵组对发酵组的关键通路分析图
Fig.6 Key pathway analysis of unfermented and fermented groups of M. oleifera leaves
3 结论
本研究以辣木叶为研究材料,探讨了植物乳杆菌发酵前后辣木叶的营养成分及代谢物的变化。结果表明,发酵提高了辣木叶中的蛋白质、黄酮、多酚、多糖含量,但辣木叶的抗氧化活性没有显著变化。基于UHPLC-OE-MS非靶标代谢组学技术,从未发酵和发酵的2组辣木叶中共鉴定出96种差异代谢物。通过对代谢通路进行分析,得到5条关键代谢通路,这些代谢途径与氨基酸类物质的代谢以及黄酮类、生物碱类物质的生物合成有关,表明植物乳杆菌发酵对辣木叶营养物质的形成、生物活性的提高具有积极的促进作用。本研究可为乳酸菌发酵辣木叶的代谢物鉴定提供理论依据,也为开发相关辣木叶功能食品提供理论参考。
[1] WANG F, BAO Y F, ZHANG C, et al.Bioactive components and anti-diabetic properties of Moringa oleifera Lam[J].Critical Reviews in Food Science and Nutrition, 2022, 62(14):3873-3897.
[2] 郭刚军, 胡小静, 徐荣, 等.辣木叶茶4种发酵方式不同发酵阶段化学成分与品质变化及其相关性分析[J].食品工业科技, 2021, 42(19):267-274.
GUO G J, HU X J, XU R, et al.Changes and correlations of chemical components and quality of Moringa oleifera leaf tea at different stages of four fermentation methods[J].Science and Technology of Food Industry, 2021, 42(19):267-274.
[3] DWIVEDI P, AGNIHOTRI A K, SHARMA S C.Moringa Oleifera: A plant with multiple medicinal uses[J].Chemical Weekly, 2007, 53(13):191-197.
[4] KASHYAP P, KUMAR S, RIAR C S, et al.Recent advances in drumstick (Moringa oleifera) leaves bioactive compounds:Composition, health benefits, bioaccessibility, and dietary applications[J].Antioxidants, 2022, 11(2):402.
[5] KHOR K Z, LIM V, MOSES E J, et al.The in vitro and in vivo anticancer properties of Moringa oleifera[J].Evidence-Based Complementary and Alternative Medicine, 2018, 2018:1-14.
[6] HASSAN M A, XU T, TIAN Y, et al.Health benefits and phenolic compounds of Moringa oleifera leaves:A comprehensive review[J].Phytomedicine, 2021, 93:153771.
[7] ABDULL RAZIS A F, IBRAHIM M D, KNTAYYA S B.Health benefits of Moringa oleifera[J].Asian Pacific Journal of Cancer Prevention, 2014, 15(20):8571-8576.
[8] SHI H H, SU B, CHEN X Y, et al.Solid state fermentation of Moringa oleifera leaf meal by mixed strains for the protein enrichment and the improvement of nutritional value[J].PeerJ, 2020, 8:e10358.
[9] CUI Y Y, LI J Z, DENG D, et al.Solid-state fermentation by Aspergillus niger and Trichoderma koningii improves the quality of tea dregs for use as feed additives[J].PLoS One, 2021, 16(11):e0260045.
[10] XIE P J, HUANG L X, ZHANG C H, et al.Nutrient assessment of olive leaf residues processed by solid-state fermentation as an innovative feedstuff additive[J].Journal of Applied Microbiology, 2016, 121(1):28-40.
[11] SHI C Y, HE J, YU J, et al.Solid state fermentation of rapeseed cake with Aspergillus niger for degrading glucosinolates and upgrading nutritional value[J].Journal of Animal Science and Biotechnology, 2015, 6(1):1-7.
[12] 张云娟, 田洋, 周学, 等.辣木叶毛霉固态发酵过程中主要营养成分及其抗氧化活性的动态变化研究[J].西南农业学报, 2019, 32(8):1773-1778.
ZHANG Y J, TIAN Y, ZHOU X, et al.Dynamic changes of main nutrients and antioxidant activities of Moringa oleifera leaves during solid state fermentation of Mucor[J].Southwest China Journal of Agricultural Sciences, 2019, 32(8):1773-1778.
[13] NAVEED M, HEJAZI V, ABBAS M, et al.Chlorogenic acid (CGA):A pharmacological review and call for further research[J].Biomedicine &Pharmacotherapy, 2018, 97:67-74.
[14] LU H J, TIAN Z M, CUI Y Y, et al.Chlorogenic acid:A comprehensive review of the dietary sources, processing effects, bioavailability, beneficial properties, mechanisms of action, and future directions[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(6):3130-3158.
[15] CHEN F, ZHANG H, ZHAO N, et al.Effect of chlorogenic acid on intestinal inflammation, antioxidant status, and microbial community of young hens challenged with acute heat stress[J].Animal Science Journal, 2021, 92(1), e13619.
[16] ZHANG J, LIU Y J, LIU L J.Hyperoside prevents sepsis-associated cardiac dysfunction through regulating cardiomyocyte viability and inflammation via inhibiting miR-21[J].Biomedicine &Pharmacotherapy, 2021, 138:111524.
[17] 张馨予, 苏建青, 褚秀玲.金丝桃苷-环糊精包合物的制备及其抗氧化活性研究[J].动物营养学报, 2022, 34(8):5426-5440.
ZHANG X Y, SU J Q, CHU X L.Preparation of hyperoside-cyclodextrin inclusion complex and its biological antioxidant activity[J].Chinese Journal of Animal Nutrition, 2022, 34(8):5426-5440.
[18] HUANG J Z, TONG X A, ZHANG L, et al.Hyperoside attenuates bleomycin-induced pulmonary fibrosis development in mice[J].Frontiers in Pharmacology, 2020, 11:550955.
[19] GUO X, ZHU C Z, LIU X J, et al.Hyperoside protects against heart failure-induced liver fibrosis in rats[J].Acta Histochemica, 2019, 121(7):804-811.
[20] 陈世春, 徐永祥, 韩伟超, 等.紫云英苷的药理特性及其作用机制研究进展[J].中华中医药学刊, 2022, 40(11):118-123;287.
CHEN S C, XU Y X, HAN W C, et al.Research progress on pharmacological properties and mechanism of astragalin[J].Chinese Archives of Traditional Chinese Medicine, 2022, 40(11):118-123;287.