泡菜是中国传统发酵食品,是将蔬菜浸泡在质量分数6%~8%的盐溶液中,在密闭环境中自然发酵数天所得,因其质地爽脆、香气宜人和健康益处而深受消费者欢迎,被誉为“国粹”[1-2]。泡菜主要通过乳酸菌发酵产酸降低pH值,与食盐的高渗透压共同抑制有害微生物的生长繁殖。
目前,在泡菜中已经鉴定和报道了几十种乳酸菌,主要为乳酸杆菌、魏斯氏菌、肠球菌和片球菌等菌属[3-4]。乳酸菌通常被认为是安全的微生物,无论是天然存在菌群,还是添加直投式发酵剂,都在食品发酵和保存中发挥着重要作用[5]。泡菜微生物的研究主要集中在缩短泡菜成熟期[6],减少亚硝酸盐[7-8],延长保质期,抑制致病菌[9-10],实现功能特性,改善感官质量[11]。母水发酵泡菜中丙二醇、甘油、甘露醇、乳酸和草酸等含量较高,且氨基酸种类更丰富,比自然发酵和接种发酵具有更好的风味和口感[12]。因泡菜母水中含有丰富的微生物,这些微生物是多轮使用后重新选择出来的,具有更好的发酵性能。接种发酵可缩短泡菜发酵周期、降低亚硝酸盐含量,但是发酵风味欠缺。已有文献在筛选优势发酵菌株时缺乏对菌株产风味物质的研究[6-8]。顶空-气相色谱-离子迁移谱(headspace gas chromatography-ion mobility spectroscopy,HS-GC-IMS)可以提高风味检测的准确性和灵敏度,有效解决GC-MS分析速度慢和前处理导致挥发性物质损失的问题[13]。近年来,GC-IMS已广泛应用于食品风味分析和质量检验等许多领域[14-15]。
本课题组前期利用高通量测序技术对传统发酵四川泡菜母水中的优势微生物群落进行了研究,结果发现乳杆菌属和片球菌属是泡菜中的优势微生物。本研究从四川传统发酵泡菜母水中分离纯化出来的乳酸菌株中筛选出优势菌株,并探究其生长性能、产酸能力、耐盐能力、耐亚硝酸及发酵产香的能力,以筛选出有可能用于泡菜发酵的乳酸菌,为其工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
实验所用菌株均分离自四川成都传统发酵风味较好的萝卜泡菜母水,萝卜泡菜母水信息见表1。类肠膜魏斯氏菌(Weissella paramesenteroides)CICC 24392购买于中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC),作为标准菌株W0。
表1 萝卜泡菜母水样品信息
Table 1 Sample information of radish pickle brines

原料品种采样地点发酵时间心里美萝卜四川成都蒲江县1年心里美萝卜四川成都大邑县2年心里美萝卜四川成都大邑县4年樱桃萝卜四川成都郫都区2年心里美萝卜四川成都金堂县3年
MRS琼脂培养基、MRS肉汤培养基、细菌 DNA 试剂盒,北京索莱宝公司;NaOH标准滴定溶液,上海麦克林生化科技有限公司;酚酞、对氨基苯磺酸、盐酸萘乙二胺、NaNO2等化学试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
BX53光学显微镜,日本奥林巴斯株式会社;Bioscreen C微生物生长曲线分析仪,芬兰Bioscreen公司;PHSJ-3F pH计,上海雷磁仪器厂;UV9100紫外可见光分光光度计, 北京莱伯泰科有限公司;FlavourSpecc®气相色谱-离子迁移谱联用仪,德国G.A.S.公司。
1.3 实验方法
1.3.1 菌株的分离纯化
取泡菜母水加入到MRS肉汤培养基中,37 ℃恒温培养24 h进行富集。取菌株富集液10 mL于无菌锥形瓶中,加入90 mL生理盐水,振荡混匀后,进行梯度稀释,吸取100 μL涂布于含有CaCO3的MRS培养基平板上,37 ℃培养48 h。挑取有溶钙圈的菌株多次划线纯化,按照菌落形态学进行分类,三代划线分离后得到纯菌株[16]。经生理生化实验,筛选出过氧化酶实验、吲哚实验、硫化氢实验均为阴性的革兰氏阳性菌株,4 ℃保藏待用。
1.3.2 16S rDNA分子鉴定
使用细菌基因组DNA提取试剂盒,按照说明书进行操作。使用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR扩增条件:35个循环(94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min),72 ℃末端延伸10 min,终止反应(4 ℃,∞)。吸取10 μL的PCR产物,加入2 μL 6×Loading Buffer混匀进行2%(质量分数)琼脂糖凝胶电泳,将出现目标条带的PCR样品纯化后送至生工生物工程(上海)股份有限公司进行16S rDNA测序。测序结果提交至GenBank数据库中,利用BLAST比对并进行序列同源性分析,构建发育树(MEGA 11软件)。
1.3.3 发酵特性
1.3.3.1 菌株生长曲线
将活化菌株接种无菌微孔板中每孔加入180 μL MRS肉汤培养基,取106 CFU/mL菌悬液20 μL接种至孔中并吹打混匀,每株菌平行5次实验,无菌MRS肉汤作为对照。将微孔板放入微生物生长测定仪中37 ℃静置培养,每1 h测定其OD600nm值,测量前振荡60 s使菌体悬浮。Gompertz模型拟合按参考文献[17]方法。
1.3.3.2 产酸性能测定
将活化菌株以体积分数为2%的接种量接种于MRS肉汤中,37 ℃培养72 h。间隔一定时间采用pH计测定发酵液pH值,总酸含量测定按照GB 12456—2021《食品安全国家标准 食品中总酸的测定》。
1.3.4 耐受性实验
参考FESSARD等[18]的方法并修改,耐受性实验结果以lg (OD24/OD0)表示:+++表示lg (OD24/OD0)>0.5为高速增长;++ 表示0.3
1.3.4.1 耐盐能力测定
将活化菌株以体积分数为2%的接种量,接入含有2%、4%、6%、8%、10%、12%(质量分数,下同)NaCl的MRS肉汤中,加入到无菌微孔板中,每孔300 μL,无菌MRS肉汤作为对照,将微孔板放入微生物生长测定仪中37 ℃静置培养,测量前振荡60 s,测定0和24 h的OD600nm值。
1.3.4.2 耐亚硝酸盐能力测定
将活化菌株以体积分数为2%的接种量,接入含有5、10、15、20、25、30 mg/L NaNO2的MRS肉汤中,加入无菌微孔板中每孔300 μL,无菌MRS肉汤作为对照,将微孔板放入微生物生长测定仪中37 ℃静置培养,测量前振荡60 s,测定0和24 h的OD600nm值。
1.3.5 降解亚硝酸盐能力测定
将活化菌株以体积分数为2% 的接种量,接种到含有200 mg/L NaNO2的MRS肉汤中,在37 ℃下培养48 h后,发酵液待测。
按照 GB /T 5009.33—2010《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》中的分光光度法测定并绘制亚硝酸盐含量标准曲线,根据标准曲线计算亚硝酸盐含量。
参考熊蝶等[19]的方法,亚硝酸盐降解率按公式(1)计算:
(1)
式中:X,亚硝酸盐的降解率,%;m1,菌株发酵48 h后培养基中NaNO2的质量,mg;m0,初始培养基中的NaNO2的质量,mg。
1.3.6 挥发性风味物质测定
将菌株以体积分数为2%的接种量接种于MRS肉汤培养基中37 ℃厌氧培养48 h,以8 000 r/min离心2 min,取上清液待测[20]。利用GC-IMS检测菌株发酵后产生的挥发性风味物质[21]。
自动进样条件:准确吸取1 mL样品置于20 mL顶空瓶中,孵育温度40 ℃,孵化转速500 r/min,孵育时间15 min,采用顶空自动进样的方式,进样量500 μL,进样针温度65 ℃,不分流模式进样。
GC条件:采用强极性色谱柱MXT-WAX(30 m×0.53 mm, 1 μm),柱温60 ℃,载气N2(≥99.999%),载气的流速程序:起始流速2 mL/min,保持2 min,8 min内升至10 mL/min,然后10 min内升至100 mL/min并保持10 min,运行时间30 min。迁移管温度45 ℃,分析时间30 min。
数据分析:使用HS-GC-IMS仪器内置的NIST数据库和IMS数据库对挥发性化合物进行定性分析,运用Gallery Plot插件生成指纹图谱。采用半定量的方法计算各挥发性物质相对占比。
1.4 统计分析
实验重复测定3次,结果以平均值±标准差表示。通过统计软件SPSS 26中进行方差分析及显著性分析(置信区间为95%),利用Origin 2022b软件绘图。
2 结果与分析
2.1 乳酸菌分离纯化与初筛结果
从5种泡菜母水中共分离出36株菌株。通过含有CaCO3的MRS 固体培养基对富集液中的菌株进行初筛,挑取有溶钙圈的菌株多次划线纯化,以筛选疑似乳酸菌。对疑似菌株进行形态学分类,革兰氏染色及部分生理生化实验,结果见表2。共发现过氧化氢酶实验、吲哚实验、H2S实验均为阴性和革兰氏阳性菌株30株,初步鉴定为乳酸菌,编号为L1~L30。乳酸菌初筛分为5个类别,每种取代表性菌株进行分析,其中1种球菌和4种杆菌。
表2 泡菜样品中分离乳酸菌的形态及部分生理生化特征
Table 2 Morphology, physiological and biochemical traits of LABs isolated from pickles

注:“+”阳性反应;“-”阴性反应。
项目菌落特征菌体特征革兰氏染色过氧化氢酶实验吲哚实验H2S实验分离到的菌株数代表性菌株编号1圆形,乳白色,边缘整齐,不透明杆状,成对或成链+---2L22圆形,乳白色,边缘整齐,不透明杆状,成链+---1L33圆形,乳白色,小菌落,边缘整齐,不透明球形,成对或成链+---7L74圆形,乳白色,边缘整齐,湿润,不透明杆状,成对或成链+---12L155圆形,乳白色,边缘整齐,湿润,不透明杆状,成对或成链+---8L24
2.2 菌株的16S rDNA鉴定结果
将5株代表性菌株的16S rDNA部分基因序列提交至NCBI数据库进行BLAST同源性比对,选取相似性高于99%的菌株序列构建系统发育树(见图1)。由图1可知,L2、L3、L7、L15和L24分别与布氏乳杆菌(Lactobacillus buchneri)、短乳杆菌(Lactobacillus brevis)、乳酸片球菌(Pediococcus acidilactici)、植物乳植杆菌(Lactiplantibacillus plantarun)和鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus)的亲缘关系最近。
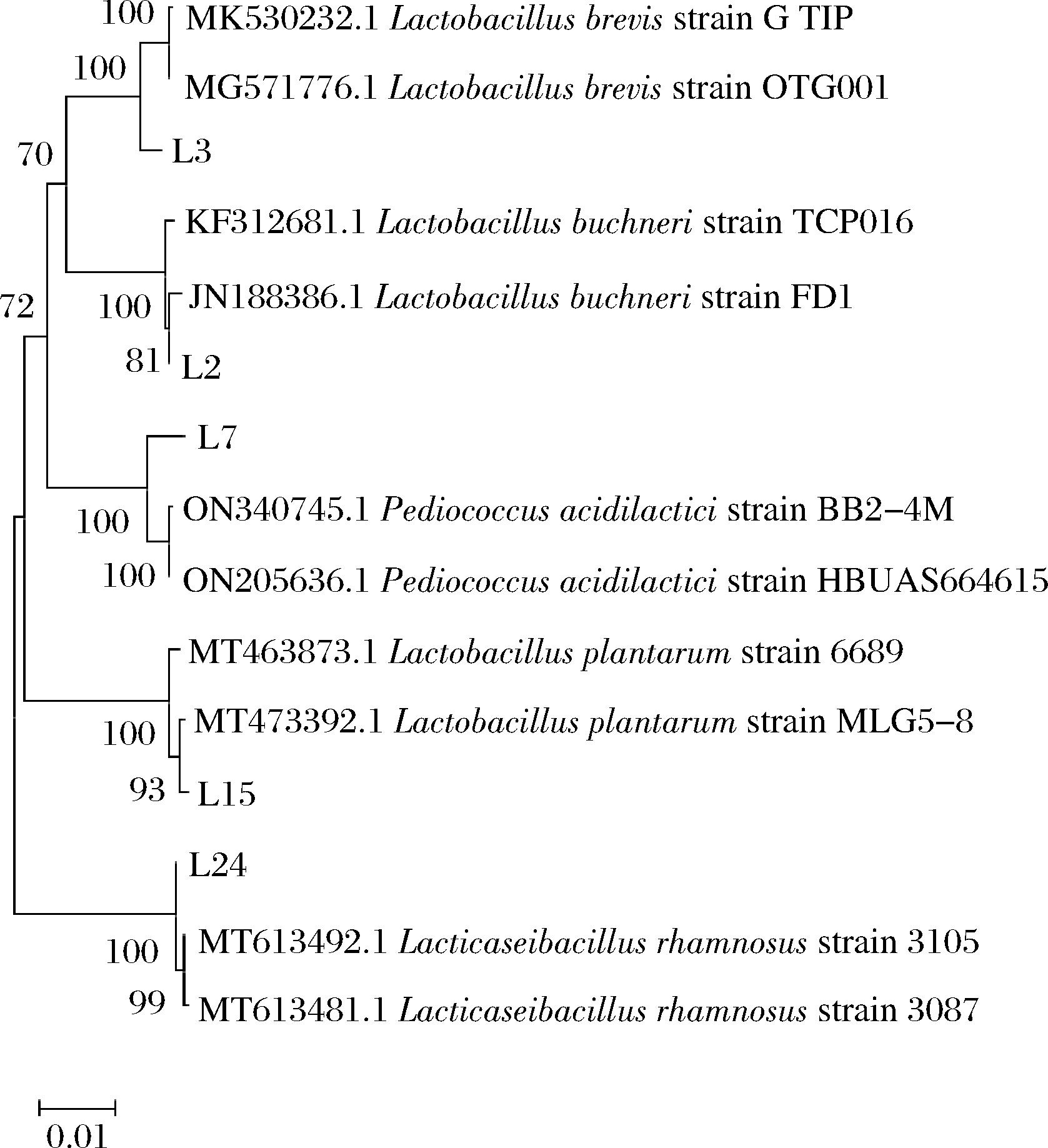
图1 LAB的系统发育树
Fig.1 Phylogenetic tree of LABs
2.3 乳酸菌生长能力与产酸能力
为了直观评价5株目标乳酸菌的发酵性能,选择中国工业微生物菌种保藏管理中心中推荐的传统泡菜发酵菌种类肠膜魏斯氏菌作为对照菌株,编号为W0。由图2-a可知,W0和L15菌株对数期为0~10 h,在10 h后进入稳定期;L7和L15对数期为0~15 h,在15 h后进入稳定期;L2和L3对数期为0~21 h,在21 h后进入稳定期。在达到稳定期后,5株目标菌株的OD值均高于标准菌株W0,其中L15和L24的OD值较高分别为1.5和1.8。通过修正Gompertz模型进行拟合,结果见图2-b。L15和L24的最大比生长速率最高可达0.07 h-1左右,但L24有较长的迟滞期(3.04 h)。L15的迟滞期为1.32 h,比W0的迟滞期(1.18 h)长,但显著短于其余菌株(P<0.05)。因此,5株乳酸菌生长能力均较好,L15和L24具有最大生长比速率和较短迟滞期,更适合作为泡菜发酵菌株。
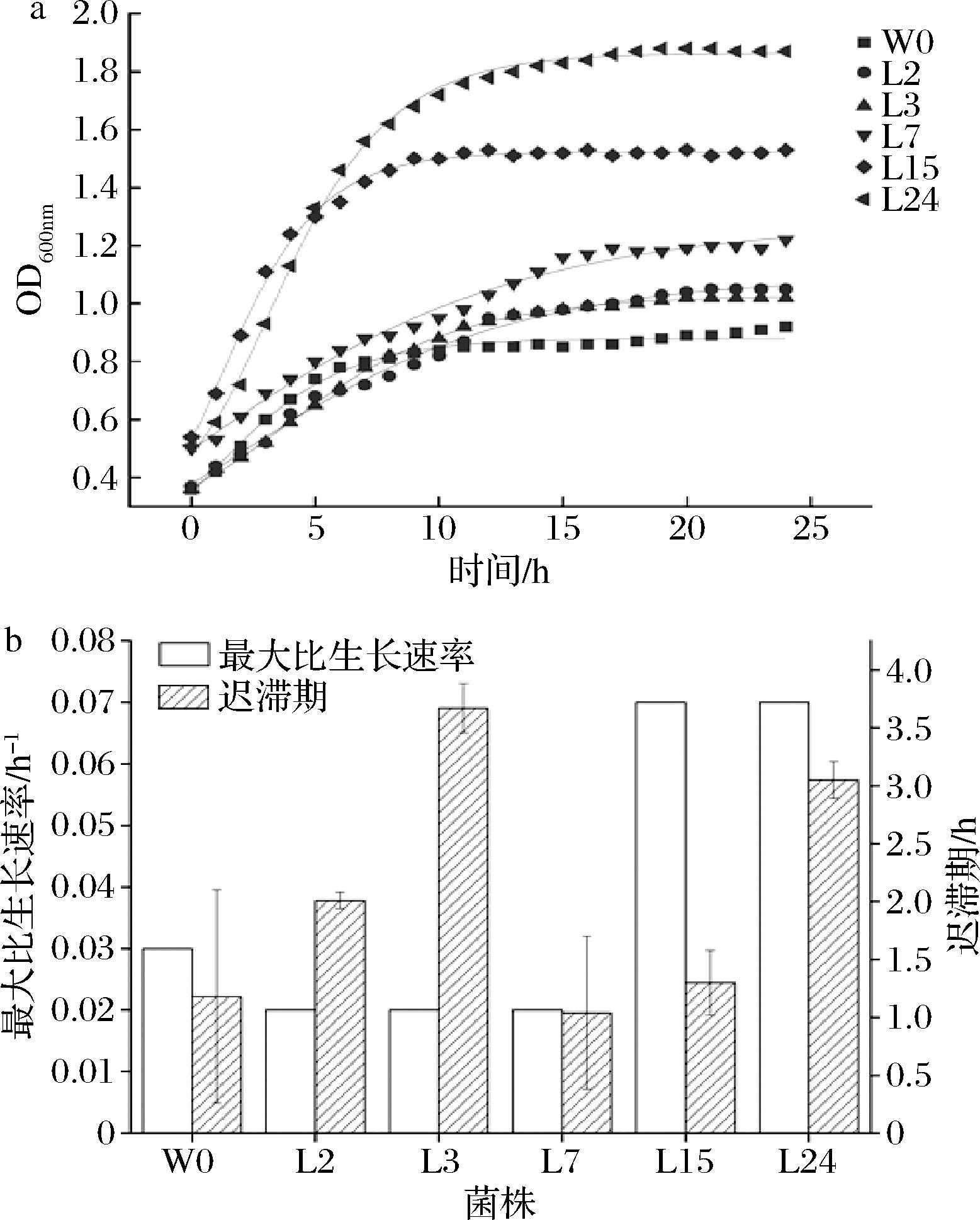
a-生长曲线;b-模型拟合
图2 目标乳酸菌生长曲线和模型拟合
Fig.2 Growth curve and model fitting of target LABs
乳酸菌可以利用碳水化合物产生乳酸等有机酸,带来泡菜独特的酸爽风味,并使pH值快速下降,从而达到抑制有害微生物的作用[22]。从图3可看出,菌株处于生长对数期时,微生物含量不断增加,并持续产酸,使总酸含量快速增加,pH值持续下降。乳酸菌生长进入稳定期后,pH值趋于平缓。L7、L15和L24产酸能力较强,发酵至48 h时pH 值降至3.75,产总酸在72 h后可达到2.00 g/100 mL;L2和L3与W0产酸能力接近,pH发酵至稳定期时pH值降至4.20,但因它们生长速率慢于W0,产酸速率也较慢。结果表明,L7、L15和L24具有较强的产酸能力,其中L24产酸能力最强,可能因为生长速度较快,这有利于乳酸等有机酸的快速积累,以抑制有害微生物生长繁殖。ZHU等[23]利用高通量测序手段从多种传统发酵食品中筛选一批产酸菌株,发现鼠李糖乳酪杆菌产酸能力较好,与本研究结果一致。

a-pH值;b-总酸含量
图3 六株乳酸菌生长过程中pH值和总酸含量的变化
Fig.3 Changes of pH value and total acid content during the growth of six LAB strains

图4 GC-IMS指纹图谱
Fig.4 GC-IMS fingerprint plot
注:M表示单体,D表示二聚体,数字表示未定性物质。
2.4 乳酸菌耐受性
2.4.1 耐盐能力
盐含量使泡菜具有较高的渗透压,抑制腐败菌的生长,有利于泡菜的保存,因此发酵菌株对盐含量的耐受性非常重要[24-25]。由表3可知,随着盐含量的不断升高,各菌株生长速度也随之减少。菌株L15和L24的耐盐能力较好,8%盐含量时菌株生长速度可达到中等增长,但在10%和12%条件下,菌株耐受性能力开始显著下降。L3在6%盐含量时可以较好生长,但8%时增长速度显著下降。L2和L7在6%盐含量时生长状态为低速增长,对盐含量的耐受能力较差。W0的耐受性最差,在4%盐含量时只能低速增长。目标菌株具有较好的盐含量耐受性,可能因为泡菜母水中高渗透压环境的驯化。欧雪等[26]采用不同盐含量(2%、5%、8%,质量分数)接种发酵泡菜,结果8%盐含量的微生物生长较差且风味较差,与本实验研究结果一致。
表3 菌株对NaCl的耐受性
Table 3 Tolerance of strain to NaCl
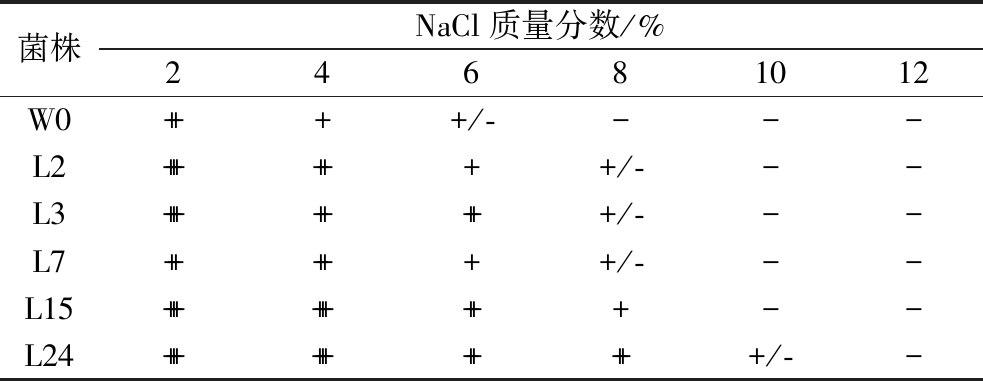
注:耐受性实验结果以lg(OD24/OD0)表示:+++ 表示高速增长;++ 表示中等增长;+表示低增长;+/-表示差增长;-表示没有生长。
菌株NaCl质量分数/%2 4 6 8 10 12W0++++/----L2+++++++/---L3++++++++/---L7++++++/---L15+++++++++--L24+++++++++++/--
2.4.2 耐亚硝酸盐能力
泡菜发酵过程中会产生亚硝酸盐,因此泡菜发酵菌株需对亚硝酸盐有一定耐受性。对不同菌株在5~30 mg/L的NaNO2耐受性进行研究,结果见表4。随着亚硝酸盐含量的增加,各菌株的生长量均无变化,可见各菌株对亚硝酸盐均具有较好的耐受性。在同一浓度亚硝酸盐的胁迫压力下,只有L7菌株中速增长,与其他菌株的耐受性存在差异性。
表4 菌株对亚硝酸盐的耐受性
Table 4 Tolerance of strain to nitrite
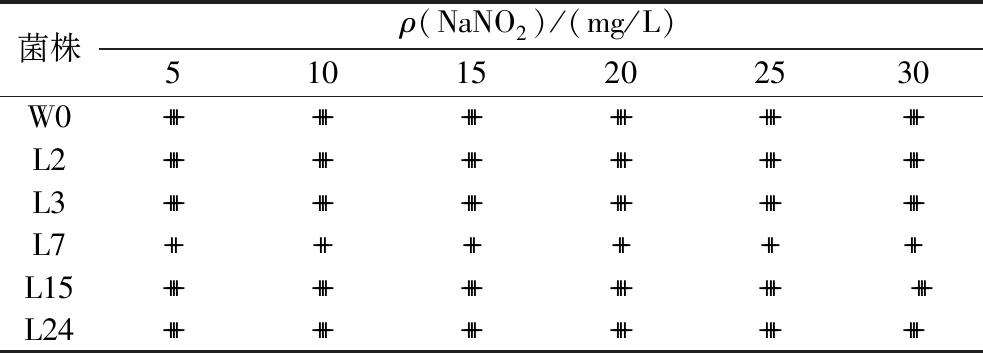
注:耐受性实验结果以lg (OD24/OD0)表示:+++ 表示高速增长;++ 表示中等增长。
菌株ρ(NaNO2)/(mg/L)51015202530W0++++++++++++++++++L2++++++++++++++++++L3++++++++++++++++++L7++++++++++++L15++++++++++++++++++L24++++++++++++++++++
表5 各菌株培养48 h后对NaNO2的降解率
Table 5 The degradation rates of strains to NaNO2 after 48 h culture
注:同列数据肩标不同小写字母表示差异显著(P<0.05)。
项目W0L2L3L7L15L24降解率/%99.51±0.17b99.64±0.01a99.52±0.03a90.03±0.06e91.63±0.08d93.87±0.02c
2.5 降亚硝酸盐能力
泡菜发酵过程中由于杂菌所含的硝酸还原酶导致亚硝酸盐含量的增加[27],根据GB 2762—2022《食品安全国家标准 食品中污染物限量》对于蔬菜及其制品(腌渍蔬菜)的规定,亚硝酸盐含量不得超过20 mg/kg,因此菌种对亚硝酸盐的降解能力非常重要。实验结果表明5株目标菌株和1株对照菌株均具有较高的降解 NaNO2 的能力,降解率都达到90.00%以上,其中L2和L3降解能力更强,与其余菌株存在显著性差异(P<0.05)。
2.6 挥发性风味物质测定
挥发性风味是衡量泡菜品质的一个重要指标,故研究泡菜发酵菌种产挥发性风味物质能力是筛选泡菜发酵菌种的重要指标。通过 GC-IMS 技术在接种菌株培养48 h的发酵液中共定性了27种挥发性风味物质(包括单体和二聚体),其中酸类1种、醇类9种、酯类8种、酮类4种、醛类4种和其他物质1种。为对比不同菌株发酵液产生的挥发性风味物质区别,采用Gallery Plot插件生成指纹图谱。在指纹图谱中,每一列代表同一挥发性有机物在不同样品中的信号峰,每一行代表一个样品中的全部挥发性风味物质。为了方便观察比较,将变化规律相似的物质排在一起比较。由图5可知,5种目标菌株都比对照菌株W0产生挥发性物质种类更多。L2的特征挥发性物质主要有乙酸乙酯二聚体、丙烯腈、乙酸和环己酮等物质,其中环己酮具有薄荷香气。L3特征挥发性物质是2-丁酮单体、叔丁醇、2-甲基丁醛二聚体、乙酸和乙偶姻等物质。2-甲基丁醛二聚体和1-戊醇代表L7菌株发酵液的特征挥发性物质。异戊烯醛、反-2-己烯醛、庚醛和甲酸乙酯单体是L15的特征风味物质。1-丁醇、乙酸异丙酯二聚体、甲酸乙酯二聚体、3-甲氧基-3-甲基丁醇、异丁醇、1-丙醇单体、乙酸丁酯是L24菌株发酵后所具有的特征挥发性物质。丙酮、2-甲基丁醛单体、乙醇、乙酸乙酯单体、乙酸甲酯为6株菌株发酵所共有挥发性物质。
为进一步研究6株菌株产挥发性物质的差异性,通过峰体积归一化法对各样品中挥发性风味物质的组成进行分析,详细见电子增强出版附件(https://doi.org/10.13995/j.cnki.11-1802/ts.035228)。从化合物类别来看,W0样品中醛类物质占比最高,具有水果特征香气;L3样品中酮类物质占比最高,显著高于其他样品(P<0.05),可以产生薄荷香气等刺激性气味;L15样品中醇类物质占比最高,其中乙醇相对含量显著高于其他组别(P<0.05);L24样品中酯类物质的占比最高,主要是乙酸丁酯、2-甲基丁酸甲酯和乙酸异戊酯的相对含量显著高于其他组,酯类物质提供香蕉、菠萝苹果等香气。这表明菌株产风味物质的能力具有差异性。各菌株所产特征挥发性物质也存在差异。W0可以产生更多2-甲基丁醛单体(9.23±0.10)%和丁酸乙酯(1.02±0.05)%,显著高于其他组别,可以产生果子香气;L2样品中检测到乙酸异丙酯单体含量高(1.46±0.09)%;L3菌株可以产生更多叔丁醇、环己酮和乙偶姻;L7菌株的1-戊烯-3-醇、丙烯腈和1-戊醇含量最高;L15菌株产1-丙醇、乙醇、1-丁醇、3-甲氧基-3-甲基丁醇、异丁醇、乙酸乙酯、乙酸甲酯、甲酸乙酯、乙酸异丙酯二聚体、2-丁酮的相对含量显著高于其他菌株(P<0.05);L24菌株可以产生更多乙酸丁酯、2-甲基丁酸甲酯、1-丙硫醇单体、丙烯腈等物质,其中2-甲基丁酸甲酯相对含量为(16.06±1.23)%显著高于其他菌株(P<0.05),具有青苹果样香气。
3 结论
为丰富传统四川泡菜发酵菌种库,对四川成都地区泡菜发酵母水优势菌株筛选,分离得到30株菌,经过16S rDNA序列同源性分析,得到2株布氏乳杆菌、1株短乳杆菌、7株乳酸片球菌、12株植物乳植杆菌和8株鼠李糖乳酪杆菌。进一步对5种乳酸菌生长曲线和产酸曲线测定以及对NaCl和亚硝酸盐的耐受性实验,与标准菌株W0进行对比。结果发现,L7、L15和L24具有更好的生长繁殖和产酸能力;L3、L15和L24对NaCl的耐受性强,其中L24在10%(质量分数)NaCl还能保持低速增长;L7对亚硝酸盐的耐受性较差与其他菌株存在显著性差异;5株乳酸菌均具有90%以上的亚硝酸盐降解能力。从菌株发酵液中共检测出27种挥发性成分,其中L3样品中酮类物质含量最高;L15样品中醇类物质含量最高;L24样品中酯类物质的含量最高,主要是乙酸丁酯、2-甲基丁酸甲酯和乙酸异戊酯的相对含量显著高于其他组,酯类物质提供香蕉、菠萝、苹果等香气。综上所述, L15和L24具有良好的发酵特性和产挥发性物质种类丰富,L2和L3可以产较多酮类物质,L7可以产生较多的1-戊烯-3-醇和1-戊醇,因此5种乳酸菌具有发酵泡菜潜能,可作为发酵泡菜功能菌株资源。
[1] 陈功. 试论中国泡菜历史与发展[J].食品与发酵科技, 2010, 46(3):1-5.
CHEN G.The history and development of Chinese pickles[J].Food and Fermentation Technology, 2010, 46(3):1-5.
[2] LIU L, TAO Y F, LI Y F, et al.Isolation and characterization of bacteria that produce quorum sensing molecules during the fermentation and deterioration of pickles[J].International Journal of Food Microbiology, 2022, 379:109869.
[3] 汪冬冬, 唐垚, 伍亚龙, 等.泡菜细菌多样性和风味成分研究进展[J].食品与发酵工业, 2021, 47(21):296-302.
WANG D D, TANG Y, WU Y L, et al.Advances on bacterial diversity and flavor of Paocai[J].Food and Fermentation Industries, 2021, 47(21):296-302.
[4] XIONG T, GUAN Q Q, SONG S H, et al.Dynamic changes of lactic acid bacteria flora during Chinese sauerkraut fermentation[J].Food Control, 2012, 26(1):178-181.
[5] LIU A P, LI X Y, PU B A, et al.Use of psychrotolerant lactic acid bacteria (Lactobacillus spp.and Leuconostoc spp.) isolated from Chinese traditional Paocai for the quality improvement of Paocai products[J].Journal of Agricultural and Food Chemistry, 2017, 65(12):2580-2587.
[6] 吴伟杰, 郜海燕, 陈杭君, 等.白萝卜泡菜发酵菌株乳酸肠球菌WJ03的分离筛选与应用[J].中国食品学报, 2017, 17(12):86-94.
WU W J, GAO H Y, CHEN H J, et al.Isolation and identification of Enterococcus lactis WJ03 for radish pickle fermentation[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(12):86-94.
[7] HUANG Y Y, JIA X Z, YU J J, et al.Effect of different lactic acid bacteria on nitrite degradation, volatile profiles, and sensory quality in Chinese traditional Paocai[J].LWT, 2021, 147:111597.
[8] 王英, 周剑忠, 李清, 等.植物乳杆菌SD-7的分离鉴定及其亚硝酸盐降解特性[J].中国食品学报, 2016, 16(7):97-104.
WANG Y, ZHOU J Z, LI Q, et al.Isolation and identification of Lactobacillus plantarum strain SD-7 and its nitrite degradation characteristics[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(7):97-104.
[9] 刘义, 周火祥, 曹瑜, 等.一株泡菜产细菌素乳酸菌的鉴定[J].应用与环境生物学报, 2020, 26(6):1460-1465.
LIU Y, ZHOU H X, CAO Y, et al.Identification of bacteriocin-producing Lactobacillus from pickle[J].Chinese Journal of Applied and Environmental Biology, 2020, 26(6):1460-1465.
[10] QIAO X X, DU R P, WANG Y, et al.Isolation, characterisation and fermentation optimisation of bacteriocin-producing Enterococcus faecium[J].Waste and Biomass Valorization, 2020, 11(7):3173-3181.
[11] WANG D D, CHEN G, TANG Y, et al.Study of bacterial community succession and reconstruction of the core lactic acid bacteria to enhance the flavor of Paocai[J].International Journal of Food Microbiology, 2022, 375:109702.
[12] 鲜双, 姜林君, 李艳兰, 等.不同方式发酵的哈密瓜幼果泡菜理化特性和氨基酸含量分析[J].食品与发酵工业, 2021, 47(5):224-230.
XIAN S, JIANG L J, LI Y L, et al.Physicochemical properties and amino acid content of Hami melon fruitlet pickles fermented by different processes[J].Food and Fermentation Industries, 2021, 47(5):224-230.
[13] LI Y, YUAN L, LIU H J, et al.Analysis of the changes of volatile flavor compounds in a traditional Chinese shrimp paste during fermentation based on electronic nose, SPME-GC-MS and HS-GC-IMS[J].Food Science and Human Wellness, 2023, 12(1):173-182.
[14] 付勋, 张海彬, 聂青玉, 等.猕猴桃品质指标差异分析及GC-IMS分析果汁中挥发性物质[J].食品科学, 2022, 43(10):247-254.
FU X, ZHANG H B, NIE Q Y, et al.Different varieties of kiwifruit:Analysis of differences in quality indexes and volatile components in juice by gas chromatography-ion mobility spectrometry[J].Food Science, 2022, 43(10):247-254.
[15] 张卜升, 高杏, 闫昕, 等.基于GC-IMS技术分析石榴果酒酿制过程中挥发性风味成分的变化[J].食品与发酵工业, 2022, 48(7):252-257.
ZHANG B S, GAO X, YAN X, et al.Changes of volatile flavor components during brewing of pomegranate wine based on GC-IMS[J].Food and Fermentation Industries, 2022, 48(7):252-257.
[16] 戴志伟, 孔令明, 刘伟, 等.西梅发酵乳酸菌的筛选、鉴定及其抗氧化特性研究[J].中国食品学报, 2022, 22(7):310-318.
DAI Z W, KONG L M, LIU W, et al.Screening and identification of lactic acid bacteria fermenting prunes and studies on their antioxidant properties[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(7):310-318.
[17] 张秀洁, 郭全友, 杨絮, 等.源自香糟大黄鱼的红酒糟优势菌特性及发酵能力研究[J].食品与发酵工业, 2022, 48(11):50-57.
ZHANG X J, GUO Q Y, YANG X, et al.Characterization and fermentation capacity of dominant strains in red vinasse from vinasse large yellow croaker[J].Food and Fermentation Industries, 2022, 48(11):50-57.
[18] FESSARD A, REMIZE F.Genetic and technological characterization of lactic acid bacteria isolated from tropically grown fruits and vegetables[J].International Journal of Food Microbiology, 2019, 301:61-72.
[19] 熊蝶, 袁岚玉, 李媛媛, 等.陕西泡菜中降解亚硝酸盐乳酸菌的筛选及其发酵特性与耐受性研究[J].食品与发酵工业, 2021, 47(6):139-144.
XIONG D, YUAN L Y, LI Y Y, et al.Screening, fermentation characteristics and tolerance of nitrite-degrading lactic acid bacteria in Shaanxi Paocai[J].Food and Fermentation Industries, 2021, 47(6):139-144.
[20] TIAN T T, WU D H, NG C T, et al.A multiple-step strategy for screening Saccharomyces cerevisiae strains with improved acid tolerance and aroma profiles[J].Applied Microbiology and Biotechnology, 2020, 104(7):3097-3107.
[21] 张二豪, 何萍, 刘盼盼, 等.西藏沙棘酵母菌的分离鉴定及其产香特性分析[J].食品科学, 2022, 43(20):207-215.
ZHANG E H, HE P, LIU P P, et al.Isolation and identification of yeast from Tibet seabuckthorn and analysis of its aroma-producing characteristics[J].Food Science, 2022, 43(20):207-215.
[22] 罗强, 李幸洋, 陈炼红, 等.传统发酵泡菜中乳酸菌种群组成及优良菌株产酸耐酸特性分析[J].食品科学, 2021, 42(2):158-163.
LUO Q, LI X Y, CHEN L H, et al.Composition of lactic acid bacteria in traditional Chinese pickles and analysis of acid production and acid tolerance characteristics of excellent strains[J].Food Science, 2021, 42(2):158-163.
[23] ZHU L J, ZHANG H, WANG S Y, et al.Screening a panel of acid-producing strains by developing a high-throughput method[J].Biotechnology and Bioprocess Engineering, 2022, 27(5):810-817.
[24] 毛丙永, 殷瑞敏, 赵楠, 等.四川老卤泡菜基本理化指标及特征菌群分离鉴定[J].食品与发酵工业, 2018, 44(11):22-27.
MAO B Y, YIN R M, ZHAO N, et al.The physical and chemical properties of Sichuan old brined Paocai and the isolation of characteristic microbes[J].Food and Fermentation Industries, 2018, 44(11):22-27.
[25] 柳青, 史迪, 刘文俊, 等.摩洛哥自然发酵驼乳中乳酸菌分离鉴定及特性研究[J].食品科学技术学报, 2022, 40(4):85-95;137.
LIU Q, SHI D, LIU W J, et al.Isolation, identification and characterization of lactic acid bacteria from Moroccan naturally fermented camel milk[J].Journal of Food Science and Technology, 2022, 40(4):85-95;137.
[26] 欧雪, 吴梦西, 廖一漠, 等.不同盐浓度对接种发酵萝卜泡菜品质的影响[J].四川农业大学学报, 2022, 40(3):438-448.
OU X, WU M X, LIAO Y M, et al.Effects of different salt concentrations on the quality of radish pickles produced by inoculated fermentation[J].Journal of Sichuan Agricultural University, 2022, 40(3):438-448.
[27] 葛焱, 郭双霜, 陈安均.泡菜中亚硝酸盐消长规律及调控技术研究进展[J].食品工业科技, 2015, 36(4):382-385;390.
GE Y, GUO S S, CHEN A J.Research progress of dynamic change and control technology of nitrite in pickle[J].Science and Technology of Food Industry, 2015, 36(4):382-385;390.