纳米银(silver nanopartcicles, AgNPs)是指尺寸在1~100 nm的粒子,由于AgNPs具有稳定的物理和化学性能,其在电子、光学、抗菌、催化等方面的应用受到越来越多的关注[1]。AgNPs的制备方法有物理、化学、生物法3种[2],物理和化学合成法对环境会造成一定的污染,存在反应的条件苛刻、生成的AgNPs不稳定等问题[3], 近年来,利用内生真菌生物合成AgNPs被广泛关注,真菌可以分泌大量合成AgNPs相关的胞外酶、多肽类物质及次级代谢产物等,在合成过程中,这些物质可以充当还原剂角色还原Ag+为AgNPs[4],传统的物理和化学方法合成AgNPs,其能耗高且使用有毒的化学试剂,采用内生真菌生物合成AgNPs具有绿色环保、有利于对合成条件的优化、使用的设备简单、花费低等优点,表现出工业化的潜力[5-6]。
臭常山(Orixa japonica Thunb.)为芸香科臭常山属植物,在《贵州民间方药集》《贵阳民间药草》《贵州草药》中称为臭山羊、大山羊[7],其根、茎、叶入药,主治风热感冒、疟疾等病症[8]。本研究以课题组前期从臭常山茎中分离得到的一株内生真菌Diaporthe orixae sp.nov.[9]为研究对象,对其进行生物合成AgNPs的条件优化,并对AgNPs的表征和催化作用进行阐述和分析,为进一步利用内生真菌生物合成金属纳米材料提供理论依据和技术支持。
1 材料与方法
1.1 菌株
本实验所用菌株Diaporthe orixae sp.nov.为本课题组前期从臭常山茎中分离得到[9],已鉴定(GenBank登录号:No.OK293041)并保存于中国科学院昆明植物研究所和贵州省农业科学院的植物标本室。
1.2 主要试剂和仪器
AgNO3,国药集团化学试剂有限公司;KBH4,郑州银丰化验试剂有限公司;4-硝基苯酚(4-nitrophenol, 4-NP), 阿拉丁(上海)有限公司;甲基橙、亚甲基蓝,天津市致远化学试剂有限公司,以上试剂均为分析纯。
UV1901PC型紫外可见分光光度计,上海奥析科学仪器有限公司;L550型离心机,湖南湘仪实验室仪器开发有限公司;ZEISS sigma500型场发射扫描电镜,德国蔡司公司;iS5型傅里叶变换红外光谱(Fourier transform infrared,FT-IR),美国赛默飞公司;D8 Advanced型X射线多晶衍射仪(X-ray diffraction,XRD),德国布鲁克公司;FD-1A-50型冷冻干燥机,北京博医康实验仪器有限公司。
1.3 培养基
斜面培养用培养基(potato dextrose agar, PDA)(g/L):马铃薯300,葡萄糖20,琼脂15,氯霉素0.1。
种子培养基(potato dextrose broth,PDB)(g/L):马铃薯300,葡萄糖20,pH 5.6±0.2。
发酵培养基(g/L):酵母提取粉3、可溶性淀粉20、KH2PO4 1、MgSO4·7H2O 0.5、维生素B1 0.1, pH 6.5。
以上培养基均在115 ℃高温蒸汽灭菌15 min后使用。
1.4 实验方法
1.4.1 菌株的发酵培养
将菌种Diaporthe orixae sp.nov.从4 ℃冰箱中取出,解冻后,接种在PDA斜面上,27 ℃培养7 d,然后从PDA斜面上取4块活化的菌块(0.5 cm×0.5 cm)接入PDB培养基中(250 mL锥形瓶装液量100 mL),27 ℃、140 r/min振荡培养4 d,获得菌株种子液。将菌株种子液按接种量7%(体积分数)接入装液量40%(体积分数)的发酵培养基,将其置于27 ℃,140 r/min的振荡培养箱内培养4 d。采用布氏漏斗分离菌丝体和发酵液,发酵液弃之,用无菌去离子水充分洗涤菌丝体 3次,获得无培养基成分的菌体。
1.4.2 菌丝裂解液的制备
取4 g无培养基成分的菌体放入装无菌去离子水中的锥形瓶中(100 mL/250 mL),27 ℃,140 r/min振荡培养24 h。采用布氏漏斗收集菌丝体和发酵液,菌丝体弃之,留下的发酵液则为菌丝裂解液,将其置于4 ℃备用。
1.4.3 AgNPs的生物合成及条件的优化
将AgNO3与菌丝裂解液按照体积比为1∶9混合,室温避光反应。观察反应混合液的颜色变化,并使用紫外可见分光光度计对反应混合液进行全波长扫描,检测范围为300~600 nm[10]。
为了探究不同反应时间对AgNPs合成的影响,按照上述方法,在不同反应时间点(1、2、4、6、8、10、12、24 h)取出混合液进行波长扫描;在最适反应时间条件下,接种不同生物量(1.0、2.0、3.0、4.0、5.0、6.0 g)的菌株获得菌丝裂解液,按照上述方法合成AgNPs并进行波长扫描;在最适反应时间和菌株生物量条件下,按照上述方法,通过添加不同浓度(0.5、1.0、1.5、2.0、2.5、3.0 mmo1/L)的AgNO3溶液,对混合液进行波长扫描;在最适反应时间、菌株生物量和底物浓度的条件下,分别调节溶液pH值为5.0、6.0、7.0、8.0、9.0、10.0,按照上述方法合成AgNPs并进行波长扫描;在最适反应时间、菌株生物量、底物浓度和pH的条件下,将混合液分别置于15、25、35、45、55、65、75 ℃的条件下避光培养合成AgNPs并进行波长扫描。
1.4.4 AgNPs的质量表征
1.4.4.1 紫外可见分光光度计(ultraviolet-visible spectrophotometry,UV-vis)分析
取2 mL的AgNPs在300~600 nm下扫描,检测AgNPs的特征吸收峰,以未加AgNO3溶液的空白菌丝裂解液作对比。
1.4.4.2 场发射扫描电镜分析
将获得的AgNPs经干燥、研磨后,在超声波的作用下,使得AgNPs均匀地分散在酒精中,然后取1滴纳米银酒精溶液滴铜网,晾干后在场发射扫描电镜下观察AgNPs的粒径和形貌。
1.4.4.3 FT-IR分析
取适量AgNPs溶液,离心后用超纯水洗涤,弃上清液,重复3次,沉淀物经冷冻干燥除去水分获得AgNPs粉末。将AgNPs粉末与KBr粉末混合,于玛瑙研钵中混合研磨进行压片,室温下用FT-IR在500~4 000 cm-1扫描测定,扫描速度和间隔为5 kHz和2 nm。
1.4.4.4 XRD分析
取获得的AgNPs研磨成细小粉末进行压片,然后进行XRD测试。测试条件:入射光源采用Cu-Kα射线、射线管电流30 mA、电压40 kV,扫描范围5°~90°,扫描速度为8°/min,步长为0.02°。
1.4.5 AgNPs的催化活性
1.4.5.1 AgNPs对4-NP的催化还原
选择4-NP为目标底物,考察菌株D.orixae合成AgNPs的催化性能。在石英比色皿中,将浓度为0.5 mol/L的KBH4溶液取100 μL (现配现用)添加至2.5 mL浓度为0.2 mmol/L的4-NP溶液,二者混合均匀,随后加入50 μL的AgNPs(0.1 mg/L),在室温下,使用UV-vis连续全波扫描对反应过程进行监测,通过400 nm左右处峰的吸光度变化来监测4-NP浓度随时间的变化,扫描范围为300~600 nm,扫描间隔1 nm,以1 min的时间间隔记录吸收光谱。
参照文献[11]的方法,4-NP的催化降解可通过伪一级动力学模型对实验数据进行拟合,其模型参照公式(1):
(1)
式中:k,催化反应速率常数,min-1;t,反应时间,min;Ct,4-NP在t时刻的浓度;C0,4-NP的初始浓度;At,不同反应时间混合液的吸光度;A0,混合液的初始吸光度;用ln(At/A0)与反应时间t作图,其斜率即为催化反应速率常数k。
1.4.5.2 AgNPs对有机染料的催化降解
考察菌株D.orixae合成的AgNPs对2种有机染料(甲基橙、亚甲基蓝)的催化脱色效果。在石英比色皿中,将浓度为0.06 mol/L的KBH4溶液吸取0.5 mL (现配现用)分别添加至2 mL浓度为0.1 mmol/L两种有机染料的溶液,二者混合均匀,随后加入50 μL的AgNPs(0.1 mg/L),在室温下,使用UV-vis连续全波扫描对反应过程进行监测。甲基橙检测范围为300~600 nm,扫描间隔1 nm,以1 min的时间间隔记录吸收光谱的变化;亚甲基蓝检测范围为400~800 nm,扫描间隔1 nm,以3 min的时间间隔记录吸收光谱的变化。
1.5 数据分析
采用Excel 2010、Nano Measurer软件处理数据,通过SPSS 25.0软件进行统计学分析,OriginPro 9.0软件进行绘图,试验均重复3次。
2 结果与分析
2.1 AgNPs合成条件优化
如图1-a所示,反应体系从1 h时开始,在416 nm处开始出现明显的特征吸收峰,证明开始形成AgNPs,随着反应时间的增加,反应体系中吸收峰的强度也逐渐增大,且12 h时吸收峰的强度达到最大,从24 h之后,吸收峰强度开始降低,这表明体系中AgNPs的量从1~12 h逐渐递增,24 h时又开始减少,12 h时反应体系已基本完成,因此本实验选取12 h作为合成AgNPs的最佳时间。

a-反应时间;b-菌株生物量;c-AgNO3 浓度;d-pH值;e-温度
图1 AgNPs合成条件的优化
Fig.1 Optimization of AgNPs synthesis conditions
选择接种不同菌株生物量(1.0、2.0、3.0、4.0、5.0、6.0 g)获得的菌丝裂解液对合成AgNPs的影响如图1-b所示。随着菌株生物量的增加,其紫外吸收光谱呈现出先增加后降低再增加又降低的趋势,当菌株生物量为5.0 g时,峰的强度达到最大,由此可知在此生物量范围内合成的AgNPs的产量最多,因此,本实验选取菌株生物量为5.0 g的条件下,进行后续实验。
杨婧等[3]研究表明,在AgNPs合成过程中会受到AgNO3初始浓度的影响,基于此,本实验探究不同AgNO3浓度对菌株D.orixae菌丝裂解液合成AgNPs的影响,实验结果如图1-c所示。当AgNO3浓度由0.5 mmol/L逐步增加至2.0 mmol/L时,其UV-Vis图中特征吸收峰的峰值也逐渐增加,当浓度为2.0 mmol/L时,特征吸收峰峰值达到最大值。当AgNO3浓度增加至3.0 mmol/L时,特征吸收峰峰值开始降低,说明浓度为2.0 mmol/L时反应已基本完成,并且随着浓度的增加,特征吸收峰的位置发生蓝移且峰宽也变小,表明AgNPs的粒径尺寸在逐渐变小,其尺寸的分布更为均一。综上,本实验选取AgNO3浓度为2.0 mmol/L为AgNPs合成的最佳浓度。
在不同pH值的反应体系中,菌丝裂解液释放次生代谢产物的稳定性会受到影响,从而也会影响AgNPs的合成[12]。本实验设置6个不同的反应体系pH梯度,以探究反应在碱性、中性和酸性条件下对AgNPs合成的影响情况,实验结果如图1-d所示。当pH值为5.0~6.0时,其UV-Vis图表现出的特征吸收峰不明显,说明了在强酸条件下不利于AgNPs的合成,当pH=7.0时,其UV-Vis图开始出现特征吸收峰,表明在此条件下逐渐形成AgNPs,pH值增加至8.0时,其特征吸收峰值达到最大,表明反应体系中合成的AgNPs最多,但随着pH逐渐增加,特征吸收峰值开始逐渐下降,当pH值增加至10,峰值下降幅度较大,由此可以判断,反应体系处于较高的碱性条件也会不利用AgNPs的合成。有文献研究表明,在强酸和强碱条件下,AgNPs的合成可被抑制,而在中性或弱碱性条件下,AgNPs的合成可被促进[13-14],这与本实验结果相一致。综上,pH=8.0为菌株D.orixae菌丝裂解液合成AgNPs的最适pH。
因发酵液中存在酶、蛋白质和多糖等生物分子,在不同的温度环境下可能抑制或促进这些生物分子的活性,从而影响AgNPs的合成过程[15],因此探究温度对AgNPs的影响具有重要的现实意义,本实验将接种5.0 g菌株生物量获得的菌丝裂解液与2.0 mmol/L的AgNO3溶液进行反应,调节反应体系的pH值为8.0,随后将这7个相同的反应体系放置不同的温度条件下反应12 h,结果如图1-e所示。反应体系在55 ℃和65 ℃条件下AgNPs的峰值较其他温度高,但65 ℃开始出现峰值下降的变化,55 ℃特征吸收峰的峰值达到最大值,表明其到达反应终点,此时合成AgNPs的产量最高,由此可以推测升温促进了AgNPs的产率,但温度不宜超过65 ℃;此外,UV-Vis图中显示随着温度的增加,吸收峰位置开始逐渐红移,表明AgNPs的粒径尺寸增大,结合实际应用考虑,实验采用以AgNPs产量为主要优化的指标。因此,本实验选取55 ℃作为菌株D.orixae菌丝裂解液合成AgNPs的最佳温度。
2.2 AgNPs的质量表征
2.2.1 UV-vis结果分析
在得出最优合成AgNPs条件后,将AgNO3溶液与菌株D.orixae菌丝裂解液混合避光反应12 h后,混合液的颜色从无色变成淡黄色,结果如图2所示。菌株D.orixae菌丝裂解液与AgNO3溶液反应后,在410 nm处可以看到生成的复合物突显出一个较强的吸收峰,说明纳米银颗粒存在于生成的复合物中。菌株D.orixae菌丝裂解液中含有蛋白质、糖类、功能酶等生物分子,与AgNO3反应后,将其中的无机物金属银离子还原制备成银纳米粒子,生成的AgNPs被赋予较大的紫外吸收波长,结果表明,菌株D.orixae菌丝裂解液可应用于纳米银颗粒的绿色合成。
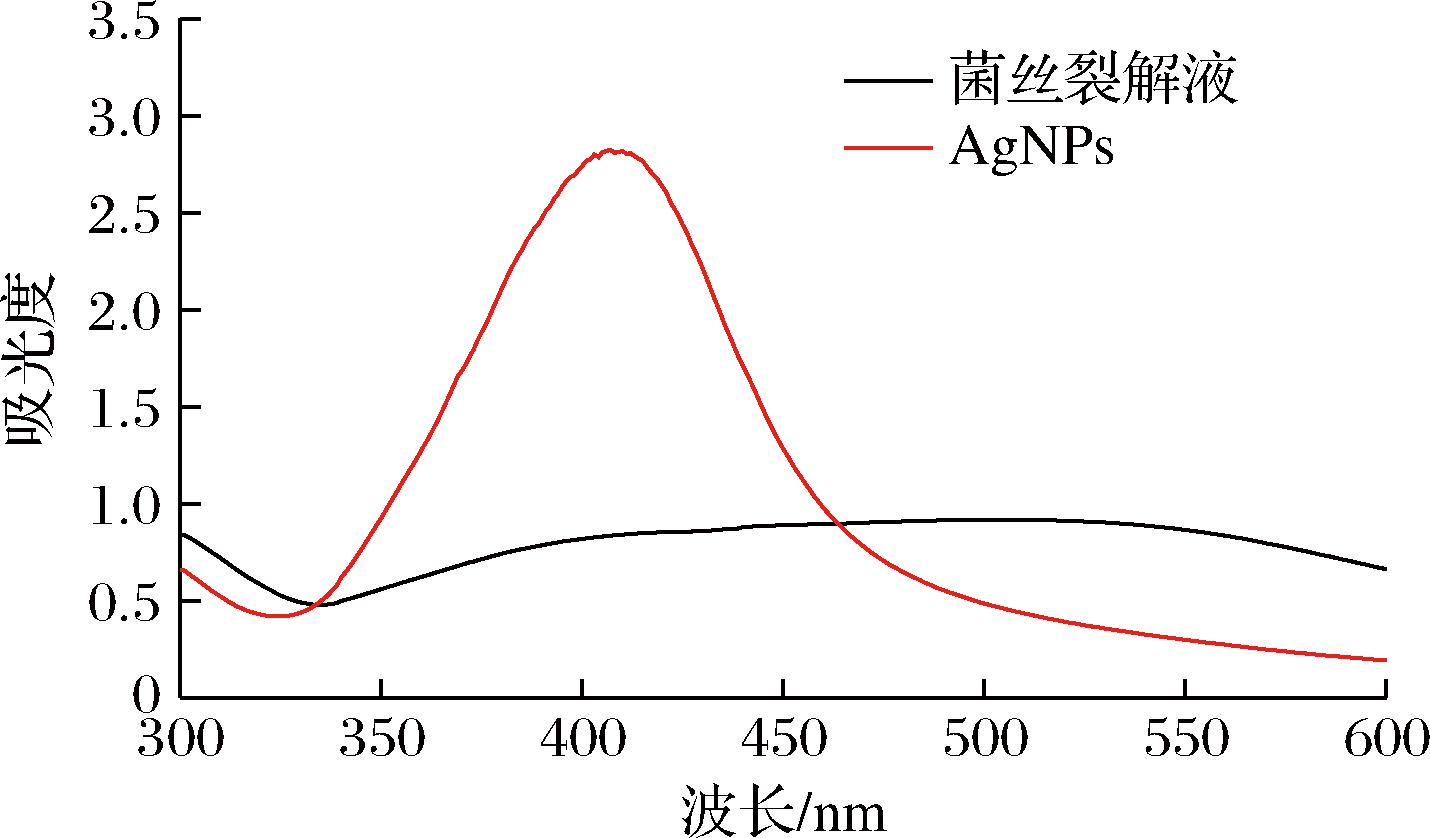
图2 菌株D.orixae菌丝裂解液合成AgNPs的紫外吸收波长
Fig.2 Strain D.orixae ultraviolet absorption wavelength of AgNPs synthesized by hypha lysate
2.2.2 合成AgNPs形貌及粒径分布
利用扫描电镜考察了菌株D.orixae菌丝裂解液合成AgNPs的形貌及尺寸,结果如图3-a所示,合成的AgNPs为球状的颗粒,粒径尺寸均一,分散性好,无明显团聚现象,从图中随机选取不同区域的近100颗AgNPs粒子进行粒径分析,结果如图3-b所示,合成的AgNPs粒径在9~36 nm,主要分布在17~20 nm,平均粒径为20 nm。
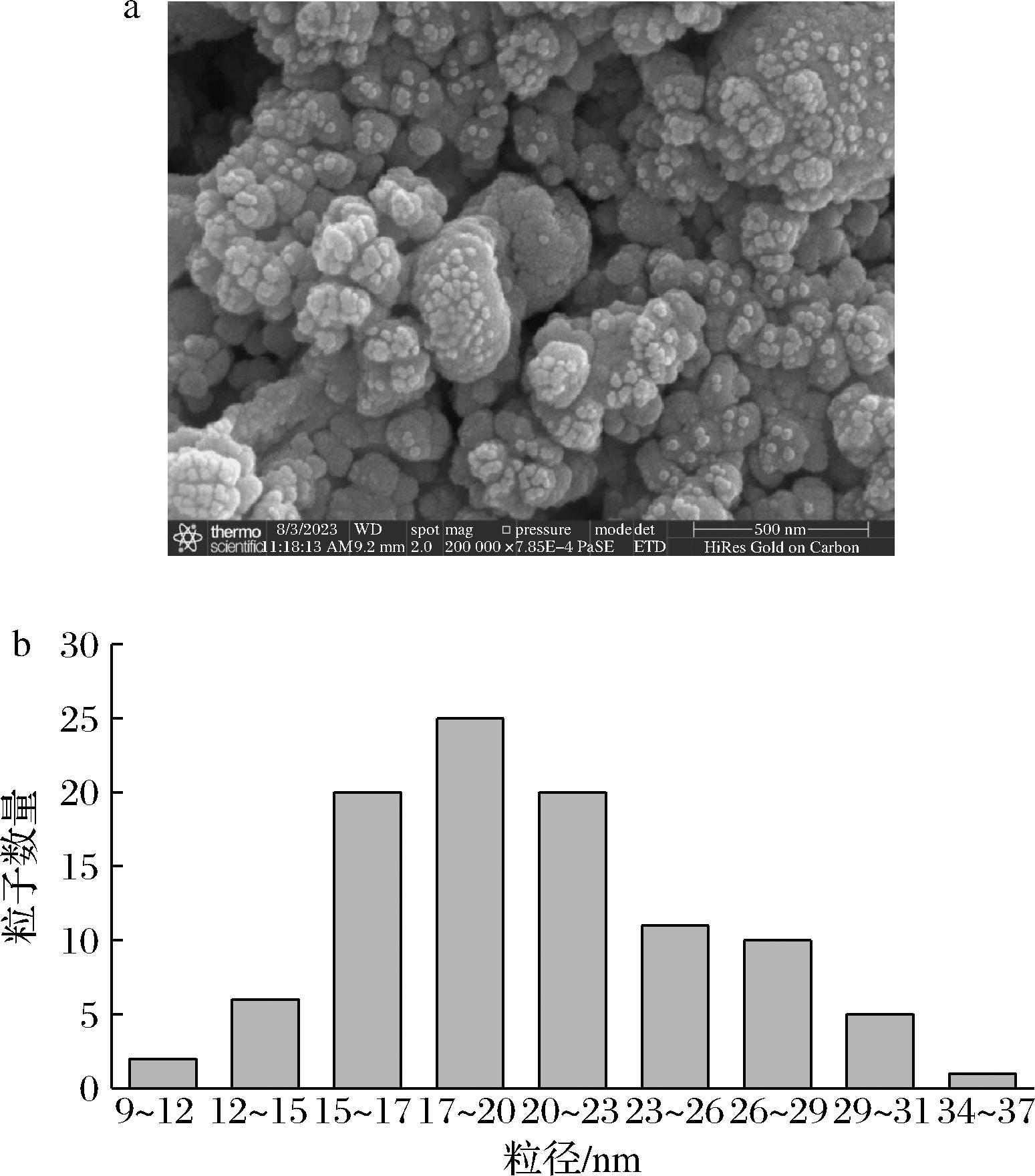
a-扫描电镜图;b-粒径分布图
图3 菌株D.orixae菌丝裂解液合成AgNPs的微观结果和粒径分布图
Fig.3 Structure of strains D.orixae hypha lysate synthesis of AgNPs and particle size distribution
2.2.3 FT-IR结果分析
图4为菌株D.orixae菌丝裂解液与AgNO3反应生成的AgNPs的FT-IR图。利用FT-IR探索附着在AgNPs表面的官能团类别,以期初步阐明菌株D.orixae菌丝裂解液合成AgNPs的机制。合成的AgNPs在3 415.23、1 640.90、1 384.41、1 019.21、554.19 cm-1处出现吸收峰,其中3 415.23 cm-1处的吸收峰是由醇或酚上的O—H键伸缩振动造成的[16],1 640.90 cm-1处的吸收峰对应蛋白质的酰胺I键的特征峰[17],1 384.41 cm-1处的吸收峰是C—H弯曲振动造成的[18],1019.21 cm-1处的吸收峰是由C—O键伸缩振动产生的[19],554.19 cm-1处的吸收峰是由醛或酮上的C—C![]() O面内弯曲振动造成的。菌株D.orixae菌丝裂解液中的O—H、C—O、酰胺键等基团的生物分子对生成的AgNPs进行保护,在还原Ag后形成稳定的—C—O…Ag等配位键[20],有助于AgNPs的形成和稳定。
O面内弯曲振动造成的。菌株D.orixae菌丝裂解液中的O—H、C—O、酰胺键等基团的生物分子对生成的AgNPs进行保护,在还原Ag后形成稳定的—C—O…Ag等配位键[20],有助于AgNPs的形成和稳定。

图4 菌株D.orixae菌丝裂解液合成AgNPs的红外光谱图
Fig.4 Strain D.orixae infrared spectra of synthesis of AgNPs from hypha lysate
2.2.4 XRD结果分析
图5出现了5个明显的特征衍射峰,其对应的2θ值分别为38.10°、44.41°、64.51°、77.48°和81.70°,依次与标准银晶态的(111)、(200)、(220)、(311)和(222)的晶面相对应(参照JCPDS No.04—0873),说明菌株D.orixae菌丝裂解液合成的AgNPs结构其晶相为面心立方结构。整个衍射图谱峰宽较宽,晶粒尺寸较小,有杂峰,其原因可能是在合成AgNPs过程中操作不当,引入杂质。
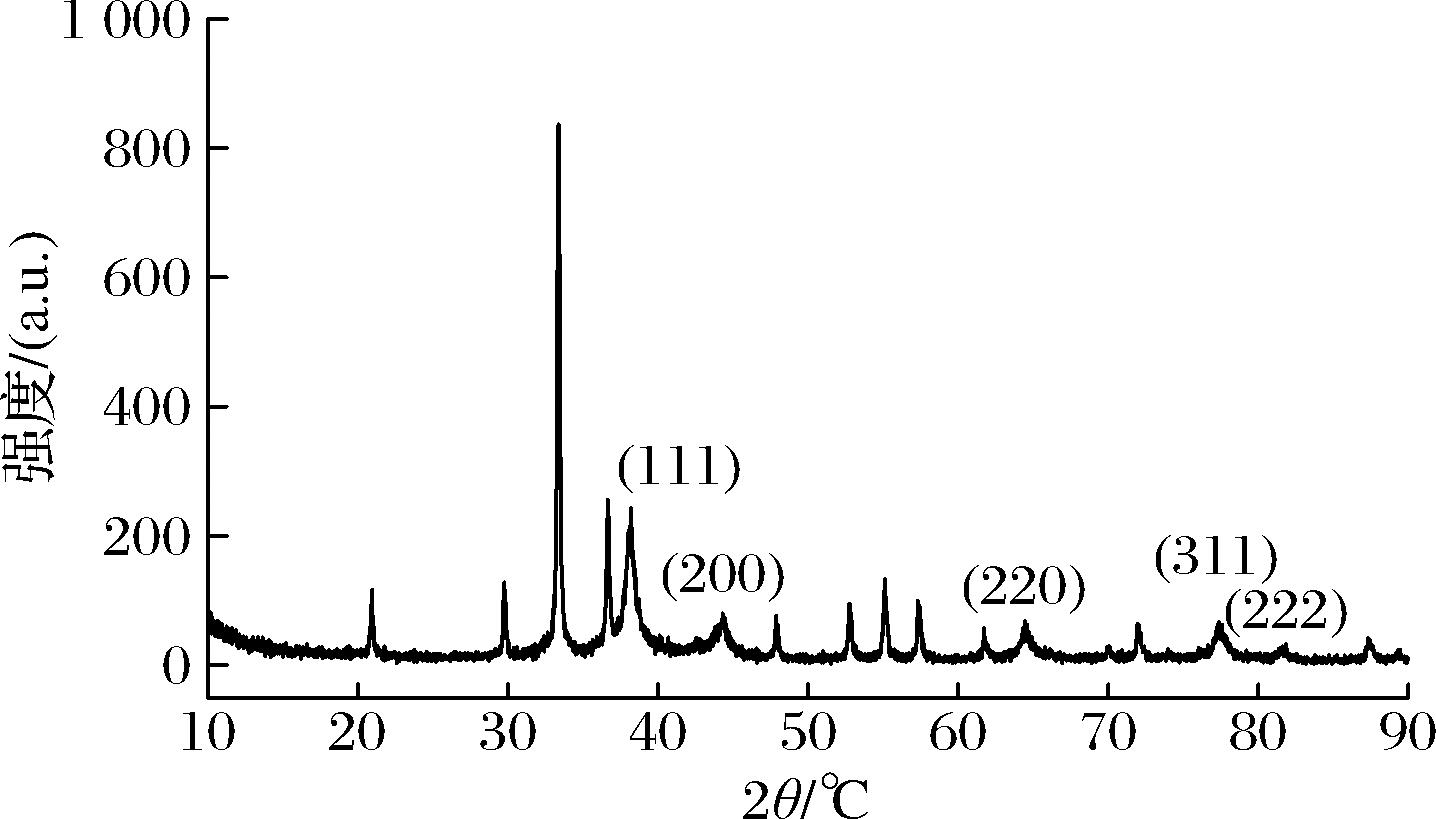
图5 菌株D. orixae菌丝裂解液合成AgNPs的XRD光谱图
Fig.5 Strain D. orixae XRD spectra of AgNPs synthesized by hypha lysate
2.3 AgNPs的催化活性
2.3.1 AgNPs对4-NP的催化还原
4-NP作为一种广泛应用的硝基芳香化合物,主要被用来生产合成染料、医药、炸药、工业溶剂以及有机磷农药[21],因其具有高溶解度、稳定性强、毒性大等特性,土壤和水体被4-NP污染后会严重威胁人类及其他动植物的正常发育,美国环保局已将其列入优先控制的污染物名单中[22]。以4-NP为模型化合物对合成的AgNPs的催化性能进行研究,在4-NP的还原过程中,KBH4作为还原剂,AgNPs作为催化剂进行催化反应,在此还原反应中,加入了过量的KBH4作为一个确定的因素,以排除其在不同催化反应中的不同作用。4-NP常温下为淡黄色溶液,其紫外特征吸收峰在 320 nm处,将其加入KBH4后,混合液颜色由淡黄色变为亮黄色,且在UV-vis图410 nm处出现特征吸收峰, 主要原因是由于在碱性环境下4-NP会生成大量的对硝基苯酚离子所导致。在本实验中,向混合液加入少量AgNPs后,410 nm处的特征吸收峰强度逐渐减弱,在360 nm处出现了新的吸收峰(4-氨基苯酚),表明4-NP逐渐被还原,并且会产生(4-氨基苯酚)。反应7 min后,410 nm处的特征吸收峰基本消失,去除效率达92.87%,反应溶液颜色由亮黄色逐渐变为无色,证明反应完全(图6)。根据公式(1)计算可得AgNPs催化4-NP降解的反应速率常数k为0.348 min-1。

图6 AgNPs对4-硝基苯酚催化还原的UV-Vis光谱图
Fig.6 UV-Vis spectra of catalytic reduction of 4-NP by AgNPs
2.3.2 AgNPs对有机染料的催化降解
水污染一直是现代社会所关注的民生问题,特别是纺织工业的废水对环境造成严重破坏。纺织工业将未经处理的染料废水排放到水体中,影响了水生态系统的正常运作,从而导致严重的疾病,如人类的肝脏和肾脏受损。染料废水(如甲基橙、亚甲基蓝)具有成分复杂、色度高、生物毒性高等特点[23],是公认的难处理有机废水,因此,寻求高效、简单的染料废水处理技术对于环境的治理具有重要的意义。目前关于生物合成AgNPs用于对有机染料催化降解中的应用研究仍然较少,本实验利用菌株Diaporthe orixae sp.nov.菌丝裂解液合成的AgNPs对2种有机染料进行催化脱色,结果见图7,在还原剂KBH4的条件下,加入AgNPs后,2种有机染料的脱色速率加快,甲基橙在反应6 min后,465 nm处的特征吸收峰就基本消失,根据吸光度值变化计算出脱色率为85.41%,反应溶液颜色也由橙色逐渐变为无色,证明反应完全(图7-a);亚甲基蓝在反应21 min后,665 nm处的特征吸收峰基本消失,脱色率为93.83%,溶液颜色由蓝色逐渐变为无色,证明该反应结束(图7-b)。反应体系中染料的浓度远低于KBH4溶液的浓度,整个反应过程中KBH4的量保持不变,符合伪一级动力学模型,根据公式(1)计算出AgNPs的催化反应速率常数k分别为:0.243 min-1(甲基橙)、0.138 min-1(亚甲基蓝)。

a-甲基橙;b-亚甲基蓝
图7 AgNPs催化降解甲基橙和亚甲基蓝的UV-Vis光谱图
Fig.7 UV-Vis spectra of methyl orange and methylene blue catalyzed by AgNPs
3 结论与讨论
本研究选用菌株D.orixae菌丝裂解液合成AgNPs,对其合成条件进行优化,利用扫描电镜、FT-IR、XRD对合成的AgNPs进行质量表征,最后利用4-NP和甲基橙、亚甲基蓝对合成AgNPs的催化活性进行考察,结果如下:
a)菌株D.orixae可应用于AgNPs的绿色合成,且反应时间、菌株生物量、AgNO3浓度、pH及温度对AgNPs的合成均会产生一定的影响。
b)合成的AgNPs为球状的颗粒,颗粒尺寸均一且分散性好,平均粒径为20 nm;XRD光谱图显示合成的AgNPs晶相结构为面心立方结构;通过FT-IR分析可得羟基、羰基、酰胺键等官能团可能有助于AgNPs的形成和稳定。
c)本实验合成的AgNPs对4-NP和甲基橙、亚甲基蓝都有较好的催化活性,其催化反应速率常数k分别为:0.348 min-1(4-NP), 0.243 min-1(甲基橙)、0.138 min-1(亚甲基蓝)。
d)内生真菌可以产生大量的蛋白质和其他生物分子等,这些生物分子与合成过程中AgNPs的聚集和稳定有关[24],本研究选用的菌株D.orixae菌丝裂解液其细胞能够分泌蛋白或酶等,以及自身含有多种还原性官能团(如羟基、羰基),能将Ag+还原为AgNPs。利用内生真菌生物合成AgNPs具有方式简单、环保、易于实现的优势,对于进一步解析臭常山内生真菌发酵产物合成稳定AgNPs的机制具有重要的指导作用。目前,真菌生物合成AgNPs机理的分析主要依靠FT-IR等常规方法,在未来的研究中,可以利用基因工程等技术改造相关菌株,结合基因组学、转录组学等组学方法,更详细地分析影响真菌生物合成纳AgNPs的关键基因、蛋白质和调控系统,为今后真菌生物合成AgNPs的工业化生产提供参考与理论支撑。
[1] 叶伟杰, 陈楷航, 蔡少龄, 等.纳米银的合成及其抗菌应用研究进展[J].材料工程, 2017, 45(9):22-30.
YE W J, CHEN K H, CAI S L, et al.Progress in research on synthesis and antibacterial applications of silver nanoparticles[J].Journal of Materials Engineering, 2017, 45(9):22-30.
[2] 刘小莉, 胡彦新, 彭欢欢, 等.内生真菌绿色生态法合成纳米银的研究[J].现代食品科技, 2017, 33(1):119-124;99.
LIU X L, HU Y X, PENG H H, et al.Green biosynthesis of silver nanoparticles using an endophytic fungus[J].Modern Food Science and Technology, 2017, 33(1):119-124;99.
[3] 杨婧, 林宇星, 刘莘轶, 等.利用Mariannaea sp.HJ菌株胞内提取物合成纳米银及其抗菌特性研究[J].微生物学报, 2020, 60(4):749-758.
YANG J, LIN Y X, LIU X Y, et al.Biosynthesis of silver nanoparticles by the cell-free extracts of Mariannaea sp.HJ and their antimicrobial characteristics research[J].Acta Microbiologica Sinica, 2020, 60(4):749-758.
[4] ZOMORODIAN K, POURSHAHID S, SADATSHARIFI A, et al.Biosynthesis and characterization of silver nanoparticles by Aspergillus species[J].BioMed Research International, 2016, 2016:5435397.
[5] 乔自鹏, 王奇志, 杨道茂, 等.真菌介导纳米银生物合成的研究进展[J].生物技术通报, 2021, 37(3):185-197.
QIAO Z P, WANG Q Z, YANG D M, et al.Research progress in fungi-mediated biosynthesis of sliver nanoparticles[J].Biotechnology Bulletin, 2021, 37(3):185-197.
[6] 厉舒祯, 沈文丽, 刘洋荧, 等.真菌介导的纳米金合成及其应用研究进展[J].环境科学与技术, 2016, 39(9):82-87;158.
LI S Z, SHEN W L, LIU Y Y, et al.Research advances in fungi-mediated biosynthesis of gold nano-particle and its application[J].Environmental Science &Technology, 2016, 39(9):82-87;158.
[7] 杨济秋,杨济中.贵州民间方药集[M].贵阳:贵州科技出版社,1958.
YANG J Q,YANG J Z.Guizhou Folk Recipe Collection[M].Guiyang:Guizhou Science and Technology Press,1958.
[8] 冯煦,董云发,王鸣,等.臭常山喹啉生物碱成分[J]中草药,2004,35(12):1336-1338.
FENG X,DONG Y F,WANG M, et al.Quinoline alkaloid constituents of Orixa japonica [J] Chinese Traditional and Herbal Drugs,2004,35(12):1336-1338.
[9] LU Q T, ZHANG J Y, SUN Y R, et al.Diaporthe orixae sp.nov., an endophytic species isolated from Orixa japonica in Southern China[J].Phytotaxa, 2022, 544(1):37-51.
[10] 杨紫浓. 石榴皮和石榴叶提取物制备银纳米粒及其应用研究[D].开封:河南大学, 2017.
YANG Z N.Pomegranate peel and pomegranate leaf aqueous extract mediated synthesis of silver nanoparticles and their potential applications[D].Kaifeng:Henan University, 2017.
[11] WU X Y, SHI Z Q, FU S D, et al.Strategy for synthesizing porous cellulose nanocrystal supported metal nanocatalysts[J].ACS Sustainable Chemistry &Engineering, 2016, 4(11):5929-5935.
[12] KHATTAK A, AHMAD B, RAUF A, et al.Green synthesis, characterisation and biological evaluation of plant-based silver nanoparticles using Quercus semecarpifolia Smith aqueous leaf extract[J].IET Nanobiotechnology, 2019, 13(1):36-41.
[13] BALAKUMARAN M D, RAMACHANDRAN R, KALAICHELVAN P T.Exploitation of endophytic fungus, Guignardia mangiferae for extracellular synthesis of silver nanoparticles and their in vitro biological activities[J].Microbiological Research, 2015, 178:9-17.
[14] 桂兵. 生物合成纳米材料及其应用研究[D].北京:华北电力大学, 2016.
GUI B.Research on biosynthesis of nanomaterials and their applications[D].Beijing:North China Electric Power University, 2016.
[15] HUSSEINY S M, SALAH T A, ANTER H A.Biosynthesis of size controlled silver nanoparticles by Fusarium oxysporum, their antibacterial and antitumor activities[J].Beni-Suef University Journal of Basic and Applied Sciences, 2015, 4(3):225-231.
[16] ZAHOOR A, TENG Q, WANG H Q, et al.Synthesis and characterization of Ag@polycarbazole coaxial nanocables and their enhanced dispersion behavior[J].Metals and Materials International, 2011, 17(3):417-423.
[17] BAGUR H, MEDIDI R S, SOMU P, et al.Endophyte fungal isolate mediated biogenic synthesis and evaluation of biomedical applications of silver nanoparticles[J].Materials Technology, 2022, 37(3):167-178.
[18] 房皓, 闫永全, 居子逸, 等.Mariannaea sp.HJ合成纳米金银合金的特性考察[J].生物工程学报, 2019, 35(11):2061-2068.
FANG H, YAN Y Q, JU Z Y, et al.Characterization of Au-Ag nanoparticles biosynthesized by fungus Mariannaea sp.HJ[J].Chinese Journal of Biotechnology, 2019, 35(11):2061-2068.
[19] HU X W, SARAVANAKUMAR K, JIN T Y, et al.Mycosynthesis, characterization, anticancer and antibacterial activity of silver nanoparticles from endophytic fungus Talaromyces purpureogenus[J].International Journal of Nanomedicine, 2019, 14:3427-3438.
[20] 秦聪丽, 傅吉全.桑叶提取物还原制备钯纳米颗粒[J].贵金属, 2016, 37(3):29-32.
QIN C L, FU J Q.Preparation of palladium nanoparticles using mulberry leaf extract[J].Precious Metals, 2016, 37(3):29-32.
[21] 张京顺. 对硝基苯酚降解菌的筛选、鉴定、降解性能与表面疏水性研究[D].泰安:山东农业大学, 2008.
ZHANG J S.Isolation and characterization of P-nitrophenol degrading bacteria, degradation characteristics and cell surface hydrophobicity[D].Tai’an:Shandong Agricultural University, 2008.
[22] WAN N S, GU J D, YAN Y.Degradation of p-nitrophenol by Achromobacter xylosoxidans Ns isolated from wetland sediment[J].International Biodeterioration &Biodegradation, 2007, 59(2):90-96.
[23] 火灿. 生物合成纳米材料的制备、表征及环境行为研究[D].北京:华北电力大学, 2019.
HUO C.Biosynthesis, characterization and environmental behavior of nanoparticles[D].Beijing:North China Electric Power University, 2019.
[24] NETALA V R, KOTAKADI V S, BOBBU P, et al.Endophytic fungal isolate mediated biosynthesis of silver nanoparticles and their free radical scavenging activity and anti microbial studies[J].3 Biotech, 2016, 6(2):132.