叶绿素(chlorophyll, C)是一类脂溶性光合作用色素,广泛分布在光合作用植物和一些细菌、藻类植物中。高等植物中的叶绿素主要是叶绿素a和叶绿素b,比例约为3∶1;各叶绿素单体含有卟啉环结构[1]。叶绿素来源广泛,具有鲜艳的绿色,不仅是天然可食用色素,还具有许多生物活性,如抗氧化、抗炎、抑菌、抗癌等[2-3]。然而,叶绿素极不稳定,易受环境影响发生降解,如氧气、酶、光、热、酸碱性环境等,导致其变色且活性降低,严重制约了叶绿素在食品工业中的应用[4-5]。因此,提升稳定性、进行色度保护,是改善叶绿素生物利用度、扩大其应用范围的前提。
近年来,众多学者采用大分子负载以提升叶绿素的稳定性,改善其生物利用度。洪军等[2]以阿拉伯胶、β-环糊精、蔗糖为壁材制备的微胶囊,显著提升了韭菜叶绿素的颜色稳定性。采用复合凝沉法,以明胶和果胶为复合壁材制备的微胶囊,对叶绿素包埋率可达(80.21±1.18)%,在21 d自然光照射下微胶囊组的叶绿素保留量比未进行微胶囊处理组约高40%;在pH 2.5和4.5酸处理条件下,微胶囊组叶绿素的保留量大于85%[1]。大豆分离蛋白(soybean protein isolate, SPI)对叶绿素具有较高的亲和性,其结合常数为6.397 2×104 L/mol;SPI-C复合物粒径较SPI小,且粒度分布均匀,稳定性高[6]。SPI和壳聚糖形成的微胶囊对叶绿素的包封率高达96.21%;在弱酸性溶液中(pH 4.5、6.5),微胶囊中叶绿素的保留率高达97.7%~100%[7]。在100 MPa静压作用下,SPI和叶绿素的结合常数高达1.38×106 L/mol,二者形成稳定的复合物;80 ℃热处理下,复合物中叶绿素色度基本不变[8]。另外,麦芽糊精和阿拉伯胶包埋显著提升了叶绿素的贮藏稳定性[4]。有研究指出,将1%和3%的叶绿素分散在酪蛋白酸钠溶液中,其溶解性和贮藏稳定性显著提升[9]。由此可见,采用适宜的大分子负载可有效提升叶绿素的稳定性。
膜分离技术是基于膜孔径筛分作用及电荷效应,实现不同粒径分子高效分离的技术,其在乳品加工业中占据着重要地位[10]。牛乳中的主要蛋白质有2大类,一类是乳清蛋白(whey protein, WP),一类是酪蛋白胶束(micellar casein, MC);其中,乳清蛋白颗粒尺寸介于4~8 nm,而以胶束形式存在的酪蛋白平均粒径为200 nm[11]。采用适宜的膜分离技术可实现酪蛋白胶束与乳清蛋白的有效分离[10]。乳清蛋白不仅功能特性优异,而且对活性小分子具有较好的亲和力,可作为活性因子的运载基质。MOHAMMADIAN等[12]研究发现,经乳清蛋白负载后,姜黄素的DPPH自由基清除活性显著提高。乳清蛋白对(-)表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)的结合常数为2.62×104 L/mol;EGCG经乳清蛋白负载后降解率显著降低,抗氧化性显著提升[13]。酪蛋白胶束是乳中酪蛋白单体的天然存在形态,呈近球形纳米结构,表面亲水内部疏水,对活性因子具有较强的亲和力。本团队前期研究发现,酪蛋白胶束对大黄素、咖啡酸、咖啡酸苯乙酯均具有较高的结合常数,且经酪蛋白胶束负载后有利于活性分子的缓释[14-15]。另外,酪蛋白胶束负载后,原花青素的热稳定性和H2O2氧化稳定性显著提升[16]。综上所述,乳蛋白对活性因子的亲和力较高,具有负载活性因子的优势。然而,乳蛋白对叶绿素的结合作用及其复合物性质研究报道较少。
本文以膜分离技术制备的乳清蛋白和酪蛋白胶束,以及脱脂乳(skim milk, SM)为基质,以叶绿素为配体,制备酪蛋白胶束-叶绿素(MC-C)、乳清蛋白-叶绿素(WP-C)、脱脂乳-叶绿素(SM-C)复合物,利用荧光光谱法解析不同类型乳蛋白与叶绿素的结合常数;采用傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)、扫描电镜表征复合物结构;进而分析复合物的溶解性、热稳定性,利用色度变化评价贮藏30 d后样品颜色稳定性,并分析模拟胃肠消化过程中复合物对叶绿素的释放特性。研究结果可为叶绿素的稳定性提升提供理论基础,也可为扩大乳蛋白的应用提供参考依据。
1 材料与方法
1.1 材料与试剂
叶绿素铜钠、胃蛋白酶(15 000 U/g)、胰蛋白酶(2 500 U/mg)、猪胆盐,上海麦克林生化科技有限公司;其他试剂均为分析纯。
新鲜牛乳,兰州天天鲜乳制品有限责任公司,离心脱脂(4 000×g,30 min),过100 kDa有机膜,浓缩液冷冻干燥制得酪蛋白胶束,滤出液过3 kDa有机膜,浓缩液冷冻干燥制得乳清蛋白,4 ℃冷藏备用;经测定,酪蛋白胶束和乳清蛋白中蛋白质含量均大于70%[17]。
1.2 仪器与设备
RF-5301PC荧光分光光度计、S-3400N扫描电子显微镜,日本日立仪器有限责任公司;Nicolet iS50型 FTIR仪,美国赛默飞世尔科学公司;STA 449 F5型 TG-DSC热分析仪,德国耐驰仪器制造有限公司;NAI-GZJ实验室小型喷雾干燥机,上海那艾精密仪器有限公司;UV-1780双光束紫外可见分光光度计,岛津仪器有限公司;CS-200色差仪,杭州彩谱科技有限公司。
1.3 实验方法
1.3.1 乳蛋白与叶绿素复合物制备
称取一定量乳清蛋白或酪蛋白胶束,溶于去离子水中,室温下搅拌4 h,放入4 ℃冰箱中水化过夜,之后定容至250 mL,蛋白质终质量浓度为2 g/L。准确移取适量脱脂乳,其蛋白质含量按照3%计,用去离子水稀释至蛋白质含量为2 g/L。配制2 mmol/L叶绿素铜钠水溶液。将不同体积叶绿素溶液加入10 mL乳清蛋白、酪蛋白胶束以及脱脂乳溶液中,补充适量水,使总添加量一致,叶绿素终浓度分别为0、10、20、30、40、50 μmol/L。使用涡流混合器将混合液混合30 s,然后分别在298、310、318 K下加热20 min,于室温下冷却,即为乳蛋白与叶绿素复合物,用于作用机理研究。采用上述方法,配制质量浓度为30 g/L的乳蛋白水溶液,脱脂乳直接使用;向500 mL 3种乳蛋白溶液中分别加入30 mL浓度为2 mmol/L的叶绿素铜钠水溶液,于298 K下按照上述方法制备复合物并喷雾干燥,收集粉末用于结构及性质研究。
1.3.2 荧光光谱分析
用荧光分光光度计测定样品荧光光谱,在290~500 nm内记录发射光谱,激发波长为280 nm,激发和发射狭缝为5 nm。利用Stern-Volmer方程计算乳蛋白与叶绿素的荧光猝灭类型,荧光猝灭类型的计算如公式(1)所示[14]:
F0/F=1+Kqτ0[Q]=1+KSV[Q]
(1)
式中:F0和F,分别为加入叶绿素前后蛋白质的荧光强度;KSV,Stern-Volmer的动态猝灭常数;Kq,双分子猝灭过程的速率常数;[Q],叶绿素浓度;τ0,没有叶绿素时荧光分子的平均寿命(10-8s)。
用双对数方程计算乳蛋白与叶绿素的结合常数Ka和结合位点数n,其计算如公式(2)所示:
lg(F0-F)/F=lgKa+nlg[Q]
(2)
式中:Ka是结合常数,n是结合位点数。
1.3.3 FTIR分析
将少量复合物粉末放于ATR元件上,采集红外图谱,扫描范围4 000~400 cm-1,仪器分辨率为2 cm-1。
1.3.4 扫描电镜分析
取适量复合物粉末置于铜台上的导电胶条表面,小心涂抹使其分散为薄层,喷金后采用扫描电子显微镜观察,电压12.0 kV。
1.3.5 溶解性测定
参考曾秋兵等[17]的方法,略有修改。称取适量样品,加入适量去离子水,于恒温磁力搅拌器在45 ℃下搅拌,用1 mol /L的HCl和NaOH溶液调节所需pH直至稳定,继续搅拌2 h后定容至终质量浓度为10 mg/mL,室温放置2 h。将10 mL溶液移入15 mL恒重的离心管中,4 000 r/min离心10 min,去掉上清液,放入烘箱中于65 ℃烘至恒重,称重记为m0,10 mL溶液中蛋白质质量记为m1,溶解性的计算如公式(3)所示:
溶解度/%=[(m1-m0)/m1]×100
(3)
1.3.6 热稳定性分析
参照QIN等[14]的方法,使用TG-DSC热分析仪测定复合物粉末的热稳定性。
1.3.7 色度分析
参照本团队[18]方法,在室温下将色差仪进行校准,然后取适量新制备的样品铺平,测定样品的颜色数据。将样品置于自封袋中,冰箱冷藏30 d后测定色度。样品色差ΔE的计算如公式(4)所示:
(4)
式中:![]() 游离叶绿素贮藏0 d时的色值;L*、a*、b*,不同贮藏期样品粉末的色值。
游离叶绿素贮藏0 d时的色值;L*、a*、b*,不同贮藏期样品粉末的色值。
1.3.8 胃肠模拟消化性分析
将100 mg复合物粉末分散在2 mL pH 1.2的蒸馏水中,装于透析袋中(分子质量2 kDa);加入2.0 mL混合模拟胃液(含2 g/L NaCl、7 mL HCl和3.2 g/L胃蛋白酶,pH 1.2)。将透析袋置于含有150 mL释放液烧杯中,释放液由无酶模拟胃液组成。然后,置于水浴恒温振荡器在37 ℃恒温下100 r/min振荡2 h。调节混合液pH至7.5,加入模拟肠液4.0 mL(SIF,由6.8 g/L KH2PO4和10 g/L胰蛋白酶组成,pH 7.5)。将透析袋置于含有150 mL释放液的烧杯中,释放液由无酶SIF组成,在相同条件下振荡22 h。在每个指定时间点收集3 mL透析介质,用3 mL新鲜介质替换。采用紫外可见分光光度计在405 nm下测定吸光度,并根据相同释放介质中的叶绿素铜钠标准曲线计算其释放量。
1.4 数据统计与分析
所有试验重复3次,试验数据采用Excel 2021处理并用平均数±标准偏差表示,用Origin Pro 9.0作图,用SPSS 22进行差异显著性分析,数据间差异显著分析采用Duncan法。
2 结果与分析
2.1 叶绿素与乳蛋白相互作用分析
2.1.1 荧光光谱分析
如图1所示,酪蛋白胶束在338 nm处出现最大荧光值,乳清蛋白在332 nm处出现最大荧光值,而脱脂乳在345 nm处出现最大荧光值。CHEN等[13]研究发现,当最大发射波长λmax<330 nm,色氨酸残基被包埋于疏水环境内部;当λmax>330 nm时,色氨酸残基位于亲水环境,暴露于蛋白链表面。可见,酪蛋白胶束、乳清蛋白以及脱脂乳中蛋白链上的色氨酸残基均暴露在亲水环境中。叶绿素对酪蛋白胶束、乳清蛋白和脱脂乳均有荧光猝灭效应;随着叶绿素浓度的增大,乳蛋白最大荧光值降低,说明叶绿素与乳蛋白结合,形成了复合物。另一方面,随着叶绿素添加量的增加,λmax出现蓝移,即向低波长移动,表明叶绿素与乳蛋白间具有相互作用,二者结合使乳蛋白构象发生变化,色氨酸残基由亲水环境向疏水环境转化。本团队前期研究发现,结合槲皮素可促使乳清蛋白最大发射波长蓝移,与本研究结果一致[19]。
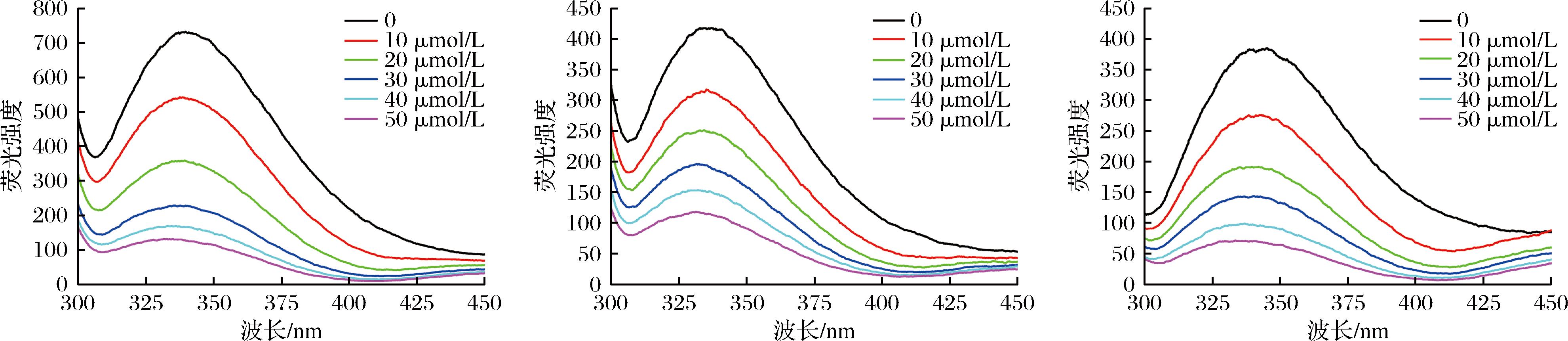
a-MC-C;b-WP-C;c-SM-C
图1 MC-C、WP-C、SM-C复合物荧光光谱图
Fig.1 Fluorescence spectra of MC-C, WP-C, and SM-C complexes
注:MC-C为酪蛋白胶束-叶绿素复合物;WP-C为乳清蛋白-叶绿素复合物;SM-C为脱脂乳-叶绿素复合物(下同)。
2.1.2 结合常数和结合位点数分析
利用Stern-Volmer方程对MC-C、WP-C、SM-C的荧光光谱进行计算,获得的猝灭速率常数见表1。叶绿素对酪蛋白胶束、乳清蛋白及脱脂乳中混合乳蛋白的荧光猝灭速率常数Kq均高于猝灭剂对生物大分子的最大扩散碰撞常数[2.0×1010 L/(mol·s)],说明叶绿素对乳蛋白的荧光猝灭是静态猝灭过程,形成稳定的静态复合物[14]。根据双对数方程计算不同温度下叶绿素和酪蛋白胶束、乳清蛋白,以及脱脂乳的结合常数Ka及结合位点数n,见表1。叶绿素与乳蛋白的结合常数Ka均大于106 L/mol,表明乳蛋白对叶绿素具有较强的结合作用。叶绿素与乳清蛋白的结合常数Ka随温度的升高而增大,说明结合过程为吸热过程;其与脱脂乳、酪蛋白胶束的Ka随温度的升高而降低,表明二者与叶绿素之间的结合是放热过程。何思宇[20]研究发现,叶绿素与酪蛋白酸钠的结合过程为放热过程,与本研究中酪蛋白胶束和叶绿素结合过程一致。对比结合常数发现,同一温度下脱脂乳与叶绿素的结合常数大于酪蛋白胶束,可见,脱脂乳体系更有利于结合叶绿素。脱脂乳体系中不仅含有酪蛋白胶束,而且有乳清蛋白及其他微量乳蛋白,这些成分的存在也可以结合一定量的叶绿素。另一方面,脱脂乳体系中成分较多,含有乳糖等小分子,可能影响酪蛋白胶束、乳清蛋白的结构,使其更有利于结合小分子[21]。因此,脱脂乳对叶绿素的结合常数大于酪蛋白胶束对叶绿素的结合常数。乳蛋白对叶绿素的结合位点数n约为1,说明叶绿素在乳蛋白上只有单个结合位点。
表1 叶绿素与乳蛋白结合过程的相关参数
Table 1 The binding parameters of milk protein by chlorophyll
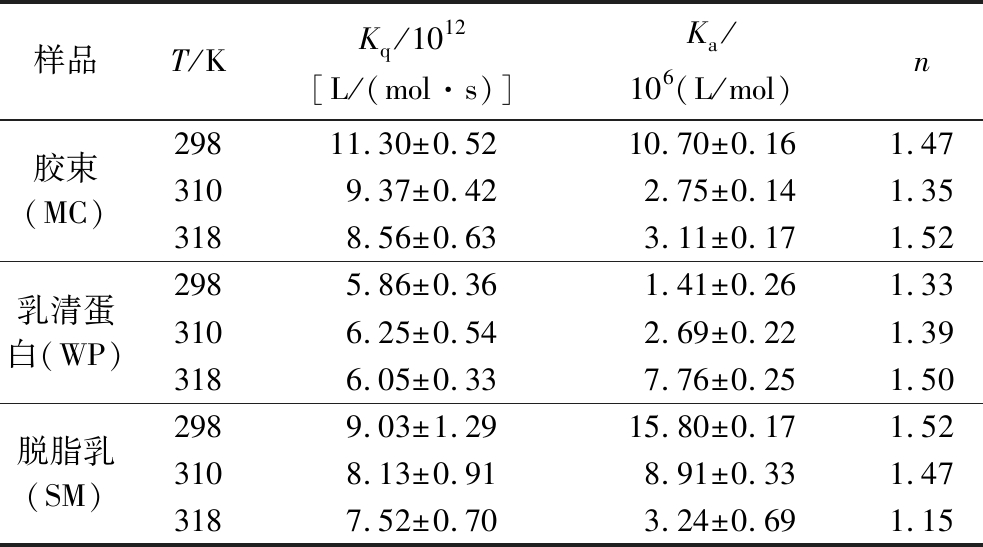
样品T/KKq/1012[L/(mol·s)]Ka/106(L/mol)n胶束(MC)29811.30±0.5210.70±0.161.473109.37±0.422.75±0.141.353188.56±0.633.11±0.171.52乳清蛋白(WP)2985.86±0.361.41±0.261.333106.25±0.542.69±0.221.393186.05±0.337.76±0.251.50脱脂乳(SM)2989.03±1.2915.80±0.171.523108.13±0.918.91±0.331.473187.52±0.703.24±0.691.15
据报道,SPI与叶绿素的Ka为6.397 2×104 L/mol[6],低于乳清蛋白对叶绿素的Ka;酪蛋白酸钠与叶绿素的Ka为8.99×105 L/mol[20],与酪蛋白胶束对叶绿素的Ka相似。本团队前期研究发现,乳清蛋白对槲皮素的Ka为3.88×104 L/mol[19];酪蛋白胶束对咖啡酸的Ka为3.09×104 L/mol,对咖啡酸苯乙酯的Ka为5.69×106 L/mol,对大黄素的Ka为5.636×103 L/mol[14-15]。由此可见,乳蛋白与活性分子的结合常数与乳蛋白类型及活性分子结构有关。
2.2 复合物的FTIR分析
如图2所示,其中叶绿素在3 320、2 927、1 616、1 558 cm-1处的峰分别为O—H、C—H、C![]() C和C
C和C![]() N伸缩振动,1 415 cm-1处为—COOH对称伸缩振动[22-23]。脱脂乳、乳清蛋白和酪蛋白胶束的FTIR谱图相似,3 294 cm-1处为氨基峰,1 640 cm-1处为C
N伸缩振动,1 415 cm-1处为—COOH对称伸缩振动[22-23]。脱脂乳、乳清蛋白和酪蛋白胶束的FTIR谱图相似,3 294 cm-1处为氨基峰,1 640 cm-1处为C![]() O伸缩振动峰(酰胺I带),1 519 cm-1处为N—H弯曲振动峰(酰胺II带),1 386 cm-1处为C—N伸缩和N—H弯曲振动峰(酰胺III带)[7]。脱脂乳中,1 028 cm-1处的峰为乳糖的C—O伸缩振动与糖环的振动[24]。与乳蛋白结合后,叶绿素的部分特征峰消失(如1 558、1 391 cm-1处的峰),说明乳蛋白与叶绿素形成了复合物。与叶绿素结合后,乳蛋白的酰胺Ⅰ带、Ⅱ带、Ⅲ带均未发生明显移动,说明叶绿素的结合对乳蛋白空间结构影响不大。本团队前期研究发现,乳清蛋白与槲皮素结合后,其空间结构显著变化,具体表现为α-螺旋结构含量增加[19];酪蛋白胶束与咖啡酸、咖啡酸苯乙酯、大黄素结合后,二级结构未发生显著变化[14-15]。另外,乳清蛋白、β-乳球蛋白与多酚,如矢车菊素-3-O-葡萄糖苷、蓝莓花青素结合后,二级结构变化较为明显[25-26]。本研究结果与文献产生差异的可能原因在于活性分子结构及其用量不同,不同活性分子与乳蛋白的结合作用不同。
O伸缩振动峰(酰胺I带),1 519 cm-1处为N—H弯曲振动峰(酰胺II带),1 386 cm-1处为C—N伸缩和N—H弯曲振动峰(酰胺III带)[7]。脱脂乳中,1 028 cm-1处的峰为乳糖的C—O伸缩振动与糖环的振动[24]。与乳蛋白结合后,叶绿素的部分特征峰消失(如1 558、1 391 cm-1处的峰),说明乳蛋白与叶绿素形成了复合物。与叶绿素结合后,乳蛋白的酰胺Ⅰ带、Ⅱ带、Ⅲ带均未发生明显移动,说明叶绿素的结合对乳蛋白空间结构影响不大。本团队前期研究发现,乳清蛋白与槲皮素结合后,其空间结构显著变化,具体表现为α-螺旋结构含量增加[19];酪蛋白胶束与咖啡酸、咖啡酸苯乙酯、大黄素结合后,二级结构未发生显著变化[14-15]。另外,乳清蛋白、β-乳球蛋白与多酚,如矢车菊素-3-O-葡萄糖苷、蓝莓花青素结合后,二级结构变化较为明显[25-26]。本研究结果与文献产生差异的可能原因在于活性分子结构及其用量不同,不同活性分子与乳蛋白的结合作用不同。

图2 MC-C、WP-C、SM-C复合物FTIR图
Fig.2 FTIR spectra of MC-C, WP-C, and SM-C complexes
2.3 复合物微观形貌分析
如图3所示,游离叶绿素为块状,表面凹凸不平,形状不规则。喷干的乳蛋白及其与叶绿素的复合物为葡萄干状,粒径分布在2~10 μm,与文献报道一致[27-28]。其中,结合叶绿素后,乳清蛋白凹陷程度增大,多数样品呈半球形中空结构。然而,叶绿素对酪蛋白胶束的形貌影响不大。蛋白质样品的形貌与蛋白基质的性质、水分扩散程度有关[29]。由于酪蛋白胶束呈纳米级球形,结构较为稳定,在结合叶绿素后和喷干过程中不易发生变形,因此其形貌变化不大。而乳清蛋白分子结构柔性较大,与叶绿素结合后,在喷干过程中随着水分和叶绿素一起向液滴外侧扩散,因此出现较大凹陷。脱脂乳中含有4.76%~4.92%乳糖[21],在喷干过程中扩散速率较大分子快,因其迅速向液滴外侧扩散,致使干燥样品的凹陷程度低于酪蛋白胶束及乳清蛋白;添加少量叶绿素不会显著改变其形貌。由此可见,叶绿素对乳清蛋白形貌的影响程度大于其对酪蛋白胶束和脱脂乳形貌的影响。

图3 MC-C、WP-C、SM-C复合物SEM图
Fig.3 SEM images of MC-C, WP-C, and SM-C complexes
2.4 复合物溶解性分析
如图4所示,在pH 2和3时,乳清蛋白和酪蛋白胶束具有较好的溶解性,溶解率超过96%;脱脂乳的溶解性低于乳清蛋白和酪蛋白胶束,在84%~88%之间,这是因为脱脂乳中含有乳糖,也有脂肪残留,其在酸性条件下溶解性不及乳蛋白高。所有样品均在pH 4.5时溶解性最差,该处接近乳蛋白的等电点。在pH 6~8内,所有样品溶解性逐渐增加,但脱脂乳和乳清蛋白在pH 9、10时溶解性逐渐降低,可能为蛋白质变性所致。

图4 MC-C、WP-C、SM-C复合物溶解性
Fig.4 Solubility of MC-C, WP-C, and SM-C complexes
在pH 4.5~8,与叶绿素结合后的复合物溶解性较未结合乳蛋白均有所改善,这是因为叶绿素带有负电荷,在该pH范围内与乳蛋白结合后有利于增加乳蛋白链上的负电荷,从而增加蛋白分子间斥力,使其分散性和溶解性变好[20]。在pH 2~4,叶绿素的结合均降低了乳蛋白的溶解性,其中在pH 2时较为明显,这可能是因为叶绿素在酸性条件下负电荷被中和所致。
2.5 复合物热稳定性分析
乳蛋白和叶绿素复合物的DSC、TG、DTG曲线如图5所示。由图5-a可以看出,叶绿素在270、475 ℃出现放热峰,分别为叶绿素的熔化和分解峰[7]。与乳蛋白结合后,该放热峰消失,证实了复合物的形成。与未结合叶绿素的乳蛋白相比,复合物的DSC曲线变化趋势未发生显著改变。
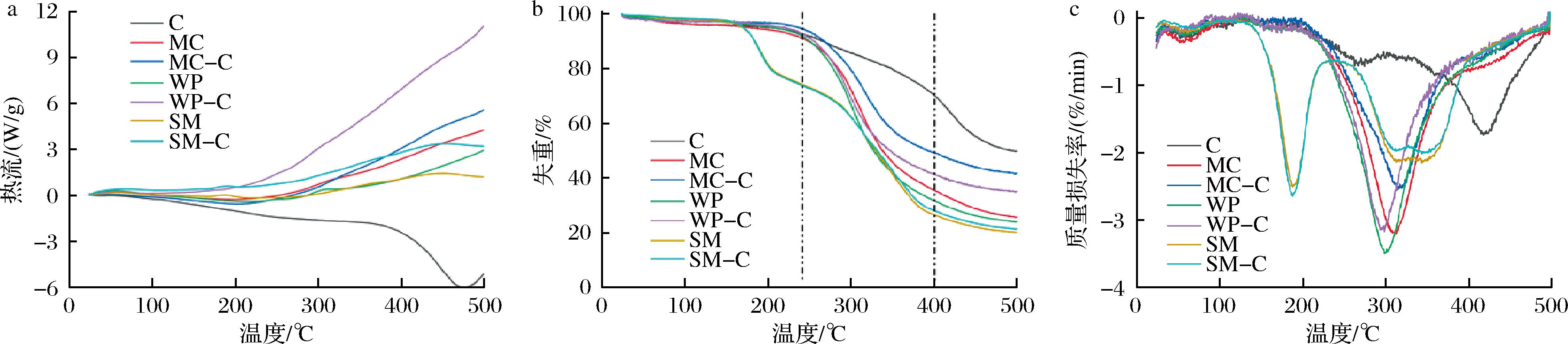
a-DSC曲线;b-TG曲线;c-DTG曲线
图5 MC-C、WP-C、SM-C复合物的DSC、TG、DTG曲线
Fig.5 DSC, TG and DTG curves of MC-C, WP-C, and SM-C complexes
复合物的TG曲线如图5-b所示,脱脂乳及其与叶绿素的复合物经历3次失重,其余样品均经历2次失重。所有样品的第一次失重是在80 ℃左右,为水分蒸发。脱脂乳及其与叶绿素的复合物第二次失重出现在150~215 ℃,为乳糖熔化所致[30];第三失重阶段为270~400 ℃,为乳蛋白分解所致[14],乳清蛋白、酪蛋白胶束及其与叶绿素的复合物在该阶段均出现明显失重。与叶绿素结合后,乳清蛋白的残留量增加,酪蛋白胶束的残留量降低,脱脂乳的残留量基本不变。酪蛋白胶束与叶绿素结合过程为放热过程,其复合物能量降低,热分解后残余量减少;而乳清蛋白与叶绿素的结合过程为吸热过程,复合物能量升高,残余量增加。由于脱脂乳中含有大量乳糖等其他成分,叶绿素对其残余量影响不大。
由复合物的DTG曲线(图5-c)可知,乳清蛋白的分解温度约为300 ℃,酪蛋白胶束的分解温度为314 ℃。脱脂乳出现2个分解温度,第1个为188 ℃,为乳糖的熔点;第2个在300~350 ℃,为乳蛋白的分解温度。与叶绿素结合后,复合物DTG曲线与游离乳蛋白的DTG曲线相似,说明叶绿素对乳蛋白的热稳定性影响不大。
2.6 复合物的色度分析
色度是食品颜色的表征,其中L*表示亮度,L*=0表示黑色,L*=100表示白色;a*表示绿(-)、红(+)两种色彩变化;b*表示蓝(-)、黄(+)2种色彩变化[7]。乳蛋白与叶绿素复合物的色度如表2所示。叶绿素亮度值较低,绿度值较大,以墨绿色为主。复合物中,脱脂乳-叶绿素的亮度值最大,这是因为脱脂乳中含有乳糖。乳清蛋白与叶绿素复合物的绿度值最大,是因为乳清蛋白呈现乳白色。3种复合物的亮度值和绿度值差异显著(P<0.05),黄度值差异不显著(P>0.05)。与叶绿素相比,复合物的亮度、绿色度和黄色度均增加,这是由于结合过程中使叶绿素分子分散性变好,在乳蛋白白色度的衬托下更能体现出黄绿色,而游离叶绿素呈聚集状态,主体呈现一定程度的黑色,与何思宇[20]研究结果一致。AGARRY等[7]的研究中,SPI/壳聚糖-叶绿素复合物的L*为41.09,低于本文研究结果,可能是因为叶绿素含量不同。
表2 叶绿素与乳蛋白复合物的色度
Table 2 The chromaticity of milk protein-chlorophyll complexes

样品L∗a∗b∗ΔE0 d30 d0 d30 d0 d30 d0 d30 dC40.09±0.1130.45±0.18-10.58±0.01-2.43±0.095.92±0.116.40±0.4112.64±0.19MC-C57.91±0.09c56.83±0.41c-20.04±0.11a-19.35±0.37a16.18±0.04a16.77±0.09a22.64±0.23c21.80±0.25cWP-C59.50±0.12b58.77±0.25b-20.52±0.03c-19.55±0.10a16.22±0.14a16.92±0.05a24.12±0.22b23.46±0.07bSM-C68.24±0.16a67.44±0.32a-20.28±0.03b-19.26±0.13a16.35±0.03a16.87±0.09a31.55±0.05a30.72±0.34a
贮藏30 d后,游离叶绿素的色度变化较大,其中亮度值、绿度值降低,黄度值有所增加,说明叶绿素发生了降解。AGARRY等[7]研究发现,叶绿素降解后主要呈现橄榄棕色,与本文研究结果一致。经乳蛋白负载后,贮藏期间叶绿素色度变化较小。由此可见,乳蛋白负载有利于改善叶绿素的颜色稳定性,且复合物呈现黄绿色,色泽较游离叶绿素好。
2.7 复合物中叶绿素的释放性分析
如图6所示,在模拟胃液消化过程中,复合物和游离叶绿素的释放率均较低,这是因为胃液的强酸性环境不利于叶绿素及乳蛋白溶解,因此叶绿素释放率较低。在模拟肠液消化10 h过程中,酪蛋白胶束负载的叶绿素释放率最高,脱脂乳负载的叶绿素释放率最低。酪蛋白胶束-叶绿素复合物中叶绿素的模拟肠液消化释放率8 h内呈线性增加,增速较为平缓,8 h后迅速增大。游离叶绿素与酪蛋白胶束负载的叶绿素释放率变化趋势类似,但释放率低于酪蛋白胶束负载的叶绿素。另外,乳清蛋白负载的叶绿素与脱脂乳负载的叶绿素模拟肠液释放曲线相似,其在6 h内缓慢增加,之后迅速释放。由于酪蛋白胶束结构稳定性较高,叶绿素结合在酪蛋白胶束表面,加上其良好的溶解性,在消化过程中易于释放,因此释放率最高。与游离叶绿素相比,酪蛋白胶束负载促进了叶绿素的释放,这可能是因为酪蛋白负载削弱了叶绿素分子的聚集,增大了其溶解性,从而促进了叶绿素的释放[23]。脱脂乳中含有大量乳糖以及微量脂肪,这些成分在喷干过程中更易于扩散到液滴表面,影响了叶绿素的释放,因此脱脂乳中叶绿素释放率较低[31]。消化24 h后,游离叶绿素累积释放率最低,仅为(38.29±3.47)%,这可能是因为游离叶绿素稳定性较差,在光、酶、热以及碱性条件下易分解,其在模拟肠液消化过程中大量分解所致[32]。
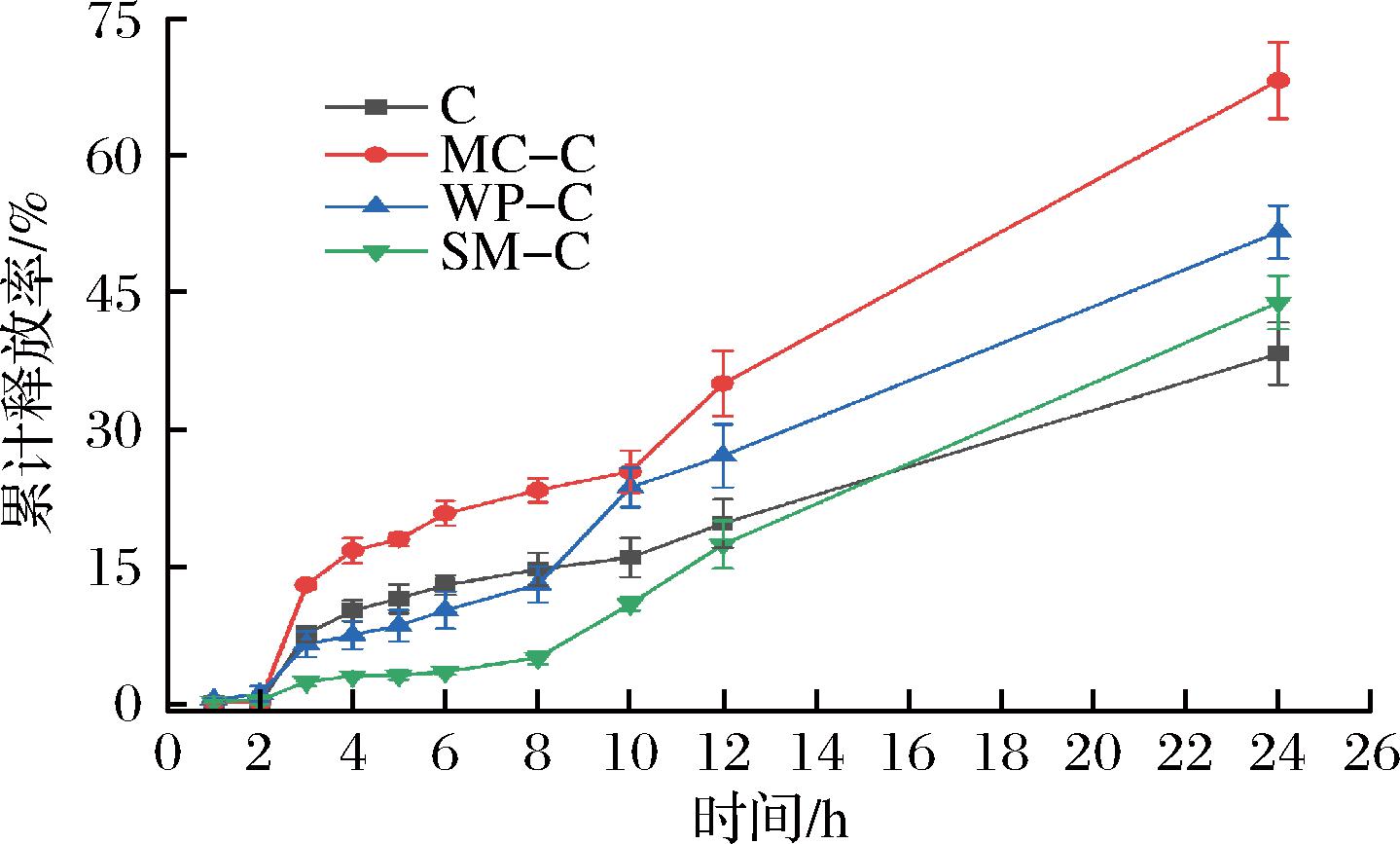
图6 复合物中叶绿素的模拟胃肠消化释放曲线
Fig.6 Release profile of chlorophyll from complexes during simulated gastrointestinal digestion
3 结论
叶绿素与酪蛋白胶束、乳清蛋白和脱脂乳可发生相互作用,自发形成静态复合物。3种类型乳蛋白对叶绿素均具有较高的亲和性,其结合常数高于106 L/mol。然而,叶绿素结合不改变乳蛋白的二级结构及其热稳定性。乳清蛋白与叶绿素形成微胶囊后,其表面凹陷程度加深,甚至出现中空结构;但酪蛋白胶束与脱脂乳形貌未发生明显改变。另外,叶绿素结合改善了乳蛋白在弱酸性和中性条件下的溶解性。乳蛋白负载后,叶绿素的颜色稳定性显著提升,且其24 h模拟胃肠消化释放率提升。综上所述,酪蛋白胶束、乳清蛋白和脱脂乳负载均可改善叶绿素的稳定性。
[1] 金子涵, 李韵唱, 陈丽君, 等.明胶/果胶复合凝沉制备叶绿素微胶囊及其性质研究[J].食品与发酵工业, 2023, 49(7):190-197.
JIN Z H, LI Y C, CHEN L J, et al.Preparation and properties of chlorophyll microcapsules by complex coacervation using gelatin and pectin[J].Food and Fermentation Industries, 2023, 49(7):190-197.
[2] 洪军, 张开放, 李倩, 等.韭菜叶绿素的提取、稳定性及微胶囊制备的研究[J].中国食品添加剂, 2021, 32(9):66-72.
HONG J, ZHANG K F, LI Q, et al.Study on extraction, stability and microcapsule preparation of chlorophyll from leek[J].China Food Additives, 2021, 32(9):66-72.
[3] CERVANTES-PAZ B, YAHIA E M, DE JES S ORNELAS-PAZ J, et al.Antioxidant activity and content of chlorophylls and carotenoids in raw and heat-processed Jalape
S ORNELAS-PAZ J, et al.Antioxidant activity and content of chlorophylls and carotenoids in raw and heat-processed Jalape o peppers at intermediate stages of ripening[J].Food Chemistry, 2014, 146:188-196.
o peppers at intermediate stages of ripening[J].Food Chemistry, 2014, 146:188-196.
[4] KANG Y R, LEE Y K, KIM Y J, et al.Characterization and storage stability of chlorophylls microencapsulated in different combination of gum Arabic and maltodextrin[J].Food Chemistry, 2019, 272:337-346.
[5] ARMESTO J, G MEZ-LIMIA L, CARBALLO J, et al.Impact of vacuum cooking and boiling, and refrigerated storage on the quality of galega kale (Brassica oleracea var. acephala cv.Galega)[J].LWT-Food Science and Technology, 2017, 79:267-277.
MEZ-LIMIA L, CARBALLO J, et al.Impact of vacuum cooking and boiling, and refrigerated storage on the quality of galega kale (Brassica oleracea var. acephala cv.Galega)[J].LWT-Food Science and Technology, 2017, 79:267-277.
[6] CAO J R, LI F W, LI Y Y, et al.Hydrophobic interaction driving the binding of soybean protein isolate and chlorophyll:Improvements to the thermal stability of chlorophyll[J].Food Hydrocolloids, 2021, 113:106465.
[7] AGARRY I E, WANG Z R, CAI T, et al.Chlorophyll encapsulation by complex coacervation and vibration nozzle technology:Characterization and stability study[J].Innovative Food Science &Emerging Technologies, 2022, 78:103017.
[8] CAO J R, LI Y Y, LI F W, et al.Effect of high hydrostatic pressure on chlorophyll/soybean protein isolate interaction and the mixtures properties[J].Food Hydrocolloids, 2022, 128:107555.
[9] HE S Y, ZHANG N, JING P.Insights into interaction of chlorophylls with sodium caseinate in aqueous nanometre-scale dispersion:Color stability, spectroscopic, electrostatic, and morphological properties[J].RSC Advances, 2019, 9(8):4530-4538.
[10] 笪晓薇, 齐婷, 柯威, 等.膜分离技术在乳品加工行业中的应用[J].膜科学与技术, 2022, 42(4):157-162.
DA X W, QI T, KE W, et al.Applications of membrane separation technology in the dairy industry[J].Membrane Science and Technology, 2022, 42(4):157-162.
[11] CARTER B G, CHENG N, KAPOOR R, et al.Invited review: Microfiltration-derived casein and whey proteins from milk[J].Journal of Dairy Science, 2021, 104(3):2465-2479.
[12] MOHAMMADIAN M, SALAMI M, MOMEN S M, et al.Enhancing the aqueous solubility of curcumin at acidic condition through the complexation with whey protein nanofibrils[J].Food Hydrocolloids, 2019, 87:902-914.
[13] CHEN W J, WANG W J, MA X B, et al.Effect of pH-shifting treatment on structural and functional properties of whey protein isolate and its interaction with (-)-epigallocatechin-3-gallate[J].Food Chemistry, 2019, 274:234-241.
[14] QIN J J, YANG M, WANG Y C, et al.Interaction between caffeic acid/caffeic acid phenethyl ester and micellar casein[J].Food Chemistry, 2021, 349:129154.
[15] YANG M, WEI Y M, ASHOKKUMAR M, et al.Effect of ultrasound on binding interaction between emodin and micellar casein and its microencapsulation at various temperatures[J].Ultrasonics Sonochemistry, 2020, 62:104861.
[16] 王楠, 杨敏, 郑杰, 等.酪蛋白胶束对原花青素稳定性的影响[J].食品与发酵工业, 2023, 49(3):164-174.
WANG N, YANG M, ZHENG J, et al.Effect of micellar casein on the stability of proanthocyanidins[J].Food and Fermentation Industries, 2023, 49(3):164-174.
[17] 曾秋兵, 杨敏, 王裕成, 等.喷雾干燥工艺对胶束态酪蛋白结构及抗氧化性的影响[J].食品与发酵工业, 2020, 46(6):140-147.
ZENG Q B, YANG M, WANG Y C, et al.Effect of spray-drying conditions on the structure and antioxidant activities of micellar casein[J].Food and Fermentation Industries, 2020, 46(6):140-147.
[18] 刘培秀, 赵美萱, 杨梅, 等.西兰花粉营养成分及理化性质研究[J].食品工业科技, 2022, 43(11):326-333.
LIU P X, ZHAO M X, YANG M, et al.Study on the nutrient components and physicochemical properties of broccoli flour[J].Science and Technology of Food Industry, 2022, 43(11):326-333.
[19] JI W, YANG F M, YANG M.Effect of change in pH, heat and ultrasound pre-treatments on binding interactions between quercetin and whey protein concentrate[J].Food Chemistry, 2022, 384:132508.
[20] 何思宇. 叶绿素-酪蛋白纳米分散体系的构建及初步评价[D].上海:上海交通大学, 2019.
HE S Y.Preparation and preliminary evaluation of chlorophylls-casein nanodispersion[D].Shanghai:Shanghai Jiao Tong University, 2019.
[21] AKKERMAN M, JOHANSEN L B, RAUH V, et al.Relationship between casein micelle size, protein composition and stability of UHT milk[J].International Dairy Journal, 2021, 112:104856.
[22] ZHANG Z H, PENG H D, WOO M W, et al.Preparation and characterization of whey protein isolate-chlorophyll microcapsules by spray drying:Effect of WPI ratios on the physicochemical and antioxidant properties[J].Journal of Food Engineering, 2020, 267:109729.
[23] YANG Z S, SONG H Y, YANG K M, et al.The physicochemical properties and the release of sodium caseinate/polysaccharide gum chlorophyll multiple-layer particles by rotary side-spray fluid bed technology[J].Food Chemistry, 2022, 394:133442.
[24] 邓月娥, 周群, 孙素琴.FTIR光谱法与奶粉的品质分析[J].光谱学与光谱分析, 2005, 12:1972-1974.
DENG Y E, ZHOU Q, SUN S Q.Quality analysis of powdered milk via FTIR spectroscopy[J].Spectroscopy and Spectral Analysis, 2005, 12:1972-1974.
[25] HE W J, MU H B, LIU Z M, et al.Effect of preheat treatment of milk proteins on their interactions with cyanidin-3-O-glucoside[J].Food Research International, 2018, 107:394-405.
[26] KHALIFA I, NIE R Z, GE Z Z, et al.Understanding the shielding effects of whey protein on mulberry anthocyanins:Insights from multispectral and molecular modelling investigations[J].International Journal of Biological Macromolecules, 2018, 119:116-124.
[27] SUN Y J, CHEN J H, ZHANG S W, et al.Effect of power ultrasound pre-treatment on the physical and functional properties of reconstituted milk protein concentrate[J].Journal of Food Engineering, 2014, 124:11-18.
[28] HETTIARACHCHI C A, VORONIN G L, HARTE F M.Spray drying of high pressure jet-processed condensed skim milk[J].Journal of Food Engineering, 2019, 261:1-8.
[29] SADEK C, LI H S, SCHUCK P, et al.To what extent do whey and casein micelle proteins influence the morphology and properties of the resulting powder?[J].Drying Technology, 2014, 32(13):1540-1551.
[30] LUQUE DE CASTRO M D, PRIEGO-CAPOTE F.Ultrasound-assisted crystallization (sonocrystallization)[J].Ultrasonics Sonochemistry, 2007, 14(6):717-724.
[31] ER B, SERT D, MERCAN E.Production of skim milk powder by spray-drying from transglutaminase treated milk concentrates:Effects on physicochemical, powder flow, thermal and microstructural characteristics[J].International Dairy Journal, 2019, 99:104544.
[32] HSIAO C J, LIN J F, WEN H Y, et al.Enhancement of the stability of chlorophyll using chlorophyll-encapsulated polycaprolactone microparticles based on droplet microfluidics[J].Food Chemistry, 2020, 306:125300.