虾青素(astaxanthin)是类胡萝卜素的一种,为一种较强的天然抗氧化剂[1]。与其他类胡萝卜素一样,虾青素属于一种脂溶性的色素,抗氧化能力强,为维生素E的550倍、β-胡萝卜素的10倍。虾青素在水产资源中分布广泛,其中雨生红球藻公认是天然虾青素的良好来源[2]。虾青素在体外和体内模型中均显示出潜在的生物学活性,对动物和人类代谢均有较好作用[3]。虾青素用作营养补充剂,抗氧化剂和抗癌剂,可预防糖尿病、心血管疾病和神经退行性疾病,并刺激免疫[4-8]。虾青素产品以多种剂型作为保健食品在市场发售。虾青素作为一类脂溶性类胡萝卜素类物质,自身存在水溶性差的特性,导致其在生物体内生物利用度较低,这在部分肠胃功能障碍以及消化系统功能弱的特殊人群中表现更为显著,因此,对藻源虾青素类产品生物利用度的研究是促进其作为功效因子应用的重要环节[9-10]。
生物利用度,指药物活性成分从制剂释放吸收进入全身循环的速度和程度,其可作为药物制剂质量的重要指标[11]。生物利用度的影响因素在于以下两方面[12-13]:剂型因素(药物由制剂中的释放速度),如活性成分的溶解性、pKa值、某些剂型特性、工艺条件等;生理因素(活性成分释放后的吸收速度和吸收分数),如胃肠道液体环境、活性成分在胃肠道的转运形式、吸收部位表面积和局部血流、代谢、肠道菌群、疾病因素等。改进方法主要围绕在增加活性成分的表面积、提高活性成分的溶解度或两种手段联合应用等方法上。随着新技术、新材料的发展,难溶性成分通过剂型修饰,经口服也可获得较好的吸收和生物利用度。在现有研究中[14-15],微囊剂型对活性成分的生物利用度具有显著的提升作用已被明确报道,其原因包括增加活性成分的水溶性,保护易降解成分,增强其稳定性,增加活性成分的释放和胃肠道吸收的表面积/体积比等。为了改善虾青素作为功能食品的稳定性和生物利用度,可以通过微囊化、乳化等手段将其进行剂型改造,改善其溶解性并提高释放度。因此,本实验旨在考察并对比虾青素各剂型间的生物利用度差异。
在口服类产品生物利用度的体外考察过程中,由于应尽可能模拟摄入产品后体内的吸收过程,即胃肠道的消化吸收,且不同产品、剂型的生物利用度差异主要表现在胃肠道环境释放差异及小肠吸收差异,因此,本实验分别在模拟胃肠道释放能力及小肠上皮透过率两方面考察不同制剂的虾青素在体外的消化吸收情况。
1 材料与方法
1.1 材料与试剂
XanGuard®雨生红球藻虾青素油10%、XanGuard®雨生红球藻虾青素微囊粉2.5%,XanGuard®雨生红球藻虾青素微粒2.5%、XanGuard®雨生红球藻虾青素乳液1%,均为质量分数,由大连医诺生物股份有限公司提供。
胃蛋白酶、胰酶,国药集团化学试剂有限公司;胆盐,北京奥博星生物技术有限责任公司;HCl、NaOH,科密欧化学试剂有限公司。
人源克隆结肠癌细胞Caco-2(30~50代), American Type Culture Collection;DMEM高糖细胞培养基、胎牛血清,Thermo Scientific;非必需氨基酸、青霉素-链霉素双抗溶液、胰蛋白酶-EDTA消化液,北京索莱宝科技有限公司;CCK-8细胞增殖及毒性检测试剂盒、DMEM高糖无酚红细胞培养基,大连美仑生物技术有限公司;Transwell细胞培养小室,Corning公司。
1.2 仪器与设备
RC-8DS溶出度仪,新天光分析仪器技术有限公司;雷磁PHS-3C pH计,上海仪电科学仪器股份有限公司;安捷伦1260型高效液相色谱仪,安捷伦科技有限公司;超净工作台,苏州净化设备总厂;低温高速离心机、3111细胞培养箱,Thermo Fisher Scientific;YS2倒置生物显微镜,日本Nikon公司;Infinit M PLEX多功能酶标仪,瑞士Tecan公司;Millicell-ERS跨膜电阻检测仪,MERCK公司。
1.3 实验方法
1.3.1 体外消化模拟
各制剂设置3个平行组。分别称取1 g虾青素油、4 g虾青素微囊粉、4 g虾青素微粒、10 g虾青素乳液(各制剂约含虾青素100 mg),与400 mL PBS混合加入1 mol/L HCl溶液调节pH值到2.0后,加入胃蛋白酶,使其质量浓度为0.42 mg/mL,调节溶出度仪搅拌桨转速为100 r/min,反应温度为37 ℃,开始模拟胃消化。并在模拟胃消化开始后的30、60、90、120 min取样,样品过滤除去固体不溶物后,取滤液进行测定。
结束胃消化后,搅拌桨继续搅拌,每组加入0.1 mol/L NaOH溶液,调节pH值至6.8~7.0,加入胰酶及猪胆盐粉末,使其终质量浓度为0.25、3.0 mg/mL,搅拌均一后开始计时,并在模拟肠消化开始后的30、60、90、120 min取样,过滤样品溶液后,取各时间点消化液样品滤液进行测定。根据公式(1)求得虾青素释放度,所得的消化终产物留存用于后续细胞实验。
释放度![]()
(1)
式中:C,溶解在消化液中的虾青素含量,%;C0,总虾青素含量,%。
1.3.2 Caco-2细胞培养
Caco-2细胞培养在含有10%(体积分数)胎牛血清、1%(体积分数)青霉素-链霉素溶液、1%(体积分数)非必需氨基酸溶液的DMEM高糖细胞培养基中,置于37 ℃,5% CO2的培养箱中进行常规培养。
1.3.3 Caco-2细胞活力检测
以1×104个细胞/孔为最终接种密度,将Caco-2细胞接种于96孔板中,待细胞密度生长至80%左右时,加入DMEM梯度稀释的各制剂消化终产物,孵育24 h后,吸弃消化终产物稀释液,并用PBS洗2遍,加入含体积分数10%的CCK-8的培养基,置于细胞培养箱中,避光反应1 h后,多功能酶标仪检测细胞活力,选择波长450 nm处检测各孔内吸光度,根据公式(2)计算细胞存活率。
细胞存活率![]()
(2)
式中:As,虾青素处理孔吸光度;Ac,虾青素未处理孔吸光度;Ab,不含细胞孔吸光度。
1.3.4 细胞透过率检测
将Caco-2细胞以5×104个细胞/cm2接种在具有可渗透性聚碳酸酯膜的12孔transwell小室中。在小室顶端侧(apical side,AP)加入0.5 mL细胞悬液,基底侧(basolateral side,BL)加入1.5 mL完全培养液。隔天更换AP及BL培养基,1周后每天换液,培养至21 d。期间利用跨膜电阻仪评估跨上皮电阻(transepithelial electrical resistance,TEER)来验证Caco-2细胞单层的完整性和致密性。当TEER>350 Ω/cm2时,认为Caco-2细胞单层模型成功建立。
弃去小室上下层培养液,以PBS缓冲液小心润洗小室上下层,充分洗去残余培养基。考察虾青素各制剂消化终产物从AP到BL的转运,在AP加入0.5 mL DMEM高糖无酚红细胞培养基稀释的虾青素各制剂消化终产物,BL加入1.5 mL空白DMEM高糖无酚红细胞培养基,置于培养箱进行模拟小肠上皮的吸收透过。于1、3、5、8、12 h各取BL小室溶液100 μL,并补足同体积DMEM高糖无酚红细胞培养基,检测各时间点BL虾青素含量,根据公式(3)计算表观渗透系数进而推导生物利用度。
(3)
式中:Papp,表观渗透系数,cm/s;dQ/dT,单位时间透过单层膜药量,pmol/s;A,单细胞层表面积(膜面积),cm2;C0,起始上层小室溶液浓度,pmol/L。
1.3.5 虾青素样品含量检测
本实验中采用内标法,使用液相色谱进行消化液样本及细胞样本中的虾青素含量检测。称取适量反式-β-阿朴-8-胡萝卜醛,以丙酮溶解作为内标溶液,终质量浓度为0.01 mg/mL。精密称取10%虾青素油标准品0.1 g于100 mL棕色容量瓶中,以丙酮定容为标准储备液,再精密吸取2 mL标准储备液于50 mL棕色容量瓶中,以丙酮定容为标准使用液。精密移取2 mL样品溶液、标准使用液,1 mL内标溶液、3 mL胆固醇酯酶-Tris-HCl溶液(pH 7.0),混匀后37 ℃水浴反应45 min,再加入1 mL丙酮、1 g Na2SO4·10H2O、2 mL石油醚,涡旋,3 000 r/min,5 min离心萃取,吸取石油醚层,加入1 g Na2SO4,室温条件N2吹干石油醚,准确加入2 mL丙酮,涡旋振荡溶解过滤,进行HPLC分析。
色谱条件:色谱柱TMC-C18柱,4.6 mm×250 mm×5 μm;流动相组成如下:溶剂A,V(磷酸)∶V(H2O)=1∶99;溶剂B,甲醇;溶剂C,甲基叔丁基醚,流速1.0 mL/min;进行如下方式的梯度洗脱:初始,6% A/84% B/10% C;15 min变为6% A/71% B/23% C,保持8 min;8 min后变为6% A/21% B/73% C,保持4 min,4 min后变为6% A/84% B/10% C,保持8 min(均为体积分数)。检测波长为474 nm,进样量20 μL,柱温30 ℃。
2 结果与分析
2.1 虾青素各剂型的体外消化模拟
本研究首先探究了在体外消化模拟过程中各制剂的体外消化情况。在体外消化过程中,虾青素各制剂在胃肠道pH及消化酶作用下使虾青素释放到消化液体系中。图1为虾青素油、虾青素微囊粉、虾青素微粒、虾青素乳液的释放度曲线。由图1可知,除乳液外,不同运载体系的虾青素均在体外肠道消化过程中表现出较高的释放,在模拟胃液环境消化完成后,虾青素油、微囊粉、微粒、乳液释放度分别为0%、52.88%、38.41%、72.10%,在模拟肠道消化完成后,虾青素油、微囊粉、微粒、乳液释放度分别达到14.73%、93.71%、89.07%、67.11%。根据上述结果,提示在胃肠道消化过程中微囊粉、微粒、乳液运载体系表现出较好的虾青素释放度。其中虾青素乳液在整个胃肠道消化过程中释放较为稳定。
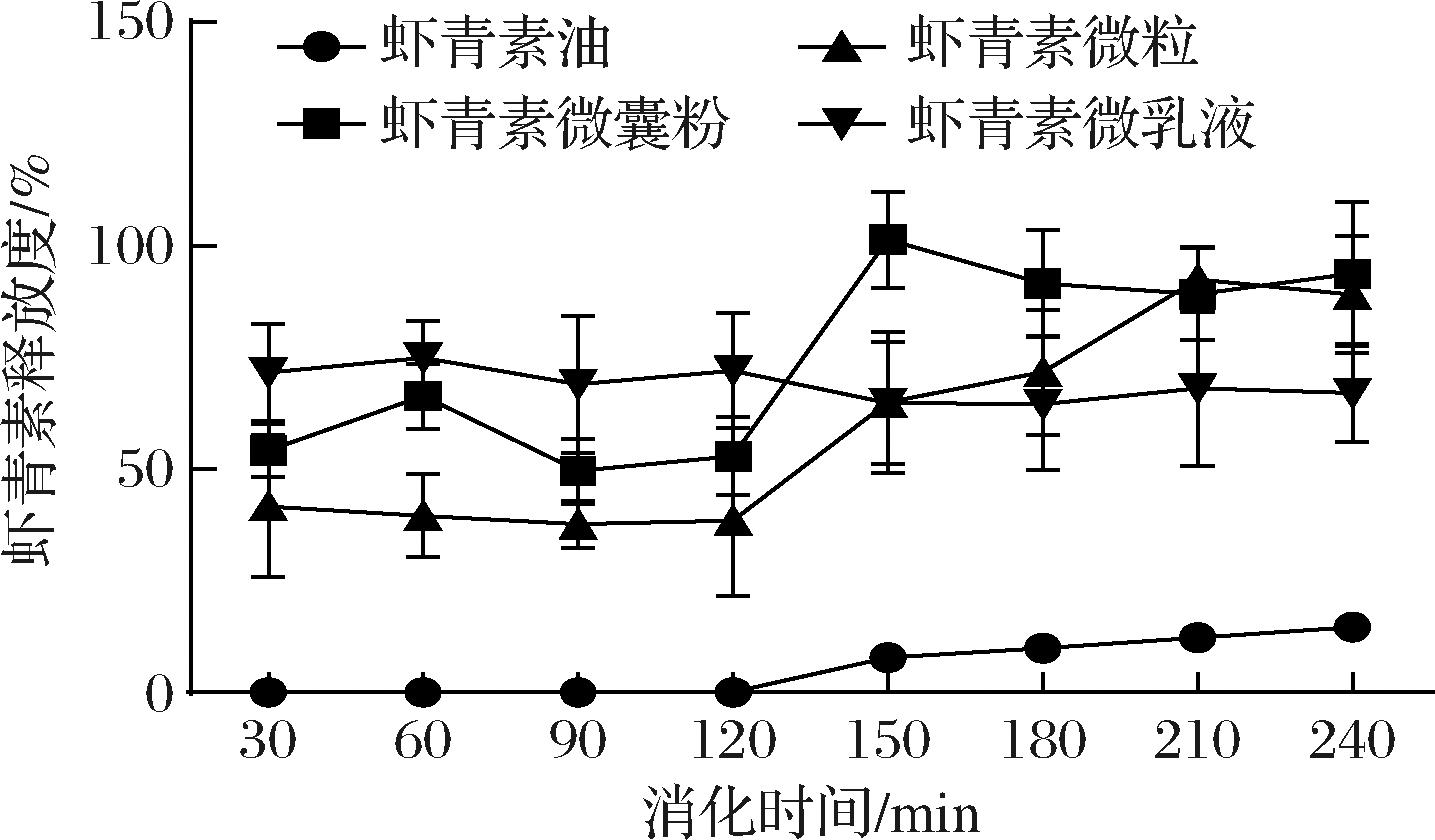
图1 各剂型虾青素在体外消化中的释放度
Fig.1 Release rate of astaxanthin in different forms during in vitro digestion
2.2 虾青素各剂型消化终产物细胞毒性检测
为了探究虾青素各制剂消化终产物对细胞活力的影响,将各制剂消化终产物进行梯度稀释后给予细胞24 h,通过CCK-8法检测细胞活力变化,所得结果如图2所示,各剂型消化终产物稀释梯度选择10倍、20倍、40倍。虾青素油、虾青素微囊粉、虾青素微粒及虾青素乳液制剂消化终产物在稀释40倍时对细胞活力无较大影响,细胞存活率分别为85.36%、94.02%、93.76%、97.16%,因此在后续消化终产物透过率实验中对各制剂终产物的稀释倍数设置为40倍。
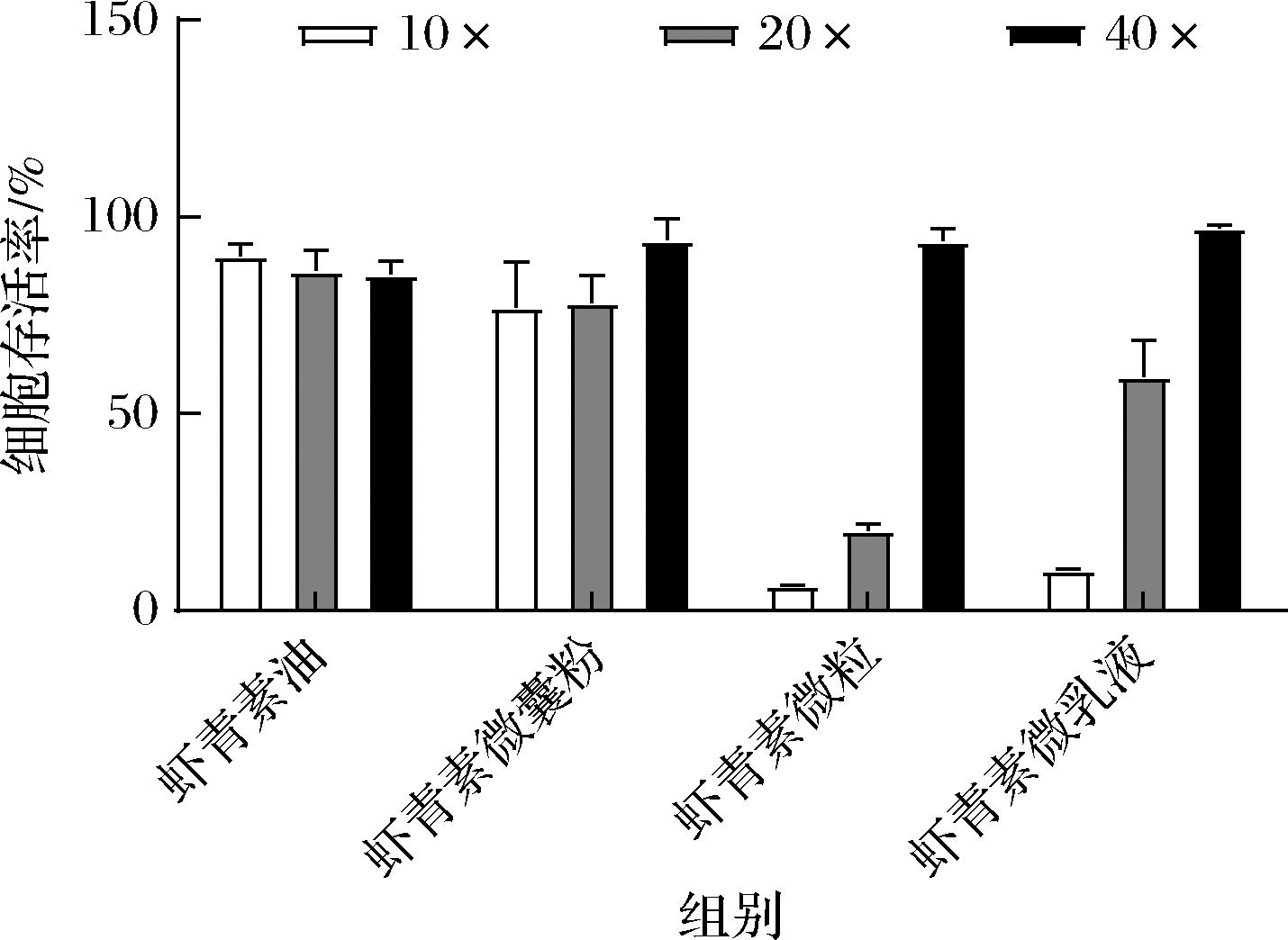
图2 各剂型虾青素消化终产物对Caco-2细胞存活率的影响
Fig.2 Effect of final digestion products of different formulations of astaxanthin on the cell viability of Caco-2
2.3 虾青素各剂型消化终产物在Caco-2细胞单层膜的跨膜转运检测
2.3.1 Caco-2细胞单层膜的建立
图3为Caco-2细胞在transwell小室中的生长曲线,Caco-2细胞的跨膜电阻随着培养时间的增加逐渐升高,在培养周期达到7 d后,跨膜电阻达到268 Ω/cm2,后期电阻增长速度变慢,于培养21 d后电阻达到372 Ω/cm2,且在显微镜下观察细胞状态较好,成膜后并未出现显著的细胞死亡。提示Caco-2细胞单层膜建立完好,可进行虾青素各制剂消化终产物的透过率实验。
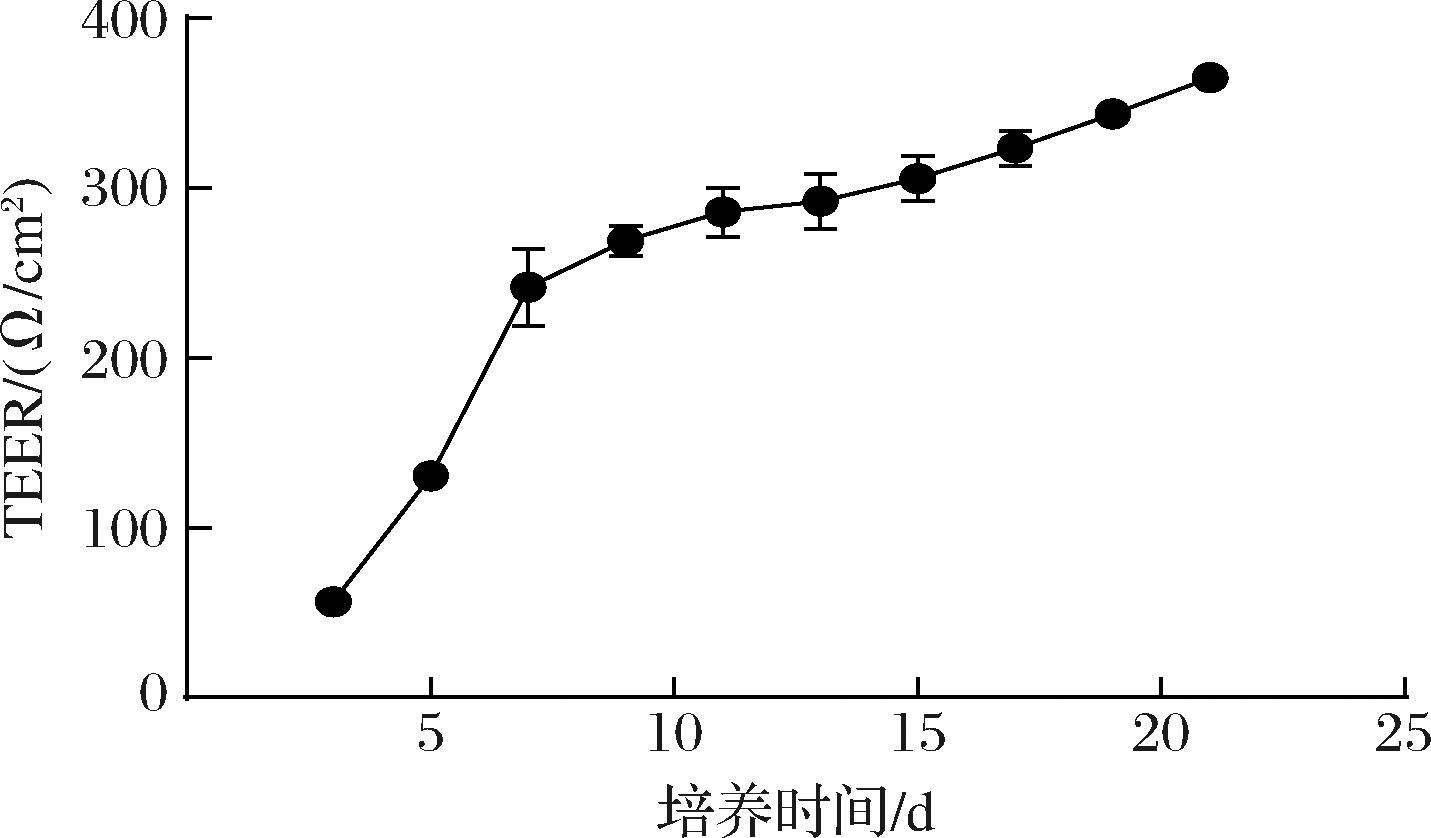
图3 Caco-2细胞单层膜TEER变化曲线
Fig.3 The change trend line of TEER in Caco-2 cell monolayer
2.3.2 虾青素各剂型消化终产物在Caco-2细胞单层透过率检测
在transwell小室AP加入以无血清无酚红培养基稀释40倍的虾青素各制剂消化终产物,考察在1~12 h内虾青素透过情况。取BL透过样本进行虾青素含量检测,计算表观渗透系数Papp,所得实验结果如图4所示,虾青素油、微囊粉、微粒及乳液的Papp(AP→BL)分别为0.058×10-6、0.483×10-6、0.461×10-6、0.656×10-6 cm/s,乳液的Papp显著高于其他3种制剂消化终产物,微囊粉及微粒表现出相似的Papp,即在4种制剂中,乳液最易于透过模拟小肠上皮,而模拟小肠上皮对微囊粉及微粒消化终产物的透过率并未表现出较大差异,油剂型的消化终产物最难透过模拟小肠上皮。
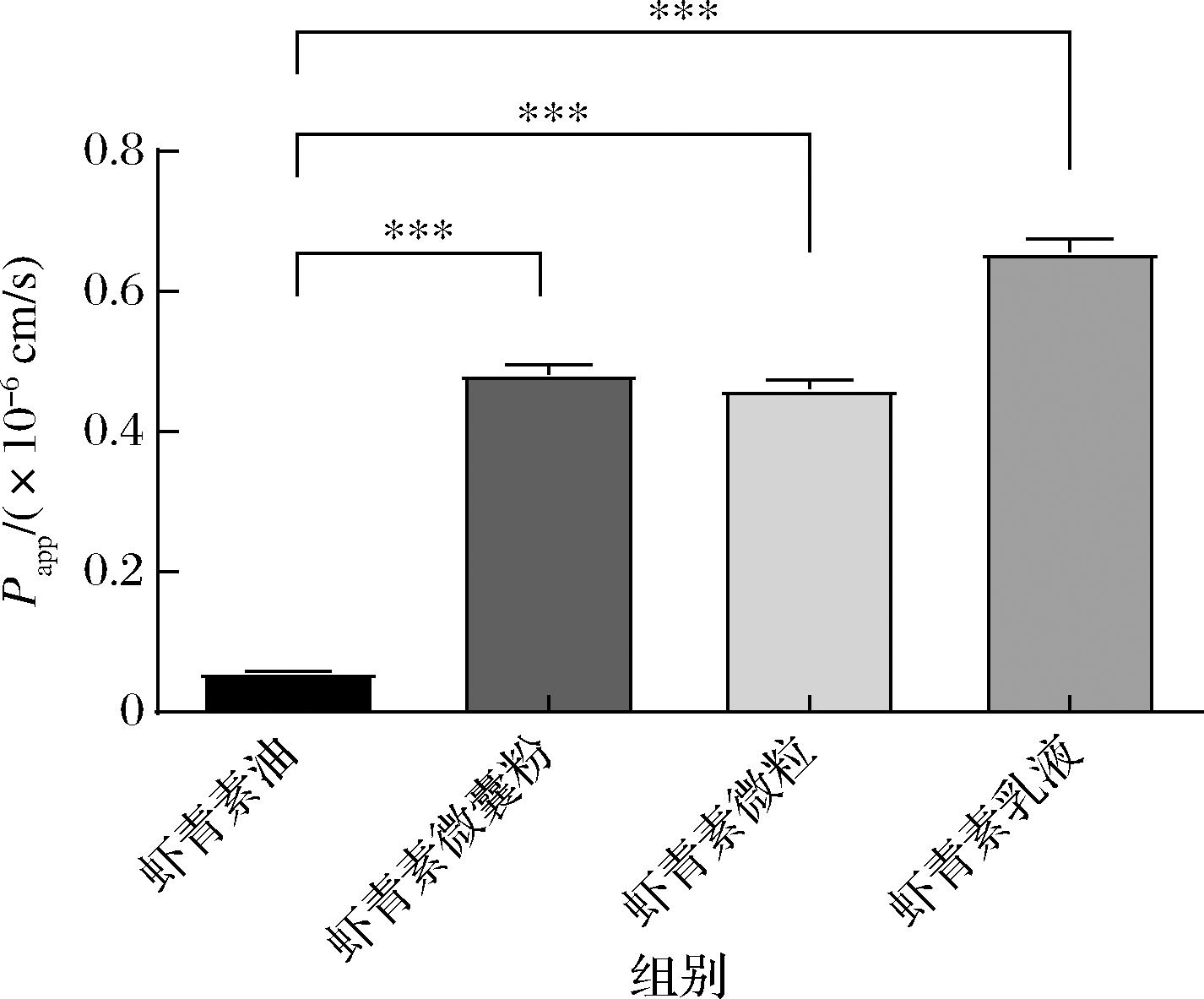
图4 不同制剂的虾青素消化终产物的表观渗透系数
Fig.4 Apparent permeability coefficient of the final digestion products of different formulations of astaxanthin
注:***表示P<0.001。
3 结论与讨论
在本研究中主要探究了不同制剂类型的虾青素在体外消化中的释放度及在Caco-2单层细胞膜的透过特性,旨在体外水平反映虾青素在不同制剂中可能存在的生物利用度差异。以未制剂化的虾青素油为对比,体现了制剂后的虾青素对吸收利用的促进情况。
虾青素是一种脂溶性天然色素类胡萝卜素,因其对人类健康的潜在益处而闻名。然而,由于其较低的生物利用度,在食品工业中的应用受到限制。口服脂溶性活性成分补充剂吸收利用低下的原因大致可归纳为3种:活性成分溶解度和溶出速率较低;活性成分的胃肠道黏膜渗透性较差;在体内快速消除。因此在本实验所涉及剂型的生物利用度比较中,主要对不同虾青素制剂的胃肠道消化过程及肠道黏膜渗透性两方面进行体外模拟。高玉云等[16] 研究发现,类胡萝卜素的消化吸收主要发生在肠道消化阶段,且由于其亲脂性,使类胡萝卜素的肠道吸收存在一定的限制。在本研究中,首先通过在体外模拟胃肠道消化过程,虾青素微囊粉、微粒及乳液在模拟胃肠液中均表现出了较高的释放。根据文献报道,虾青素油在肠道环境中与胆盐及胰酶形成了包裹虾青素的水溶性胶束,进而可被小肠上皮吸收并进一步代谢。将虾青素油进行制剂化,与适当的赋形剂及聚合物等结合,制备为乳液、微囊粉、微粒剂型后,形成了坚固的包封系统,在消化液中以稳定的分散体系存在,既能保护虾青素,提高稳定性,又能提高虾青素与胃肠道消化酶接触的表面积,使虾青素释放度显著提升[17-18]。在3种制剂中,微囊粉更易在模拟胃肠道消化条件下分解,使虾青素释放,显著促进了虾青素的消化吸收。此外,微粒在体外消化模拟中具有与微囊粉相似的消化特性,但与微囊粉相比在虾青素释放速度上有所减慢,表现出了一定的缓释现象。原因可能在于虾青素微粒剂型的制备在微囊粉基础上,经过了水溶性保护层的多重包埋,使其释放速度减慢。乳液为稳定的乳化体系,乳液形式的虾青素降解速率显著降低,且由于其较小的粒径,除具有增加虾青素稳定性的优势外,近一步增加了虾青素暴露于消化液中消化酶的表面积,使其更易于被消化,表现为更高的释放度,提高生物可获得率。综上所述,本研究涉及的对虾青素的制剂化修饰形式,可显著提升虾青素释放度,进一步促进其在小肠上皮的吸收代谢。
Caco-2细胞来源于人类结肠癌细胞,其结构和生化特点类似于人类小肠上皮细胞,其特点在于连续生长分化一段时间后可形成具有小肠上皮结构的单层细胞膜,含有与小肠刷状缘上皮相关的酶,能够在细胞水平提供关于药物分子通过小肠黏膜的吸收、代谢、转运信息,广泛用于体外模拟小肠上皮生理结构功能[19]。该模型操作简便,重现性好,可评价不同实验条件下药物的跨膜转运速率[20]。在该细胞模型中,通常用Papp值来评价药物在肠道的吸收情况,Papp>10-6cm/s时生物利用度为100%;Papp值为(0.1~10)×10-6 cm/s,生物利用度为1%~100%;Papp<10-7 cm/s,则生物利用度<1%。在本实验中,首先将虾青素各制剂的消化终产物给予Caco-2细胞,考察制剂配方、消化液成分等对细胞的潜在毒性,将消化终产物稀释到不影响细胞活力的倍数再进行透过率检测。将生长状态良好的Caco-2细胞在transwell小室中培养约21 d左右后形成模拟小肠上皮,该阶段通过检测细胞电阻确定培养时间。形成模拟通过小肠上皮给予稀释后消化液样本,检测一段时间各制剂消化终产物透过模拟小肠上皮虾青素含量,计算Papp值进而推导各制剂对小肠上皮吸收的促进作用。实验结果表明,虾青素油属于吸收率较低的制剂形式,而虾青素制剂化后Papp值显著提高,更易被吸收。微囊粉、微粒等制剂由于粒径较小、增溶、增加稳定性、增加吸收表面积等优势,对于许多生物利用度低的成分可显著提高其吸收利用[21-22]。在本实验体外消化过程中的胃消化阶段,由于pH、静电相互作用及消化酶的影响等因素,微囊粉、微粒结构已经被打开,即在透过率实验中微囊粉及微粒表现出相似的透过率。在虾青素制备为乳液后,除具有较高的虾青素释放度外,模拟小肠透过率还可进一步提升。引起该现象的原因可能是乳液与微囊粉、微粒相比,具有更低的粒径,更易穿过模拟小肠上皮而被吸收,即具有更高的生物利用度。
综上所述,本研究在体外水平研究了虾青素不同制剂形式的消化、吸收过程。结果表明,通过设计不同类型的制剂形式可以有效提高虾青素的释放度及转运,一定程度上改善了虾青素生物利用度低的问题,后续在虾青素的应用中可根据不同的应用场景选择不同的剂型。但本实验得出的体外生物利用度比较,为通过细胞实验推导估算得到,无法涵盖所有体内影响因素,因此本实验所得结果与体内实验所得生物利用度可能存在一定差异,后续仍需开展体内实验进一步验证结果。
[1] HIGUERA-CIAPARA I, FÉLIX-VALENZUELA L, GOYCOOLEA F M.Astaxanthin:A review of its chemistry and applications[J].Critical Reviews in Food Science and Nutrition, 2006, 46(2):185-196.
[2] 高桂玲, 成家杨, 马炯.雨生红球藻和虾青素的研究[J].水产学报, 2014, 38(2):297-304.
GAO G L, CHENG J Y, MA J.Research review of Haematococcus pluvialis and astaxathin[J].Journal of Fisheries of China, 2014, 38(2):297-304.
[3] 姜燕蓉, 刘锴锴, 齐筱莹, 等.虾青素的生物功效及其运载体系研究现状[J].食品与发酵工业, 2019, 45(13):250-256.
JIANG Y R, LIU K K, QI X Y, et al.Biological activities and delivery systems of astaxanthin[J].Food and Fermentation Industries, 2019, 45(13):250-256.
[4] 肖素荣, 李京东.虾青素的特性及应用前景[J].中国食物与营养, 2011, 17(5):33-35.
XIAO S R, LI J D.Features of astaxanthin and its application prospects[J].Food and Nutrition in China, 2011, 17(5):33-35.
[5] 杨艳, 周宇红, 徐海滨, 等.虾青素抗氧化作用动物实验研究[J].现代预防医学, 2009, 36(13):2432-2433.
YANG Y, ZHOU Y H, XU H B, et al.Study on the antioxygenation of astaxanthin in mice[J].Modern Preventive Medicine, 2009, 36(13):2432-2433.
[6] 陈晋明, 王世平, 马俪珍, 等.虾青素抗氧化活性研究[J].营养学报, 2007, 29(2):163-165;169.
CHEN J M, WANG S P, MA L Z, et al.Study on anti-oxidation actity of astaxanthin[J].Acta Nutrimenta Sinica, 2007, 29(2):163-165;169.
[7] 陈志强, 任璐, 江慎华, 等.虾青素降血糖作用的研究 [J].食品科学, 2008, 29(7):402-404.
CHEN Z Q, REN L, JIANG S H, et al.Study on hypoglycemic effects of astaxanthin[J].Food Science, 2008, 29(7):402-404.
[8] 王茵, 刘淑集, 苏永昌, 等.天然虾青素的抗疲劳及抗氧化作用研究 [J].西南大学学报(自然科学版), 2015, 37(9):42-48.
WANG Y, LIU S J, SU Y C, et al.Study on the anti-fatigue and anti-oxidant effects of natural astaxanthin[J].Journal of Southwest University (Natural Science Edition), 2015, 37(9):42-48.
[9] 彭宇, 任晓丽, 陈林, 等.虾青素制剂技术及其对虾青素稳定性影响的研究进展 [J].中国油脂, 2019, 44(4):115-121.
PENG Y, REN X L, CHEN L, et al.Advance in preparation technology of astaxanthin and its effects on stability of astaxanthin[J].China Oils and Fats, 2019, 44(4):115-121.
[10] YANG C, ZHANG H A, LIU R H, et al.Bioaccessibility, cellular uptake, and transport of astaxanthin isomers and their antioxidative effects in human intestinal epithelial Caco-2 cells[J].Journal of Agricultural and Food Chemistry, 2017, 65(47):10223-10232.
[11] 赖珺, 廖正根, 杨明福, 等.生物利用度的研究进展[J].中国实验方剂学杂志, 2010, 16(18):226-229.
LAI J, LIAO Z G, YANG M F, et al.Research and progress of bioavailability[J].Chinese Journal of Experimental Traditional Medical Formulae, 2010, 16(18):226-229.
[12] TOUTAIN P L, BOUSQUET-MÉLOU A.Bioavailability and its assessment[J].Journal of Veterinary Pharmacology and Therapeutics, 2004, 27(6):455-466.
[13] GELLENBECK K, SALTER-VENZON D, LALA R, et al.A multicarotenoid beadlet for human nutrition-proof of concept of in vitro timed release [J].Acta Biochimica Polonica, 2012, 59(1):35-38.
[14] 龚秋翼, 钱俊青, 郭辉, 等.番茄红素微囊生物利用度检测的实验研究 [J].浙江工业大学学报, 2012, 40(2):129-132;187.
GONG Q Y, QIAN J Q, GUO H, et al.Experimental study on bioavailability detection of lycopene microencapsulation[J].Journal of Zhejiang University of Technology, 2012, 40(2):129-132;187.
[15] WONG C Y, AL-SALAMI H, DASS C R.Microparticles, microcapsules and microspheres:A review of recent developments and prospects for oral delivery of insulin[J].International Journal of Pharmaceutics, 2018, 537(1-2):223-244.
[16] 高玉云, 毕英佐, 谢青梅, 等.类胡萝卜素的吸收代谢及其功能的研究进展[J].动物营养学报, 2010, 22(4):823-829.
GAO Y Y, BI Y Z, XIE Q M, et al.Research advances in absorption, metabolism and function of carotenoid[J].Chinese Journal of Animal Nutrition, 2010, 22(4):823-829.
[17] DONOSO A, GONZ LEZ-DUR
LEZ-DUR N J, MU
N J, MU OZ A A, et al.Therapeutic uses of natural astaxanthin:An evidence-based review focused on human clinical trials [J].Pharmacological Research, 2021, 166:105479.
OZ A A, et al.Therapeutic uses of natural astaxanthin:An evidence-based review focused on human clinical trials [J].Pharmacological Research, 2021, 166:105479.
[18] FERRUZZI M G, LUMPKIN J L, SCHWARTZ S J, et al.Digestive stability, micellarization, and uptake of β-carotene isomers by Caco-2 human intestinal cells[J].Journal of Agricultural and Food Chemistry, 2006, 54(7):2780-2785.
[19] SHEN X E, ZHAO C H, LU J, et al.Physicochemical properties of whey-protein-stabilized astaxanthin nanodispersion and its transport via a Caco-2 monolayer[J].Journal of Agricultural and Food Chemistry, 2018, 66(6):1472-1478.
[20] YANG C, HASSAN Y I, LIU R H, et al.Anti-inflammatory effects of different astaxanthin isomers and the roles of lipid transporters in the cellular transport of astaxanthin isomers in Caco-2 cell monolayers[J].Journal of Agricultural and Food Chemistry, 2019, 67(22):6222-6231.
[21] 许良葵. 中药微囊制剂制备及应用研究进展[J].亚太传统医药, 2016, 12(10):55-56.
XU L K.Study on preparation and application of microcapsule preparation of traditional Chinese medicine[J].Asia-Pacific Traditional Medicine, 2016, 12(10):55-56.
[22] LI R L, CHEN R C, LIU W W, et al.Preparation of enteric-coated microcapsules of astaxanthin oleoresin by complex coacervation [J].Pharmaceutical Development and Technology, 2018, 23(7):674-681.