搅打稀奶油是一类以无水奶油为主要原料制备的搅打充气类食品,奶香浓郁、自然,乳液可用于生产酸奶、冰淇淋等乳制品,赋予产品良好的乳脂风味,搅打泡沫可用于烘焙食品的裱花、涂抹,深受消费者喜爱。我国搅打稀奶油行业起步较晚,如何保证产品有较高稳定性的同时兼具良好搅打品质是行业研究的热点及难点[1]。
产品的稳定性和搅打品质很大程度上受到乳液脂肪球界面膜及结晶脂肪的影响。界面膜的机械强度较高时,其空间稳定性强,脂肪球不易聚集,乳液稳定性强,但搅打过程中结晶脂肪发生部分聚结的难度也更高[2],搅打品质变差;乳液结晶脂肪的性质包括热力学性质、晶体尺寸和晶型,对产品的稳定性及搅打性能也有显著影响[3-5],热力学性质影响不同温度下乳液中固体脂肪含量(solid fat content,SFC),搅打稀奶油乳液中SFC质量占全部脂肪的30%~45%时具有良好的促进部分聚结作用[1, 6],可以达到更高的打发率,SFC过低时产品难以搅打成型,过高则导致乳液失稳[7],这是因为脂肪球内过多的晶体可能在加工或低温贮藏过程中刺破界面膜,导致液滴聚结,同样,当晶体的尺寸过大时也可能会引发这样的失稳现象,并且导致搅打泡沫结构粗糙、析水率高[8-9];结晶脂肪的晶型可分为α、β′、β 3种[10],乳液经快速冷却后发生结晶,首先形成α型结晶体,随后在低温贮藏过程中逐渐转变为稳定性更高的β′、β型[11],这种转变主要受温度、时间的影响。β′型晶体熔点适中,稳定性较好,晶体尺寸小,包裹空气能力强,是搅打稀奶油产品理想的晶型。
搅打稀奶油的传统工业生产中常通过高压均质增大总脂肪球膜比表面积从而提高产品稳定性,但过小的脂肪球粒径会导致产品难以打发[12],因此寻找均质处理中稳定性与搅打品质的平衡点非常重要;近年来有学者注意到通过调整均质压力、老化时间等工艺参数可以使β′晶型变明显,搅打泡沫品质更佳[9],然而结晶体尺寸也会变大,易引发乳液失稳,BOEKEL等[13]研究表明快速冷却的工艺无法达到减小晶体尺寸的目的。除优化工艺外,优化产品配方也是一种提高产品品质的有效方法,乳化剂作为最有效的稳定乳液的添加剂早已被应用于搅打稀奶油的生产中,其稳定乳液的机理为乳化剂分子吸附在油水界面处,显著降低界面张力,通过Gibbs-Marangoni效应增强乳液稳定性[14]。除此之外,有研究证明亲油型乳化剂对O/W乳液结晶脂肪性质有显著影响,典型的亲油乳化剂如单、双甘油脂肪酸酯(mono-and diglycerides,MAG),它可以作为脂肪结晶的异相成核位点改变结晶脂肪的性质,这为通过添加乳化剂在增强产品稳定性的同时提升搅打品质提供了理论依据。但目前相关文献大多侧重亲油乳化剂对SFC及结晶脂肪热力学性质的影响,鲜有多晶型变化研究,并且当亲油乳化剂与亲水乳化剂复配使用时脂肪结晶性质与产品品质变化间的关系不甚明确。
为研制兼具稳定性与搅打品质的高品质搅打稀奶油,本课题在前期实验中探究乳化剂总质量分数在0.00~0.60%的最适用量,实验结果发现当乳化剂总量为0.30%时产品打发率最高,脂肪球平均粒径较小,说明产品具有较好的乳液稳定性(实验结果未公开),但产品整体品质仍有较大提升空间。因此,本实验固定乳化剂总质量分数为0.3%,选取具有显著降低界面张力的亲水乳化剂吐温-80(TW-80)与MAG以一定比例复配制备搅打稀奶油,从乳液脂肪结晶性质、界面膜性质变化的角度揭示TW-80与MAG协同作用对产品品质的影响机理,为工业化生产高品质搅打稀奶油提供参考。
1 材料与方法
1.1 实验材料
无水奶油,新西兰安佳集团;生牛乳,扬州市扬大康源乳业有限公司;单甘油酯(有效成分为单硬脂酸甘油酯,含量约95%),广州佳力士添加剂公司;吐温-80,广东华纳化工有限公司;复配增稠剂,江苏省乳品生物技术与安全控制重点实验室提供。
1.2 实验仪器
APV-1000高压均质机,德国APV公司;TMS-Pro食品质构仪,美国FTC公司;DSC 8500差示扫描量热仪,美国PerkinElmer公司;Nano ZS90马尔文粒子分析仪、Malvern Kinexus Pro旋转流变仪,英国马尔文仪器公司;UDK159全自动凯氏定氮仪,北京盈盛恒泰科技公司;H2500R-2高速冷冻离心机,长沙湘仪仪器有限公司。
1.3 样品制备
1.3.1 乳化剂复配方法及添加量
复配乳化剂总质量分数固定为0.3%,2种乳化剂的比例分别设置为TW-80∶MAG(T∶M)=1∶1、1∶2、1∶3、1∶4、1∶5、1∶6(g∶g),制备600.0 g搅打稀奶油产品所需TW-80和MAG用量见下表:
表1 制备600.0 g搅打稀奶油所需TW-80和MAG添加量
Table 1 Amount of TW-80 and MAG needed to prepare 600.0 g of whipped cream
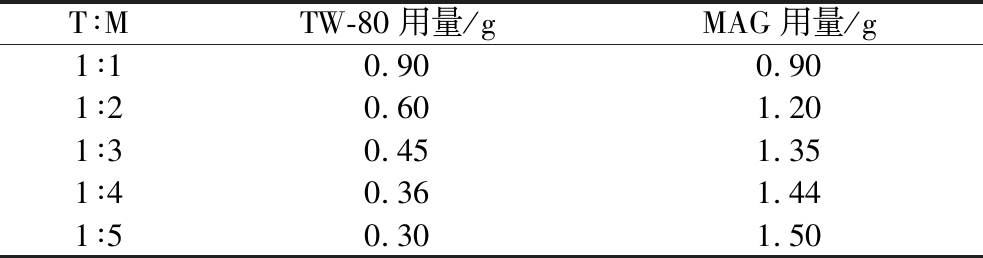
T∶MTW-80用量/gMAG用量/g1∶10.900.901∶20.601.201∶30.451.351∶40.361.441∶50.301.50
1.3.2 黄油基搅打稀奶油制备
无水奶油60 ℃熔化,生牛乳预热至60 ℃,按实验要求加入乳化剂,搅拌至完全溶解,将油相缓缓倒入水相,高速剪切10 min,使用高压均质仪以18 MPa/4 MPa压力进行二级均质,85 ℃/15 min杀菌处理,迅速冷却至4 ℃左右,所有产品在4 ℃冰箱老化24 h后测定数据。
1.4 数据测定
1.4.1 产品稳定性测定
1.4.1.1 粒度分布测定
采用马尔文粒子分析仪测定搅打稀奶油乳状液粒度分布,准确称量1.0 g乳状液,使用去离子水以1∶1 000的比例稀释,测试温度25 ℃,每个产品测试3次。
1.4.1.2 Turbiscan稳定性指数测定
将5 mL乳状液装入玻璃管,提交至Turbiscan Lab Expert machine,用脉冲近红外光源(波长880 nm)在30 ℃条件下扫描2 h,间隔10 min采点,平行测定2次。
1.4.2 产品搅打品质测定
1.4.2.1 搅打时间测定
准确称取200.0 g乳状液于搅打缸中,使用打蛋器在约160 r/min条件下搅打,记录从开始搅打直至形成坚挺峰形所需的时间,单位s,每个样品测试3次,结果取平均值。
1.4.2.2 打发率测定
分别将静态乳液和搅打成型的泡沫轻轻填充入25 mL铝盘,表面抹平,称量质量,每个产品重复测试3次,结果取平均值。打发率计算见公式(1):
打发率![]()
(1)
式中:m1,未搅打的稀奶油质量,g;m2,搅打后泡沫的质量,g。
1.4.2.3 泡沫析水率测定
准确称取30.0 g搅打泡沫于铜丝网,下置一个已恒重的烧杯接取析水,放于35 ℃恒温箱中,静置2 h后取出称量烧杯质量,每个产品重复测试3次,结果取平均值。计算见公式(2):
泡沫析水率![]()
(2)
式中:m1,2 h后析出水相质量,g;m2,称取的搅打泡沫的质量,g。
1.4.3 乳液界面膜性质测定
1.4.3.1 表观黏度测定
使用Kinexus Pro型旋转流变仪测定乳状液流变特性,取适量乳状液样品平铺于测试台上,选择转子型号CP4/40,测试温度4 ℃,剪切速率变化范围为0.1~100 s-1,以线性取点方式采集数据。平行测定3次。
1.4.3.2 液相蛋白质浓度测定
称取30.0 g乳状液于50 mL离心管,使用高速冷冻离心机于4 ℃,10 000×g离心30 min,吸取中层清液,使用全自动凯氏定氮仪测定液相中蛋白质浓度,结果从仪器直接读取,每个样品测试3次。
1.4.4 乳液结晶脂肪性质测定
1.4.4.1 热力学性质测定
称取10.0 mg样品于坩埚内,加盖密封,用N2控制温度,流速为45 mL/min,程序设置如下:(1)加热至80 ℃维持3 min至完全融化;(2)以5 ℃/min速率降温至-30 ℃;(3)-30 ℃维持3 min;(4)以5 ℃/min速率升温至40 ℃;得到乳液结晶脂肪的结晶、熔化曲线。平行测定2次。
1.4.4.2 脂肪晶型测定
准确移取200 μL待测乳状液,将待测乳状液样品铺满检测片上的方孔,水平放置于多晶X-射线衍射仪测量台上,测定同质多晶,扫描角度:3°<2θ<30°;扫描速度:2°/min;步长:0.02°。平行测定2次。
1.5 数据分析
各个测试指标的平行实验数据使用SPSS 22软件进行差异分析,结果使用(平均值±标准差)的形式表示,P<0.05,差异显著。数据使用Origin 2018软件绘图。
2 结果与分析
2.1 TW-80与MAG比例对搅打稀奶油稳定性的影响
通过测定搅打稀奶油的平均粒径、Turbiscan稳定性指数(turbiscan stability index,TSI)评价体系的稳定性。由斯托克斯定律可知,脂肪球平均粒径越小,沉降速率越小,产品稳定性更好[15];TSI是描述产品静置时体系内脂肪球运动剧烈程度的指标,由Turbiscan多重光散射仪检测,TSI数值越小,稳定性越好。
由图1-a可知,随着复配乳化剂中MAG比例增大,产品脂肪球粒度分布曲线逐渐右移,峰值降低,粒度分布范围变宽,当T∶M=1∶1时,脂肪球平均粒径最大仅有(1.06±0.19) μm,当T∶M=1∶6时脂肪球粒径最大可达(1.95±0.63) μm,即随着TW-80占比减小,产品平均粒径增大,与WU等[16]研究结果相符。这样的变化可归因于TW-80和MAG对脂肪球界面性质的影响不同,MAG属于亲油型乳化剂,倾向于形成W/O型乳液,而TW-80属于亲水型表面活性剂,能显著降低分散相界面张力,脂肪球最终粒径由乳化过程中脂肪球液滴破裂和重新聚结之间形成的平衡决定[17],TW-80分子降低界面张力,减小界面自由能,促进液滴破裂,形成的脂肪球粒径更小[18],因此当复配乳化剂中TW-80占比下降时,产品脂肪球粒径会增大。

a-粒度分布;b-TSI
图1 TW-80与MAG的比例(T∶M)对搅打稀奶油粒度分布和TSI的影响
Fig.1 Effect of Tween 80 to MAG ratio (T∶M) on particle size distribution and instability coefficient of whipped cream
由图1-b可知,测试2 h后,产品复配乳化剂中MAG占比越大,TSI数值越大,即乳液物理稳定性显著降低。这样的现象可以通过脂肪球粒径变化来解释,乳液稳定性与脂肪球的粒径密切相关,大粒径的脂肪球沉降速率更高,乳液颗粒迁移率和尺寸大小发生明显变化,乳液稳定性下降。从提高产品稳定性角度,搅打稀奶油复配乳化剂中TW-80与MAG的比例不应超过1∶4。
2.2 TW-80与MAG比例对搅打稀奶油搅打品质的影响
高品质搅打稀奶油应具备打发时间短、打发率高、泡沫稳定性良好等特点[19]。脂肪球界面膜处吸附着大量蛋白质,形成一层黏弹性的蛋白质膜,增强界面膜机械强度[20],搅打充气过程中结晶脂肪需要刺破界面膜完成部分聚结以形成完整泡沫结构,当更多的界面吸附蛋白质被乳化剂取代后,界面处吸附的蛋白质层变薄弱,液相中蛋白质浓度上升,搅打充气过程中形成部分聚结的难度下降,搅打时间变长;液相中游离的蛋白质具有良好的起泡能力[1],使得产品打发率上升;泡沫的析水率除与界面蛋白质膜有关外,还受体系表观黏度影响[21],体系表观黏度升高,搅打泡沫持水力上升。
由图2-a可知随着复配乳化剂中MAG占比增大,产品搅打时间呈显著增加(P<0.05),即完成部分聚结的难度上升,可预测随着复配乳化剂中MAG占比增大,复配乳化剂取代界面吸附蛋白质的能力减弱,界面膜机械强度较高,导致产品搅打时间长,这与图3-b中液相蛋白质浓度随复配乳化剂中MAG占比上升而下降的实验结果相符。由图2-b可知产品打发率先上升、后下降,且变化显著(P<0.05),当T∶M=1∶4时产品打发率最大达(158.9±1.23)%,产品搅打时间变长、液相蛋白质浓度上升都会提升产品打发率,当复配乳化剂中MAG占比较低时,虽然液相蛋白质浓度较高,但此时搅打时间过短,并且包裹空气的蛋白质膜强度较弱,新形成的蛋白质气泡易逸散,因此打发率较低;由图2-c可知,泡沫析水率先下降、后上升,当T∶M=1∶4时最低仅有(1.55±0.47)%,而T∶M=1∶6时,产品泡沫析水率显著上升至(9.56±0.64)% (P<0.05),此时产品泡沫持水力很差,结合图3-a表观黏度测定结果,可能的原因是体系表观黏度过低,屈服应力弱,导致泡沫抗析水能力下降。综上所述可知,若要使产品搅打时间短、打发率高、泡沫析水率低,应将TW-80与MAG比例控制为1∶3~1∶5。

a-搅打时间;b-打发率;c-泡沫析水率
图2 TW-80与MAG的比例(T∶M)对搅打稀奶油搅打时间、打发率、泡沫析水率的影响
Fig.2 Effect of Tween 80 to MAG ratio (T∶M) on stirring time, overrun, water extraction rate of whipped cream
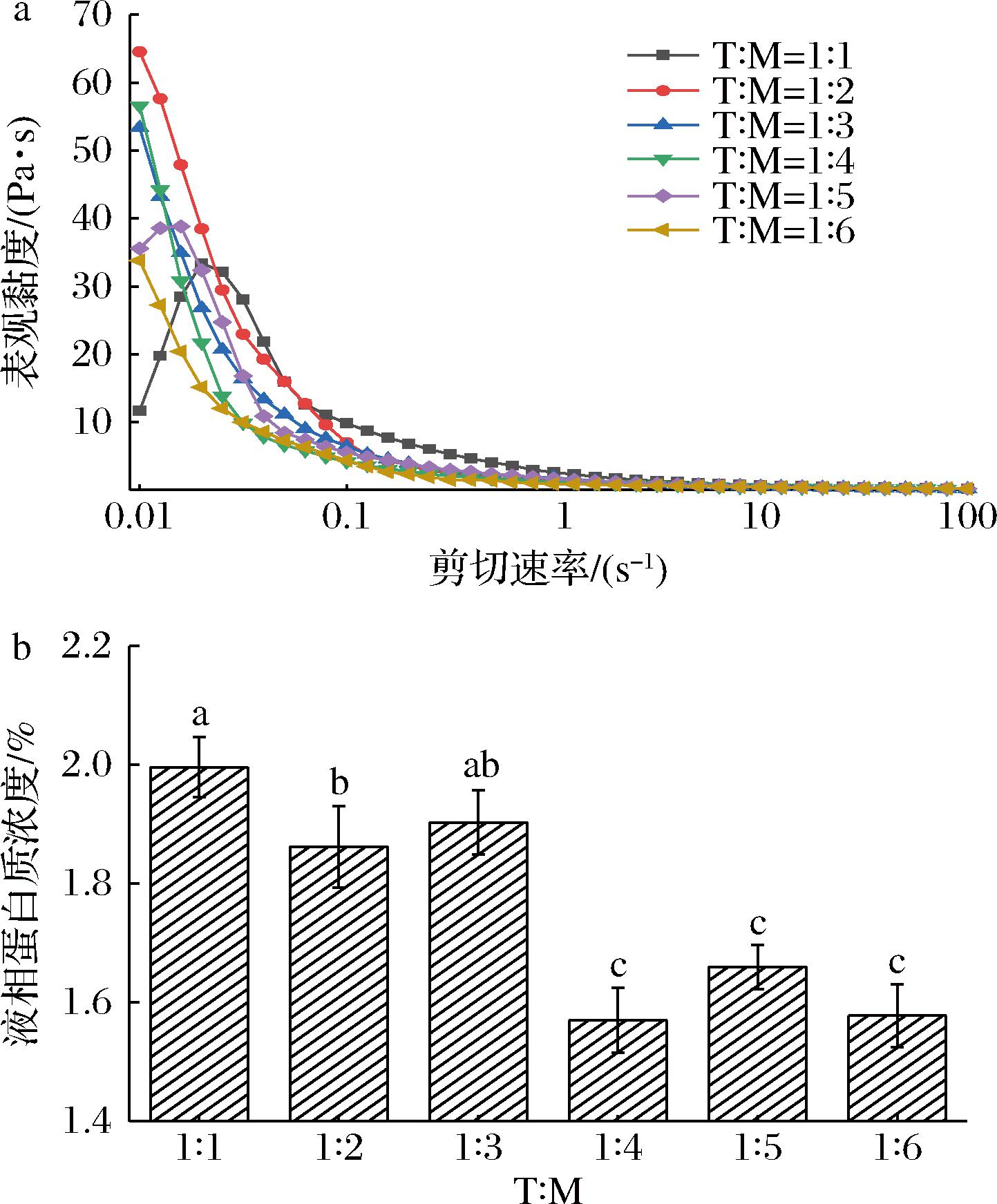
a-表观黏度;b-液相蛋白质浓度
图3 TW-80与MAG的比例(T∶M)对搅打稀奶油表观黏度和液相蛋白质浓度的影响
Fig.3 Effect of Tween 80 to MAG ratio (T∶M) on apparent viscosity and liquid protein concentration of whipped cream
2.3 TW-80与MAG比例对搅打稀奶油乳液中脂肪球界面膜性质的影响
通过测试剪切流变、液相蛋白质浓度评价产品脂肪球界面膜性质,脂肪球界面膜的性质主要受界面吸附的分子组成、排列影响。剪切流变对界面上生物大分子间的侧向相互作用敏感[1],反应脂肪球间的相互作用的强弱,主要受脂肪球间距、界面膜组成影响;液相蛋白质浓度的变化可以反应界面吸附蛋白质被取代的程度,揭示界面膜机械强度的变化,并且游离的蛋白质具有良好的包裹空气的能力,利于提升起泡率[22-23]。由图3-a可知,除T∶M=1∶1产品外,其余产品的表观黏度随剪切速率增大而下降,即剪切稀化[24],这是因为脂肪球之间的相互作用被逐渐上升的剪切速率破坏。而T∶M=1∶1产品在剪切速率为0.01~0.02 s-1时表观黏度却呈现反常的上升趋势,这可能是因为该产品中TW-80的添加量高,TW-80分子内亲水性聚乙氧基脱水山梨糖醇酯尾部大量附着在液滴表面,脂肪球间相互作用变强,使乳液表观黏度增大[25],对较低的剪切速率不敏感。除反常部分外,在相同剪切速率作用下产品的表观黏度随复配乳化剂中MAG比例增大而降低,结合图1-a,当产品脂肪球粒径越小,产品表观黏度越高,这是因为乳液中脂肪球粒径减小,数量增多,脂肪球间距缩短,脂肪球间相互作用增强,使产品表观黏度升高[26]。
由图3-b可知,随着复配乳化剂中MAG占比增大,产品液相蛋白质浓度显著下降(P<0.05)。亲水乳化剂取代界面吸附蛋白质的能力比亲油乳化剂更强[27],当复配乳化剂中TW-80比例减小,MAG占比升高,取代界面吸附蛋白质的能力也相应减弱,表现为液相中的蛋白质浓度显著下降。当T∶M达到1∶4~1∶6时,产品中液相蛋白质浓度无显著差异,这可能是由于MAG浓度较高,此时界面性质由小分子乳化剂主导,复配乳化剂与界面处吸附的蛋白质处于动态平衡。由上述实验结果可知,当复配乳化剂中MAG占比变大,界面吸附蛋白质被取代的程度下降,界面膜的机械强度较高,产品稳定性增强;但与此同时脂肪球粒径增大,使得产品表观黏度下降,不利于乳液长期稳定性[1]。若要使产品兼具良好的搅打品质和乳液稳定性,应将复配乳化剂中TW-80与MAG的比例控制为1∶3~1∶4。
2.4 TW-80与MAG比例对搅打稀奶油乳液中脂肪结晶性质的影响
通过测定产品脂肪结晶、熔融曲线及晶型来评价不同的TW-80、MAG比例对结晶脂肪热力学性质及多晶型转变的影响。结晶脂肪的含量及物理状态极大地影响搅打稀奶油乳液稳定性和搅打性能,产品在一定温度中含有30%~45%结晶脂肪表明产品可以在该温度下有良好搅打品质,这要求结晶脂肪具有一定的耐热性。由图4-a、图4-b及表2可知,当T∶M由1∶1逐渐变为1∶6时,产品开始结晶温度TCon及结晶峰值温度TC1整体呈现下降-上升-下降-上升的复杂变化,当T∶M=1∶5时达到最低,分别为(-20.3±1.3) ℃、(-20.5±1.3) ℃;结晶脂肪开始熔化的温度TMon无明显差异,而两个熔化峰的峰值温度TM1及TM2均呈先上升、后下降的趋势,当T∶M=1∶5时产品TM1、TM2最高,分别为(2.6±0.3)、(15.4±0.4) ℃,熔化过程吸收总焓最高,达(187.5±6.8) J/g,由图4-b实验结果可知,当T∶M=1∶5时,产品结晶脂肪的耐热性最好,一方面MAG是甘油三酯衍生物,可以与油相很好地互溶,作为结晶脂肪异相成核的位点[18],增加了结晶脂肪的含量,这可以通过表2中吸收总焓、释放总焓的变化证明;另一方面MAG本身熔点较高[18],可以提高低熔点结晶脂肪的熔化温度[28],增强结晶脂肪的耐热性。

a-结晶曲线;b-熔化曲线;c-晶体形态;d-β′晶型含量
图4 TW-80与MAG的比例(T∶M)对搅打稀奶油结晶曲线、熔化曲线、晶体形态及β′晶型含量的影响
Fig.4 Effect of Tween 80 to MAG ratio (T∶M) on crystallization curve, melting curve, crystal morphology, and β′ crystal content of whipped cream
表2 TW-80与MAG的比例(T∶M)对搅打稀奶油脂肪结晶、熔化温度的影响
Table 2 Effect of Tween 80 to MAG ratio (T∶M) on fat crystallization and melting temperature of whipped cream
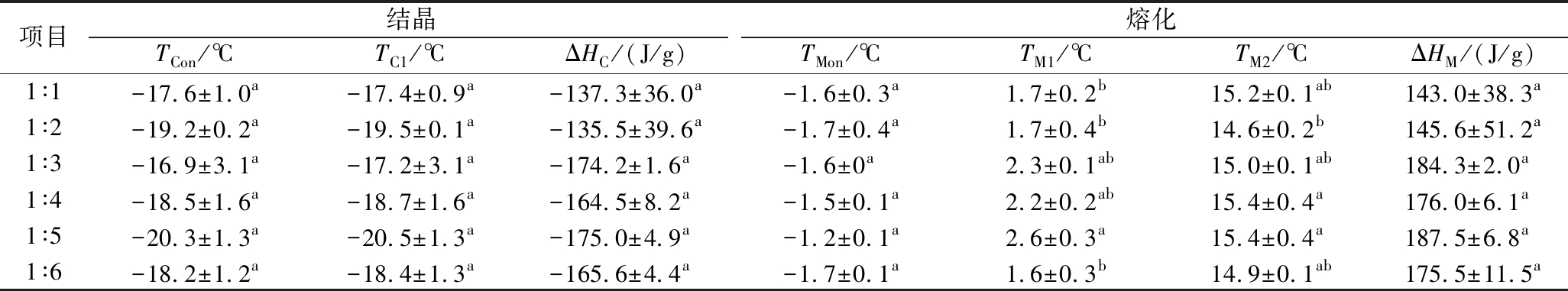
注:同列不同字母表示有显著性差异(P<0.05)。
项目结晶熔化TCon/℃TC1/℃ΔHC/(J/g)TMon/℃TM1/℃TM2/℃ΔHM/(J/g)1∶1-17.6±1.0a-17.4±0.9a-137.3±36.0a-1.6±0.3a1.7±0.2b15.2±0.1ab143.0±38.3a1∶2-19.2±0.2a-19.5±0.1a-135.5±39.6a-1.7±0.4a1.7±0.4b14.6±0.2b145.6±51.2a1∶3-16.9±3.1a-17.2±3.1a-174.2±1.6a-1.6±0a2.3±0.1ab15.0±0.1ab184.3±2.0a1∶4-18.5±1.6a-18.7±1.6a-164.5±8.2a-1.5±0.1a2.2±0.2ab15.4±0.4a176.0±6.1a1∶5-20.3±1.3a-20.5±1.3a-175.0±4.9a-1.2±0.1a2.6±0.3a15.4±0.4a187.5±6.8a1∶6-18.2±1.2a-18.4±1.3a-165.6±4.4a-1.7±0.1a1.6±0.3b14.9±0.1ab175.5±11.5a
图4-c、图4-d分别为产品XRD曲线及根据周绪霞等[9]的方法计算得到的β′晶型含量。由图4-c可知,当T∶M=1∶1~1∶3时,产品的XRD曲线在4.20 Å、3.80 Å附近均有强吸收峰,对应β′晶型[10, 29],并且吸收峰很强,即该产品结晶脂肪中β′晶型晶体含量丰富;继续提高复配乳化剂中MAG的比例,曲线变平缓,无明显吸收峰,即晶体尺寸减小[30],且形态无显著差异。这样的差异可能是由于复配乳化剂中MAG的比例变化导致。MAG可以作为异相成核位点促进晶体形成,显著影响晶体形成及生长、晶型转变阶段,改变晶体的尺寸和排列,但具体的机制仍未被掌握。由实验结果可知,复配乳化剂中适量的MAG比例可以抑制β′型向β型转化,但当MAG占比过高时,晶体尺寸显著减小,结晶体变为无明显差异的混合态,对产品搅打品质无贡献。
3 总结
本课题组通过前期实验确定了乳化剂总质量分数为0.3%时产品打发率较高,稳定性较好,在此条件下使用TW-80及MAG进行复配,改变TW-80与MAG的比例,通过考察界面膜性质变化及脂肪结晶性质变化探究复配乳化剂不同组成对产品稳定性及搅打品质的影响机理,实验结果发现,随着复配乳化剂中MAG占比增大,界面膜吸附蛋白质被取代的程度下降,界面膜黏弹性更强,产品稳定性上升,但更难搅打成型;当T∶M比例达到1∶3~1∶4时产品结晶脂肪β′晶型明显,此时结晶脂肪晶体尺寸较小,包裹空气能力强,产品搅打品质更佳。界面膜性质和结晶性质的变化共同决定了产品最终的稳定性及搅打品质,当T∶M达到1∶4时,产品打发率最高,达(158.9±1.23)%,泡沫析水率最低,仅有(1.55±0.47)%,并且拥有良好的乳液稳定性。综上所述,TW-80与MAG复配使用协同影响产品的界面膜性质及脂肪结晶性质,当T∶M=1∶3~1∶4时产品兼具良好的稳定性及搅打品质,此可以作为工业化生产高品质搅打稀奶油的参考。
[1] 李扬, 李妍, 李栋, 等. 搅打稀奶油品质及其影响因素的研究进展[J]. 食品科学, 2022, 43(15):327-335.
LI Y, LI Y, LI D, et al. Progress in research on whipping cream quality and the factors influencing it[J]. Food Science, 2022, 43(15):327-335.
[2] 赵谋明, 范瑞, 林伟锋. 脂肪球在搅打乳状液中的部分聚结及其作用[J]. 食品与发酵工业, 2004, 30(2):77-81.
ZHAO M M, FAN R, LIN W F. The partial coalescence of fat in whipped dairy emulsions[J]. Food and Fermentation Industries, 2004, 30(2):77-81.
[3] AWAD T, SATO K. Acceleration of crystallisation of palm kernel oil in oil-in-water emulsion by hydrophobic emulsifier additives[J]. Colloids and Surfaces B: Biointerfaces, 2002, 25(1):45-53.
[4] IHARA K, HIROTA M, AKITSU T, et al. Effects of emulsifying components in the continuous phase of cream on the stability of fat globules and the physical properties of whipped cream[J]. Journal of Dairy Science, 2015, 98(5):2875-2883.
[5] SMITH K W, BHAGGAN K, TALBOT G, et al. Crystallization of fats: Influence of minor components and additives[J]. Journal of the American Oil Chemists’ Society, 2011, 88(8):1085-1101.
[6] WANG Y N, YUAN D D, LI Y, et al. Thermodynamic and whipping properties of milk fat in whipped cream: A study based on DSC and TD-NMR[J]. International Dairy Journal, 2019, 97:149-157.
[7] BOODE K, BISPERINK C, WALSTRA P. Destabilization of O/W emulsions containing fat crystals by temperature cycling[J]. Colloids and Surfaces, 1991, 61:55-74.
[8] ROUSSEAU D. Fat crystals and emulsion stability:A review[J]. Food Research International, 2000, 33(1):3-14.
[9] 周绪霞, 戚雅楠, 丁玉庭. 黄油-代可可脂基奶油生产工艺优化及其晶型形成分析[J]. 食品科学, 2018, 39(12):276-282.
ZHOU X X, QI Y N, DING Y T. Optimization of production process and crystallization characteristics of butter and cocoa butter replacer-based whipping cream[J]. Food Science, 2018, 39(12):276-282.
[10] TRUONG T, MORGAN G P, BANSAL N, et al. Crystal structures and morphologies of fractionated milk fat in nanoemulsions[J]. Food Chemistry, 2015, 171:157-167.
[11] TZOMPA-SOSA D A, RAMEL P R, VAN VALENBERG H J F, et al. Formation of β polymorphs in milk fats with large differences in triacylglycerol profiles[J]. Journal of Agricultural and Food Chemistry, 2016, 64(20):4152-4157.
[12] ED N J, DEJMEK P, LÖFGREN R, et al. Native milk fat globule size and its influence on whipping properties[J]. International Dairy Journal, 2016, 61:176-181.
N J, DEJMEK P, LÖFGREN R, et al. Native milk fat globule size and its influence on whipping properties[J]. International Dairy Journal, 2016, 61:176-181.
[13] BOEKEL M. Influence of fat crystals in the oil phase on stability of oil-in-water emulsions[J]. Agricultural Research Reports, 1980.
[14] WILDE P, MACKIE A, HUSBAND F, et al. Proteins and emulsifiers at liquid interfaces[J]. Advances in Colloid and Interface Science, 2004, 108-109:63-71.
[15] MCCLEMENTS D J. Edible nanoemulsions: Fabrication, properties, and functional performance[J]. Soft Matter, 2011, 7(6):2297-2316.
[16] WU S Z, WANG G, LU Z, et al. Effects of glycerol monostearate and Tween 80 on the physical properties and stability of recombined low-fat dairy cream[J]. Dairy Science &Technology, 2016, 96(3):377-390.
[17] ZAFEIRI I, HORRIDGE C, TRIPODI E, et al. Emulsions co-stabilised by edible Pickering particles and surfactants: The effect of HLB value[J]. Colloid and Interface Science Communications, 2017, 17:5-9.
[18] WANG Y N, HARTEL R W, ZHANG L B. The stability of aerated emulsions: Effects of emulsifier synergy on partial coalescence and crystallization of milk fat[J]. Journal of Food Engineering, 2021, 291:110257.
[19] WANG Y N, YUAN D D, LI Y, et al. Thermodynamic and whipping properties of milk fat in whipped cream: A study based on DSC and TD-NMR[J]. International Dairy Journal, 2019, 97:149-157.
[20] WILDE P, MACKIE A, HUSBAND F, et al. Proteins and emulsifiers at liquid interfaces[J]. Advances in Colloid and Interface Science, 2004, 108-109:63-71.
[21] RULLIER B, AXELOS M A V, LANGEVIN D, et al. β-Lactoglobulin aggregates in foam films: Effect of the concentration and size of the protein aggregates[J]. Journal of Colloid and Interface Science, 2010, 343(1):330-337.
[22] VAN LENT K, LE C T, VANLERBERGHE B, et al. Effect of formulation on the emulsion and whipping properties of recombined dairy cream[J]. International Dairy Journal, 2008, 18(10-11):1003-1010.
[23] BÖRJESSON J, DEJMEK P, LÖFGREN R, et al. The influence of serum phase on the whipping time of unhomogenised cream[J]. International Dairy Journal, 2015, 49:56-61.
[24] PEAMPRASART T, CHIEWCHAN N. Effect of fat content and preheat treatment on the apparent viscosity of coconut milk after homogenization[J]. Journal of Food Engineering, 2006, 77(3):653-658.
[25] FULLER G T, CONSIDINE T, MACGIBBON A, et al. Effect of tween emulsifiers on the shear stability of partially crystalline oil-in-water emulsions stabilized by sodium caseinate[J]. Food Biophysics, 2018, 13(1):80-90.
[26] KOV
 OV
OV R,
R,  T
T TINA J,
TINA J,  URDA L. Influence of processing and κ-carrageenan on properties of whipping cream[J]. Journal of Food Engineering, 2010, 99(4):471-478.
URDA L. Influence of processing and κ-carrageenan on properties of whipping cream[J]. Journal of Food Engineering, 2010, 99(4):471-478.
[27] JIANG J, JIN Y, LIANG X Y, et al. Synergetic interfacial adsorption of protein and low-molecular-weight emulsifiers in aerated emulsions[J]. Food Hydrocolloids, 2018, 81:15-22.
[28] MUNK M B, MARANGONI A G, LUDVIGSEN H K, et al. Stability of whippable oil-in-water emulsions: Effect of monoglycerides on crystallization of palm kernel oil[J]. Food Research International, 2013, 54(2):1738-1745.
[29] CHAPMAN D. The polymorphism of glycerides[J]. Chemical Reviews, 1962, 62(5):433-456.
[30] 徐玉林, 徐明波, 杨水金. XRD在无机合成中物相分析的应用[J]. 湖北师范学院学报(自然科学版), 2013, 33(4):40-46;62.
XU Y L, XU M B, YANG S J. Application of X-ray powder diffraction in phase analysis of inorganic synthesis[J]. Journal of Hubei Normal University (Natural Science), 2013, 33(4):40-46;62.