巴旦木蛋白饮料是以巴旦木为原料,经脱皮、磨浆、加入增稠剂及乳化剂剪切混匀,加入糖、盐等调配、均质、灭菌制得的一类植物蛋白饮料,由于其富含脂肪和蛋白[1],不含乳糖[2],常被用作乳糜泻和乳糖不耐症个体的牛奶来源替代品[3]。该产品体系是一个涉及胶体系统的混合成分系统[4],这种胶体系统的稳定性对于维持巴旦木饮料所需的流变特性至关重要[5]。贮藏期间,植物蛋白饮料易出现蛋白沉淀、脂肪上浮,导致饮料发生不稳定的分层、絮凝、聚结等状况,从而影响饮料品质和口感,缩短货架期[6]。作为一种典型的植物蛋白饮料,市面上的巴旦木饮料常用酪蛋白酸钠(sodium caseinate,SC)作为乳化剂,但由于牛奶蛋白具有一定的致敏性,因此,亟需开发以植物源蛋白为来源的替代品[7-9]。
豌豆蛋白(pea protein isolate,PPI)是豌豆淀粉(粉丝)生产过程中的副产物,尚未得到充分开发利用,在一定程度上造成了资源的浪费[10]。2019年,全球PPI的市场规模为2.155亿美元,预计到2027年将达到3.87亿美元[11]。PPI对人体有多种健康作用,包括预防肾病、降低患心血管疾病的风险等[12],同时营养价值高、致敏性低、价格低[13],但其较差的乳化性限制了其在食品中的应用,因此,一般先对其进行改性处理[14]。
在本团队前期工作中,以PPI为原料,获得了功能特性明显改善的挤压处理豌豆蛋白(extruded pea protein isolate,EPPI)、磷酸化处理豌豆蛋白(phosphorylated pea protein isolate,PPPI)以及挤压联合磷酸化处理豌豆蛋白(extruded co-phosphorylated pea protein isolate,EPPPI)[9]。在本研究中,以巴旦木饮料为模拟体系,以SC为参照对象,通过测定饮料的粒径、电位、流变性质及微观形态等指标的变化,研究改性PPI对饮料贮藏稳定性的影响并探究其机理。
1 材料与方法
1.1 材料与试剂
巴旦木,新疆喀什西泽果业开发有限公司;风味蛋白酶,沧州夏盛酶生物技术有限公司;SC、PPI[碱溶酸沉法提取,(89.80±0.20)%],西安千叶草生物科技有限公司;稳定剂A,丹尼斯克(中国)有限公司;BCA蛋白浓度测定试剂盒(增强型),上海碧云天生物技术有限公司;尼罗红、尼罗蓝,美国sigma公司。
改性PPI的处理:EPPI:调整水分质量分数至35%,经60、80、95、105 ℃升温程序,喂料速度10 kg/h,螺杆转速300 r/min条件下挤出,再将挤出物置于40 ℃恒温烘箱中平衡水分至质量分数为10%以下,冷却至室温,粉碎后过80目筛,贮藏备用;PPPI:豌豆蛋白体积分数3%、三聚磷酸钠体积分数2%、pH值8.0、反应时间3.5 h、温度30 ℃,4 ℃透析72 h,冻干,过筛,贮藏备用;EPPPI:将挤压预处理的PPI进行磷酸化处理,挤压和磷酸化处理条件分别同上,协同处理后样品经过冻干,过筛,贮藏备用。
1.2 仪器与设备
T25 digital ULTRA-TURRAX®高性能分散机,德国IKA公司;AH-2010高压均质机,加拿大ATS公司;GI54DWS高压灭菌器,致微(厦门)仪器有限公司;L550台式低速大容量离心机,湖南湘仪实验室仪器开发有限公司;T9型紫外分光光度计,北京普析通用仪器有限责任公司;Zetasizer nano ZS纳米粒度及ZETA电位仪,英国马尔文公司;DHR-3旋转流变仪,美国TA公司;LSM880激光共聚焦显微镜,德国卡尔蔡司公司。
1.3 实验方法
1.3.1 巴旦木饮料的制备
以市面上销售的巴旦木饮料配方制备巴旦木饮料,且按照敬思群等[15]的方法并稍做修改:将脱皮的巴旦木用湿法超细粉碎机湿磨,制备得到巴旦木原浆;在巴旦木原浆中添加风味蛋白酶酶解,得到酶解巴旦木原浆;稳定剂A与SC经70~75 ℃水预剪切10 min后与巴旦木原浆、酶解原浆按比例混合,再加入糖、食用盐、小苏打调配,混合剪切后均质,灌装于玻璃瓶中,121 ℃灭菌20 min。
实验组设定:第1组不添加乳化剂SC(对照组,CON组),第2组为正常配方(市售产品组,SC组),第3~6组为添加不同改性处理PPI的实验组:第3组采用未改性豌豆蛋白(untreated pea protein isolate,UPPI)替代SC(UPPI组),第4组采用EPPI替代SC(EPPI组),第5组采用PPPI替代SC(PPPI组),第6组采用EPPPI替代SC(EPPPI组)。
1.3.2 饮料离心沉淀率的测定
取10.00 g饮料于离心管中,室温下3 000 r/min离心15 min,弃去上层液体,将离心管置于烘箱干燥,称量沉淀物质量m,离心沉淀率的计算见公式(1)。
离心沉淀率![]()
(1)
式中:m,离心沉淀物质量,g。
1.3.3 饮料界面蛋白吸附率的测定
取适量制备好的巴旦木饮料测定其界面蛋白吸附率,参考CHEN等[16]的方法测定界面蛋白吸附率和界面蛋白含量。取1 mL 饮料经12 000 r/min室温离心30 min,此时饮料分成两相。用1 mL注射器吸取下层液体,用BCA法测定其蛋白浓度C2。界面蛋白吸附率(adsorption rate of interface protein,AP)和界面蛋白含量(Γ)按公式(2)和公式(3)计算。
界面蛋白吸附率![]()
(2)
界面蛋白含量![]()
(3)
式中:ρ1和ρ2,分别为巴旦木饮料的蛋白浓度和离心后下层溶液的蛋白质量浓度,mg/mL;φ,油相分数,%;d3,2-SDS,巴旦木饮料在10 g/L SDS中的表面积平均粒径,μm。
1.3.4 饮料粒径及ζ-电位的测定
采用粒径及电位分析仪测定巴旦木饮料的粒径及电位,设置分散质折射率为1.492,分散相折射率为1.33。
1.3.5 饮料表观流变性质的测定
采用流变仪测定巴旦木饮料流变性质。选用40 mm平板,测定黏度时剪切速率为0.1~100 s-1;应变扫描时应变范围为0.1%~100%,频率扫描时频率范围为0.1~100 Hz。
1.3.6 饮料微观形态的测定
取适量制备好的巴旦木饮料测定其微观形态,按照FENG等[17]的方法并稍做修改,在1 mL巴旦木饮料中加入10 μL尼罗蓝和10 μL尼罗红,振荡摇匀后避光染色。取8 μL染色后样品,采用LSM880高分辨率激光共聚焦显微镜观察,激发波长为488和633 nm。
1.3.7 数据统计与分析
所有实验均至少重复3次,数据为平均值±标准偏差。采用Origin 2018制作图表,并用SPSS 25对数据进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 豌豆蛋白对饮料贮藏稳定性的影响
图1显示了添加SC和不同改性处理PPI的饮料在室温贮藏1、3、5、7、14、30 d的照片。新鲜制备的饮料均保持稳定;贮藏3 d后CON饮料上层出现轻度乳析现象,且在贮藏5、7 d时加剧,其他组饮料保持稳定;贮藏14 d时,CON饮料分层明显,UPPI饮料、EPPI饮料、PPPI饮料的上层也出现乳析现象,其中乳析程度UPPI>PPPI>EPPI;贮藏30 d时,CON饮料除上层乳析严重外,底部还出现半透明的水析,UPPI饮料、EPPI饮料、PPPI饮料乳析程度加剧,SC饮料和EPPPI饮料仍保持稳定,这可能是由于挤压联合磷酸化处理显著改善了PPI的乳化性,提高了饮料的稳定性。

a-第1天;b-第3天;c-第5天;d-第7天;e-第14天;f-第30天
图1 添加SC和不同改性处理PPI后饮料在30 d内的贮藏稳定性
Fig.1 The stability of beverage formed by SC and PPI with different modification methods during storage within 30 days
注:CON、SC、UPPI、EPPI、PPPI、EPPPI分别为不添加乳化剂、添加SC、UPPI、EPPI、PPPI、EPPPI为乳化剂的巴旦木饮料(下同)。
2.2 豌豆蛋白对饮料离心沉淀率的影响
离心沉淀率一般可以较为直观地反映饮料的稳定性,离心沉淀率越小,其稳定性就越好。如图2所示,CON饮料的离心沉淀率最大,添加UPPI、EPPI、PPPI的饮料次之。而添加SC或EPPPI后,饮料的离心沉淀率显著降低(P<0.05),这表明添加改性后的PPI后,巴旦木饮料体系的稳定性在改善,且以添加EPPPI的实验组效果最为接近SC。

图2 添加SC和不同改性处理PPI后饮料的离心沉淀率
Fig.2 Centrifugal precipitation rate of beverage formed by SC and PPI with different modification methods
注:不同小写字母代表不同巴旦木饮料间差异显著(P<0.05)(下同)。
2.3 豌豆蛋白对饮料界面蛋白吸附率的影响
由图3可知,添加PPI后,饮料的界面蛋白吸附率含量显著增加(P<0.05),但仍小于使用SC作为乳化剂的饮料。在添加SC或PPI的饮料中,UPPI组的界面蛋白吸附率最低,而经挤压处理和磷酸化处理后,饮料界面蛋白吸附率均得到提高,且添加EPPPI的饮料界面蛋白吸附率仅比添加SC的小3.51%,这可能是由于PPI经改性处理后,表面疏水性增大,二硫键含量增加,促进了PPI在油-水界面的吸附[18],有利于形成界面膜结构以及饮料界面蛋白吸附率的增加,从而改善体系稳定性。
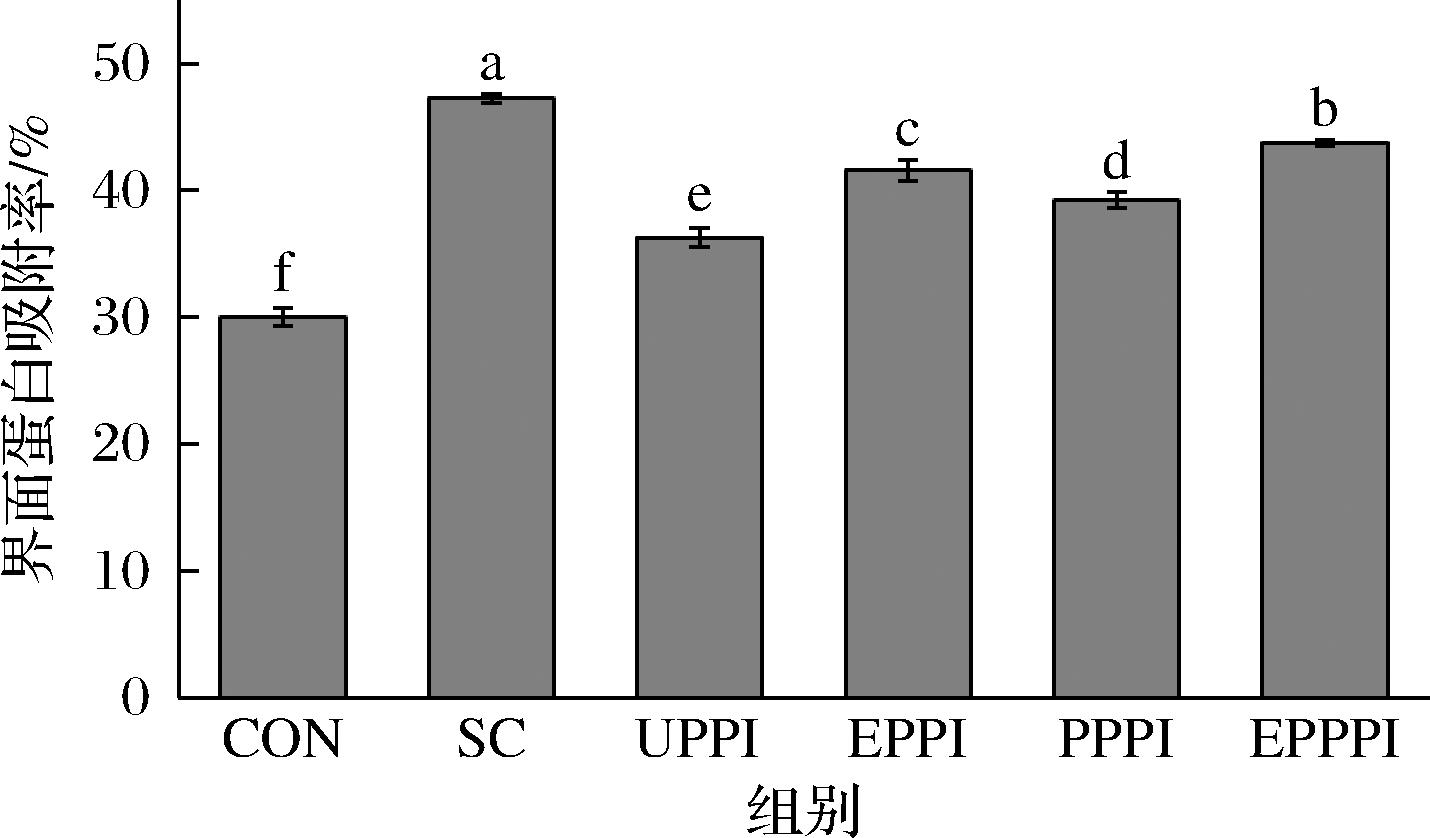
图3 添加SC和不同改性处理PPI后饮料的界面蛋白吸附率
Fig.3 Percentage of adsorbed proteins of beverage formed by SC and PPI with different modification methods
2.4 豌豆蛋白对饮料ζ-电位及粒径的影响
由图4-a可知,所有饮料的ζ-电位均为负值,表明饮料中带负电的粒子多于带正电的粒子,这归因于巴旦木蛋白的等电点以及添加的稳定剂的特性。CON饮料的ζ-电位绝对值最小,UPPI饮料次之,改性处理后,饮料ζ-电位绝对值增加。这可能与改性处理后,PPI分子表面带电基团发生变化有关,因而导致了饮料体系中的液滴电位改变。添加PPI或SC后,饮料的静电排斥力增加,饮料样品中的悬浮颗粒更不易聚集,稳定性得到改善。此外,随着时间推移,所有饮料的ζ-电位绝对值出现不同程度的减小,与RYAN等[19]报道的趋势类似,这可能是由于在贮藏期间饮料液滴之间发生聚集,静电排斥力减少。但SC饮料或者EPPPI饮料的ζ-电位绝对值减小程度较小,表明SC和EPPPI对饮料稳定性的改善效果更好。

a-ζ-电位;b-粒径
图4 添加SC和不同改性处理PPI后饮料的ζ-电位和粒径
Fig.4 The ζ- potential and particle size of beverage formed by SC and PPI with different modification methods
注:小写字母表示同一天内不同巴旦木饮料的组间差异显著(P<0.05),大写字母表示同一种巴旦木饮料在不同贮藏时间内的组间差异显著(P<0.05)。
由图4-b可知,与CON饮料相比,添加PPI或SC的饮料粒径显著减小(P<0.05),且添加改性处理后的PPI的饮料粒径均小于UPPI的饮料粒径。此外,随着贮藏时间的增加,饮料粒径均有所增加,但添加改性PPI或SC的饮料粒径仍小于CON饮料或添加UPPI的饮料粒径,表明添加SC或改性PPI有利于抑制悬浮颗粒的聚集。这可能是因为改性处理后,PPI分子表面活性提高,促进其在油-水界面的吸附,使其乳化活性、乳化稳定性改善[20],且饮料液滴间静电排斥力增大,减少饮料液滴聚集,因此改性处理后饮料贮藏稳定性得到改善。斯托克定律指出,液滴移动的速度与其黏度成反比,与其半径的平方和水相油相之间的密度差成正比。经饮料粒径及ζ-电位实验结果可知,PPI经改性处理后,由其制备的饮料粒径显著减小(P<0.05),饮料液滴间静电排斥力增加,能够有效改善液滴间的聚集与饮料的分层沉淀,提高体系的稳定性。
2.5 豌豆蛋白对饮料流变性质的影响
许多食品乳状液的稳定性取决于组分相的流变特性,而饮料的流变学性质常受到油相体积分数、液滴尺寸、电荷和胶体相互作用的影响[21]。如图5-a所示,所有饮料样品在测试的剪切速率范围内都表现出典型的剪切稀化行为,饮料的黏度由小到大为:CON a-黏度随剪切速率变化的曲线;b-应变扫描结果;c-G′频率扫描结果;d-G″频率扫描结果 图5 添加SC和不同改性处理PPI后饮料的黏度随剪切速率变化的曲线、应变扫描结果和频率扫描结果 Fig.5 Shear-rate dependence of viscosity for beverage formed by SC and PPI with different modification methods;strain sweep results of beverage formed by SC and PPI with different modification methods;frequency sweep results of beverage formed by SC and PPI with different modification methods 对饮料进行应变扫描,以考察其在稳定条件下的应变范围,结果如图5-b所示。SC饮料表现出最大的弹性模量,其次是PPPI组,但SC饮料、PPPI饮料在应变超过1%时G′降低,表明应变大于1%后饮料空间网络结构被破坏,而EPPI饮料、EPPPI饮料线性黏弹区延伸,对5%以内的应变仍保持一定的承受能力,弹性模量基本不发生变化,说明挤压、挤压联合磷酸化处理的PPI可以改善饮料稳定性,而CON饮料、UPPI饮料的G′和线性黏弹区远小于其他饮料,表明CON饮料、UPPI饮料内部空间网络结构不够稳定。为保证实验的准确性,在饮料频率扫描时选取0.5%作为其应变值。 为了研究饮料的黏弹性,进行了频率扫描测量。由图5-c、图5-d可知,与应变扫描的趋势类似,SC饮料、PPPI饮料的G′最大,其次是EPPPI饮料和EPPI饮料,最后是UPPI饮料和CON饮料。所有饮料的G′和G″都随着频率增加而逐渐提高,并表现出一定的频率依赖性,说明饮料的空间结构以非共价键交联为主[22]。此外,在整个频率扫描范围内,饮料的G′明显大于G″,表明该饮料具有凝胶状行为并形成了强大而稳定的凝胶网络[23]。添加改性处理后的PPI,饮料的弹性模量G′明显增加,这可能是由于改性处理增强PPI分子间作用力,形成了一定的空间网络结构,从而改善黏弹性[24],有利于液滴在饮料中悬浮,从而提高饮料的稳定性。 由图6显示了饮料第1天、第7天、第30天时的CLSM观察结果,蓝色荧光信号和红色荧光信号分别代表经尼罗蓝染色的蛋白和尼罗红染色的油相。第1天时,饮料粒径差异明显,CON饮料最大,UPPI饮料次之,且粒径分布不均匀;PPPI饮料、EPPI饮料粒径较小,仅有小部分液滴分布不均匀;SC饮料和EPPPI饮料液滴粒径小、分布均匀,CLSM观察结果与测定的粒径结果相一致。贮藏7 d后发现,饮料液滴均有不同程度的增加,CON饮料液滴仍明显大于其他样品,且其液滴粒径分布不均匀,小油滴被吸附到大油滴表面,从而使得油相出现融合或聚结等不稳定现象;UPPI饮料也出现了较为明显的液滴聚集;PPPI饮料、EPPI饮料液滴尺寸变大,但分布较为均匀;EPPPI饮料、SC饮料液滴尺寸最小,且分布均匀,这可能是因EPPPI饮料及SC饮料具有更大的表面电荷值,液滴上的电荷会影响液滴与液滴的相互作用并防止它们相互接触和聚集[25]。饮料液滴尺寸增大这种情况在贮藏30 d时进一步加剧,PPPI饮料、EPPI饮料也出现液滴聚结或絮凝现象,而EPPPI饮料液滴仍分布较为均匀,其粒径仅略大于SC饮料,这可能是因为EPPPI表面疏水性大,有利于对油滴的包裹与覆盖,ζ-电位增加以及黏度增加,有效防止液滴聚集[26]。总体来说,CLSM观察结果与贮藏稳定性实验的结果相一致。 a-CON饮料;b-SC饮料;c-UPPI饮料;d-PPPI饮料;e-EPPI饮料;f-EPPPI饮料 图6 添加SC和不同改性处理PPI后饮料在30 d内的微观形态图 Fig.6 Microstructure of beverage formed by SC and PPI with different modification methods during storage within 30 days 本研究探究了不同改性处理PPI对巴旦木饮料贮藏稳定性的影响。实验结果表明,添加未处理或改性处理的PPI后,较为明显地改善了饮料贮藏稳定性,降低了离心沉淀率。同时,饮料的界面蛋白吸附率含量显著增加,粒径减小,黏度增加,ζ-电位绝对值增加,液滴间静电排斥力增大,减少聚集,进一步改善饮料贮藏稳定性。且与常用乳化剂SC相比,EPPPI实验组效果最为接近SC,具有替代其作为乳化剂应用在市售巴旦木饮料中的可能性。 [1] MAGHSOUDLOU Y, ALAMI M, MASHKOUR M, et al.Optimization of ultrasound-assisted stabilization and formulation of almond milk[J].Journal of Food Processing and Preservation, 2016, 40(5):828-839. [2] VALENCIA-FLORES D C, HERN [3] QAMAR S, MANRIQUE Y J, PAREKH H, et al.Nuts, cereals, seeds and legumes proteins derived emulsifiers as a source of plant protein beverages:A review[J].Critical Reviews in Food Science and Nutrition, 2020, 60(16):2742-2762. [4] GAMA A, HUNG Y C, ADHIKARI K.Optimization of emulsifier and stabilizer concentrations in a model peanut-based beverage system:A mixture design approach[J].Foods, 2019, 8(4):116. [5] DICKINSON E.Hydrocolloids as emulsifiers and emulsion stabilizers[J].Food Hydrocolloids, 2009, 23(6):1473-1482. [6] SARDAO R, AMARAL R A, ALEXANDRE E M C, et al.Effect of high-pressure processing to improve the safety and quality of an quercus acorn beverage[J].LWT- Food Science and Technology, 2021, 149:111858. [7] 权煜, 刘佳欣, 刘婷婷, 等.豌豆苦荞复合饮品的工艺研究[J].饮料工业, 2021, 24(6):34-42. QUAN Y, LIU J X, LIU T T, et al.Study on the technology of pea and tartary buckwheat compound drink[J].Beverage Industry, 2021, 24(6):34-42. [8] 夏轩泽, 李言, 钱海峰, 等.豌豆蛋白乳化性及其改善研究进展[J].食品与发酵工业, 2021, 47(2):279-284. XIA X Z, LI Y, QIAN H F, et al.Research progress on improvement the emulsification property of pea protein[J].Food and Fermentation Industries, 2021, 47(2):279-284. [9] 夏轩泽, 李言, 钱海峰, 等.改性处理对豌豆蛋白结构和功能特性的影响[J].食品科学技术学报, 2021, 39(5):32-38;48. XIA X Z, LI Y, QIAN H F, et al.Effects of modification treatments on structural characteristics and functional properties of pea protein[J].Journal of Food Science and Technology, 2021, 39(5):32-38;48. [10] 师伟伟. 豌豆粉丝副产物中蛋白质的提取及性能改善[D].无锡:江南大学, 2014. SHI W W.Extraction and performance improvement of protein from by-products of pea vermicelli[D].Wuxi:Jiangnan University, 2014. [11] BOUKID F, ROSELL C M, CASTELLARI M.Pea protein ingredients:A mainstream ingredient to (re)formulate innovative foods and beverages[J].Trends in Food Science &Technology, 2021, 110:729-742. [12] BOGAHAWATHTHA D, BAO CHAU N H, TRIVEDI J, et al.Impact of selected process parameters on solubility and heat stability of pea protein isolate[J].LWT, 2019, 102:246-253. [13] GUO Q, SU J Q, YUAN F, et al.Preparation, characterization and stability of pea protein isolate and propylene glycol alginate soluble complexes[J].LWT, 2019, 101:476-482. [14] 马宁, 魏姜勉.豌豆蛋白的改性及其开发利用研究进展[J].中国市场, 2015(32):231-233. MA N, WEI J M.Research progress on modification, development and utilization of pea protein[J].China Market, 2015(32):231-233. [15] 敬思群, 赵文杰.动态高压微射流处理对巴旦木-红枣粗多糖乳饮料稳定性的影响[J].食品科技, 2014, 39(2):88-92. JING S Q, ZHAO W J.Effect of dynamic high pressure microfluidization on the stability of the almond-jujube polysaccharide milk drinks[J].Food Science and Technology, 2014, 39(2):88-92. [16] CHEN M S, LU J H, LIU F, et al.Study on the emulsifying stability and interfacial adsorption of pea proteins[J].Food Hydrocolloids, 2019, 88:247-255. [17] FENG T T, WANG X J, WANG X W, et al.High internal phase Pickering emulsions stabilized by pea protein isolate-high methoxyl pectin-EGCG complex:Interfacial properties and microstructure[J].Food Chemistry, 2021, 350:129251. [18] ZHU L J, XU Q Y, LIU X Y, et al.Soy glycinin-soyasaponin mixtures at oil-water interface:Interfacial behavior and O/W emulsion stability[J].Food Chemistry, 2020, 327:127062. [19] RYAN K N, FOEGEDING E A.Formation of soluble whey protein aggregates and their stability in beverages[J].Food Hydrocolloids, 2015, 43:265-274. [20] DAN L, YUE Z, XU W, et al.Effects of (+)-catechin on a rice bran protein oil-in-water emulsion:Droplet size, zeta-potential, emulsifying properties, and rheological behavior[J].Food Hydrocolloids, 2020, 98:105306. [21] TAHERIAN A R, FUSTIER P, BRITTEN M, et al.Rheology and stability of beverage emulsions in the presence and absence of weighting agents:A review[J].Food Biophysics, 2008, 3(3):279-286. [22] 仲志峰. 热超声处理对绿豆分离蛋白结构和界面活性及乳化功能的影响[D].无锡:江南大学, 2020. ZHONG Z F.Effect of thermal ultrasonic treatment on structure, interfacial activity and emulsifying function of mung bean protein isolate[D].Wuxi:Jiangnan University, 2020. [23] CAI L Y, FENG J H, REGENSTEIN J, et al.Confectionery gels:Effects of low calorie sweeteners on the rheological properties and microstructure of fish gelatin[J].Food Hydrocolloids, 2017, 67:157-165. [24] HOSSAIN BRISHTI F, CHAY S Y, MUHAMMAD K, et al.Structural and rheological changes of texturized mung bean protein induced by feed moisture during extrusion[J].Food Chemistry, 2021, 344:128643. [25] PENG W W, KONG X Z, CHEN Y M, et al.Effects of heat treatment on the emulsifying properties of pea proteins[J].Food Hydrocolloids, 2016, 52:301-310. [26] ZOU W J, TANG S T, LI Q, et al.Addition of cationic guar-gum and oleic acid improved the stability of plasma emulsions prepared with enzymatically hydrolyzed egg yolk[J].Food Hydrocolloids, 2020, 105:105827.
2.6 豌豆蛋白对饮料微观形态的影响


3 结论
 NDEZ-HERRERO M, GUAMIS B, et al.Comparing the effects of ultra-high-pressure homogenization and conventional thermal treatments on the microbiological, physical, and chemical quality of almond beverages[J].Journal of Food Science, 2013, 78(2):E199-E205.
NDEZ-HERRERO M, GUAMIS B, et al.Comparing the effects of ultra-high-pressure homogenization and conventional thermal treatments on the microbiological, physical, and chemical quality of almond beverages[J].Journal of Food Science, 2013, 78(2):E199-E205.