随着我国国民经济的发展与人民生活水平的提高,人们的生活节奏日益加快,饮食消费习惯也发生着巨大的转变。尽管近年来外卖行业的迅速发展在很大程度上满足了人们基本的饮食消费需求,但其由于监管力度有限、加工制作条件参差不齐、从业人员鱼龙混杂等因素的影响,外卖食品一直存在较高食品安全风险。而这些现实的食品安全风险也促使消费者日趋理性地选择方便、营养且健康的调理预制食品。在品种众多的调理预制食品中,预上浆调理肉制品的关注度越来越高,其新产品的开发和产品品质的提升技术更是近年来的研究热点。
上浆是水煮鱼片、水煮肉片等传统中式菜肴烹饪中常用的一种基本技法[1]。其是将肉类等食品原料先以淀粉、蛋清等为主要成分的浆液充分包裹,随后在热处理过程中表层浆液率先热变性,在最大限度地保持食品原料的水分、形态和营养成分的同时,提升产品鲜嫩的口感,增加产品表面光润效果,并通过美拉德反应、焦糖化反应等一系列食品化学变化,产生多种挥发性风味物质的处理方法[2-3]。预上浆调理肉制品的品质主要受上浆和热处理两个加工工序的综合影响。相关研究表明,不同浆液配比[3]、不同食盐添加量[3]、不同淀粉种类[4]等因素均显著影响肉片的感官品质。相较于上浆处理,热处理工序由于加工方法的多样性以及工艺条件参数的巨大差异,其对预上浆调理肉制品的最终感官品质有着更为显著的影响[5-7]。但现阶段,不同热处理方法及工艺参数对预上浆调理肉制品品质影响的研究仍较为有限。李越[8]的研究表明,滑油温度为105 ℃、滑油时间70 s、料油比为1∶2.76时,调理肉片具有最佳的感官品质。GUO等[9]研究了油炸处理的预制肉片在贮藏过程中的品质变化,结果表明随着贮藏时间的延长,肉片的水分含量逐渐下降,特别是不易流动水的比例降低导致了产品品质的显著下降。可见,预上浆调理肉制品品质提升与保持的关键在于使用适宜的热处理方式及工艺参数,并使产品保持较高的水分含量与合理的水分分布比例。但造成各类肉制品感官品质变化的根本原因则是不同热处理条件下,肉制品中肌原纤维蛋白等主要蛋白质变性程度的不同[10-11],由于蛋白质的空间结构的差异以及蛋白质与水分间的相互作用强度的不同[12-13],最终影响产品的质地、嫩度、多汁性等感官品质[9]。然而,滑油处理对调理肉片品质影响的潜在作用机制研究迄今仍未见报道。
鉴于家庭日常烹饪过程中一般不使用滑油处理,仅沸水短时煮制(即焯水)。因此,本研究以沸水短时煮制处理(100 ℃,30 s)为对照组,考察以淮扬菜烹饪常用的低温滑油处理(90 ℃,60 s)[2, 4]及众多餐饮企业广泛使用的高温滑油处理(120 ℃,20 s)两个不同滑油处理条件对调理肉片感官品质的影响。并进一步分析不同热处理条件对肉片中肌原纤维蛋白二级结构的影响,探究不同滑油处理对品质影响的潜在机制问题,以期为相关工艺的优化及新产品研发提供必要的理论依据。
1 材料与方法
1.1 材料与试剂
冷鲜猪里脊、玉米淀粉、大豆油、食盐,购自芜湖市当地超市;双缩脲试剂盒,索莱宝公司;磷酸盐、乙二醇双氨乙基醚四乙酸[glycol-bis-(2-aminoethylether)-N,N,N′,N′-tetraacetic acid,EGTA]及其他所有试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
立式DQ-SL切肉机,佛山市伟琪博五金机械有限公司;DMS-DZL101D恒温油炸锅,广东德玛仕智能厨房设备有限公司;NMI20-040H-I低场核磁共振成像分析仪,苏州纽迈分析仪器有限公司;TA-XTPlus物性仪,英国Stable Micro System公司;C-LM3B剪切力仪,东北农业大学;CR-400手持色差仪,日本Konia Minolta公司;Nicolet iS 10型傅里叶变换红外光谱仪,美国Nicolet公司;Nano ZS90 粒度电位仪,英国Malvern公司。
1.3 实验方法
1.3.1 调理肉片预制处理
使用切肉机将冷鲜猪里脊肉切割成0.3 cm的薄片,再整形切分成3 cm×3 cm×0.3 cm的肉片。向肉片添加1.0%(质量分数)的食盐,并分3次添加总计25.0%(质量分数)的水,与此同时在室温条件下搅打10 min,使肉片充分吸收水分。再添加3.0%(质量分数)的玉米淀粉并充分搅拌均匀,完成上浆处理后待用。热处理选用不同工艺条件进行,所有料油比或料水比均设置为1∶5(质量比)。以100 ℃沸水煮制30 s模拟家庭日常烹饪的焯水处理,作为对照组;参考孟祥忍等[4]所述淮扬菜烹饪的滑油方法,在90 ℃油温下处理60 s,作为低温滑油组;再以部分餐饮企业实际加工中常用的120~150 ℃短时滑油处理为参考,使用120 ℃油温滑油处理20 s,作为高温滑油组。不同热处理后,随机选取部分样本趁热立即进行感官评价分析,部分样本冷却至室温进行其他感官指标分析,并取少量样本保存于-80 ℃,用于肌原纤维蛋白的提取与分析。
1.3.2 感官评价
感官评价参考文献[14-15]的方法稍作修改。感官评价小组由10位成员组成,男女各半,年龄在18~25岁,具有较为丰富的感官评价经验,且前期已进行多次针对性的系统训练。分别从色泽、风味、滋味、嫩度、多汁性以及总体评价对不同的调理肉片进行评定,每项分数均介于1~9(具体评分如表1所示),结果表示为10次重复的平均值。
表1 感官评价标准
Table 1 Sensory evaluation standard
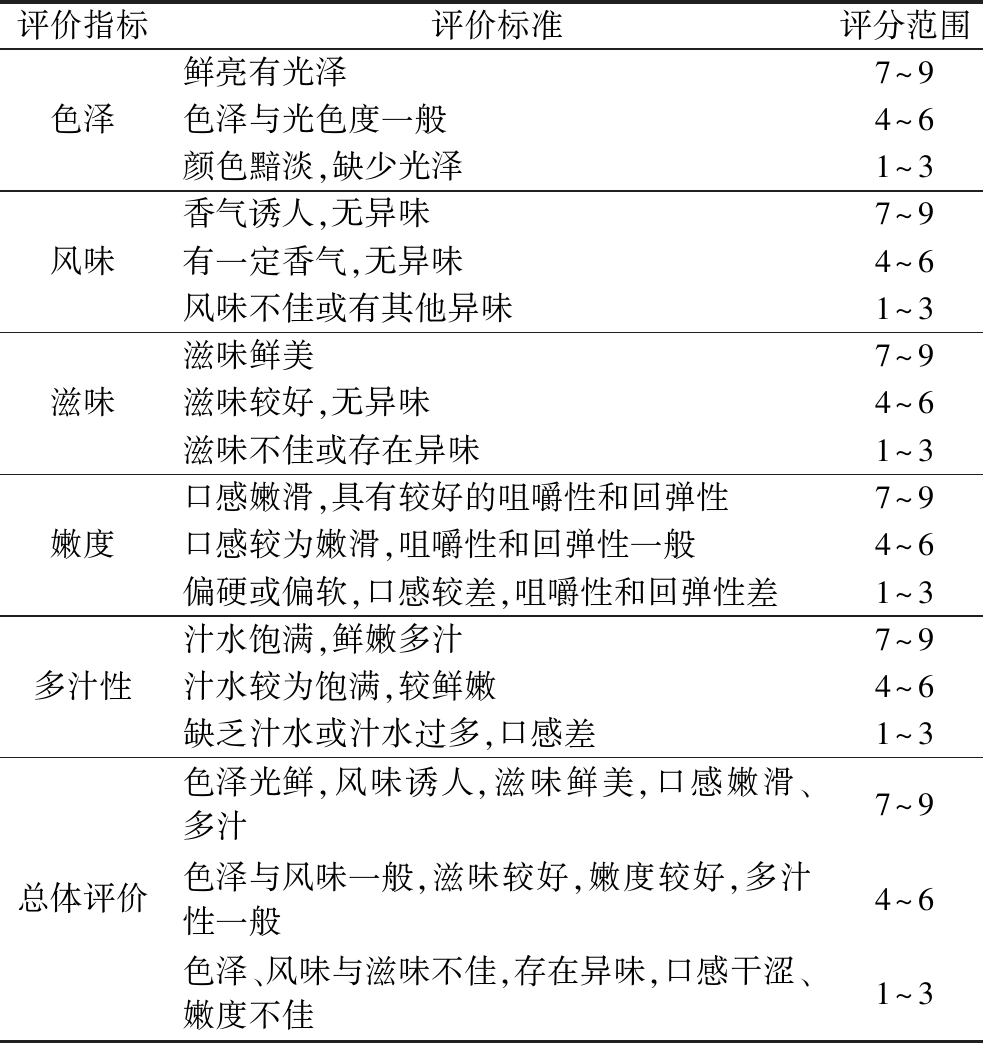
评价指标评价标准评分范围色泽鲜亮有光泽7^9色泽与光色度一般4^6颜色黯淡,缺少光泽1^3风味香气诱人,无异味7^9有一定香气,无异味4^6风味不佳或有其他异味1^3滋味滋味鲜美7^9滋味较好,无异味4^6滋味不佳或存在异味1^3嫩度口感嫩滑,具有较好的咀嚼性和回弹性7^9口感较为嫩滑,咀嚼性和回弹性一般4^6偏硬或偏软,口感较差,咀嚼性和回弹性差1^3多汁性汁水饱满,鲜嫩多汁7^9汁水较为饱满,较鲜嫩4^6缺乏汁水或汁水过多,口感差1^3总体评价色泽光鲜,风味诱人,滋味鲜美,口感嫩滑、多汁7^9色泽与风味一般,滋味较好,嫩度较好,多汁性一般4^6色泽、风味与滋味不佳,存在异味,口感干涩、嫩度不佳1^3
1.3.3 水分含量与烹饪损失测定
水分含量测定参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中所述的直接干燥法。精确称量约0.5 g样本于105 ℃烘干24 h后,于干燥器中冷却至室温并再次精确称重。通过比较各样本烘干前后质量差,计算得出样本水分含量。每个处理组随机选取30个样本进行分析。
精确称取约100 g(m0,精确至0.001 g)已上浆肉片,经不同热处理后沥干并冷却至室温,再次精确称量成品质量(m1,精确至0.001 g)。每个处理组进行20个批次的样本重复,并按公式(1)计算烹饪损失。
烹饪损失![]()
(1)
1.3.4 低场核磁共振分析
参考HUANG等[16]的方法测定与分析样本的自旋弛豫时间T2。每个处理组随机选择10个肉片,并切成2.0 cm×1.0 cm的条状肉片放入石英管中,使用CPMG序列测定,参数设置如下:主频40 MHz,偏频654 384.21 Hz,90°硬脉冲脉宽7.00 μs,180°硬脉冲脉宽13.52 μs,采样频率200 kHz,采样点数300 076,采样等待时间为4 000 ms,回波个数3 000,模拟增益3 db,数字增益3,重复采样次数8,数据半径1,开始采样时间0.2 ms,半回波时间0.5 ms。每个处理组进行5个样本重复。低场核磁共振成像参考薛美芳等[17]的方法,主要参数为:重复时间为1 500 ms,纵向弛豫时间为20 ms,自旋回波时间为20 ms。
1.3.5 色泽分析
各处理组肉片的色泽分析使用经过标准白板校正后的手持色差仪测定,测定时白昼光光源色温为6 500K。每个处理组随机选取30个样本进行分析,分别记录样本的L*、a*、b*值(分别表示亮度、红度与黄度)。
1.3.6 质构与剪切力分析
质构分析参考戚军[18]的方法并稍作修改。每个处理组随机选择30个样本,切成2.0 cm×2.0 cm的肉片,以P50探头进行测试,参数设定如下:测前速率5.0 mm/s,测试速率2.0 mm/s,触发力25 g,压缩率50%,压缩间隔时间2 s,数据收集率200 pps。使用仪器自带的Texture Exponent 32软件记录各样本的原始数据并导出后分析。
剪切力测定参考QI等[19]的方法,并稍作修改。将肉片切分成1.0 cm×0.5 cm的条状,使用1 mm厚V型缺口刀片的剪切力测定仪测量。每个处理组进行30个样本重复,记录数据后分析。
1.3.7 肌原纤维蛋白提取
肌原纤维蛋白的提取参考TRAORE等[20]的方法稍作修改。先配制提取肌原纤维蛋白的磷酸缓冲液(100 mmol/L KCl,2 mmol/L MgCl2,1 mmol/L EGTA以及10 mmol/L磷酸盐缓冲液,pH 7.0),并预冷至4 ℃。称取20 g肉片,加入80 mL充分预冷的提取缓冲液后于冰浴中在7 500 r/min 下匀浆30 s,间歇10 s后继续匀浆30 s。使用4层纱布过滤悬浊液,滤液于4 ℃、2 000 r/min下离心10 min。弃去上清液后,继续用80 mL的预冷提取液再提取沉淀2次,并离心。随后用80 mL浓度为0.1 mol/L的KCl溶液洗涤沉淀2次,所得沉淀即为肌原纤维蛋白。冷冻干燥后于-80 ℃保存,分析前使用磷酸盐缓冲溶液复溶至所需蛋白浓度,并使用双缩脲试剂盒法测定。
1.3.8 蛋白质二级结构分析
固定样品的蛋白质量浓度为0.15 mg/mL,在常温下使用傅里叶变换红外光谱仪进行扫描,波段范围为400~4 000 cm-1,每个谱图平均扫描64次,分辨率为4 cm-1。所得数据通过Omnic 8.2软件进行处理与分析,识别α-螺旋、β-折叠、β-转角和无规则卷曲等二级结构,并利用各对应峰面积积分来计算各二级结构比例。每个处理组蛋白样本平行测定10次。
1.3.9 粒度特性分析
参考CHEN等[21]的方法分析不同滑油处理肌原纤维蛋白样本的Zeta表面电位。将肌原纤维蛋白溶液质量浓度固定为0.15 mg/mL,精确吸取1 mL于光程为1 cm的比色皿中,使用纳米粒度仪测定,检测温度(25.0±0.1) ℃,探测角度90 °。每个处理组蛋白样本平行测定10次。
1.3.10 粒度特性分析
实验结果均以平均值±标准偏差表示。应用SPSS 18.0软件使用单因素方差分析(ANOVA)对数据进行分析,当P<0.05时判定组间存在显著差异。数据分析结果使用Origin 8.0进行可视化。
2 结果与分析
2.1 感官评价
如图1所示,2个滑油处理组的样本的总体评价显著高于对照组(P<0.05),表明滑油处理能显著改善调理肉片的感官品质,但2个不同滑油处理组间的总体评价无显著差异(P>0.05)。而从各指标来看,对照组除在色泽与滋味上与两个滑油处理组无显著差异外(P>0.05),风味与嫩度与两个滑油处理组样本均存在显著差异(P<0.05),但多汁性仅显著低于高温滑油组(P<0.05)。相关研究结果[4, 8]表明,滑油处理可显著促进淀粉糊化,从而形成保护膜,为产品提供更好的感官品质。由于肉制品的风味与热处理中脂类的氧化和裂解关系密切[22],故本研究中2个滑油处理组样本的风味显著优于对照组。嫩度是影响肉制品感官品质的重要指标,其与消费者接受程度高度相关[23]。本研究中2个滑油处理组样本的嫩度均显著高于对照组(P<0.05),该结果也与不同处理组样本的总体评价结果一致。此外,多汁性也是衡量肉制品食用品质的一个重要指标,大量的汁液流失会严重影响肉制品的质地特性及感官品质[24]。本研究中,对照组的多汁性最差,该结果也从侧面印证了不同处理组样本的总体评价结果。但2个滑油处理组之间的各感官评价指标均无显著差异(P>0.05),表明两者间感官品质差异不显著(P>0.05)。

图1 不同处理对调理肉片感官品质的影响
Fig.1 Effect of different treatments on sensory quality of prepared pork slices
注:不同小写字母代表差异显著,P<0.05(下同)。
2.2 水分含量、烹饪损失与水分分布
如图2-a所示,低温滑油组样本的水分含量显著低于对照组与高温滑油组(P<0.05)。S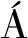 NCHEZ DEL PULGAR等[25]指出,肉制品中水分含量的降低与热处理过程的温度与压强关系密切,其直接影响蛋白质变性和结缔组织收缩的程度。由于本研究中3种热处理条件均在常压环境中进行,因此仅从本研究结果来看,高温滑油组和对照组样本受到的热处理强度可能低于低温滑油组,这或许是由于低温滑油处理组长达60 s的滑油处理时间所致。但从3个不同处理组样本的水分含量均高于70%也可以看出,上浆处理有效保护了产品的内部成分,减少了水分的流失[4]。从图2-b所示的不同处理组烹饪损失可以看出,3个处理组中低温滑油组的烹饪损失最高,而高温滑油组的最低。但相较于相关研究报道的上浆肉片滑油处理不超过10%的烹饪损失[2-4],本研究中3个处理组约15%的烹饪损失率明显更高,这与本研究中使用更高的料油比有关。相关研究表明,过低的料油比会导致滑油处理中油温下降过于明显,肉片表面的浆液无法迅速变性并形成致密的保护膜,从而对产品的品质有较大的影响[8]。
NCHEZ DEL PULGAR等[25]指出,肉制品中水分含量的降低与热处理过程的温度与压强关系密切,其直接影响蛋白质变性和结缔组织收缩的程度。由于本研究中3种热处理条件均在常压环境中进行,因此仅从本研究结果来看,高温滑油组和对照组样本受到的热处理强度可能低于低温滑油组,这或许是由于低温滑油处理组长达60 s的滑油处理时间所致。但从3个不同处理组样本的水分含量均高于70%也可以看出,上浆处理有效保护了产品的内部成分,减少了水分的流失[4]。从图2-b所示的不同处理组烹饪损失可以看出,3个处理组中低温滑油组的烹饪损失最高,而高温滑油组的最低。但相较于相关研究报道的上浆肉片滑油处理不超过10%的烹饪损失[2-4],本研究中3个处理组约15%的烹饪损失率明显更高,这与本研究中使用更高的料油比有关。相关研究表明,过低的料油比会导致滑油处理中油温下降过于明显,肉片表面的浆液无法迅速变性并形成致密的保护膜,从而对产品的品质有较大的影响[8]。
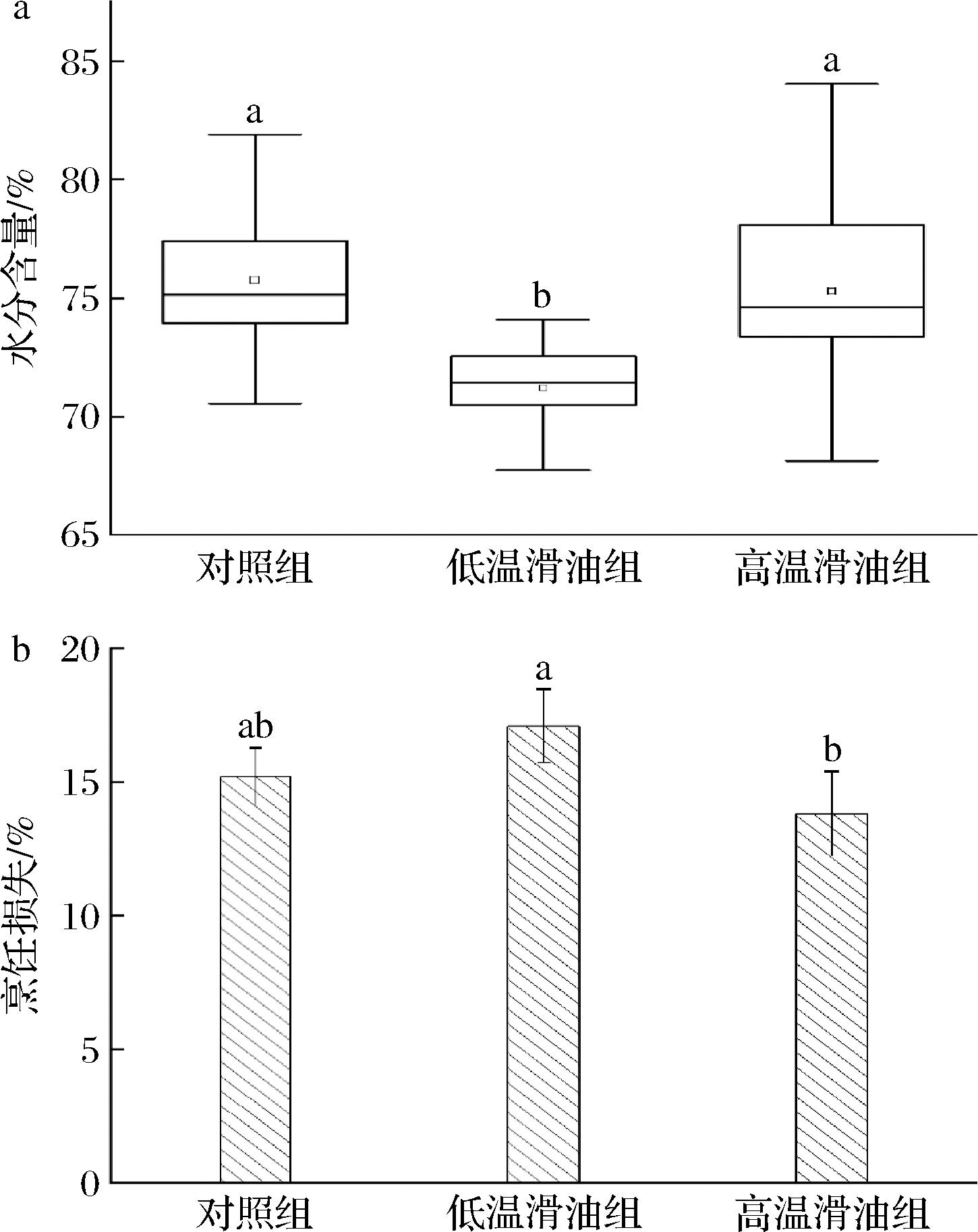
a-水分含量;b-烹饪损失
图2 不同处理对调理肉片水分含量与烹饪损失的影响
Fig.2 Effect of different treatments on the water content and cooking loss of prepared pork slices
氢质子的T2弛豫时间长短可以表现样本中水分的存在形式,其大小与氢质子所受的束缚力与自由度有关[13]。图谱中峰的位置越靠左,则T2弛豫时间越短,表明氢质子受到的束缚越大,其自由度越小;反之则氢质子受到的束缚越小,其自由度越大。其中弛豫时间在0~10 ms的为结合水,弛豫时间在10~100 ms的表示蛋白质、淀粉、脂肪等食品组分结合的不易流动水,弛豫时间100 ms以上的则表示自由水[16,26]。滑油处理对调理肉片样本中水分弛豫时间的影响如图3-a所示。从中可以看出不同处理组样本均出现3个特征峰,且不易流动水占比最高,但不同处理组样本间自由水的弛豫时间存在较大差异。由于T2弛豫时间的高低与水分的流动性成正比,而信号强弱则反应水分的含量[17, 26]。可以看出,对照组的T22峰信号强度高,且向左移动,表明自由水分含量高,但流动性略有降低。由图3-b所示的不同水分的比例可以看出,对照组样本中的自由水比例显著高于两个滑油处理组(P<0.05),不易流动水的比例则显著低于两个滑油处理组(P<0.05),但两个滑油处理组样本间3种水分的比例均无显著差异(P>0.05)。说明对照组中不易流动水有向自由水转变的趋势,但两个滑油处理组对这一影响则较为有限。GUO等[9]指出不易流动水与肌原纤维蛋白的结构和特性密切相关,因此对照组中不易流动水的大幅降低可能与样本中蛋白质结构和特性的显著变化有关。
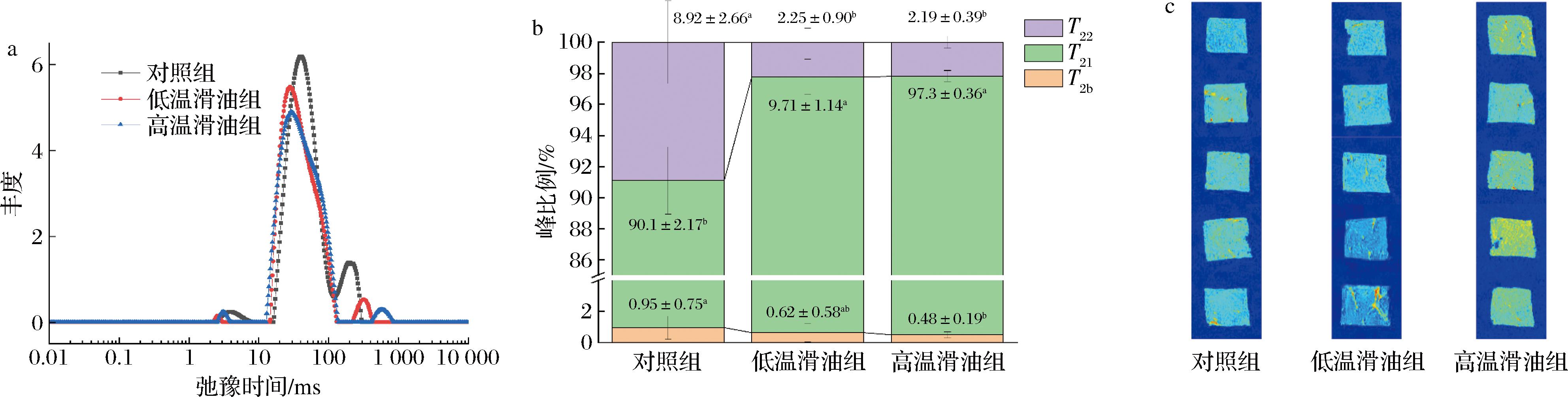
a-水分分布;b-比例;c-氢质子密度成像
图3 不同处理对调理肉片水分分布、比例及氢质子密度成像的影响
Fig.3 Effect of different treatments on the water distribution, population and hydrogen proton density imaging of prepared pork slices
进一步利用核磁共振成像技术(magnetic resonance imaging,MRI)对各处理组样本的氢质子密度进行成像,结果如图3-c所示。由于MRI是通过投影重建法,依据磁共振信号的强度表现样本中水分的含量与存在状态[17]。从图3-c中可以明显看出高温滑油组样本的成像亮度明显更高,表明其含水率较高。相比之下,对照组的信号强度稍弱,而低温滑油组信号强度最低。该结果也与水分含量、烹饪损失以及感官评价中多汁性结果保持一致。说明不同处理对调理肉片的水分有显著影响,且高温滑油处理优于其他2种处理方式。
2.3 色泽分析
调理肉制品的色泽显著影响消费者对其购买欲和消费欲。从图4可以看出,不同处理对调理肉片的L*值与a*值均无显著差异(P>0.05),但低温滑油组样本的b*值显著高于另2个处理组(P<0.05)。肉制品的L*值与保水性关系密切,保水性的降低导致肌细胞内的汁液流出与损失,会在一定程度上影响肉制品的L*值[27];而预制肉片的a*值与其中肌红蛋白的含量及其状态有关[2,4,28]。但本研究中3个处理组样本间的水分含量、烹饪损失(见图2)以及水分分布(见图3)存在显著的差异,这可能是由于不同热处理前各组样本均已上浆处理,在热处理过程中表层淀粉的迅速糊化对调理肉片中的肌红蛋白有很好的保护作用所致[4]。此外,尽管从图1所示的感官评价结果中可以看出各组的色泽差异并不显著(P>0.05),但考虑到通常b*值越小调理肉片的色泽越好[2]。因此综合考虑,本研究中高温滑油组和对照组的色泽略好于低温滑油组。
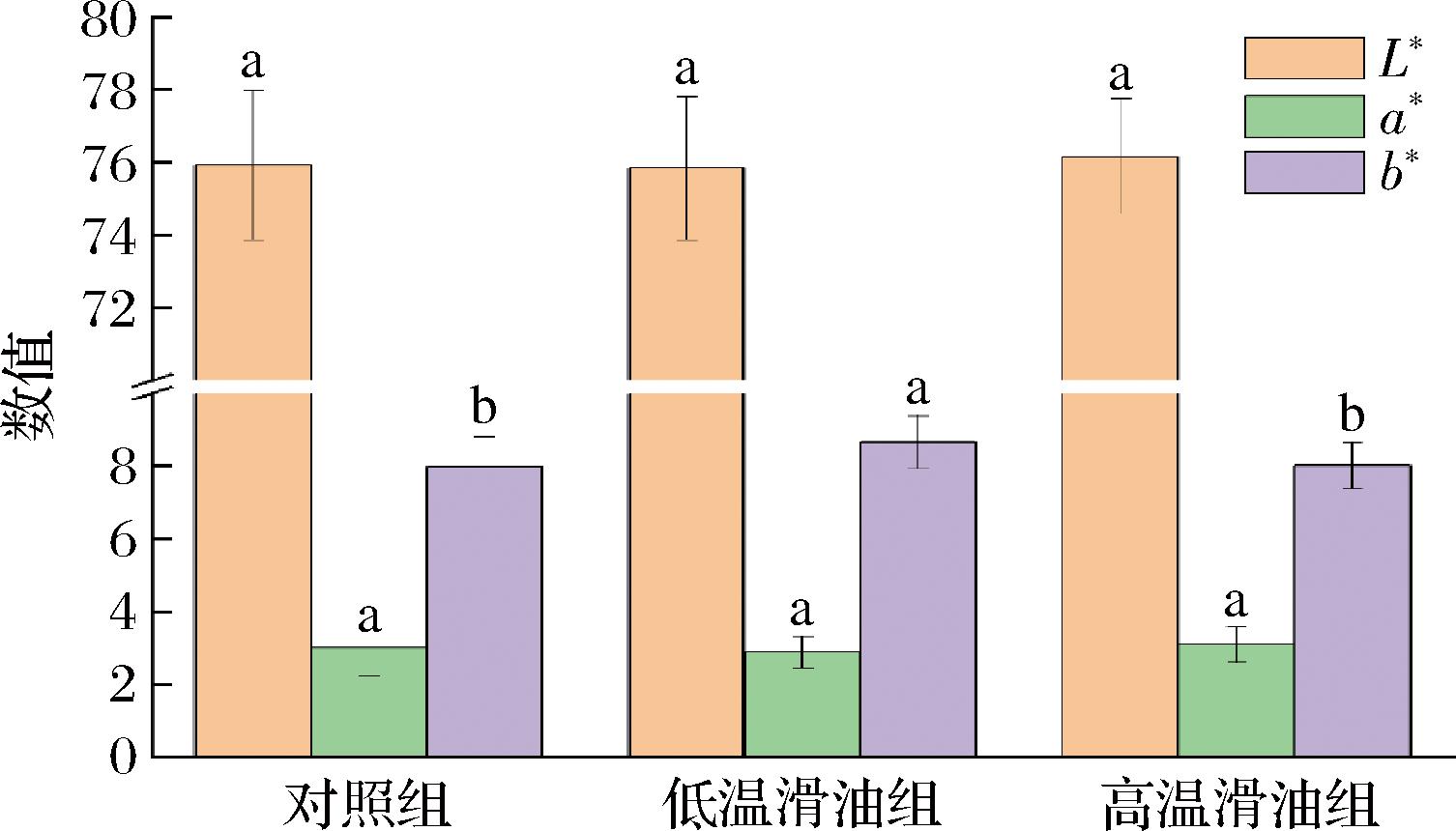
图4 不同处理对调理肉片色泽影响
Fig.4 Effect of different treatments on the color of prepared pork slices
2.4 质构与剪切力分析
如表2所示,2个滑油处理组样本的硬度、黏结性、黏性与剪切力均显著小于对照组(P<0.05),弹性无显著差异(P>0.05),而恢复性则显著高于对照组(P<0.05)。但2个不同滑油处理组之间,各指标均无显著差异(P>0.05)。研究表明,硬度、咀嚼性和弹性是调理肉片口感的关键指标,通常硬度与咀嚼性越小,弹性越大,则产品的口感更好,更嫩滑[4]。此外,剪切力也是能较为客观反映肉制品嫩度的重要指标,其数值大小与嫩度成反比[24]。本研究结果也表明滑油处理显著影响了调理肉片的质构特性,提升了产品的嫩度,但不同滑油处理工艺对产品的感官品质无显著影响(P>0.05)。不同热处理对调理肉片感官品质产生显著影响的原因与蛋白质性质的改变有密切联系。YU等[29]指出,煮制时间的延长引起蛋白质的氧化与变性,导致产品剪切力的显著增大,而肌原纤维蛋白和胶原蛋白等蛋白质的结构降解则使剪切力与硬度显著降低。此外,部分研究指出肉制品质地的变化与其汁液损失关系密切,肌纤维结合水分降低引起肉制品的剪切力的增高与韧性增加[24, 30]。孙红霞等[13]特别指出,肉制品中蛋白质性质的变化从根本上影响了肉制品的嫩度以及其他感官特性,且由于肉制品蛋白质中肌原纤维蛋白的含量占比最高,其性质的变化对肉制品嫩度与质地的影响通常也最大。
表2 不同处理对调理肉片质构及剪切力影响
Table 2 Effect of different treatments on the texture and shear force of prepared pork slices
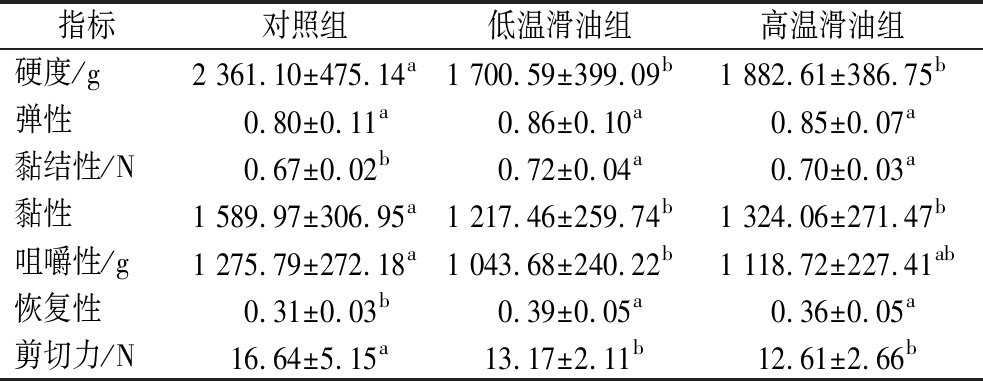
注:同行数据中不同字母表示结果存在显著性差异(P<0.05)(下同)。
指标对照组低温滑油组高温滑油组硬度/g2 361.10±475.14a1 700.59±399.09b1 882.61±386.75b弹性0.80±0.11a0.86±0.10a0.85±0.07a黏结性/N0.67±0.02b0.72±0.04a0.70±0.03a黏性1 589.97±306.95a1 217.46±259.74b1 324.06±271.47b咀嚼性/g1 275.79±272.18a1 043.68±240.22b1 118.72±227.41ab恢复性0.31±0.03b0.39±0.05a0.36±0.05a剪切力/N16.64±5.15a13.17±2.11b12.61±2.66b
2.5 蛋白质二级结构分析
为进一步探究滑油处理影响调理肉片感官品质的潜在机制,本研究提取不同处理组样本的肌原纤维蛋白,并运用傅里叶变换红外光谱分析其结构变化。蛋白质的傅里叶变换红外光谱图主要有酰胺A带、酰胺I带、酰胺II带等光谱吸收带,分别代表N—H或O—H振动、C![]() O或C
O或C![]() N振动以及C
N振动以及C![]() N或N
N或N![]() H振动[31-32]。其中酰胺A带被广泛认为是“水区域”,其吸收峰的强度与波峰位置可用于评价蛋白质与水分子之间氢键的强弱[32]。从图5-a所示的不同处理组肌原纤维蛋白傅里叶变换红外光谱可以看出,高温滑油组的酰胺A带峰响应最高,表明高温滑油组肌原纤维蛋白与水分子间作用较强。而从各肌原纤维蛋白样本的酰胺A带波峰位置可以看出,相较于对照组的3 219 cm-1,高温滑油组的波峰位置为3 195 cm-1。吸收峰位置的迁移表明蛋白质分子中O—H基团的拉伸振动发生变化[9]。由于酰胺A带波峰向更低波数迁移表明蛋白质与水分子之间的氢键密度更高,相互作用更紧密[31]。因此,肌原纤维蛋白与水分子间更强的相互作用,可能是高温滑油组样本高水分含量、低烹饪损失以及多汁性最佳的主要原因。
H振动[31-32]。其中酰胺A带被广泛认为是“水区域”,其吸收峰的强度与波峰位置可用于评价蛋白质与水分子之间氢键的强弱[32]。从图5-a所示的不同处理组肌原纤维蛋白傅里叶变换红外光谱可以看出,高温滑油组的酰胺A带峰响应最高,表明高温滑油组肌原纤维蛋白与水分子间作用较强。而从各肌原纤维蛋白样本的酰胺A带波峰位置可以看出,相较于对照组的3 219 cm-1,高温滑油组的波峰位置为3 195 cm-1。吸收峰位置的迁移表明蛋白质分子中O—H基团的拉伸振动发生变化[9]。由于酰胺A带波峰向更低波数迁移表明蛋白质与水分子之间的氢键密度更高,相互作用更紧密[31]。因此,肌原纤维蛋白与水分子间更强的相互作用,可能是高温滑油组样本高水分含量、低烹饪损失以及多汁性最佳的主要原因。

a-傅里叶变换红外光谱图;b-二级结构相对含量
图5 不同处理对调理肉片肌原纤维蛋白的傅里叶变换红外光谱图及二级结构相对含量的影响
Fig.5 The impact of different treatments on the FTIR spectra and secondary structure relative contents of myofibrillar protein of prepared pork slices
蛋白质的二级结构是蛋白质在一级结构的基础上,在氢键的作用下向一定方向盘绕和折叠,从而形成的局部空间构象,主要包括α-螺旋,β-折叠,β-转角和无规卷曲[9]。其中α-螺旋与β-折叠分别是由蛋白质的分子内氢键与分子间氢键维持的蛋白质分子间的有序排列[10, 33]。采用反卷积、二阶导数拟合确定不同处理组肌原纤维蛋白的二级结构相对含量变化,结果如图5-b所示。从图中可以看出2个滑油处理组样本肌原纤维蛋白的α-螺旋相对含量显著低于对照组(P<0.05),而β-折叠相对含量显著高于对照组(P<0.05)。尽管高温滑油组的α-螺旋相对含量最低,β-折叠相对含量最高,但2个滑油处理组之间各肌原纤维蛋白二级结构的相对含量无显著差异(P>0.05)。不同处理对调理肉片肌原纤维蛋白的二级结构影响存在显著差异,主要是由于不同的热处理方法及强度对其产生显著影响[10]。其中,α-螺旋相对含量的下降表明蛋白质分子内的氢键作用减弱,进而引起蛋白质分子展开程度增加;β-折叠相对含量上升则表明蛋白质分子间的氢键作用更强,蛋白质分子间的聚集程度增加[33]。特别是β-折叠的相对含量变化会显著影响蛋白质的表面疏水性[12],且不易流动水含量又与蛋白质二级结构的维持密切相关[9]。通常蛋白质二级结构中更高的β-折叠相对含量,有助于肉制品获得更好的质构特性与保水性[12],这或许可以很好地解释本研究中高温滑油组样本具有最高的不易流动水相对含量(如图3-b所示)以及最佳的多汁性感官品质(如图1所示)。
2.6 Zeta电位分析
从表3所示的滑油处理对调理肉片肌原纤维蛋白粒径的影响中可以看出,滑油处理显著降低了调理肉片中肌原纤维蛋白的平均粒径(P<0.05)。其中高温滑油处理组的平均粒径最小,仅为658.03 nm。相比之下,尽管2个滑油处理组的分散指数均显著高于对照组(P<0.05),但2个滑油处理组间则无显著差异(P>0.05)。李保玲等[34]指出蛋白质平均粒径的大小与蛋白质氧化导致的带电荷氨基酸残基的暴露程度有关,进而影响蛋白质分子间交联聚集的程度与蛋白粒子间静电相互作用。因此,2个滑油处理组肌原纤维蛋白粒径的差异可能也与不同的氧化程度有关。
表3 不同处理对调理肉片肌原纤维蛋白粒径影响
Table 3 Effect of different treatments on the particle size of myofibrillar protein

不同处理组对照组低温滑油组高温滑油组平均粒径/nm2 248.47±112.80a749.05±28.10b658.03±14.41c分散指数0.46±0.07b0.72±0.03a0.71±0.03a
3 结论
本研究先在感官评价的基础上,考察了不同滑油处理对调理肉片水分含量与分布、烹饪损失、色泽、质构特性及嫩度的影响。结果表明高温滑油处理显著改善了调理肉片的感官品质,其产品的风味、多汁性、质构特性以及嫩度均显著优于对照组。但不同滑油处理对调理肉片品质的影响有限,两处理组样本间仅水分含量与烹饪损失存在显著差异。进一步分析各处理组样本肌原纤维蛋白的特性与二级结构变化情况。结果表明,高温滑油处理显著增强了肌原纤维蛋白与水分子间的相互作用。伴随着α-螺旋相对含量的下降与β-折叠相对含量的上升,滑油处理在显著减弱蛋白质分子内氢键作用的同时,显著增强了蛋白质分子间的氢键作用。此外滑油处理显著降低了肌原纤维蛋白的平均粒径,而其分散指数则显著升高。因此,滑油处理对调理肉片感官品质的影响,源于不同处理条件下调理肉片中肌原纤维蛋白特性的差异。
[1] 周爱东. 上浆工艺中影响因素的分析[J].扬州大学烹饪学报, 2001, 18(2):17-19.
ZHOU A D.Analysis of effect factors in starching skill[J].Cuisine Journal of Yangzhou University, 2001, 18(2):17-19.
[2] 高子武, 王恒鹏, 陈胜姝, 等.不同宰后时间下调理猪肉片品质特性及挥发性风味物质比较[J].现代食品科技, 2020, 36(11):263-272;312.
GAO Z W, WANG H P, CHEN S S, et al.Comparison of quality characteristics and volatile flavor compounds of pork slices at different post-slaughter time[J].Modern Food Science and Technology, 2020, 36(11):263-272;312.
[3] 陈胜姝. 调理猪肉片上浆工艺机理及保鲜研究[D].扬州:扬州大学, 2020.
CHEN S S.Study on sizing mechanism and preservation of conditioned pork slices[D].Yangzhou:Yangzhou University, 2020.
[4] 孟祥忍, 高子武, 陈胜姝, 等.不同种类淀粉对上浆猪肉片品质的影响[J].食品工业科技, 2020, 41(4):36-41.
MENG X R, GAO Z W, CHEN S S, et al.Effects of different kinds of starch on the quality of pork slices with sizing[J].Science and Technology of Food Industry, 2020, 41(4):36-41.
[5] GUO X J, WANG R Q.Analysis of dynamic changes of lipid composition and structure of deep-fried pork slices during storage[J].European Journal of Lipid Science and Technology, 2021, 123(11):2100049.
[6] 张宁. 猪肉烹饪加工关键技术研究[D].天津:天津科技大学, 2016:58-79.
ZHANG N.Study on key technologies of pork cooking and processing[D].Tianjin:Tianjin University of Science &Technology, 2016:58-79.
[7] MEURILLON M, ENGEL E.Mitigation strategies to reduce the impact of heterocyclic aromatic amines in proteinaceous foods[J].Trends in Food Science &Technology, 2016, 50:70-84.
[8] 李越. 猪肉片上浆工艺优化及短期放置品质变化的研究[D].哈尔滨:哈尔滨商业大学, 2017.
LI Y.Optimization of sizing process of pork slices and changes of short-term storage quality[D].Harbin:Harbin University of Commerce, 2017.
[9] GUO X J, WANG R Q.Changes in secondary structure of myofibrillar protein and its relationship with water dynamic changes during storage of battered and deep-fried pork slices[J].Food Science and Biotechnology, 2018, 27(6):1667-1673.
[10] 万红兵, 李海鹏, 雷元华, 等.烹饪熟度对牛肉肌原纤维蛋白结构特性和氧化特性的影响[J].食品科学, 2021, 42(13):17-25.
WAN H B, LI H P, LEI Y H, et al.Effect of degree of doneness on structural and oxidation properties of beef myofibrillar protein[J].Food Science, 2021, 42(13):17-25.
[11] 董晗, 王道营, 张牧焓, 等.不同加热温度对鸭肉肌动球蛋白解离的影响[J].食品工业科技, 2012, 33(20):120-124.
DONG H, WANG D Y, ZHANG M H, et al.Effect of different heating temperatures on liberation of actin from actomyosin in duck meat[J].Science and Technology of Food Industry, 2012, 33(20):120-124.
[12] 李清正, 张顺亮, 罗永康, 等.温度对复合肌原纤维蛋白结构及其表面疏水性的影响[J].肉类研究, 2017, 31(2):6-10.
LI Q Z, ZHANG S L, LUO Y K, et al.Effects of temperature on the structure and surface hydrophobicity of mixed myofibrillar proteins[J].Meat Research, 2017, 31(2):6-10.
[13] 孙红霞, 黄峰, 丁振江, 等.不同加热条件下牛肉嫩度和保水性的变化及机理[J].食品科学, 2018, 39(1):84-90.
SUN H X, HUANG F, DING Z J, et al.Changes in tenderness and water-holding capacity and underlying mechanism during beef stewing[J].Food Science, 2018, 39(1):84-90.
[14] ZHANG J, ZHANG W G, XING L J.Effects of ultrasound on the taste components from aqueous extract of unsmoked bacon[J].Food Chemistry, 2021, 365:130411.
[15] ZHOU C Y, WU J Q, TANG C B, et al.Comparing the proteomic profile of proteins and the sensory characteristics in Jinhua ham with different processing procedures[J].Food Control, 2019, 106:106694.
[16] HUANG J C, HUANG M, YANG J, et al.The effects of electrical stunning methods on broiler meat quality:Effect on stress, glycolysis, water distribution, and myofibrillar ultrastructures[J].Poultry Science, 2014, 93(8):2087-2095.
[17] 薛美芳, 王永瑞, 张也, 等.不同干燥温度对牛肉脯水分分布迁移规律的影响[J].食品与生物技术学报, 2021, 40(11):62-69.
XUE M F, WANG Y R, ZHANG Y, et al.Effect of different drying temperatures on moisture distribution and migration of dried beef jerky[J].Journal of Food Science and Biotechnology, 2021, 40(11):62-69.
[18] 戚军. 基于结构蛋白与风味物质结合的黄羽鸡汤风味形成研究[D].南京:南京农业大学, 2018.
QI J.Study on flavor formation of yellow feather chicken soup based on the combination of structural protein and flavor substances[D].Nanjing:Nanjing Agricultural University, 2018.
[19] QI J, LI C B, CHEN Y J, et al.Changes in meat quality of ovine Longissimus dorsi muscle in response to repeated freeze and thaw[J].Meat Science, 2012, 92(4):619-626.
[20] TRAORE S, AUBRY L, GATELLIER P, et al.Effect of heat treatment on protein oxidation in pig meat[J].Meat Science, 2012, 91(1):14-21.
[21] CHEN X, ZOU Y F, HAN M Y, et al.Solubilisation of myosin in a solution of low ionic strength L-histidine:Significance of the imidazole ring[J].Food Chemistry, 2016, 196:42-49.
[22] MOTTRAM D S.Flavour formation in meat and meat products:A review[J].Food Chemistry, 1998, 62(4):415-424.
[23] BECKER A, BOULAABA A, PINGEN S, et al.Low temperature cooking of pork meat:Physicochemical and sensory aspects[J].Meat Science, 2016, 118:82-88.
[24] 程天赋, 俞龙浩, 蒋奕, 等.基于低场核磁共振探究解冻过程中肌原纤维水对鸡肉食用品质的影响[J].食品科学, 2019, 40(9):16-22.
CHENG T F, YU L H, JIANG Y, et al.Effect of myofibrillar water on chicken quality during thawing as studied by low-field nuclear magnetic resonance[J].Food Science, 2019, 40(9):16-22.
[25] S NCHEZ DEL PULGAR J, G
NCHEZ DEL PULGAR J, G ZQUEZ A, RUIZ-CARRASCAL J.Physico-chemical, textural and structural characteristics of sous-vide cooked pork cheeks as affected by vacuum, cooking temperature, and cooking time[J].Meat Science, 2012, 90(3):828-835.
ZQUEZ A, RUIZ-CARRASCAL J.Physico-chemical, textural and structural characteristics of sous-vide cooked pork cheeks as affected by vacuum, cooking temperature, and cooking time[J].Meat Science, 2012, 90(3):828-835.
[26] LI C B, LIU D Y, ZHOU G H, et al.Meat quality and cooking attributes of thawed pork with different low field NMR T21[J].Meat Science, 2012, 92(2):79-83.
[27] HOLMER S F, MCKEITH R O, BOLER D D, et al.The effect of pH on shelf-life of pork during aging and simulated retail display[J].Meat Science, 2009, 82(1):86-93.
[28] 孟彤, 刘源, 仇春泱, 等.蛋白质氧化及对肉品品质影响[J].中国食品学报, 2015, 15(1):173-181.
MENG T, LIU Y, QIU C Y, et al.Research progress on protein oxidation mechanisms and its effects on meat quality[J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(1):173-181.
[29] YU M M, FAN Y C, ZHANG X R, et al.Effect of boiling on texture of abalone muscles and its mechanism based on proteomic techniques[J].Food Chemistry, 2022, 388:133014.
[30] HARKOUSS R, ASTRUC T, LEBERT A, et al.Quantitative study of the relationships among proteolysis, lipid oxidation, structure and texture throughout the dry-cured ham process[J].Food Chemistry, 2015, 166:522-530.
[31] 赵雪. 酸碱处理改善类PSE鸡肉蛋白加工特性研究[D].南京:南京农业大学, 2020.
ZHAO X.Study on improving the processing characteristics of PSE-like chicken protein by acid-base treatment[D].Nanjing:Nanjing Agricultural University, 2020.
[32] ABDOLLAHI M, REZAEI M, JAFARPOUR A, et al.Dynamic rheological, microstructural and physicochemical properties of blend fish protein recovered from kilka (Clupeonella cultriventris) and silver carp (Hypophthalmichthys molitrix) by the pH-shift process or washing-based technology[J].Food Chemistry, 2017, 229:695-709.
[33] 杨玉玲, 游远, 彭晓蓓, 等.加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响[J].中国农业科学, 2014, 47(10):2013-2020.
YANG Y L, YOU Y, PENG X B, et al.Influence of heating on structure and gel properties of myofibrillar proteins from chicken breast muscle[J].Scientia Agricultura Sinica, 2014, 47(10):2013-2020.
[34] 李保玲, 李颖, 朱振宝, 等.氧化亚油酸对肌原纤维蛋白胶凝行为及热诱导凝胶体外消化率的影响[J].食品与发酵工业, 2021, 47(19):111-119.
LI B L, LI Y, ZHU Z B, et al.Effect of oxidized linoleic acid on gelling behavior of myofibrillar protein and in vitro digestibility of heat-induced gel[J].Food and Fermentation Industries, 2021, 47(19):111-119.