马瑟兰(Vitis vinifera L.cv.Marselan)是一种原产于法国的红色酿酒葡萄品种,是法国国家农业研究院以赤霞珠和歌海娜为亲本杂交育成的品种,具有优良的抗病虫害特性[1-2]。马瑟兰葡萄酒具有丰富的酚类物质[3],且通常伴有果香、陈酿香等优雅的香气[4]。自2001年引入河北省种植之后,马瑟兰便表现出了较好的适应性和酿造潜力。目前中国已是马瑟兰种植面积位列第二的国家[5],并且随着对高品质葡萄酒需求的不断提升,中国将有越来越多的地区开始种植马瑟兰。
地理位置在一定程度上决定了各种影响葡萄生长和葡萄酒发酵的生态因子和生物因素,进而极大地影响了葡萄和葡萄酒的品质[6]。大多数葡萄酒生产国依赖地理分级系统来对葡萄酒进行划分[7]。已有研究证实,中国主要马瑟兰葡萄酒产区微生物群落之间具有显著差异[8],而微生物群落是葡萄酒风土的重要影响因素[9]。因此,不同产区马瑟兰葡萄酒在质量风格等方面可能具有不同的特征和差异。同时,大量研究表明,市售葡萄酒普遍被用于比较产区之间质量风格,是能够体现各产区风土特征、较好地排除不同酿酒师酿造工艺影响的有效工具[3,10-15]。得益于独特的气候和地理条件,以贺兰山东麓而闻名的宁夏产区正逐渐成为世界葡萄酒产区的新星[16-17]。河北产区作为马瑟兰首次引入中国开始种植的地区,同样是我国重要的葡萄酒产区[18]。此前有研究基于挥发性香气化合物分析对中国部分产区的马瑟兰葡萄酒成功进行了地理区分[3]。然而,作为我国2个重要的马瑟兰葡萄酒产区,河北和宁夏产区马瑟兰葡萄酒理化特征的比较分析却十分有限。
鉴于我国马瑟兰葡萄引种时间较短,目前对于中国马瑟兰葡萄酒的成分特征研究尚不充分,本研究选择宁夏和河北地区共27款市售干红葡萄酒作为代表进行研究,解析其理化性质、有机酸、花色苷和其他酚类物质特征及抗氧化能力,揭示马瑟兰在不同产区间的质量表现;同时,利用正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)进行关联分析,尝试建立2个产区马瑟兰干红葡萄酒的地理判别方法,以期进一步促进马瑟兰葡萄酒在中国区域特色化品质发展。本研究通过系统研究马瑟兰在中国不同产区质量风格的具体表现,将为进一步揭示马瑟兰与不同产区风土条件之间的联系提供理论依据,进而助力凝练中国马瑟兰质量风格。
1 材料与方法
1.1 材料与试剂
27款市售马瑟兰干红葡萄酒样品分别来自宁夏回族自治区和河北省,酒样基本信息见表1。
表1 马瑟兰市售酒样基本信息
Table 1 Basic information of Marselan wine samples
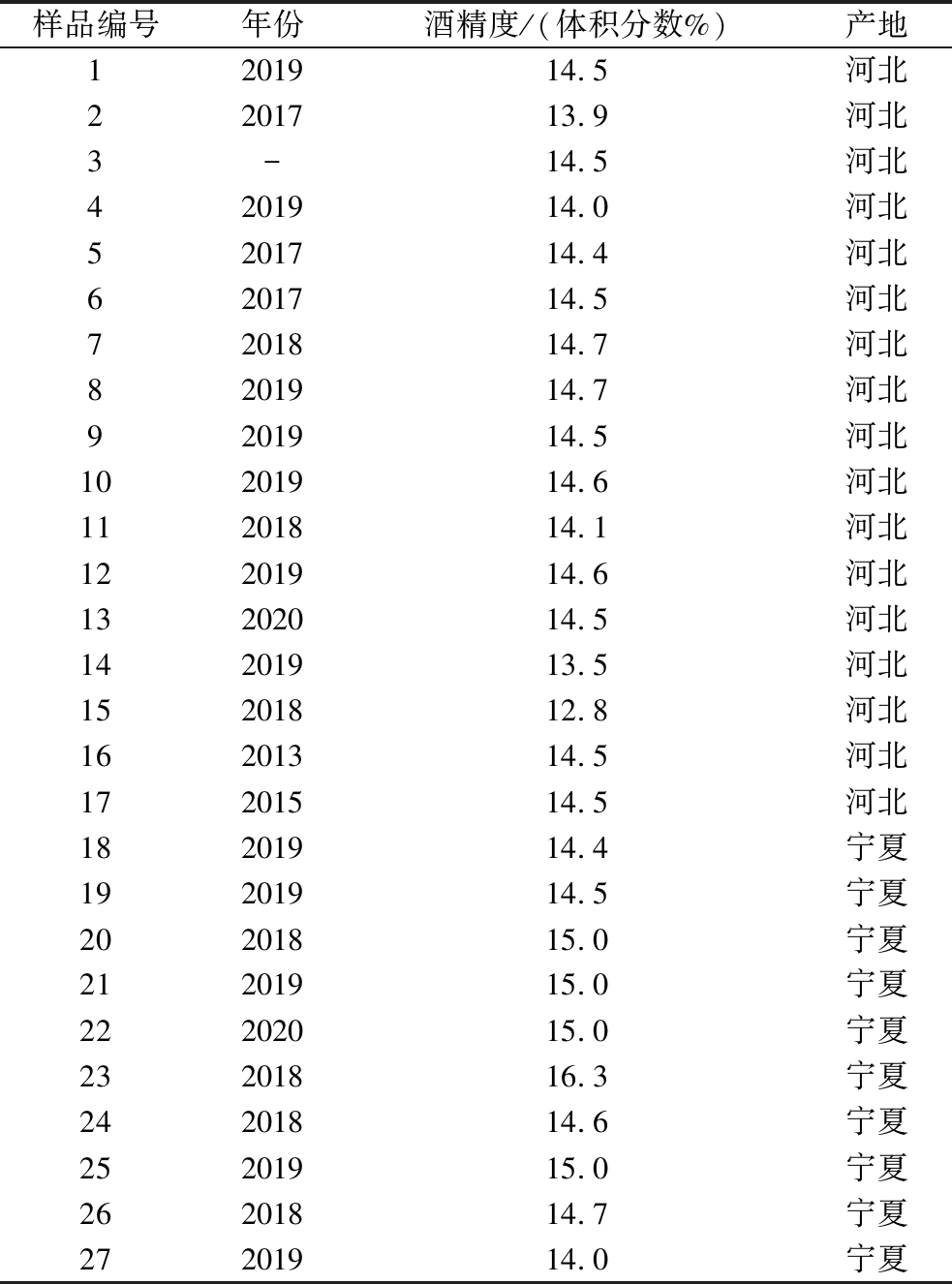
样品编号年份酒精度/(体积分数%)产地1201914.5河北2201713.9河北3-14.5河北4201914.0河北5201714.4河北6201714.5河北7201814.7河北8201914.7河北9201914.5河北10201914.6河北11201814.1河北12201914.6河北13202014.5河北14201913.5河北15201812.8河北16201314.5河北17201514.5河北18201914.4宁夏19201914.5宁夏20201815.0宁夏21201915.0宁夏22202015.0宁夏23201816.3宁夏24201814.6宁夏25201915.0宁夏26201814.7宁夏27201914.0宁夏
甲醇、乙酸、乙腈、乙酸乙酯、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox),均为色谱级,德国Meker公司;有机酸标准品(草酸、酒石酸、奎宁酸、苹果酸、莽草酸、乳酸、柠檬酸、琥珀酸)、花色苷标准品(二甲花翠素-3-O-葡萄糖苷)、31种单体酚标准品(儿茶酸等),美国Sigma-Aldrich公司;所有分析纯化学品,成都西陇科学股份有限公司。
1.2 仪器与设备
Enology Y15葡萄酒全自动分析仪,西班牙Biosystems公司;2699高效液相色谱仪,美国Waters公司;LC-20A液相色谱仪、LC-15C高效液相色谱仪,日本岛津公司;UV-2800A紫外可见分光光度计,上海尤尼柯仪器有限公司。
1.3 实验方法
1.3.1 样品处理
葡萄酒样品经0.45 μm滤器过滤,部分指标测定前进行适当稀释。
1.3.2 基础理化
基础理化(包括还原糖、果糖、葡萄糖、总酸度、总硫、游硫、氨氮)以及总酚和总花色苷由Enology Y15葡萄酒全自动分析仪测定。葡萄酒样品经0.45 μm滤器过滤后,按照仪器说明进行分析。
1.3.3 单体有机酸
参考高海燕等[19]的方法,使用Waters 2699高效液相色谱仪进行检测,配备有C18色谱柱(4.6 mm×250 mm;5 μm,CAPCELL PAK C18;Shiseido, Japan)。流动相A:0.02 mol/L K2HPO4(pH=2.3);流动相B:甲醇。流动相A∶B=99∶1(体积比)的洗脱程序等梯度洗脱,流速0.5 mL/min。以保留时间确定各有机酸成分,采用外标法计算样品中各有机酸的浓度。
1.3.4 单体花色苷
参照YANG等[20]的方法,样品测定前经0.22 μm滤膜过滤,使用岛津LC-20A液相色谱仪进行检测,配备有Synergi Hydro-RPC18色谱柱(250 mm×4.6 mm,4 μm)。流动相A[V(甲酸)∶V(乙晴)∶V(水)=2.5∶10∶80],流动相B[V(甲酸)∶V(乙腈)∶V(水)=2.5∶50∶40]。梯度洗脱程序:0~45 min:0%~35% B;45~46 min:35%~100% B;46~50 min:100% B;50~51 min:100% B;51~55 min:0% B。流速1 mL/min;柱温35 ℃;检测波长520 nm。根据花色苷的保留时间、最大吸收波长和实验花色苷质谱数据库对花色苷进行定性分析;以二甲花翠素-3-O-葡萄糖苷为标准品,采用外标法进行定量分析,所有花色苷浓度以二甲花翠素-3-O-葡萄糖苷当量表示。花色苷标准曲线浓度范围为0.27~400×10-3 g/L。
1.3.5 单体酚
参照葛谦等[21]的方法,采用LC-15C高效液相色谱仪进行检测,配备有Waters×Terra MS C18色谱柱(250 mm×4.6 mm, 5 μm)。样品前处理:取30 mL葡萄酒样液,加入60 mL乙酸乙酯,萃取3次后,35 ℃减压旋蒸至干,甲醇定容至10 mL,0.45 μm微孔滤膜过滤,-20 ℃保存待测。流动相A:2%(体积分数)的乙酸水溶液;流动相B:含0.5%乙酸的乙腈-水溶液;V(流动相A)∶V(流动相B)=50∶50。梯度洗脱程序:0~50 min:10%~55%A;0~60 min:55%~100%A;60~65 min:100%~10%A;65~75 min:10%A。柱温30 ℃;流速0.8 mL/min。检测波长280 nm(黄烷-3-醇类以及二氢查耳酮类),320 nm(羟基肉桂酸类),360 nm(黄酮醇)。定性方法采用目标化合物与标准品保留时间比对的方法,定量方法为峰面积外标定量法。
1.3.6 抗氧化能力
DPPH自由基清除测定法和铁离子还原能力(ferric reducing antioxidant capacity, FRAP)测定法参照MA等[22]。铜离子还原能力(cupric reducing antioxidant capacity, CUPRAC)方法参照CHENG等[23]。结果均以mmol Trolox 当量/L表示。
1.3.7 数据处理
使用SPSS 26.0进行独立样本t检验,统计评估显著性水平为P=0.05。酒样基础理化指标箱线图的绘制采用GraphPad Prism(Version 9.3.1)进行。OPLS-DA使用SIMCA 14.1版进行。在进行多变量统计分析之前,所有的化学变量都被归一化。
2 结果与分析
2.1 基础理化
葡萄酒的理化指标与诸多因素相关,土壤、气候、栽培方式和酿造策略均会对其产生影响[24]。此外,有研究表明,存在同一地区的不同酿酒厂之间差异较大的情况[8]。因此,为了更好地研究产区特点,并尽可能忽略酒厂间的差异,地区内酒样在指标检测时进行了平均处理。宁夏和河北2个地区共27款市售马瑟兰干红葡萄酒的基础理化指标检测结果如图1所示。

图1 两地区酒样基本理化指标
Fig.1 Basic physicochemical indexes of wine samples from two regions
注:****代表存在显著性差异(P<0.000 1);***代表存在显著性差异(P<0.001);ns代表无显著性差异。
所检测的基础理化指标中,仅总酸在两地区间无显著差异(P>0.05)。总酸在葡萄酒的感官感受中起着举足轻重的作用,并直接影响到葡萄酒的整体感官特征。通常来说,过高的酸度会带来尖锐的感官,而酸度过低的葡萄酒会让人感到松弛和平淡,呈现出寡淡的风味[25]。宁夏(2.06 g/L)与河北(2.04 g/L)市售酒样总酸无显著差异,这可能导致两地区酒样感官酒体结构难以区分。酒样还原糖含量在很大程度上取决于酿酒策略[26]。宁夏地区酒样总还原糖含量以及葡萄糖、果糖含量均显著高于河北地区,宁夏酒样还原糖含量为河北的2.20倍。宁夏地区马瑟兰葡萄可能由于其更为充足的光热资源而具有较好的成熟度和较高糖度,导致该地区酒庄酿酒策略与河北地区不同,进而体现在两地区葡萄酒样品还原糖含量差异。河北地区酒样中葡萄糖和果糖含量比例约为1∶1,宁夏地区约为0.7∶1。SO2是最常见的葡萄酒添加剂,常用于抑菌和抗氧化。葡萄酒中SO2的含量易随着时间变化而改变。总硫含量比游硫更加稳定[26]。河北地区酒样总硫(0.081 g/L)显著高于宁夏(0.048 g/L),尽管其游硫含量显著低于宁夏地区约24.27%(P<0.05)。
OPLS-DA模型有助于在反映数据最大变异信息的同时,剔除数据中的无关变量。根据地区酒样7种理化指标的含量建立了OPLS-DA模型![]() 如图2所示,两地区样品可以按照地区区分开,尤其是可以在第一成分方向上区分为2个地区。总硫和氨氮是相对较关键的化合物,对两地区之间OPLS-DA模型建立贡献较大。总体而言,基于7种理化指标建立的OPLS-DA模型基本可以实现河北和宁夏两地区马瑟兰酒样之间的区分。这可能预示着不同地区基本理化指标可以作为地区酒样判别和区分标准之一,用于地理溯源。
如图2所示,两地区样品可以按照地区区分开,尤其是可以在第一成分方向上区分为2个地区。总硫和氨氮是相对较关键的化合物,对两地区之间OPLS-DA模型建立贡献较大。总体而言,基于7种理化指标建立的OPLS-DA模型基本可以实现河北和宁夏两地区马瑟兰酒样之间的区分。这可能预示着不同地区基本理化指标可以作为地区酒样判别和区分标准之一,用于地理溯源。

a-OPLS-DA得分图;b-OPLS-DA载荷图;c-VIP得分图
图2 基于两地区酒样基本理化指标OPLS-DA
Fig.2 OPLS-DA plots based on basic physicochemical indexes of wine samples from two regions
2.2 有机酸
有机酸与葡萄酒的总酸度密切相关,并且不同的有机酸具有不同的感官特点[27-29]。除莽草酸和乳酸外,两地区其他6种有机酸含量均存在显著差异。宁夏地区酒样草酸、奎宁酸、柠檬酸和琥珀酸含量均显著高于河北地区,与之相对应的是河北地区的酒石酸和苹果酸均显著高于宁夏地区(P<0.05)。苹果酸和酒石酸是天然葡萄或有机物产物,它们的含量可能会受到葡萄原料和酿酒过程的影响。河北地区隶属华北大区,宁夏位处西北干旱半干旱地区,不同的气候和风土特点可能对葡萄原料和葡萄酒发酵过程产生影响,进而导致各类有机酸的含量差异。河北地区柠檬酸含量比宁夏地区低0.31 g/L。苹果酸-乳酸发酵是葡萄酒中乳酸含量增加的重要原因,这一过程中乳酸菌也会利用柠檬酸[30]。有研究发现,混菌发酵和酒泥陈酿也可提高葡萄酒中乳酸和酒石酸的含量[31]。因此酿酒工艺对于葡萄酒的理化特征具有重要影响。由样品聚类热图可得(图3-b),27款马瑟兰干红葡萄酒之间莽草酸、酒石酸和奎宁酸3种单体有机酸含量差异较大。其中尽管来自宁夏的17号样品在草酸、苹果酸和奎宁酸含量为所有样品中最低,但其莽草酸含量为地区最高。由图3-b得出马瑟兰葡萄酒样品按照地区聚类的趋势较弱。由图3-c可知,同一地区的样品趋近于聚集,但宁夏地区样品相对河北较为分散。两地区在第一成分方向有按照地区区分的趋势,河北地区样品倾向于分布在第一成分的负方向而宁夏地区样品则更倾向于分布在正向。柠檬酸、苹果酸和草酸为贡献较大的两类物质(VIP值>1)。总酸与有机酸的关系密切[27-29],2.1节中分析得出的两地区间总酸含量无显著差异,但样品有机酸含量组成上具有不同的特征。

a-两地区单体有机酸柱图;b-酒样单体有机酸热图;c-OPLS-DA得分图;d-OPLS-DA载荷图;e-OPLS-DA VIP得分图
图3 两地区酒样有机酸含量及基于有机酸含量的OPLS-DA结果
Fig.3 Organic acid content of wine samples from two regions and related OPLS-DA plots
2.3 花色苷
花色苷是葡萄酒中一类与酒的颜色、口感等特性相关的重要成分,尤其是对年轻葡萄酒而言更是影响其颜色的主要因素[32]。不同品种花色苷含量不同,也与所酿造的葡萄酒中花色苷的变化规律相关。对两地区酒样总花色苷含量检测结果显示,宁夏地区总花色苷含量显著高于河北地区(图4-a)。葡萄是酒中花色苷的唯一来源,诸如浸渍、陈酿时间和容器的选择等酿酒学参数的不同也会影响葡萄酒中的花色苷含量[33-35]。因此,葡萄酒中花色苷的种类和含量与葡萄品种、气候、农艺实践和酿酒学处理密切相关[36-37]。研究发现气候对葡萄成分的影响最大,其次是土壤和栽培品种[38]。位于西北干旱半干旱地区的宁夏产区具有充足的光热资源,导致花色苷在葡萄中的大量积累,这可能是宁夏产区酒样总花色苷含量显著高于河北地区的原因。

a-两地区总花色苷含量;b-OPLS-DA VIP得分图;c-OPLS-DA载荷图;d-OPLS-DA得分图;e-两地区单体花色苷含量;f-酒样单体花色苷热图
图4 两地区酒样花色苷含量及OPLS-DA
Fig.4 Anthocyanin content of wine samples from two regions and related OPLS-DA plots
单体花色苷作为一类游离花色苷,被认为对葡萄酒的颜色和健康功效有巨大贡献[33]。所检测的9种花色苷中,二甲花翠素-3-O葡萄糖苷为所有马瑟兰干红葡萄酒样品中含量最高的单体花色苷,宁夏地区该花色苷平均含量高达0.051 g/L。此外,两地区9种单体花色苷含量分别具有显著差异。河北地区花青素-3-O-葡萄糖苷含量高于宁夏地区88.13%。除花青素-3-O-葡萄糖苷外,宁夏地区其他单体花色苷均显著高于河北地区,特别是二甲花翠素-3-O葡萄糖苷两地区差值可达0.033 g/L。根据聚类热图(图4-f)中单体花色苷聚类结果,花青素-3-O-葡萄糖苷单独聚为一类,区别于其余8种花色苷单体。与单体有机酸聚类结果相比,单体花色苷样品按照地区进行聚类的趋势较为明显。除21号样品外,来自河北的样品倾向于聚为一大类。这一趋势在基于单体花色苷含量建立的OPLS-DA模型![]() 中也可看出,同一地区样品趋近于聚集,且可在第一成分方向进行区分(图4-d)。由图4-b可得,甲基花青素-3-O葡萄糖苷、甲基花翠素-3-O葡萄糖苷、甲基花青素-3-O(6-O-反式对香豆酰)葡萄糖苷、二甲花翠素-3-O葡萄糖苷、二甲花翠素-3-O(6-O-乙酰)葡萄糖苷这5种花色苷为模型建立关键化合物(VIP值>1)。
中也可看出,同一地区样品趋近于聚集,且可在第一成分方向进行区分(图4-d)。由图4-b可得,甲基花青素-3-O葡萄糖苷、甲基花翠素-3-O葡萄糖苷、甲基花青素-3-O(6-O-反式对香豆酰)葡萄糖苷、二甲花翠素-3-O葡萄糖苷、二甲花翠素-3-O(6-O-乙酰)葡萄糖苷这5种花色苷为模型建立关键化合物(VIP值>1)。
2.4 单体酚
由图5-a可得,河北地区酒样总酚含量显著高于宁夏地区。酚类物质在果实中的积累受气候影响很大,并且葡萄树的水分是决定酚类含量的决定性参数[38]。因此,位于西北干旱半干旱地区的宁夏均具有较高的总酚含量(2.0 g/L)。然而,位于中国华北的河北产区总酚含量(2.1 g/L)却显著高于宁夏。酒样中的酚类物质含量虽然与葡萄果实的酚类物质积累极为相关(即与自然条件不可分割),但同时酒庄、年份和地区同样不可忽视[7]。由表2可得,两地
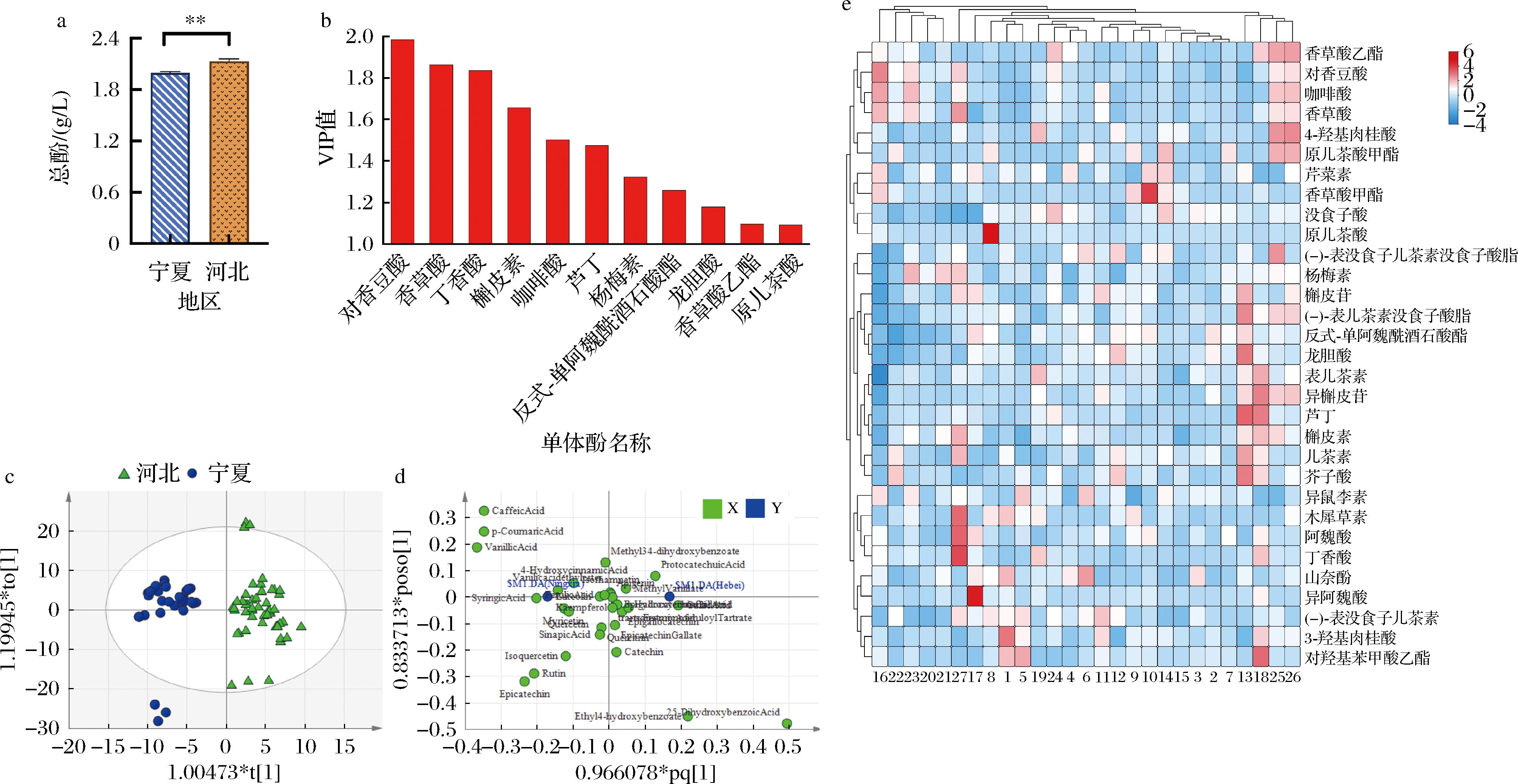
a-两地区总酚含量;b-OPLS-DA VIP得分图;c-OPLS-DA得分图;d-OPLS-DA载荷图;e-样品单体酚含量热图
图5 两地区酒样酚类含量及OPLS-DA
Fig.5 Polyphenol content of wine samples from two regions and related OPLS-DA plots
表2 马瑟兰市售酒样单体酚物质含量 单位:mg/L
Table 2 Monomeric phenolic content of Marselan commercial wine samples

注:同一行不同字母代表存在显著性差异(P<0.05),未标注字母即无显著性差异。
物质宁夏河北物质宁夏河北表没食子儿茶素10.14±0.33b11.29±0.11a儿茶素24.12±0.3624.59±0.08 表没食子儿茶素没食子酸酯4.38±0.11 4.42±0.07 表儿茶素49.21±1.27a39.80±0.69b表儿茶素没食子酸酯5.92±0.04 5.97±0.11 杨梅素7.35±0.18a4.48±0.03b异鼠李素1.01±0.03b1.15±0.03a芦丁22.44±0.85a14.58±0.45b异槲皮苷18.28±0.41a13.95±0.28b槲皮苷15.14±0.18 14.89±0.27 槲皮素4.48±0.11a2.88±0.04b木犀草素1.07±0.03a0.81±0.02b芹菜素0.23±0.01b0.29±0.00a山奈酚0.35±0.00b0.42±0.01a反式-单阿魏酰酒石酸酯1.92±0.03b2.57±0.07a咖啡酸49.47±1.36a29.61±0.46b对香豆酸35.76±0.71a20.56±0.18b4-羟基肉桂酸13.72±0.18a10.05±0.27b阿魏酸2.97±0.03b3.12±0.06a3-羟基肉桂酸2.14±0.02b2.27±0.06a芥子酸6.36±0.05a5.33±0.09b异阿魏酸1.09±0.03b1.86±0.06a没食子酸33.73±0.35b44.67±0.55a原儿茶酸2.87±0.11b7.27±0.43a龙胆酸55.47±1.67b90.15±2.35a香草酸45.98±1.62a28.20±0.04b丁香酸13.47±0.58a9.45±0.14b原儿茶酸甲酯19.81±0.50a17.44±0.37b香草酸甲酯0.57±0.01b1.43±0.05a对羟基苯甲酸乙酯54.51±3.13b74.07±1.63a香草酸乙酯5.13±0.08a1.48±0.03b
区各单体酚含量相似,但宁夏地区(49.21 mg/L)在表儿茶素含量上显著高于河北地区(39.80 mg/L)。由单体酚聚类结果也可看出,除龙胆酸、丁香酸和对羟基苯甲酸乙酯外,所有羟基安息酸类物质聚为一大类。所研究的所有样品中,表儿茶素、没食子酸、龙胆酸及对羟基苯甲酸乙酯为含量较高的单体酚物质。由样品单体酚含量(图5-e)得,尽管样品没有严格聚为两类,但河北地区样品按照地区进行聚类的趋势相对明显,相比较下宁夏地区样品分布则较为分散。但总体而言,同一地区的样品有聚为一类的趋势。与葡萄不同,葡萄酒是经过人为加工后的产品,因此其中酚类物质不仅受自然条件的影响,酒庄酿造工艺等人为因素也是重要的影响条件之一。除此之外,可能也与所检测的31种单体酚物质种类有关,虽然种类较多,但并不能完全反映酒样中所有单体酚的概况。酒样31种单体酚含量的OPLS-DA模型![]() 显示两地区酒样可以进行无重叠地明显区分(图5-c)。根据第一成分可以将样品按照地区分为两类,其中宁夏地区分布于第一成分的负方向,河北地区分布于第一成分的正方向。这与关于年轻马瑟兰葡萄酒的研究得出的很难依靠酚类物质含量的OPLS-DA模型按地区区分开的结果有所差别[3],可能是由于采样及所研究的单体酚种类不同所致。根据各物质的VIP值,其中有11种单体酚在模型建立中起到较为关键作用(VIP值>1,图5-b)。
显示两地区酒样可以进行无重叠地明显区分(图5-c)。根据第一成分可以将样品按照地区分为两类,其中宁夏地区分布于第一成分的负方向,河北地区分布于第一成分的正方向。这与关于年轻马瑟兰葡萄酒的研究得出的很难依靠酚类物质含量的OPLS-DA模型按地区区分开的结果有所差别[3],可能是由于采样及所研究的单体酚种类不同所致。根据各物质的VIP值,其中有11种单体酚在模型建立中起到较为关键作用(VIP值>1,图5-b)。
2.5 抗氧化功能及相关性分析
由图6-a可知,河北和宁夏地区马瑟兰酒样抗氧化能力上具有显著差异,且河北地区显著高于宁夏地区。经过相关性分析可得,这一结果可能由于河北地区样品总酚含量显著高于宁夏地区所致(图6-b)。比较样品之间的抗氧化能力可得,DPPH自由基清除能力和FRAP指标中河北地区的13号样品最高,其次是1号样品(图6-c)。而CUPRAC结果显示,河北地区12号样品抗氧化能力最高,其次是1号样品。河北地区的1号样品在3种抗氧化指标评分均位列前茅。总体来看,样品3种抗氧化指标趋势基本一致,河北地区酒样抗氧化能力较高。经过抗氧化能力与单体有机酸、单体花色苷及其他酚类物质相关性分析可得,具显著性的相关性系数几乎均为正值,即呈正相关关系。仅有对香豆酸与FRAP指标呈显著负相关关系(图6-b)。除此之外,3种指标评价下的抗氧化能力均与总酚、表儿茶素没食子酸酯和龙胆酸含量呈显著正相关。有2种抗氧化指标与表没食子儿茶素没食子酸酯、异槲皮苷、儿茶素、表儿茶素、芦丁和反式-单阿魏酰酒石酸酯含量呈显著正相关。所有显著相关性的成分均为单体酚类,这一结果可能说明了酚类物质(包括单体酚类)对马瑟兰葡萄酒的抗氧化能力有重要贡献。由相关性热图聚类结果可得,除二甲花翠素-3-O-(6-O-乙酰)葡萄糖苷外,单体花色苷聚为一大类。单体有机酸中,柠檬酸和琥珀酸聚为一大类,除此之外其他单体有机酸聚为一类。

a-两地区抗氧化能力;b-Pearson相关性分析系数热图;c-样品抗氧化能力
图6 两地区抗氧化能力及Pearson相关性分析
Fig.6 Antioxidant capacity of two regions and Pearson correlation analysis
3 结论
本研究基于河北和宁夏产区市售马瑟兰干红葡萄酒样品的基础理化指标、有机酸、花色苷和单体酚含量分别建立了OPLS-DA模型,以期实现马瑟兰酒样的地理区分。其中基于单体酚含量的OPLS-DA模型可以将两地区清晰区分,有11种单体酚对该模型的建立起关键作用(VIP值>1)。这一结果与之前对马瑟兰酒样基于酚类物质进行区分的结果有所差别[3],可能由于样品数量有限及所研究的单体酚种类差异所致。尽管结果有所不同,本研究结果充分说明了基于单体酚含量模型有对马瑟兰酒样进行地理位置区分的潜力。两地区的总酸含量无显著差别。除总酸外,其他6种基础理化指标在两地区间均显示出了显著差异。根据基础指标可得宁夏地区样品之间差异较大。两地区间除莽草酸和乳酸含量无显著差异外,其余单体有机酸均具有统计学差异。琥珀酸是两地区含量差异最大的单体有机酸。两地区之间比较可得,河北地区马瑟兰酒样以较高的花青素3-O-葡萄糖苷(1.14 mg/L)为特点。宁夏地区二甲花翠素3-O葡萄糖苷则显著高于河北地区。通常认为干旱半干旱地区葡萄中酚类物质的积累会更加显著[38],但本研究结果显示位于西北干旱半干旱地区的宁夏地区马瑟兰干红葡萄酒总酚含量(2.0 g/L)显著低于河北地区(2.1 g/L)。因此,本研究的结果证实了酒样中的酚类物质含量尽管与果实酚类积累极为相关,但同时酒庄等其他非自然因素的影响也不可忽略[7]。总体而言,通过对来自河北和宁夏两地区的27款马瑟兰干红葡萄酒进行的理化分析,揭示了马瑟兰在不同产区间的不同质量表现特点。同时,结合OPLS-DA方法进行关联分析,按照地区成功进行马瑟兰酒样区分,表明了马瑟兰葡萄酒的地理溯源和区域特色化品质发展的可能性。鉴于马瑟兰在中国目前仍处于发展阶段,受限于采集马瑟兰酒样数目和检测条件的有限,对于酒样化学成分的规律发掘仍有待深入。本研究可为建立不同产区马瑟兰葡萄酒的地理溯源判别,促进马瑟兰葡萄酒在中国不同区域特色化品质发展提供数据支撑。
[1] ROBINSON J, HARDING J, VOUILLAMOZ J.Wine grapes:A complete guide to 1,368 vine varieties, including their origins and flavours[J].Journal of Wine Economics, 2013,8(1):106-109.
[2] RAHMAN M U, HANIF M, SHAH F, et al.Botrytis cinerea structural development and host responses in resistant and susceptible grapevine cultivars:A physiological and structural study[J].Fresenius Environmental Bulletin, 2019, 28(4A):3162-3171.
[3] LAN Y B, LIU M, ZHANG X K, et al.Regional variation of chemical characteristics in young Marselan (Vitis vinifera L.) red wines from five regions of China[J].Foods, 2022, 11(6):787.
[4] LYU J H, MA Y E, XU Y, et al.Characterization of the key aroma compounds in Marselan wine by gas chromatography-olfactometry, quantitative measurements, aroma recombination, and omission tests[J].Molecules, 2019, 24(16):2978.
[5] 王舒伟, 马雪蕾, 马银凤, 等.‘马瑟兰’葡萄在我国的栽培表现及研究进展[J].中外葡萄与葡萄酒, 2019(3):66-70.
WANG S W, MA X L, MA Y F, et al.Cultivation performance and research progress on ‘Marselan’ grapevine in China[J].Sino-Overseas Grapevine &Wine, 2019(3):66-70.
[6] DE BLIJ H J.Wine:A Geographic Appreciation[M].Totowa, NJ:Rowman &Allanheld, 1983.
[7] FISCHER U, ROTH D, CHRISTMANN M.The impact of geographic origin, vintage and wine estate on sensory properties of Vitis vinifera cv.Riesling wines[J].Food Quality and Preference, 1999, 10(4-5):281-288.
[8] LI R L, YANG S Y, LIN M Y, et al.The biogeography of fungal communities across different Chinese wine-producing regions associated with environmental factors and spontaneous fermentation performance[J].Frontiers in Microbiology, 2022, 12:636639.
[9] BELDA I, BELDA I, ZARRAONAINDIA I, et al.From vineyard soil to wine fermentation:Microbiome approximations to explain the “terroir” concept[J].Frontiers in Microbiology, 2017, 8:821.
[10] DULEY G, DUJOURDY L, KLEIN S, et al.Regionality in Australian Pinot noir wines:A study on the use of NMR and ICP-MS on commercial wines[J].Food Chemistry, 2021, 340:127906.
[11] MARCON  R, DELAMARE A P L, SCHWARZ L V, et al.Volatile and sensory composition of Brazilian Muscat sparkling wine and Asti[J].Journal of Food Processing and Preservation, 2021, 45(4):e15240.
R, DELAMARE A P L, SCHWARZ L V, et al.Volatile and sensory composition of Brazilian Muscat sparkling wine and Asti[J].Journal of Food Processing and Preservation, 2021, 45(4):e15240.
[12] PHAN Q, TOMASINO E.Untargeted lipidomic approach in studying pinot noir wine lipids and predicting wine origin[J].Food Chemistry, 2021, 355:129409.
[13] RANAWEERA R K R, GILMORE A M, CAPONE D L, et al.Authentication of the geographical origin of Australian Cabernet Sauvignon wines using spectrofluorometric and multi-element analyses with multivariate statistical modelling[J].Food Chemistry, 2021, 335:127592.
[14] HAN B, HAN X Y, DENG H A, et al.Profiling the occurrence of biogenic amines in wine from Chinese market and during fermentation using an improved chromatography method[J].Food Control, 2022, 136:108859.
[15] ZHANG X, WANG K Q, GU X F, et al.Flavor chemical profiles of Cabernet Sauvignon wines:Six vintages from 2013 to 2018 from the eastern foothills of the Ningxia Helan Mountains in China[J].Foods, 2021, 11(1):22.
[16] WANG L, LIU J M, WANG L G, et al.Tourism resource assessment and spatial analysis of wine tourism development:A case study of the eastern foothills of China’s Helan Mountains[J].Journal of Mountain Science, 2018, 15(3):645-656.
[17] 杨伟, 李东.宁夏贺兰山东麓葡萄酒产业发展存在的问题及对策[J].现代农业科技, 2022(5):219-222.
YANG W, LI D.Problems existing in development of wine industry at eastern foot of Helan Mountain in Ningxia and its countermeasures[J].Modern Agricultural Science and Technology, 2022(5):219-222.
[18] 易黎, 亓桂梅.秦皇岛产区:老产区的新角色[J].中外葡萄与葡萄酒, 2016(4):67-68.
YI L, QI G M.Qinhuangdao production area:The new role of the old production area[J].Sino-Overseas Grapevine &Wine, 2016(4):67-68.
[19] 高海燕, 廖小军, 王善广, 等.反相高效液相色谱法测定果汁中11种有机酸条件的优化[J].分析化学, 2004, 32(12):1645-1648.
GAO H Y, LIAO X J, WANG S G, et al.Simultaneous determination of eleven organic acids in fruit juice by reversed phase high performance liquid chromatography[J].Chinese Journal of Analytical Chemistry, 2004, 32(12):1645-1648.
[20] YANG P, YUAN C L, WANG H A, et al.Stability of anthocyanins and their degradation products from cabernet sauvignon red wine under gastrointestinal pH and temperature conditions[J].Molecules, 2018, 23(2):354.
[21] 葛谦, 曹彩霞, 吴燕, 等.贺兰山东麓产区不同单品种葡萄酒风味物质特征分析[J].食品与发酵工业, 2021, 47(17):256-264.
GE Q, CAO C X, WU Y, et al.Flavor characteristics of varieties wines from eastern foot of Helan Mountain[J].Food and Fermentation Industries, 2021, 47(17):256-264.
[22] MA T T, WANG J Q, WANG L K, et al.Ultrasound-combined sterilization technology:An effective sterilization technique ensuring the microbial safety of grape juice and significantly improving its quality[J].Foods, 2020, 9(10):1512.
[23] CHENG X H, MA T T, WANG P P, et al.Foliar nitrogen application from veraison to preharvest improved flavonoids, fatty acids and aliphatic volatiles composition in grapes and wines[J].Food Research International, 2020, 137:109566.
[24] VAN LEEUWEN C, SEGUIN G.The concept of terroir in viticulture[J].Journal of Wine Research, 2006, 17(1):1-10.
[25] MATO I, SU REZ-LUQUE S, HUIDOBRO J F.A review of the analytical methods to determine organic acids in grape juices and wines[J].Food Research International, 2005, 38(10):1175-1188.
REZ-LUQUE S, HUIDOBRO J F.A review of the analytical methods to determine organic acids in grape juices and wines[J].Food Research International, 2005, 38(10):1175-1188.
[26] GODDEN P, WILKES E, JOHNSON D.Trends in the composition of Australian wine 1984-2014[J].Australian Journal of Grape and Wine Research, 2015, 21:741-753.
[27] MARGALIT Y.Concepts in Wine Chemistry[M].Wine Appreciation Guild,2010.
[28] BELY M, RINALDI A, DUBOURDIEU D.Influence of assimilable nitrogen on volatile acidity production by Saccharomyces cerevisiae during high sugar fermentation[J].Journal of Bioscience and Bioengineering, 2003, 96(6):507-512.
[29] DEFILIPPI B G, MANR QUEZ D, LUENGWILAI K, et al.Chapter 1 aroma volatiles[M].Advances in Botanical Research.Amsterdam:Elsevier, 2009:1-37.
QUEZ D, LUENGWILAI K, et al.Chapter 1 aroma volatiles[M].Advances in Botanical Research.Amsterdam:Elsevier, 2009:1-37.
[30] 丁仁君, 夏延斌.葡萄酒中的有机酸及检测方法研究进展[J].食品与机械, 2014, 30(1):243-247.
DING R J, XIA Y B.Research progress on detection of organic acids in grape wines[J].Food &Machinery, 2014, 30(1):243-247.
[31] 刘晓燕, 张小月, 阿卜杜喀依尔·阿卜杜艾尼, 等.混菌发酵、酒泥陈酿结合β-葡聚糖酶对赤霞珠干红葡萄酒有机酸含量的影响[J].食品与发酵工业, 2022, 48(15):55-61.
LIU X Y, ZHANG X Y, ABUDUOAINI A.Effects of mixed fermentation, wine lees aging combined with β-glucanase on organic acid content of Cabernet Sauvignon dry red wine[J].Food and Fermentation Industries, 2022, 48(15):55-61.
[32] TANG K, LIU T, HAN Y, et al.The importance of monomeric anthocyanins in the definition of wine colour properties[J].South African Journal of Enology &Viticulture, 2017, 38(1):1-10.
[33] HE F, LIANG N N, MU L, et al.Anthocyanins and their variation in red wines I.monomeric anthocyanins and their color expression[J].Molecules, 2012, 17(2):1571-1601.
[34] WATRELOT A A, WATERHOUSE A L.Oak barrel tannin and toasting temperature:Effects on red wine anthocyanin chemistry[J].LWT, 2018, 98:444-450.
[35] ALCALDE-EON C, ESCRIBANO-BAIL N M T, GARC
N M T, GARC A-ESTÉVEZ I.Role of oak ellagitannins in the synthesis of vitisin A and in the degradation of malvidin 3-O-glucoside:An approach in wine-like model systems[J].Journal of Agricultural and Food Chemistry, 2022, 70(41):13049-13061.
A-ESTÉVEZ I.Role of oak ellagitannins in the synthesis of vitisin A and in the degradation of malvidin 3-O-glucoside:An approach in wine-like model systems[J].Journal of Agricultural and Food Chemistry, 2022, 70(41):13049-13061.
[36] R O SEGADE S, ROLLE L, GERBI V, et al.Phenolic ripeness assessment of grape skin by texture analysis[J].Journal of Food Composition and Analysis, 2008, 21(8):644-649.
O SEGADE S, ROLLE L, GERBI V, et al.Phenolic ripeness assessment of grape skin by texture analysis[J].Journal of Food Composition and Analysis, 2008, 21(8):644-649.
[37] ROLLE L, TORCHIO F, ZEPPA G, et al.Relationship between skin break force and anthocyanin extractability at different ripening stages[J].American Journal of Enology and Viticulture, 2009, 60(1):93-97.
[38] GUTIÉRREZ-ESCOBAR R, ALIA O-GONZ
O-GONZ LEZ M J, CANTOS-VILLAR E.Wine polyphenol content and its influence on wine quality and properties:A review[J].Molecules, 2021, 26(3):718.
LEZ M J, CANTOS-VILLAR E.Wine polyphenol content and its influence on wine quality and properties:A review[J].Molecules, 2021, 26(3):718.