冬瓜[Benincasa hispida (Thb.) Cogn.]是葫芦科草本植物,我国南北地区均有种植,且种植面积大,产量高,是仅次于黄瓜的第二大瓜类蔬菜[1]。冬瓜富含营养成分,含有多种功能活性成分,低钠高钾,且具有较高的药用价值,能清热利水、减肥降脂、防治心脑血管疾病等,有一定的保健或治疗效果[2-3]。冬瓜药食价值高,但其物质基础研究较少,功效成分未有明确的解释。因此,冬瓜的化学成分分析对其药食价值说明和精深加工指导具有重要的科学意义。张晓蕾等[4]利用GC-MS对冬瓜皮和果肉测定邻苯二甲酸二(2-乙基己基)酯[bis(2-ethylhexyl) phthalate,DEHP]发现,DEHP含量果皮显著高于果肉;盛留洋等[5]对生腌冬瓜和熟腌冬瓜的研究发现,两者的挥发性物质有显著性差异;李杨等[6]在冬瓜皮不同干燥工艺研究中发现,烘箱60 ℃、烘箱105 ℃、常温30 ℃和微波干燥中,活性成分保留效果最好的干燥工艺为烘箱60 ℃干燥。冬瓜贮运性好,有较长的货架期,具有良好的加工性能,是现代农产品加工的良好原料和调节市场供需关系的的重要蔬菜[7]。冬瓜传统的加工产品以馅料、蜜饯以及果脯为主,此外,常见的还有冬瓜酱、冬瓜果冻、冬瓜保健饮料等[8],往往只利用冬瓜果肉,产生8%的冬瓜皮和4%的冬瓜瓤被作为废弃物直接丢弃[9-10]。
冬瓜瓤作为一种副产物,潜在的经济价值高,现有的研究中,冬瓜瓤可以加工成饮料及其发酵酒[11],除此,并没有更多的研究或产品开拓冬瓜瓤市场。目前,冬瓜瓤的化学成分分析鲜有报道,制约着冬瓜瓤精深加工利用,对提高冬瓜的经济附加值有一定的局限。因此,本研究首次运用广泛靶向代谢组学技术对冬瓜瓤代谢物进行分离鉴定,分析其化学成分,为冬瓜副产物精深加工及品质调控提供参考依据,对于延长冬瓜产业链,促进冬瓜产业高质量发展具有重要意义。
1 材料与方法
1.1 材料与试剂
黑皮冬瓜,广东省农业科学院蔬菜研究所。
甲醇、乙腈(色谱纯),Merck &Co.Inc.;二甲基亚砜(dimethyl sulfoxide, DMSO,色谱纯),BioBioPha/Sigma-Aldrich;三吡啶三吖嗪(tripyridine triazine,TPTZ)、DPPH(98%)、Trolox(分析标准品),上海源叶生物科技有限公司;乙酸钠等试剂均为国产分析纯。
1.2 仪器与设备
101-3ABS鼓风干燥箱,上海科恒实业发展有限公司;Scientz-100F冷冻干燥机,宁波新芝生物科技股份有限公司;MM 400研磨仪,德国Retsch公司;Nexera X2超高效液相色谱(ultra performance liquid chromatography, UPLC),日本SHIMADZU公司;4500 QTRAP串联质谱(tandem mass spectrometry, MS/MS),德国Applied Biosystems公司。
1.3 试验方法
1.3.1 冬瓜不同部位的总黄酮、总酚及抗氧化测定
将冬瓜皮、肉、瓤和籽进行干燥、研磨,参考王立抗等[12]测定冬瓜瓤总黄酮、总酚,其中总黄酮结果以每克冬瓜皮、肉、瓤、籽中所含芦丁当量(rutinum equivalent,RE,mg RE/g)表示,总酚结果以每克冬瓜皮、肉、瓤、籽中所含没食子酸当量(gallic acid equivalent,GAE,mg GAE/g)表示;取冬瓜4个部位的总酚提取液测定其铁离子还原力、DPPH自由基清除力和ABTS阳离子自由基清除力,其中结果以每克冬瓜皮、肉、瓤、籽中所含Trolox当量(mg TE/g)表示。
铁离子还原力:FRAP-Trolox抗氧化活性测定,参考DINARDO等[13] 的方法,取1 mL样液加入3 mL FRAP工作液[0.3 mol/L乙酸钠水溶液∶10 mmol/L TPTZ盐酸(40 mmol/L)溶液∶20 mmol/L FeCl3水溶液=10∶1∶1, 体积比],室温避光反应10 min,593 nm测定吸光值,每个样品测定3次,以Trolox为对照品;
DPPH自由基清除力:DPPH-Trolox抗氧化活性测定参考SHARMA等[14] 的方法,取1 mL样液加入5 mL DPPH-乙醇溶液(130 μmol/L)室温避光反应30 min,517 nm测定吸光值,每个样品重复3次,Trolox为对照品。
ABTS阳离子自由基清除力:ABTS-Trolox抗氧化活性测定,参考MZID等[15] 的方法,配制7 mmol/L ABTS阳离子储备液,使用时无水乙醇稀释使其吸光值为0.70±0.02。0.5 mL样液,加入3 mL ABTS阳离子稀释液,室温避光反应30 min,734 nm测定吸光值,每个样品重复3次,Trolox为对照品。
1.3.2 冬瓜瓤UPLC-MS/MS样品制备
参考CHEN等[16] 的方法,将冬瓜瓤进行真空冷冻干燥,研磨至粉末状。准确称取0.100 0 g粉末,1.2 mL提取液(70%甲醇)溶解,涡旋6次(间隔30 min/次,每次涡旋30 s),得到的样液放置于4 ℃过液,离心10 min(12 000 r/min),将上清液过微孔滤膜(孔径0.22 μm),保存滤液于进样瓶用于UPLC-MS/MS分析。
1.3.3 UPLC-MS/MS采集分析
1.3.3.1 UPLC条件
色谱柱:Agilent SB-C18 1.8 μm,2.1 mm×100 mm;流动相程序:流速0.35 mL/min;柱温40 ℃;进样量4 μL。
UPLC流动相洗脱方法:A相为超纯水-0.1%(体积分数,下同)的甲酸,B相乙腈-0.1%的甲酸,0~9 min,95%~5% A、5%~95% B,9~10 min,5% A、95% B,10~11 min,5%~95% A、95%~5% B,11~25 min,95% A、5% B。
1.3.3.2 MS/MS条件
由三重四极杆线性离子阱质谱仪(Q TRAP),AB4500 Q TRAP UPLC/MS/MS系统(配备了ESI Turbo离子喷雾接口),由Analyst 1.6.3软件(AB Sciex)控制运行正负2种离子模式。ESI源操作参数参考ZHOU等[17] 的方法,离子源气体Ⅰ,气体Ⅱ和帘气分别设置为50、60、25.0 psi,参数设置为高。
1.4 数据统计与分析
采用Excel、Origin 2018对1.3.1节数据进行统计分析及作图,运用SPSS对结果进行显著性差异分析。基于武汉迈维生物公司自建数据库与代谢物信息公共数据库,根据二级谱信息和三重四极杆质谱的多反应检测模式(multiple reaction monitoring, MRM)进行代谢物定性定量。利用软件Analyst 1.6.3处理质谱数据,利用Origin 2018等软件进行作图分析。
2 结果与分析
2.1 冬瓜各部位总黄酮、总酚及抗氧化活性分析
黄酮、多酚类化合物在植物的抗氧化活性中起重要作用[18]。由图1可知,冬瓜中不同部位黄酮含量存在显著性差异,其中冬瓜肉总黄酮含量最高,为2.45 mg RT/g,瓤中次之,为1.90 mg RT/g,冬瓜籽含量最低。冬瓜各部位总多酚含量介于0.31~2.36 mg GAE/g,4个部位的总多酚含量存在显著性差异,冬瓜瓤含量最高,为2.36 mg GAE/g,冬瓜肉次之,为1.73 mg GAE/g,冬瓜籽含量最低。
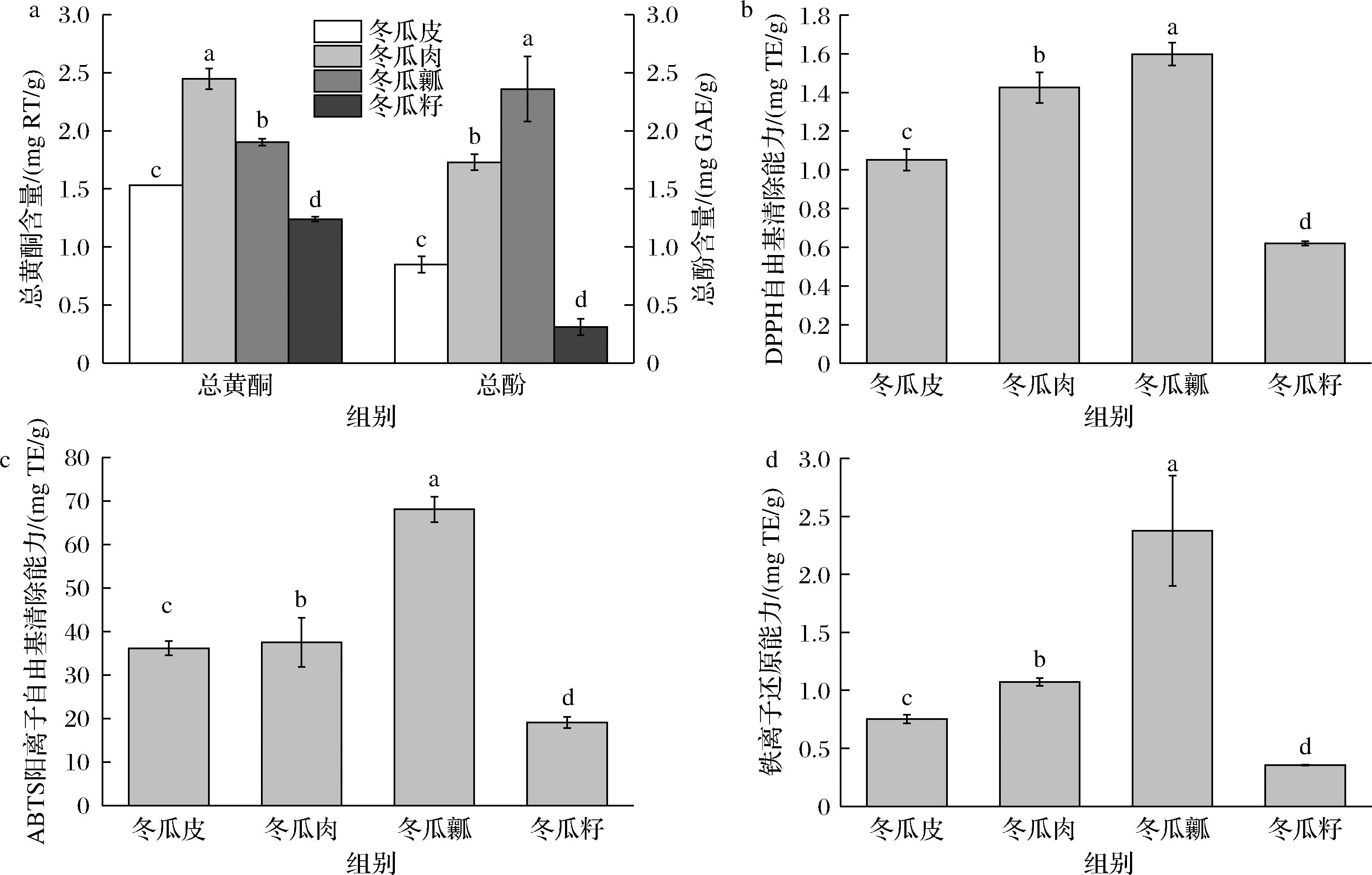
a-冬瓜各部位总黄酮和总酚;b-DPPH自由基清除能力;c-ABTS阳离子自由基清除能力;d-铁离子还原力
图1 总黄酮、总酚及抗氧化活性
Fig.1 Total flavonoids, total phenols, and antioxidant activity
注:图中不同字母表示该指标存在显著性差异。
基于冬瓜各部位多酚提取物,测定其还原力、DPPH自由基清除力、ABTS阳离子自由基清除力,结果表明,不同部位提取物均有不同程度的还原力和自由基清除力,其中冬瓜瓤部位的还原力(2.38 mg TE/g)、DPPH自由基清除能力(1.60 mg TE/g)和ABTS阳离子自由基清除能力(68.11 mg TE/g)均是最强,冬瓜肉次之,冬瓜籽最弱。因此,相较于冬瓜皮、肉和籽,冬瓜瓤的抗氧化能力最强。因此,本研究选取冬瓜瓤为研究对象,基于UHPLC-QqQ-MS分析其化学成分。
2.2 广泛靶向代谢组样本质控及统计分析
通过对质控(quality control,QC)样本质谱检测分析的MRM代谢物检测多峰图(多物质提取的离子流谱图)进行重叠展示分析,可以看到重复样本不同物质的离子峰值重叠性比较好(图2-a),质控样本的总离子流图如图2-b所示,QC样品总离子流图的基线稳定,其重复性好,峰分离度高。说明实验过程具有稳定性,检测结果可靠。
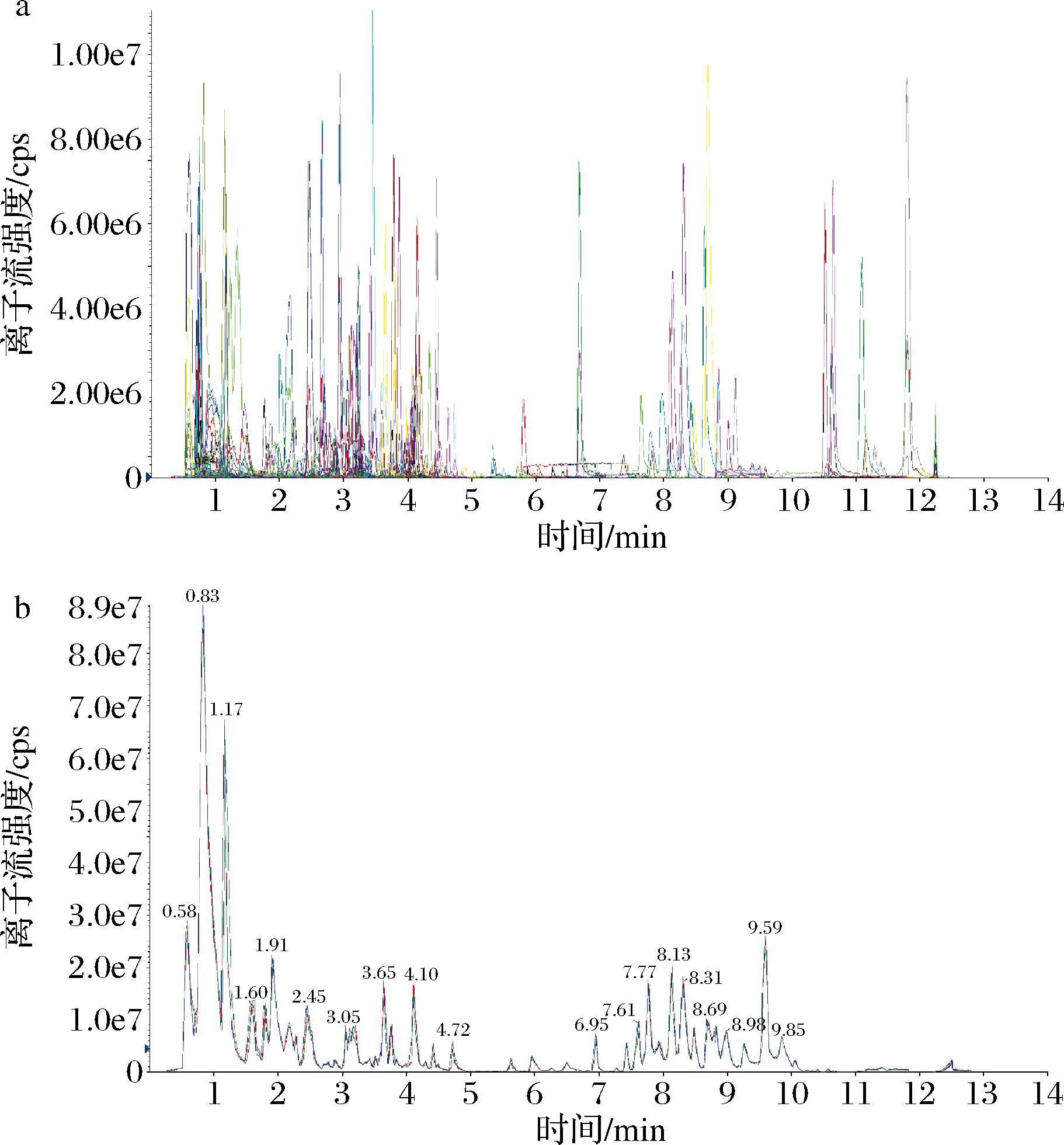
a-MRM代谢物检测多峰图;b-QC样本总离子流图
图2 MRM代谢物检测多峰图和QC样本总离子流图
Fig.2 MRM detection of multimodal maps and Total ion current chromatograms of quality control samples
2.3 冬瓜瓤代谢物组成分析
2.3.1 代谢物分类
通过冬瓜瓤代谢组学数据,共鉴定出825种代谢物,图3根据代谢物的结构对冬瓜瓤的代谢物进行一级分类,分为11类。其中初生代谢物451个(59.01%),包括氨基酸及其衍生物(114个,21.41%)、脂质(123个,13.28%)、有机酸(74个,10.82%)、糖及醇类(58个,6.68%)、核苷酸及其衍生物(62个,5.62%)、维生素(20个,1.22%);次生代谢物374个(40.99%),包括酚酸类(161个,21.10%)、生物碱(57个,7.84%)、黄酮(92个,7.36%)、木脂素和香豆素(51个,3.63%)、萜类(13个,1.06%)。

a-初生代谢物;b-次生代谢物
图3 冬瓜瓤代谢物组成丰度图
Fig.3 Diagram of composition abundance of metabolites in wax gourd pith
2.3.2 初生代谢物分析
为了研究冬瓜瓤中的重要化合物及主要特性,表1筛选冬瓜瓤中相对含量≥0.5%的初生代谢物,共计27种,是总代谢物的35.88%,包括氨基酸及其衍生物(8种,15.86%)、脂质(8种,8.28%)、有机酸(5种,6.19%)、核苷酸及其衍生物(4种,3.72%)、糖及醇类(2种,1.84%)。
表1 冬瓜瓤主要的初生代谢物
Table 1 Main primary metabolites in wax gourd pith
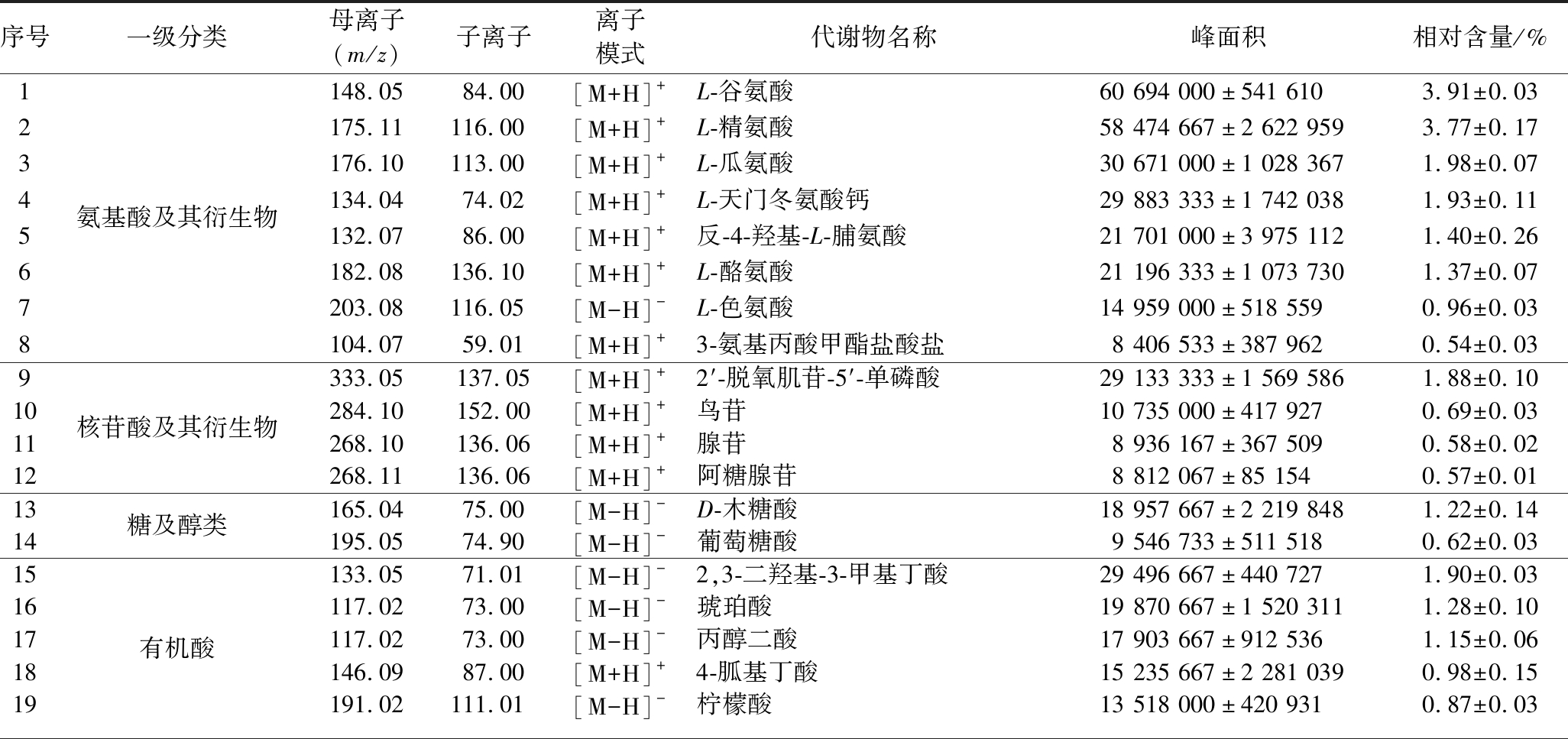
序号一级分类母离子(m/z)子离子离子模式代谢物名称峰面积相对含量/%12345678氨基酸及其衍生物148.0584.00[M+H]+L-谷氨酸60 694 000±541 6103.91±0.03175.11116.00[M+H]+L-精氨酸58 474 667±2 622 9593.77±0.17176.10113.00[M+H]+L-瓜氨酸30 671 000±1 028 3671.98±0.07134.0474.02[M+H]+L-天门冬氨酸钙29 883 333±1 742 0381.93±0.11132.0786.00[M+H]+反-4-羟基-L-脯氨酸21 701 000±3 975 1121.40±0.26182.08136.10[M+H]+L-酪氨酸21 196 333±1 073 7301.37±0.07203.08116.05[M-H]-L-色氨酸14 959 000±518 5590.96±0.03104.0759.01[M+H]+3-氨基丙酸甲酯盐酸盐8 406 533±387 9620.54±0.039101112核苷酸及其衍生物333.05137.05[M+H]+2′-脱氧肌苷-5′-单磷酸29 133 333±1 569 5861.88±0.10284.10152.00[M+H]+鸟苷10 735 000±417 9270.69±0.03268.10136.06[M+H]+腺苷8 936 167±367 5090.58±0.02268.11136.06[M+H]+阿糖腺苷8 812 067±85 1540.57±0.011314糖及醇类165.0475.00[M-H]-D-木糖酸18 957 667±2 219 8481.22±0.14195.0574.90[M-H]-葡萄糖酸9 546 733±511 5180.62±0.031516171819有机酸133.0571.01[M-H]-2,3-二羟基-3-甲基丁酸29 496 667±440 7271.90±0.03117.0273.00[M-H]-琥珀酸19 870 667±1 520 3111.28±0.10117.0273.00[M-H]-丙醇二酸17 903 667±912 5361.15±0.06146.0987.00[M+H]+4-胍基丁酸15 235 667±2 281 0390.98±0.15191.02111.01[M-H]-柠檬酸13 518 000±420 9310.87±0.03
续表1

序号一级分类母离子(m/z)子离子离子模式代谢物名称峰面积相对含量/%2021222324252627脂质279.23279.23[M-H]-亚油酸30 518 667±3 944 1991.97±0.25239.00223.00[M-H]-棕榈醛19 060 667±1 737 8731.23±0.11227.20227.20[M-H]-肉豆蔻酸18 700 667±1 251 3131.21±0.08281.25281.25[M-H]-岩芹酸14 411 333±2 530 1750.93±0.16281.25281.25[M-H]-11-十八碳烯酸14 286 000±2 684 0010.92±0.17522.36184.07[M+H]+溶血磷脂酰胆碱18∶110 792 333±467 0460.70±0.03522.36184.07[M+H]+溶血磷脂酰胆碱18∶1(2n异构)10 691 333±306 7530.69±0.02279.20149.40[M+H]+十八碳-9E,13E,15Z-三烯酸9 863 267±1 536 1940.64±0.10
2.3.2.1 氨基酸及其衍生物
氨基酸是蛋白质的基本组成单位,冬瓜瓤氨基酸及其衍生物种类及含量丰富,共检测出114种氨基酸及其衍生物,由表1可知,相对含量≥0.5%的氨基酸及其衍生物有L-谷氨酸、L-精氨酸、L-瓜氨酸、L-天门冬氨酸钙、反-4-羟基-L-脯氨酸、L-酪氨酸、L-色氨酸、3-氨基丙酸甲酯盐酸盐。其中L-色氨酸(0.96%)是8种必需氨基酸之一,其在癞皮病、精神分裂症、抑郁症、高血压及疼痛等方面有良好的疗效[19-20];L-谷氨酸(3.91%)是最主要呈鲜味氨基酸之一,还包括天冬氨酸、丙氨酸、甘氨酸、苯丙氨酸和酪氨酸及其钠盐,此外,含量较多的L-精氨酸、组氨酸也有重要的生理作用和营养功能[21]。
2.3.2.2 核苷酸及其衍生物
核苷酸是组成DNA和RNA的基本单位,是生物体内重要的低分子化合物,核苷酸参与多种调节和代谢,通过参与细胞代谢和更新,改善细胞活力,提高机体自身功能和自我调节能力,也可改善食物的感官特征[22]。本研究从冬瓜瓤中检测到62种核苷酸及其衍生物,由表1可知,其相对含量≥0.5%的核苷酸及其衍生物有2′-脱氧肌苷-5′-单磷酸、鸟苷、腺苷、阿糖腺苷。
2.3.2.3 糖及醇类
糖是生物体所需要的必须营养物质,参与生物体的合成与代谢,冬瓜瓤中共鉴定出58种糖及醇类,包括24种糖、14种醇、15种糖酸以及5种糖醇衍生物。冬瓜瓤中相对含量≥0.5%的糖及醇类代谢物有D-木糖酸、葡萄糖酸,此外,还积累了果糖、葡萄糖、甘露糖、半乳糖。
2.3.2.4 有机酸
有机酸和糖的比例影响着果实的风味品质,冬瓜瓤中有机酸的种类和含量丰富,共检测出74种有机酸,其中相对含量≥0.5%的有机酸有2,3-二羟基-3-甲基丁酸、琥珀酸、丙醇二酸、4-胍基丁酸、柠檬酸(表1)。其中琥珀酸(1.28%),可赋予食物鲜味;丙醇二酸(1.15%)是具有较强功能活性的有机酸,丙醇二酸能有效抑制糖类转化为脂肪,减少脂肪堆积,在减肥方面有较好的效果[23],此外,还能防治高血压和动脉粥样硬化,是衡量原料及其加工品保健功能的重要指标之一[24]。
2.3.2.5 脂质
脂质广泛存在生物体中,是生物体所需的重要营养素之一,也是细胞重要的组成成分。冬瓜瓤中共鉴定出123种脂类物质,主要为溶血磷脂(53种,30.69%)和脂肪酸(60种,68.42%),还包括甘油酯(8种,0.77%)、鞘脂(2种,0.11%);相对含量≥0.5%的脂类物质有亚油酸、棕榈醛、肉豆蔻酸、岩芹酸、11-十八碳烯酸、溶血磷脂酰胆碱 18∶1、溶血磷脂酰胆碱 18∶1(2n异构)、十八碳-9E,13E,15Z-三烯酸(表1)。冬瓜瓤中含量最高亚油酸(1.97%),是功能性多不饱和脂肪酸,是人体的必需脂肪酸,适量的亚油酸,能降低胆固醇[25]。另外含量较高的肉豆蔻酸(1.21%)可减少皮肤炎症和伤害感受,还具有抗氧化和抗糖尿病作用,可应用于食品调味剂[26]。
2.3.3 次生代谢物分析
表2筛选冬瓜瓤中相对含量≥0.5%的次生代谢物,共22种,占总代谢物的28.26%,包括酚酸类(9种,15.66%)、黄酮(4种,5.95%)、生物碱(6种,5.67%)、木质素和香豆素(2种,1.70%)、萜类(1种,0.65%)。
表2 冬瓜瓤主要的次生代谢物
Table 2 Main secondary metabolites in wax gourd pith

序号一级分类母离子(m/z)子离子离子模式代谢物名称峰面积相对含量/%1234黄酮299.10223.10[M-H]-4′-羟基-5,7-二甲氧基黄酮37 373 000±4 724 1052.40±0.30521.09329.20[M-H]-苜蓿素-7-O-葡萄糖二酸苷32 193 333±2 853 3352.07±0.18403.14373.10[M+H]+川陈皮素14 013 000±821 9390.90±0.05373.13343.09[M+H]+桔皮素8 864 333±559 6690.57±0.045678910生物碱162.1185.03[M+H]+左旋肉碱34 374 667±4 225 8372.21±0.27104.1060.10[M+H]+胆碱15 547 667±394 4011.00±0.031 387.0594.07[M+H]+葫芦巴碱11 245 333±270 1430.73±0.02142.10124.09[M+H]+组氨醇9 288 933±1 407 5610.60±0.09240.1385.03[M+H]+乙酰左旋肉碱盐酸盐9 034 600±1 381 3390.58±0.08304.15185.09[M+H]+烟胺8 558 800±501 4950.55±0.05111213141516酚酸类329.12167.00[M-H]-3,4,5-三甲氧基苯基-1-O-葡萄糖苷48 020 333±1 527 0023.10±0.10521.20131.05[M+H]+脱氢二松柏醇-4-O-葡萄糖苷38 877 000±2 605 4992.51±0.19521.20131.05[M+H]+脱氢二松柏醇-γ′-O-葡萄糖苷37 555 667±3 563 8162.42±0.23279.1149.02[M+H]+邻苯二甲酸二丁酯32 480 667±4 431 3252.09±0.29279.16149.02[M+H]+邻苯二甲酸二异丁酯31 614 333±2 890 3362.04±0.19315.077153.02[M-H]-原儿茶酸-4-O-葡萄糖苷23 361 667±1 418 5541.51±0.09
续表2

序号一级分类母离子(m/z)子离子离子模式代谢物名称峰面积相对含量/%171819151.04136.00[M-H]-香草醛11 843 000±622 9660.76±0.04315.07153.00[M-H]-1-O-龙胆酰-D-葡萄糖10 299 667±277 4930.66±0.02401.14269.10[M-H]-苄基-(2″-O-木糖基)葡萄糖苷8 984 633±206 5430.58±0.012021木脂素和香豆素519.19357.14[M-H]-松脂醇-4-O-葡萄糖苷16 761 667±960 8981.08±0.06681.24519.19[M-H]-松脂醇-4,4′-O-二-O-葡萄糖苷9 683 000±859 2310.62±0.0622萜类331.14151.11[M+H]+巴斯苷10 030 933±1 116 9260.65±0.08
2.3.3.1 黄酮
冬瓜瓤中的黄酮种类和含量非常丰富,共检测出92种黄酮类代谢物,主要是黄酮、二氢黄酮、黄酮醇,还包括查尔酮、二氢黄酮醇、花青素、黄酮碳糖苷、异黄酮共10个亚类,具有显著的抗氧化、抗炎症、提高免疫力、降低心血管疾病风险的生物学活性[27]。相对含量≥0.5%的黄酮类代谢物有苜蓿素-7-O-葡萄糖二酸苷(2.07%)、4′-羟基-5,7-二甲氧基黄酮(2.41%)、川陈皮素(0.90%)、桔皮素(0.57%),4′-羟基-5,7-二甲氧基黄酮、川陈皮素、桔皮素是多甲氧基黄酮化合物,现有研究中,它们具有体内体外化学预防作用,包括抗癌、抗炎、抗动脉粥样硬化和神经保护,通过调节信号级联、基因转录以及蛋白质功能和酶活性来调节细胞生理功能[28]。
2.3.3.2 生物碱
生物碱是一类含氮的有机化合物,具有显著的生物活性,冬瓜瓤共检测出57种生物碱代谢物,分属于吡啶类(5种)、吡咯类(3种)、酚胺类(14种)、生物碱类(26种)、吲哚类(9种)。相对含量≥0.5%的生物碱有左旋肉碱(2.21%)、胆碱(1.00%)、葫芦巴碱(0.73%)、组氨醇(0.60%)、乙酰左旋肉碱盐酸盐(0.58%)和烟胺(0.55%),其中含量最多的是左旋肉碱,是广泛存在于生物体内的活性物质,是通过刺激脂肪分解和β氧化来调节脂质代谢,并伴有相应的基因表达变化和抑制脂肪原基因表达,具有抗肥胖作用[29];含量较多的胆碱是构成生物膜的重要组成成分,是人类必须的营养素,可以促进脑发育和提高记忆力、促进脂肪代谢和体内转甲基代谢,还可以降低血清胆固醇,预防心血管疾病[30-31];此外,葫芦巴碱(0.73%)能促进人体新陈代谢,具有降血糖[32]、降血脂[33]和抗肿瘤的活性作用[34]。
2.3.3.3 酚酸类
酚酸是广泛分布在植物中的一类生物活性物质,赋予植物颜色、风味等,具有抗炎、抗血栓、抗糖尿病等药理特性[35]。冬瓜瓤酚酸的种类和含量丰富,共鉴定出161中酚酸类代谢物,相对含量≥0.5%的酚酸类代谢物有3,4,5-三甲氧基苯基-1-O-葡萄糖苷、脱氢二松柏醇-γ′-O-葡萄糖苷、邻苯二甲酸二丁酯、邻苯二甲酸二异丁酯、原儿茶酸-4-O-葡萄糖苷、香草醛、1-O-龙胆酰-D-葡萄糖、苄基-(2″-O-木糖基)葡萄糖苷,其中含有0.76%的香草醛,是一种重要的调味化合物,具有香荚兰豆香气及浓郁的奶香,起增香和定香作用,广泛应用在食品和饮料的添加剂以及各种药物配方的掩蔽剂等[36]。
2.3.3.4 木脂素和香豆素
木脂素和香豆素广泛分布在植物和人类食物来源中,有多种药理特性,如抗炎、抗菌、抗病毒、抗氧化和抗肝脏损伤等[37-38]。冬瓜瓤中共检测出51种木脂素和香豆素代谢物,其中木脂素27种,香豆素24种。相对含量≥0.5%的木脂素代谢物有松脂醇-4-O-葡萄糖苷、松脂醇-4,4′-O-二-O-葡萄糖苷。东莨菪内酯是冬瓜瓤中相对含量较高的代谢物,占冬瓜瓤代谢物的0.22%,是一种具有多种药理作用的活性物质,如抗肿瘤、降血压和降血糖等[39]。
3 结论
比较冬瓜皮、肉、瓤和籽4个部位,冬瓜瓤总黄酮含量仅次于冬瓜肉,且总酚含量最高;此外冬瓜瓤总酚提取液的铁离子还原力(2.38 mg TE/g)、DPPH自由基清除力(1.60 mg TE/g)和ABTS阳离子自由基清除力(68.11 mg TE/g)均是最强,因此冬瓜瓤的抗氧化能力最强。本研究首次采用广泛靶向代谢组学方法,分离鉴定冬瓜瓤的代谢物,检测出825种代谢物,其中,初生代谢物451种(59.01%),次生代谢物374种(40.99%)。氨基酸、核苷酸、脂质、有机酸,糖及醇类代谢物为冬瓜瓤主要的初生代谢物,黄酮、酚酸类、生物碱类代谢物为冬瓜瓤中主要的次生代谢物。
本研究通过分析冬瓜瓤各类代谢物数量和丰度,揭示冬瓜瓤中代谢物对冬瓜副产物营养和活性的贡献。本研究结果为冬瓜瓤副产物精深加工和利用提供了理论依据。
[1] XIE D S, XU Y C, WANG J P, et al.The wax gourd genomes offer insights into the genetic diversity and ancestral cucurbit karyotype[J].Nature Communications, 2019, 10:5158.
[2] ZAINI N A M, ANWAR F, HAMID A A, et al.Kundur[Benincasa hispida (Thunb.) Cogn.]:A potential source for valuable nutrients and functional foods[J].Food Research International, 2011, 44(7):2368-2376.
[3] MA L L, LIU Z G, CHENG Z K, et al.Identification and application of BhAPRR2 controlling peel colour in wax gourd (Benincasa hispida)[J].Frontiers in Plant Science, 2021, 12:716772.
[4] 张晓蕾, 沈国明, 杜琪珍.DEHP在冬瓜果皮和果肉的累积差异及与果皮蜡质组成的关系[J].北方园艺, 2011(16):37-40.
ZHANG X L, SHEN G M, DU Q Z.The differences of DEHP accumulation in wax gourd peel and pulp and relationship with waxy composition in peel[J].Northern Horticulture, 2011(16):37-40.
[5] 盛留洋, 翁佩芳, 吴祖芳, 等.生腌熟腌冬瓜挥发性风味成分及指纹图谱分析[J].中国野生植物资源, 2018, 37(6):19-27.
SHENG L Y, WENG P F, WU Z F, et al.Analysis of volatile components and fingerprint of raw and cooked pickled wax gourd[J].Chinese Wild Plant Resources, 2018, 37(6):19-27.
[6] 李杨, 刘明杰, 肖洪, 等.不同干燥工艺对冬瓜皮中生物活性成分含量的影响[J].中国调味品, 2018, 43(4):53-58.
LI Y, LIU M J, XIAO H, et al.Effects of different drying techniques on the bioactive components content in waxgourd peel[J].China Condiment, 2018, 43(4):53-58.
[7] 童军茂, 周红, 杨艳彬, 等.冬瓜复合汁加工技术的研究[J].食品与发酵工业, 2001, 27(12):77-79.
TONG J M, ZHOU H, YANG Y B, et al.Study on processing technology of wax gourd compound juice[J].Food and Fermentation Industries, 2001, 27(12):77-79.
[8] 陈占伟, 高映菊, 陈广泉, 等.冬瓜酸乳饮料生产工艺优化研究[J].甘肃农业科技, 2022, 53(3):64-70.
CHEN Z W, GAO Y J, CHEN G Q, et al.Study on the optimization of production technology of wax melon sour milk beverage[J].Gansu Agricultural Science and Technology, 2022, 53(3):64-70.
[9] 陈月华, 李嘉, 符锋, 等.不同干燥方法对冬瓜皮活性成分的影响[J].食品与发酵工业, 2017, 43(2):129-133.
CHEN Y H, LI J, FU F, et al.Effects of different drying methods on the content of active components of wax gourd peel[J].Food and Fermentation Industries, 2017, 43(2):129-133.
[10] 刘宗林, 王熊, 郭宏.冬瓜浓缩液-冬瓜综合利用之一[J].食品科学, 2000, 21(12):51-53.
LIU Z L, WANG X, GUO H.Study on the comprehensive use of the concentrated juice of benincare hispida[J].Food Science, 2000, 21(12):51-53.
[11] 武杰, 张引成, 项海波, 等.冬瓜瓤汁保健饮料配方优化研究[J].农产品加工, 2012(7):74-76.
WU J, ZHANG Y C, XIANG H B, et al.Study on formula optimization of health beverage of wax gourd pith juice[J].Farm Products Processing, 2012(7):74-76.
[12] 王立抗, 陈鸿庚, 黄智霖, 等.牛大力不同部位总黄酮、多酚含量及其抗氧化活性研究[J].中华中医药学刊, 2022, 40(3):139-142.
WANG L K, CHEN H G, HUANG Z L, et al.Antioxidant activities and contents of total flavonoids and polyphenols from different parts of Niudali (Millettia speciose Champ)[J].Chinese Archives of Traditional Chinese Medicine, 2022, 40(3):139-142.
[13] DINARDO A, SUBRAMANIAN J, SINGH A.Investigation of antioxidant content and capacity in yellow European plums[J].International Journal of Fruit Science, 2018, 18(1):99-116.
[14] SHARMA O P, BHAT T K.DPPH antioxidant assay revisited[J].Food Chemistry, 2009, 113(4):1202-1205.
[15] MZID M, BEN KHEDIR S, BEN SALEM M, et al.Antioxidant and antimicrobial activities of ethanol and aqueous extracts from Urtica urens[J].Pharmaceutical Biology, 2017, 55(1):775-781.
[16] CHEN W, GONG L, GUO Z L, et al.A novel integrated method for large-scale detection, identification, and quantification of widely targeted metabolites:Application in the study of rice metabolomics[J].Molecular Plant, 2013, 6(6):1769-1780.
[17] ZHOU Y Q, SHAO L Y, ZHU J L, et al.Comparative analysis of tuberous root metabolites between cultivated and wild varieties of Rehmannia glutinosa by widely targeted metabolomics[J].Scientific Reports, 2021, 11:11460.
[18] PALIKHOVA T A.Effects of monodiets with different tryptophan contents on shell color, behavior, and neuron activity in the common snail[J].Neuroscience and Behavioral Physiology, 2021, 51(5):616-619.
[19] RAVIPATI A S, ZHANG L, KOYYALAMUDI S R, et al.Antioxidant and anti-inflammatory activities of selected Chinese medicinal plants and their relation with antioxidant content[J].BMC Complementary and Alternative Medicine, 2012, 12:173.
[20] COMAI S, BERTAZZO A, BRUGHERA M, et al.Tryptophan in health and disease[J].Advances in Clinical Chemistry, 2020, 95:165-218.
[21] YU Z L, JIANG H R, GUO R C, et al.Taste, umami-enhance effect and amino acid sequence of peptides separated from silkworm pupa hydrolysate[J].Food Research International, 2018, 108:144-150.
[22] 董长勇, 于伟厚, 苟亚夫, 等.核苷酸类食品添加剂的生产与应用研究进展[J].食品与发酵工业, 2022, 48(22):345-352.
DONG C Y, YU W H, GOU Y F, et al.Research progress on the production and application of nucleotide-based food additives[J].Food and Fermentation Industries, 2022, 48(22):345-352.
[23] 由玉卿, 秦智伟, 周秀艳, 等.黄瓜果实中丙醇二酸含量的配合力分析[J].北方园艺, 2014(10):19-21.
YOU Y Q, QIN Z W, ZHOU X Y, et al.Analysis on combining ability of tartronic acid content in cucumber[J].Northern Horticulture, 2014(10):19-21.
[24] 郑亚琴. 仙人掌黄瓜复合饮料的研制[J].食品科学, 2010, 31(22):525-528.
ZHENG Y Q.Development of compound beverage from cactus and cucumber[J].Food Science, 2010, 31(22):525-528.
[25] JANDACEK R J.Linoleic acid:A nutritional quandary[J].Healthcare, 2017, 5(2):25.
[26] ALONSO-CASTRO A J, SERRANO-VEGA R, PÉREZ GUTIÉRREZ S, et al.Myristic acid reduces skin inflammation and nociception[J].Journal of Food Biochemistry, 2022, 46(1):e14013.
[27] 张梦玲, 李绮丽, 李高阳, 等.柑橘多甲氧基黄酮的来源及生物学作用[J].食品与机械, 2019, 35(1):213-220;236.
ZHANG M L, LI Q L, LI G Y, et al.Sources and biological functions of citrus polymethoxy flavones[J].Food &Machinery, 2019, 35(1):213-220;236.
[28] LAI C S, WU J C, HO C T, et al.Disease chemopreventive effects and molecular mechanisms of hydroxylated polymethoxyflavones[J].BioFactors, 2015, 41(5):301-313.
[29] LEE M S, LEE H J, LEE H S, et al.L-carnitine stimulates lipolysis via induction of the lipolytic gene expression and suppression of the adipogenic gene expression in 3T3-L1 adipocytes[J].Journal of Medicinal Food, 2006, 9(4):468-473.
[30] ZEISEL S H, KLATT K C, CAUDILL M A.Choline[J].Advances in Nutrition, 2018, 9(1):58-60.
[31] BLUSZTAJN J K, SLACK B E, MELLOTT T J.Neuroprotective actions of dietary choline[J].Nutrients, 2017, 9(8):815.
[32] CASTA EDA R, RODRIGUEZ I, NAM Y H, et al.Trigonelline promotes auditory function through nerve growth factor signaling on diabetic animal models[J].Phytomedicine, 2017, 36:128-136.
EDA R, RODRIGUEZ I, NAM Y H, et al.Trigonelline promotes auditory function through nerve growth factor signaling on diabetic animal models[J].Phytomedicine, 2017, 36:128-136.
[33] BAKURADZE T, LANG R, HOFMANN T, et al.Antioxidant effectiveness of coffee extracts and selected constituents in cell-free systems and human colon cell lines[J].Molecular Nutrition &Food Research, 2010, 54(12):1734-1743.
[34] HIRAKAWA N, OKAUCHI R, MIURA Y, et al.Anti-invasive activity of niacin and trigonelline against cancer cells[J].Bioscience, Biotechnology, and Biochemistry, 2005, 69(3):653-658.
[35] RASHMI H B, NEGI P S.Phenolic acids from vegetables:A review on processing stability and health benefits[J].Food Research International, 2020, 136:109298.
[36] BANERJEE G, CHATTOPADHYAY P.Vanillin biotechnology:The perspectives and future[J].Journal of the Science of Food and Agriculture, 2019, 99(2):499-506.
[37] FANG X H, HU X D.Advances in the synthesis of lignan natural products[J].Molecules, 2018, 23(12):3385.
[38] SRIKRISHNA D, GODUGU C, DUBEY P K.A review on pharmacological properties of coumarins[J].Mini Reviews in Medicinal Chemistry, 2018, 18(2):113-141.
[39] DEY P, SOSMITHA G, ELINA K, et al.An overview of the pharmacological activities of scopoletin against different chronic diseases[J].Pharmacological Research, 2022:106202.