益生菌是指当给予足够数量时,能够为宿主带来健康益处的活的微生物[1],主要包括乳杆菌属、双歧杆菌属、兼性厌氧球菌(包括肠球菌、乳球菌、链球菌等)和一些芽孢杆菌属、酵母等[2]。当足够数量的益生菌通过人体上消化道并在大肠内定植后,会产生诸多有益影响,如调节肠道菌群平衡、增强机体免疫,降低糖尿病、心血管疾病、胃肠道疾病和各类癌症的罹患风险[3]。然而,在加工、储存和人体消化过程中,益生菌容易受到O2、pH值、温度、水分、胃酸和胆汁盐等因素影响,导致存活率和活力降低。为了避免益生菌到达肠道的数量低于发挥益生功能的最低活菌数标准(每g/mL益生菌产品中最低益生菌数≥107 CFU)[4],可通过微胶囊化技术将益生菌包埋在合适的壁材中,提高其对恶劣环境的抵抗及在肠道中的存活和定植。
微胶囊化是将目标物质包埋在由天然或人工合成的高分子成膜材料中,形成具有半透性或密封性聚合物壁壳的微小粒子,其中被包裹的物质称为芯材,包裹芯材的物质称为壁材、涂层、膜、壳或基质[5]。多糖类和蛋白质类是食品工业中最常用的微胶囊壁材,膳食纤维(dietary fiber, DF)作为多糖类的一种,来源丰富、价格低廉、性质稳定、安全无毒。DF具有一定的溶解性、乳化性和胶凝性,在微胶囊化过程中可形成稳定的凝胶网络结构,芯材与壁材紧密结合,使其在胃液低pH值下收缩或保持稳定;或形成稳定玻璃态基质或保护膜,以包埋芯材形成胶囊保护屏障,以阻挡胃液侵蚀、减少芯材在O2和高温等不利环境中的损害。本文就膳食纤维壁材的来源、特性和微胶囊制备方法,以及膳食纤维微胶囊对益生菌稳定性和递送方面影响的最新研究进行综述,并对膳食纤维基微胶囊的未来发展进行了展望。
1 膳食纤维壁材的来源和特性
中国营养学会将DF定义为天然存在于植物来源的食物中,通过物理、酶或化学方法从植物中提取或合成获得的聚合度≥3的、可食用的、不能被人体小肠消化吸收的、对人体有健康意义的碳水化合物聚合物,分为可溶性膳食纤维(soluble dietary fiber, SDF)和不可溶性膳食纤维(insoluble dietary fiber, IDF)[6]。
1.1 膳食纤维壁材的来源
DF广泛来源于水果、蔬菜、谷物类等植物性原料和微生物、虾蟹外壳[2](表1)。目前,部分农产品加工副产物用作饲料或者肥料,但剩下大部分作为废弃物处理,造成资源浪费。从这些废料或副产品中提取DF并作为包埋壁材加以利用,符合当今绿色、可持续发展的要求,同时也符合“清洁标签”食品[7]的发展趋势。
表1 膳食纤维的来源、特性、应用优点和限制
Table 1 The sources, characteristics, application advantages and limits of dietary fiber

壁材来源特性应用优点应用限制参考文献菊粉菊苣、龙舌兰、小麦、黑麦、大麦、大蒜、洋葱、香蕉胶凝性、溶解性、低黏度、高玻璃化转变温度形成稳定的玻璃态保护层,减少氧化缺乏良好的乳化性,吸水促进团聚导致核芯物质损失[8][10]果胶苹果浆、甜菜渣、浆果渣、橄榄果渣、马铃薯浆、柑橘废料乳化稳定性、胶凝性、成膜性、抗氧化性、溶解性、低黏度羧基与Ca2+交联,通过静电相互作用结合形成物理屏障,减少氧化,对胃酸稳定胶凝性随分子质量降低而下降,且与甲基化分布模式相关[8][11]可溶性大豆多糖豆渣高溶解性、低黏度、高热稳定性、高乳化性、强界面膜形成能力其疏水性多肽链吸附在乳液的油滴表面并抑制氧化机械强度较低[12][13]β-葡聚糖燕麦、大麦、小麦等谷物和微生物乳化性、胶凝性、稳定性、成膜性独特的蜂窝状结构,提高对O2、胃酸等的耐受性分子质量较高,形成高黏度的乳液[12]罗望子胶罗望子种子乳化性、胶凝性、高热稳定性通过物理交联形成优良的水凝胶冷水中溶解度低,快速生物降解性,高黏度[8]阿拉伯胶金合欢树乳化性、成膜性、机械性能好、溶解性、低黏度,高玻璃化转变温度在宽pH范围下产生稳定的乳液形成半透膜,导致部分O2和水分通过[8][14]海藻酸钠藻类耐热性、保水性、胶凝性、稳定性与二价阳离子物理交联形成凝胶,在中性和碱性pH值下溶解结构孔径大,胃酸易扩散到微胶囊中,芯材易快速释放[8][15]壳聚糖虾、蟹、昆虫等外壳成膜性、良好的机械性能、抗氧化性其pH敏感性使其适用于芯材的控制释放不溶于水和多数有机溶剂,溶于弱酸性溶剂,表面活性较弱[16]
1.2 膳食纤维壁材的特性
壁材的物理化学性质对于微胶囊的包封效率和稳定性至关重要[8]。理想的微胶囊壁材应对生物安全无毒,具有生物相容性和生物降解性;良好的成膜性能、溶解性、乳化性和一定的机械强度;性质稳定,加工和长期储存过程中不与芯材和周围介质发生化学反应;来源丰富,价格低廉[9]。表1列举了部分DF的来源、作为壁材的特性及其应用优点和限制。
1.2.1 溶解性和乳化性
在食品工业中,大多数微胶囊制备时需要先将壁材与芯材混合形成溶液、悬浮液或乳液体系,然后分散形成液滴,通过冷冻、加热、固化等方法形成微胶囊。DF的溶解性和乳化性使其可以溶解在水或其他溶剂中并具有分散和乳化其他成分以形成稳定溶液或乳状液的能力[9]。DF的溶解性与其组成和结构有关,SDF因其主链和侧链结构不规则使得其溶解性较好并具有良好的黏性和胶凝性,在微胶囊中应用更为广泛。果胶作为常用的壁材,具有良好的溶解性和乳化性,质量分数2%果胶就具有与质量分数15%阿拉伯胶相似的乳液稳定性,使得其能较好地包围芯材,制得的微胶囊产品性质均一稳定[8]。
1.2.2 胶凝性
DF的胶凝性是指其聚合物单元结合形成具有牢固三维结构的凝胶网络。所形成的网络结构能够很好地将芯材捕获到凝胶基质中,从而保护芯材免受胃酸环境和O2的影响,并在肠道中逐渐溶解实现控制释放。此外,凝胶结构越密实,对芯材的保护作用越强。海藻酸盐和果胶具有良好的胶凝性,它们与钙离子交联或与阳离子明胶之间的静电相互作用可以得到更致密的结构,使益生菌能够抵抗酶和酸性水解[17]。另外,具有胶凝特性的DF还可以稳定乳液以防止絮凝和聚结,DF的组成、结构会影响凝胶的强度、致密性和弹性,从而影响微胶囊的封装效率、稳定性以及芯材在胃肠道中的释放[18]。
1.2.3 持水能力和持油能力
DF还具有保持油脂的能力,通过吸附油脂减少界面张力,从而稳定乳液,实现对疏水性芯材的包埋[19]。不仅如此,DF的高持水能力可控制微胶囊在冷冻干燥过程中的水分迁移和冰晶形成,从而提高稳定性。波斯胶、海藻酸钠等具有较好的持水能力,能防止微胶囊过度干燥对菌体造成严重的干燥损伤[20]。但过高的持水能力会增加微胶囊水分含量,从而影响其保质期,在制备过程中,需要调节芯材与壁材的配比、优化制备参数以控制水分含量。
1.2.4 其他特性
具有高玻璃化转变温度的DF(如菊粉、海藻糖和果胶等)在热干燥过程中更容易形成稳定的玻璃态保护层,为益生菌提供半透性的物理保护屏障,减少微胶囊在储存过程中的吸湿性和氧化速率,提高益生菌的生存能力和储存稳定性[21]。果胶和壳聚糖还具有抗氧化特性,能提高微胶囊的稳定性,减少益生菌膜脂质的氧化损伤,维持菌体活力。同时,部分DF作为益生元能促进有益菌生长繁殖,提高菌株活力。除此之外,DF壁材还能为微胶囊产品提供额外健康益处,包括吸附螯合胆固醇、胆汁酸以及肠道内的有毒物质,对于缓解便秘、降血糖、预防肥胖、心血管疾病和增强免疫系统防御具有积极作用[22]。
2 膳食纤维基微胶囊的制备方法
膳食纤维微胶囊化包埋益生菌的常用方法包括挤压、喷雾干燥、冷冻干燥和凝聚法等[27]。近些年出现一些新型制备方法,如电喷雾、静电纺丝技术以及细菌介导的生物界面原位封装。微胶囊结构主要有核壳型(单核和多核)、多层型、基质型和不规则型,它们的制备方法和类型如图1所示。

a-挤压法[23];b-喷雾干燥法[24];c-静电纺丝和电喷雾法[23, 25];d-细菌介导的生物界面原位组装技术[26];e-不同类型的益生菌微胶囊[2]
图1 益生菌微胶囊的制备方法和类型示意图
Fig.1 Schematic diagram of preparation methods and types of probiotic microcapsules
挤压法具有包埋率高、条件温和,但是颗粒尺寸较大且形成速度慢,难以大规模应用。
喷雾干燥法是食品工业微胶囊化最广泛使用的方法之一,具有生产效率高、产品干燥、稳定等优点,但高入口温度和瞬间脱水会对菌体造成严重的热损伤导致其活力降低或死亡,通过添加抗性淀粉、菊粉等SDF,可提高对菌体的热保护[5]。
电喷雾和静电纺丝技术是电流体动力学中封装益生菌的可行方法,通过在喷嘴与收集器之间施加高压电场,然后将益生菌分散液雾化成细小液滴或将益生菌液滴拉伸形成细纤维以微射流沉积到带电收集器上,从而分别形成颗粒或纤维[23]。此过程利用电场快速干燥分散液,没有施加高温,从而具有较高的存活率[28]。最近一项研究使用静电纺丝技术在阿拉伯胶-普鲁兰多糖混合纳米纤维中包封乳酸菌,与冷冻干燥法(80.92%~89.84%)相比,静电纺丝纳米纤维显示出更好的益生菌存活率(85.38%~97.83%),并且在4 ℃下储存28 d仍然保持较高活力,表明静电纺丝技术在益生菌包封中具有巨大应用潜力[29]。
细菌介导的生物界面原位封装技术,是在温和碱性条件下,使用天然酚类前体物质(如多巴胺、咖啡酸等)在单个细菌上氧化聚合从而形成保护的纳米涂层,益生菌细胞释放的Mn2+(作为益生菌的一种必需营养素储存)作为这个过程的催化剂以激活酚类氧化并诱导其在菌体表面聚合[26]。该技术对益生菌具有较好的保护作用,并提高其在胃环境中的存活率、定植能力和抗氧化性能,而无需任何额外的化学修饰步骤。
3 膳食纤维基壁材在微胶囊化包埋益生菌中的应用
益生菌主要在肠道发挥健康效应,而膳食纤维具有不易被人体消化吸收,能被肠道有益菌发酵利用等特点,因而在益生菌包埋、稳定化、递送等方面有很大的应用前景。表2列举了部分膳食纤维基壁材在益生菌微胶囊化方面的研究。
表2 膳食纤维基壁材在微胶囊化包埋益生菌中的应用
Table 2 Application of dietary fiber wall material in microencapsulated probiotics
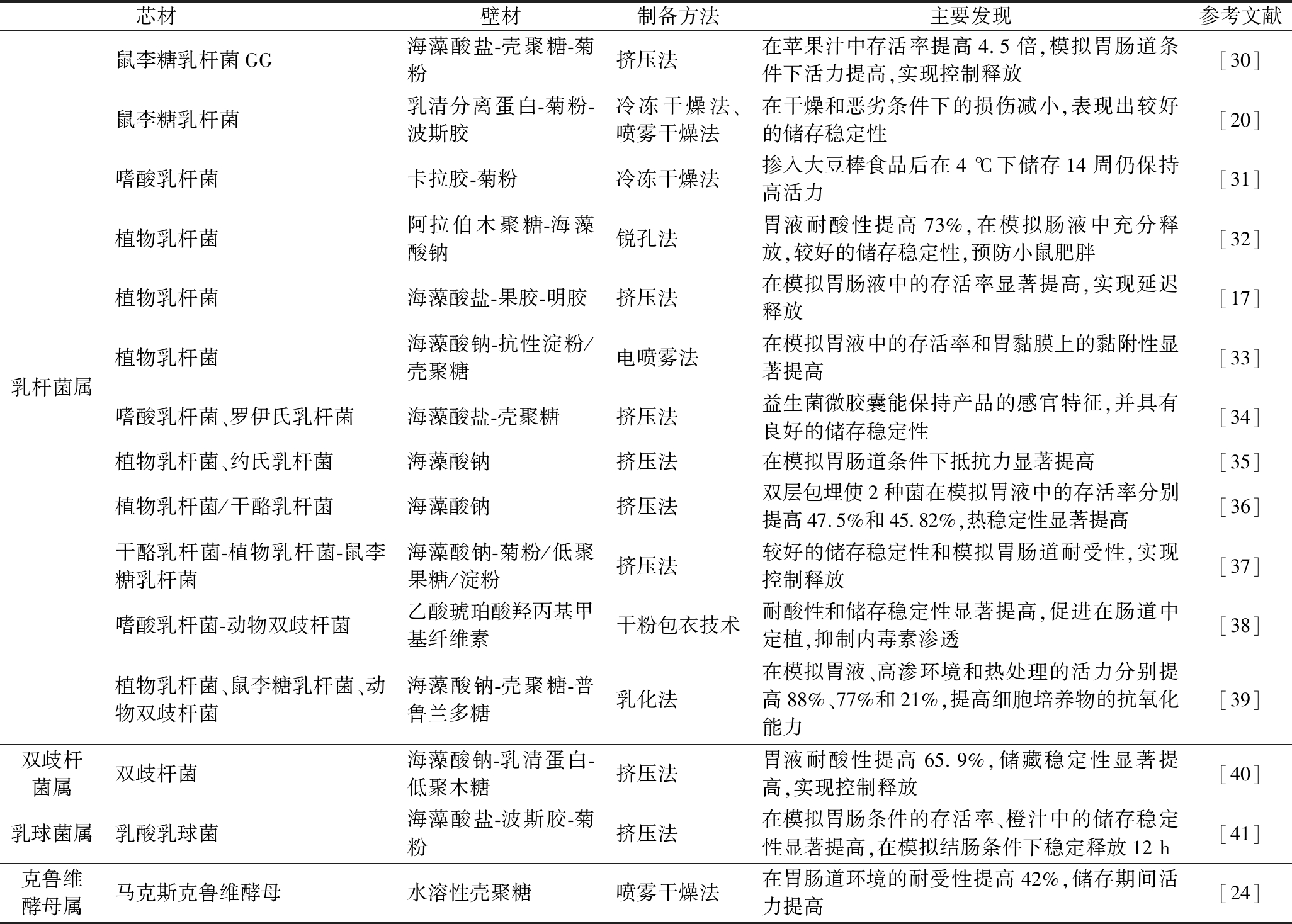
芯材 壁材制备方法主要发现参考文献乳杆菌属鼠李糖乳杆菌GG海藻酸盐-壳聚糖-菊粉挤压法在苹果汁中存活率提高4.5倍,模拟胃肠道条件下活力提高,实现控制释放[30]鼠李糖乳杆菌乳清分离蛋白-菊粉-波斯胶冷冻干燥法、喷雾干燥法在干燥和恶劣条件下的损伤减小,表现出较好的储存稳定性[20]嗜酸乳杆菌卡拉胶-菊粉冷冻干燥法掺入大豆棒食品后在4 ℃下储存14周仍保持高活力[31]植物乳杆菌阿拉伯木聚糖-海藻酸钠锐孔法胃液耐酸性提高73%,在模拟肠液中充分释放,较好的储存稳定性,预防小鼠肥胖[32]植物乳杆菌海藻酸盐-果胶-明胶挤压法在模拟胃肠液中的存活率显著提高,实现延迟释放[17]植物乳杆菌海藻酸钠-抗性淀粉/壳聚糖电喷雾法在模拟胃液中的存活率和胃黏膜上的黏附性显著提高[33]嗜酸乳杆菌、罗伊氏乳杆菌海藻酸盐-壳聚糖挤压法益生菌微胶囊能保持产品的感官特征,并具有良好的储存稳定性[34]植物乳杆菌、约氏乳杆菌海藻酸钠挤压法在模拟胃肠道条件下抵抗力显著提高[35]植物乳杆菌/干酪乳杆菌海藻酸钠挤压法双层包埋使2种菌在模拟胃液中的存活率分别提高47.5%和45.82%,热稳定性显著提高[36]干酪乳杆菌-植物乳杆菌-鼠李糖乳杆菌海藻酸钠-菊粉/低聚果糖/淀粉挤压法较好的储存稳定性和模拟胃肠道耐受性,实现控制释放[37]嗜酸乳杆菌-动物双歧杆菌乙酸琥珀酸羟丙基甲基纤维素干粉包衣技术耐酸性和储存稳定性显著提高,促进在肠道中定植,抑制内毒素渗透[38]植物乳杆菌、鼠李糖乳杆菌、动物双歧杆菌海藻酸钠-壳聚糖-普鲁兰多糖乳化法在模拟胃液、高渗环境和热处理的活力分别提高88%、77%和21%,提高细胞培养物的抗氧化能力[39]双歧杆菌属双歧杆菌海藻酸钠-乳清蛋白-低聚木糖挤压法胃液耐酸性提高65.9%,储藏稳定性显著提高,实现控制释放[40]乳球菌属乳酸乳球菌海藻酸盐-波斯胶-菊粉挤压法在模拟胃肠条件的存活率、橙汁中的储存稳定性显著提高,在模拟结肠条件下稳定释放12 h[41]克鲁维酵母属马克斯克鲁维酵母水溶性壳聚糖喷雾干燥法在胃肠道环境的耐受性提高42%,储存期间活力提高[24]
3.1 提高益生菌的稳定性
益生菌在加工、储存以及添加到食品基质后往往会受到温度、酸碱、氧气、水分等因素影响,导致其生存能力下降。为了使足够数量的益生菌能顺利到达宿主结肠部位发挥益生功能,需要提高其在不利环境条件下的稳定性以保持在最终产品中有较高的存活率和活力。
VANDEN BRABER等[24]发现水溶性壳聚糖在喷雾干燥过程中可以在颗粒表面形成凝胶或致密的涂层,使得微胶囊对O2和水蒸气的渗透性降低,提高了酵母在储存期间(8 ℃或25 ℃,90 d)的稳定性。同时,在6 h的模拟胃肠道条件下微胶囊酵母表现出比游离酵母更好的耐受性,表明水溶性壳聚糖可以很好地保护益生菌在储存过程中的活力和稳定性。单一DF壁材不能满足微胶囊所需的全部良好特性,与其他多糖类或蛋白类壁材复配可以实现优势互补,提高DF的适用性和封装能力。MOAYYEDI等[20]研究发现,在乳清分离蛋白(whey protein isolate,WPI)微胶囊化包埋鼠李糖乳杆菌的过程中,WPI对益生菌具有一定保护作用,但效果不佳(在40 g/L NaCl溶液中死亡率为53.3%)。加入菊粉和波斯胶后,增强了WPI在喷雾干燥和冷冻干燥过程中对益生菌的保护作用,从而显著提高其在NaCl、青霉素、胆汁盐、溶菌酶溶液中的存活率,这是因为高分子质量波斯胶吸附在微生物表面形成黏性层,保护益生菌免受恶劣条件的损伤;同时,在储存期间(25 ℃,24周)表现出更高的存活率,这是由于波斯胶的水分保持能力防止了微胶囊在储存期间过度干燥,从而具有更好的储存稳定性。也有研究表明,将海藻酸盐与壳聚糖结合能形成强电解质络合物,提高微胶囊在低pH环境下的稳定性,增强对益生菌的保护作用[28]。除此之外,在用海藻酸盐包埋益生菌后再用壳聚糖进行第二层包埋,能弥补海藻酸盐微胶囊表面多孔的缺陷,减少水扩散到微胶囊中,从而提高益生菌的稳定性[34]。
在长时间的干燥储存过程中,益生菌活力的下降大多是由于细胞膜受到活性氧的攻击导致菌体损伤,水分活度和储存温度是影响益生菌微胶囊储存稳定性的重要因素[20]。因此在选择壁材时要考虑微胶囊形成后对氧气和水蒸气的渗透性,降低水分子在颗粒中的流动性,同时也要避免过度干燥,并在适宜的温度下储存。
3.2 实现益生菌的控制释放
芯材的释放特性在很大程度上取决于微胶囊壁材的物理化学性质。微胶囊在特定环境因子刺激下响应或不响应,从而控制芯材的释放与滞留,释放机制大多是pH敏感型释放(基于人体消化道不同部位的pH值存在明显差异)和菌群/酶触发型释放(基于肠道菌群对多糖的发酵降解作用)[42]。
VAZIRI等[17]用海藻酸盐复配果胶、明胶制备pH敏感型植物乳杆菌微胶囊,海藻酸盐和果胶的羧基与Ca2+形成离子交联并与明胶的氨基形成静电相互作用以形成致密的基质将益生菌完全包埋,微胶囊在模拟胃液中保持稳定而在模拟肠液中溶胀解聚,从而实现益生菌在肠液中的延迟释放。姚泽晨[32]将阿拉伯木聚糖、阿拉伯木寡糖和海藻酸钠复配作为壁材包埋植物乳杆菌,包埋效率为81.27%。模拟胃肠道试验发现,绝大部分微胶囊在模拟胃液中保持正常形态而不崩解破碎,使得益生菌可以抵抗胃液的侵蚀;同时,微胶囊具有良好的肠溶性,能在模拟肠液(pH 7.4)中充分释放,从而促进肠道健康。益生菌在结肠中的靶向释放对发挥其益生功效具有重要意义,选择合适的壁材组合才能更有效地保护益生菌,使其顺利到达结肠并发挥功能。
3.3 促进益生菌的功能特性
微胶囊化提高益生菌对胃液的耐受性,实现在肠道的控制释放,最终促进益生菌在宿主体内发挥健康效应。DF微胶囊不仅促进益生菌生长和在肠道定植的能力,同时有助于改善肠道菌群平衡和肠道屏障的完整性,发挥抗氧化、抗炎和预防肥胖等作用[43]。
姚泽晨[32]通过锐孔法制得海藻酸钙-阿拉伯木聚糖凝胶球体,经真空冷冻干燥得到微胶囊粉末颗粒。动物试验发现载菌微胶囊和空壳微胶囊均能明显减轻小鼠肥胖症状,改善机体脂代谢异常状态,并在一定程度上改善由高脂饮食引起的肠道菌群紊乱。试验表明这种DF微胶囊在调节肠道菌群和延缓肥胖方面具有重要作用;同时,作为益生菌包埋壁材能被菌群发酵利用,促进短链脂肪酸生成。CHANG等[44]也发现,含有藻酸盐低聚糖或低聚壳聚糖的海藻酸盐微胶囊不仅能作为益生元促进小鼠肠道中有益菌生长,还能降低肠球菌和埃希氏菌等致病菌数量,从而促进肠道微生态平衡。一项体外抗炎研究表明,与游离益生菌相比,海藻酸钠-壳聚糖和普鲁兰多糖复配壁材包埋的益生菌混合物微胶囊在经过模拟胃肠道条件处理后,将其溶解制得的益生菌悬浮液能更好地提高炎症状态下HT-29细胞活力和抗氧化能力,以及下调促炎细胞因子TNF-α和上调抗炎症细胞因子IL-4和IL-10发挥抗炎作用[39]。表明该DF微胶囊能有效保护益生菌并促进其发挥抗炎特性。PARK等[38]使用改性纤维素(乙酸琥珀酸羟丙基甲基纤维素)包埋嗜酸乳杆菌和动物双歧杆菌,小鼠体内黏膜黏附试验表明,黏附性物质作为微胶囊壁材能促进菌群定植于小肠和大肠黏膜,并增强肠道的屏障功能,抑制肠道黏液中内毒素(能刺激机体发生炎症反应)的渗透。ANSELMO等[45]通过猪肠模型研究发现,壳聚糖-海藻酸钠逐层封装益生菌能促进其在短时间内黏附在肠道表面。DF的益生元特性和健康作用,以及海藻酸盐、壳聚糖、果胶等亲水胶体物质的生物黏附性,可促进微胶囊中益生菌的生长、定植,从而更好地发挥益生功能、阻止病原体的黏附或抵御有害物质[27]。
4 总结与展望
膳食纤维基微胶囊不仅可以提高益生菌在模拟胃肠道条件和食品基质中的稳定性和存活率,还可以实现其在肠道中控制释放,并成功定植于肠道黏膜以发挥健康功能,在食品、药品领域具有较大的发展前景。但是,在实际应用中还存在许多不足,如包埋效率较低;所形成的微胶囊表面孔径较大、有裂缝,不能较好地抵抗胃液的侵蚀,在食品中稳定性较差;微胶囊颗粒尺寸较大,影响产品的感官等。在未来的研究中,可持续关注从农业废料和副产品中获得新型性能优异的绿色壁材;针对不同应用领域对壁材改性、选择多种壁材复配使用或进行多层包埋以获得更好的包埋效果;探索或改良出一种既经济又适合大规模工业化生产的益生菌微胶囊制备方法。此外,关于膳食纤维基益生菌微胶囊的消化特性研究,大部分是在体外模拟胃肠道条件下进行的,考虑到动物胃肠道环境的复杂性,为了更好地反映微胶囊对益生菌在消化道的保护效果和控制释放效应,还需要开展动物试验进行验证。目前,关于膳食纤维基益生菌微胶囊在人体或动物中的功能研究还相对较少,若将益生菌添加到功能食品中,应开展系统的从微胶囊化、加入食品中的稳定性和安全性、对食品的感官特性、在体内的消化特性到最终在目标部位的活性和功效研究,以提高益生菌的有效利用。
[1] SWANSON K S, GIBSON G R, HUTKINS R, et al. The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of synbiotics[J]. Nature Reviews. Gastroenterology &Hepatology, 2020, 17(11):687-701.
[2] MISRA S, PANDEY P, DALBHAGAT C G, et al.Emerging technologies and coating materials for improved probiotication in food products:A review[J].Food and Bioprocess Technology, 2022, 15(5):998-1039.
[3] BALTHAZAR C F, GUIMAR ES J F, COUTINHO N M, et al.The future of functional food:Emerging technologies application on prebiotics, probiotics and postbiotics[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(3):2560-2586.
ES J F, COUTINHO N M, et al.The future of functional food:Emerging technologies application on prebiotics, probiotics and postbiotics[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(3):2560-2586.
[4] 田文静, 朱莹丹, 岳林芳, 等.益生菌微胶囊化研究现状[J].中国食品学报, 2016, 16(8):186-194.
TIAN W J, ZHU Y D, YUE L F, et al.Research status on microcapsulation technology of probiotics[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(8):186-194.
[5] FRAKOLAKI G, GIANNOU V, KEKOS D, et al.A review of the microencapsulation techniques for the incorporation of probiotic bacteria in functional foods[J].Critical Reviews in Food Science and Nutrition, 2021, 61(9):1515-1536.
[6] MEHTA D, CHATURVEDI K, SIDANA A, et al.Processing treatment of atmospheric- and vacuum-cold plasma improved physical properties, glucose diffusion and fermentability of dietary fibers extracted from de-oiled rice and corn bran[J].Bioactive Carbohydrates and Dietary Fibre, 2022, 28:100326.
[7] 张连慧, 应欣, 王勇.清洁标签在食品行业中的应用[J].食品科技, 2018, 43(6):326-330.
ZHANG L H, YING X, WANG Y.Application of clean label in the food industry[J].Food Science and Technology, 2018, 43(6):326-330.
[8] HALAHLAH A, PIIRONEN V, MIKKONEN K S, et al.Polysaccharides as wall materials in spray-dried microencapsulation of bioactive compounds:Physicochemical properties and characterization[J].Critical Reviews in Food Science and Nutrition, 2023,63(24):6983-7015.
[9] DESAI K G H, JIN PARK H J.Recent developments in microencapsulation of food ingredients[J].Drying Technology, 2005, 23(7):1361-1394.
[10] KUHN F, AZEVEDO E S, NORE A C P Z.Behavior of inulin, polydextrose, and egg albumin as carriers of Bougainvillea glabra Bracts extract:Rheological performance and powder characterization[J].Journal of Food Processing and Preservation, 2020, 44(10):e14834.
A C P Z.Behavior of inulin, polydextrose, and egg albumin as carriers of Bougainvillea glabra Bracts extract:Rheological performance and powder characterization[J].Journal of Food Processing and Preservation, 2020, 44(10):e14834.
[11] MOLINO S, RUFI N HENARES J
N HENARES J  , G
, G MEZ-MASCARAQUE L G.Tannin-rich extracts improve the performance of amidated pectin as an alternative microencapsulation matrix to alginate[J].Current Research in Food Science, 2022, 5:243-250.
MEZ-MASCARAQUE L G.Tannin-rich extracts improve the performance of amidated pectin as an alternative microencapsulation matrix to alginate[J].Current Research in Food Science, 2022, 5:243-250.
[12] SAMBORSKA K, BOOSTANI S, GERANPOUR M, et al.Green biopolymers from by-products as wall materials for spray drying microencapsulation of phytochemicals[J].Trends in Food Science &Technology, 2021, 108:297-325.
[13]  UPINA K, KOWALCZYK D, KAZIMIERCZAK W.Gum Arabic/gelatin and water-soluble soy polysaccharides/gelatin blend films as carriers of astaxanthin:A comparative study of the kinetics of release and antioxidant properties[J].Polymers, 2021, 13(7):1062.
UPINA K, KOWALCZYK D, KAZIMIERCZAK W.Gum Arabic/gelatin and water-soluble soy polysaccharides/gelatin blend films as carriers of astaxanthin:A comparative study of the kinetics of release and antioxidant properties[J].Polymers, 2021, 13(7):1062.
[14] COIMBRA P P S, DE SOUZA NEVES CARDOSO F, DE ANDRADE GONÇALVES É C B.Spray-drying wall materials:Relationship with bioactive compounds[J].Critical Reviews in Food Science and Nutrition, 2021, 61(17):2809-2826.
[15] RAZAVI S, JANFAZA S, TASNIM N, et al.Microencapsulating polymers for probiotics delivery systems:Preparation, characterization, and applications[J].Food Hydrocolloids, 2021, 120:106882.
[16] LIANG J, YAN H, PULIGUNDLA P, et al.Applications of chitosan nanoparticles to enhance absorption and bioavailability of tea polyphenols:A review[J].Food Hydrocolloids, 2017, 69:286-292.
[17] VAZIRI A S, ALEMZADEH I, VOSSOUGHI M, et al.Co-microencapsulation of Lactobacillus plantarum and DHA fatty acid in alginate-pectin-gelatin biocomposites[J].Carbohydrate Polymers, 2018, 199:266-275.
[18] ZHU F.Encapsulation and delivery of food ingredients using starch based systems[J].Food Chemistry, 2017, 229:542-552.
[19] ELLEUCH M, BEDIGIAN D, ROISEUX O, et al.Dietary fibre and fibre-rich by-products of food processing:Characterisation, technological functionality and commercial applications:A review[J].Food Chemistry, 2011, 124(2):411-421.
[20] MOAYYEDI M, ESKANDARI M H, RAD A H E, et al.Effect of drying methods (electrospraying, freeze drying and spray drying) on survival and viability of microencapsulated Lactobacillus rhamnosus ATCC 7469[J].Journal of Functional Foods, 2018, 40:391-399.
[21] 陶萄, 侯丹平, 尹肖寒, 等.喷雾干燥技术在益生菌微胶囊制品中的应用研究进展[J].食品工业, 2019, 40(4):271-275.
TAO T, HOU D P, YIN X H, et al.Advances in application of spray drying technology in microencapsulation of probiotics[J].The Food Industry, 2019, 40(4):271-275.
[22] PATHANIA S, KAUR N.Utilization of fruits and vegetable by-products for isolation of dietary fibres and its potential application as functional ingredients[J].Bioactive Carbohydrates and Dietary Fibre, 2022, 27:100295.
[23] GU Q Z, YIN Y, YAN X J, et al.Encapsulation of multiple probiotics, synbiotics, or nutrabiotics for improved health effects:A review[J].Advances in Colloid and Interface Science, 2022, 309:102781.
[24] VANDEN BRABER N, VERGARA L D, ROSSI Y, et al.Effect of microencapsulation in whey protein and water-soluble chitosan derivative on the viability of the probiotic Kluyveromyces marxianus VM004 during storage and in simulated gastrointestinal conditions[J].LWT, 2020, 118:108844.
[25] KHOSHNOUDI-NIA S, FORGHANI Z, JAFARI S M.A systematic review and meta-analysis of fish oil encapsulation within different micro/nanocarriers[J].Critical Reviews in Food Science and Nutrition, 2022, 62(8):2061-2082.
[26] CENTURION F, MERHEBI S, BAHARFAR M, et al.Cell-mediated biointerfacial phenolic assembly for probiotic nano encapsulation[J].Advanced Functional Materials, 2022, 32(26):2200775.
[27] RASHIDINEJAD A, BAHRAMI A, REHMAN A, et al.Co-encapsulation of probiotics with prebiotics and their application in functional/synbiotic dairy products[J].Critical Reviews in Food Science and Nutrition, 2020, 62(9):21-25.
[28] ZAEIM D, SARABI-JAMAB M, GHORANI B, et al.Microencapsulation of probiotics in multi-polysaccharide microcapsules by electro-hydrodynamic atomization and incorporation into ice-cream formulation[J].Food Structure, 2020, 25:100147.
[29] MA J G, XU C, YU H L, et al.Electro-encapsulation of probiotics in gum Arabic-pullulan blend nanofibres using electrospinning technology[J].Food Hydrocolloids, 2021, 111:106381.
[30] GANDOMI H, ABBASZADEH S, MISAGHI A, et al.Effect of chitosan-alginate encapsulation with inulin on survival of Lactobacillus rhamnosus GG during apple juice storage and under simulated gastrointestinal conditions[J].LWT - Food Science and Technology, 2016, 69:365-371.
[31] CHEN M, MUSTAPHA A.Survival of freeze-dried microcapsules of α-galactosidase producing probiotics in a soy bar matrix[J].Food Microbiology, 2012, 30(1):68-73.
[32] 姚泽晨. 植物乳杆菌微胶囊及其壁材对小鼠肥胖的预防作用[D].无锡:江南大学, 2019.
YAO Z C.The preventative effect of Lactobacillus plantarum microcapsule and its wall material on diet induced obesity in mice[D].Wuxi:Jiangnan University, 2019.
[33] PHUONG TA L, BUJNA E, KUN S, et al.Electrosprayed mucoadhesive alginate-chitosan microcapsules for gastrointestinal delivery of probiotics[J].International Journal of Pharmaceutics, 2021, 597:120342.
[34] GARC A-CEJA A, MANI-L
A-CEJA A, MANI-L PEZ E, PALOU E, et al.Viability during refrigerated storage in selected food products and during simulated gastrointestinal conditions of individual and combined lactobacilli encapsulated in alginate or alginate-chitosan[J].LWT-Food Science and Technology, 2015, 63(1):482-489.
PEZ E, PALOU E, et al.Viability during refrigerated storage in selected food products and during simulated gastrointestinal conditions of individual and combined lactobacilli encapsulated in alginate or alginate-chitosan[J].LWT-Food Science and Technology, 2015, 63(1):482-489.
[35] TIANI K A, YEUNG T W, MCCLEMENTS D J, et al.Extending viability of Lactobacillus plantarum and Lactobacillus johnsonii by microencapsulation in alginate microgels[J].International Journal of Food Sciences and Nutrition, 2018, 69(2):155-164.
[36] RATHER S A, AKHTER R, MASOODI F A, et al.Effect of double alginate microencapsulation on in vitro digestibility and thermal tolerance of Lactobacillus plantarum NCDC201 and L.casei NCDC297[J].LWT-Food Science and Technology, 2017, 83:50-58.
[37] LUCA L, OROIAN M.Influence of different prebiotics on viability of Lactobacillus casei, Lactobacillus plantarum and Lactobacillus rhamnosus encapsulated in alginate microcapsules[J].Foods, 2021, 10(4):710.
[38] PARK H J, LEE G H, JUN J H, et al.Formulation and in vivo evaluation of probiotics-encapsulated pellets with hydroxypropyl methylcellulose acetate succinate (HPMCAS)[J].Carbohydrate Polymers, 2016, 136:692-699.
[39] D’ORAZIO G, DI GENNARO P, BOCCARUSSO M, et al.Microencapsulation of new probiotic formulations for gastrointestinal delivery:In vitro study to assess viability and biological properties[J].Applied Microbiology and Biotechnology, 2015, 99(22):9779-9789.
[40] 张传伟, 朱慧霞, 柴佳太, 等.低聚木糖复配冻干保护剂的优化及其对双歧杆菌微胶囊性能的影响[J].食品工业科技, 2022, 43(21):245-251.
ZHANG C W, ZHU H X, CHAI J T, et al.Optimization of cryoprotectants complexed with xylooligosaccharides and its effects on the properties of Bifidobacterium microcapsules[J].Science and Technology of Food Industry, 2022, 43(21):245-251.
[41] NAMI Y, LORNEZHAD G, KIANI A, et al.Alginate-Persian Gum-Prebiotics microencapsulation impacts on the survival rate of Lactococcus lactis ABRIINW-N19 in orange juice[J].LWT, 2020, 124:109190.
[42] 王淑敏, 叶发银, 刘嘉, 等.食物活性成分结肠靶向输送系统研究进展[J].食品科学, 2014, 35(23):320-324.
WANG S M, YE F Y, LIU J, et al.Progress in preparation and application of colon-specific delivery systems for food bioactive components[J].Food Science, 2014, 35(23):320-324.
[43] SARAO L K, ARORA M.Probiotics, prebiotics, and microencapsulation:A review[J].Critical Reviews in Food Science and Nutrition, 2017, 57(2):344-371.
[44] CHANG L Y, WANG P, SUN S J, et al.A synbiotic marine oligosaccharide microcapsules for enhancing Bifidobacterium longum survivability and regulatory on intestinal probiotics[J].International Journal of Food Science &Technology, 2021, 56(1):362-373.
[45] ANSELMO A C, MCHUGH K J, WEBSTER J, et al.Layer-by-layer encapsulation of probiotics for delivery to the microbiome[J].Advanced Materials, 2016, 28(43):9486-9490.