近年来,肌酐作为基本的生化标志物在检测肾脏状况中的应用广泛,可以为临床提供肾脏功能相关的定性和定量数据。肾脏通过肾小球超滤来清除血浆中的肌酐以维持体内的动态平衡,肾脏会清除血液中的肌酐,但随着肾功能的下降,肌酐水平会上升,因此肌酐含量是肾脏功能最重要的生化指标[1]。肌酐测定试剂盒由于具备操作简单、处理速度快、反应敏感度高等优点,目前被广泛应用于肌酐的常规检测。该试剂盒按照检测原理主要分为酶法和苦味酸法[2]2种,相比较而言,酶法抗干扰性能较好、准确度高且交叉污染相对少,可为临床诊断提供可靠的数据支持。其中肌酐酶(EC 3.5.2.10,creatininase,CA)、肌酸酶(EC 3.5.3.3,creatinase,CI)以及肌氨酸氧化酶(EC 1.5.3.1,sarcosine oxidase,SOX)是用于酶法检测肌酐的关键工具酶,但酶法试剂盒中的关键工具酶目前还主要依赖进口,国产CA发酵产量低且稳定性不佳[3-4],致使肌酐检测试剂盒生产成本一直居高不下。为了降低成本和减轻患者负担,研究与开发活性高、稳定性好的产CA菌株,并通过发酵条件优化提高表达量,对推动其在肌酐检测试剂盒中的应用尤其重要。
CA分子质量在29 kDa左右,主要来源于假单胞菌和节杆菌。TANG等[5]和陶政宇等[6]分别实现了恶臭假单胞杆菌(Pseudomonas putida)来源的CA在大肠杆菌(Escherichia coli)和枯草芽孢杆菌的表达,但由于纯化时需要两步柱层析,操作繁琐、损失较大,导致胞内蛋白回收率比较低;且枯草芽孢杆菌胞外分泌蛋白较少,蛋白纯化回收的方法尚不明确,未得到纯蛋白。大肠杆菌代谢网络研究清晰,且培养条件简单易操作、发酵时间成本低,成为目前最热门的外源表达宿主。本研究全基因合成来源于P.putida的CA基因,并根据大肠杆菌密码子偏好性进行优化,实现了其在E.coli BL21(DE3)中的可溶性表达,对重组菌发酵条件和酶学性质进行了研究,并完成了在5 L发酵罐中的初步放大生产,以期为CA的工业生产提供理论依据及技术支持。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种
实验室构建的基因工程菌E.coli BL21(DE3)pET28a-CA菌株。
1.1.2 基础培养基
Terrific-Broth(TB)液体培养基(g/L):胰蛋白胨12,酵母浸粉24,87%(体积分数)甘油4 mL/L,K2HPO4 0.072 mol/L,KH2PO4 0.017 mol/L(调节至pH 6.5);Luria-Bertani(LB)液体培养基(g/L):胰蛋白胨10,NaCl 10,酵母浸粉5;LB固体培养基:在LB液体培养基的基础上,加入15 g/L琼脂粉。上述所需培养基均在121 ℃灭菌30 min后备用。
1.1.3 仪器与设备
XMTD-204数显恒温水浴锅,常州智博瑞仪器制造有限公司;ZWY-200D恒温培养振荡器,上海智诚分析仪器制造有限公司;GS-LH300高压匀浆机,格瑞特康生物有限公司;D/37520高速控温离心机,德国艾本德公司;UV-1100紫外可见分光光度计,美普达仪器有限公司;LRH-1000F生化培养箱,上海一恒科学仪器有限公司;DYY-6C电泳仪,北京市六一仪器厂;5BG离位灭菌玻璃发酵罐,上海保兴生物设备工程有限公司;GI54T立式压力蒸汽灭菌器,致微仪器有限公司。
1.1.4 主要实验药品
异丙基β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside, IPTG),日本宝生物公司;胰蛋白胨、酵母浸粉、过硫酸铵,北京奥博星生物技术有限公司;考马斯亮蓝R250,上海化学试剂公司;硫酸卡那霉素,北京索莱宝科技有限公司;NaOH、KH2PO4、K2HPO4、Na2CO3、三羟甲基氨基甲烷(Tris),天津市风船化学试剂科技有限公司;β-巯基乙醇,卡迈舒生物科技有限公司;HCl,天津津海华兴有限公司;CI和SOX均来自本课题组实验室。
1.2 实验方法
1.2.1 重组表达菌株的构建
CA基因片段源自于GenBank数据库(GenBank:D45424.1)已知的CA(P.putida1978)的基因序列[4],委托金唯智生物科技有限公司合成并根据大肠杆菌中密码子的偏好性完成密码子优化。质粒的构建如图1所示,载体为pET-28a,酶切位点分别为Nco I和Xho I,抗性基因选用Kan,将重组质粒导入到E.coli BL21(DE3)中。
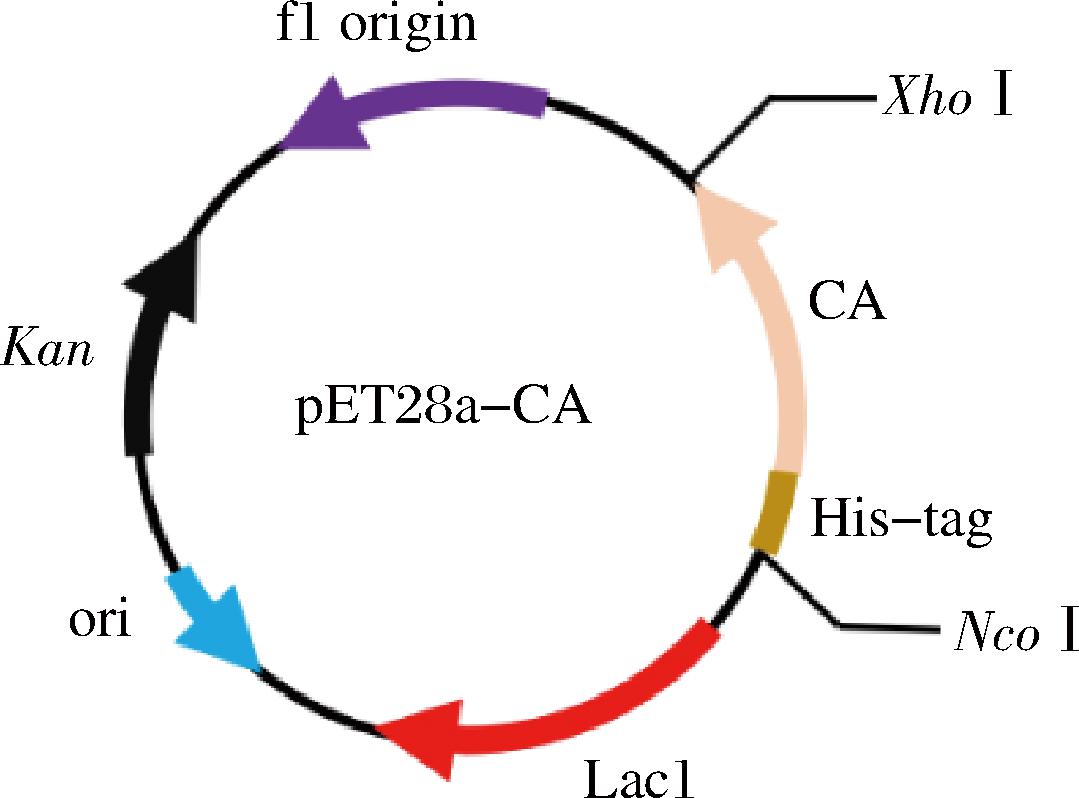
图1 重组质粒构建示意图
Fig.1 Construction of recombinant plasmid pET-28a His-CA
1.2.2 种子活化与摇瓶发酵
利用-80 ℃冰箱保藏的CA菌种在固体LB培养基划线培养,挑取单菌落在10 mL LB液体培养基中,37 ℃恒温培养18 h得到一级种子;将一级种子按照1%(体积分数,下同)接种量接种在50 mL LB液体培养基中,37 ℃下培养6 h得到二级种子。
摇瓶培养条件:按1%接种量将一级种子接种于50 mL TB培养基中,补加卡那霉素至终质量浓度为50 μg/mL,待其生长至OD600=0.8,加入终浓度为0.2 mmol/L IPTG进行诱导培养,20 ℃诱导培养20 h。
1.2.3 酶液的收集
发酵完毕后,4 ℃、8 000 r/min离心收集菌体,使用0.1 mol/L的Tris-HCl(pH 8.0)缓冲液将发酵菌体洗涤2遍后,使用1/3发酵液体积的Tris-HCl(pH 8.0)缓冲液重悬菌体,用细胞匀浆机破碎细胞,破碎完毕后,离心去除下层细胞碎片沉淀,上清液即为粗酶液。
1.2.4 SDS-PAGE验证
发酵完成后,收集粗酶液,蛋白电泳的样品和Marker的上样量分别为8、5 μL,在105 V电压下运行20 min,然后加压至155 V,胶片用考马斯亮蓝染色40 min,利用凝胶成像仪观察CA目的蛋白表达情况。
1.2.5 酶活力的测定
CA活性的检测原理:底物肌酐在CA作用下水解生成肌酸,与在弱碱性条件下α-萘酚被双乙酰氧化生成的α-萘醌反应生成荧光化合物,该荧光产物可在525 nm波长下进行吸光值测定[6-7]。
检测试剂:0.2 mol/L Tris-HCl缓冲溶液(pH 8.0);0.1 mol/L肌酐溶液;2 g Na2CO3溶于50 mL双蒸水;1 g α-萘酚溶于50 mL无水乙醇;0.6 g NaOH和1.6 g Na2CO3溶于50 mL双蒸水;25 μL二乙酰溶于50 mL双蒸水。检测方法:取100 μL Tris-HCl缓冲溶液和800 μL肌酐溶液至试管中,37 ℃静置5 min;加入100 μL粗酶液,混匀后于37 ℃孵育10 min,后加入2 mL Na2CO3溶液终止反应,移取100 μL反应液,依次加入900 μL双蒸水、500 μL α-萘酚溶液、500 μL NaOH溶液、500 μL二乙酰溶液,25 ℃孵育20 min;加入2.5 mL双蒸水在525 nm处测定OD值,以灭活酶液(沸水浴5 min)为空白对照。
酶活力定义为:在37 ℃的反应液中,水解底物产生1 μmol肌酸所需的CA的量为1个酶活力单位(U)。单位体积(mL)酶液所具有的酶活力单位定义为毫升酶活力(U/mL)。比酶活力为单位质量(mg)蛋白质所具有的酶活力(U/mg),蛋白质浓度采用考马斯亮蓝法测定。
1.3 摇瓶发酵培养基优化
1.3.1 单因素试验
以TB培养基作为基础培养基,对培养基中的主要成分进行优化,以菌体生长状况和CA活力作为评价标准,依次对碳源种类及浓度、氮源种类及浓度、磷酸盐浓度进行单因素优化试验[8]。
1.3.2 Box-Behnken试验设计(BBD)与结果验证
采用BBD的响应面分析法对各因素及其交互作用的影响进行评价,响应面分析是一种用于建立多变量方程和评估变量的最优值的统计技术[9-11],可考察培养基中各组分之间交互作用对发酵效果的影响。数据处理应用Design Expert 8.0.6软件,通过软件找出4个选定变量之间的交互作用,每个变量都在3个不同的水平上进行了分析,4个变量的中心编码值为零(表1)。
表1 Box-Behnken试验设计因素与水平编码
Table 1 Factors and levels of Box-Behnken experiment

因素水平-101A葡萄糖/(g/L)7.51012.5B酵母浸粉/(g/L)17.52022.5C磷酸盐/(mmol/L)115130145D蛋白胨/(g/L)12.51517.5
根据BBD试验设计获得的实验结果数据与模型进行拟合分析确定回归方程的极值点及相应的自变量取值,并进行摇瓶验证实验,重复3次。根据摇瓶验证结果验证模型的可靠性,最终确定优化结果。
1.4 5 L发酵罐培养条件优化
发酵罐培养条件:利用优化后的培养基,将二级种子按1%~7%的体积分数接入5 L发酵罐中,固定发酵溶氧值(dissolved oxygen,DO)10%~30%,设置转速和溶氧值串联,通气量为6 L/min,罐内温度设置为37 ℃,待菌株发酵培养至OD600=1.8加入IPTG诱导培养,使加入的IPTG在发酵液中的终浓度为0.05~0.6 mmol/L,设定罐内温度20~30 ℃以利于工程菌株表达CA。诱导培养10~24 h后,4 ℃、8 000 r/min离心5 min收集菌体。
1.5 数据处理与分析
采用Design Expert 8.0.6软件进行Box-Behnken实验设计、数据处理和分析,采用Origin 8.0软件编辑绘图。
2 结果与分析
2.1 CA的SDS-PAGE验证
经SDS-PAGE测定,结果如图2所示,M为蛋白质标准条带(marker),1号泳道为重组菌株表达后细胞破碎上清液,2号泳道为重组菌株全细胞,3号泳道为空载质粒pET-28a表达后细胞破碎上清粗酶液,结果表明CA是胞内酶,分子质量大约为29 kDa,与相关文献报道一致[4],说明重组菌株的成功构建。

图2 诱导表达后的CA的SDS-PAGE分析
Fig.2 Analysis of SDS-PAGE on expression of CA
2.2 培养基优化
大肠杆菌的发酵一般利用TB培养基,但其中的氮源、碳源、无机盐等对菌体生长有重要的影响,不同的菌体对各种元素的需求量不同,为了提高发酵产量,本文以TB培养基为基础培养基,对培养基的各组分进行优化。
2.2.1 培养基碳源的选择和用量的优化
在50 mL基础培养基中,分别加入相同质量浓度(10 g/L)的甘油、葡萄糖、乳糖、蔗糖、淀粉作为碳源。不同碳源对重组菌的生长与产酶情况如图3-a所示,当以乳糖作为碳源时,虽然菌体比酶活力很高,但是菌体生长状况不佳,同一批次总酶活力产出远远低于其他碳源。以葡萄糖作为碳源时,总产酶水平与甘油基本持平,考虑到葡萄糖的成本远远低于甘油,因此选择葡萄糖作为培养基的碳源。如图3-b所示,在葡萄糖质量浓度的不断增加过程中,重组菌产酶总体水平显现出先增高后降低的趋势,菌体量基本持平,可能由于高浓度葡萄糖抑制CA的表达[12],当葡萄糖质量浓度为10 g/L时,CA活力达到最高值252.53 U/mL,所以最终选用10 g/L的葡萄糖作为最佳碳源。
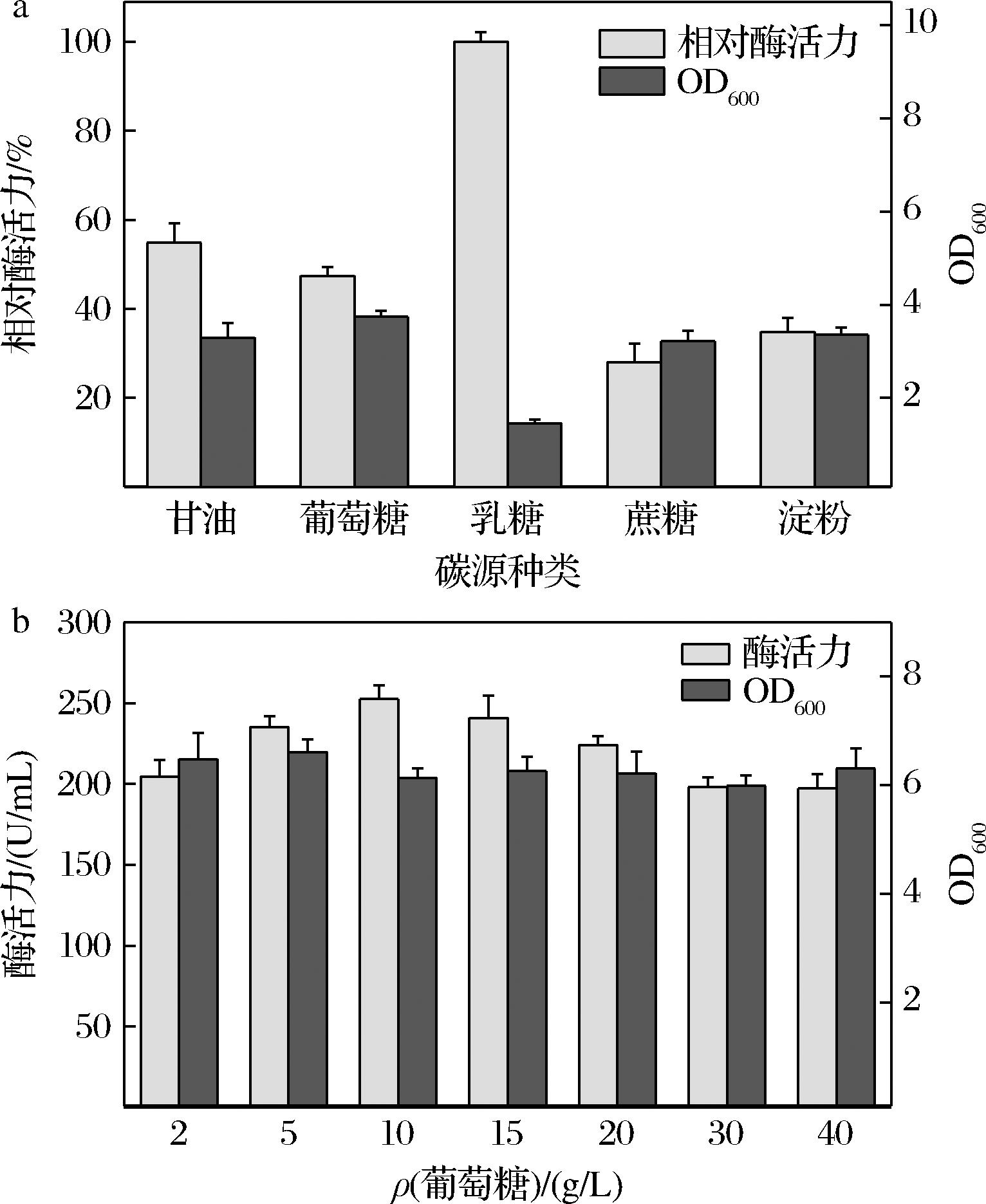
a-碳源种类;b-葡萄糖浓度
图3 碳源种类与葡萄糖浓度对发酵的影响
Fig.3 Influence of carbon source and glucose concentration on fermentation
2.2.2 培养基氮源的选择和用量的优化
在50 mL基础培养基中,分别加入相同质量浓度(10 g/L)的尿素、NH4NO3、(NH4)2SO4、NH4Cl、酵母浸粉、胰蛋白胨作为氮源。
由图4-a可知,以尿素、NH4NO3、(NH4)2SO4和NH4Cl作为氮源时,菌体的生长情况较差,说明无机氮源营养物质不利于菌株利用,另外发酵过程中由于菌体利用无机氮源后会使发酵液的pH下降,不利于CA的表达。无机氮源中,以(NH4)2SO4为氮源的生长量最低,菌体的生长缓慢也导致其酶活力较低。以胰蛋白胨和酵母浸粉作为氮源时,可以发现使用有机氮源菌体生长量和CA活力都明显优于使用无机氮源,而且胰蛋白胨优于酵母浸粉,这是由于其含有多种菌体生长需要的维生素和生长因子以及矿物元素,与文献报道一致[13]。因此,本实验选择酵母浸粉与胰蛋白胨作为氮源。

a-氮源种类;b-酵母浸粉浓度;c-胰蛋白胨浓度
图4 氮源种类、酵母浸粉浓度与胰蛋白胨浓度对发酵的影响
Fig.4 Influence of nitrogen source, yeast powder concentration, and tryptone concentration on fermentation
如图4-b所示,随着酵母浸粉质量浓度增大,菌体量呈现出先上升后下降的趋势,在酵母浸粉质量浓度为20 g/L时,菌体量基本达到最大值。在酵母浸粉质量浓度>25 g/L时,菌体量大幅度下降,可能由于高浓度的酵母浸粉含有过量的氨基酸,从而抑制了重组菌的生长[14]。另外CA活力也随着酵母浸粉浓度增加呈先上升后下降的态势,酵母浸粉质量浓度为20 g/L时,CA活力达到最高值330.78 U/mL,之后酶活力下降,因此选用20 g/L酵母浸粉有利于CA的表达。
如图4-c所示,随着胰蛋白胨质量浓度不断增大,CA活力呈现先上升而后降低的状态,胰蛋白胨质量浓度为15 g/L时,CA活力达到最高值405.16 U/mL。综上最终选择15 g/L的胰蛋白胨,20 g/L的酵母浸粉作为培养基氮源。
2.2.3 培养基磷酸盐用量的优化
在50 mL基础培养基中,分别控制磷酸盐的终浓度为40~220 mmol/L,探究磷酸盐浓度对菌体产酶情况的影响,结果如图5所示。在磷酸盐浓度增加的过程中,菌体浓度并没有产生较大波动,酶活力出现了先增加后降低的趋势,可能是由于高浓度磷酸盐对CA的生产产生了抑制作用,无机磷促进初级代谢,而过量的磷酸盐会抑制许多抗生素和其他次生代谢物的生物合成[15],不利于CA的生产。实验发现磷酸盐在130 mmol/L时菌体生长状况与其他浓度基本持平,但是此时的酶活力达到最高326.77 U/mL。因此,本实验最终选择磷酸盐终浓度为130 mmol/L。
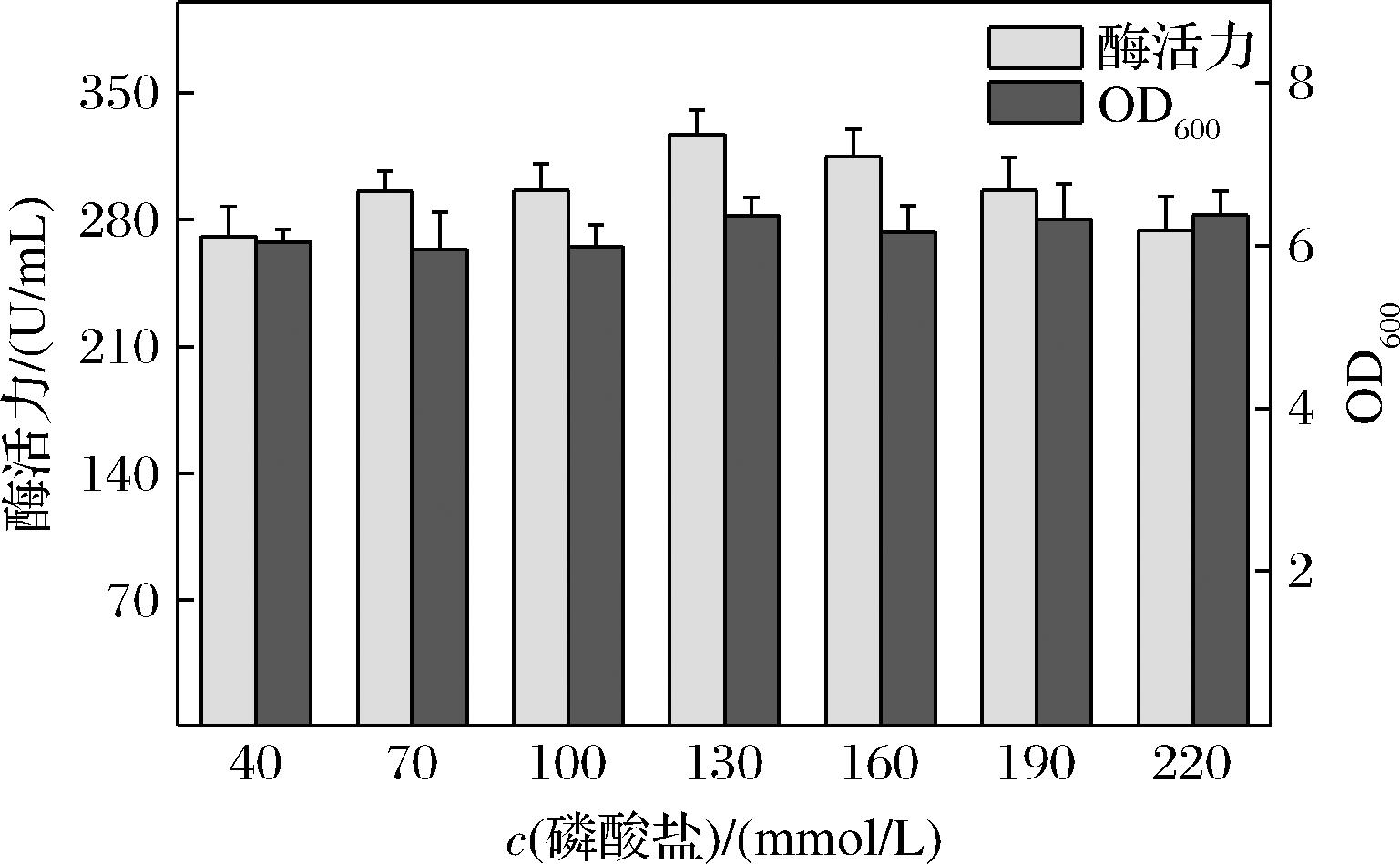
图5 磷酸盐浓度对发酵的影响
Fig.5 Effects of phosphate concentration on fermentation
2.3 响应面优化培养基成分及结果验证
在单因素试验的基础上,选择葡萄糖、酵母浸粉、胰蛋白胨和磷酸盐浓度作为变量,并用BBD确定了影响CA产量的4个因素的最优水平[16]。对葡萄糖(7.5、10、12.5 g/L)、酵母浸粉(17.5、20、22.5 g/L)、磷酸盐(115、130、145 mmol/L)和胰蛋白胨(12.5、15、17.5 g/L)进行29组实验(表2)。经过Design Expert 8.0.6对方差分析(表3)和交互作用分析,优化的培养基组葡萄糖、酵母浸粉、磷酸盐和胰蛋白胨浓度分别为10.33 g/L、21.80 g/L、137.63 mmol/L和15.60 g/L时,该模型预测的CA活力为406.66 U/mL。
表2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiment

试验号葡萄糖酵母浸粉磷酸盐胰蛋白胨实际酶活力/(U/mL)10000372.682001-1248.7330000376.224-1-100213.6050110411.186010-1247.607-10-10263.638-1010298.0390011322.96101010321.29110101322.76121100355.82130-101172.38140-10-1143.78150000401.51160000351.0917-1100328.621810-10285.561900-1-1220.97201001303.69210000369.98220-110247.60230-1-10230.042401-10361.32251-100255.532600-11296.8927100-1237.9628-1001281.0329-100-1175.08
表3 CA活力响应面模型的方差分析
Table 3 Analysis of variance for the response surface model of CA activity
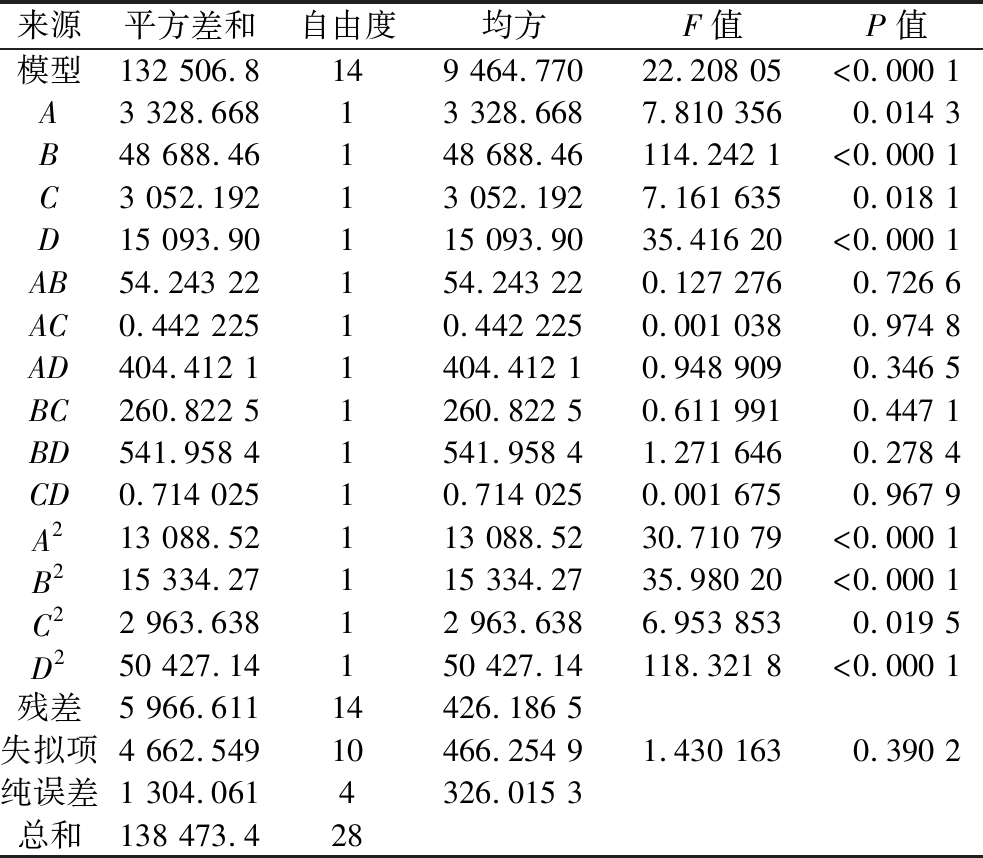
来源平方差和自由度均方F值P值模型132 506.8149 464.77022.208 05<0.000 1A3 328.66813 328.6687.810 3560.014 3B48 688.46148 688.46114.242 1<0.000 1C3 052.19213 052.1927.161 6350.018 1D15 093.90115 093.9035.416 20<0.000 1AB54.243 22154.243 220.127 2760.726 6AC0.442 22510.442 2250.001 0380.974 8AD404.412 11404.412 10.948 9090.346 5BC260.822 51260.822 50.611 9910.447 1BD541.958 41541.958 41.271 6460.278 4CD0.714 02510.714 0250.001 6750.967 9A213 088.52113 088.5230.710 79<0.000 1B215 334.27115 334.2735.980 20<0.000 1C22 963.63812 963.6386.953 8530.019 5D250 427.14150 427.14118.321 8<0.000 1残差5 966.61114426.186 5失拟项4 662.54910466.254 91.430 1630.390 2纯误差1 304.0614326.015 3总和138 473.428
根据得到的结果,考虑到操作可行性,将理论培养基最佳条件调整为:葡萄糖10.30 g/L、酵母浸粉21.80 g/L、磷酸盐137.60 mmol/L、胰蛋白胨15.60 g/L。利用优化后的培养基在摇瓶水平通过3组平行实验验证结果,3组验证实验的CA活力平均值为401.76 U/mL,与回归模型预测的最大酶活力406.66 U/mL的相对误差为1.14%,表明本实验得出的回归模型合理、可信。响应面优化前单因素下发酵产CA活力最大为326.77 U/mL,优化后重组菌株生产的CA活力比优化前增大了22.95%。优化后的发酵培养基降低了成本,可大幅度提高CA活力,缩减培养周期,提高了发酵效率。
2.4 5 L发酵罐反应条件的优化
全自动发酵罐中的发酵培养过程的高度非线性和复杂特性是由于微生物的非线性生长行为造成的。此外,微生物的代谢机制非常复杂,对培养环境非常敏感。环境的微小变化会导致不同的代谢途径,因此对发酵罐培养中影响微生物生长和代谢过程的条件,包括IPTG浓度、接种量、温度和溶解氧浓度等的优化非常重要[17-18]。
2.4.1 IPTG浓度对重组菌生长状况和CA活力的影响
以IPTG为诱导剂的T7启动子表达系统已被广泛应用于大肠杆菌中异源蛋白的表达,T7启动子可以帮助重组菌有效表达外源蛋白CA。如图6-a所示,IPTG在低浓度(0.05~0.2 mmol/L)时酶活力随着IPTG浓度的增加而增加,浓度增加至0.2 mmol/L时,CA活力达到最大值401.76 U/mL。IPTG浓度的增加能使CA的表达量和菌体量增加,但超过0.2 mmol/L之后,对CA活力和菌体量都有一定负面影响,这种影响在其他文献中也有报道[19-20]。因此,以0.2 mmol/L的诱导剂作为最佳诱导浓度。
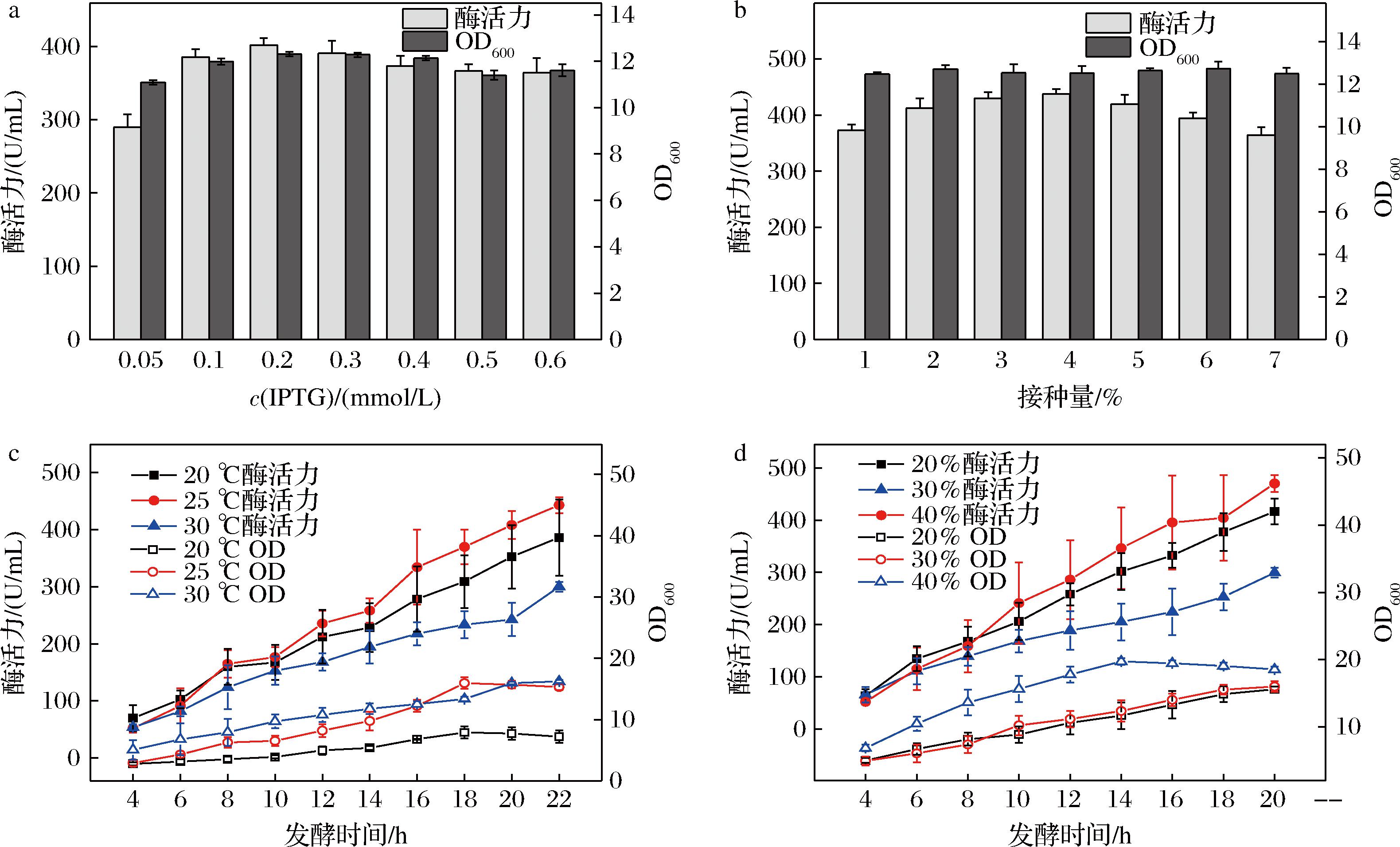
a-IPTG浓度;b-接种量;c-温度和时间;d-溶氧
图6 发酵罐中IPTG浓度、接种量、温度和时间和溶氧对发酵的影响
Fig.6 Effects of IPTG concentration, inoculation amount, induction temperature and time, and dissolved oxygen on fermentation in fermentation tank
2.4.2 接种量对重组菌生长状况和CA活力的影响
大肠杆菌的生长和代谢也受接种量的影响,合适的接种量对菌体的快速生长和发酵产物的合成有积极的作用。如图6-b所示,发酵罐的接种量对菌体量没有明显影响,接种量4%发酵18 h后CA的活力达到最大值。但当接种量过大时,CA活力下降,这可能是由于菌体浓度增长过快,过早进入稳定期,发酵液中溶解氧较低,抑制了CA的表达。随着接种量的增加,菌体浓度也增加,当接种量为6%时,菌体浓度达到最大。随着接种量的增加,菌体浓度开始下降,这可能是由于接种量较高时,发酵液中起始菌体浓度较高,培养基中营养成分消耗较快。综上,最佳接种量为4%。
2.4.3 发酵诱导温度和时间对重组菌生长状况和CA活力的影响
菌体的繁殖需要适宜的温度,过高或过低都会影响菌体的产酶活性和代谢,抑制菌体的生长。本实验将诱导温度温度分别控制在20、25、30 ℃,由图6-c可知,温度对CA活力有显著影响。温度过高和过低都会降低CA活力,在超过25 ℃时,下降明显。结果表明,重组菌株在高温和低温条件下都不适合发酵,因此确定25 ℃为最佳发酵温度。
如图6-c可知,菌体在发酵初期呈对数生长,中后期积累代谢产物,稳定生长后逐渐衰老。发酵液中的CA菌体量在18 h前随发酵时间的延长而增加,在18 h时达到最高。18 h后,菌体量开始下降,可能是由于营养供应不足所致。结果表明,最佳发酵时间为18 h。
2.4.4 DO浓度对重组菌生长状况和CA活力的影响
DO作为影响大肠杆菌发酵的一个重要因素已被广泛研究[21]。如图6-d所示,DO为40%时,充足的O2供应可以为CA的合成提供更多的能量,提高重组菌代谢的速度。由于O2量充足,在14 h时菌体量达到最大,后随着时间的增长,菌体逐渐降低,过高的DO水平会加速细胞的衰亡,可能与过量O2的毒性作用有关,也可能是出现自溶的现象。当DO在20%时,菌体生长速度较慢。在DO为30%时酶活力达到最高470.24 U/mL,在18 h菌体量也基本达到最大,因此,选择在30% DO条件下进行发酵。
通过对发酵罐培养条件的优化,确定在0.2 mmol/L IPTG、4%接种量、DO维持在30%、在25 ℃下诱导18 h进行发酵培养,CA活力可达到470.24 U/mL,经过计算得到CA比酶活力达到367.38 U/mg,与摇瓶培养条件下相比,CA活力得到显著提高,有利于在工业中实现放大生产。
3 结论与讨论
肌酐酶作为一种重要的体外诊断酶制剂,医学临床需求量大,但野生菌株产肌酐酶活性不稳定、产量低,工业放大难度大,这些因素限制了酶法检测肌酐技术的推广。为了提高肌酐酶的产量和稳定性,潘华平等[7]利用酵母表达系统通过酵母孢子微胶囊固定化肌酐酶,提高了酶活性和重复使用性;陶政宇等[6]在枯草芽孢杆菌胞外表达肌酐酶,比酶活力为238 U/mg;赵更峰等[22]分离得到一株节杆菌(Arthrobacter sp.)可产肌酐酶,经过多步纯化后比酶活力为209.10 U/mg。本文利用来源于P.putida的肌酐酶基因实现在大肠杆菌中外源表达,对重组工程菌的发酵培养基和发酵条件进行优化,首先在摇瓶培养水平上对发酵培养基营养成分种类和浓度进行了单因素优化,再通过BBD实验对各个因素进行响应面优化设计,得到发酵培养基的组成:葡萄糖10.30 g/L、酵母浸粉21.80 g/L、磷酸盐137.60 mmol/L、胰蛋白胨15.60 g/L,此时摇瓶培养肌酐酶的酶活力为401.76 U/mL。并在5 L发酵罐中,对发酵条件进行优化:接种量为4%,诱导温度为25 ℃,诱导时间为18 h,IPTG浓度为0.2 mmol/L,溶氧值控制在30%,菌体浓度与酶活力有了进一步的提升,经细胞破碎后,粗酶液中酶活力为470.24 U/mL,此时比酶活力达到367.38 U/mg,肌酐酶活性得到了明显提升,研究结果为之后的工业化提供了理论基础。
[1] OOSTERWIJK M M, DEN BRABER N, BAKKER S J L, et al.Urinary creatinine excretion is an indicator of physical performance and function[J].Journal of Cachexia, Sarcopenia and Muscle, 2022, 13(2):1431-1433.
[2] WANG Y, YANG Y Q, HU M, et al.Reference intervals for serum creatinine with jaffe’s method in healthy Chinese geriatric population[J].Clinical Laboratory, 2019, 65(11):2043-2048.
[3] INOUYE Y, MATSUDA Y, NAID T, et al.Purification and characterization of creatinine amidohydrolase of Alcaligenes origin[J].Chemical and Pharmaceutical Bulletin, 1986, 34(1):269-274.
[4] YAMAMOTO K, OKA M, KIKUCHI T, et al.Cloning of the creatinine amidohydrolase gene from Pseudomonas sp.PS-7[J].Bioscience, Biotechnology, and Biochemistry, 1995, 59(7):1331-1332.
[5] TANG T Y, WEN C J, LIU W H.Expression of the creatininase gene from Pseudomonas putida RS65 in Escherichia coli[J].Journal of Industrial Microbiology and Biotechnology, 2000, 24(1):2-6.
[6] 陶政宇, 付刚, 闻建平, 等.肌酐酶在枯草芽孢杆菌中的异源表达及分泌机制[J].化工进展, 2020, 39(4):1458-1468.
TAO Z Y, FU G, WEN J P, et al.Secretion exploration and heterologous expression of creatininase in Bacillus subtilis[J].Chemical Industry and Engineering Progress, 2020, 39(4):1458-1468.
[7] 潘华平, 中西秀树, 孔军, 等.Kre1Δ酿酒酵母孢子固定肌酐酶体系的构建及其酶学分析[J].食品与发酵工业, 2018, 44(2):1-7.
PAN H P, NAKANISHI H, KONG J, et al.Construction and analysis of creatininase encapsulated in Kre1Δ Saccharomyces cerevisiae yeast spores[J].Food and Fermentation Industries, 2018, 44(2):1-7.
[8] WU Q W, LI M Z, BILAL M, et al.Enhanced production of mycophenolic acid from Penicillium brevicompactum via optimized fermentation strategy[J].Applied Biochemistry and Biotechnology, 2022, 194(7):3001-3015.
[9] SU J F, CHENG C, MA F.Comparison of the NH4+-N removal ability by Klebsiella sp.FC61 in a bacterial suspension system and a bacterial immobilization system[J].Separation and Purification Technology, 2017, 172:463-472.
[10] ZHOU Y L, LU Z H, WANG X, et al.Genetic engineering modification and fermentation optimization for extracellular production of recombinant proteins using Escherichia coli[J].Applied Microbiology and Biotechnology, 2018, 102(4):1545-1556.
[11] SHU H, YULING L, ZHAO P H, et al.Optimization of dissolution and fermentation acid production of rhamnolipid-alkali-heat synergistic pretreatment of sludge[J].Chemosphere, 2022, 306:135607.
[12] SHI X J, XIE J C, LIAO S Y, et al.High-level expression of recombinant thermostable β-glucosidase in Escherichia coli by regulating acetic acid[J].Bioresource Technology, 2017, 241:795-801.
[13] 李星硕, 朱玥明, 管于平, 等.产胶原酶菌株的筛选鉴定、发酵优化及胶原酶纯化[J].微生物学报, 2016, 56(6):1034-1043.
LI X S, ZHU Y M, GUAN Y P, et al.Screening, identification and fermentation optimization of a collagenase-producing strain and purification of the collagenase[J].Acta Microbiologica Sinica, 2016, 56(6):1034-1043.
[14] NI H J, LYU S Y, SHENG Y T, et al.Optimization of fermentation conditions and medium compositions for the production of chrysomycin a by a marine-derived strain Streptomyces sp.891[J].Preparative Biochemistry &Biotechnology, 2021, 51(10):998-1003.
[15] QIU X H, GONG L Z, XIN X J, et al.Enhancement of emodin production by medium optimization and KH2PO4 supplementation in submerged fermentation of marine-derived Aspergillus favipes HN4-13[J].Marine Drugs, 2021, 19(8):421.
[16] KHALILVAND A B, AMINZADEH S, SANATI M H, et al.Media optimization for SHuffle T7 Escherichia coli expressing SUMO-Lispro proinsulin by response surface methodology[J].BMC Biotechnology, 2022, 22(1):1.
[17] SAKURAI T, MIZUNO S, MIYAHARA Y, et al.Optimization of culture conditions for secretory production of 3-hydroxybutyrate oligomers using recombinant Escherichia coli[J].Frontiers in Bioengineering and Biotechnology, 2022, 10:829134.
[18] 施慧, 穆晓清, 杨兴龙, 等.大肠杆菌NAD+合成关键酶的克隆表达及发酵优化[J].微生物学报, 2017, 57(7):1112-1125.
SHI H, MU X Q, YANG X L, et al.Cloning and expression of key enzymes for NAD+ synthesis and optimization of fermentation in Escherichia coli[J].Acta Microbiologica Sinica, 2017, 57(7):1112-1125.
[19] MALIK A, ALSENAIDY A M, ELROBH M, et al.Optimization of expression and purification of HSPA6 protein from Camelus dromedarius in E.coli[J].Saudi Journal of Biological Sciences, 2016, 23(3):410-419.
[20] LIPNI ANOV
ANOV S, LEGERSK
S, LEGERSK B, CHMELOV
B, CHMELOV D, et al.Optimization of an inclusion body-based production of the influenza virus neuraminidase in Escherichia coli[J].Biomolecules, 2022, 12(2):331.
D, et al.Optimization of an inclusion body-based production of the influenza virus neuraminidase in Escherichia coli[J].Biomolecules, 2022, 12(2):331.
[21] CHEN X, LIU L, LI J H, et al.Improved glucosamine and N-acetylglucosamine production by an engineered Escherichia coli via step-wise regulation of dissolved oxygen level[J].Bioresource Technology, 2012, 110:534-538.
[22] 赵更峰, 马晓航, 贾小明, 等.节杆菌肌酐水解酶的纯化及特性研究[J].生物工程学报, 2005, 21(2):250-253.
ZHAO G F, MA X H, JIA X M, et al.Purification and characteristics of creatininase from Arthrobacter sp[J].Chinese Journal of Biotechnology, 2005, 21(2):250-253.