海洋因其丰富的资源,被喻为“蓝色粮仓”,鱼类资源已经成为解决世界饥饿以及营养缺乏的重要支撑,全世界超过45亿人通过水产品摄入每日所需的大部分蛋白质[1],水产品正逐渐成为人类膳食的重要组成部分。2021年全国水产品总产量6 690.29万t,比2020年增长2%,渔业捕捞产量和水产养殖收成均呈现稳定增长状态[2]。水产品含有丰富的优质蛋白,从中摄取的蛋白质占人均摄入总动物蛋白质含量的20%[3];它是人类多不饱和脂肪酸的重要来源,多不饱和脂肪酸在人体健康中具有重要功能:提供热量、是脂溶性物质的载体[4]、保护心脏健康、清除血管中多余的脂类物质、调节免疫代谢等[5];另外,水产品口感特殊[6]、味道鲜美,广受消费者欢迎。
但水产品因其含水量较高,且富含营养物质,极易发生腐败变质,其中由腐败引起的损失在我国每年约800万t,高达总产量的15%[7],腐败的水产品体表黏液增多,肌肉变得松散,其品质大打折扣[8]。其中细菌是引发水产品腐败变质最主要的因素,致腐细菌可将水产品中的蛋白质、脂类等大分子逐渐分解成氨基酸、脂肪酸等小分子化合物,并生成胺类、硫化氢等有害物质,同时产生令人不愉快的气味。水产品品质与安全常用K值、挥发性盐基氮 (total volatile basic nitrogen,TVB-N)、生物胺等生化指标来衡量[9]。生物胺作为评价水产品品质与安全的指标之一,水产品中游离氨基酸经细菌产生的氨基酸脱羧酶脱羧作用后生成,包括组胺、腐胺、苯乙胺等8种,生物胺组胺作为对人类危害最大的一种生物胺,过量摄入会造成人类的食物中毒反应,包括腹泻、呕吐、头晕等[10]。美国食品药品管理局 (Food and Drug Administration,FDA)规定鱼类产品中的组胺限量为50 mg/kg,我国规定青皮红肉鱼类检测不得高于400 mg/kg,其余限量为200 mg/kg[11]。
水产品的腐败不仅严重影响了水产品的质量安全,还给水产品加工业造成了巨大的经济损失,因此,提高水产品的保鲜技术,减少水产品腐败是我国水产品加工行业亟需解决的问题之一。传统的防腐方法主要是化学保鲜,包括盐渍、酸渍、烟熏等,虽然抑制细菌生长的效果明显,杀菌效率高,但一些化学保鲜手段破坏了水产品品质,改变了水产品特有的鲜味和软嫩的口感,同时产生一定程度的化学残留,还会对环境造成污染[12]。物理保鲜技术也在水产品加工与贮藏中广泛使用,低温技术的应用使得水产品腐败这一研究领域取得突破性进展,但其费用昂贵,且耐冷腐败菌会变为特异性腐败菌,同样会导致水产品变色、降解和产生异味[13],且鱼与冰表面接触时容易造成鱼体机械损伤,不均匀的低温分布使得产生的冰晶大小不一,损伤肌原纤维[12];随着科技的发展,辐照保藏成为一种新兴的水产品保鲜手段,其具有穿透力强、效率高、营养物质不易流失等优点,但辐照技术的安全性一直是人们担心的问题,水产品在进行辐照过程中也会产生多种降解物质,这些物质的安全性有待验证[14];超高压技术可保持水产品本身的色泽和风味,但蛋白质会由于高压导致肌肉组织更紧密,促进蛋白质相互作用而发生变性[15]。
随着消费者日渐增长对食品安全以及健康的需求,化学及一些破坏营养成分的物理保鲜方法受到消费者的排斥,近年来,从植物中提取天然物质用于保障食品的质量和安全成为了研究趋势。目前,随着对细菌群体感应(quorum-sensing,QS)系统研究的不断深入,研究人员也逐渐关注到细菌QS在水产品腐败中发挥的作用,对其进行了大量的研究报道,试图阐明QS信号分子在水产品腐败中的作用机制,从分子水平上说明水产品腐败的原因,并以此为突破口,从致腐菌株QS角度抑制或减缓水产品腐败进程,为水产保鲜提供新路径。综上,有必要总结阐述致腐细菌群体感应信号系统调控水产品腐败变质的研究进展,以期对水产品保鲜工作提供必要研究信息。
1 细菌群体感应现象
细菌是高度密集的生物群体,QS是一种广泛存在于细菌之间的交流机制(图1),这种通讯机制可以调节细菌的一系列重要行为[12],它能使基因的表达与群体细胞密度同步[13],以此来调节细菌在环境中的适应能力,已知的受QS调控的行为有:生物发光[14]、质粒接合转移[15-16]、毒性基因表达[17]、色素合成[18-19]、细菌群游[20]、生物聚集行为[21]等。
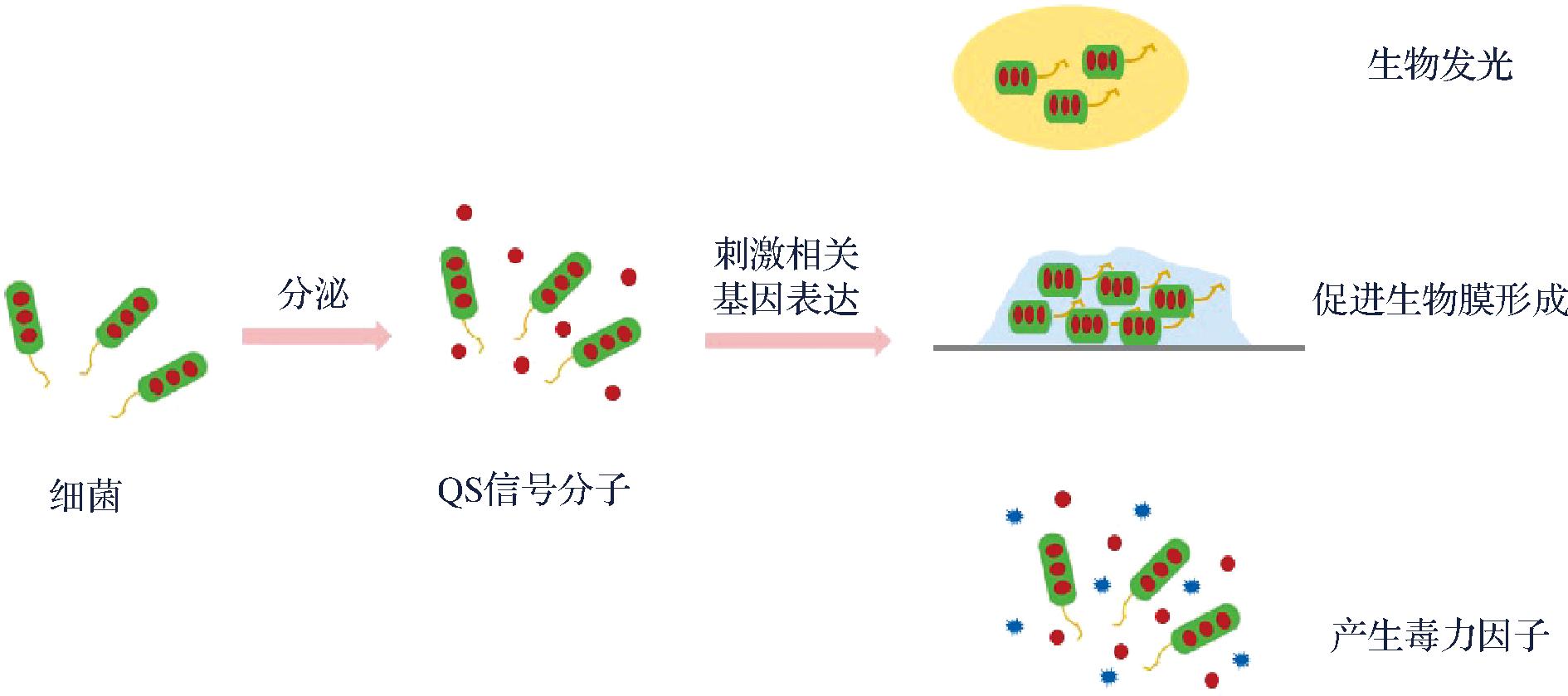
图1 细菌的QS现象
Fig.1 Bacterial quorum sensing (QS)
QS现象最初发现于一种名为哈维氏弧菌(Vibrio harveyi)的发光海洋细菌中,在研究中发现,哈维氏弧菌可以感受自身产生的信号分子,也可以感受到其他细菌产生的信号分子,当信号分子累积到一定程度,便会诱导哈维氏弧菌产生发光现象[22]。QS于1994年首次被TAKAYAMA等[23]提出并定义,研究人员如今将QS概述为:随着细菌的生长繁殖,大多数细菌可以产生一种诱导性质的信号分子,自诱导物的浓度随着细菌种群密度的增加逐渐增多,当这种自诱导物信号分子累积到一定浓度阈值时,便能够刺激或诱导相关基因的表达,从而使细菌展现出与低密度条件时截然不同的群体行为以及特性,以此来应对环境的变化[24-26]。QS系统基本都是由诱导器、信号合成酶、信号受体、信号相应调节器和调控基因五部分组成,细菌的种类不同,自诱导因子也有所区别(图2)。

a-革兰氏阴性菌;b-革兰氏阳性菌
图2 典型的革兰氏阴性菌和革兰氏阳性菌QS系统[33]
Fig.2 Typical QS system of Gram-negative bacteria and Gram-positive bacteria
革兰氏阳性菌大多分泌自诱导肽类信号分子(autoinducing peptides,AIPs)作为QS系统之间交流的化学信号分子[26],双组分组氨酸激酶(histidine kinase,HK)作为信号传感和转导模块[27],AIP是一种被修饰的寡肽,不能自由地跨细胞膜扩散,需要由双组分组氨酸激酶介导转运过程[28]。AIP信号系统是基于磷酸化/去磷酸化级联反应的,磷酸化级联反应产生的信号分子激活DNA结合蛋白,从而影响特定基因的转录,细菌将信号分子分泌到生存环境中,随着细菌的生长繁殖,信号分子在环境中累积的浓度越来越高,与信号识别系统相互识别,逐渐达到启动某个基因的阈值浓度,从而进行相应的生理调控[29-30]。
革兰氏阴性菌QS系统由自诱导合成酶(例:LuxM和 LuxI)和转录调节因子(例:LuxN和 LuxR)2部分组成[31],产生N-乙酰-L-高丝氨酸内酯(N-acyl homoserine lactones,AHLs)类自诱导因子[32],AHLs类自诱导因子由一个高丝氨酸内酯环和一个N-酰基侧链构成(图3),因为N-酰基侧链的碳原子个数各不相同[34],所以AHLs类自诱导因子种类丰富。若细菌通过LuxI/LuxR系统调控相关基因的表达,先由LuxI同源蛋白合成AHLs信号分子,通过自由扩散将其从细胞内运输到细胞外[35],当细胞外的AHLs信号分子达到一定的浓度阈值,会与受体蛋白LuxR结合形成复合物,与靶基因的启动子结合,刺激一系列基因的表达,产生相应的腐败所需毒力因子[36-37]。
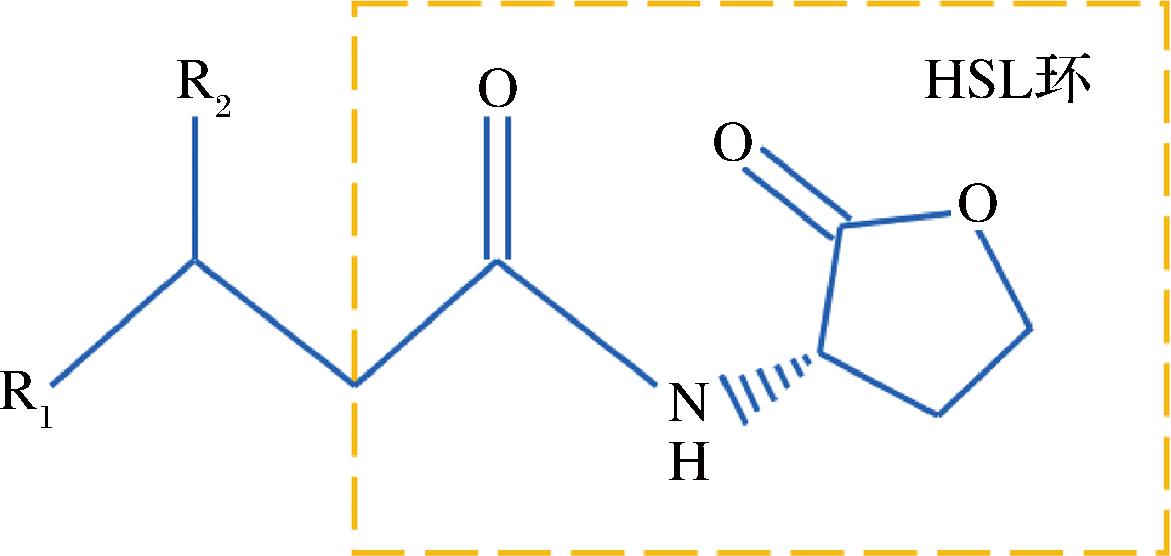
图3 酰基高丝氨酸内酯(AHLs)的化学分子结构
Fig.3 Chemical molecular structure of acyl homoserine lactones (AHLs)
除了典型的革兰氏阳性菌和革兰氏阴性菌中存在的QS系统外,由于天然细菌群落具有细菌多样性和空间结构性,有些细菌可以同时利用几个QS系统,通过截获其他QS系统产生的信号分子,也可以进行种间QS信息交流,使自己的相关基因得到表达[38],这些系统之间也有着错综复杂的联系,所以,考虑种间QS信号如何发挥作用显得尤为重要。研究发现,革兰氏阳性菌与革兰氏阴性菌之间能够利用呋喃硼酸二酯类自诱导物-2(autoinducer-2,AI-2)[39]作为信息交流的信号分子,其产生依赖于LuxS蛋白[40],信号分子由4,5 -二羟基- 2,3 -戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD)经LuxS酶催化合成,然后被LuxPQ蛋白跨膜转运到转录调节因子[31]。研究普遍认为,许多革兰氏阳性菌与革兰氏阴性菌均能够产生AI-2,这些QS信号分子是通用的,所以,它们也被称为LuxS/AI-2型信息系统[24]。此外,一些革兰氏阴性菌中尤其是海洋细菌会产生环二肽类(diketopiperazine,DKPs)自诱导因子,DKPs通过激活或抑制LuxR型蛋白而调节LuxR型QS[41]。铜绿假单胞菌(Pseudomonas aeruginosa)能够产生喹诺酮类信号分子[42]、扩散信号因子 (diffusible signaling factor,DSF)[43]等,并且刺激胞外多聚物(exo-polysaccharide,EPS)和其他毒力因子的产生[44]。
有的细菌存在QS现象,但是细菌自身并不产生引起QS的信号分子,这些细菌可以利用其他细菌分泌的QS信号分子来增强自身的集体行为,这种现象被称为窃听现象(图4)。群体细菌共同分享信号分子可以保持群体菌落的稳定,有一些细菌会因为窃听行为充分利用了QS信号分子而变成菌群中的优势菌种,波罗的海希瓦氏菌(Shewanella baltica)作为水产品中常见的致腐菌株,它可以窃听其他细菌产生的AHLs信号分子,使自身成为水产品中的优势致腐菌株,同时增强自身致腐能力[45]。细菌的窃听现象不止存在于不同菌种之间,同时存在于同种属之间,像腐败希瓦氏菌和波罗的海希瓦氏菌之间也存在窃听现象[45]。

图4 细菌QS系统窃听现象
Fig.4 Eavesdropping of bacterial QS system
2 群体感应系统与水产品腐败
2.1 QS对水产品腐败指标的影响
大多数水产品的腐败都是由致腐细菌的生长繁殖和代谢活动引起的,不同的贮存温度和加工方式会导致不同的腐败菌生长,希瓦氏菌、假单胞菌、肉食杆菌属、索丝菌属、发光杆菌属、不动杆菌、气单胞菌等均被报道作为不同水产品中的优势腐败菌株[46]。多项研究已证明许多参与水产品腐败的菌株能够分泌QS信号分子,这些信号分子在水产品腐败过程中不断积累并发挥形成生物膜、降解蛋白质和脂质等作用[47]。
ZHU等[48]采用生物报告实验、薄层层析和气相色谱-质谱联用技术对冷藏凡纳滨对虾腐败过程中的QS信号分子进行了检测,结果显示,存在3种类型的自诱导因子,AHLs、AI-2和DKPs均可能参与冷藏凡纳滨对虾的腐败变质;研究发现,外源AHLs提高了凡纳滨对虾中致腐细菌的生长速率和种群占比,外源性4,5-二羟基-2,3-戊二酮通过抑制竞争菌的生长提高了虾肉特定腐败菌的占比。GU等[49]从4 ℃贮藏的大黄鱼中分离出102株腐败菌,其中60株为希瓦氏菌,鉴定为大黄鱼的特异性腐败菌,从中检测出4种DKPs分子,通过添加这4种合成的DKPs,以TVB-N值作为腐败潜力的评价指标,结果表明,4种DKPs均对希瓦氏菌的致腐能力具有促进作用。罗未[50]测定了贮藏期间鲭鱼组胺呈累计上升趋势,并检测出一共含有3种DKPs信号分子,相关性分析结果显示,腐败指标生物胺的积累与DKPs信号分子变化趋势显著相关。
此外,QS系统可以调控水产品致腐菌株致腐基因的表达。RpoS是QS系统中一种重要的调节因子,参与许多病原体毒力因子的表达,LIU等[51]研究发现,RpoS通过调节胞外蛋白酶和灭菌三文鱼汁中TVB-N的产生来促进荧光假单胞菌的腐败,假单胞菌存在QS现象,其能够产生AHLs信号分子,通过构建了RpoS的缺失突变菌株以探索其在荧光假单胞菌中的功能,AHLs的产生和5个 AHLs 相关基因的转录水平与野生型菌株相比,RpoS突变体明显降低,所以QS通过刺激致腐基因的表达,加速了水产品的腐败变质。WANG等[52]运用全基因组测序分析方法揭示了大菱鲆的特定腐败菌荧光假单胞菌PF08的QS系统与其致腐性的关系,证明了QS系统诱导蛋白酶、生物膜、硫及生物胺的生成等致腐相关基因表达,阐明了QS系统在调控相关腐败基因时发挥的关键作用。
2.2 QS对生物膜生成的影响
水产品的腐败与致腐细菌生物膜的生成密不可分。生物膜通常被定义为附着在物体表面并包被在胞外聚合物基质中的高密度细菌团[53],生物膜细胞相对于单个细胞具有其独特的性质,包括对抗菌药物的耐受性增强、对外界环境的附着能力增强等,使得其难以从食品所处环境中去除[8]。由于生物膜的顽强性,导致其总是成为食源性疾病和食品腐败变质的潜在关键因素,生物膜通常含有高浓度的细胞,是QS细胞密度依赖的基因表达调控的重要组成部分[54-55]。细菌的QS现象有助于生物膜的形成、流动和物质的分泌以及提高生物膜抗菌治疗的能力[56-58]。AHLs影响食品腐败细菌和食源性致病菌对细胞外聚合物的初始附着和产生,是对生物膜形成影响最多的QS系统[59]。PARSEK等[13]研究表明,QS通过减少生物膜的主要胞外多糖之一的合成和诱导表面活性剂分子(鼠李糖脂)的合成,来促进铜绿假单胞菌生物被膜的分散。XIANG等[60]研究发现,荧光假单胞菌的QS现象调控与生物膜密切相关的胞外凝集素的产生,影响其基因表达,c-di-GMP是该水产品致腐菌株生物膜形成的关键调控因子,QS促进了该基因的表达,另外,由生物被膜表面蛋白表达的转录谱分析发现,大多数基因受到QS的调控。
2.3 QS相关基因对水产品腐败的影响
一个完整的QS系统离不开相关信号受体,为了通过抑制QS现象来抑制水产品的腐败,研究人员构建了相关接收QS信号的基因缺陷型菌株,将控制分泌QS信号受体的基因敲除,通过造成信号分子受体缺陷而无法被识别,进而使得QS系统的表达受阻。曾名湧教授团队通过同源重组技术构建了希瓦氏菌LuxR受体的缺陷菌株,希瓦氏菌LuxR基因敲除后,与野生型希瓦氏菌相比较,其生长没有受到明显影响,但是其致腐、产硫、QS窃听和感受外源信号分子的能力显著降低,减缓了凡纳滨对虾的腐败[61-62];朱耀磊等[63]用基因敲除构建了QS基因LuxRI缺失型菌株,与野生型相比,即食海参的蜂房哈夫尼菌H4(Hafnia alvei H4)失去分泌AHLs的能力,其生物膜的形成和泳动能力也明显减弱,研究结果表明QS相关基因对水产品腐败具有重要调控作用。
3 通过调控QS抑制水产品腐败
如图5所示,理论上的抑制QS途径包括抑制信号分子的生成、降解信号分子、阻止信号分子扩散、产生信号分子受体的竞争性受体以及产生与信号分子类似的信号分子去竞争受体等,可以达到上述目的化学物质被称为QS抑制剂(quorum-sensing inhibition,QSI)。QSI被认为是阻止腐败菌造成水产品腐败的有效替代手段,它能够阻断细胞间QS信号分子交流并抑制特定基因表达[56],通过阻断信号分子的产生、传播和与受体结合等来达到抑制腐败的产生[65]。
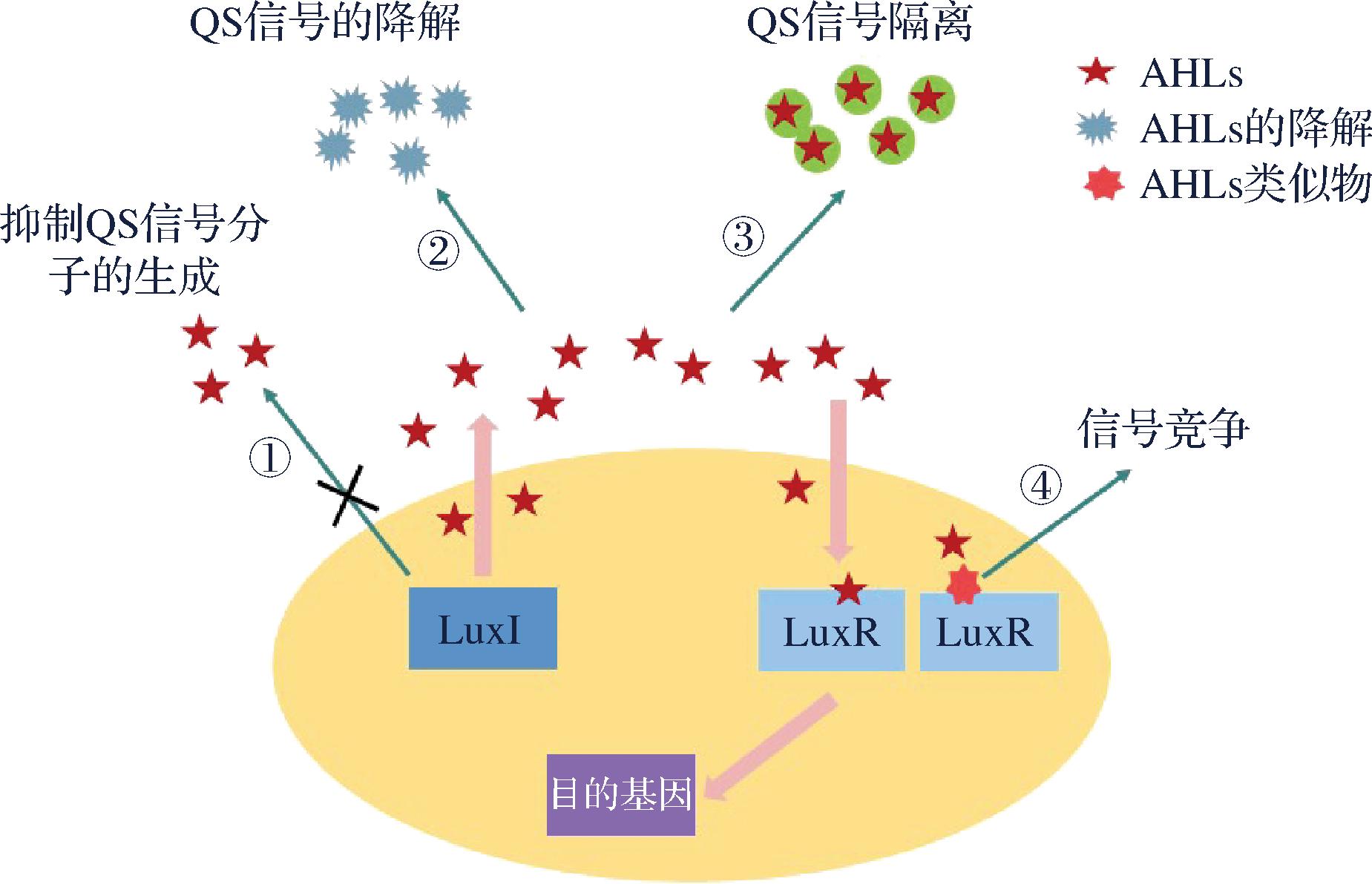
图5 抑制细菌QS现象的途径
Fig.5 Approaches to inhibit bacterial QS phenomenon[64]
注:①抑制QS信号分子的生成 ②降解信号分子 ③阻止信号分子扩散 ④产生与信号分子类似的信号分子去竞争受体。
3.1 植物提取物
研究发现,一些植物提取物具有延缓食品腐败、防止生物膜形成、降解生物膜等[27,66]功能,具有成为QSI的潜力(表1),研究报道,其中发挥主要抑制作用的功能成分包括酚类、醌类、黄酮类、生物碱类、萜类、聚乙炔类等[75-76]。柠檬油能够干扰AHLs介导的铜绿假单胞菌和嗜水气单胞菌(Aeromonas hydrophila)QS毒力因子的产生,影响其生物膜的形成[67],从而减缓了致腐细菌的群聚和生长,能够延长水产品的货架期;LI等[66]研究表明,肉桂醛显著抑制荧光假单胞菌的QS相关因子,在不干扰AHLs信号分子的基础上,可与LuxR型蛋白结合,使荧光假单胞菌QS依赖表型发生改变,从而影响荧光假单胞菌胞外蛋白酶的产生、游动和聚集运动以及生物膜的形成,并通过测定大菱鲆4 ℃贮藏期间TVB-N值的变化,证明了肉桂醛可以抑制大菱鲆贮藏期间TVB-N值的上升,有效抑制了大菱鲆的腐败进程;HUSAIN FOHAD等[69]研究称,薄荷油强烈干扰了AHLs调控的铜绿假单胞菌和嗜水气单胞菌毒力因子和生物被膜的形成,使得AHLs介导的紫色杆菌素产量呈剂量依赖性降低,致腐菌株的生长均不受影响,分子对接结果证明薄荷醇具有QSI的特性;ZHU等[68]研究指出,绿茶多酚类物质可引起大黄鱼中波罗的海希瓦氏菌QS系统AI-2分子的降解,同时降低了DKPs的活性,并且腐败指标三甲胺的生成也随之减少;VASAVI等[70]研究了从番石榴中提取的黄酮组分对铜绿假单胞菌的菌落群体运动和生物膜的形成的影响,采用紫色杆菌CV026生物传感器法测定番石榴叶黄酮的抗QS活性,通过评估紫色杆菌素产生的反应,结果表明,黄酮组分通过干扰AHLs信号的反应来抑制QS,但并不抑制细菌的生长和AHLs的合成;HUSAIN FOHAD等[71]的实验结果表明,芒果叶的甲醇提取物可以使得AHLs信号分子含量显著降低,细菌的生长却不受影响,扫描电镜结果显示,还破坏了铜绿假单胞菌胞外多糖的合成,从而影响其生物膜的形成,除了生物膜的生成受到影响外,芒果叶的甲醇提取物对受QS调控的多个性状均表现出了抑制作用,表明其通过QS干扰可能具有多靶点的广谱活性;从柚子皮中筛选到的QS抑制活性物质鉴定为柚皮苷类化合物,计算机模拟显示,柚皮苷类化合物与QS受体LasR/LuxR结合稳定,使得信号分子无法与受体结合,从而达到了抑制细菌的QS现象的目的[67]。
表1 植物源提取物调控QS及其抑制水产品腐败作用
Table 1 Regulation of QS by plant extracts and its inhibition of aquatic products corruption

植物来源提取物实验菌株QS的调控环节结果参考文献柠檬柠檬油铜绿假单胞菌干扰AHLs产生延长水产品货架期[67]肉桂皮肉桂醛荧光假单胞菌结合LuxR型蛋白降低TVB-N值[66]绿茶茶多酚波罗的海希瓦氏菌降解AI-2分子、降低DKPs活性减少三甲胺生成[68]薄荷薄荷油嗜水气单胞菌减少AHLs产生减缓生物膜的生成[69]番石榴黄酮组分铜绿假单胞菌干扰AHLs信号反应 减缓菌株泳动能力[70]芒果叶甲醇提取物铜绿假单胞菌降低AHLs含量破坏胞外多糖的合成[71]柚子皮柚皮苷类化合物铜绿假单胞菌结合LasR/LuxR受体延缓细菌生长[67]芸香科植物香草素蜂房哈夫尼菌与AHLs受体结合干扰生物膜形成[72]唇形科植物迷迭香酸铜绿假单胞菌与QS调节因子RhlR结合增加蛋白酶的产生[73]连翘连翘提取物气单胞菌与LasR受体蛋白竞争性结合抑制细菌运动能力[74]
3.2 植物提取物
群体淬灭是指通过使用生物或者非生物因素降解信号分子从而干扰QS,阻断细胞间的通讯交流,信号降解可以通过改变菌落生存环境的化学特性来实现,如改变其pH;也可以是来自细菌或动物产生的酶的作用,已知AHLs降解酶的2种主要类型是乳糖酶和酰化酶[77],乳糖酶水解AHLs的HSL环进而生成相应的酰基胡桃苷,酰化酶切割AHLs的酰胺键生成相应的脂肪酸和高丝氨酸内酯[78]。JIE等[61]文章显示,来自芽孢杆菌属(Bacillus sp.)新型高丝氨酸内酯酶(AHLs内酯酶)通过水解AHLs的内酯键来降低AHLs的活性,淬灭了QS信号分子,显著降低了水产品优势腐败菌的致腐能力。
4 结论与展望
伴随人们日益增长的水产品摄入需求,减少水产品腐败变质成为水产品加工领域重点研究方向之一。本文从致腐细菌引发水产品中腐败变质的角度出发,详细介绍了菌株QS系统的分类及其相关的作用机制,阐述了已开展的研究中如何从细菌QS环节抑制水产品腐败现象,并对相关QSI使用情况和作用效果的研究进展进行了总结。
从QS角度出发研究细菌引发的水产品腐败变质尚处于初步阶段,研究人员仍旧需要对细菌QS系统及其产生何种QS信号分子、不同QS信号分子如何调控细菌致腐能力做更深一步的研究;其次,绿色来源的QSI作为延缓水产品腐败变质、保障水产品品质安全的重要新型抑菌保鲜剂,其作用机理、提取的规模化制备以及使用稳定性等方面都需要开展更深一步的研究。目前,对于水产品致腐菌株QSI的研究仍停留在实验环境中,如何将理论实验结果运用到实际生产中同样面临挑战。但伴随系统生物学、食品组学、生物信息学、合成生物学等领域的发展,相信未来可以更好地阐明基于细菌QS系统的水产品腐败变质机制,为水产品品质与安全控制提供新的理论基础与技术支撑。
[1] Food and Griculture Organization of the United Nations.The State of World Fisheries and Aquaculture 2022:Towards Blue Transformation [M].Rome:FAO, 2022.
[2] 王丹, 吴反修, 农业农村部渔业渔政管理局, 等.中国渔业统计年鉴.2022[M].北京:中国农业出版社, 2022:2-10.
[3] 钱韻芳, 林婷.水产品中微生物相互作用机制研究进展[J].生物加工过程, 2020, 18(2):150-157.
QIAN Y F, LIN T.Advances in microbial community interactions in aquatic products[J].Chinese Journal of Bioprocess Engineering, 2020, 18(2):150-157.
[4] TIMILSENA Y P, WANG B, ADHIKARI R, et al.Advances in microencapsulation of polyunsaturated fatty acids (PUFAs)-rich plant oils using complex coacervation:A review[J].Food Hydrocolloids, 2017, 69:369-381.
[5] GONZ LEZ A, MART
LEZ A, MART NEZ M L, PAREDES A J, et al.Study of the preparation process and variation of wall components in chia (Salvia hispanica L.) oil microencapsulation[J].Powder Technology, 2016, 301:868-875.
NEZ M L, PAREDES A J, et al.Study of the preparation process and variation of wall components in chia (Salvia hispanica L.) oil microencapsulation[J].Powder Technology, 2016, 301:868-875.
[6] QIU L Q, ZHANG M, BHANDARI B, et al.Shelf life extension of aquatic products by applying nanotechnology:A review[J].Critical Reviews in Food Science and Nutrition, 2022, 62(6):1521-1535.
[7] 蓝蔚青, 郎艾, 梅俊, 等.植物精油对微生物作用机制及在鱼类保鲜中的应用研究进展[J].食品与发酵工业, 2021, 47(13):296-302.
LAN W Q, LANG A, MEI J, et al.Research progress on the action mechanism of plant essential oils on microorganisms and its application in the preservation of fish products[J].Food and Fermentation Industries, 2021, 47(13):296-302.
[8] GALIÉ S, GARC A-GUTIÉRREZ C, MIGUÉLEZ E M, et al.Biofilms in the food industry:Health aspects and control methods[J].Frontiers in Microbiology, 2018, 9:898.
A-GUTIÉRREZ C, MIGUÉLEZ E M, et al.Biofilms in the food industry:Health aspects and control methods[J].Frontiers in Microbiology, 2018, 9:898.
[9] MCGLACKEN G P, MCSWEENEY C M, O’BRIEN T, et al.Synthesis of 3-halo-analogues of HHQ, subsequent cross-coupling and first crystal structure of Pseudomonas quinolone signal (PQS)[J].Tetrahedron Letters, 2010, 51(45):5919-5921.
[10] KULEY E, YAVUZER M N, YAVUZER E, et al.Inhibitory effects of safflower and bitter melon extracts on biogenic amine formation by fish spoilage bacteria and food borne pathogens[J].Food Bioscience, 2019, 32:100478.
[11] ZHANG X, FANG C L, HUANG D M, et al.Determination of 8 biogenic amines in aquatic products and their derived products by high-performance liquid chromatography-tandem mass spectrometry without derivatization[J].Food Chemistry, 2021, 361:130044.
[12] BA ARAN T I, BERBER D, GÖKALS
ARAN T I, BERBER D, GÖKALS N B, et al.Extremophilic Natrinema versiforme against Pseudomonas aeruginosa quorum sensing and biofilm[J].Frontiers in Microbiology, 2020, 11:79.
N B, et al.Extremophilic Natrinema versiforme against Pseudomonas aeruginosa quorum sensing and biofilm[J].Frontiers in Microbiology, 2020, 11:79.
[13] PARSEK M R, GREENBERG E P.Sociomicrobiology:The connections between quorum sensing and biofilms[J].Trends in Microbiology, 2005, 13(1):27-33.
[14] MACHADO I, SILVA L R, GIAOURIS E D, et al.Quorum sensing in food spoilage and natural-based strategies for its inhibition[J].Food Research International, 2020, 127:108754.
[15] FAZLI M, ALMBLAD H, RYBTKE M L, et al.Regulation of biofilm formation in Pseudomonas and Burkholderia species[J].Environmental Microbiology, 2014, 16(7):1961-1981.
[16] WHITELEY M, DIGGLE S P, GREENBERG E P.Progress in and promise of bacterial quorum sensing research[J].Nature, 2017, 551(7680):313-320.
[17] SOLANO C, ECHEVERZ M, LASA I.Biofilm dispersion and quorum sensing[J].Current Opinion in Microbiology, 2014, 18:96-104.
[18] CHONG G, KIMYON O, RICE S A, et al.The presence and role of bacterial quorum sensing in activated sludge[J].Microbial Biotechnology, 2012, 5(5):621-633.
[19] EL SAHILI A, LI S Z, LANG J, et al.A pyranose-2-phosphate motif is responsible for both antibiotic import and quorum-sensing regulation in Agrobacterium tumefaciens[J].PLoS Pathogens, 2015, 11(8):e1005071.
[20] MHEDBI-HAJRI N, YAHIAOUI N, MONDY S, et al.Transcriptome analysis revealed that a quorum sensing system regulates the transfer of the pAt megaplasmid in Agrobacterium tumefaciens[J].BMC Genomics, 2016, 17(1):1-14.
[21] YANG Q A, DEFOIRDT T.Quorum sensing positively regulates flagellar motility in pathogenic Vibrio harveyi[J].Environmental Microbiology, 2015, 17(4):960-968.
[22] SALINI R, PANDIAN S K.Interference of quorum sensing in urinary pathogen Serratia marcescens by Anethum graveolens[J].Pathogens and Disease, 2015, 73(6):ftv038.
[23] TAKAYAMA Y, KATO N.In vitro analysis of essential binding sites on the promoter of the Serratia marcescens spn operon with the quorum-sensing receptor SpnR[J].Biotechnology and Bioengineering, 2016, 113(11):2513-2517.
[24] REMUZGO-MART NEZ S, L
NEZ S, L ZARO-D
ZARO-D EZ M, MAYER C, et al.Biofilm formation and quorum-sensing-molecule production by clinical isolates of Serratia liquefaciens[J].Applied and Environmental Microbiology, 2015, 81(10):3306-3315.
EZ M, MAYER C, et al.Biofilm formation and quorum-sensing-molecule production by clinical isolates of Serratia liquefaciens[J].Applied and Environmental Microbiology, 2015, 81(10):3306-3315.
[25] REN T T, LI X Y, YU H Q.Effect of N-acy-l-homoserine lactones-like molecules from aerobic granules on biofilm formation by Escherichia coli K12[J].Bioresource Technology, 2013, 129:655-658.
[26] GREENBERG E P, HASTINGS J W, ULITZUR S.Induction of luciferase synthesis in Beneckea harveyi by other marine bacteria[J].Archives of Microbiology, 1979, 120(2):87-91.
[27] FUQUA W C, WINANS S C, GREENBERG E P.Quorum sensing in bacteria:The LuxR-LuxI family of cell density-responsive transcriptional regulators[J].Journal of Bacteriology, 1994, 176(2):269-275.
[28] 陈邦会. 草鱼耐冷特定腐败菌中AHLs类群体信号分泌及姜黄素脂质体抑制作用[D].扬州:扬州大学, 2020:15-30.
CHEN B H.The AHLs quorum signal secretion and the curcumin liposome inhibition effect of the specific psychrotroph spoilage bacteria in grass carp[D].Yangzhou:Yangzhou University, 2020:15-30.
[29] 郑义, 郭世英, 隋凤翔, 等.群体感应系统在合成生物学中的应用[J].中国生物工程杂志, 2021, 41(11):100-109.
ZHENG Y, GUO S Y, SUI F X, et al.Applications of quorum sensing systems in synthetic biology[J].China Biotechnology, 2021, 41(11):100-109.
[30] 励建荣, 李婷婷, 王当丰.微生物群体感应系统及其在现代食品工业中应用的研究进展[J].食品科学技术学报, 2020, 38(1):1-11.
LI J R, LI T T, WANG D F.Research progress on microbial quorum sensing system and its application in modern food industry[J].Journal of Food Science and Technology, 2020, 38(1):1-11.
[31] NAZZARO F, FRATIANNI F, COPPOLA R.Quorum sensing and phytochemicals[J].International Journal of Molecular Sciences, 2013, 14(6):12607-12619.
[32] LI Y H, TIAN X L.Quorum sensing and bacterial social interactions in biofilms[J].Sensors, 2012, 12(3):2519-2538.
[33] WU S B, LIU J H, LIU C J, et al.Quorum sensing for population-level control of bacteria and potential therapeutic applications[J].Cellular and Molecular Life Sciences, 2020, 77(7):1319-1343.
[34] WITHERS H, SWIFT S, WILLIAMS P.Quorum sensing as an integral component of gene regulatory networks in Gram-negative bacteria[J].Current Opinion in Microbiology, 2001, 4(2):186-193.
[35] 周丽曼. 革兰氏阴性菌群体感应抑制剂的筛选与活性评价[D].青岛:中国海洋大学, 2013.
ZHOU L M.Screening and activity evaluation of Gram-negative bacteria quorum sensing inhibitors[D].Qingdao:Ocean University of China, 2013.
[36] WATERS C M, BASSLER B L.Quorum sensing:Cell-to-cell communication in bacteria[J].Annual Review of Cell and Developmental Biology, 2005, 21:319-346.
[37] PRESCOTT R D, DECHO A W.Flexibility and adaptability of quorum sensing in nature[J].Trends in Microbiology, 2020, 28(6):436-444.
[38] SHAN T B, MAJERCZYK CHARLOTTE D, DA SILVA DANIEL P, et al.Quorum sensing influences Burkholderia thailandensis biofilm development and matrix production[J].Journal of Bacteriology, 2016, 198(19):2643-2650.
[39] PASSOS DA SILVA D, SCHOFIELD M C, PARSEK M R, et al.An update on the sociomicrobiology of quorum sensing in gram-negative biofilm development[J].Pathogens, 2017, 6(4):51.
[40] LI T T, MEI Y L, HE B B, et al.Reducing quorum-sensing-mediated virulence factor expression and biofilm formation in Hafnia alvei by using the potential quorum-sensing inhibitor L-carvone[J].Fronties in Microbiology, 2019, 9:3324.
[41] GALLOWAY W R J D, HODGKINSON J T, BOWDEN S D, et al.Quorum sensing in Gram-negative bacteria:Small-molecule modulation of AHL and AI-2 quorum sensing pathways[J].Chemical Reviews, 2011, 111(1):28-67.
[42] HAWVER L A, JUNG S A, NG W L.Specificity and complexity in bacterial quorum-sensing systems[J].FEMS Microbiology Reviews, 2016, 40(5):738-752.
[43] ZHAO J, QUAN C S, JIN L M, et al.Production, detection and application perspectives of quorum sensing autoinducer-2 in bacteria[J].Journal of Biotechnology, 2018, 268:53-60.
[44] 黄旭镇. 大黄鱼特定腐败菌波罗的海希瓦氏菌QS系统的鉴定及茶多酚调控研究[D].杭州:浙江工商大学, 2015.
HUANG X Z.Identification of quorum sensing system in sso Shewanella baltica from Pseudosciaena crocea and interference of its qs-related spoilage by tea polyphenols[D].Hangzhou:Zhejiang Gongshang University, 2015.
[45] TOMMONARO G, ABBAMONDI G R, IODICE C, et al.Diketopiperazines produced by the halophilic archaeon, Haloterrigena hispanica, activate AHL bioreporters[J].Microbial Ecology, 2012, 63(3):490-495.
[46] 王岩, 于雅萌, 张静静, 等.海洋微生物群体感应与群体感应淬灭的开发利用[J].生物资源, 2017, 39(6):413-422.
WANG Y, YU Y M, ZHANG J J, et al.Exploitation and application of quorum sensing and quorum quenching in marine microorganisms[J].Biotic Resources, 2017, 39(6):413-422.
[47] SRIVASTAVA D, WATERS C M.A tangled web:Regulatory connections between quorum sensing and cyclic Di-GMP[J].Journal of Bacteriology, 2012, 194(17):4485-4493.
[48] ZHU S Q, WU H H, ZHANG C L, et al.Spoilage of refrigerated Litopenaeus vannamei:Eavesdropping on acinetobacter acyl-homoserine lactones promotes the spoilage potential of Shewanella baltica[J].Journal of Food Science and Technology, 2018, 55(5):1903-1912.
[49] GU Q Q, FU L L, WANG Y B, et al.Identification and characterization of extracellular cyclic dipeptides as quorum-sensing signal molecules from Shewanella baltica, the specific spoilage organism of Pseudosciaena crocea during 4 ℃ storage[J].Journal of Agricultural and Food Chemistry, 2013, 61(47):11645-11652.
[50] 罗未. 群体感应信号分子DKPs介导的鲭鱼腐败关联生物胺调控机制研究[D].杭州:浙江工商大学, 2022.
LUO W.Regulation of biogenic amines associated with spoilage in mackerel mediated by quorum sensing signal molecules DKPs[D].Hangzhou:Zhejiang Gongshang University, 2022.
[51] LIU X X, JI L, WANG X, et al.Role of RpoS in stress resistance, quorum sensing and spoilage potential of Pseudomonas fluorescens[J].International Journal of Food Microbiology, 2018, 270:31-38.
[52] WANG D F, CUI F C, REN L K, et al.Complete genome analysis reveals the quorum sensing-related spoilage potential of Pseudomonas fluorescens PF08, a specific spoilage organism of turbot (Scophthalmus maximus)[J].Frontiers in Microbiology, 2022, 13:856802.
[53] 王亚会, 王锡昌, 王帅, 等.水产品新鲜及腐败程度的评价指标[J].食品与发酵工业, 2015, 41(10):240-246.
WANG Y H, WANG X C, WANG S, et al.Advances in freshness and corruption of aquatic product[J].Food and Fermentation Industries, 2015, 41(10):240-246.
[54] ODEYEMI O A, ALEGBELEYE O O, STRATEVA M, et al.Understanding spoilage microbial community and spoilage mechanisms in foods of animal origin[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(2):311-331.
[55] 郭红. 凡纳滨对虾特定腐败菌中AHLs介导的群体感应与调控的初步研究[D].青岛:中国海洋大学, 2010.
GUO H.Quorum sensing and regulation mechanism of litopenaeus vannamei spoilage bacteria mediated by AHLs[D].Qingdao:Ocean University of China, 2010.
[56] ZHU S Q, WU H H, ZENG M Y, et al.The involvement of bacterial quorum sensing in the spoilage of refrigerated Litopenaeus vannamei[J].International Journal of Food Microbiology, 2015, 192:26-33.
[57] COSTERTON J W, CHENG K J, GEESEY G G, et al.Bacterial biofilms in nature and disease[J].Annual Review of Microbiology, 1987, 41:435-464.
[58] BORGES A, ABREU A, DIAS C, et al.New perspectives on the use of phytochemicals as an emergent strategy to control bacterial infections including biofilms[J].Molecules, 2016, 21(7):877.
[59] LU L, HU W, TIAN Z R, et al.Developing natural products as potential anti-biofilm agents[J].Chinese Medicine, 2019, 14(1):11.
[60] XIANG Y T, DING Y, CAO J, et al.Non-antibiotic methods against Pseudomonas aeruginosa include QS inhibitors:A narrative review[J].Annals of Palliative Medicine, 2021, 10(6):6926-6935.
[61] JIE J X, YU H L, HAN Y Y, et al.Acyl-homoserine-lactones receptor LuxR of Shewanella baltica involved in the development of microbiota and spoilage of refrigerated shrimp[J].Journal of Food Science and Technology, 2018, 55(7):2795-2800.
[62] 韩云燕, 李渐鹏, 于红雷, 等.luxR基因对希瓦氏菌群体感应特性的影响研究[J].食品科技, 2019, 44(3):27-32.
HAN Y Y, LI J P, YU H L, et al.Effect of luxR gene on the quorum-sensing characteristics of Shewanella baltica[J].Food Science and Technology, 2019, 44(3):27-32.
[63] 朱耀磊, 侯红漫, 张公亮, 等.蜂房哈夫尼菌群体感应对其生物膜及泳动性的调控作用[J].食品科学, 2020, 41(14):169-174.
ZHU Y L, HOU H M, ZHANG G L, et al.Regulation of quorum sensing on biofilm formation and swimming motility in Hafnia alvei[J].Food Science, 2020, 41(14):169-174.
[64] LAMIN A, KAKSONEN A H, COLE I S, et al.Quorum sensing inhibitors applications:A new prospect for mitigation of microbiologically influenced corrosion[J].Bioelectrochemistry, 2022, 145:108050.
[65] ALLEN R C, POPAT R, DIGGLE S P, et al.Targeting virulence:Can we make evolution-proof drugs?[J].Nature Reviews Microbiology, 2014, 12(4):300-308.
[66] LI T T, WANG D F, LIU N, et al.Inhibition of quorum sensing-controlled virulence factors and biofilm formation in Pseudomonas fluorescens by cinnamaldehyde[J].International Journal of Food Microbiology, 2018, 269:98-106.
[67] LUCIARDI M C, BL ZQUEZ M A, ALBERTO M R, et al.Lemon oils attenuate the pathogenicity of Pseudomonas aeruginosa by quorum sensing inhibition[J].Molecules, 2021, 26(10):2863.
ZQUEZ M A, ALBERTO M R, et al.Lemon oils attenuate the pathogenicity of Pseudomonas aeruginosa by quorum sensing inhibition[J].Molecules, 2021, 26(10):2863.
[68] ZHU J L, HUANG X Z, ZHANG F, et al.Inhibition of quorum sensing, biofilm, and spoilage potential in Shewanella baltica by green tea polyphenols[J].Journal of Microbiology, 2015, 53(12):829-836.
[69] HUSAIN FOHAD M, IQBAL A, KHAN MOHAMMAD S, et al.Sub-MICs of Mentha piperita essential oil and menthol inhibits AHL mediated quorum sensing and biofilm of Gram-negative bacteria[J].Frontiers in Microbiology, 2015, 6:420.
[70] VASAVI H S, ARUN A B, REKHA P D.Anti-quorum sensing activity of Psidium guajava L.flavonoids against Chromobacterium violaceum and Pseudomonas aeruginosa PAO1[J].Microbiology and Immunology, 2014, 58(5):286-293.
[71] HUSAIN FOHAD M, AHMAD I, AL-THUBIANI A S, et al.Leaf extracts of Mangifera indica L.inhibit quorum sensing-regulated production of virulence factors and biofilm in test bacteria[J].Frontiers in Microbiology, 2017, 8:727.
[72] LI T T, HE B B, MEI Y C, et al.Inhibitory effect of vanillin on the virulence factors and biofilm formation of Hafnia alvei[J].LWT, 2019, 102:223-229.
[73] CORRAL-LUGO A, DADDAOUA A, ORTEGA A, et al.Rosmarinic acid is a homoserine lactone mimic produced by plants that activates a bacterial quorum-sensing regulator[J].Science Signaling, 2016, 9(409):eaaa8271.
[74] 许腾腾, 赵慧娟, 刘尊英.连翘提取物对嗜水气单胞菌群体感应系统的影响[J].微生物学通报, 2022, 49(1):256-269.
XU T T, ZHAO H J, LIU Z Y.Effect of Forsythia suspensa extract on quorum sensing system of Aeromonas hydrophila[J].Microbiology China, 2022, 49(1):256-269.
[75] HUBER B, EBERL L, FEUCHT W, et al.Influence of polyphenols on bacterial biofilm formation and quorum-sensing[J].Zeitschrift Fur Naturforschung C, Journal of Biosciences,2003, 58(11-12):879-884.
[76] RIEDEL K, KÖTHE M, KRAMER B, et al.Computer-aided design of agents that inhibit the cep quorum-sensing system of Burkholderia cenocepacia[J].Antimicrobial Agents and Chemotherapy, 2006, 50(1):318-323.
[77] DONG Y H, WANG L H, XU J L, et al.Quenching quorum-sensing-dependent bacterial infection by an N-acyl homoserine lactonase[J].Nature, 2001, 411(6839):813-817.
[78] LIN Y H, XU J L, HU J Y, et al.Acyl-homoserine lactone acylase from Ralstonia strain XJ12B represents a novel and potent class of quorum-quenching enzymes[J].Molecular Microbiology, 2003, 47(3):849-860.