海洋包含范围广泛的栖息地以及丰富的生物多样性[1]。据《联合国海洋法公约》划分,我国不仅是陆地大国,更是海洋大国[2]。随着人们生活水平的提高,我国水产品进出口量大幅增长,由此产生大量的鱼皮、鱼骨、鱼鳔等副产物,其中只有小部分鱼皮被制成廉价的饲料或肥料,经济效益低,大部分副产物则直接被丢弃,这不仅对环境造成严重的影响,同时导致鱼副产品综合利用率降低,不利于可持续发展[3-4]。针对这一现状,水产资源的研究开发逐渐成为研究重点,如研究者们从尼罗罗非鱼皮[5]、鳕鱼皮[6]、大型黄鱼皮[1]等多种鱼皮中成功提取胶原蛋白及胶原蛋白肽,据实验研究表明可以用于医药、生物材料、食品、化妆品等行业。
1 胶原蛋白
胶原蛋白属于生物大分子,广泛存在于哺乳动物的肌肉、皮肤、骨骼等结缔组织中[7]。从类型上看,目前已有29种不同类型的胶原蛋白被发现,其中最常见的为Ⅰ型胶原蛋白,占整体胶原蛋白的90%[8]。蛋白质的结构由3个氨基酸α链构成,α链的基本结构为Gly-X-Y。由于胶原蛋白稳定的三螺旋结构,使其具有良好的生物相容性和优异的降解性,因此被广泛应用于医药、生物材料、食品、化妆品等行业[9-10]。
传统的胶原蛋白来源主要包括猪、牛等动物的皮肤、肌肉以及骨骼等。然而,由于宗教文化以及可能的病毒传播等风险,此类胶原蛋白是否适用于医药、食品以及化妆品等行业有待商榷[11-12]。而大多水产动物则没有宗教的限制,且相对于陆生动物而言,水产动物中胶原蛋白的含量较为丰富,同时由于水产动物胶原蛋白因其氨基酸组成等方面的不同,使其具有低抗原性、低过敏性等优点[13-14]。
然而,由于大分子质量的胶原蛋白不易被人体很好的吸收利用,因此需要通过化学、酶或微生物发酵的方法,将胶原蛋白水解为更易被人体吸收利用的胶原蛋白肽,进而发挥相应作用[15]。胶原蛋白肽是一种由2个或2个以上氨基酸组成的介于胶原蛋白和氨基酸之间的一种肽化合物。研究表明,单个氨基酸分子质量一般在100 Da左右,二肽及三肽被称为寡肽,由于分子质量较小,在人体中短时间内即可进入血液进而被人体吸收,吸收率较好。低聚肽即小分子肽,又称小分子活性肽,分子质量一般在1 kDa以下,由2~10个氨基酸组成,同样也能较好的被人体所吸收利用,具有降血压、降血糖、抗氧化等多种活性。多肽的分子质量一般在1~3或3 kDa以上,一般含有10~30个或30个以上的氨基酸,其吸收率以及生物活性与低分子质量的肽相比,效果不显著[16]。
本文将从胶原蛋白以及明胶出发,对其药用价值进行阐述,并对胶原蛋白的制备、分离纯化进行概述。
1.1 鱼皮中胶原蛋白的提取
由于胶原蛋白优异的生物相容性和降解性,一般可以通过酸碱、酶、热水等方法提取胶原蛋白(优缺点见表1),目前常见的提取流程为预处理、提取、纯化、冻干储存。
表1 酸碱法、酶法、热水法比较
Table 1 Comparison of acid-base method, enzyme method and hot water method

方法优点缺点酸碱提取法酸法采用低浓度酸,条件较为温和,三螺旋结构保存较好当采用碱法提取水解比较严重时,易产生有毒的D-型氨基酸,易破坏蛋白质结构。酸碱提取均可能造成有机试剂残留酶提取法条件较温和,不损失营养价值,几乎无有毒试剂残留,所得胶原蛋白性质稳定灭活不彻底影响后续使用,单一酶水解速度缓慢热水提取法操作简单,速度快温度过高,蛋白质变性,不适用于医药产业,且提取率不高
1.1.1 鱼皮的预处理
即使鱼皮中含有丰富的胶原蛋白,但仍含有少量的脂肪、杂蛋白和钾、钙、镁等矿物质[17],因此在正式提取胶原蛋白之前,需要对鱼皮进行预处理,将鱼皮中杂蛋白、脂肪、色素等物质先去除掉,防止对胶原蛋白的提取率、纯度造成间接或直接的影响[18]。目前常用的预处理方法是采用NaOH和丁醇对鱼皮组织进行预处理[19]。然而当采用单一化学试剂或多种试剂共同使用时,易造成试剂残留的情况,这会导致提取的胶原蛋白纯度降低,甚至彻底破坏胶原蛋白的结构。SONG等[19]采用贝莱斯芽孢杆菌发酵和化学法同时对鱼皮进行预处理,再用相同的酸和酶分别对发酵法和化学法处理过的鱼皮进行水解,通过对羟脯氨酸等氨基酸组分的分析以及紫外、傅里叶变换红外光谱等方法进行测定,实验表明,采用发酵预处理在一定程度上使所得的胶原蛋白产率提高,具有安全、环保等特点,并且能够保持胶原蛋白原有的三螺旋结构,纯度也相比酸碱处理的要高。
1.1.2 酸碱提取法
碱提取法是指采用碱性等物质对鱼皮进行水解,使胶原蛋白中含有羟基、疏水基的氨基酸不稳定,进而得到胶原蛋白[20]。但在提取过程中,易破坏胶原蛋白的三螺旋结构,且当水解比较严重时,会产生有毒的D-型氨基酸[17]。酸法是利用乙酸或柠檬酸[21]等低浓度的酸溶液,通过破坏胶原蛋白内部的离子键,使含有醛胺类交联键的胶原蛋白溶出,进而提取胶原蛋白。该方法对于胶原蛋白原有的三螺旋结构保存度较好[20]。
ABBAS等[22]在0.5 mol/L乙酸条件下提取,经傅里叶变换红外光谱和扫描电子显微镜测定所提取的胶原蛋白具有高度纤维性且官能团未受到损害,还发现变性温度低于猪胶原蛋白,可替代猪胶原蛋白应用于食品工业。KO ODZIEJSKA等[23]采用pH 11.5的NaOH溶液提取鱿鱼皮胶原蛋白,提取率提高至90%。淑英等[24]采用醋酸提取鳕鱼皮胶原蛋白,使用响应面法对工艺进行优化,结果表明:0.47 mol/L醋酸、料液比为1∶33、提取时间为90.2 h,在此条件下提取率为37.36%。
ODZIEJSKA等[23]采用pH 11.5的NaOH溶液提取鱿鱼皮胶原蛋白,提取率提高至90%。淑英等[24]采用醋酸提取鳕鱼皮胶原蛋白,使用响应面法对工艺进行优化,结果表明:0.47 mol/L醋酸、料液比为1∶33、提取时间为90.2 h,在此条件下提取率为37.36%。
1.1.3 酶提取法
酶提取法是利用酶从鱼皮中提取酶溶性胶原蛋白(pepsin-solubilized collagen, PSC),该方法的优点是在水解过程中不会损失营养价值[25],且有机试剂或有毒物质残留较酸碱法少,因此,比较适用于医药食品等行业[26]。常见的酶有胃蛋白酶、胰蛋白酶、碱性蛋白酶和复合蛋白酶等[21]。
DEVITA等[27]采用菠萝蛋白酶、木瓜蛋白酶、胃蛋白酶和胰蛋白酶进行处理,最终发现胃蛋白酶和菠萝蛋白酶的胶原蛋白产量最高。LIU等[28]采用胃蛋白酶处理,料液比为1∶10(g∶mL),所得PSC表征为Ⅰ型胶原蛋白,并保持稳定的三螺旋结构。程波等[29]研究3种酶分别对鲟鱼皮胶原蛋白的提取率,经正交试验表明,当采用0.5 mol/L乙酸的胃蛋白酶,且酶量4 000 U/g、提取温度37 ℃、提取时间为6 h、固液比为1∶4时,胶原蛋白的提取率最高为70.15%。
1.1.4 热水提取法
热水法即直接采用热水提取水溶性胶原蛋白,操作简便,最佳温度通常为50~90 ℃[30]。但当温度过高时,会使蛋白质发生变性;温度过低时,则导致提取速度缓慢。张强等[31]通过酸法、酶法和热水法3种方法提取胶原蛋白,研究发现,经过热水处理后的胶原蛋白基本呈片状结构,网状结构消失,说明胶原蛋白已发生变性和交联,表现出凝胶性质,不适用于医药领域。
1.1.5 其他
据文献报道,除上述提取方法外,还有一些其他方法可对鱼皮中活性物质进行提取。本文综述了几种相关的提取方法,如表2所示。
表2 其他提取方法
Table 2 Other extraction methods

方法条件结论超声波辅助酶提取[32]加酶量100 U/g,pH 7.5,温度40 ℃,超声波处理50 min提高胶原蛋白的提取效率和经济效益超声-双酶提取[33]超声波60 min,料液比为1∶10(g∶mL),两种酶为碱性蛋白酶和风味酶,温度45 ℃与双酶法比较,超声-双酶法提取率更高酸酶复合提取[27]将鱼皮浸泡在含有0.5 mol/L蛋白酶的乙酸中,NaCl沉淀,最后进行透析冻干酸酶复合提取优于单一酸或酶提取均质辅助提取[34]pH 2.4,固液比1∶5^1∶20(g∶mL),酶浓度0.118^23.6 KU/g,7 000 r/min下均质5 min具有较好的经济效益和较高的胶原蛋白产量
1.1.6 胶原蛋白的纯化
尽管胶原蛋白提取之前已经预处理去除杂质,但在后续提取完成后仍然会存在少量杂质或提取过程中残留下的试剂等,因此需要对粗提取的胶原蛋白进一步纯化。可采用盐析、层析、高效液相色谱、电泳等方法进行提纯[35]。
CHEN等[36]采用电渗析的方法对提取的胶原蛋白进行纯化,条件如下:进料室NaCl溶液150 L,其中NaCl与水的质量比是3∶97,浓缩室150 L蒸馏水,电势80 V/cm,流量≤1 m3/h,时间2 h。实验表明,该种方法相对传统渗析具有高效、大容量、环保的特点。
1.2 鱼皮中胶原蛋白的药用价值
1.2.1 抗高血压活性
血管紧张素转化酶(angiotensin-converting enzyme,ACE)抑制剂被广泛用于治疗高血压,通过降低肾上腺皮质醛固酮的分泌,使肾小管对水和钠的再吸收减少,细胞外体积减小,血管舒张进而降低血压[37],常见的ACE抑制剂有卡托普利、贝那普利、依那普利等,然而此类抑制剂会对肾功能造成一定的损伤,同时会引发高血钾症等副作用[38],因此研发安全有效的抗高血压药物显得尤为重要。ACE抑制肽(见表3)是一种短链肽(2~12个氨基酸残基),近年来,研究人员们发现源自鱼皮的ACE抑制肽与ACE抑制剂具有相似的作用,不仅来源丰富,且对人体具有较小的毒副作用,展现出作为传统降压药物替代品的巨大潜力[39]。
表3 ACE抑制肽
Table 3 ACE inhibitory peptides
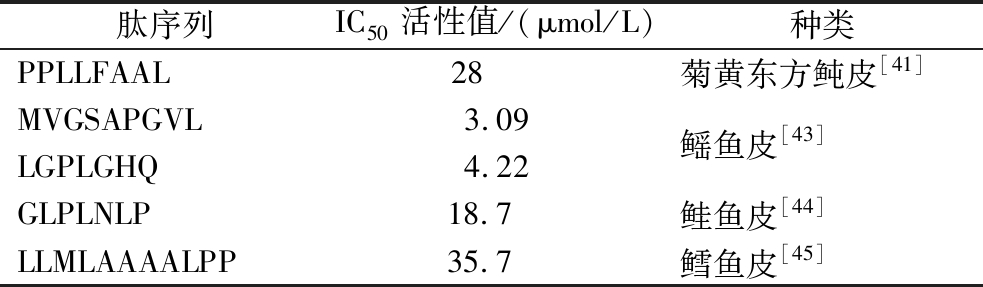
肽序列IC50活性值/(μmol/L)种类PPLLFAAL28 菊黄东方鲀皮[41]MVGSAPGVL3.09LGPLGHQ4.22鳐鱼皮[43]GLPLNLP18.7 鲑鱼皮[44]LLMLAAAALPP35.7 鳕鱼皮[45]
据相关研究表明,ACE抑制肽的活性与其分子质量、氨基酸序列有关,短链肽更易与ACE活性位点结合,且当C末端具有疏水性或带正电荷的残基时,有利于增强其ACE抑制活性[40]。SU等[41]通过酶解、超滤从菊黄东方鲀皮中分离出5组不同分子质量(<1、1~3、3~10、10~50和>50 kDa)的ACE抑制肽,经研究表明,分子质量<1 kDa的具有较高的抑制活性(IC50为0.58 mg/mL),证明小分子活性肽相比高分子质量具有较高的活性,选用分子质量<1 kDa继续进一步研究。随后与静脉给药后的卡托普利组相比,ACE抑制肽能够维持较长时间的低收缩压且降压效果优于卡托普利。刘文颖等[42]以三文鱼皮为原料制备ACE抑制肽,得到分子质量<132、132~576、576~1 000、1 000~3 000和3 000~10 000 u 5个范围,其中分子质量在1 000 u(八肽以下的低聚肽或部分游离的氨基酸)以下的占90.59%,并选取1 000 u以下的进一步研究,测得海洋低聚肽IC50值为1.25 mg/mL。
由上述研究结果表明,鱼皮胶原蛋白肽具有显著的降血压以及稳定血压的效果,且低分子质量的短肽具有比单一氨基酸更易吸收的优势和较高的ACE抑制活性,与传统的ACE抑制剂相比,在安全性、有效性等方面具有十分广阔的发展前景。
1.2.2 抗氧化活性
抗氧化肽是一类由动植物胶原蛋白经酶解或发酵产生的生物活性肽(2~20个氨基酸[46]),因为胶原蛋白具有独特的三螺旋结构不易被人体消化吸收,所以将胶原蛋白酶解成为胶原蛋白多肽,以便让人体很好的吸收,其能够维持机体内自由基平衡和抑制脂质氧化,具有较强的抗氧化活性以及安全、高效、易消化吸收的特点,且来源广泛,具有广阔的市场前景。相关研究表明,抗氧化肽由于较稳定的自由基,被证明是比传统游离氨基酸更有效的抗氧化剂。而抗氧化肽的活性高低通常是由其中氨基酸的类型、位置和疏水性所决定。目前,常用的抗氧化活性检测方法有氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)、铁离子还原法(fluorescence recovery after photobleaching,FRAP)和DPPH自由基清除实验。
蔡金秀等[47]采用双酶分布酶解法提取马面鱼皮胶原抗氧化肽,经超滤后得到分子质量为<5、5~8、8~10和>10 kDa,4个组分,该实验以DPPH自由基清除率和水解度(degree of hydrolysis,DH)为评价指标,其中分子质量<5 kDa的组分具有较高的保留率以及较低的IC50值,其清除DPPH自由基的IC50值为1.80 mg/mL,结果表明,其水解产物主要是由低分子质量的肽组成,且低分子质量的肽具有较强的抗氧化活性,最终经超高液相色谱-质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS)分析推测,其可能的氨基酸序列为GGGACA或AGGACG。NURILMALA等[48]研究黄鳍金枪鱼皮抗氧化肽,由十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)得胶原蛋白的分子质量在2.94~11.93 kDa,采用ABTS和DPPH两种方法对多肽的抗氧化活性进行测定,结果表明,分子质量3~10 kDa的抗氧化肽表现出较强的抗氧化活性以及较好的DPPH清除率。TKACZEWSKA等[49]通过FRAP和铁离子螯合能力方法,证明了从鲤鱼皮中提取的Ala-Tyr二肽具有较强的体外抗氧化特性,并进行体外消化测试,表明其具有良好的肠道吸收能力。
仅管实验表明获得的抗氧化肽具有较好的抗氧化活性,但由于多肽在体内吸收程度等问题,目前仍然局限于体外抗氧化实验以及体外模拟实验,因此,仍然需要进一步研究。
1.2.3 促伤口愈合活性
胶原蛋白可以为成纤维细胞的增殖提供良好的环境基质,并且可以诱导血小板的凝固以及血管内皮生长因子(vascular endothelial growth factor,VEGF)、纤维细胞生长因子(β-fibroblast growth factor,β-FGF)、抗炎因子等各类生长因子的上调,从而达到促进伤口愈合的功效。
ZHANG等[50]从鲑鱼皮中提取海洋胶原蛋白肽(marine collagen peptides,MCP),将MCP处理的大鼠伤口与药物处理的大鼠伤口进行比较,经MCP处理后的伤口愈合速度快于药物处理的,并且改善了血管生成以及形成更厚的胶原纤维沉积。陈秀丽等[51]通过SD大鼠背部创伤模型,测定了鲨鱼皮胶原海绵的促愈合活性,发现其能够显著的提高CD31、TGF-β和VEGF的表达,进而加速新血管和肉芽组织的形成,以达到促伤口愈合的目的。MEI等[52]采用鲑鱼皮胶原肽和罗非鱼皮胶原肽建立小鼠创伤模型,研究发现经2种鱼皮胶原肽处理的伤口愈合率明显优于实验对照组,并发现促炎因子(TNF-α、IL-6、IL-8)被下调,而VEGF、β-FGF、抗炎因子(lL-10)等被上调,结构表明此类肽不仅可以加速创伤面的愈合,还具有潜在的抗炎活性。HU等[53]从尼罗罗非鱼皮中提取MCP,通过体外划痕实验研究MCP对愈合过程的影响,实验表明MCP处理的愈合效果明显优于其他对照组,并采用兔子建立深度局部烫伤模型,在同一时间下MCP组的愈合率较高,并通过组织学评估,发现MCP组伤口被3层新表皮完全覆盖,且真皮层中炎症细胞消失,成熟肉芽组织增殖出现,而其他对照组的肌肉层中可以看到疤痕组织的形成,成功地证明了MCP促伤口愈合的活性。
胶原蛋白除制成相应蛋白肽来促进伤口愈合外,还可联合其他功能性物质制备胶原蛋白膜,该膜具有多孔网状结构,以及稳定性好,低抗原性的特点,被广泛应用于伤口止血敷料的研发。GE等[54]从罗非鱼鱼皮中制备新型水凝胶敷料,动物实验表明,该胶原蛋白水凝胶敷料能够促进创面的愈合,且由于其规则的网络结构和无明显细胞毒性以及低抗原性,因此可以用于深度烧伤创面的愈合及护理。AHMED等[55]以驴右掌伤口为实验模型,左掌为对照模型,评估尼罗罗非鱼鱼皮作为生物敷料的活性,结果表明,鱼皮包扎的伤口附近的微生物计数显著减少,且伤口开始愈合。
1.2.4 抑制肥胖和高血糖活性
随着生活水平的提高,糖尿病的发展正趋于年轻化,导致年轻人患糖尿病的一大因素就是肥胖。近年来,利用生物活性肽来降低肥胖的发展进而控制血糖正成为一大热点[56-57]。
NEVES等[56]使用人二肽基肽酶Ⅳ(dipeptidyl peptidase-Ⅳ,DPP-Ⅳ)对从鲑鱼中提取的生物活性肽进行DPP-Ⅳ抑制活性测定,研究结果证明了其有效的抑制DPP-Ⅳ活性,IC50值为(0.08±0.01) mg/mL。WOO等[57]研究源自鳐鱼皮的胶原蛋白肽(1 050 Da),通过小鼠实验发现,口服胶原蛋白肽的小鼠,其体重和内脏脂肪质量低于对照组,实验显示通过下调脂肪酸合成的肝蛋白表达水平和胆固醇合成,上调β氧化和胆汁酸的合成,小鼠在喂养胶原蛋白肽后,肝脏蛋白表达水平的磷酸化5′单磷酸腺苷激活的蛋白激酶和血浆中的脂肪素水平较高,而瘦素水平较低,结果表明胶原蛋白肽有效地抑制了肝脏脂质的积累,进而达到抑制肥胖的效果。
1.2.5 用作生物材料
骨骼是由钙化的骨基质、细胞和其他的生物活性因子构成,存在于骨基质中的有机聚合物是骨再生的关键。胶原蛋白因其低抗原性和较好的生物相容性,可作为优异的骨支架材料。然而,胶原蛋白的机械强度较低,且骨诱导性极大程度地限制了骨再生、骨移植等,因此需要将胶原蛋白与其他生物材料相结合,来改善胶原蛋白的机械强度和骨诱导性,以期成为良好的骨支架材料。ZHANG等[58]概述了生物陶瓷、碳基材料、天然聚合物/人造高分子材料的相应性质,并分别与胶原蛋白相结合,以此来制备性能良好的胶原蛋白复合骨支架。
1.2.6 抗菌活性
抗菌肽(antimicrobial peptides,AMPs)是一种具有生物活性的小分子蛋白,通常由生物体自行产生进而发挥作用,属于生物体本身抗感染所不可或缺的部分。主要通过直接与细菌作用,从而发挥抗菌活性。鱼类大多生活在含有大量的致病微生物的环境中,鱼皮本身可以作为物理屏障,从而发挥抗菌作用,而AMPs此时则发挥着化学屏障的作用。天然的AMPs对多类细菌、真菌等显示出广谱抗菌活性,因此,鱼类可以作为AMPs的潜在来源[59-60]。
研究人员从不同湖泊中非洲鲢鱼的皮肤黏液成功提取出了7种新的AMPs(含有11~16个氨基酸残基)[61],以金黄色葡萄球菌(ATCC 25923)和大肠杆菌(ATCC 25922)为评价指标,采用琼脂扩散法和肉汤稀释法测定其抑菌活性,并采用环丙沙星作为对照,结果表明这7种AMPs对大肠杆菌和金黄色葡萄球菌均显示出较高抗菌活性,其中活性最佳的一组MIC值分别为2.84和0.71 μg/mL。研究人员还研究了黄鲶鱼[62]的皮肤黏液得出一种新的线性AMPs叫Pelteobagrin,其对革兰氏阳性菌和革兰氏阴性菌均表现出较好的抗菌活性,肽序列为GKLNLFLSRLEILKLFVGAL。
除了从皮肤黏液中提取纯化AMPs以外,还可从鱼皮肤中提取相应AMPs。BROEKMAN等[63]从太平洋鳕鱼中提取纯化得到一种新型抗菌肽,研究表明,该肽对革兰氏阳性菌活性较弱,而其对真菌显示出较好的抗菌活性,MIC值为2.5 μmol/L。CHEN等[64]分别选用了2种不同鱼源的抗菌肽CATH_BRALE和codCath1来研究其抗菌活性。结果表明这2种肽对革兰氏阳性菌和革兰氏阴性菌显示出有效的光谱抗菌活性,MIC值为2.34~18.75和2.34~37.5 μg/mL,它们均是通过直接诱导细菌细胞膜渗透和细胞破裂来发挥抗菌作用。ATEF等[65]使用微量稀释法测定鲟鱼皮胶原水解物对大肠杆菌和沙门氏菌菌株的抗菌活性,其水解产物能够释放出较好的抗菌活性。还有利用枯草杆菌对鳐鱼皮进行水解,并采用离子交换、固相萃取和反向高效液相色谱法进一步纯化得出分子质量分别为841和1 010 Da的2种肽,其肽序列分别为GRPGNRGE和AKDYEVDAT,经抗菌活性实验得到,2种肽对金黄色葡萄球菌均显示出较高的抗菌活性,MIC值为0.52和0.46 mg/mL[66]。
2 明胶
作为胶原的变性产物,明胶是胶原蛋白经温和而不可逆的水解或热变性处理后的一种良好的溶胶-凝胶可逆热塑性的多肽化合物[67],其分子质量一般为几万到几十万不等,属于一种高分子物质,相较胶原蛋白具有更好的水溶解性、凝胶性、乳化性等特殊性质。因此,食用明胶可用作食品中的增稠剂、乳化剂等;工业明胶一般用于生物复合材料的制备;医用明胶常联合其他生物材料用于药物的载体以及伤口止血敷料。
2.1 鱼皮中明胶的制备
明胶的制备一般分为预处理、提取、纯化3步,即采用酸法、碱法、酶法等方法进行预处理,使胶原蛋白在酸性或碱性的条件下,氢键断裂,螺旋结构解体,进而在水和热的条件下转变为明胶。
酸法是利用盐酸、磷酸等酸溶液对胶原蛋白进行处理,使其充分酸化膨胀,接着调节pH并提取明胶。吴佳南等[68]以新西兰鳕鱼皮为原料,采用0.1 mol/L HCl溶液浸泡,使鱼皮充分溶胀,洗至中性,最后采用热水抽提的方法进行提取。碱法则是采用NaOH等碱性溶液来水解胶原蛋白的一种方法,其优点是在处理原料时可以同时去除其他杂蛋白,以达到纯化的目的。仅管碱法提取的明胶质量较好,但其生产周期过长。陈仁荟等[69]采用超声波辅助碱法提取鲑鱼皮明胶,经研究表明最佳条件为pH 8、超声80 min、30 ℃下提取7 h,提取率为54.66%,以此获得高质量的鱼皮明胶。
2.2 鱼皮中明胶的药用价值
由于明胶特殊的凝胶性、成膜性,因此被广泛用于医用材料的制备,如外科敷料、栓剂以及胶囊剂的囊材等方面。而鱼皮明胶的凝胶强度、成膜性、乳化等功能特性相对较差,因此需要联合一些生物材料或直接对明胶进行化学、物理改性,使鱼皮明胶达到作为医用材料的要求[67]。
刘晗等[70]研究了鳕鱼皮明胶,并联合海藻酸钠制备出一种可吸收性的复合止血敷料,通过对该敷料的物理性能、肝脏相容性及其结构的研究,证明该止血敷料具有良好的止血功效。宋雪等[71]同样采用海藻酸钠联合太平洋鳕鱼皮明胶,制备得到一种可吸收复合止血敷料,经试验研究表明,明胶复合止血敷料可以明显缩短活化部分凝血活酶时间和凝血酶时间,激活内源性凝血系统和共同性凝血途径,以达到快速止血效果,并通过生物相容性实验进一步表明,该复合止血敷料无急性毒性、无刺激性且溶血率小于5%,可以作为医用材料进一步研究。
3 总结
我国是水产大国,2021年我国鱼类养殖与捕捞总产量为3 561.84 t,水产加工品总量2 125.04万t,同比增长1.64%,具有丰富的鱼类资源。从鱼皮中提取生物活性物质并用于制药、食品、化妆品等行业,不仅可以解决资源浪费以及环境污染的问题,同时能够获得较好的经济效益,实现可持续发展。本文从胶原蛋白及其变性产物明胶出发,着重对胶原蛋白的处理、纯化进行概述,并对二者的药用价值进行阐述,以期为后续研究新的处理工艺或开发新的药用价值提供理论基础。目前,由于技术成熟度的缺陷,鱼皮脱腥工艺以及后续胶原蛋白稳定性等问题不能得到妥善解决,进而不能实现工业化生产。因此,针对水产资源的研究仍然是一项十分重要的任务。
[1] TANG Y P, JIN S J, LI X Y, et al.Physicochemical properties and biocompatibility evaluation of collagen from the skin of giant croaker (Nibea japonica)[J].Marine Drugs, 2018, 16(7):222.
[2] 杨泽伟, 刘丹, 王冠雄, 等.《联合国海洋法公约》与中国(圆桌会议)[J].中国海洋大学学报(社会科学版), 2019(5):1-12.
YANG Z W, LIU D, WANG G X, et al.The united nations convention on the law of the sea and China (round-table conference)[J].Journal of Ocean University of China (Social Sciences), 2019(5):1-12.
[3] CHALAMAIAH M, DINESH KUMAR B, HEMALATHA R, et al.Fish protein hydrolysates:Proximate composition, amino acid composition, antioxidant activities and applications:A review[J].Food Chemistry, 2012, 135(4):3020-3038.
[4] JONGJAREONRAK A, BENJAKUL S, VISESSANGUAN W, et al.Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of Brownstripe red snapper (Lutjanus vitta)[J].Food Chemistry, 2005, 93(3):475-484.
[5] SUN L L, HOU H, LI B F, et al.Characterization of acid- and pepsin-soluble collagen extracted from the skin of Nile tilapia (Oreochromis niloticus)[J].International Journal of Biological Macromolecules, 2017, 99:8-14.
[6] 周勰, 陈楚央, 唐云平, 等.鳕鱼皮免疫活性肽的制备[J].浙江海洋大学学报(自然科学版), 2020, 39(6):484-489.
ZHOU X, CHEN C Y, TANG Y P, et al.Preparation of immunoregulatory peptides from the skin of Gadus macrocephalus[J].Journal of Zhejiang Ocean University (Natural Science), 2020, 39(6):484-489.
[7] COPPOLA D, OLIVIERO M, VITALE G A, et al.Marine collagen from alternative and sustainable sources:Extraction, processing and applications[J].Marine Drugs, 2020, 18(4):214.
[8] 魏洁琼, 余群力, 韩玲, 等.牛骨胶原蛋白肽制备工艺优化及抗氧化活性分析[J].甘肃农业大学学报, 2020, 55(5):203-211;218.
WEI J Q, YU Q L, HAN L, et al.Optimization of preparation process and antioxidant activity analysis of bovine bone collagen peptide[J].Journal of Gansu Agricultural University, 2020, 55(5):203-211;218.
[9] FU Y, THERKILDSEN M, ALUKO R E, et al.Exploration of collagen recovered from animal by-products as a precursor of bioactive peptides:Successes and challenges[J].Critical Reviews in Food Science and Nutrition, 2019, 59(13):2011-2027.
[10] VENKATESAN J, ANIL S, KIM S K, et al.Marine fish proteins and peptides for cosmeceuticals:A review[J].Marine Drugs, 2017, 15(5):143.
[11] LI Z R, WANG B, CHI C F, et al.Isolation and characterization of acid soluble collagens and pepsin soluble collagens from the skin and bone of Spanish mackerel (Scomberomorous niphonius)[J].Food Hydrocolloids, 2013, 31(1):103-113.
[12] 杨晓东, 张杨, 张寿, 等.胶原蛋白肽的提取及应用研究进展[J].食品工业科技, 2022, 43(9):469-476.
YANG X D, ZHANG Y, ZHANG S, et al.Research progress in extraction and application of collagen peptides[J].Science and Technology of Food Industry, 2022, 43(9):469-476.
[13] KHONG N M H, YUSOFF F M, JAMILAH B, et al.Improved collagen extraction from jellyfish (Acromitus hardenbergi) with increased physical-induced solubilization processes[J].Food Chemistry, 2018, 251:41-50.
[14] SILVA T, MOREIRA-SILVA J, MARQUES A, et al.Marine origin collagens and its potential applications[J].Marine Drugs, 2014, 12(12):5881-5901.
[15] GEAHCHAN S, BAHARLOUEI P, RAHMAN A.Marine collagen:A promising biomaterial for wound healing, skin anti-aging, and bone regeneration[J].Marine Drugs, 2022, 20(1):61.
[16] 梁飞, 左红梅.胶原蛋白肽的性质、应用及发展前景的研究综述[J].明胶科学与技术, 2014, 34(3):109-115.
LIANG F, ZUO H M.A review on the properties, applications and prospect of collagen peptide[J].The Science and Technology of Gelatin, 2014, 34(3):109-115.
[17] 赵然, 曹敏杰, 王晶, 等.水产动物源胶原蛋白的提取及应用研究进展[J].食品安全质量检测学报, 2020, 11(22):8157-8165.
ZHAO R, CAO M J, WANG J, et al.Research progress on extraction and application of collagen from aquatic animals[J].Journal of Food Safety &Quality, 2020, 11(22):8157-8165.
[18] XU S C, YANG H A, SHEN L R, et al.Purity and yield of collagen extracted from southern catfish (Silurus meridionalis Chen) skin through improved pretreatment methods[J].International Journal of Food Properties, 2017, 20(sup1):S141-S153.
[19] SONG Z L, LIU H M, CHEN L W, et al.Characterization and comparison of collagen extracted from the skin of the Nile tilapia by fermentation and chemical pretreatment[J].Food Chemistry, 2021, 340:128139.
[20] 周瑞, 陈舜胜.鱼皮胶原蛋白提取方法研究及其在食品中的应用[J].上海农业学报, 2021, 37(1):129-135.
ZHOU R, CHEN S S.Research progress on extraction methods of fish skin collagen and its application in food industry[J].Acta Agriculturae Shanghai, 2021, 37(1):129-135.
[21] 江洪有, 谷峰, 鉏晓艳, 等.水产胶原蛋白的制备、性能及应用综述[J].湖北农业科学, 2015, 54(14):3329-3334.
JIANG H Y, GU F, ZU X Y, et al.Review on the preparation, performance and application of aquatic collagen[J].Hubei Agricultural Sciences, 2015, 54(14):3329-3334.
[22] ABBAS A A, SHAKIR K A, WALSH M K.Functional properties of collagen extracted from catfish (Silurus triostegus) waste[J].Foods, 2022, 11(5):633.
[23] KO ODZIEJSKA I, SIKORSKI Z E, NIECIKOWSKA C.Parameters affecting the isolation of collagen from squid (Illex argentinus) skins[J].Food Chemistry, 1999, 66(2):153-157.
ODZIEJSKA I, SIKORSKI Z E, NIECIKOWSKA C.Parameters affecting the isolation of collagen from squid (Illex argentinus) skins[J].Food Chemistry, 1999, 66(2):153-157.
[24] 淑英, 敖冉, 宋佳, 等.响应面法优化鳕鱼皮酸溶性胶原蛋白的提取工艺[J].食品工业科技, 2015, 36(24):269-272;277.
SHU Y, AO R, SONG J, et al.Optimization of extraction condition of acid-soluble collagen from cod skin by response surface methodology[J].Science and Technology of Food Industry, 2015, 36(24):269-272;277.
[25] HUANG C Y, WU C H, YANG J I, et al.Evaluation of iron-binding activity of collagen peptides prepared from the scales of four cultivated fishes in Taiwan[J].J Food Drug Anal, 2015, 23(4):671-678.
[26] KIM S K, WIJESEKARA I.Development and biological activities of marine-derived bioactive peptides:A review[J].Journal of Functional Foods, 2010, 2(1):1-9.
[27] DEVITA L, NURILMALA M, LIOE H N, et al.Chemical and antioxidant characteristics of skin-derived collagen obtained by acid-enzymatic hydrolysis of bigeye tuna (Thunnus obesus)[J].Marine Drugs, 2021, 19(4):222.
[28] LIU D S, LIANG L, REGENSTEIN J M, et al.Extraction and characterisation of pepsin-solubilised collagen from fins, scales, skins, bones and swim bladders of bighead carp (Hypophthalmichthys nobilis)[J].Food Chemistry, 2012, 133(4):1441-1448.
[29] 程波, 吴洁, 张玉蓉, 等.酶法提取人工养殖鲟鱼皮中胶原蛋白的工艺研究[J].食品研究与开发, 2009, 30(3):1-4.
CHENG B, WU J, ZHANG Y R, et al.Study on the extraction of collagen with enzyme from the skin of farmed sturgeon[J].Food Research and Development, 2009, 30(3):1-4.
[30] 李保强, 王利强, 丁建虹, 等.鱼鳞胶原蛋白的研究进展[J].包装工程, 2018, 39(17):53-60.
LI B Q, WANG L Q, DING J H, et al.Research progress in fish scale collagen[J].Packaging Engineering, 2018, 39(17):53-60.
[31] 张强, 王倩倩, 陆剑锋, 等.不同方法提取鲢鱼皮胶原蛋白的理化特性比较[J].现代食品科技, 2014, 30(5):104-110.
ZHANG Q, WANG Q Q, LU J F, et al.Comparison of physical and chemical characteristics of collagen from silver carp skin using different extraction methods[J].Modern Food Science and Technology, 2014, 30(5):104-110.
[32] 王正云, 蒋慧亮.超声波辅助酶法提取青鱼鱼皮胶原蛋白工艺[J].食品研究与开发, 2020, 41(5):133-137.
WANG Z Y, JIANG H L.Technology of ultrasound-assisted extraction of collagen from black carp skin[J].Food Research and Development, 2020, 41(5):133-137.
[33] 鲜雪梅, 冯冲, 郭雨慧, 等.不同方法提取鲫鱼鱼皮胶原蛋白的比较研究[J].食品安全导刊, 2021(36):153-157;161.
XIAN X M, FENG C, GUO Y H, et al.Comparative study on extraction of colloid protein from crucian carp skin by different methods[J].China Food Safety Magazine, 2021(36):153-157;161.
[34] TAN Y Q, CHANG S K C.Isolation and characterization of collagen extracted from channel catfish (Ictalurus punctatus) skin[J].Food Chemistry, 2018, 242:147-155.
[35] 宫萱, 包建强, 黄可承, 等.鱼骨胶原蛋白提取、纯化工艺及应用的研究进展[J].食品与发酵工业, 2022, 48(24):346-351.
GONG X, BAO J Q, HUANG K C, et al.Progress on extraction, purification, and application of fish bone collagen[J].Food and Fermentation Industries, 2022, 48(24):346-351.
[36] CHEN J D, LI M, YI R Z, et al.Electrodialysis extraction of pufferfish skin (Takifugu flavidus):A promising source of collagen[J].Marine Drugs, 2019, 17(1):25.
[37] MARTIN P, ALI P M, REINHOLD K.Physiology of local renin-angiotensin systems[J].Physiological Reviews, 2006, 86(3):747-803.
[38] 王茵, 吴靖娜, 苏捷, 等.鱼皮胶原多肽的降血压效果研究[J].中国海洋药物, 2014, 33(2):39-44.
WANG Y, WU J N, SU J, et al.Study on antihypertensive effect of collagen peptides from fish skin gelatin[J].Chinese Journal of Marine Drugs, 2014, 33(2):39-44.
[39] 王晓丹, 薛璐, 胡志和, 等.ACE抑制肽构效关系研究进展[J].食品科学, 2017, 38(5):305-310.
WANG X D, XUE L, HU Z H, et al.Progress in research on structure-activity relationship of ACE inhibitory peptides[J].Food Science, 2017, 38(5):305-310.
[40] 刘轶, 马良, 张宇昊.胶原ACE抑制肽研究进展[J].食品科学, 2013, 34(13):350-355.
LIU Y, MA L, ZHANG Y H.Research advances in ACE inhibitory peptides from collagen[J].Food Science, 2013, 34(13):350-355.
[41] SU Y C, CHEN S C, CAI S L, et al.A novel angiotensin-I-converting enzyme (ACE) inhibitory peptide from Takifugu flavidus[J].Marine Drugs, 2021, 19(12):651.
[42] 刘文颖, 林峰, 陈亮, 等.食源性低聚肽的血管紧张素转化酶(ACE)抑制作用[J].食品科技, 2016, 41(2):9-13.
LIU W Y, LIN F, CHEN L, et al.Angiotensin I-converting enzyme(ACE)inhibitory activity of food-origin oligopeptides[J].Food Science and Technology, 2016, 41(2):9-13.
[43] NGO D H, RYU B, KIM S K.Active peptides from skate (Okamejei kenojei) skin gelatin diminish angiotensin-I converting enzyme activity and intracellular free radical-mediated oxidation[J].Food Chemistry, 2014, 143:246-255.
[44] LEE J K, JEON J K, BYUN H G.Antihypertensive effect of novel angiotensin I converting enzyme inhibitory peptide from chum salmon (Oncorhynchus keta) skin in spontaneously hypertensive rats[J].Journal of Functional Foods, 2014, 7:381-389.
[45] HIMAYA S W A, NGO D H, RYU B, et al.An active peptide purified from gastrointestinal enzyme hydrolysate of Pacific cod skin gelatin attenuates angiotensin-1 converting enzyme (ACE) activity and cellular oxidative stress[J].Food Chemistry, 2012, 132(4):1872-1882.
[46] 张红玉, 李会珍, 张天伟, 等.抗氧化肽作用机制研究进展[J].食品安全质量检测学报, 2022, 13(12):3981-3988.
ZHANG H Y, LI H Z, ZHANG T W, et al.Research progress on the mechanism of antioxidant peptides[J].Journal of Food Safety &Quality, 2022, 13(12):3981-3988.
[47] 蔡金秀, 夏姗姗, 马佳雯, 等.马面鱼皮胶原抗氧化肽的分离制备及稳定性研究[J].核农学报, 2021, 35(11):2569-2577.
CAI J X, XIA S S, MA J W, et al.Isolation, preparation and stability of collagen antioxidant peptides from the skin of navodon septentrionalis[J].Journal of Nuclear Agricultural Sciences, 2021, 35(11):2569-2577.
[48] NURILMALA M, HIZBULLAH H H, KARNIA E, et al.Characterization and antioxidant activity of collagen, gelatin, and the derived peptides from yellowfin tuna (Thunnus albacares) skin[J].Marine Drugs, 2020, 18(2):98.
[49] TKACZEWSKA J, BUKOWSKI M, MAK P.Identification of antioxidant peptides in enzymatic hydrolysates of carp (Cyprinus carpio) skin gelatin[J].Molecules, 2018, 24(1):97.
[50] ZHANG Z, WANG J, DING Y, et al.Oral administration of marine collagen peptides from Chum Salmon skin enhances cutaneous wound healing and angiogenesis in rats[J].Journal of the Science of Food and Agriculture, 2011, 91(12):2173-2179.
[51] 陈秀丽, 沈先荣, 谢海霞, 等.鲨鱼皮胶原海绵的体外抗氧化及其促创伤愈合作用研究[J].中国海洋药物, 2017, 36(1):55-62.
CHEN X L, SHEN X R, XIE H X, et al.The effect of antioxidation and promoting wound healing of shark skin collagen sponge[J].Chinese Journal of Marine Drugs, 2017, 36(1):55-62.
[52] MEI F F, LIU J J, WU J T, et al.Collagen peptides isolated from Salmo salar and Tilapia nilotica skin accelerate wound healing by altering cutaneous microbiome colonization via upregulated NOD2 and BD14[J].Journal of Agricultural and Food Chemistry, 2020, 68(6):1621-1633.
[53] HU Z, YANG P, ZHOU C X, et al.Marine collagen peptides from the skin of Nile tilapia (Oreochromis niloticus):Characterization and wound healing evaluation[J].Marine Drugs, 2017, 15(4):102.
[54] GE B S, WANG H N, LI J E, et al.Comprehensive assessment of Nile tilapia skin (Oreochromis niloticus) collagen hydrogels for wound dressings[J].Marine Drugs, 2020, 18(4):178.
[55] AHMED I, MAHMOUD S, SABER K, et al.Evaluation of fish skin as a biological dressing for metacarpal wounds in donkeys[J].BMC Veterinary Research, 2020, 16(1):472.
[56] NEVES A C, HARNEDY P A, O’KEEFFE M B, et al.Peptide identification in a salmon gelatin hydrolysate with antihypertensive, dipeptidyl peptidase IV inhibitory and antioxidant activities[J].Food Research International, 2017, 100:112-120.
[57] WOO M, SONG Y, KANG K H, et al.Anti-obesity effects of collagen peptide derived from skate (Raja kenojei) skin through regulation of lipid metabolism[J].Marine Drugs, 2018, 16(9):306.
[58] ZHANG D W, WU X W, CHEN J D, et al.The development of collagen based composite scaffolds for bone regeneration[J].Bioactive Materials, 2018, 3(1):129-138.
[59] LUONG H X, THANH T T, TRAN T H.Antimicrobial peptides-Advances in development of therapeutic applications[J].Life Sciences, 2020, 260:118407.
[60] LEI J, SUN L C, HUANG S Y, et al.The antimicrobial peptides and their potential clinical applications[J].American Journal of Translational Research, 2019, 11(7):3919-3931.
[61] OKELLA H, IKIRIZA H, OCHWO S, et al.Identification of antimicrobial peptides isolated from the skin mucus of African Catfish, Clarias gariepinus (Burchell, 1822)[J].Frontiers in Microbiology, 2021, 12:794631.
[62] SU Y J.Isolation and identification of pelteobagrin, a novel antimicrobial peptide from the skin mucus of yellow catfish (Pelteobagrus fulvidraco)[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2011, 158(2):149-154.
[63] BROEKMAN D C, ZENZ A, GUDMUNDSDOTTIR B K, et al.Functional characterization of codCath, the mature cathelicidin antimicrobial peptide from Atlantic cod (Gadus morhua)[J].Peptides, 2011, 32(10):2044-2051.
[64] CHEN C, WANG A L, ZHANG F, et al.The protective effect of fish-derived cathelicidins on bacterial infections in zebrafish, Danio rerio[J].Fish &Shellfish Immunology, 2019, 92:519-527.
[65] ATEF M, CHAIT Y A, OJAGH S M, et al.Anti-Salmonella activity and peptidomic profiling of peptide fractions produced from sturgeon fish skin collagen (Huso huso) using commercial enzymes[J].Nutrients, 2021, 13(8):2657.
[66] MIRZAPOUR-KOUHDASHT A, LEE C W, YUN H, et al.Structure-function relationship of fermented skate skin gelatin-derived bioactive peptides:A peptidomics approach[J].Food Science and Biotechnology, 2021, 30(13):1685-1693.
[67] 王卫东, 李超, 孙月娥.鱼皮明胶的制备、特性及应用[J].食品科学, 2009, 30(23):484-488.
WANG W D, LI C, SUN Y E.Preparation, Characterization and Application of fish skin gelatin [J].Food Science, 2009, 30(23):484-488.
[68] 吴佳南, 孙娜, 林松毅, 等.鳕鱼皮明胶肽硒复合物的制备及结构表征[J].食品科学, 2021, 42(4):87-93.
WU J N, SUN N, LIN S Y, et al.Preparation and structural characterization of peptide-selenium complex from hoki(Macruronus novaezelandiae) skin gelatin[J].Food Science, 2021, 42(4):87-93.
[69] 陈仁荟, 耿姣姣, 赵梦雯, 等.超声波辅助碱水法提取大西洋鲑鱼皮明胶工艺的研究[J].轻工科技, 2022, 38(2):48-50.
CHEN R H, GENG J J, ZHAO M W, et al.Study on ultrasonic-assisted alkaline extraction of gelatin from Atlantic salmon skin[J].Light Industry Science and Technology, 2022, 38(2):48-50.
[70] 刘晗, 王月坤, 侯虎, 等.可吸收性鳕鱼皮明胶复合止血敷料的制备及性能研究[J].中国海洋药物, 2018, 37(4):45-51.
LIU H, WANG Y K, HOU H, et al.Study on the preparation and properties of absorbable composite hemostatic sponge based on the gelatin from Pacific cod (Gadus macrocephalus) skin[J].Chinese Journal of Marine Drugs, 2018, 37(4):45-51.
[71] 宋雪, 刘晗, 李昭璇, 等.鳕鱼皮源医用复合止血敷料的制备及性能研究[J].南方水产科学, 2022, 18(2):66-73.
SONG X, LIU H, LI Z X, et al.Preparation and properties of medical compound hemostasis dressing from Pacific cod skin[J].South China Fisheries Science, 2022, 18(2):66-73.