乳酸乳球菌(Lactococcus lactis)是乳球菌属中重要的模式菌,一般认为乳酸乳球菌包括了乳酸乳球菌乳酸亚种、乳酸乳球菌乳脂亚种和乳酸乳球菌霍氏亚种,传统上被用作发酵乳制品(如奶酪、酸奶油和酪乳)生产的发酵剂[1]。2022年被中国卫计委列入《可用于食品的菌株名单》。近年来,乳酸乳球菌许多功能特性不断被挖掘出来,如缓解结直肠癌[2]、肠应激综合征[3]、便秘[4]等症状,它与人体肠道健康息息相关,越来越多地在乳品、医疗医药、动物饲料等行业被应用。
乳酸乳球菌必须达到一定的活菌数才能在体内发挥相应的功效,所以需要通过优化培养基和培养工艺来提高培养密度。目前使用最多的是恒pH培养,但是存在渗透压抑制和底物不足等问题。培养基的渗透压与溶质的量直接相关,而培养基中的底物浓度直接决定了菌株发酵最终的生物量,但如果初始底物浓度过高反而会抑制菌株的生长,如何在两者之间寻找一个平衡点就显得非常重要。已知培养基中的无机盐在分批培养时主要起到中和作用,而在恒pH分批培养时,则可以不添加无机盐成分以降低初始培养基的渗透压。氮源利用率比较低,培养基中底物不能够全部用来增殖导致底物不足抑制产生;而不同菌株因为生境的不同,其蛋白酶解系统不同,对不同氮源的偏好性也不同,因此需要筛选或制备一种可高效利用的氮源,使底物能够物尽其用,变相去提高菌株的耐渗能力。
传统的优化方法主要是通过单因素试验或者正交试验筛选更优的底物和培养条件,然而却无法准确解释底物对菌株增殖的影响。本研究通过底物解析,寻找或制备最优的碳氮源后基于耐渗透压能力和碳氮消耗比去配制培养基,使得底物尽可能被菌株利用,结合培养工艺优化,大幅提高发酵液中的生物量水平。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
2株乳酸乳球菌CCFM1093、CCFM1032均来自江南大学食品微生物保藏中心(无锡,中国),该菌株在MRS培养基中培养,将培养基的初始pH值调节到6.2~6.4,并在115 ℃下高温灭菌20 min,之后在37 ℃恒温培养箱中进行培养。
1.1.2 试剂
蛋白胨、牛肉膏、酵母浸粉、葡萄糖、CH3COONa、吐温-80、K2HPO4、柠檬酸二铵、MgSO4·7H2O、MnSO4·H2O、NaCl、半乳糖、乳糖、蔗糖、麦芽糖,国药集团化学试剂有限公司;安琪酶母浸粉FM 502、安琪酵母浸粉FP 351、安琪酵母浸粉FA 31、安琪酵母浸粉FM 528、安琪酵母浸粉FM 803、酵母浸粉888、酵母浸粉528、酵母浸粉FM 405、酵母蛋白103、PRO 021 YEAST EXTRACT、Nucel 786 MG酵母抽提物粉、Nucel 875 MG 酵母抽提物粉、SIGMA-ALDRI、安琪大豆蛋白胨FP 410、胰蛋白胨、酪蛋白胨、鱼骨蛋白胨FP351、牛骨蛋白胨、安琪蛋白胨(牛骨)FP 326、牛肉浸粉、鱼粉蛋白胨,安琪酵母股份有限公司;葡萄糖试剂盒,上海荣盛生物药业有限公司。
1.2 仪器与设备
恒温培养箱,上海森信实验仪器有限公司;pH计、电子天平,梅特勒-托利多仪器(上海)有限公司;高温高压灭菌锅,日本SANYO公司;超净工作台,上海智诚分析仪器制造有限公司;迷你平行发酵罐,迪比尔生物工程有限公司;冰点渗透压测定仪,德国löser公司;真空冷冻干燥机,西班牙Telstar公司;落地式离心机,赛默飞世尔公司。
1.3 实验方法
1.3.1 培养基的配制
MRS液体培养基(g/L):蛋白胨10,牛肉膏10,酵母浸粉5,葡萄糖20,CH3COONa 5,吐温-80 1 mL/L,K2HPO4 2.0,柠檬酸二铵2.0,MgSO4·7H2O 0.1,MnSO4·H2O 0.05,pH 6.2~6.4,115 ℃灭菌20 min。
MRS固体培养基:在MRS液体培养基的基础上添加1.5~2.0 g/L的琼脂粉。
筛氮分析培养基(g/L):氮源1、葡萄糖6、K2HPO4 10、Na2HPO4 10、MgSO4·7H2O 0.25、MnSO4·H2O 0.05、吐温-80 1 mL/L,pH 6.0,115 ℃灭菌20 min。
渗透压培养基:在MRS液体培养基的基础上,添加不同浓度的NaCl溶液配制成梯度渗透压的液体培养基,渗透压为300~3 000 mOsm/kg。
1.3.2 菌株活化与培养
将在-80 ℃冰箱中冻藏的乳酸乳球菌CCFM 1093和CCFM 1032,在MRS固体平板上用接种环三区划线纯化,在温度为37 ℃的恒温培养箱下生长24~36 h,挑取单个菌落转移至5 mL新的液体培养基中,37 ℃下生长24 h,再以2%(体积分数)接种量传代至新的液体培养基中,在37 ℃条件下生长24 h,连续活化3~5次后作为种子培养液。
1.3.3 菌株碳源偏好性分析
采用20 g/L葡萄糖、半乳糖、乳糖、蔗糖、麦芽糖作为MRS培养基中的碳源,其余条件不变,按照2%(体积分数)的比例接种第三代活化对数末期的菌株于培养基中,置于37 ℃恒温培养箱中培养,使用分光光度计测定菌株稳定期的OD600。
1.3.4 菌株氮源偏好性分析
将市售氮源分为四大类(表1),每类挑选一种按照1.3.1节的方法配制筛氮分析培养基,然后将表现较好的一类的所有氮源再进行二次筛选,测定乳酸乳球菌在不同氮源的培养基下的生长曲线及对数期代时。
表1 氮源分类
Table 1 Nitrogen source classification
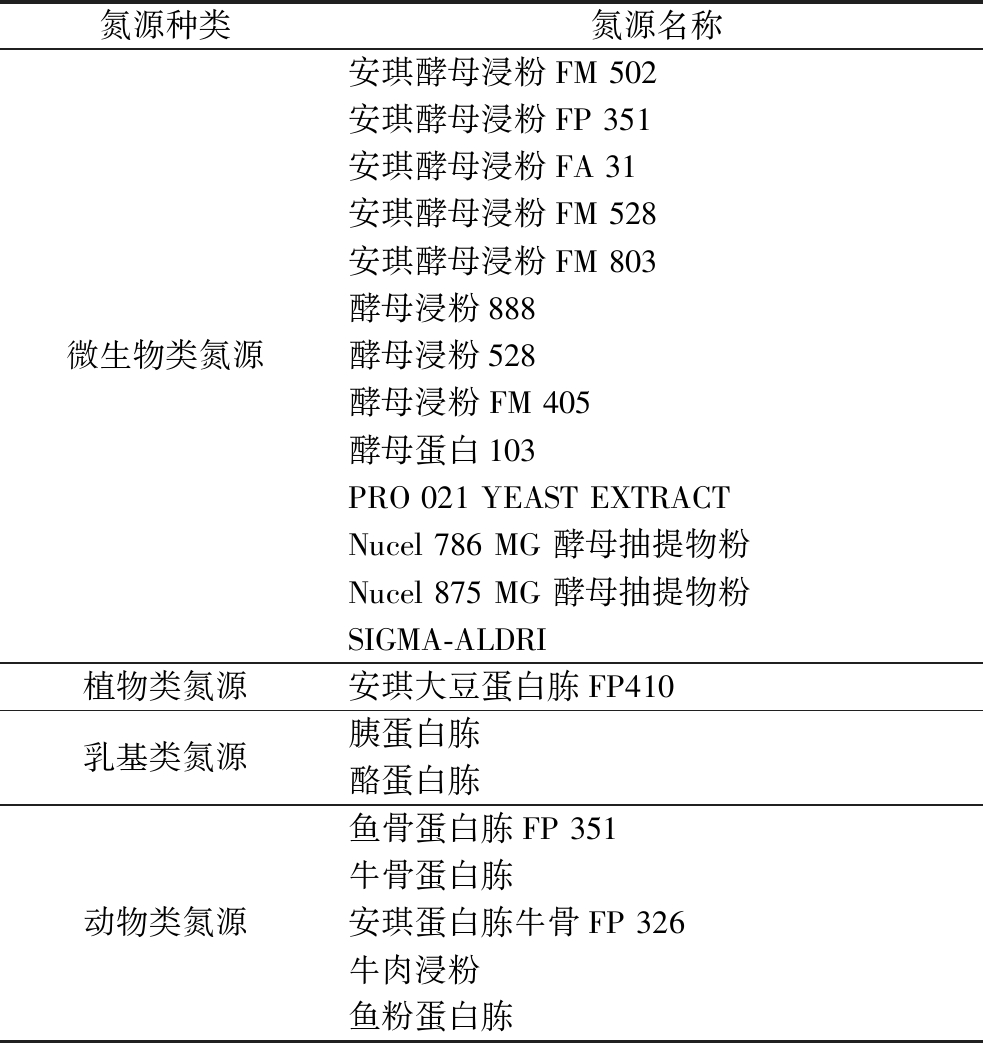
氮源种类氮源名称微生物类氮源安琪酵母浸粉FM 502安琪酵母浸粉FP 351安琪酵母浸粉FA 31安琪酵母浸粉FM 528安琪酵母浸粉FM 803酵母浸粉888酵母浸粉528酵母浸粉FM 405酵母蛋白103PRO 021 YEAST EXTRACTNucel 786 MG 酵母抽提物粉Nucel 875 MG 酵母抽提物粉SIGMA-ALDRI植物类氮源安琪大豆蛋白胨FP410乳基类氮源胰蛋白胨酪蛋白胨动物类氮源鱼骨蛋白胨FP 351牛骨蛋白胨安琪蛋白胨牛骨FP 326牛肉浸粉鱼粉蛋白胨
代时是指菌株在生长过程中平均每分裂一次所需要的时间,其代时能够直接反映生长的快慢,代时越短表明生长的越快。代时计算方法为:取指数生长期的数据,以菌株生长时间为横坐标,以lg(OD600, 2)为纵坐标,绘制曲线,计算代时,线性斜率倒数即为代时。
1.3.5 酪蛋白肽的制备
采用复合蛋白酶对酪蛋白进行水解,酶解条件如表2所示,采用pH-STAT法使体系pH稳定在7±0.05,不断搅拌使得充分酶解30 min,反应结束后立即沸水浴10 min使体系中的酶失活,待冷却到室温后,将体系pH调整至4.6使得未水解的酪蛋白沉淀,然后离心(8 000×g,20 min)取上清液备用。将收集到的上清液在透析袋(MD25-100)中透析48 h,每6 h换1次水,除去体系中的游离氨基酸,截留下所需要的多肽,冻干成粉作为氮源按照不同比例添加到发酵培养基中,测定发酵液稳定期的活菌数。
表2 不同蛋白酶酶解酪蛋白条件
Table 2 The conditions of casein hydrolysis with different proteases

蛋白酶胰蛋白酶木瓜蛋白酶酶活力/(U/g)3×1052×106酶解温度/℃5050pH值76.5底物浓度/%77加酶量/(U/g pro)4 0004 000
1.3.6 生长限制性微量元素
在1.3.1节筛氮分析培养基的基础上配制,其中氮源为1.3.4节中筛选出的最佳氮源,分为4组微量元素含量不同的培养基;A组:添加MnSO4·H2O 0.06 g/L;B组:添加MgSO4·7H2O 0.087 g/L;C组:添加MgSO4·7H2O 0.043 g/L、MnSO4·H2O 0.03 g/L;D组:不添加微量元素,其余成分均不变,调节pH 6.2~6.4,115 ℃灭菌20 min后按照2%(体积分数)的比例接种种子液于培养基中,测定其稳定期的OD600。
1.3.7 碳氮消耗比的测定
采用1.3.1节筛氮分析培养基,其中氮源为最佳氮源,以2%(体积分数)的接种量接种在5 mL培养基中,37 ℃恒温培养,每隔2 h取样测定生长曲线以及发酵液中葡萄糖的含量,葡萄糖含量采用葡萄糖试剂盒进行测定。
1.3.8 耐渗透压能力测定
将活化后的种子液体以2%(体积分数)的接种量接种在按照1.3.1节配制的梯度渗透压的液体培养基中,在恒温培养箱中生长12~18 h,每隔2 h取样测定发酵液的OD600,根据生长曲线计算其对数期的代时。
1.3.9 最适生长pH的测定
根据生长速率初始被抑制碳氮消耗比和菌株的耐渗透压能力确定发酵培养基的初始碳氮源的最适添加量,115 ℃灭菌20 min后,调节转速为300 r/min,温度为37 ℃,分别设置pH为5.0、5.5、6.0、6.5,以2%(体积分数)的接种量将种子液接种到平行发酵罐中培养,在稳定期取样测定发酵液中的活菌数。
1.3.10 数据统计与分析
所有实验至少重复3次,结果表示为平均值±标准差。使用SPSS 22.0软件(SPSS Inc.,Chicago,Illinois,USA)分析数据。并进行了单因素方差分析(ANOVA)和DUNCAN多重比较完成了差异显著性分析,P<0.05值的差异被认为具有统计学意义。
2 结果与分析
2.1 底物利用偏好性
2.1.1 碳源的利用偏好性分析
乳酸乳球菌CCFM 1093和CCFM 1032在5种不同碳源的培养基中的生长情况如图1所示,结果显示2株菌对不同糖类的偏好性不尽相同,对同一糖类的偏好性也存在差异,但在葡萄糖为碳源的培养基中稳定期的生物量均为最大,分别为5.808和3.241。葡萄糖作为碳源时利用率更高,因此鉴于乳酸乳球菌对葡萄糖的高亲和力和高增殖效率,综合考虑后,后续实验将会采用葡萄糖作为培养基最佳的碳源。
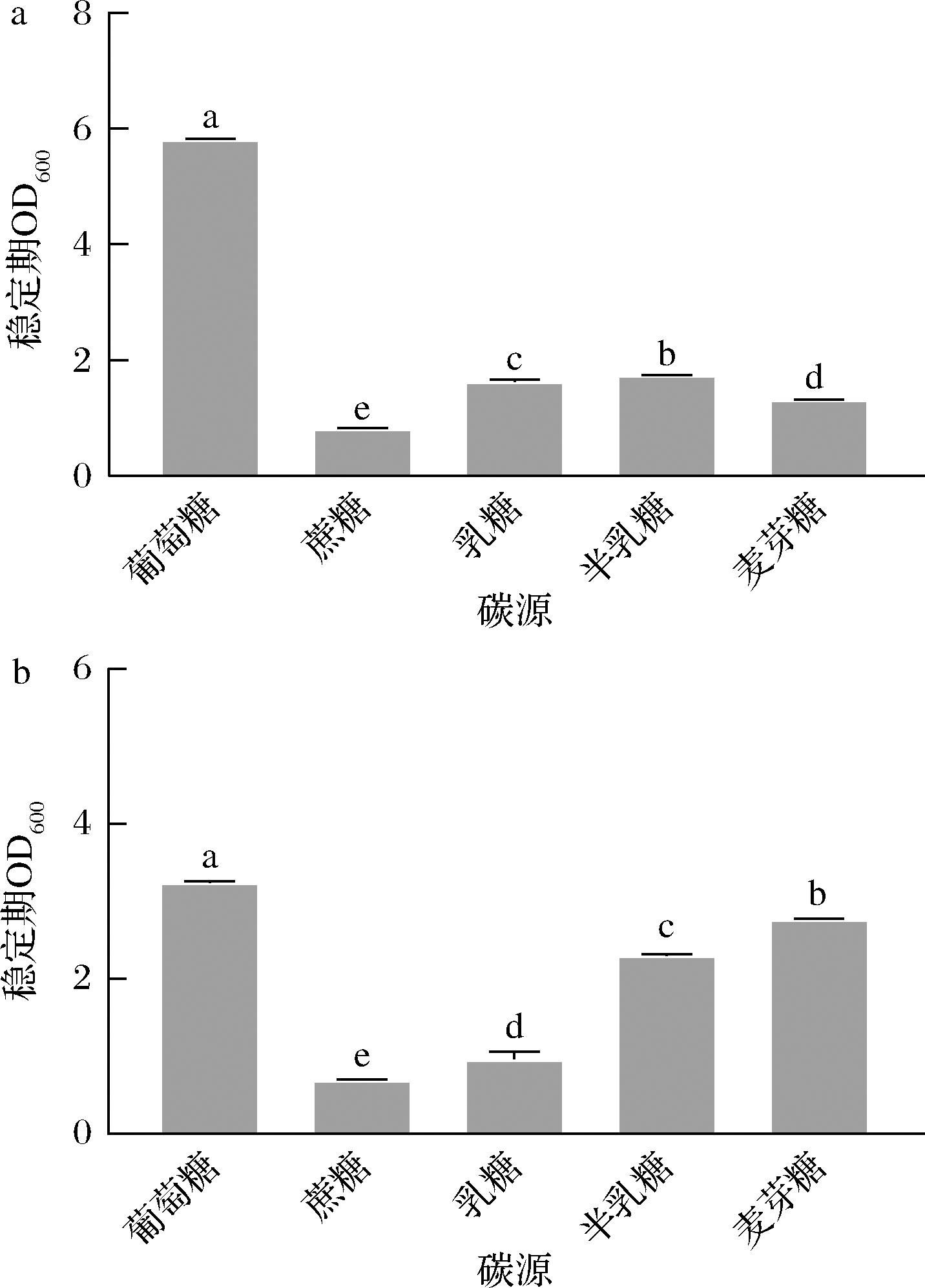
a-乳酸乳球菌CCFM 1093;b-乳酸乳球菌CCFM 1032
图1 乳酸乳球菌在不同碳源下稳定期的最大生物量
Fig.1 Maximum biomass in stable period of L. lactis with different carbon sources
2.1.2 氮源偏好性分析
MRS中的氮源通常不能被完全利用,当培养基中的碳源不足或者渗透压抑制作用导致菌株停止生长时,就会导致氮源的浪费。因此就需要挑选合适的氮源,采用筛氮培养基,提高其中的碳氮比,低浓度的碳氮源也能确保培养基中的pH不会降低到抑制菌株生长的水平,保证菌株停止生长时,培养基中仍有充足的碳源和适宜的pH,分析哪种氮源可以更好地提供氨基酸和肽段。将不同的市售氮源分为四大类:微生物类氮源、植物类氮源、乳基类氮源和动物类氮源(表1),挑选其中的安琪酵母浸粉FM 803、PRO 021 YEAST EXTRACT、安琪大豆蛋白胨FP 410、酪蛋白胨、安琪蛋白胨牛骨FP 326进行初次筛选。
采用单位质量氮源的细胞增殖量结合代时评估对氮源的利用率,图2结果显示不同类别的氮源对菌株的生长和代时有显著性差异,其中安琪酵母浸粉FM 803作为微生物类氮源显示了最高的亲和力,生物量为最大的同时对数期代时也为最小。

a-CCFM 1093不同氮源下的生长曲线;b-CCFM 1093不同氮源下的对数期代时;c-CCFM 1032不同氮源下的生长曲线;d-CCFM 1032不同氮源下的对数期代时
图2 菌株在不同类别氮源下的生长曲线及对数期代时
Fig.2 Growth curve and logarithmic generation time of strain with different types of nitrogen sources
在对微生物类氮源进行第二次筛选时,图3的结果表明安琪酵母浸粉FM 803相较于其他氮源,其对数期代时具有显著性差异,表明相较于其他微生物类氮源更具有竞争力。有研究表明,乳酸乳球菌的蛋白水解系统相关基因表达量不仅会随着生长时期的延长而增大,在对数期达到最大值,而且还受到外界环境和肽供应的影响,更偏好于利用含寡肽的氮源。有研究通过高效液相色谱法对不同氮源氨基酸和肽的组成特性进行了分析,发现安琪酵母浸粉FM 803分子质量2 kDa以下占比为99.3%,含有丰富的游离氨基酸和多肽,这也和微生物类氮源中含有较多的寡肽段的结果相吻合[5-6];而且酵母浸粉中含有嘌呤碱和嘧啶碱以及维生素B,如烟酸、叶酸、泛酸等,这些都是乳酸菌生长所必须的[7]。
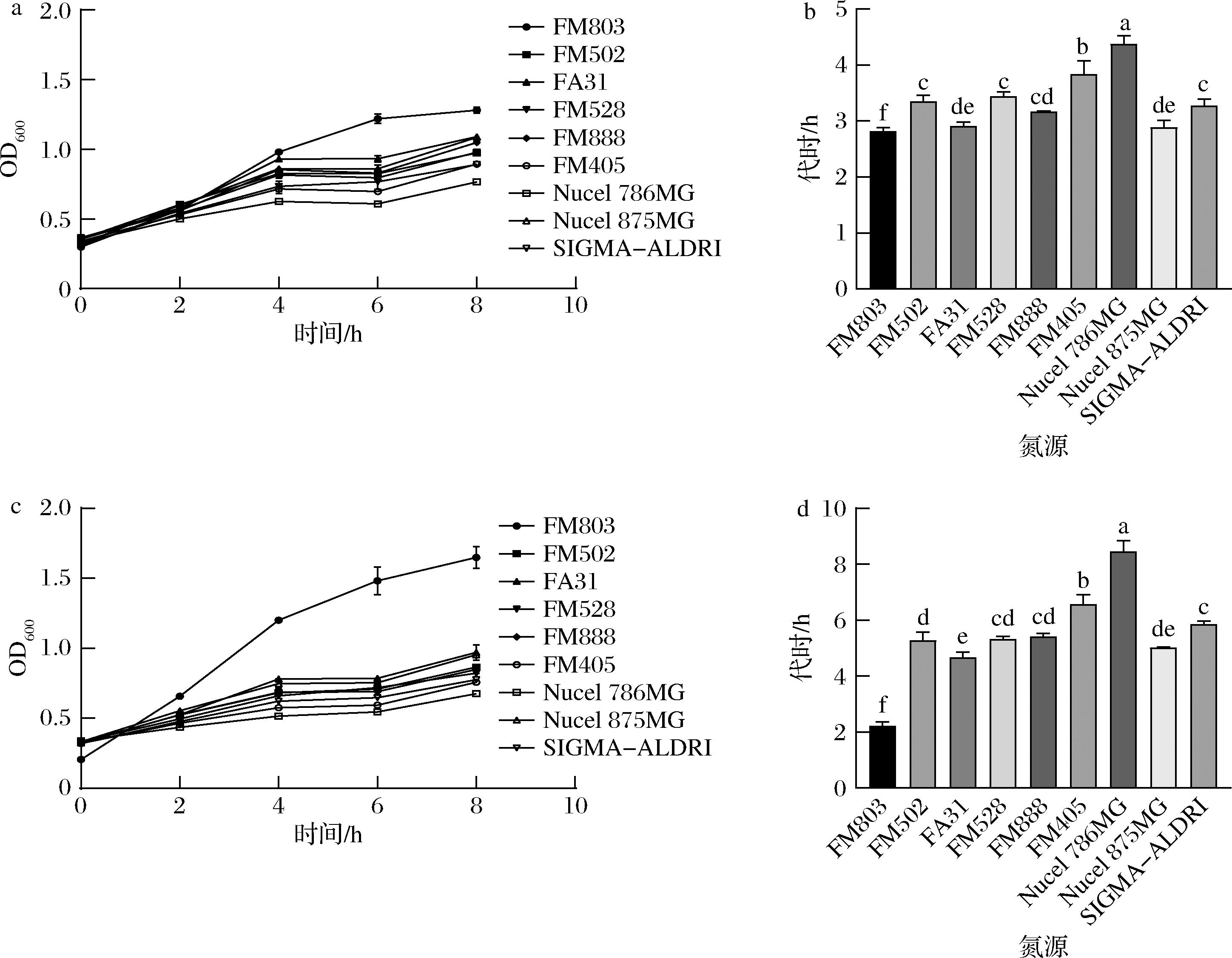
a-CCFM 1093不同氮源下的生长曲线;b-CCFM 1093不同氮源下的对数期代时;c-CCFM 1032不同氮源下的生长曲线;d-CCFM 1032不同氮源下的对数期代时
图3 菌株在不同微生物类氮源下的生长曲线及代时
Fig.3 Growth curve and generation time of strains under different microbial nitrogen sources
2.1.3 酪蛋白肽对乳球菌生长的影响
不同菌株对氮源的偏好性不同是由其蛋白水解系统决定的,菌株在不断的进化过程中,形成了不同的蛋白水解系统水解外界蛋白质产生肽段和氨基酸来满足自身生长需要。目前,蛋白水解系统在乳酸乳球菌中研究的最为清楚,主要分为3个部分:水解酪蛋白的胞外蛋白酶、将水解后的多肽转移至胞内的转运系统以及可水解成游离氨基酸的多种肽酶[8]。ST-GELAIS等[9]报道氮源中肽链的长度是影响乳酸菌生长活性的重要因素;植物乳杆菌缺乏细胞包膜蛋白酶不能够水解利用牛奶蛋白,短链肽相比长链肽更容易被植物乳杆菌吸收[10];双歧杆菌由于缺乏细胞壁蛋白酶,也会更偏好于利用游离氨基酸和小分子肽[11],KUNJI等[12]发现乳酸菌对于小肽的吸收利用还要高于游离氨基酸。
张清丽[13]的研究发现使用木瓜蛋白酶和胰蛋白酶酶解得到的酪蛋白肽对于乳酸菌具有明显的促生长作用。因此,为了进一步提高菌株发酵的活菌数,采用牛奶中的酪蛋白为底物,采用木瓜蛋白酶和胰蛋白酶复合酶酶解制备酪蛋白肽,验证酪蛋白肽对乳酸菌增殖的影响。
按照表2的条件采用复合胰蛋白酶和木瓜蛋白酶对酪蛋白进行水解,将水解后的产物作为多肽类氮源使用。氮源总质量采用30 g/L,按照酪蛋白肽∶安琪酵母浸粉FM 803=1∶3、1∶2、1∶1、2∶1和3∶1的质量比作为发酵培养基的氮源,在稳定期取样,生理盐水梯度稀释后平板计数去比较不同多肽含量对菌株增殖的影响。
图4的结果显示了当酪蛋白肽∶安琪酵母浸粉=1∶2时,乳酸乳球菌的增殖量最多,活菌数分别为(6.80±0.46)×1011和(6.31±0.29)×1011 CFU/mL。VERMEULEN等[14]研究了菌株不同生长时期肽的供应对蛋白水解系统基因表达的影响,发现在发酵过程中随着肽含量的增大,PepT胞内酶的表达水平在一定范围内有显著升高,而Opp和DtpT肽转运系统的基因表达量降低了17倍左右,这和本研究中酪蛋白肽含量过高反而出现了抑制菌株生长的情况相符合,并且酪蛋白肽比例的提高也降低了氮源中其他营养物质的含量,后续实验氮源采用酪蛋白肽和安琪酵母浸粉FM 803复合氮源,质量比为1∶2。

a-乳酸乳球菌CCFM 1093;b-乳酸乳球菌CCFM 1032
图4 氮源的不同比例对菌株生长的影响
Fig.4 The effect of different proportion of nitrogen source on the growth of strain
2.1.4 生长限制性微量元素分析
金属离子在细胞中发挥着十分重要的功能,如作为辅酶因子参与细胞代谢、结构稳定金属蛋白以及与蛋白结合作为信号转导因子、调控基因的表达等,因此维持细胞内的金属离子的相对稳定对细菌的生存至关重要[15]。Mn2+是乳酸菌和其他生物生长所必须的生长因子,可以作为乳酸脱氢酶和其他酶的关键组成部分,Mn2+的加入还对超氧化物歧化酶的活性至关重要,可以保护乳酸菌免受活性氧的直接和间接毒性作用[16];Mg2+广泛参与乳酸菌的葡萄糖代谢,是葡萄糖代谢途径中包括乙酸激酶、半乳糖激酶、磷酸甘油激酶、转酮醇酶和葡糖激酶在内的多种酶的酶促因子[17];已有研究表明Mn2+和Mg2+相较于Fe2+、Zn2+、Ca2+和Cu2+在菌株增殖方面更重要[18],因此本研究挑选Mn2+和Mg2+研究其浓度对菌株增殖的影响。
缺乏Mn2+会导致植物乳杆菌的发酵明显变慢,Mn2+的添加可以增强乳酸脱氢酶的活性,其作为“代谢开关”可以调节丙酮酸到乳酸和其他代谢途径的代谢通量,Mg2+的添加还可以促进ATP的合成,提高植物乳杆菌的发酵活性[19-20]。如图5所示,Mn2+、Mg2+均含有的的培养基其稳定期的OD600明显优于单一添加微量元素和空白组,说明这2种微量元素都是菌株生长所需要的。

图5 不同微量元素含量对菌株生长的影响
Fig.5 The effect of different trace element contents on the growth of strain
2.2 发酵工艺优化
2.2.1 碳氮消耗比
上述的实验得到了最优的底物,而碳氮比对菌株增殖的影响也必须阐明。碳氮比会直接影响微生物的生长和代谢[21],在乳酸菌恒pH发酵过程中,菌株生长会不断消耗发酵培养基中的碳源和氮源,当碳源或氮源有一方不足时,菌株就会停止生长,碳氮比过高过低不仅会造成底物的浪费,还会抑制菌株生长。王玉林等[22]和高欣伟等[23]的研究已经证实了,在乳酸菌的发酵培养中,当初始发酵培养基中碳源和氮源的比例为生长速率被抑制时的碳氮消耗比时,增殖效率最高。按照1.3.6节的方法测定乳酸乳球菌CCFM 1093和CCFM 1032生长速率被抑制时的碳氮消耗比,碳源使用葡萄糖,氮源使用上述复合氮源。图6的结果显示乳酸乳球菌CCFM 1093和CCFM 1032在生长速率被抑制时的碳氮消耗比分别为(2.56±0.06)∶1和(2.07±0.05)∶1。

a-乳酸乳球菌CCFM 1093;b-乳酸乳球菌CCFM 1032
图6 菌株生长速率被抑制时的碳氮消耗比
Fig.6 Carbon and nitrogen consumption ratio when strain growth rate was inhibited
2.2.2 菌株在不同渗透压条件下的生长
渗透压是指溶液中溶质所产生的机械压力,渗透压的大小是由溶液中所含的分子或离子的质点数决定的,高渗溶液会使细胞发生质壁分离,而低渗溶液则会使细胞吸水膨胀,形成很高的膨压,这对于较脆弱的细胞来说是致命的。微生物不断的进化已经形成了一套可以有效抵御外界高渗透压的策略,例如可以通过糖原等大分子贮藏物的合成或分解来调节胞内的渗透压。如图7所示,当渗透压过高时会抑制生长,因此需要尽可能地降低发酵培养基的初始渗透压,也就是说要尽可能降低底物碳氮源的浓度,然而菌株最终的生物量是和底物的量成正比的,因此需要平衡这两者对菌株生长的影响。通过加入NaCl配制梯度渗透压的培养基,测定菌株在不同渗透压的生长曲线和代时,确定其耐渗能力。
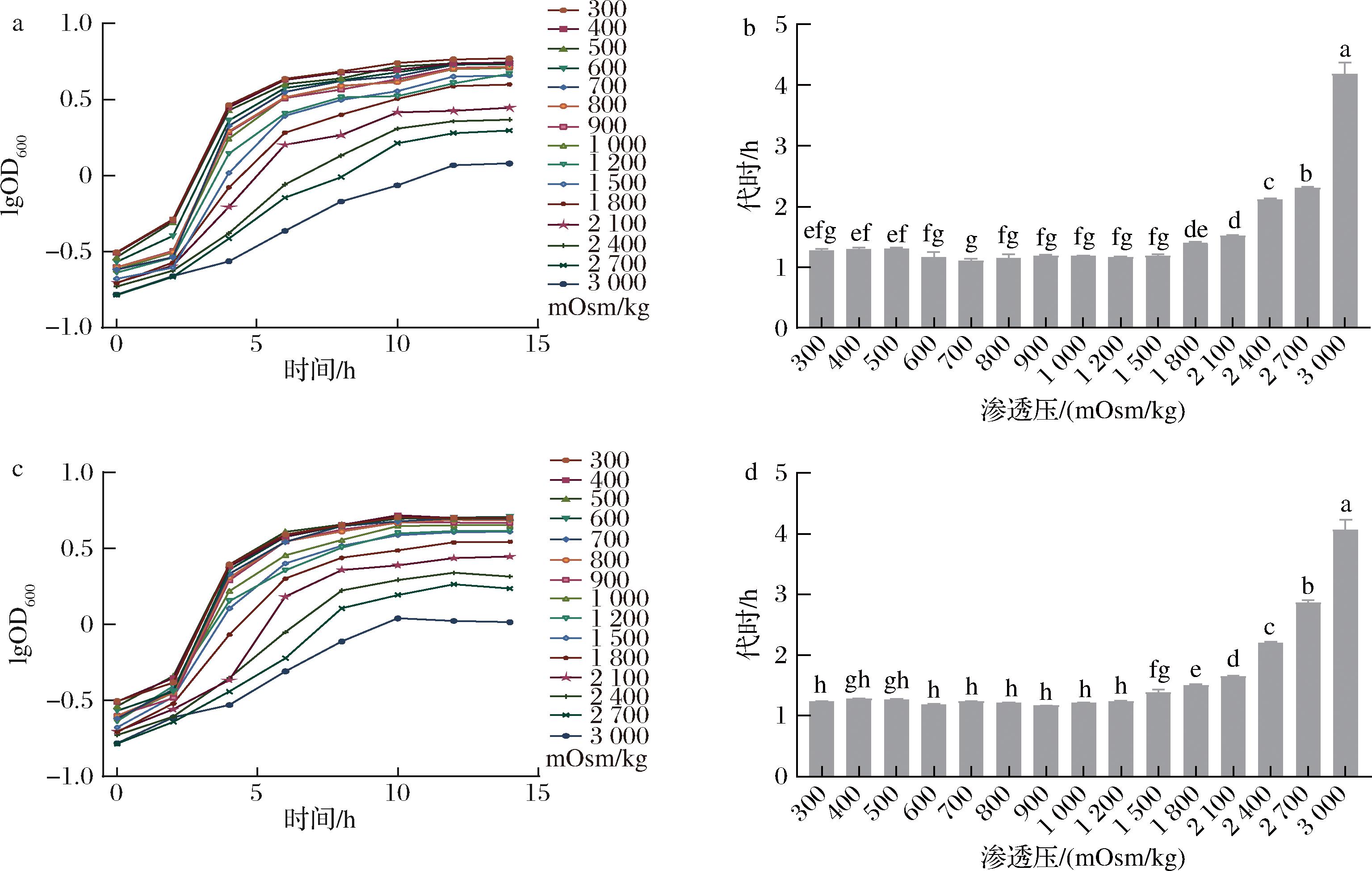
a-CCFM 1093不同渗透压下的生长曲线;b-CCFM 1093不同渗透压下的对数期代时;c-CCFM 1032不同渗透压下的生长曲线;d-CCFM 1032不同渗透压下的对数期代时
图7 菌株在不同渗透压下的生长曲线和对数期代时
Fig.7 Growth curves and generation time during logarithmic growth period at different osmotic pressure
乳酸乳球菌CCFM 1093较CCFM 1032具有更强的耐渗能力,前者在渗透压低于1 500 mOsm/kg时生长速率不受影响,且渗透压继续增高的情况下虽然生长受到一定程度抑制但没有被完全抑制,菌株依然可以得到生长。在发酵过程中,菌株消耗葡萄糖积累酸根,即渗透压增加,但发酵前期生物量较少,底物消耗和渗透压增加亦比较慢,所以培养基浓度控制在不影响菌株生长的浓度,发酵前期对菌株生长的影响不大;待菌达到一定数量且进入对数生长期后期,糖的消耗和渗透压的积累是个较快的增加过程,此时发酵体系的渗透压有可能影响菌的生长,但如果尚未达到完全抑制渗透压,对最高生物量的影响较小。根据前期研究成果[23-24],该菌要达到高生物量,其培养基浓度可以提高至其渗透压达到或略低于1 500 mOsm/kg(生长速率被抑制时的渗透压)。对于乳酸乳球菌CCFM 1032,在渗透压低于1 200 mOsm/kg时,生长速率不受影响,其培养基的浓度可以提高至渗透压达到或略低于1 200 mOsm/kg。
2.2.3 最适生长pH
各类微生物都有其生长适宜的pH范围,乳酸菌为5.0~7.0。乳酸菌在生长代谢过程中会产生引起培养基pH变化的代谢产物,影响酶的活性,如果不对此进行调节,就会抑制菌株生长甚至杀死菌株。而在恒pH培养时就需要寻找最适合菌株生长的pH,从而提高发酵生物量,而且适宜的pH还可以提高菌株细胞膜不饱和脂肪酸的比例和环状脂肪酸的含量,能够在后续的冻干过程中提高存活率[25]。
根据2.2.1节和2.2.2节的结果分析与前期研究成果,菌株培养要达到最高增殖效率,发酵培养基的碳氮比为生长速率被抑制时的碳氮消耗比,发酵培养基的浓度为初始渗透压低于但接近菌株生长速率被抑制时的渗透压[25],因此分别配制乳酸乳球菌CCFM1093和乳酸乳球菌CCFM 1032的发酵培养基为:葡萄糖137 g/L、复合氮源53 g/L、MgSO4·7H2O 0.043 g/L、MnSO4·H2O 0.03 g/L、吐温-80 1 mL/L(渗透压1 200 mOsm/kg);葡萄糖106 g/L、复合氮源51 g/L、MgSO4·7H2O 0.043 g/L、MnSO4·H2O 0.03 g/L、吐温-80 1 mL/L(渗透压1 000 mOsm/kg)。然后在37 ℃条件下控制不同pH培养,研究pH对最高生物量的影响。
图8的结果显示了乳酸乳球菌CCFM 1093和CCFM 1032在pH为5.5的条件下,其发酵液活菌数最高,分别达到了(1.01±0.06)×1012 CFU/mL和(9.78±0.38)×1011 CFU/mL。另研究分析了培养过程中发酵体系渗透压的变化,在发酵前期渗透压未达到各自的生长速率抑制渗透压,菌株生长不受影响;在发酵后期,发酵体系的渗透压得到较高的增幅,菌株发酵终点时乳酸乳球菌CCFM 1093和CCFM 1032的发酵体系渗透压分别为(2 716±12) mOsm/kg和(2 313±17) mOsm/kg,虽对菌株生长速率有影响,但未完全抑制其生长。测定了发酵终点时残糖的含量,分别为(1.90±0.17) g/L和(2.27±0.26) g/L,说明培养基的营养成分得到了高效利用。
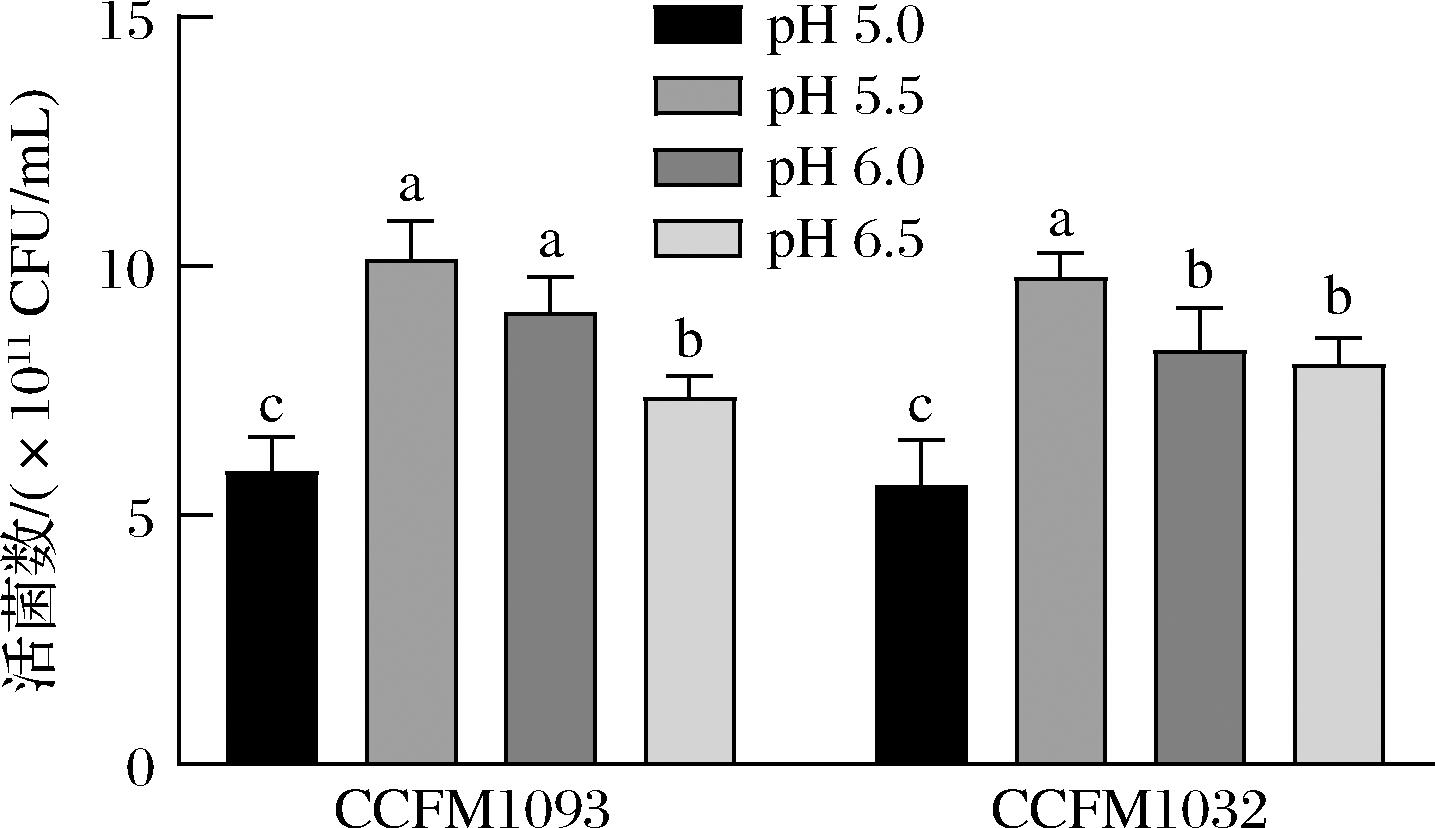
图8 菌株在不同pH下发酵活菌数
Fig.8 The number of viable strains fermented at different pH
3 结论
乳酸乳球菌对葡萄糖的利用率最高;在氮源方面,更倾向于利用酵母浸粉FM 803;另外,微量元素Mn2+和Mg2+都是乳酸乳球菌生长所需要的。乳酸乳球菌在恒pH分批培养时渗透压抑制和底物不足是制约生长的主要原因;乳酸乳球菌CCFM 1093在渗透压达到1 500 mOsm/kg时生长速率被抑制,乳酸乳球菌CCFM 1032在渗透压达到1 200 mOsm/kg时生长速率被抑制。乳酸乳球菌CCFM 1093和CCFM 1032碳氮消耗比分别为2.56∶1和2.07∶1。
发酵培养基的碳氮比为生长速率被抑制时的碳氮消耗比,发酵培养基的浓度为初始渗透压低于但接近菌株生长速率被抑制时的渗透压,菌株培养可以达到较高增殖效率。采用胰蛋白酶和木瓜蛋白酶酶解制备酪蛋白肽作为氮源添加可提高发酵生物量。乳酸乳球菌CCFM 1093的最优培养基:葡萄糖137 g/L、复合氮源53 g/L、MgSO4·7H2O 0.043 g/L、MnSO4·H2O 0.03 g/L、吐温-80 1 mL/L;乳酸乳球菌CCFM 1032最优培养基(g/L):葡萄糖106 g/L、复合氮源51 g/L、MgSO4·7H2O 0.043 g/L、MnSO4·H2O 0.03 g/L、吐温-80 1 mL/L。
[1] CAVANAGH D, FITZGERALD G F, MCAULIFFE O.From field to fermentation:The origins of Lactococcus lactis and its domestication to the dairy environment[J].Food Microbiology, 2015, 47:45-61.
[2] KVAKOVA M, KAMLAROVA A, STOFILOVA J, et al.Probiotics and postbiotics in colorectal cancer:Prevention and complementary therapy[J].World Journal of Gastroenterology, 2022, 28(27):3370-3382.
[3] BOIX-AMOR S A, MONACO H, SAMBATARO E, et al.Novel technologies to characterize and engineer the microbiome in inflammatory bowel disease[J].Gut Microbes, 2022, 14(1):2107866.
S A, MONACO H, SAMBATARO E, et al.Novel technologies to characterize and engineer the microbiome in inflammatory bowel disease[J].Gut Microbes, 2022, 14(1):2107866.
[4] TAN Q A, HU J, ZHOU Y J, et al.Inhibitory effect of Lactococcus lactis subsp.lactis HFY14 on diphenoxylate-induced constipation in mice by regulating the VIP-cAMP-PKA-AQP3 signaling pathway[J].Drug Design, Development and Therapy, 2021, 15:1971-1980.
[5] DETMERS F J M, KUNJI E R S, LANFERMEIJER F C, et al.Kinetics and specificity of peptide uptake by the oligopeptide transport system of Lactococcus lactis[J].Biochemistry, 1998, 37(47):16671-16679.
[6] 汪文丽. 双歧杆菌氮源利用的选择性及特征分析[D].无锡:江南大学, 2021.
WANG W L.Selectivity and characteristic analysis of nitrogen source utilization by bifidobacteria[D].Wuxi:Jiangnan University, 2021.
[7] LIU B B, YANG M H, QI B K, et al.Optimizing l-(+)-lactic acid production by thermophile Lactobacillus plantarum As.1.3 using alternative nitrogen sources with response surface method[J].Biochemical Engineering Journal, 2010, 52(2-3):212-219.
[8] GUÉDON E, RENAULT P, EHRLICH S D, et al.Transcriptional pattern of genes coding for the proteolytic system of Lactococcus lactis and evidence for coordinated regulation of key enzymes by peptide supply[J].Journal of Bacteriology, 2001, 183(12):3614-3622.
[9] ST-GELAIS D, ROY D, HACHÉ S, et al.Growth of nonproteolytic Lactococcus lactis in culture medium supplemented with different casein Hydrolyzates[J].Journal of Dairy Science, 1993, 76(11):3327-3337.
[10] JIANG Y Z, SHI Y Y, LI R, et al.The peptides in oat and malt extracts that are preferentially absorbed by Lactobacillus plantarum and stimulates its proliferation in milk[J].International Journal of Food Science and Technology, 2021, 56(9):4690-4699.
[11] LI S N, TANG S H, HE Q A, et al.Changes in proteolysis in fermented milk produced by Streptococcus thermophilus in co-culture with Lactobacillus plantarum or Bifidobacterium animalis subsp.lactis during refrigerated storage[J].Molecules, 2019, 24(20):3699.
[12] KUNJI E R S, MIERAU I, HAGTING A, et al.The proteotytic systems of lactic acid bacteria[J].Antonie Van Leeuwenhoek, 1996, 70(2):187-221.
[13] 张清丽. 酪蛋白活性肽对乳酸菌生长代谢及酸乳发酵影响的研究[D].广州:华南理工大学, 2011.
ZHANG Q L.Studies on the influence of casein-derived bioactive peptides on lactic acid bacteria metabolism and yoghurt fermentation[D].Guangzhou:South China University of Technology, 2011.
[14] VERMEULEN N, PAVLOVIC M, EHRMANN M A, et al.Functional characterization of the proteolytic system of Lactobacillus sanfranciscensis DSM 20451T during growth in sourdough[J].Applied and Environmental Microbiology, 2005, 71(10):6260-6266.
[15] BEGG S L.The role of metal ions in the virulence and viability of bacterial pathogens[J].Biochemical Society Transactions, 2019, 47(1):77-87.
[16] ZHANG J, LI Y, CHEN W, et al.Glutathione improves the cold resistance of Lactobacillus sanfranciscensis by physiological regulation[J].Food Microbiology, 2012, 31(2):285-292.
[17] DE VRIES W, STOUTHAMER A H.Pathway of glucose fermentation in relation to the taxonomy of bifidobacteria[J].Journal of Bacteriology, 1967, 93(2):574-576.
[18] CUI S M, ZHU D F, MAO B Y, et al.Rapid evaluation of optimal growth substrates and improvement of industrial production of Bifidobacterium adolescentis based on the automatic feedback feeding method[J].LWT, 2021, 143:110960.
[19] CHENG X, DONG Y, SU P, et al.Improvement of the fermentative activity of lactic acid bacteria starter culture by the addition of Mn2+[J].Applied Biochemistry and Biotechnology, 2014, 174(5):1752-1760.
[20] WU P, LI J Z, WANG Y L, et al.Promoting the growth of Rubrivivax gelatinosus in sewage purification by the addition of magnesium ions[J].Biochemical Engineering Journal, 2014, 91:66-71.
[21] OMONI V T, BANKOLE P O, NWOSU T F X, et al.Impact of different nitrogen amendments on the biodegradation of 14C-phenanthrene by endophytic fungal strains in liquid culture[J].Microbiological Research, 2023, 266:127223.
[22] 王玉林, 黄洁, 崔树茂, 等.植物乳杆菌最适生长底物解析及高密度培养工艺[J].食品与发酵工业, 2020, 46(4):19-27.
WANG Y L, HUANG J, CUI S M, et al.Analysis of optimal growth substrate and high-density culture process of Lactobacillus plantarum[J].Food and Fermentation Industries, 2020, 46(4):19-27.
[23] 高欣伟, 崔树茂, 唐鑫, 等.长双歧杆菌的最适底物解析和高密度发酵工艺优化[J].食品与发酵工业, 2021, 47(19):12-20.
GAO X W, CUI S M, TANG X, et al.Optimization of substrate in high-density fermentation of Bifidobacterium longum[J].Food and Fermentation Industries, 2021, 47(19):12-20.
[24] 孙媛媛, 崔树茂, 唐鑫, 等.发酵乳杆菌的生长限制性因素分析及高密度培养工艺优化[J].食品与发酵工业, 2021, 47(6):1-10.
SUN Y Y, CUI S M, TANG X, et al.Growth limiting factors of Lactobacillus fermentum and optimization of its high-density cultivation[J].Food and Fermentation Industries, 2021, 47(6):1-10.
[25] FONSECA F, PÉNICAUD C, TYMCZYSZYN E E, et al.Factors influencing the membrane fluidity and the impact on production of lactic acid bacteria starters[J].Applied Microbiology and Biotechnology, 2019, 103(17):6867-6883.