作为一种食品添加剂,β-半乳糖苷酶(β-galactosidase,EC 3.2.1.23)能够水解乳糖为葡萄糖和半乳糖[1-2],被广泛用于降低乳制品中乳糖含量,进而解决消费者中的乳糖不耐受问题[3]。近年来,随着乳糖不耐受症状逐渐大龄化,β-半乳糖苷酶的需求也逐年增加[4-6]。β-半乳糖苷酶广泛存在于动物、植物和微生物,而微生物源β-半乳糖苷酶具有周期短、产量高、不受季节气候影响等特点而被广泛应用于β-半乳糖苷酶的工业生产[7-9]。不同微生物源β-半乳糖苷酶酶学性质的差异性为其在不同环境中的应用奠定了基础[10]。目前,微生物生产工业中主要使用的菌种包括:(1)乳酸克鲁维酵母、脆壁酵母等酵母菌;(2)米曲霉、黑曲霉等霉菌,其酶最适温度较高、最适pH偏酸性,适合面包及酸奶等酸性环境下使用[11-12]。马克斯克鲁维酵母(Kluyveromyces marxianus)常见于发酵乳制品当中,与乳酸克鲁维酵母同为克鲁维酵母属,也是β-半乳糖苷酶的优质来源。它具备比乳酸克鲁维酵母更强的耐热性,使其在较高温度的应用环境中更具有优势。与此同时,马克斯克鲁维酵母作为生长速率最快的真核生物,其在β-半乳糖苷酶的生产过程中具备更高的效率[13]。虽然当前已报道的研究中有很多利用廉价碳源进行生产的研究,但对廉价氮源的利用却少之又少,且产酶量不稳定。
本研究对马克斯克鲁维酵母GX-UN120最适产酶条件进行优化,选取几种廉价氮源进行尝试,并进一步对β-半乳糖苷酶的酶学性质进行表征,以期为不同环境中的工业应用提供新的选择。
1 材料与方法
1.1 菌种及培养条件
马克斯克鲁维酵母(Kluyveromyces marxianus)GX-UN120为广西大学生命科学与技术学院庞宗文教授惠赠。马克斯克鲁维酵母接种于酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium, YPD)(10 g/L酵母粉、20 g/L蛋白胨、20 g/L葡萄糖)中,40 ℃、150 r/min培养12~16 h,固体培养基则在37 ℃恒温培养箱倒置培养。
1.2 试剂及仪器
蛋白胨、琼脂粉、PBS、邻硝基苯-β-D-半乳糖苷(o-nitrophenyl β-D-galactopyranoside,ONPG),北京索莱宝科技有限公司;酵母粉、胰蛋白胨,英国Oxoid公司;葡萄糖,上海沪试试验器材股份有限公司;NaCl、乳糖、麦芽糖,成都金山化学试剂有限公司;FeCl2、FeCl3、CaCl2、MnCl2、MgCl2、CuCl2,天津欧博凯化工有限公司;大豆蛋白胨、玉米浆干粉,北京鸿润宝顺科技有限公司。
MQL-61R恒温摇床,上海晏泉仪器有限公司;DHP-9082恒温培养箱,上海齐欣科学仪器有限公司;BT103S分配型蠕动泵,保定雷弗科技有限公司;XO-400SD细胞破碎仪,南京先欧仪器制造有限公司;M200PRO光栅型酶标仪,瑞士TECAN公司;MINIC-100金属浴,德誉实验室设备。
1.3 最适产酶条件单因素优化
以YPD为初始培养基对GX-UN120产β-半乳糖苷酶的主要影响因素进行单因素优化,培养36 h获得粗酶液的单位酶活力为指标。将培养基中碳源等量替换为蔗糖、乳糖、半乳糖、麦芽糖、果糖;培养基中氮源等量替换为大豆蛋白胨、胰蛋白胨、玉米浆干粉、(NH4)2SO4;发酵温度分别为25、30、35、40、45 ℃(pH 6.5, 200 r/min);初始pH分别为5.5、6、6.5、7、7.5、8(40 ℃、200 r/min);摇床转速分别为0、50、100、150、200 r/min(40 ℃, pH 6.5)。
1.4 粗酶液的提取
将供试菌液以2%(体积分数)接种量接种于YPD液体培养基中,200 r/min,40 ℃培养36 h。取30 mL菌液离心10 min(4 ℃、8 000 r/min),弃去上清液,收集菌体。用pH 7.0,10 mmol/L的PBS重悬洗涤菌体。然后加入30 mL PBS并将其置于冰上进行超声波细胞破碎(250 W, 5 s/5 s,20 min),细胞破碎液经8 000 r/min离心10 min后取上清液,经0.22 μm滤膜抽滤后即为粗酶液。
1.5 β-半乳糖苷酶的纯化
1.5.1 (NH4)2SO4分级沉淀
将9个装有10 mL粗酶液的烧杯置于冰水浴中,在磁力搅拌条件下缓缓向其中加入研磨后的(NH4)2SO4粉末,分别添加至不同饱和度(20%~90%)。继续搅拌20 min后在4 ℃下静置30 min。静置后离心(4 ℃、8 000 r/min、15 min)取上清液,测定酶活力,以确定沉淀所用最佳的(NH4)2SO4饱和度。依照测定获得的最佳(NH4)2SO4饱和度,缓缓向粗酶液中添加(NH4)2SO4粉末,取最佳(NH4)2SO4饱和度范围内析出的沉淀物,于PBS中复溶后待后续实验使用。
1.5.2 透析脱盐
将1.5.1节中所获得的复溶酶液装入透析袋中,然后将其置于4 ℃冰柜中透析,每5 h换1次超纯水直至粗酶液中电导率不再改变。
1.5.3 DEAE-Sepharose阴离子交换柱层析
预先将DEAE-Sepharose Fast Flow阴离子交换柱用pH 6.5的PBS冲洗平衡4个柱体积,再将透析获得的粗酶液上样15 mL。分别使用浓度为0.1、0.3、0.5、0.7 mol/L NaCl缓冲液进行冲洗,流速1 mL/min,洗脱180 min,每6 min收集1管洗脱液。最后将收集的洗脱液依次在280 nm下测定其吸光度并绘制洗脱曲线。对收集获得的每一个洗脱峰进行乳糖酶活力检测,将具有活性的洗脱液经透析脱盐、冻干复溶后得到纯化酶。
1.5.4 蛋白浓度检测
粗酶液及纯化酶中的蛋白浓度采用BCA法测定其质量浓度。
1.6 β-半乳糖苷酶的活性测定
采用ONPG试验法测定[14]。以10 mmol/L,pH 6.5的PBS为溶剂配制质量浓度为1 mg/mL的ONPG溶液。取400 μL上述溶液于2 mL离心管中,35 ℃预热10 min后,加入200 μL稀释后的β-半乳糖苷酶酶液,于35 ℃反应15 min后加入2.5 mL,0.15 mol/L的Na2CO3溶液终止反应,静置5 min后,用酶标仪测定反应液在420 nm波长处的吸光度。将35 ℃条件下,1 min催化ONPG反应生成1 μmol邻硝基苯酚(o-nitrophenol,ONP)的酶量定义为一个标准酶活力单位[15]。
最适温度及热稳定性测定:分别将200 μL酶液加入到400 μL提前预热的ONPG溶液中,于25、30、35、40、45 ℃的金属浴中反应15 min后测定其相对酶活力;将200 μL酶液于20、30、40、50、60 ℃的金属浴中热处理30 min后再测定其酶活力。
最适pH及pH稳定性测定:分别用pH 4、5、6、7、8、9的PBS溶液配制ONPG溶液,再加入200 μL酶液于40 ℃的金属浴中反应15 min后测定其相对酶活力。将纯化后的酶分别溶于pH 4、5、6、7、8、9的PBS中,30 min后取200 μL加入到对应pH的ONPG溶液中测定相对酶活力。
金属离子对酶活力影响:用含有10 mmol/L不同金属盐的(CaCl2、CuCl2、MgCl2、ZnCl2、FeCl2、FeCl3、MnCl2)PBS配制ONPG溶液,再加入200 μL酶液后于40 ℃的金属浴中反应15 min后测定其相对酶活力。
酶促动力学测定:以10 mmol/L,pH 6.5的PBS为溶剂分别配制质量浓度为0.5、1.0、2.0、3.0、4.0、5.0 mg/mL的ONPG溶液。分别取400 μL上述溶液与200 μL酶液于40 ℃的金属浴中反应15 min后测定其相对酶活力。
2 结果与分析
2.1 马克斯克鲁维酵母最适产酶条件单因素优化
2.1.1 碳源及氮源对菌株产酶量的影响
如图1所示,不同碳源下GX-UN120的β-半乳糖苷酶产量呈现出显著差异,以半乳糖和乳糖为碳源时的产酶量分别为21.8和19.5 U/mL,是以葡萄糖为碳源的7.7和6.9倍,这可能表示该菌株表达β-半乳糖苷酶的相关基因受乳糖操纵子调控。此外,除去常见的有机无机氮源外还选择了2种廉价氮源,其中玉米浆干粉效果最佳产酶量达到了3.1 U/mL,推测为玉米浆干粉中的维生素及无机盐对酵母产酶产生了促进作用。

a-碳源组;b-氮源组
图1 不同碳源、氮源对菌株产酶量的影响
Fig.1 Effects of different carbon sources and nitrogen sources on enzyme production of strains
注:不同小写字母表示具有显著差异(P<0.05),下同。
2.1.2 培养基初始pH及温度对菌株产酶量的影响
温度通过影响菌体内相关催化酶的活性来影响菌体的生长和繁殖速率,从而影响其产酶量。如图2所示,GX-UN120在40 ℃时产酶量最高,当温度偏离40 ℃,产酶量与温度的改变值均成负相关。此外,不同的初始pH对菌株产酶量也有类似的影响。pH为6.5时,菌株产酶量达到最大值,这表明菌株更偏好中性环境。
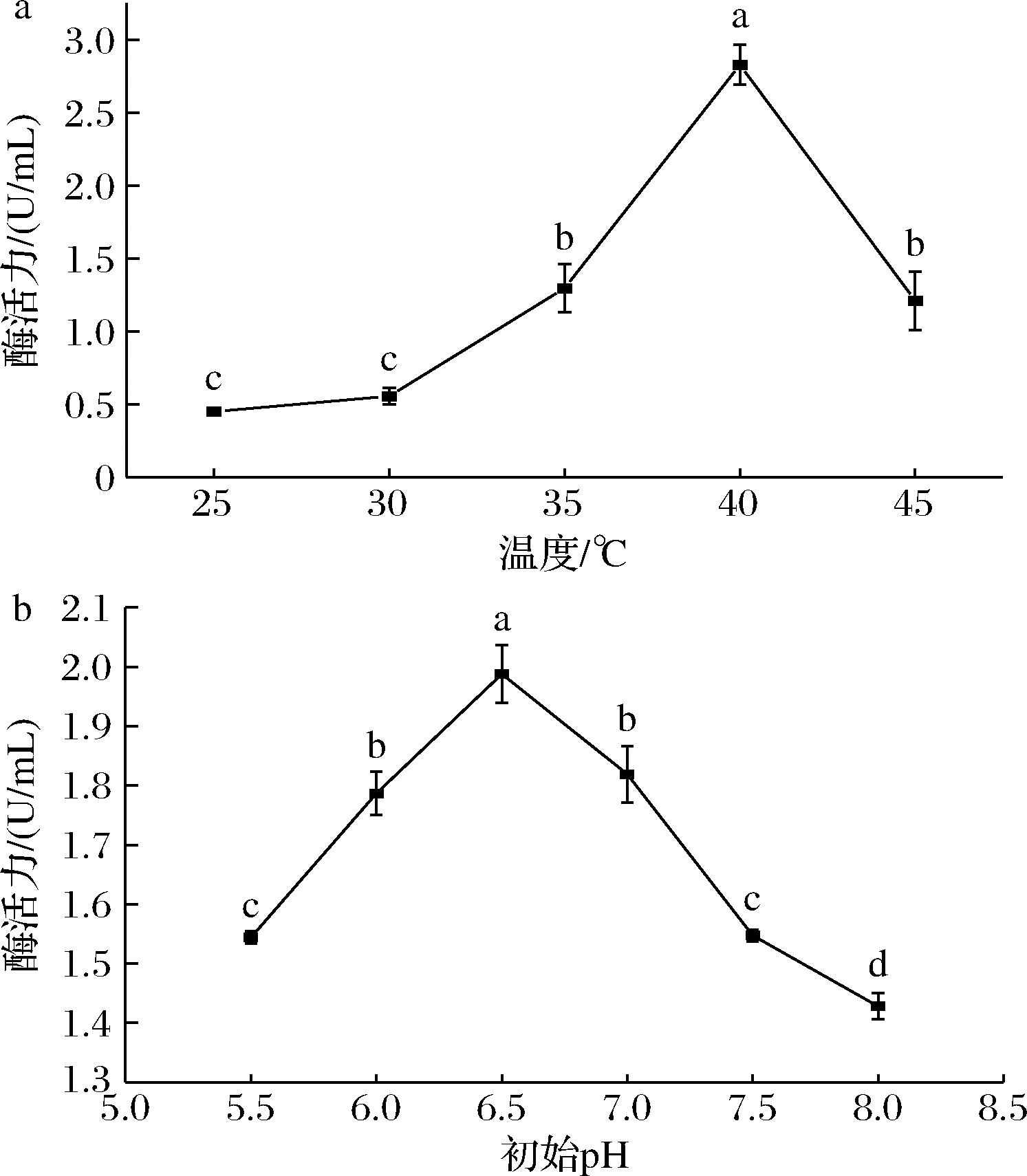
a-温度;b-pH
图2 不同培养温度、初始pH对菌株产酶量的影响
Fig.2 Effects of different culture temperature and initial pH on the enzyme production of strain
2.1.3 摇床转速对菌株产酶量影响
摇床转速通过影响摇瓶发酵的溶氧量来影响菌株的代谢。由图3可知,转速<150 r/min时菌株的产酶量较低且转速的改变对产酶量几乎没有影响。而转速150 r/min时,菌株的产酶量最高。推测为β-半乳糖苷酶的表达需要一定量的O2激活,在未达到一定量的溶氧环境下以低水平进行本底表达。

图3 转速对菌株产酶量的影响
Fig.3 Effect of shaker rotation speed on enzyme production of strains
2.2 β-半乳糖苷酶的纯化
2.2.1 (NH4)2SO4分级沉淀
由图4可知,当(NH4)2SO4饱和度由300 g/L提高到400 g/L时,上清液的相对酶活力降低了61.01%,这表明大部分酶在300~400 g/L的饱和度间被沉淀了下来。因此,后续实验中选择保留300~400 g/L所获得的沉淀,用10 mmol/L,pH 6.5的PBS复溶后于4 ℃冰箱保存待后续实验使用。
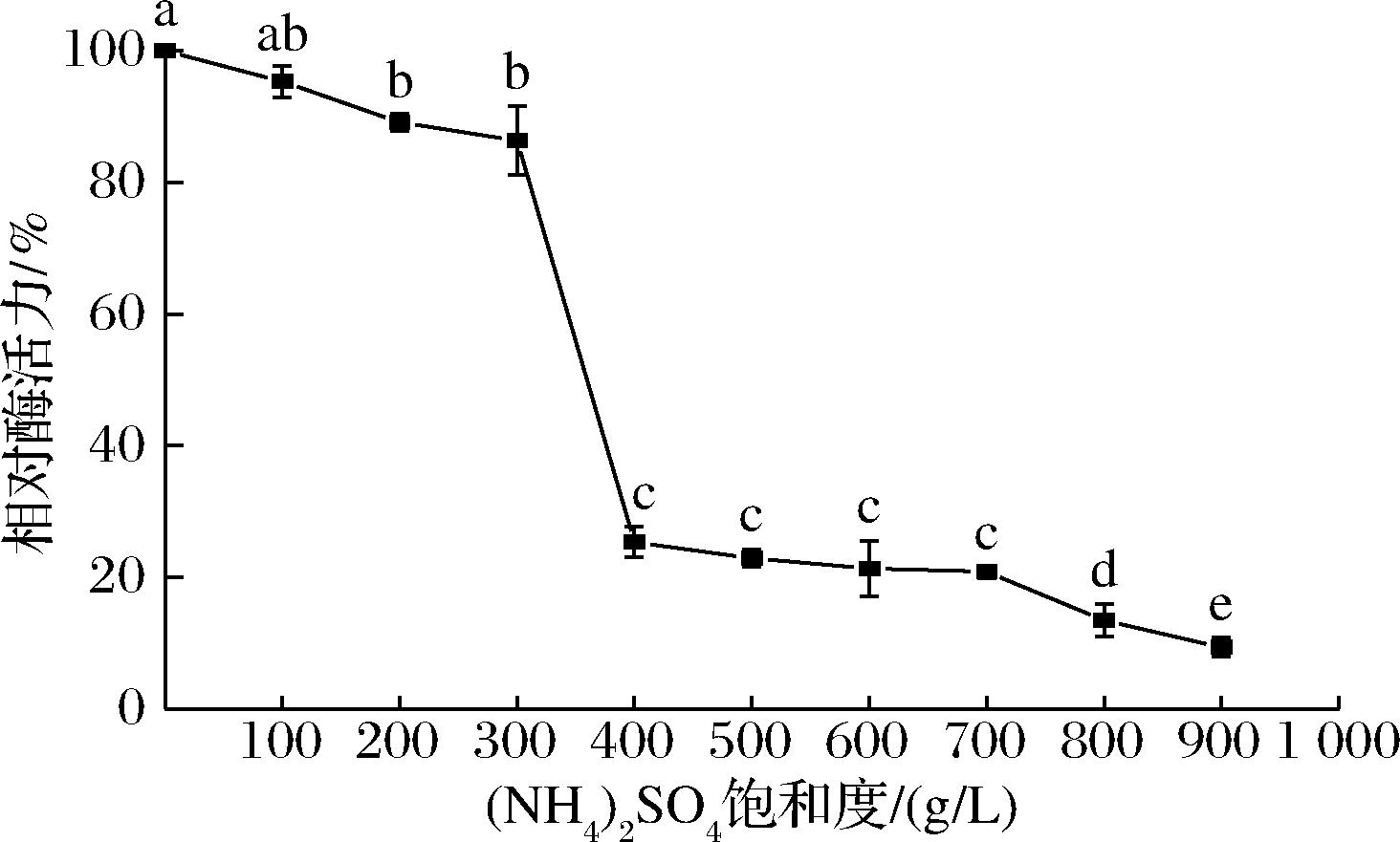
图4 添加不同浓度(NH4)2SO4后上清液的相对酶活力
Fig.4 Relative enzyme activities of supernatants at different saturation of ammonium sulfate
2.2.2 DEAE-FastFlow阴离子交换柱层析
根据前期对该酶基因序列的测序结果,预测该酶的等电点小于7,因此选用DEAE-FF阴离子交换柱对该酶进行纯化[16]。如图5所示,分别在0.3、0.5、0.7 mol/L浓度的NaCl洗脱得到3个蛋白峰,检测其洗脱液的乳糖酶活性发现0.3 mol/L NaCl洗脱获得的活性峰具有β-半乳糖苷酶活性。纯化结果如表1所示,纯化后粗酶液比酶活力由1.41 U/mg提升至124.09 U/mg,纯化倍率达到88.01倍,粗酶液中大量杂蛋白被除去,酶液得到了很大程度的纯化。
表1 马克斯克鲁维酵酵母GX-UN120 β-半乳糖苷酶纯化结果
Table 1 Purification results of K.marxianus GX-UN120 β-galactosidase
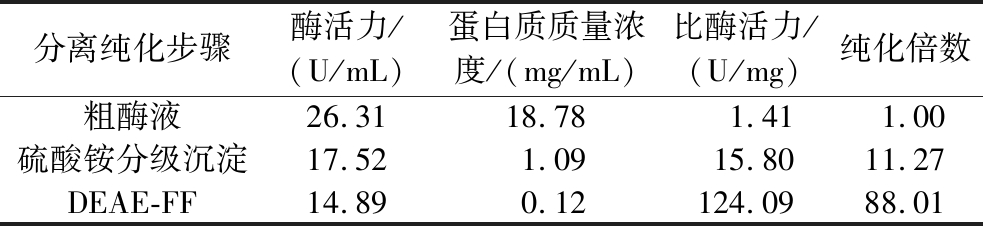
分离纯化步骤酶活力/(U/mL)蛋白质质量浓度/(mg/mL)比酶活力/(U/mg)纯化倍数粗酶液26.3118.78 1.411.00硫酸铵分级沉淀17.521.0915.8011.27DEAE-FF14.890.12124.09 88.01

图5 马克斯克鲁维酵母β-半乳糖苷酶纯化曲线
Fig.5 Kluyveromyces marxianus β-galactosidase purification curve
2.3 β-半乳糖苷酶性质表征
2.3.1 温度对β-半乳糖苷酶影响
如图6所示,从耐热菌株GX-UN120中获得的β-半乳糖苷酶的最适温度为40 ℃,且在20~40 ℃该酶均表现出良好的热稳定性,30 min热处理后活力均可维持在90%以上。因此该酶能够适应温度跨度较大的工业环境,具备相应的工业应用潜力。
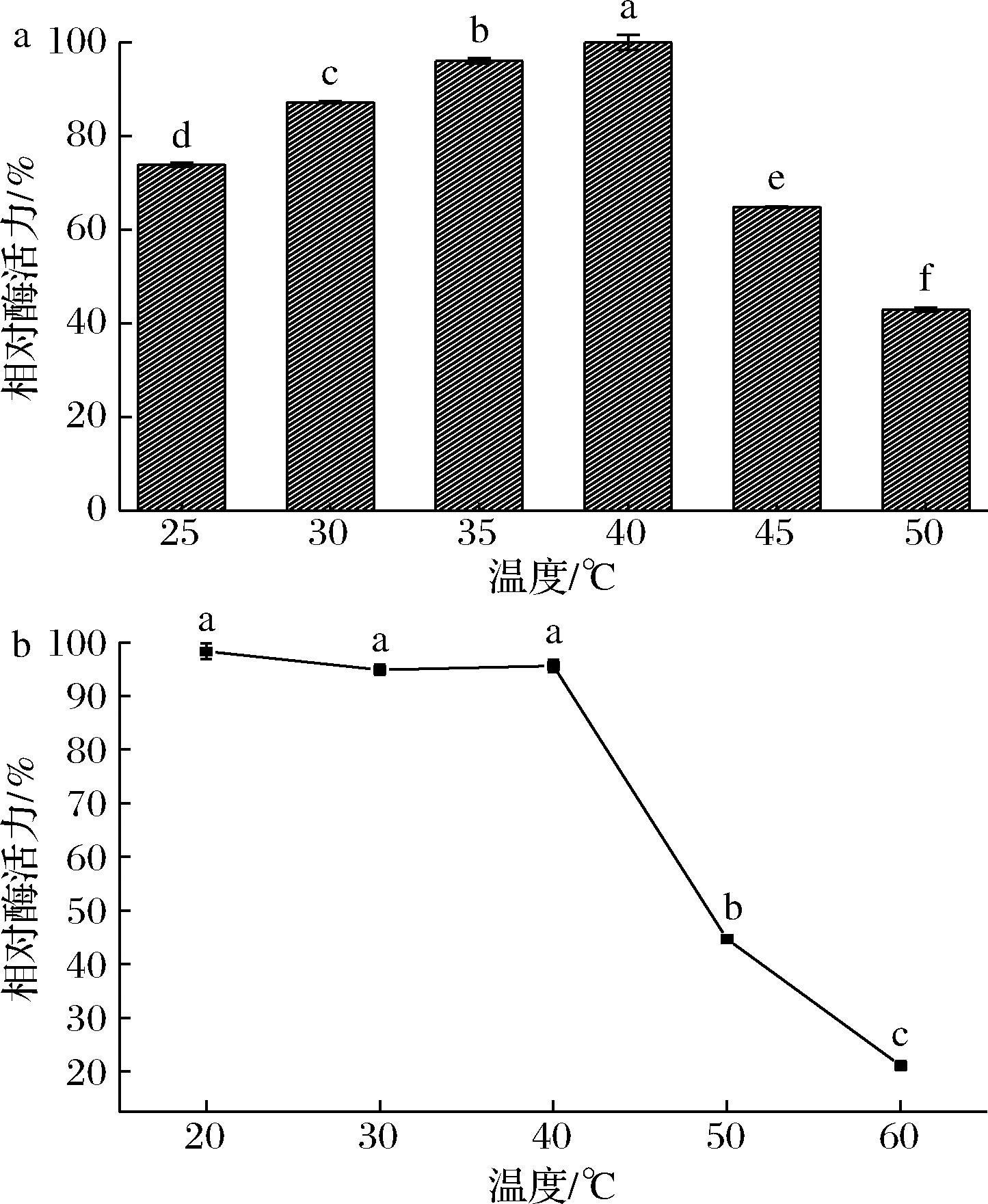
a-活性;b-热稳定性
图6 温度对β-半乳糖苷酶的活性及热稳定性
Fig.6 Effect of temperature on β-galactosidase activity temperature and thermostability
2.3.2 pH对β-半乳糖苷酶影响
pH影响酶的构象以及催化相关关键基团的解离状态来改变酶活性。如图7所示,来自GX-UN120的β-半乳糖苷酶最适pH为6;在偏酸和偏碱的环境下酶活力均较低;特别是在pH=4时酶活力下降至41.8%,可能是由于环境中H+的增加影响活性基团的解离。此外,该酶在中性环境下稳定性较高,30 min内酶活力能保持在90%以上。
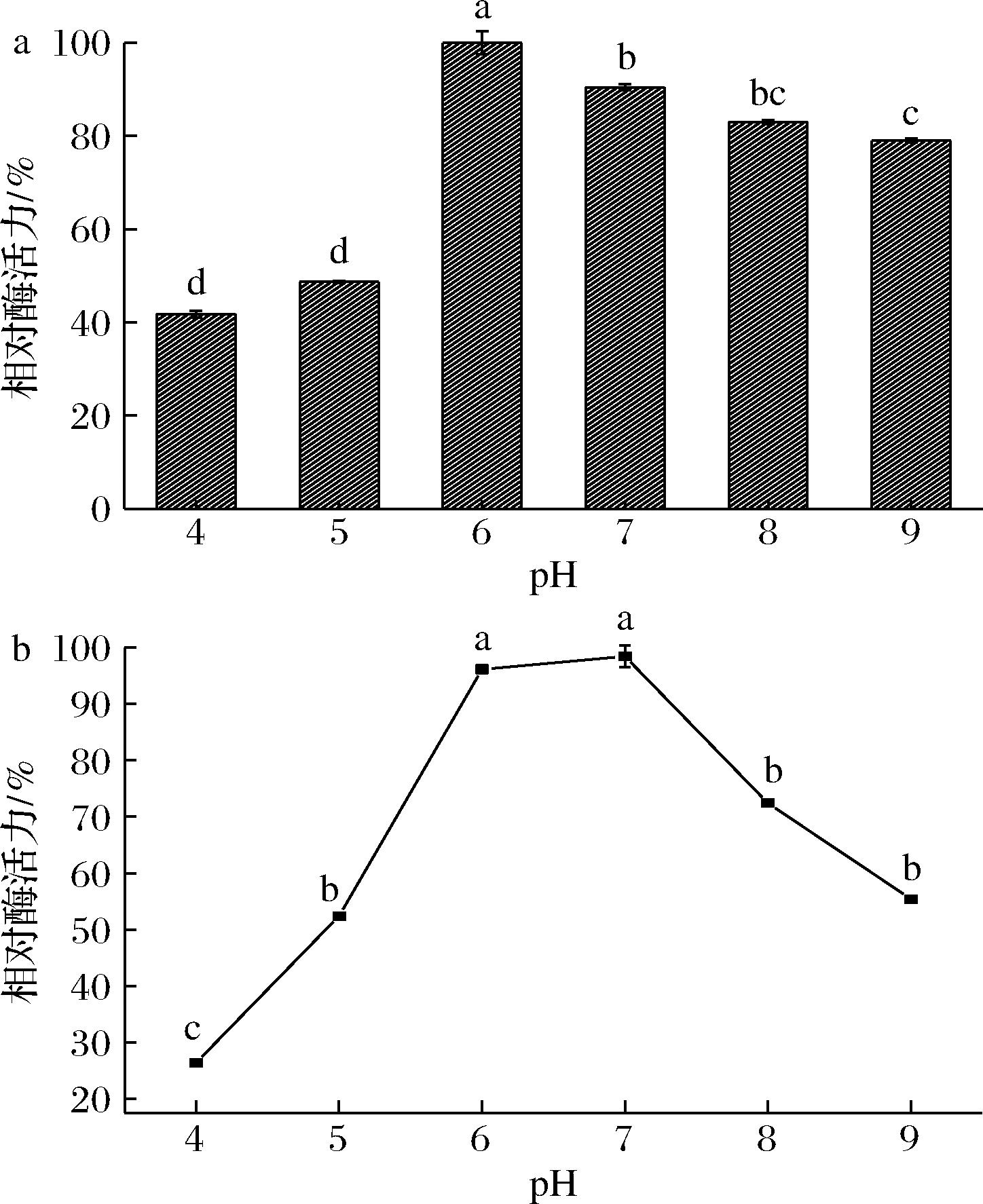
a-活性;b-稳定性
图7 pH对β-半乳糖苷酶的活性及稳定性的影响
Fig.7 Effect of pH on the activity and stability of β-galactosidase
2.3.3 金属离子对β-半乳糖苷酶影响
不同的金属离子与酶结合或改变酶的构象来影响酶的活力。如图8所示,来自GX-UN120的β-半乳糖苷酶受到Cu2+、Ca2+、Zn2+、Fe2+、Fe3+、Mn2+的抑制作用,其中Zn2+、Ca2+、Fe3+的抑制率均达90%以上。尽管Mg2+对该酶具有促进作用,但仅提高了6.97%,因此Mg2+可能不是作为其活性中心存在,而是帮助稳定酶蛋白的构象而起作用。

图8 金属离子对β-半乳糖苷酶的活性影响
Fig.8 Effect of metal ions on the activity of β-galactosidase
2.3.4 酶促动力学常数
根据不同浓度底物浓度下酶促反应的反应速率,绘制Lineweaver-Burk双倒数图如图9所示。根据其线性方程y=1.508 5x+0.285 5,可计算得到该酶的Km为5.28 mmol/L,Vmax为0.29 mmol/min。再根据公式Vmax=kcat[E0]可以计算得到 kcat=4.74 s-1。

图9 不同底物浓度酶促反应速率双倒数图
Fig.9 Double reciprocal graph of enzymatic reaction rate with different substrate concentrations
3 结论与讨论
本研究对具有良好乳糖水解活力的马克斯克鲁维酵母GX-UN120进行了发酵条件的优化,在20 g/L半乳糖、20 g/L玉米浆干粉、40 ℃、初始pH 6.5、150 r/min的条件下使其产酶量最高达到26.3 U/mL。郑义等[15]对马克斯克鲁维酵母ZX-5的发酵条件进行了优化,在碳源优化上获得了类似的结果;但以乳糖为碳源产酶量仅能达到最高产量的一半。本研究中以乳糖为碳源的条件下,可达最高产酶量的89.3%,因此考虑到底物成本等因素,在工业生产当中乳糖或许比半乳糖更具有优势。同时,得益于这一性质,GX-UN120或许可以利用一些富含乳糖的工业副产物(如乳清等)来进行β-半乳糖苷酶的生产,从而进一步降低工业生产过程中的成本[17]。
对酶进行纯化后进一步探究其酶学性质,其最适温度为40 ℃,最适pH 6,Km为5.28 mmol/L、kcat为4.74 s-1、受到Mg2+的促进作用并且受到Ca2+、Zn2+、Fe3+的完全抑制作用达90%以上。酵母来源的β-半乳糖苷酶一般最适pH偏中性,因此适用范围广泛,但其最适温度会受酵母种类的影响而产生较大差异[18]。黄倩等[19]研究的马克斯克鲁维酵母XL-B36所产乳糖酶受到Mg2+、Mn2+的促进作用,热稳定性与GX-UN120性质类似但最适温度为47 ℃。同样的,郑义等[15]研究的马克斯克鲁维酵母ZX-5受Mn2+的促进,但最适温度为35 ℃。正是由于β-半乳糖苷酶性质的多样性,使其在不同环境中的应用提供了选择空间。本研究中所表征的β-半乳糖苷酶适用于中性环境,适用温度范围较广,可在20~40 ℃保持稳定,具备良好的应用前景。
[1] 董艺凝, 陈海琴, 张灏, 等.β-半乳糖苷酶的研究现状与进展[J].食品与生物技术学报, 2018, 37(4):337-343.
DONG Y N, CHEN H Q, ZHANG H, et al.Research status and progress on β-galactosidase[J].Journal of Food Science and Biotechnology, 2018, 37(4):337-343.
[2] 曹晓聪, 张朝军, 苟浩琦, 等.棉花β-半乳糖苷酶基因家族的全基因组鉴定及分析[J].分子植物育种, 2021, 19(24):8032-8047.
CAO X C, ZHANG C J, GOU H Q, et al.Genome-wide identification and analysis of cotton β-galactosidase gene family[J].Molecular Plant Breeding, 2021, 19(24):8032-8047.
[3] 范琴, 曾璐瑶, 杨金茹, 等.粪便宏基因组来源低分子量碱性β-半乳糖苷酶的异源表达及酶学性质[J].微生物学通报, 2022, 49(5):1594-1607.
FAN Q, ZENG L Y, YANG J R, et al.Heterologous expression and enzyme properties of low-molecular-weight and basic β-galactosidase derived from the metagenome of faeces[J].Microbiology China, 2022, 49(5):1594-1607.
[4] JUMA A A, BADAWY A S, MOHAMMED S B.Isolation and purification of β-galactosidase enzyme from local lactic acid bacteria isolates to overcome the phenomenon of non-degradation of milk lactose[J].IOP Conference Series:Earth and Environmental Science, 2021, 910(1):012075.
[5] POP C, SPOREA I, SANTOS J, et al.Efficacy and safety of a novel therapeutic of natural origin (NTN) in adult patients with lactose intolerance:A multicenter, randomized, crossover, double-blind, placebo-controlled study[J].Foods, 2022, 11(17):2600.
[6] KOLEV P, ROCHA-MENDOZA D, RUIZ-RAM REZ S, et al.Screening and characterization of β-galactosidase activity in lactic acid bacteria for the valorization of acid whey[J].JDS Communications, 2022, 3(1):1-6.
REZ S, et al.Screening and characterization of β-galactosidase activity in lactic acid bacteria for the valorization of acid whey[J].JDS Communications, 2022, 3(1):1-6.
[7] 段小果, 李博, 贺银凤.乳酸菌与酵母菌共生机理的研究进展[J].微生物学通报, 2017, 44(8):1988-1995.
DUAN X G, LI B, HE Y F.Progress in symbiotic mechanism between lactic acid bacteria and yeast[J].Microbiology China, 2017, 44(8):1988-1995.
[8] ZHAO J C, MU Y L, GU X Y, et al.Site-directed mutation of β-galactosidase from Streptococcus thermophilus for galactooligosaccharide-enriched yogurt making[J].Journal of Dairy Science, 2022, 105(2):940-949.
[9] INTANON M, ARREOLA S L, PHAM N H, et al.Nature and biosynthesis of galacto-oligosaccharides related to oligosaccharides in human breast milk[J].FEMS Microbiology Letters, 2014, 353(2):89-97.
[10] ZHOU Z H, HE N N, HAN Q, et al.Characterization and application of a new β-galactosidase Gal42 from marine bacterium Bacillus sp.BY02[J].Frontiers in Microbiology, 2021, 12:742300.
[11] 卜建斌, 云战友, 邢黎明.β-半乳糖苷酶的应用及固定化[J].农产品加工(学刊), 2006(2):4-6;10.
BU J B, YUN Z Y, XING L M.Application and immobilization of β-galactosidase[J].Academic Periodical of Farm Products Processing, 2006(2):4-6;10.
[12] DEUTCH CHARLES E, FARDEN AMY M, DICESARE EMILY S.Characterization of β-galactosidase and α-galactosidase activities from the halophilic bacterium Gracilibacillus dipsosauri[J].Annals of Microbiology, 2021, 71(1):1-15.
[13] KARIM A, GERLIANI N, AÏDER M.Kluyveromyces marxianus:An emerging yeast cell factory for applications in food and biotechnology[J].International Journal of Food Microbiology, 2020, 333:108818.
[14] LEDERBERG J.The β-D-galactosidase of Escherichia coli, strain K-12[J].Journal of Bacteriology, 1950, 60(4):381-392.
[15] 郑义, 张健, 曹永强, 等.产β-D-半乳糖苷酶马克斯克鲁维酵母的分离鉴定及其产酶特性[J].食品科学, 2020, 41(2):158-165.
ZHENG Y, ZHANG J, CAO Y Q, et al.Isolation, identification and enzymatic characteristics of Kluyveromyces marxianus producing β-D-galactosidase[J].Food Science, 2020, 41(2):158-165.
[16] 剧淑君, 缪铭, 江波.克鲁维酵母SK16.001 β-半乳糖苷酶的纯化工艺研究[J].食品工业科技, 2011, 32(7):182-185.
JU S J, MIAO M, JIANG B.Study on purification process of β-galactosidase from Kluyveromyces SK16.001[J].Science and Technology of Food Industry, 2011, 32(7):182-185.
[17] DUAN F Y, ZHAO R F, YANG J Y, et al.Integrated utilization of dairy whey in probiotic β-galactosidase production and enzymatic synthesis of galacto-oligosaccharides[J].Catalysts, 2021, 11(6):658.
[18] 谢毅, 江培翝, 郭杰炎.乳酸克鲁维酵母(Kluveromces lactis)β-半乳糖苷酶的稳定性研究[J].复旦学报(自然科学版), 1999,38(5):523-528.
XIE Y, JIANG P H, GUO J Y.Studies on stability of K.lactis β-galactosidase[J].Journal of Fudan University (Natural Science), 1999,38(5):523-528.
[19] 黄倩, 李洁, 郑晓春, 等.奶酪中高产β-半乳糖苷酶菌株的筛选及发酵条件的优化[J].中国调味品, 2021, 46(2):23-30.
HUANG Q, LI J, ZHENG X C, et al.Screening of high-yield β-galactosidase strains in cheese and optimization of fermentation conditions[J].China Condiment, 2021, 46(2):23-30.