L-半胱氨酸是一种重要的含硫氨基酸,被广泛用于医药制造、食品加工及饲料生产等领域[1-4]。全球每年L-半胱氨酸需求超过4 000 t,市场前景十分光明[5]。目前,L-半胱氨酸的工业生产仍采用盐酸水解毛发的传统生产模式[6],但这种方法有很大的局限性,如收率低和环境污染严重。微生物发酵法具有原料来源广泛、生产条件温和、环境友好和过程容易控制等优势,越来越受到各国的重视。
微生物发酵法生产L-半胱氨酸常用的菌株主要是大肠杆菌(Escherichia coli)和谷氨酸棒杆菌(Corynebacterium glutamicum)[7-9]。由于L-半胱氨酸代谢合成网络复杂且具细胞毒性[3,10-11],建立高效L-半胱氨酸生产菌株面临困难。因此,降低细胞毒性是微生物发酵法高效生产L-半胱氨酸的一种有效策略。早期的研究报道,有效的外排系统可以维持细胞内氨基酸的稳态,降低反馈抑制和细胞毒性,并进一步提高生产能力[5,12-13]。LIU等[14]在大肠杆菌中发现了一种新的L-蛋氨酸外排蛋白YjeH,它显著提高了L-蛋氨酸的转运能力,并将L-蛋氨酸的产量提高了70%。ZHANG等[15]在谷氨酸棒杆菌中发现了一种新的L-丝氨酸转运蛋白SerE,SerE过表达极大地提高了菌株对L-丝氨酸的耐受性,并进一步提高了L-丝氨酸的产量。外排系统在L-半胱氨酸的生产中也发挥着重要作用,能够显著增强L-半胱氨酸的分泌能力和耐受性,从而进一步提高L-半胱氨酸生产能力[5,16]。在大肠杆菌中已鉴定出至少5种L-半胱氨酸外排蛋白,包括EamA、EamB、Bcr、CydDC和TolC[2]。过表达上述外排蛋白后,胞内L-半胱氨酸水平显著降低,同时L-半胱氨酸耐受性和生产能力显著提高[17]。此外,CefA和CefB被鉴定为菠萝泛菌的L-半胱氨酸外排蛋白,过表达这些蛋白可降低生长抑制效应并促进胞外L-半胱氨酸积累[18]。
谷氨酸棒杆菌作为一种重要的食品安全级工业微生物,被认为是生产各种氨基酸的理想菌株[19-20]。在谷氨酸棒杆菌中,约750种膜蛋白涉及17个转运蛋白家族作为氨基酸候选转运蛋白。然而,很少有关于谷氨酸棒杆菌L-半胱氨酸转运蛋白的研究。为了提高谷氨酸棒杆菌L-半胱氨酸的生产能力,寻求其自身的L-半胱氨酸转运蛋白具有重要意义。因此,本研究通过转录组分析寻找谷氨酸棒杆菌中潜在的L-半胱氨酸转运蛋白,然后测试不同候选基因缺失突变体的L-半胱氨酸耐受性和外排能力,最终确定Cg1298-Cg1299为谷氨酸棒杆菌的L-半胱氨酸外排蛋白,并通过发酵实验探究了转运蛋白对L-半胱氨酸发酵的影响。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
表1列出了本研究中使用的所有菌株。其中大肠杆菌DH5a与谷氨酸棒杆菌ATCC 13032均由中国科学院天津工业生物技术研究所保藏。
表1 本研究所用的菌株
Table 1 Strains used in this study

菌株特性来源DH5aE.coli derivative;host for plasmids construction英杰公司WTWild-type;C.glutamicum strain ATCC 13032实验室保藏QWild-type strain with deletion of CD;expression of CysE(M201R) from E.coli实验室保藏Δcg1299C.glutamicum mutant derivative;lacks the cg1299 gene本研究构建Δcg1298C.glutamicum mutant derivative;lacks the cg1298 gene本研究构建Δcg0456C.glutamicum mutant derivative;lacks the cg0456 gene本研究构建Δcg1288C.glutamicum mutant derivative;lacks the cg1288 gene本研究构建Δcg2277C.glutamicum mutant derivative;lacks the cg2277 gene本研究构建Δcg2301C.glutamicum mutant derivative;lacks the cg2301 gene本研究构建Δcg2339C.glutamicum mutant derivative;lacks the cg2339 gene本研究构建Δcg3245C.glutamicum mutant derivative;lacks the cg3245 gene本研究构建Δcg3321C.glutamicum mutant derivative;lacks the cg3321 gene本研究构建Δcg0314C.glutamicum mutant derivative;lacks the cg0314 gene本研究构建Δcg1100C.glutamicum mutant derivative;lacks the cg1100 gene本研究构建Δcg1664C.glutamicum mutant derivative;lacks the cg1664 gene本研究构建Δcg2279C.glutamicum mutant derivative;lacks the cg2279 gene本研究构建Δcg2812C.glutamicum mutant derivative;lacks the cg2812 gene本研究构建Δcg1298-1299C.glutamicum mutant derivative;lacks the cg1298-cg1299 gene本研究构建Δcg1299-RΔcg1299 derivative;containing the pECXK-99E-cg1299 plasmid本研究构建Δcg1298-RΔcg1298 derivative;containing the pECXK-99E-cg1298 plasmid本研究构建Δcg1298-1299-RΔcg1 298-1299 derivative;containing the pECXK-99E-cg1298-cg1299 plasmid本研究构建Q-cg1299Q derivative;containing the pECXK-99E-cg1299 plasmid本研究构建Q-cg1298Q derivative;containing the pECXK-99E-cg1298 plasmid本研究构建Q-cg1298-1299Q derivative;containing the pECXK-99E-cg1298-cg1299 plasmid本研究构建
本研究中使用的质粒列于表2。大肠杆菌-谷氨酸棒杆菌穿梭载体pECXK-99E用于基因表达,pCRD206用于基因敲除。
表2 本研究所用的质粒
Table 2 Plasmids used in this study

质粒特性来源pCRD206Temperature-sensitive replicon;gene sacB of Bacillus subtilis;Kanr实验室保藏pCRD206-1299pCRD206 derivative;deleting cg1299 gene本研究构建pCRD206-1298pCRD206 derivative;deleting cg1298 gene本研究构建pCRD206-0456pCRD206 derivative;deleting cg0456 gene本研究构建pCRD206-1288pCRD206 derivative;deleting cg1288 gene本研究构建pCRD206-2277pCRD206 derivative;deleting cg2277 gene本研究构建pCRD206-2301pCRD206 derivative;deleting cg2301 gene本研究构建pCRD206-2339pCRD206 derivative;deleting cg2339 gene本研究构建pCRD206-3245pCRD206 derivative;deleting cg3245 gene本研究构建pCRD206-3321pCRD206 derivative;deleting cg3321 gene本研究构建pCRD206-0314pCRD206 derivative;deleting cg0314 gene本研究构建pCRD206-1100pCRD206 derivative;deleting cg1100 gene本研究构建pCRD206-1664pCRD206 derivative;deleting cg1664 gene本研究构建pCRD206-2279pCRD206 derivative;deleting cg2279 gene本研究构建pCRD206-2812pCRD206 derivative;deleting cg2812 gene本研究构建pCRD206-1298-1299pCRD206 derivative;deleting cg1298-cg1299 gene本研究构建pECXK-99EShuttle expression vector of C.glutamic-E.coli;Kanr实验室保藏pECXK-99E-cg1298pECXK-99E deribative;containing the cg1298 gene from C.glutamicum本研究构建pECXK-99E-cg1299pECXK-99E deribative;containing the cg1299gene from C.glutamicum本研究构建pECXK-99E-cg1298-1299pECXK-99E deribative;containing the cg1298-cg1299 gene from C.glutamicum本研究构建
1.1.2 工具酶及试剂
T4DNA连接酶、Eco31 I、Xba I、BamH I、Phusion DNA聚合酶,Thermo Fisher公司;质粒提取试剂盒和胶回收试剂盒,天根生物公司;卡那霉素,索莱宝生物科技有限公司;L-半胱氨酸,上海阿拉丁生化科技股份有限公司;琼脂粉、脑心浸液、胰蛋白胨、酵母提取物、葡萄糖、尿素、山梨醇、玉米浆,天津百赛斯生物科技有限公司;其他试剂(如NaCl、K2HPO4、MgCl2等)均为国产分析纯。
1.1.3 培养基及培养条件
Luria-Bertani(LB)(g/L):酵母提取物 5,胰蛋白胨 10,NaCl 10。LBHIS(g/L):酵母提取物 2.5,胰蛋白胨 5,脑心浸液 18.5,NaCl 5,山梨醇 91。CGXII(g/L):葡萄糖 5,NH4Cl 20,尿素 5,KH2PO4 1,K2HPO4 1.3,MgCl2 0.25,CaCl2 10 mg/L,3-吗啉丙磺酸42,生物素0.2 mg/L,维生素B1 0.1 mg/L,原儿茶酸0.03 mg/L,FeCl2 10 mg/L,MnCl2 10 mg/L,ZnCl2 1 mg/L,CuCl2 0.2 mg/L,NiCl2 0.02 mg/L。种子培养基(g/L):葡萄糖 30,玉米浆 20,(NH4)2SO4 5,尿素 2,MgSO4 0.5,KH2PO4 0.5。发酵培养基(g/L):葡萄糖 80,玉米浆 30,Na2S2O3 20,KH2PO4 1,MgSO4 0.5,L-蛋氨酸 0.5,L-异亮氨酸 0.5,MnSO4 0.01,FeSO4 0.01,维生素B1 1 mg/L,生物素0.2 mg/L。此外,向发酵培养基中添加20 g/L CaCO3以缓冲pH。PBS(pH=7.2)(g/L):NaCl 8,KH2PO4 0.2,Na2HPO4·12 H2O 2.9,KCl 0.2。其中固体培养基加20 g/L琼脂粉。
大肠杆菌DH5a为宿主细胞,在37 ℃ LB培养基中进行基因克隆。谷氨酸棒杆菌ATCC 13032在32 ℃ LBHIS培养基中培养。如有抗生素需求,将50 μg/L或25 μg/L卡那霉素分别添加到培养基中,用来培养大肠杆菌和谷氨酸棒杆菌。
1.2 实验方法
1.2.1 基因敲除
利用特异性引物以谷氨酸棒杆菌ATCC 13032基因组DNA为模板扩增目标基因。PCR扩增使用Phusion DNA聚合酶。通过Gibson组装方法将纯化的产物克隆到目标载体中[21],并获得重组质粒。根据OKIBE等[22]报道的方法,通过两步同源重组法构建谷氨酸棒杆菌的基因缺失菌株。
1.2.2 转录组测序分析
将过夜培养谷氨酸棒杆菌ATCC 13032按照初始OD600值为0.1的接种量转接至新鲜LBHIS培养基,向体系中添加不同浓度的L-半胱氨酸(5、20、50 mmol/L)。当菌株生长到对数中期时,立即采集样本进行RNA提取。RNA制备纯细胞/细菌试剂盒用于分离提纯总RNA。转录组测序在北京诺禾致源科技股份有限公司完成,参考基因组为(https://www.genome.jp/dbget-bin/get_linkdb?-t+genes+gn:T00244)。转录组测序结果已上传NCBI SRA数据库,登录号:PRJNA942449。
1.2.3 L-半胱氨酸耐受性分析
琼脂平板中随机选择单克隆,在32 ℃ LBHIS培养基中培养过夜。洗涤并收集菌体,PBS重悬,将重悬后的菌液转接到新鲜的LBHIS培养基中(含有0、2.5、5、7.5、10 mmol/L L-半胱氨酸),初始OD600值为0.1。32 ℃,200 r/min培养定时取样,使用紫外分光光度计(中国上海鑫茂仪器)在600 nm处检测吸光度值。
1.2.4 二肽摄取和L-半胱氨酸外排测定
为了表征野生型和缺失突变体的外排性能,使用二肽Cys-Tyr测试L-半胱氨酸的外排能力[23]。菌株在LBHIS培养基中32 ℃过夜培养。低速离心收菌、重悬并转接至新鲜CGXII培养基中,初始OD600值为0.1。菌体达到中期生长阶段,立即收菌并用32 ℃预热的PBS将其重悬至OD600= 10。将重悬物转接到32 ℃预热的CGXII培养基中,并加入10 mmol/L的Cys-Tyr,在200 r/min,32 ℃条件下培养10 min取样,测定细胞外L-半胱氨酸浓度。
1.2.5 摇瓶发酵
挑选单菌落WT、cg1298-R、cg1299-R和cg1298-1299-R接种至5 mL LBHIS 液体培养基中,200 r/min,32 ℃过夜培养。以5%接种量接种至20 mL种子培养基中,200 r/min,32 ℃培养12 h后,转接至发酵培养基进行发酵生产L-半胱氨酸,控制初始OD值为1,发酵时长为72 h。
1.2.6 L-半胱氨酸测定方法
使用GAITONDE[24]的标准方法测定L-半胱氨酸的浓度。茚三酮溶液与L-半胱氨酸发生特异性反应,形成的粉红色产物在560 nm处可检测到吸收光。
2 结果与分析
2.1 L-半胱氨酸对谷氨酸棒杆菌生长的影响
L-半胱氨酸的细胞毒性被认为是微生物法发酵生产L-半胱氨酸的一个限制因素[3,17,23]。为了研究这一毒性机制对谷氨酸棒杆菌的影响,我们首先监测了在不同浓度L-半胱氨酸(0、2.5、5、7.5、10 mmol/L)胁迫下谷氨酸棒杆菌的生长能力。如图1所示,谷氨酸棒杆菌生物量随L-半胱氨酸浓度的增加而降低,尤其在添加10 mmol/L L-半胱氨酸压力下,该菌株的生物量仅为对照组的44%。

图1 谷氨酸棒杆菌在不同浓度L-半胱氨酸胁迫下的细胞生长测定
Fig.1 Measurement of the cell growth of C.glutamicum cultivated with different concentrations of L-cysteine
2.2 转录组分析L-半胱氨酸对谷氨酸棒杆菌的影响
为了探究谷氨酸棒杆菌的L-半胱氨酸解毒机制,我们对其进行了不同浓度L-半胱氨酸 (5、20、50 mmol/L)的胁迫,并做转录组测序分析。
2.2.1 转录组分析L-半胱氨酸生物合成途径基因变化
为了进一步了解L-半胱氨酸对谷氨酸棒杆菌的影响,我们分析了L-半胱氨酸生物合成途径相关基因的表达变化。谷氨酸棒杆菌中L-半胱氨酸的合成途径包括碳模块和硫模块,其中硫模块分为硫酸盐同化途径和硫代硫酸盐同化途径。在谷氨酸棒杆菌中硫酸盐同化途径比较清晰,但是硫代硫酸盐同化途径鲜有报道。如图2所示,受到L-半胱氨酸胁迫时,谷氨酸棒杆菌硫酸盐同化途径的关键基因表达量都显著下降,这将会降低其硫同化的速度,进而影响L-半胱氨酸的生物合成。另一方面,L-半胱氨酸碳模块的基因表达量也都下调,使得更少的代谢流流向L-半胱氨酸合成途径,进一步影响合成L-半胱氨酸。以50 mmol/L L-半胱氨酸处理组为例,与对照组相比,硫酸盐同化途径基因cysD、cysN、cysH、cysI和cysJ分别下降93.1%、94.5%、93.7%、91.1%和84.7%;L-半胱氨酸的碳模块基因serA、serC、serB、cysE和cysK分别下降27.0%、26.6%、39.0%、16.8%和78.5%。由于L-半胱氨酸具有细胞毒性,使得谷氨酸棒杆菌不能积累过量的L-半胱氨酸,这成为以谷氨酸棒杆菌为底盘菌株生产L-半胱氨酸不可避免的问题。先前的研究报道,将L-半胱氨酸从体内转运到体外可以降低L-半胱氨酸对细胞的毒害作用[25],从而提高菌株对L-半胱氨酸的耐受性,因此,寻找合适的L-半胱氨酸外排蛋白显得尤为重要。

图2 转录组分析L-半胱氨酸生物合成途径基因表达水平变化
Fig.2 The expression levels of L-cysteine biosynthesis pathway genes in C.glutamicum based on transcriptome analysis
注:L-半胱氨酸胁迫下,菌体内基因表达水平提高(上调)、降低(下调)分别用红、绿色表示;方框颜色表示所示基因log2(Fold Change)值;从左到右方框依次表示5、20、50 mmol/L L-半胱氨酸处理的样品。APS:腺苷5′-磷酸硫酸盐;PAPS:3′-磷酸腺苷-5′-磷酸硫酸。cysND:硫酸腺苷转移酶;cysH:磷酸腺苷磷酸硫酸盐还原酶;cysJI:亚硫酸盐还原酶;cysK:O-乙酰丝氨酸(硫醇)裂解酶;sseA I:硫代硫酸盐硫转移酶蛋白;aecD:胱硫醚β-裂解酶;serA:磷酸甘油酸脱氢酶;serC:磷酸丝氨酸转氨酶;serB:磷酸丝氨酸磷酸化酶;cysE:丝氨酸氧乙酰转移酶;eno:磷酸丙酮酸水合酶;pyk:丙酮酸激酶;ace:丙酮酸脱氢酶E1组分;gltA:柠檬酸合酶;can:乌头酸水合酶;icd:异柠檬酸脱氢酶;odhA:2-氧戊二酸 脱氢酶;sucDC:琥珀酰辅酶A合酶;sdhAB:琥珀酸脱氢酶AB;fum:富马酸水合酶;mdh:苹果酸脱氢酶;mqo:苹果酸脱氢酶
2.2.2 谷氨酸棒杆菌外排蛋白筛选
谷氨酸棒杆菌中对L-半胱氨酸转运蛋白的研究甚少,本研究通过转录组测序,以转运蛋白基因在3个L-半胱氨酸胁迫条件下的表达量变化为依据,寻找谷氨酸棒杆菌中潜在的L-半胱氨酸外排蛋白。为了进一步筛选谷氨酸棒杆菌中的天然L-半胱氨酸外排蛋白,使用火山图分析了L-半胱氨酸胁迫下实验组中的差异表达基因,如图3-a所示,与野生型谷氨酸棒杆菌ATCC 13032相比,在5、20、50 mmol/L L-半胱氨酸处理组中分别有131、245、303个基因上调,122、198、262个基因下调。其中,与转运蛋白相关的差异表达基因131个,其中表达上调基因有32个,结合KEGG注释从差异表达基因中选出14个候选的L-半胱氨酸外排蛋白基因 cg2812、cg2279、cg1664、cg1100、cg0314、cg3321、cg3245、cg2339、cg2301、cg2277、cg1288、cg0456、cg1298和cg1299(表3、图3-b),其中实验室前期已经对候选基因cg1298和cg1299进行了初步的探究[26]。

a-不同浓度L-半胱氨酸对谷氨酸棒杆菌基因表达影响的火山图;b-候选外排蛋白的基因表达变化;c-候选外排蛋白敲除菌株L-半胱氨酸的耐受性分析;d-cg1298和cg1299的生物信息学分析;e-候选外排蛋白回补菌株L-半胱氨酸的耐受性分析
图3 不同浓度 L-半胱氨酸胁迫下谷氨酸棒杆菌转录组分析及候选靶点的验证
Fig.3 An overview of transcriptome analysis among different concentrations of L-cysteine-treated and functional verification of candidate genes
注:G0、G5、G20、G50分别表示培养基中添加0、5、20、50 mmol/L L-半胱胺酸培养处理菌体。
表3 L-半胱氨酸转运蛋白候选基因
Table 3 Candidate genes of L-cysteine exporters

基因描述cg1298ABC转运蛋白;ABC转运蛋白跨膜区cg1299ABC转运蛋白cg0456MFS转运蛋白cg1288MFS转运蛋白cg2277ABC转运蛋白ATP结合蛋白cg2301MFS转运蛋白cg2339EamA家族转运蛋白cg3245MFS转运蛋白cg3321ABC转运蛋白ATP结合蛋白cg0314AzlC家族;ABC转运蛋白;渗透酶;AzlC蛋白cg1100ABC转运蛋白ATP结合蛋白;ABC转运蛋白跨膜区cg1664SulP家族;硫酸盐渗透酶家族;STAS结构域cg2279ABC转运蛋白ATP结合蛋白;ABC转运蛋白跨膜区cg2812ABC转运蛋白ATP结合蛋白
2.3 谷氨酸棒杆菌L-半胱氨酸外排蛋白功能鉴定
2.3.1 L-半胱氨酸候选蛋白对谷氨酸棒杆菌生长影响
为了探究候选外排蛋白的L-半胱氨酸转运功能,我们对野生型谷氨酸棒杆菌ATCC 13032中15个候选基因分别进行敲除,将所得菌株在含有0 mmol/L和7.5 mmol/L L-半胱氨酸的LBHIS培养基中培养,培养8 h后测定其细胞生长。如图3-c所示,在0 mmol/L L-半胱氨酸处理组中,所有菌株的生长没有明显差异。然而在7.5 mmol/L L-半胱氨酸处理组中,cg1298和cg1299缺失菌株的生物量显著减少,与野生型谷氨酸棒杆菌ATCC 13032菌株相比分别下降了13.5%和16.7%。
生物信息学分析发现,cg1298和cg1299在基因组上有重叠区域(图3-d),推测其可能协同发挥功能。因此,对cg1298和cg1299同时进行敲除,并研究了该双敲菌株对L-半胱氨酸的耐受性。结果表明,与单敲菌株相比,双敲菌株对L-半胱氨酸更加敏感,与野生型谷氨酸棒杆菌ATCC 13032菌株相比,其生长降低了24.2%(图3-c)。为了进一步研究cg1298和cg1299的功能,对双敲菌株进行了基因的回补,得到其回补菌株Δcg1298-cg1299-R,并进行生长测试(图3-e)。如图3-e所示,回补菌株的生长与野生型谷氨酸棒杆菌ATCC 13032的基本一致,证明了回补菌株恢复了其对L-半胱氨酸的抗性。
2.3.2 Cg1298-Cg1299对L-半胱氨酸外排能力测定
外排能力被认为是外排蛋白的一项重要指标。为更好地了解候选蛋白Cg1298-Cg1299对L-半胱氨酸的转运能力,使用二肽Cys-Tyr检测3种缺失菌(Δcg1298、Δcg1299 和Δcg1298-cg1299)的L-半胱氨酸外排能力。二肽转运原理如图4-a所示,Cys-Tyr穿过细胞膜经过细胞代谢分解成氨基酸后,L-半胱氨酸通过外排蛋白排出胞外。
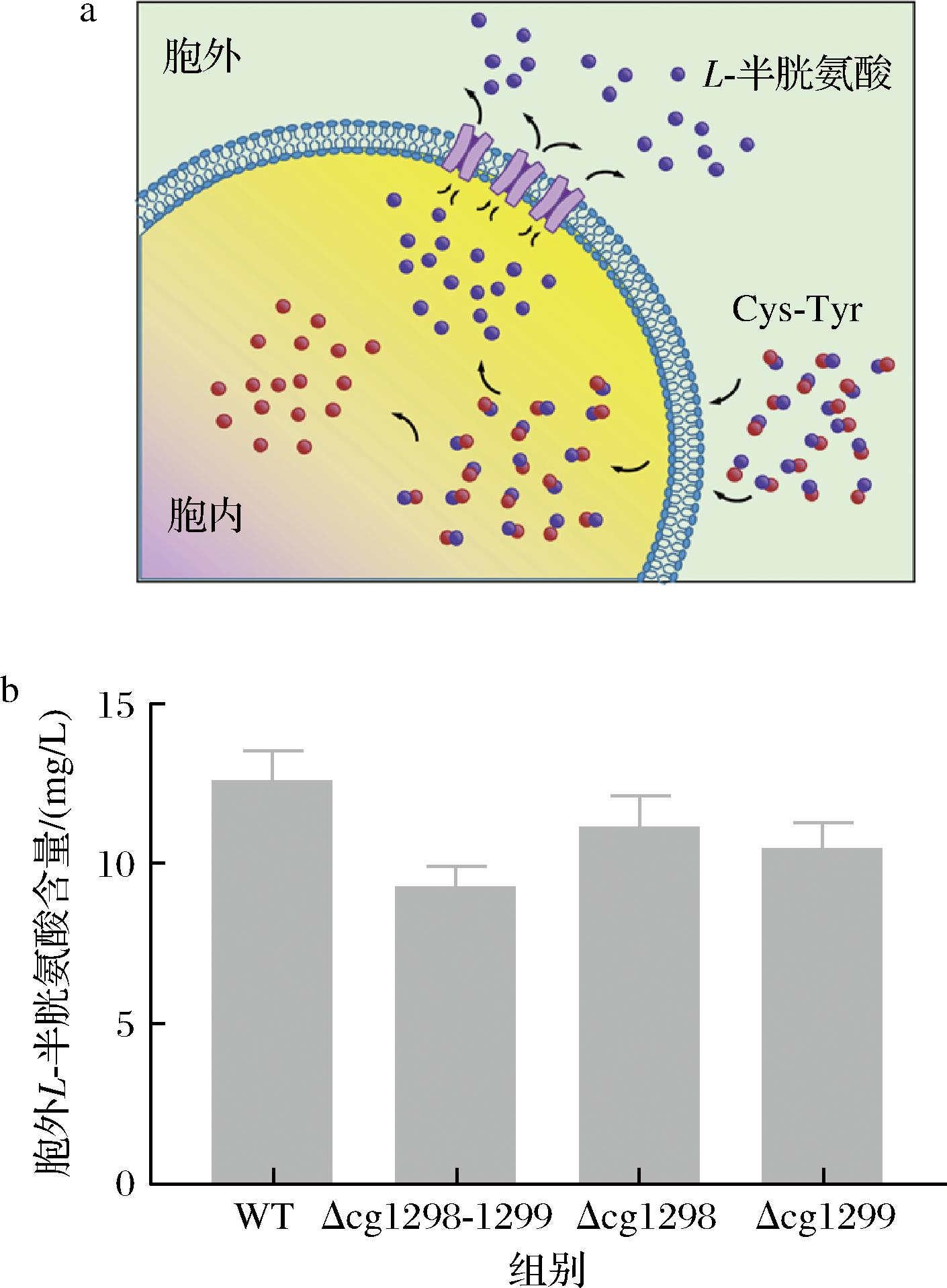
a-L-半胱氨酸外排示意图;b-胞外L-半胱氨酸含量
图4 不同缺失突变体对L-半胱氨酸外排能力的影响
Fig.4 Effects of the different deletion mutants on the export capacity of L-cysteine
由图4-b可知,与野生型谷氨酸棒杆菌ATCC 13032相比,3株缺失菌株的L-半胱氨酸转运能力都有不同程度下降,尤其是双敲菌株,其 L-半胱氨酸的外排能力下降了26.3%。综上所述, Cg1298和Cg1299具有L-半胱氨酸的外排功能。接着,以谷氨酸棒杆菌 ATCC 13032为研究对象,利用网站https://blast.ncbi.nlm.nih.gov/Blast.cgi?PAGE=Proteins& 对Cg1298和Cg1299进行同源性分析,发现Cg1298和Cg1299与大肠杆菌中CydDC具有一定的同源性,相似性分别为29%和29%(表4)。早期研究指出,CydDC属于ABC转运蛋白家族,具有转运谷胱甘肽和半胱氨酸的能力,其主要形成一个复合体行使转运功能[27-29]。因此,推测Cg1298-Cg1299具有与大肠杆菌CydDC相似的功能,可能也以复合体的形式行使转运功能,这也与本实验结果相一致(图3-e、图4-b)。
表4 谷氨酸棒杆菌中L-半胱氨酸外排蛋白的同源性分析
Table 4 Homology analysis of L-cysteine exporters from C. glutamicum
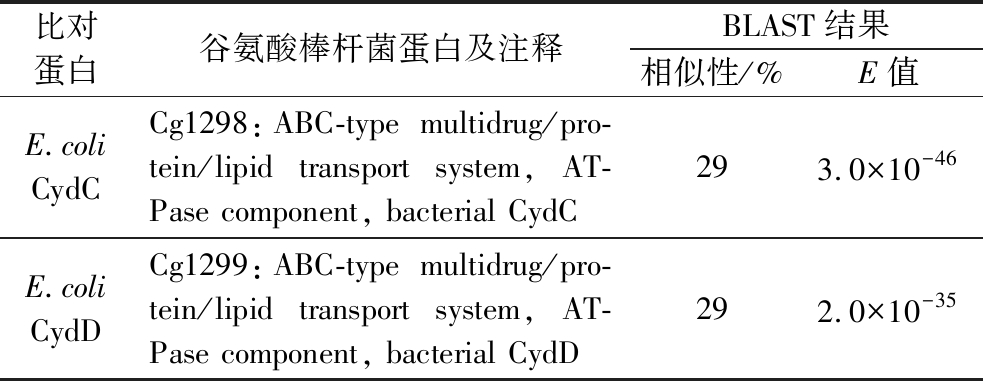
比对蛋白谷氨酸棒杆菌蛋白及注释BLAST结果相似性/%E值E.coliCydCCg1298:ABC-type multidrug/pro-tein/lipid transport system, AT-Pase component, bacterial CydC293.0×10-46E.coliCydDCg1299:ABC-type multidrug/pro-tein/lipid transport system, AT-Pase component, bacterial CydD292.0×10-35
2.3.3 Cg1298-Cg1299对L-半胱氨酸发酵影响
由于cg1298-cg1299双敲菌株显著降低了L-半胱氨酸的耐受性及转运能力,推测Cg1298-Cg1299是谷氨酸棒杆菌中与L-半胱氨酸外排相关的转运蛋白。研究指出, L-半胱氨酸的外排可以增强菌株对L-半胱氨酸的耐受性,提高L-半胱氨酸的产量[23]。在本研究中,将cg1298、cg1299和cg1298-cg1299分别在L-半胱氨酸底盘菌株Q中过表达[3],成功构建了3株工程菌株(Q-cg1298、Q-cg1299、Q-cg1298-1299)。结果表明,与对照菌株相比,3株菌株的细胞生长在培养前48 h无明显差异,然而48 h后生物量均略微下降(图5-a)。如图5-b所示,过表达菌株Q-cg1298-1299的L-半胱氨酸产量在摇瓶发酵中产量达到466 mg/L,比对照菌株(398 mg/L)提高约17.1%,这与L-半胱氨酸的耐受性和外排能力一致(图3、图4),从而进一步证明了Cg1298-Cg1299是谷氨酸棒杆菌的L-半胱氨酸外排蛋白。

a-生物量;b-L-半胱氨酸产量
图5 发酵过程中谷氨酸棒杆菌WT和外排蛋白过表达菌株生物量和L-半胱氨酸产量
Fig.5 Cell growth and L-cysteine production in the C.glutamicum WT and exporter overexpression strains during fermentation
3 结论与讨论
如今,随着代谢工程和合成生物学的蓬勃发展,微生物已经成为了生产各种产品的一个有前景的工具[30-32]。针对产品毒性和产量问题,外排系统对产量提高的重要性日益明显,尤其是氨基酸生产[33-35]。在对Cg1298-Cg1299的详细研究中,根据以下证据确定其为谷氨酸棒杆菌中新的L-半胱氨酸外排蛋白:(a)转录组分析得出无论以高浓度还是低浓度L-半胱氨酸刺激,cg1298和cg1299的基因表达量都被上调;(b)cg1298-cg1299双敲菌株对L-半胱氨酸的敏感性显著增强,而回补菌株则恢复了对L-半胱氨酸的抗性;(c)与野生型谷氨酸棒杆菌 ATCC 13032相比,cg1298-cg1299双敲菌株对L-半胱氨酸的外排能力显著降低;(d)在L-半胱氨酸生产菌株中过表达cg1298-cg1299显著提高了L-半胱氨酸的产量,从应用的角度证明其外排功能。
先前的研究报道,外排系统在氨基酸积累中起着关键作用。MALLA等[36]通过功能性宏基因组学分析发现了一种L-赖氨酸外排蛋白MglE,通过过表达该外排蛋白使大肠杆菌对L-赖氨酸的耐受性提高了40%,并将谷氨酸棒杆菌中L-赖氨酸产量提高了7.8%。WEI等[3]在谷氨酸棒杆菌中表达了大肠杆菌来源的L-半胱氨酸外排蛋白Bcr,该菌株的L-半胱氨酸产量显著增加,约为对照菌株的2倍。本研究在L-半胱氨酸底盘菌中过表达了外排蛋白Cg1298-Cg1299,发酵72 h后L-半胱氨酸产量比对照组提高约17.1%。综上所述,本研究鉴定了一种新的L-半胱氨酸外排蛋白,在谷氨酸棒杆菌中挖掘半胱氨酸转运蛋白有助于了解菌株对L-半胱氨酸的耐受机制,为进一步构建高效L-半胱氨酸细胞工厂提供了新的参考。
[1] LIU H, WANG Y, HOU Y H, et al.Fitness of chassis cells and metabolic pathways for L-cysteine overproduction in Escherichia coli[J].Journal of Agricultural and Food Chemistry, 2020, 68(50):14928-14937.
[2] TAKAGI H, OHTSU I.L-cysteine metabolism and fermentation in microorganisms[M]//Amino Acid Fermentation. Tokyo: Springer Japan,2016, 159:129-151.
[3] WEI L, WANG H, XU N, et al.Metabolic engineering of Corynebacterium glutamicum for L-cysteine production[J].Applied Microbiology and Biotechnology, 2019, 103(3):1325-1338.
[4] MOKHTARI V, AFSHARIAN P, SHAHHOSEINI M, et al.A review on various uses of N-acetyl cysteine[J].Cell Journal, 2017, 19(1):11-17.
[5] JONES C M, HERN NDEZ LOZADA N J, PFLEGER B F.Efflux systems in bacteria and their metabolic engineering applications[J].Applied Microbiology and Biotechnology, 2015, 99(22):9381-9393.
NDEZ LOZADA N J, PFLEGER B F.Efflux systems in bacteria and their metabolic engineering applications[J].Applied Microbiology and Biotechnology, 2015, 99(22):9381-9393.
[6] WENDISCH V F.Metabolic engineering advances and prospects for amino acid production[J].Metabolic Engineering, 2020, 58:17-34.
[7] WADA M, TAKAGI H.Metabolic pathways and biotechnological production of L-cysteine[J].Applied Microbiology and Biotechnology, 2006, 73(1):48-54.
[8] LIU H, FANG G C, WU H, et al.L-cysteine production in Escherichia coli based on rational metabolic engineering and modular strategy[J].Biotechnology Journal, 2018, 13(5):e1700695.
[9] KONDOH M, HIRASAWA T.L-cysteine production by metabolically engineered Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology, 2019, 103(6):2609-2619.
[10] KISHINO M, KONDOH M, HIRASAWA T.Enhanced L-cysteine production by overexpressing potential L-cysteine exporter genes in an L-cysteine-producing recombinant strain of Corynebacterium glutamicum[J].Bioscience, Biotechnology, and Biochemistry, 2019, 83(12):2390-2393.
[11] PARK S, IMLAY J A.High levels of intracellular cysteine promote oxidative DNA damage by driving the Fenton reaction[J].Journal of Bacteriology, 2003, 185(6):1942-1950.
[12] EGGELING L, SAHM H.New ubiquitous translocators:Amino acid export by Corynebacterium glutamicum and Escherichia coli[J].Archives of Microbiology, 2003, 180(3):155-160.
[13] SHANG X L, ZHANG Y, ZHANG G Q, et al.Characterization and molecular mechanism of AroP as an aromatic amino acid and histidine transporter in Corynebacterium glutamicum[J].Journal of Bacteriology, 2013, 195(23):5334-5342.
[14] LIU Q, LIANG Y, ZHANG Y, et al.YjeH is a novel exporter of L-methionine and branched-chain amino acids in Escherichia coli[J].Applied and Environmental Microbiology, 2015, 81(22):7753-7766.
[15] ZHANG X M, GAO Y J, CHEN Z W, et al.High-yield production of L-serine through a novel identified exporter combined with synthetic pathway in Corynebacterium glutamicum[J].Microbial Cell Factories, 2020, 19(1):115.
[16] EGGELING L.Exporters for production of amino acids and other small molecules[M]//Amino Acid Fermentation.Tokyo:Springer Japan, 2016:199-225.
[17] YAMADA S, AWANO N, INUBUSHI K, et al.Effect of drug transporter genes on cysteine export and overproduction in Escherichia coli[J].Applied and Environmental Microbiology, 2006, 72(7):4735-4742.
[18] TAKUMI K, ZIYATDINOV M K, SAMSONOV V, et al.Fermentative production of cysteine by Pantoea ananatis[J].Applied and Environmental Microbiology, 2017, 83(5):e02502-e02516.
[19] BECKER J, WITTMANN C.Systems and synthetic metabolic engineering for amino acid production:The heartbeat of industrial strain development[J].Current Opinion in Biotechnology, 2012, 23(5):718-726.
[20] LEUCHTENBERGER W, HUTHMACHER K, DRAUZ K.Biotechnological production of amino acids and derivatives:Current status and prospects[J].Applied Microbiology and Biotechnology, 2005, 69(1):1-8.
[21] LI L, ZHAO Y W, RUAN L J, et al.A stepwise increase in pristinamycin Ⅱ biosynthesis by Streptomyces pristinaespiralis through combinatorial metabolic engineering[J].Metabolic Engineering, 2015, 29:12-25.
[22] OKIBE N, SUZUKI N, INUI M, et al.Efficient markerless gene replacement in Corynebacterium glutamicum using a new temperature-sensitive plasmid[J].Journal of Microbiological Methods, 2011, 85(2):155-163.
[23] LIU G H, DING C, JU Y, et al.Directed evolution of an EamB transporter for improved L-cysteine tolerance and production in Escherichia coli[J].FEMS Microbiology Letters, 2022, 368(21-24):fnac008.
[24] GAITONDE M K.A spectrophotometric method for the direct determination of cysteine in the presence of other naturally occurring amino acids[J].The Biochemical Journal, 1967, 104(2):627-633.
[25] WIRIYATHANAWUDHIWONG N, OHTSU I, LI Z D, et al.The outer membrane TolC is involved in cysteine tolerance and overproduction in Escherichia coli[J].Applied Microbiology and Biotechnology, 2009, 81(5):903-913.
[26] 刘川. 谷氨酸棒状杆菌半胱氨酸转运蛋白的鉴定与特性研究以及半胱氨酸单细胞生物传感器的构建与应用[D].天津:天津科技大学, 2018.
LIU C.Identification and characerization of cystiene transporters in Corynebacterium glutamicum, construction and application of A single-cell biosensor of cysteine[D].Tianjin:Tianjin University of Science &Technology, 2018.
[27] POOLE R K, COZENS A G, SHEPHERD M.The CydDC family of transporters[J].Research in Microbiology, 2019, 170(8):407-416.
[28] HOLYOAKE L V, POOLE R K, SHEPHERD M.The CydDC family of transporters and their roles in oxidase assembly and homeostasis[M]//Advances in Microbial Physiology.Amsterdam:Elesevier,2015,66:1-53.
[29] SHEPHERD M.The CydDC ABC transporter of Escherichia coli:New roles for a reductant efflux pump[J].Biochemical Society Transactions, 2015, 43(5):908-912.
[30] DELLOMONACO C, CLOMBURG J M, MILLER E N, et al.Engineered reversal of the β-oxidation cycle for the synthesis of fuels and chemicals[J].Nature, 2011, 476(7360):355-359.
[31] KUNJAPUR A M, TARASOVA Y, PRATHER K L J.Synthesis and accumulation of aromatic aldehydes in an engineered strain of Escherichia coli[J].Journal of the American Chemical Society, 2014, 136(33):11644-11654.
[32] XU P, LI L Y, ZHANG F M, et al.Improving fatty acids production by engineering dynamic pathway regulation and metabolic control[J].Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(31):11299-11304.
[33] AHMED M S, LAUERSEN K J, IKRAM S, et al.Efflux transporters’ engineering and their application in microbial production of heterologous metabolites[J].ACS Synthetic Biology, 2021, 10(4):646-669.
[34] VAN DER HOEK S A, BORODINA I.Transporter engineering in microbial cell factories:The ins, the outs, and the in-betweens[J].Current Opinion in Biotechnology, 2020, 66:186-194.
[35] ZHU Y, ZHOU C, WANG Y, et al.Transporter engineering for microbial manufacturing[J].Biotechnology Journal, 2020, 15(9):1900494.
[36] MALLA S, VAN DER HELM E, DARBANI B, et al.A novel efficient L-lysine exporter identified by functional metagenomics[J].Frontiers in Microbiology, 2022, 13:855736.