共轭亚油酸(conjugated linoleic acid, CLA)是具有共轭双键的十八碳二烯酸的总称,是亚油酸(linoleic acid, LA)的立体和几何异构体[1]。其中,c9,t11-CLA和t10,c12-CLA等2种单体获得了美国食品和药物管理局安全认证,大量研究证明CLA具有抗癌、预防心血管疾病、改善炎症等功能[2-3],但是不同的单体具有不同的生理活性。c9,t11-CLA可以抑制肠癌细胞的生长,诱导乳腺癌细胞的凋亡,具有抗癌、改善炎症等生理功能[2-3],而t10,c12-CLA具有减少脂质积累的作用[4],并且t10,c12-CLA在某些动物模型中会促进结肠癌细胞的转移、乳腺肿瘤细胞生长以及子宫癌细胞生长等[5-6]。无论是为了研究不同CLA单体的生理功能,还是为了满足特定的生理需求,获得CLA单体都具有重要的现实意义。
来源于短双歧杆菌的亚油酸异构酶(Bifidobacterium breve isomerase, BBI)是目前唯一已知的乳酸菌源的单酶转化LA生成c9,t11-CLA的亚油酸异构酶[7]。不同于植物乳杆菌中的多组分酶系,需经水合、脱水、移位等5步反应生成c9,t11-CLA[8-9],BBI可以经单步反应转化LA生成c9,t11-CLA[7]。有研究表明,短双歧杆菌CCFM683是一株具有较高CLA生物转化能力的双歧杆菌,不仅可以转化LA生成c9,t11-CLA(转化率高达90.3%),还可以转化α-亚麻酸(α-linolenic acid, ALA)和γ-亚麻酸(γ-linolenic acid, GLA)生成相应的共轭亚麻酸(conjugated linolenic acid, CLNA)[7]。
然而,短双歧杆菌作为一种严格厌氧菌,对生长环境要求极为严苛;培养基成分复杂,培养成本昂贵,较难应用于工业化生产[10-11]。因此,实现BBI在合适宿主中的表达不仅具有工业化生产c9,t11-CLA的潜力,还有助于获得一定量的纯化蛋白来研究BBI的结构与功能。大肠杆菌作为优良的表达宿主,具有生长速度快、培养成本低廉、遗传背景清晰等优点,被广泛应用于目的基因的异源表达和工业化生产[12-13]。根据重组蛋白的不同表达需求特性,生物技术公司开发了一系列商业化大肠杆菌宿主,如E.coli BL21(DE3)-pLysS菌株,它是在E.coli BL21(DE3)菌株的基础上加入了可以表达T7溶菌酶的基因,能在不影响目的基因表达的同时降低背景表达水平,因此适用于表达某些对宿主有危害的重组蛋白;E.coli Rosetta(DE3)菌株则补充了大肠杆菌中的6种稀有密码子对应的转运RNA,它可以显著提高外源基因的表达水平。
此外,目的蛋白异源表达时可以引入标签,组氨酸标签作为一种分子质量小、对蛋白分泌、折叠影响较小的蛋白标签,一方面便于检测目的蛋白的表达量,另一方面也可以作为纯化标签实现快速纯化[14]。尽管有上述优势,但组氨酸标签添加的位置会对部分目的蛋白的表达量和活性产生重大影响,标签位置是目的蛋白异源表达时必须要考虑的影响因素之一[15]。
因此,本研究采用大肠杆菌作为表达宿主,将来源于短双歧杆菌CCFM683的亚油酸异构酶bbi基因在3种类型的大肠杆菌宿主中进行异源表达,通过改变标签位置、优化蛋白表达条件,实现BBI蛋白的异源表达。在此基础上,初步探究了BBI对不同脂肪酸底物的偏好性,同时利用分子对接技术解释其潜在的原因,这为进一步揭示BBI的结构与功能关系奠定了研究基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株
E.coli BL21/pET-28a(+)-bbi-His、E.coli BL21/pET-28a(+)-His-bbi、E.coli BL21 pLysS/pET-28a(+)-bbi-His、E.coli BL21 pLysS/pET-28a(+)-His-bbi、E.coli Rosetta/pET-28a(+)-bbi-His、E.coli Rosetta/pET-28a(+)-His-bbi,现保藏于江南大学食品学院生物技术中心菌种库。
1.1.2 试剂
异丙基硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside, IPTG),上海生工生物工程公司;BCA蛋白浓度测定试剂盒,碧云天生物技术公司;酸洗玻璃珠,美国BioSpec公司;LA(纯度≥99%)、内标十五烷酸(C15∶0),Sigma-Aldrich公司;重氮甲烷、2.0 mol/L己烷溶液,百灵威科技有限公司。
1.1.3 培养基及主要试剂配制
Luria-Bertani(LB)培养基(g/L):NaCl 10,胰蛋白胨10,酵母提取物5。
磷酸盐破碎缓冲液(mg/L):KH2PO4 901.9,K2HPO4 587.422,pH=6.5。
LA母液(30 mg/mL):300 mg LA,20 mg吐温-80加水定容至10 mL,充分乳化后用0.22 μm无菌滤膜过滤除菌,-20 ℃保存。ALA和GLA以同样的方式进行配制。
卡那霉素(100 mg/mL):1 g卡那霉素加水定容至10 mL,混合溶解后用0.22 μm无菌滤膜过滤除菌,-20 ℃保存。
氯霉素(34 mg/mL):340 mg氯霉素加无水乙醇定容至10 mL,充分溶解后用0.22 μm无菌滤膜过滤除菌,-20 ℃保存。
十五烷酸内标(2 mg/mL):100 mg十五烷酸加正己烷定容至50 mL,充分溶解后分装,-20 ℃保存。
1.1.4 仪器与设备
Trace 1300气相色谱仪,美国赛默飞世尔科技有限公司;组织破碎仪,宁波新芝生物科技有限公司。
1.2 实验方法
1.2.1 重组菌诱导表达
将本实验室构建并保存的重组菌进行复苏培养,在含不同抗生素的LB平板上划线培养至单菌落产生,挑取单菌落至5 mL LB液体培养基中进行扩大培养,以1%(体积分数)的接种量接种至20 mL LB液体培养基中,37 ℃培养至OD600在0.6~0.8之间,添加诱导剂IPTG至终浓度为0.2 mmol/L后16 ℃诱导培养。诱导结束后经8 000×g离心5 min,收集菌体,保存于-80 ℃冰箱中用于后续实验。
1.2.2 诱导表达条件优化
IPTG浓度优化:在不同浓度的IPTG(0.2、0.4、0.6、0.8、1.0 mmol/L)下,重组菌于16 ℃诱导8 h,测定酶活力以确定IPTG的最佳浓度。
IPTG诱导时间优化:控制IPTG浓度为各自的最佳浓度,重组菌在16 ℃分别诱导4、6、8、16、24 h,测定酶活力以确定IPTG的最佳诱导时间。
1.2.3 BBI活性检测
KPB缓冲液重悬菌体,加入等体积的酸洗玻璃珠,通过组织破碎仪进行破碎,提取粗蛋白用于活性检测。取1 mg破碎的粗蛋白,加入10 μL LA母液定容至1 mL,于37 ℃、200 r/min反应2 h,待反应结束通过重氮甲烷甲酯化,利用气相色谱法进行脂肪酸检测[16]。
气相色谱条件:初始温度150 ℃,以5 ℃/min升温至200 ℃,保持10 min;以4 ℃/min升温至240 ℃,保持10 min。载气He,进样器和检测器温度保持在240 ℃[17]。
BBI的粗酶活性检测指标为共轭脂肪酸的转化率,即LA转化生成CLA,LNA转化生成CLNA的转化率。CLA转化率和CLNA转化率的计算如公式(1)和公式(2)所示:
CLA转化率![]()
(1)
CLNA转化率![]()
(2)
1.2.4 BBI序列信息分析及分子对接
使用ExPASy(http://www.expasy.ch/tools/)分析蛋白的基本理化性质。利用RoseTTAFold(https://www.rosettacommol/Lmmol/Lol/Lons.org/software/servers#rosie)构建BBI的三维结构模型,从ZinC数据库获得LA、ALA和GLA的三维结构,使用拉氏图提供的信息对蛋白模型进行质量评估。使用AutoDock 4.2软件以构建的BBI蛋白模型为受体,将3种脂肪酸分别作为配体进行分子对接,对接参数采用默认设置。
2 结果与分析
2.1 BBI序列信息分析
2.1.1 BBI蛋白的理化性质分析
使用ExPASy软件分析显示,BBI蛋白由330个氨基酸组成,理论分子质量为37.18 kDa,分子式为C1753H2591N419O442S18,理论等电点8.63。该蛋白由20种氨基酸组成,其中含量最丰富的氨基酸为丙氨酸(占10.9%),含量最少的是组氨酸(占1.5%),带负电荷的残基总数为16,带正电荷的残基总数为21。BBI的脂肪系数为98.76,亲水系数为0.482,是疏水蛋白,其不稳定指数为26.36,说明其为稳定蛋白。结合BBI在原始短双歧杆菌CCFM683中为膜结合蛋白这一推测,它在异源表达过程中可能会出现表达量低或者重组蛋白无活性等情况[7]。

图1 BBI蛋白的氨基酸组成
Fig.1 Amino acids composition of BBI
2.1.2 BBI蛋白三级结构预测与建模
BBI作为新发现的膜结合型亚油酸异构酶,与已知结构的蛋白同源性低,利用RoseTTAFold的从头建模方式模拟其三维结构,结果见图2-a。一个合理的模型构象落在不允许区域的氨基酸残基数目在总蛋白中的占比应低于5%。由其构象评估由图2-b可知,BBI蛋白内部92.9%的氨基酸残基位于最适区域(红色),0.3%的氨基酸残基位于不允许区域(白色),所以构建的模型结构是合理的。β2肾上腺素能受体中有7段α螺旋,一部分形成了识别底物的底物结合口袋,另一部分接触底物并形成不同构象[18]。BBI蛋白分子中47.58%的氨基酸残基处于α螺旋区域,其余肽链则以无规则卷曲和转角结构连接着10段α螺旋,这些螺旋不是完全笔直的,其中1/3的螺旋中存在着不利于螺旋形成的脯氨酸,形成略微弯折的螺旋结构,BBI整体呈桶状,其结构与β2肾上腺素能受体结构相似,与底物结合的方式也可能相近。
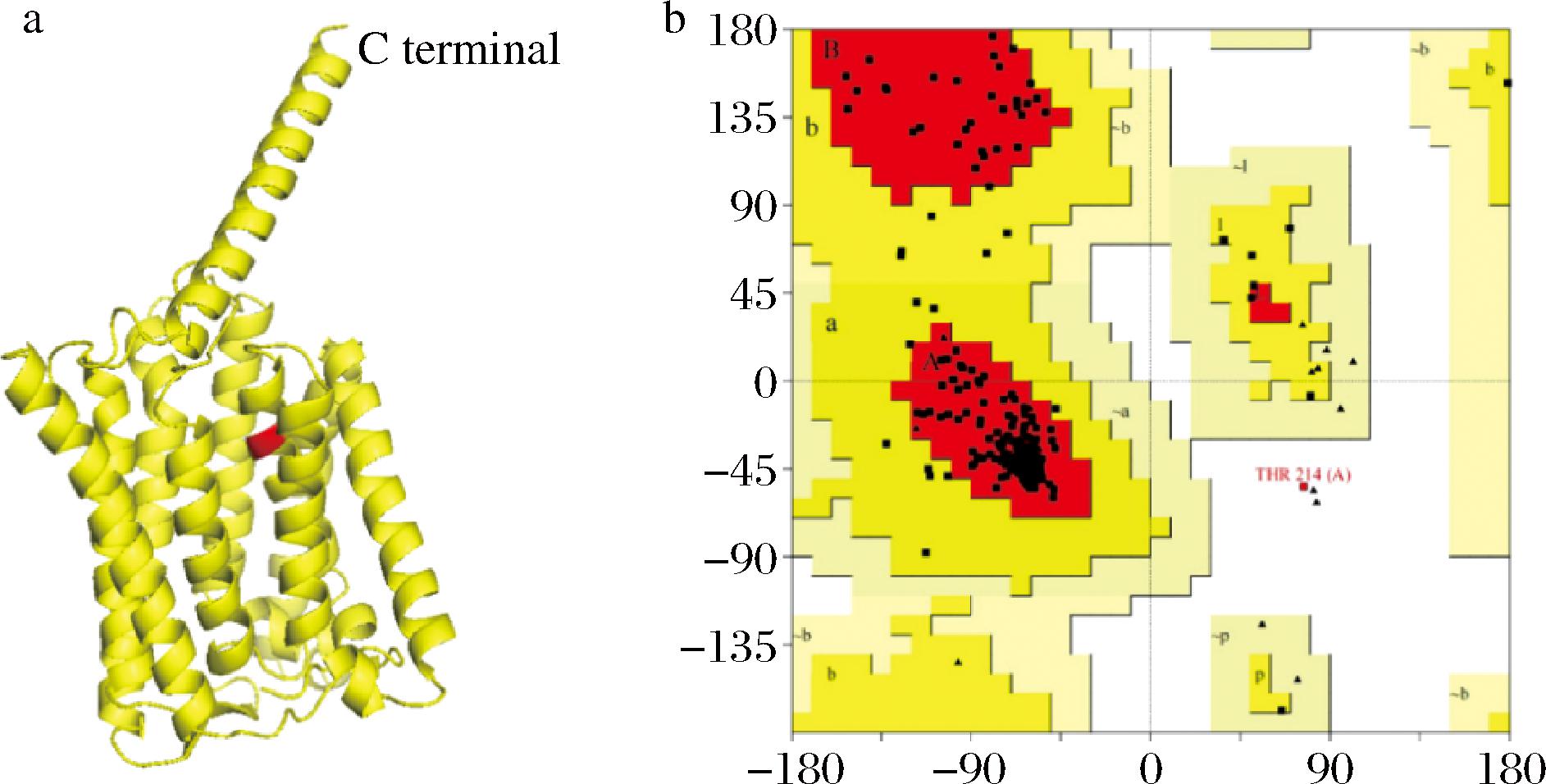
a-三维结构;b-构象评估
图2 BBI的三维结构与构象评估
Fig.2 3D structure and Ramachandran plot of BBI
2.2 组氨酸标签位置和不同大肠杆菌宿主对BBI粗酶活性的影响
2.2.1 组氨酸标签位置对BBI粗酶活性的影响
组氨酸标签作为一个分子质量较小的常见标签,其仍会对目的蛋白的表达产生影响。ESEN等[15]在研究甲酸脱氢酶(Chaetomium thermophilum formate dehydrogenase,CtFDH)时发现组氨酸标签位于C端时CtFDH的比酶活力是其位于N端时的3倍。朱圣花[19]在研究重组人釉原蛋白(recombinant human amelogenin,rhAm)时发现,当组氨酸标签位于C端时rhAm完全不表达,将其添加到N端时rhAm表达能力变强。因此,为确定组氨酸标签位置对BBI异源表达的影响,本文构建了组氨酸标签分别位于N端和C端的重组质粒pET-28a(+)-His-bbi和pET-28a(+)-bbi-His,将其转化至E.coli BL21(DE3)中。由图3中E.coli BL21(黑色)可知,与空载对照相比,2株BBI大肠杆菌重组菌均具有转化LA至CLA的能力,说明目的基因成功实现了在大肠杆菌中的异源表达。BBI在E.coli BL21(DE3)中表达时,组氨酸标签位于BBI的C端时CLA转化率(73.7%)明显高于其位于N端时CLA转化率(7.9%),组氨酸标签位于BBI的N端时可能影响了BBI蛋白的表达和酶活力。马君燕等[20]发现鹰嘴豆孢克鲁维酵母外切菊粉酶的C端可能具有促进酶和底物结合作用,加上组氨酸标签后影响其结合,从而影响酶的催化活性。由图2-a可知,BBI蛋白分子中9段α螺旋共同构成一个“桶”,形成一个空腔,若将组氨酸标签添加到N端可能对这个空腔的构象产生影响,进而影响底物与活性位点的结合。
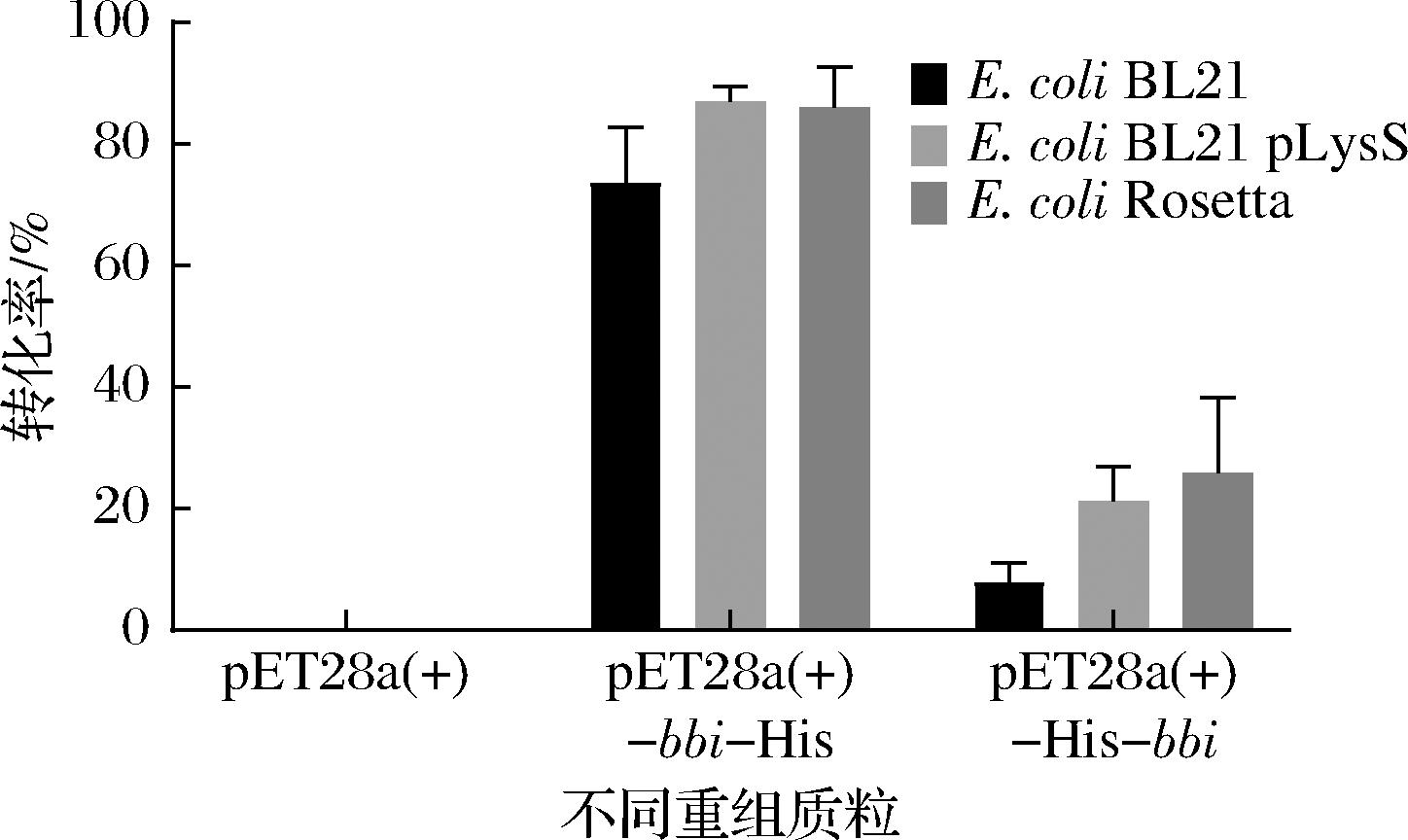
图3 不同大肠杆菌重组菌的转化率
Fig.3 Conversion rate of different E.coli recombinant strain
2.2.2 不同大肠杆菌宿主对BBI粗酶活性的影响
利用原核表达系统进行异源表达时需要考虑很多因素,包括选择合适的宿主、构建合适的重组质粒以及优化诱导表达条件等。职韶阳等[21]在表达鸢尾素(irisin)时发现E.coli Rosetta-irisin较E.coli BL21-irisin的表达量提高了2.3倍。因此,为探究不同类型的大肠杆菌表达宿主对BBI的影响,本研究将已获得的2个重组载体在E.coli BL21、E.coli BL21-pLysS和E.coli Rosetta中分别进行表达,共6个重组菌。由图3可知,在3个大肠杆菌表达宿主中,组氨酸标签位于N端的粗酶活性均明显弱于组氨酸标签位于C端时。同时,重组质粒pET-28a(+)-bbi-His分别在3个宿主中进行表达时,E.coli BL21 pLysS/pET-28a(+)-bbi-His(86.96%)和E.coli Rosetta/pET-28a(+)-bbi-His(86.11%)这2种类型的大肠杆菌宿主中的粗酶活性略高于其在E.coli BL21/pET-28a(+)-bbi-His(73.69%)中的活性。因此,选取重组菌株E.coli Rosetta/pET-28a(+)-bbi-His、E.coli BL21/pET-28a(+)-bbi-His和E.coli BL21 pLysS/pET-28a(+)-bbi-His作为后续优化实验的出发菌株。
2.3 BBI诱导表达条件优化
IPTG作为强诱导剂,不能被菌体所代谢且具有一定的细胞毒性,影响菌体的生长和蛋白的表达。诱导时间过短会导致目的蛋白无法大量表达,而诱导时间过长则可能会因为菌体衰亡释放有毒物质,从而导致目的蛋白降解或者活性减弱。因此,本研究对诱导剂浓度和诱导时间进行了单因素优化,通过BBI粗酶活性检测目的蛋白表达情况。
本研究考察了诱导剂IPTG的浓度对BBI表达的影响,结果如图4-a所示,IPTG浓度在0.2~1.0 mmol/L之间时,E.coli Rosetta/pET-28a(+)-bbi-His粗酶活性随着诱导剂浓度增加略微增强,且粗酶活性高于其他2株重组菌[E.coli BL21 pLysS/pET-28a(+)-bbi-His和E.coli BL21/pET-28a(+)-bbi-His]。综合考虑粗酶活性及实验成本,将E.coli Rosetta/pET-28a(+)-bbi-His和E.coli BL21 pLysS/pET-28a(+)-bbi-His的IPTG最佳诱导浓度定为1.0 mmol/L,将E.coli BL21/pET-28a(+)-bbi-His的IPTG最佳诱导浓度定为0.6 mmol/L。
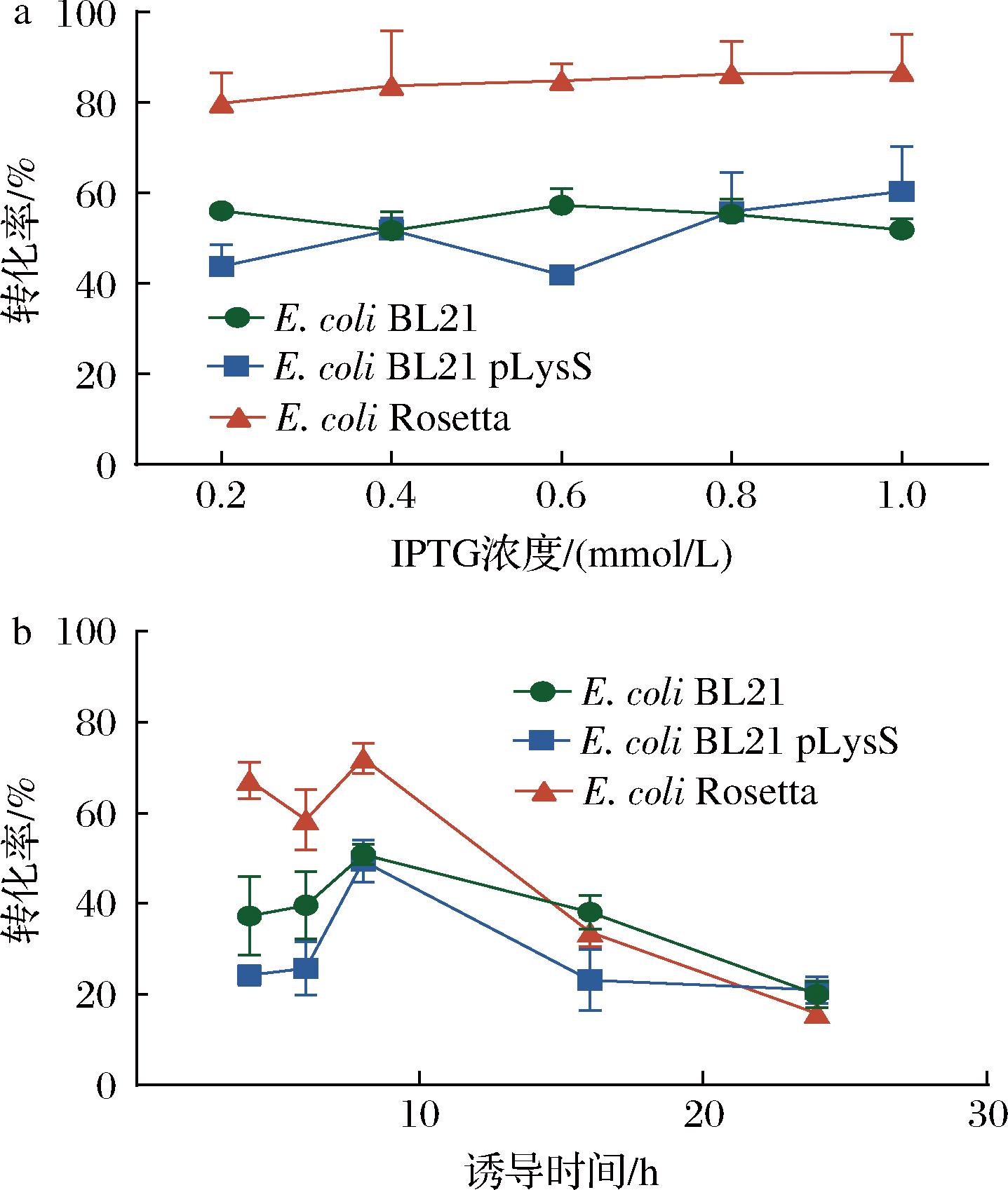
a-诱导剂IPTG浓度;b-诱导时间
图4 诱导剂IPTG浓度和诱导时间对BBI粗酶活性的影响
Fig.4 Effect of IPTG concentration and induction time on BBI crude enzyme activity
本研究进一步考察了诱导时间对BBI表达的影响,结果如图4-b所示,在4~8 h内,BBI的粗酶活性随着诱导时间的延长逐渐升高;在8~24 h内,BBI的粗酶活性随着诱导时间的延长逐渐降低,因此最佳诱导时间为8 h。
综上所述,BBI的最佳表达条件为E.coli Rosetta/pET-28a(+)-bbi-His菌株以1.0 mmol/L IPTG诱导8 h。
2.4 BBI对不同脂肪酸底物的偏好性分析
短双歧杆菌CCFM683不仅可以转化LA生成CLA,还可以转化LNA生成CLNA[7]。本文为探究BBI对于不同游离脂肪酸的偏好性,以ALA、GLA和LA为底物测定转化率。如图5所示,BBI粗酶对ALA的利用能力最高,可达63.54%,其次为LA,对GLA的利用能力最弱,仅为20.15%,这与BBI在短双歧杆菌CCFM683中的表现出来的偏好性一致。因此,相较于LA和GLA,BBI粗酶更偏好转化ALA。
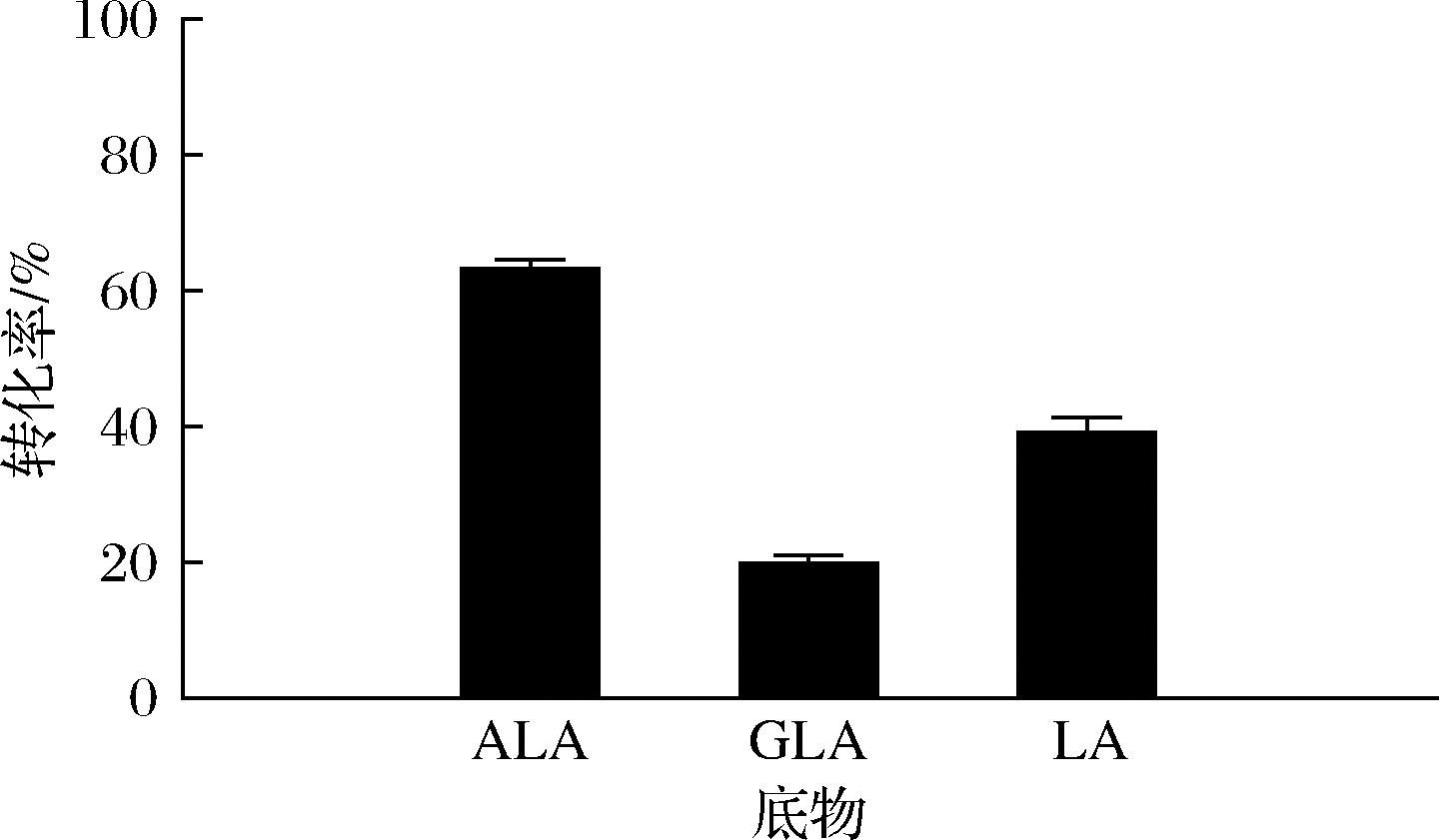
图5 BBI粗酶对不同脂肪酸底物的转化率
Fig.5 Conversion of BBI crude enzymes to different fatty acid
通过AutoDock软件将组氨酸标签位于BBI的C端的重组蛋白和3种底物(ALA、GLA和LA)分别进行对接。选取了蛋白与底物的最佳复合结果,计算其结合自由能。ALA、GLA和LA对应的结合自由能分别为-31.51、-30.17和-31.80 kJ/mol,均形成了2个氢键而无其他作用力。在分子对接中,结合自由能越低则构象越稳定,与蛋白质结合力越强。一般认为,结合自由能>-16.74 kJ/mol结合力极弱或无结合能力;-29.29 kJ/mol<结合自由能≤-16.74 kJ/mol结合力中等;结合自由能≤-29.29 kJ/mol结合力较强。因此,这3种底物与BBI的结合力均较强,且三者的结合自由能相差不大,缺乏晶体结构和活性位点信息,对接结果可能存在误差。同时,由图6可知,这3种底物都与Arg243形成氢键,推测其为BBI结合位点之一;由图2-a(红色残基)可知,Arg243位于9段α螺旋形成的空腔内,与之前组氨酸标签位于N端时影响BBI与底物的结合推测一致。
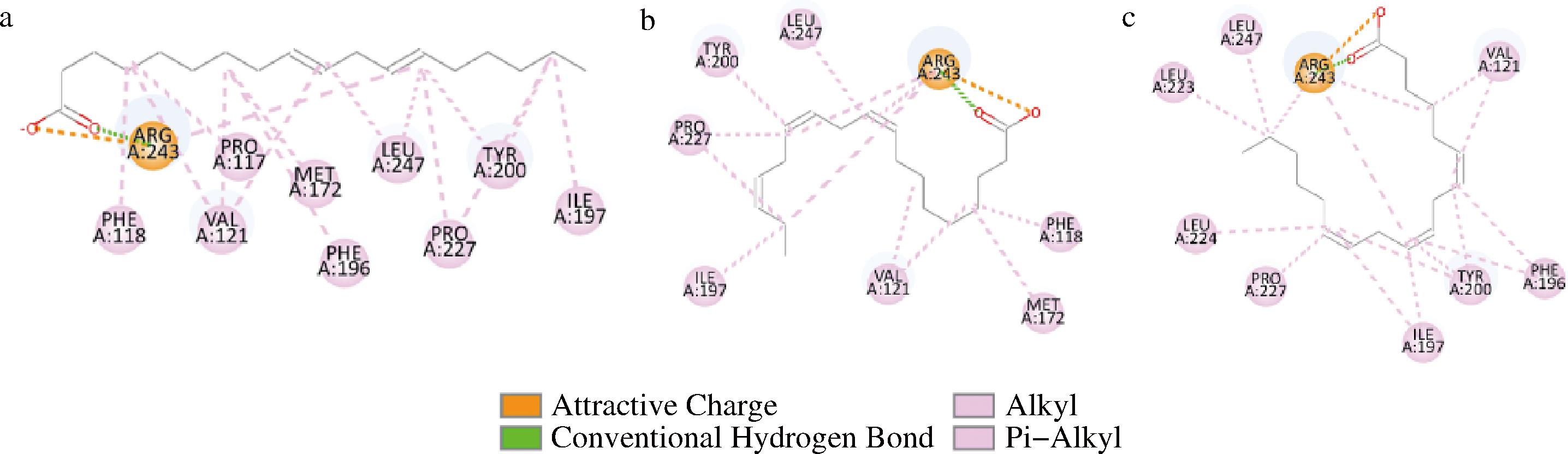
a-LA;b-ALA;c-GLA
图6 BBI与不同脂肪酸底物的分子对接结果
Fig.6 Results of molecular docking between BBI and different fatty acid
3 结论
c9,t11-CLA具有许多重要的生理功能,目前市售的CLA为多种同分异构体的混合物。BBI是目前唯一已知的乳酸菌来源的的单酶转化生成c9,t11-CLA的亚油酸异构酶,具有很好的应用前景。前期研究发现短双歧杆菌CCFM683只能在生长过程中转化LA,其静息细胞不具备转化能力,同时BBI经预测为九次跨膜蛋白,在短双歧杆菌CCFM683中的表达量极低,为了解决这个问题,对BBI进行异源表达和优化重组表达条件势在必行[7]。
本研究在3种类型的大肠杆菌宿主中实现了BBI的异源表达,并且探究了组氨酸标签位于C端和N端时对粗酶活性的影响,在此基础上,通过对诱导剂IPTG的浓度和诱导时间进行优化,确定了组氨酸标签位于C端的重组质粒在E.coli Rosetta中进行表达,并以1.0 mmol/L的IPTG诱导8 h,BBI的粗酶活性最高。在最佳诱导条件下,初步探究了BBI对不同底物的偏好性,确定了其对ALA的利用能力最强,其次为LA,最后是GLA。通过分子对接技术,确定了BBI与底物的潜在结合位点Arg243位于空腔内,这与组氨酸位于目的蛋白N端时粗酶活性明显较低这一实验结果相符。综上,本研究为进一步研究BBI的结构与功能关系奠定基础。
[1] GITANE F, LAERTE N J.Systematic evaluation on the effectiveness of conjugated linoleic acid in human health[J].Critical Reviews in Food Science and Nutrition, 2017, 57(1):1-7.
[2] BEPPU F, HOSOKAWA M, TANAKA L, et al.Potent inhibitory effect of trans9, trans11 isomer of conjugated linoleic acid on the growth of human colon cancer cells[J].The Journal of Nutritional Biochemistry, 2006, 17(12):830-836.
[3] EL ROZ A, BARD J M, HUVELIN J M, et al.The anti-proliferative and pro-apoptotic effects of the trans9, trans11 conjugated linoleic acid isomer on MCF-7 breast cancer cells are associated with LXR activation[J].Prostaglandins, Leukotrienes and Essential Fatty Acids, 2013, 88(4):265-272.
[4] LARSEN T M, TOUBRO S, GUDMUNDSEN O, et al.Conjugated linoleic acid supplementation for 1 y does not prevent weight or body fat regain 3[J].The American Journal of Clinical Nutrition, 2006, 83(3):606-612.
[5] BERRYHILL G E, GLOVICZKI J M, TROTT J F, et al.Diet-induced metabolic change induces estrogen-independent allometric mammary growth[J].Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(40):16294-16299.
[6] IP M M, MCGEE S O, MASSO-WELCH P A, et al.The t10, c12 isomer of conjugated linoleic acid stimulates mammary tumorigenesis in transgenic mice over-expressing erbB2 in the mammary epithelium[J].Carcinogenesis, 2007, 28(6):1269-1276.
[7] 高鹤. 双歧杆菌生物转化共轭亚油酸的机制研究[D].无锡:江南大学, 2020.
GAO H.Study on mechanism of biotransformation of conjugated linoleic acid by Bifidobacterium[D].Wuxi:Jiangnan University, 2020.
[8] KISHINO S, OGAWA J, YOKOZEKI K, et al.Linoleic acid isomerase in Lactobacillus plantarum AKU1009a proved to be a multi-component enzyme system requiring oxidoreduction cofactors[J].Bioscience, Biotechnology, and Biochemistry, 2011, 75(2):318-322.
[9] KISHINO S, PARK S B, TAKEUCHI M, et al.Novel multi-component enzyme machinery in lactic acid bacteria catalyzing CC double bond migration useful for conjugated fatty acid synthesis[J].Biochemical and Biophysical Research Communications, 2011, 416(1-2):188-193.
[10] CHOU C C, HOU J W.Growth of bifidobacteria in soymilk and their survival in the fermented soymilk drink during storage[J].International Journal of Food Microbiology, 2000, 56(2-3):113-121.
[11] 吕锡斌, 何腊平, 张汝娇, 等.双歧杆菌生理功能研究进展[J].食品工业科技, 2013, 34(16):353-358.
LV X B, HE L P, ZHANG R J, et al.Research progress in physiological functions of Bifidobacterium[J].Science and Technology of Food Industry, 2013, 34(16):353-358.
[12] YANG D, PARK S Y, PARK Y S, et al.Metabolic engineering of Escherichia coli for natural product biosynthesis[J].Trends in Biotechnology, 2020, 38(7):745-765.
[13] SU L Q, XU C H, WOODARD R W, et al.A novel strategy for enhancing extracellular secretion of recombinant proteins in Escherichia coli[J].Applied Microbiology and Biotechnology, 2013, 97(15):6705-6713.
[14] 阮建兵, 梅艳珍.多聚组氨酸融合标签在蛋白药物开发中的应用[J].生物技术通报, 2012(6):49-53.
RUAN J B, MEI Y Z.Applications of poly-histidine affinity tags in protein drugs development[J].Biotechnology Bulletin, 2012(6):49-53.
[15] ESEN H, ALPDATA S, AKAR M M, et al.Polyhistidine tag effect on solubility and activity of Chaetomium thermophilum formate dehydrogenase (CtFDH)[C] Proceedings of the 1 Eurasia Biochemical Approaches &Technologies Congress.Antalya:Taylor &Francis Group, 2018.
[16] 杨波. 乳酸菌生物转化共轭亚油酸的研究[D].无锡:江南大学, 2014.
YANG B.Study on biotransformation of conjugated linoleic acid by lactic acid bacteria[D].Wuxi:Jiangnan University, 2014.
[17] 李秀清, 陈海琴, 唐鑫, 等.痤疮丙酸杆菌亚油酸异构酶在毕赤酵母中的异源表达及其静息细胞催化合成共轭亚油酸[J].中国油脂, 2021, 46(9):87-91.
LI X Q, CHEN H Q, TANG X, et al.Heterologous expression of linoleate isomerase from Propionibacterium acnes in Pichia pastoris and its catalytic synthesis of conjugated linoleic acid by resting cells[J].China Oils and Fats, 2021, 46(9):87-91.
[18] 高海娇, 徐超, 程古月, 等.β2肾上腺素能受体的研究进展及其在兴奋剂残留检测中的应用[J].中国兽医学报, 2020, 40(1):216-224.
GAO H J, XU C, CHENG G Y, et al.Research progress of β2 adrenergic receptor and their applications in agonist residues detection[J].Chinese Journal of Veterinary Science, 2020, 40(1):216-224.
[19] 朱圣花. 重组人釉原蛋白的原核表达优化及生物学功能鉴定[D].广州:暨南大学, 2020.
ZHU S H.Prokaryotic expression optimization and biological function identification of recombinant human amelogenin[D].Guangzhou:Jinan University, 2020.
[20] 马君燕, 谭海东, 王文霞, 等.组氨酸标签位置对重组鹰嘴豆孢克鲁维酵母外切菊粉酶活性的影响[J].生命科学研究, 2016, 20(3):218-223;277.
MA J Y, TAN H D, WANG W X, et al.The effects of His6-tag position in Kluyveromyces cicerisporus exo-inulinase on its activity[J].Life Science Research, 2016, 20(3):218-223;277.
[21] 职韶阳,杨丽萍,秦超彬等.鲤irisin多克隆抗体的制备及应用[J/OL].水产学报:1-16[2023-09-06].http://kns.cnki.net/kcms/detail/31.1283.S.20221228.2027.003.html.
ZHI S Y, YANG L P, QIN C B, et al.Preparation and application of polyclonal antibody to irisin of Cyprinus carpio[J/OL].Journal of Fisheries of China,:1-16[2023-09-06].http://kns.cnki.net/kcms/detail/31.1283.S.20221228.2027.003.html.