非酿酒酵母是广泛存在于葡萄园和酿造环境中的一类非常规酵母,常见的非酿酒酵母有美极梅奇酵母(Metschnikowia pulcherrima)、有孢汉逊酵母(Hanseniaspora)、戴尔有孢圆酵母(Torulaspora delbrueckii)等[1]。大量研究表明,非酿酒酵母具有丰富的胞外酶,能够产生大量酯类、高级醇和挥发酸等香气化合物,也能降低乙醇含量并调节酸度及颜色,可为葡萄酒增香、改善品质和提升风味多样性拓宽途径[2-3]。非酿酒酵母通常具有较低的发酵性能和乙醇耐受性,难以单独完成乙醇发酵。因此,葡萄酒酿造过程中广泛采用非酿酒酵母和酿酒酵母的混合发酵用于改善葡萄酒的感官品质。在混菌发酵过程中,非酿酒酵母与酿酒酵母间的交互作用影响代谢产物和微生物的生长,对于获得葡萄酒所需性状具有重要作用。因此,为控制和优化混菌发酵,了解和掌握非酿酒酵母和酿酒酵母间的生理和代谢交互作用非常必要。
群体感应是微生物界广泛存在的细胞-细胞之间的通讯方式。许多真菌通过群体感应的形式进行交流,即通过分泌群体感应信号分子(quorum sensing molecules,QSM)来沟通和协调群体行为[4-5]。很多真菌既可以单细胞酵母形态生长,也可以丝状酵母形态生长[6-7]。这种二型态被认为是一种古老的真菌特异性适应行为[8]。群体感应信号介导包括酿酒酵母在内的非致病真菌和致病性真菌(如白色念珠菌等)的二型态转变。作为白色念珠菌的主要QSM,法尼醇抑制酵母形态到菌丝形态的转换,而酪醇则促进白色念珠菌体由单细胞向多细胞菌丝的二型态转变[9-10]。2-苯乙醇是酿酒酵母重要的QSM之一,由酿酒酵母在酒精发酵过程中通过Ehrlich途径合成[11]。2-苯乙醇参与调节细胞密度和刺激假菌丝体的形成,外源添加2-苯乙醇也会导致细胞形态发生改变和单倍体侵入生长[12-15]。2-苯乙醇还参与酵母菌生物被膜的形成[16]。有研究认为作为酵母中枢碳代谢产物的2-苯乙醇等QSMs的合成反映了菌体代谢途径通量,使酵母菌在不同环境条件下改变路径优化生长[17]。在氮源丰富条件下酵母菌经莽草酸途径合成少量2-苯乙醇,在氮源受限条件下,酵母通过Ehrlich途径合成2-苯乙醇[18]。
目前发现有一些非酿酒酵母Hanseniaspora uvarum、T.delbrueckii、M.pulcherrima、Starmerella bacillaris也能够合成2-苯乙醇[19-20]。非酿酒酵母Kloeckera apiculata不仅自身可以合成2-苯乙醇,而且6个与菌体成膜相关基因的表达也可被2-苯乙醇诱导,并产生细胞间黏附形成生物膜[21]。有些非酿酒酵母如Candida zemplinina和Dekkera bruxellensis,没有检测到任何已知的QSM[19]。不同非酿酒酵母菌株合成QSM的种类和能力不同,具有种特异性[22]。目前人们对非酿酒酵母的QSM研究重视不足,对2-苯乙醇在非酿酒酵母中的合成规律和影响以及其所引发的群体感应机制还不太清楚。因此,从性状优良的本土非酿酒酵母中筛选出可以合成2-苯乙醇的菌株,并进一步研究2-苯乙醇在非酿酒酵母菌中的合成规律及作用将有助于对未来通过调节QSM来控制和优化混菌发酵过程提供理论依据。
本研究从实验室前期分离鉴定的发酵性能优良的非酿酒酵母中筛选出1株具有明显二型态转换的非酿酒酵母Mp-57。采用GC法验证了这株非酿酒酵母合成2-苯乙醇的能力,分析研究该菌株2-苯乙醇合成规律,并考察了外源添加2-苯乙醇对目标菌活性、生物被膜形成及乙醇耐受力的影响。以期为未来研究混菌发酵中非酿酒酵母和酿酒酵母的交互作用,以及群体感应机制提供菌株来源和基础数据,也为葡萄酒混菌发酵体系的定向调控拓展研究思路和途径。
1 材料与方法
1.1 材料与试剂
商业酿酒酵母Ds(原产国:法国)、42株本土非酿酒酵母,河北科技师范学院食品科技学院。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose, YPD)培养基(g/L):葡萄糖20,蛋白胨20,酵母浸粉10,pH 6.0,121 ℃高压灭菌20 min。
营养丰富(nutrient rich, NR)培养基:无氨基酵母氮源(yeast nitrogen base, YNB)1.7 g/L,葡萄糖20 g/L,(NH4)2SO4 45.4 mmol/L,琼脂20 g/L。
限制性培养基(minimal medium, MM):YNB 1.7 g/L,葡萄糖20 g/L,5 μmol/L L-脯氨酸。
酵母基础(synthetic dropout,SD)培养基:YNB 1.7 g/L,(NH4)2SO4 37.8 mmol/L,葡萄糖20 g/L。
合成低铵葡萄糖(synthetic low-ammonium detrose,SLAD)培养基:4×YNB 6.8 g/L,(NH4)2SO4 50 μmol/L,葡萄糖20 g/L,琼脂20 g/L。
2-苯乙醇标准品,上海阿拉丁生化科技股份有限公司;无水乙醇,天津欧博凯化工有限公司。
1.2 仪器与设备
7890A 气相色谱仪,美国Agilent Technologies公司;BioSpec-mini 核酸蛋白分析仪,日本岛津公司;EN PH pH计,上海梅特勒-托利多仪器有限公司;BHC-1300IIA2 生物安全柜,哈尔滨市东联电子技术开发有限公司;BL-320S 分析天平,北京赛多利斯天平有限公司;HVE-50 高压灭菌锅,上海天呈科技有限公司;BGZ-246 电热鼓风干燥箱,上海博讯医疗生物仪器股份有限公司;YCP-5 生化培养箱,长沙华曦电子科技有限公司;THZ-82B 气浴恒温振荡器,江苏金坛市医疗仪器厂;MultifugeX3R 高速冷冻离心机,赛默飞世尔科技有限公司;QJD0025 酶标仪,美国伯腾仪器有限公司北京代表处。
1.3 实验方法
1.3.1 限氮条件下二型态转换非酿酒酵母菌株的筛选
实验室筛选的非酿酒酵母试验菌株在YPD固体培养基上,28 ℃活化培养48 h,挑取单菌落接种于YPD液体培养基中,28 ℃、120 r/min培养24 h,取活化菌悬液1 mL于9 mL蛋白胨生理盐水中,摇匀,将其作为10-1稀释浓度,依次稀释至10-6,然后移取每个梯度稀释菌悬液100 μL于SLAD固体平板上,涂布棒均匀涂抹,每组重复3次,28 ℃倒置培养。分别于7、14、21 d观察菌落形态并拍照记录。
1.3.2 非酿酒酵母Mp-57的2-苯乙醇合成鉴定
采用气相色谱法进行2-苯乙醇的鉴定。
样品准备:YPD培养基活化菌株,离心收集菌体,蒸馏水洗涤,MM液体培养基中28 ℃培养72 h,收集菌液冻存。
样品预处理:取2 mL冻存液,10 000 r/min离心5 min除去菌泥,上清液用纯水稀释至合适倍数,然后用0.22 μm的滤膜过滤即得待测液。
GC-FID色谱条件:色谱柱:Agilent DB-WAX弹性石英毛细管柱(30 m×0.32 mm×0.5 μm);载气He(≥99.999%),流速为2 mL/min;H2流速35 mL/min;空气流速400 mL/min;进样口温度250 ℃;检测器温度300 ℃;升温程序:初始温度80 ℃保持2 min,以20 ℃/min升温至220 ℃保持3 min;进样方式:分流进样,分流比10∶1,进样量1 μL。
1.3.3 非酿酒酵母菌Mp-57的2-苯乙醇合成规律研究
28 ℃,YPD培养基活化非酿酒酵母Mp-57和酿酒酵母Ds(对照),6 500 r/min离心收集菌泥,蒸馏水清洗后接种于MM培养基中,初始接种密度分别调整至4×103、4×105、4×107CFU/mL。然后28 ℃、120 r/min培养78 h,每隔6 h取样,一部分样品6 500 r/min离心10 min,上清液-20 ℃冻存,用于GC测定2-苯乙醇含量;另一部分样品用血球计数板及美兰染色法测定活细胞数。
样品预处理:取2 mL冻存上清液,10 000 r/min离心5 min弃沉淀,上清液用纯水稀释至合适倍数,然后用0.22 μm滤膜过滤即得GC法2-苯乙醇定量分析待测液。
GC法测定2-苯乙醇含量,测定条件同GC-FID条件。以标准2-苯乙醇溶液绘制标准曲线进行定量分析。2-苯乙醇合成速率计算如公式(1)所示[20]:
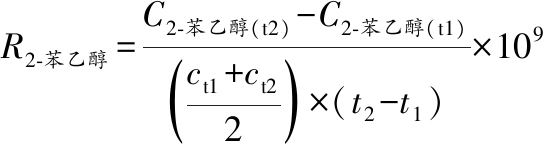
(1)
式中:R2-苯乙醇,2-苯乙醇合成速率,fg/(cell·h);C2-苯乙醇,2-苯乙醇质量浓度,mg/L;c,细胞浓度,cell/mL;t,时间,h。
1.3.4 外源添加2-苯乙醇对非酿酒酵母Mp-57及酿酒酵母Ds生长的影响
将Mp-57和Ds(对照)在YPD液体培养基中28 ℃、120 r/min预培养24 h,分别以106 CFU/mL的量接种至2组10 mL SD培养基中,一组添加2-苯乙醇至终浓度(质量浓度)分别为5 μmol/L(0.6 mg/L)、50 μmol/L(6 mg/L)及500 μmol/L(60 mg/L),另一组添加相同体积水作对照,置于120 r/min的摇床中28 ℃培养72 h,通过血球计数板计数、测定OD600nm评价细胞生长情况。
1.3.5 外源添加2-苯乙醇对非酿酒酵母Mp-57及酿酒酵母Ds生物被膜形成能力的影响
为检测2-苯乙醇对Mp-57和Ds生物被膜形成能力的影响,将Mp-57和Ds(对照)在YPD培养基中28 ℃培养24 h,收集和清洗后用YPD重悬,调整细胞浓度为107 CFU/mL,取20 μL 107 CFU/mL的培养物,加入到每孔含有180 μL YPD培养基的96孔板中,处理孔中分别加入2-苯乙醇至终浓度5、50、500 μmol/L,空白对照组加入相同体积水,于28 ℃保温培养72 h,每个处理重复4次。用200 μL PBS清洗2次去除游离细胞,之后用200 μL 0.4%(体积分数)结晶紫(crystal violet,CV)溶液在室温下染色45 min,PBS重复清洗4次后,每孔加入95%(体积分数)乙醇200 μL,室温处理45 min,轻微摇晃以洗脱CV。移取100 μL脱色液到另一块96孔板中,使用酶标仪测量OD630nm值。
1.3.6 外源添加2-苯乙醇对非酿酒酵母菌Mp-57及酿酒酵母Ds乙醇耐受性的影响
将Mp-57和Ds(对照)在YPD液体培养基中28 ℃振荡培养24 h,离心收集菌泥,蒸馏水洗涤2次后用YPD重悬,将菌体密度均调整至107 CFU/mL,取相同浓度菌液1 mL离心,菌泥用YPD重悬,加入无水乙醇至终体积分数为15%,混匀后再加入2-苯乙醇至终浓度分别为5、50、500 μmol/L,对照加入水,置于28 ℃恒温培养箱中培养,分别于30、60、90 min取样20 μL,稀释相同倍数后,点接至YPD平板上,培养24 h后拍照记录生长情况。
1.4 数据处理
采用Excel 2016进行基本数据处理,SPSS 26进行数据统计分析,Origin 2022进行相关图表绘制。
2 结果与分析
2.1 限氮条件下二型态转换非酿酒酵母菌株的筛选
氮是自发酵葡萄醪中微生物生长的主要限制性营养元素。酿酒酵母能根据环境营养供应情况调整自身生长形态以适应环境变化。在氮源受限时,2-苯乙醇等QSM介导酿酒酵母由单细胞酵母形态转变为丝状形态生长。为研究非酿酒酵母的群体感应机制,将前期实验室筛选鉴定过的性状优良的非酿酒酵母菌株,分别接种到SLAD(限制氮源)和NR(丰富氮源)2种培养基上。观察21 d培养期间平板菌落形态变化,筛选发现一株非酿酒酵母Mp-57(Mp-57 ID NO Z1392-30 Metschnikowia aff)为美极梅奇酵母,仅在SLAD平板上分化形成假菌丝。从图1可以看到该菌株在NR平板上菌落边缘一直保持光滑,无明显变化;SLAD平板上7 d已分化形成明显假菌丝,并随时间延长形成向各个方向辐射的绒毛状菌丝。

图1 限制氮源平板筛选二型态转换菌株
Fig.1 Screening of dimorphic switching strains with a restricted nitrogen source plate
2.2 非酿酒酵母Mp-57的2-苯乙醇合成规律研究
2-苯乙醇在酿酒酵母菌二态型转换中发挥重要作用。2-苯乙醇合成基因突变后,菌体不能形成假菌丝。添加2-苯乙醇,酿酒酵母重新分化形成假菌丝,恢复部分野生型表型[12]。利用SLAD平板筛选获得一株具有二型态转换的Mp-57。推测在相同自然环境中生存的Mp-57菌株也能合成2-苯乙醇,并诱导菌丝基因表达,使菌体在氮源受限时发生二型态转换[8]。采用GC法,以二型态转换明显的商业酿酒酵母菌株Ds为阳性对照,验证了非酿酒酵母Mp-57在限氮培养基中存在2-苯乙醇。
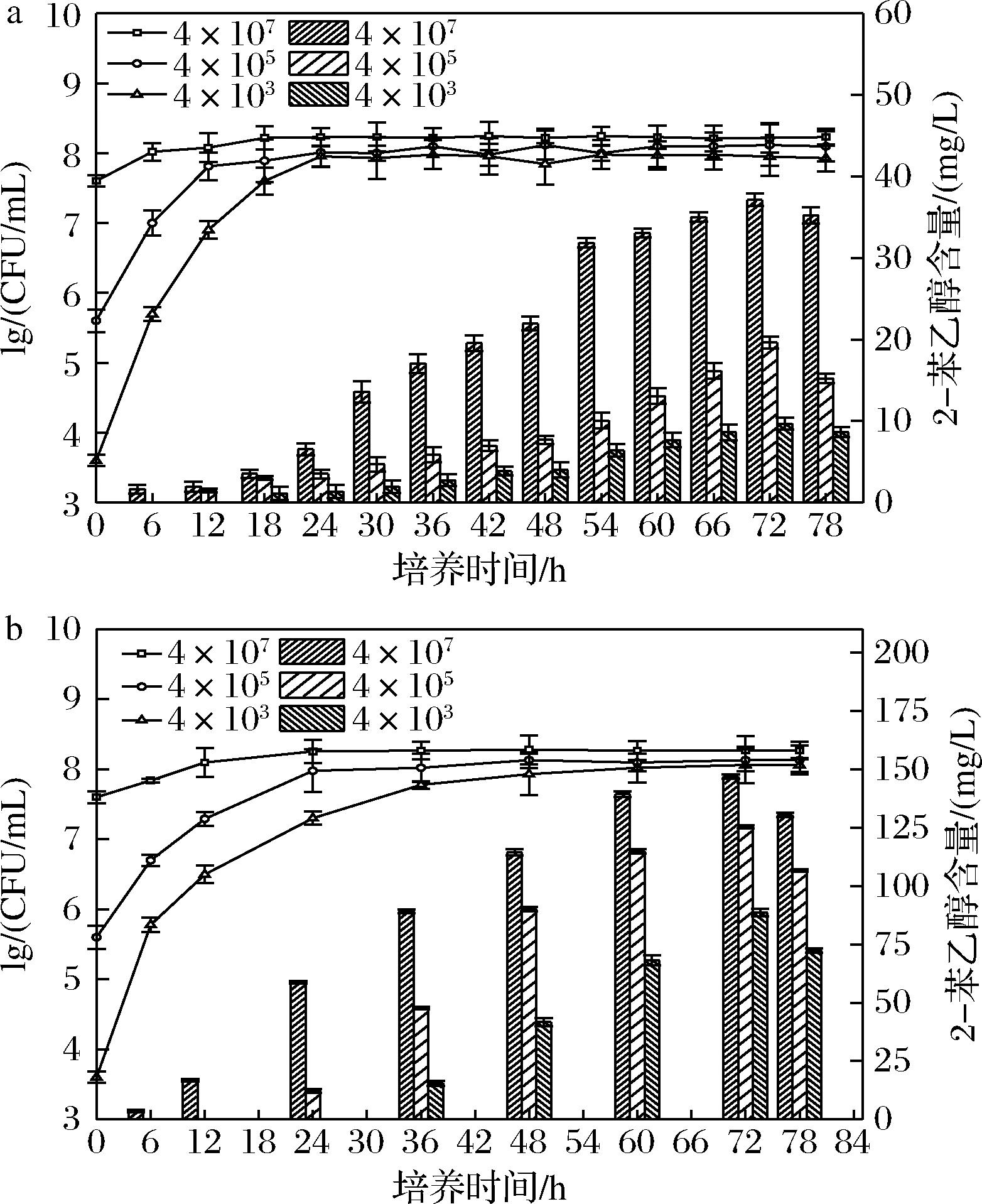
酿酒酵母2-苯乙醇合成与细胞密度相关[12, 23],高群体密度刺激芳香醇合成。由图2结果可知,尽管生长曲线不同,Mp-57菌株2-苯乙醇合成的起始具有细胞密度依赖性。与Ds(对照)均在细胞密度达到107CFU/mL时,开始检测到2-苯乙醇。Ds菌株2-苯乙醇合成的细胞密度阈值与已报道的研究结果基本一致[23]。其次Mp-57上清液中2-苯乙醇含量随细胞密度增加而增加,静止期达到最大值,之后保持在较高水平。另外不同初始接种密度下,Mp-57菌株2-苯乙醇合成量始终显著高于对照(图3)。如高接种密度(4×107细胞/mL)下Mp-57菌株2-苯乙醇含量最大值为146 mg/L,是Ds菌株的4倍。表明Mp-57在限氮条件下,Ehrlich途径非常活跃,超过Ds。与GONZ LEZ等[20]的研究认为非酿酒酵母2-苯乙醇合成能力普遍低于酿酒酵母的结论不同。我们筛选的另一株库德毕赤酵母H1的2-苯乙醇合成量也显著低于Mp-57。即非酿酒酵母2-苯乙醇的合成有种属特异性。
LEZ等[20]的研究认为非酿酒酵母2-苯乙醇合成能力普遍低于酿酒酵母的结论不同。我们筛选的另一株库德毕赤酵母H1的2-苯乙醇合成量也显著低于Mp-57。即非酿酒酵母2-苯乙醇的合成有种属特异性。
a-酿酒酵母Ds(对照);b-非酿酒酵母Mp-57
图2 不同初始接种密度下Mp-57及Ds培养过程中活细胞数和2-苯乙醇含量
Fig.2 Total viable cells and production of 2-phenylethanol of Mp-57 and Ds (control) under different initial cell concentrations during fermentation

图3 不同初始接种密度下Mp-57及Ds不同生长阶段上清液2-苯乙醇含量
Fig.3 Contents of 2-phenylethanol in superannuants of Mp-57 and Ds in different growth periods under different initial cell concentrations
注:组间不同小写字母表示差异显著(P<0.05)(下同)。
酿酒酵母菌体2-苯乙醇合成除受细胞密度影响以外,还受环境氮源水平影响。在菌体不同生长阶段,随着培养基氮源消耗,2-苯乙醇合成相关基因表达发生变化,合成速率不断改变[23]。为研究Mp-57菌株细胞内2-苯乙醇合成能力变化规律,利用已测得的78 h培养过程中,不同取样点活细胞数和2-苯乙醇含量,换算成2-苯乙醇合成速率并绘制变化曲线(图4)。发现Mp-57的2-苯乙醇合成速率,在对数期不断增加,对数期末期增至峰值,在进入静止期后迅速降低(图4),尽管合成速率在不断降低,但从总体上看静止期培养液中2-苯乙醇累积含量持续保持在较高水平。菌体在静止期2-苯乙醇合成速率的迅速降低,可能由于生长环境中营养缺乏,细胞整体代谢水平下降导致2-苯乙醇合成前体物苯丙氨酸不足所致[20]。
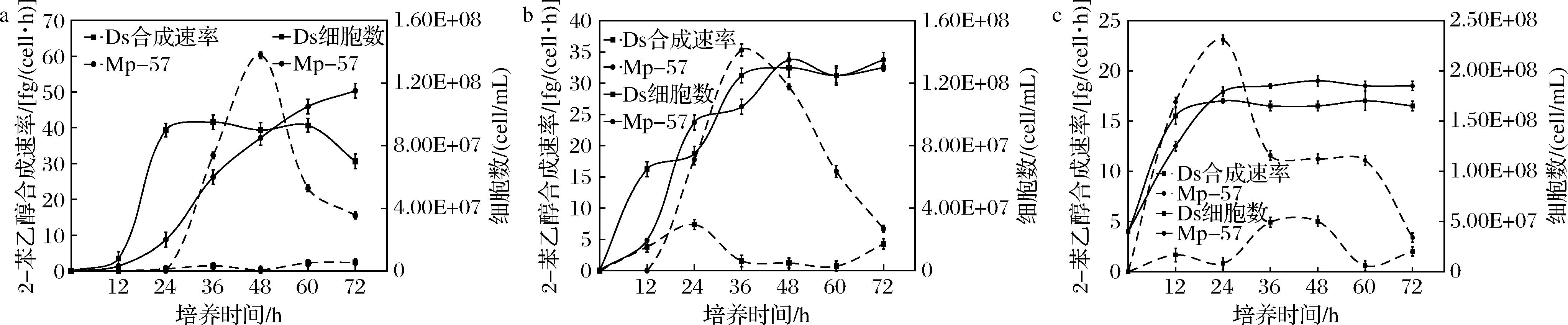
a-4×103细胞/mL;b-4×105细胞/mL;c-4×107细胞/mL
图4 不同初始接种密度下Mp-57及Ds培养过程中2-苯乙醇合成速率
Fig.4 Synthesis rate of 2-phenylethanol of Mp-57 and Ds under different initial cell concentrations during fermentation
2.3 外源添加2-苯乙醇对非酿酒酵母Mp-57及酿酒酵母Ds菌株的影响
酿酒酵母合成分泌2-苯乙醇参与自身细胞生长、形态变化、生物被膜形成等生理过程[4]。进化上同源的非酿酒酵母在混菌发酵体系中,是否也是利用2-苯乙醇调控上述生理过程尚不清楚,因此根据2.2节中Mp-57及Ds的2-苯乙醇含量测定结果,并参考以往2-苯乙醇对菌体影响的相关文献[12,16],研究不同浓度2-苯乙醇对Mp-57及Ds发酵相关特性的影响。
2.3.1 外源添加2-苯乙醇对非酿酒酵母Mp-57菌株生长的影响
选用可以抑制内源性2-苯乙醇合成的含有高浓度(NH4)2SO4的SD培养基[12],以各自未处理菌株为对照,用5、50、500 μmol/L 3种不同浓度2-苯乙醇分别处理Mp-57和Ds培养液,然后测定相同培养时长后菌体细胞量,以评价该化合物对Mp-57及Ds菌株生长的影响。从图5可以看出,当2-苯乙醇处理浓度为5 μmol/L时,Mp-57和Ds菌体生长量与各自对照相比无明显变化;当处理浓度提高至50 μmol/L,Mp-57和Ds菌体量与各自对照相比分别增加了80%和62.5%;继续增加2-苯乙醇浓度至500 μmol/L时,Mp-57和Ds菌体量与各自对照相比分别下降了20%和25%,与国内研究报道高浓度2-苯乙醇有细胞毒性的结论相符[24]。2-苯乙醇对2株菌生长的影响呈现相同的规律,即在50 μmol/L浓度时促进菌体生长,500 μmol/L浓度时有细胞毒性,抑制菌体生长。此结果表明2-苯乙醇以剂量依赖方式影响Mp-57菌株和Ds菌株的生长,暗示作为已知酿酒酵母QSM的2-苯乙醇,也可能是Mp-57的信号分子,而且在菌体不同生长阶段下发挥不同的生理效应。目前已有研究利用2-苯乙醇对酿酒酵母菌生长的抑制作用,通过在发酵培养基中添加2-苯乙醇降低菌体生物量来提高目的物乙醇产量[25]。
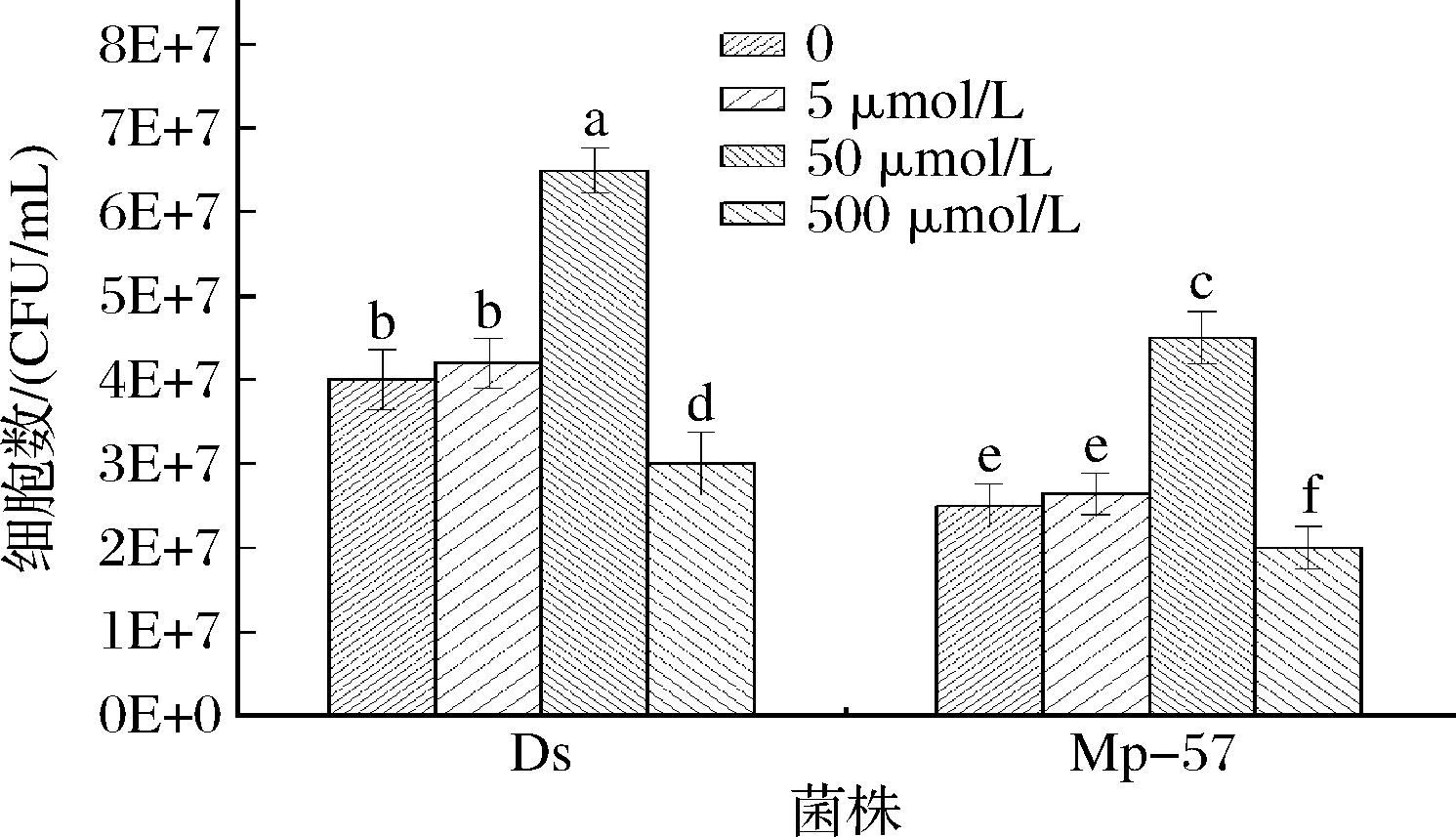
图5 外源添加2-苯乙醇对Mp-57及Ds生长的影响
Fig.5 Effects of exogenous 2-phenylethanol on the growth of Mp-57 and Ds
2.3.2 外源添加2-苯乙醇对非酿酒酵母Mp-57生物被膜形成能力的影响
生物被膜是一种微生物群落形式,微生物通过形成生物被膜这种群落结构,可以更好地适应高渗透压、热休克、氧化应激和营养缺乏等不利环境条件[26]。群体感应参与调节真菌的许多种群水平行为,如致病/毒力和生物被膜形成[5,10,27-28]。研究显示酵母细胞形成生物被膜,有助于提高固定化发酵产品乙醇含量[29],也有利于生物膜反应器中进行的工业发酵[30]。如图6所示,5 μmol/L的2-苯乙醇对2株菌生物被膜形成均无显著影响;50 μmol/L的2-苯乙醇促进Mp-57菌株形成生物被膜,与自身未处理菌株相比,Mp-57在处理后,成膜能力提高28.7%。测定Ds成膜情况时发现50 μmol/L的2-苯乙醇显著抑制Ds成膜。当处理浓度提高至500 μmol/L时,2-苯乙醇对Mp-57和Ds两株菌生物被膜的形成抑制率分别为38%和44.3%。从图6中明显也可以看出,即使在未添加2-苯乙醇的条件下,Mp-57成膜能力也显著高于Ds。表明Mp-57未来在生物膜固定化混菌发酵中可能有着良好的应用前景。
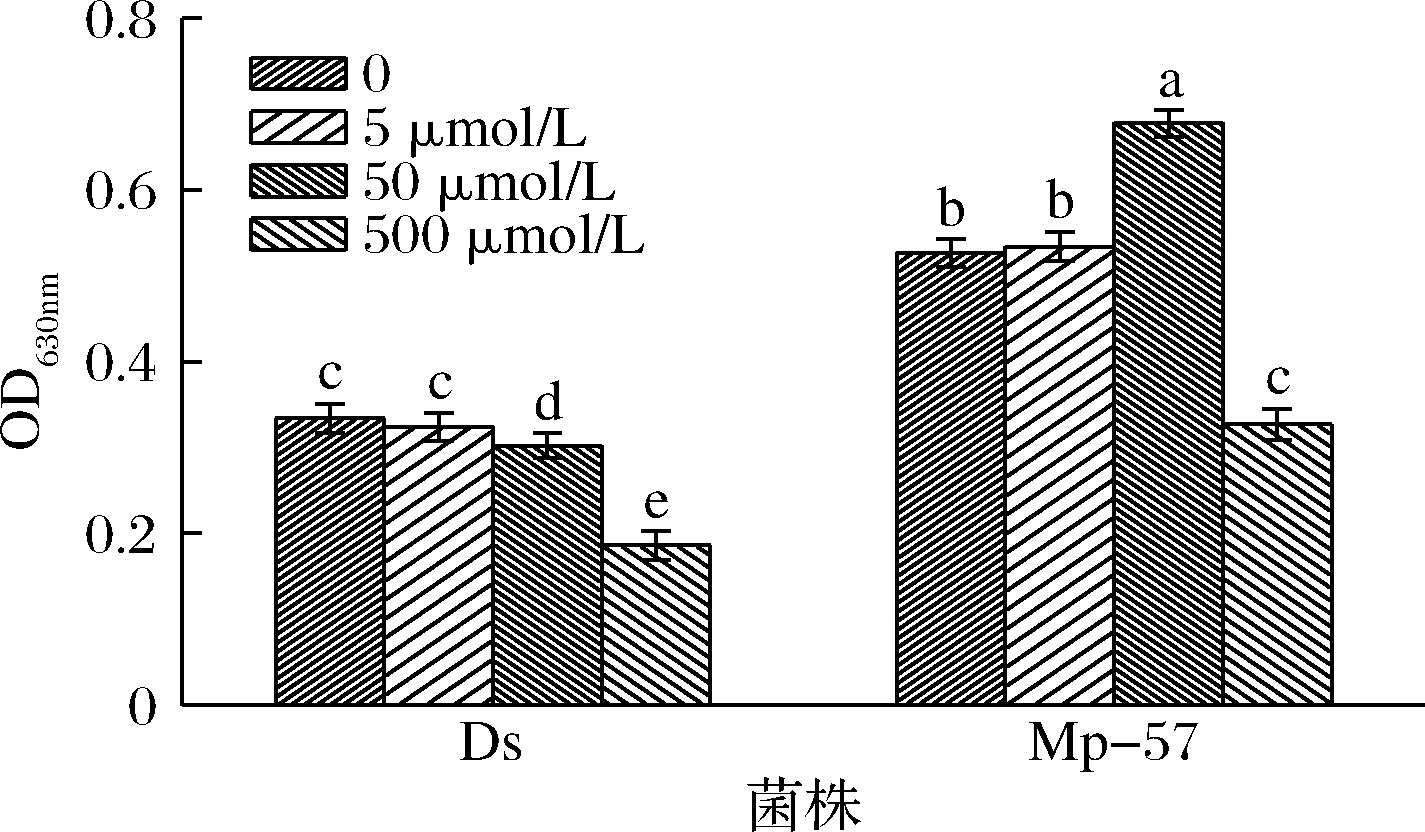
图6 外源添加2-苯乙醇对Mp-57及Ds生物被膜形成能力的影响
Fig.6 Effects of exogenous 2-phenylethanol on biofilm formation of Mp-57 and Ds
2.3.3 外源添加2-苯乙醇对非酿酒酵母Mp-57乙醇耐受性的影响
在前面研究中发现,不同浓度2-苯乙醇对Mp-57和Ds生长及生物被膜形成产生不同影响,这些性状变化与菌体对抗不良环境耐受力相关。因此为评价2-苯乙醇是否会提高Mp-57和Ds对乙醇的耐受性。参照文献[31]中的方法,采用5、50、500 μmol/L 3种不同浓度的2-苯乙醇处理含有15%(体积分数)乙醇的Mp-57及Ds菌体培养液,对照与处理组完全相同,仅未添加2-苯乙醇。结果见图7。
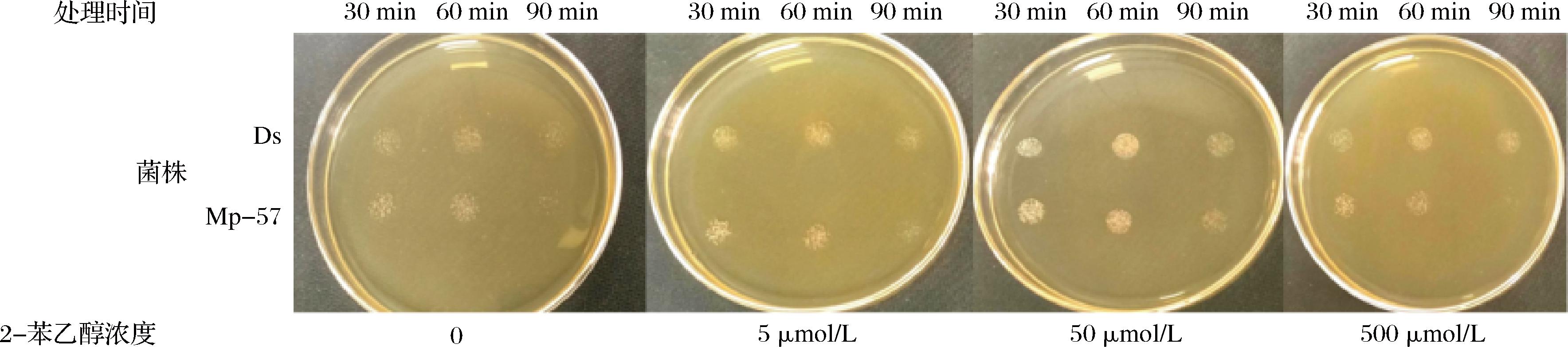
图7 外源添加2-苯乙醇对Mp-57及Ds乙醇耐受性的影响
Fig.7 Effects of exogenous 2-phenylethanol on ethanol tolerance of Mp-57 and Ds
从2-苯乙醇添加量为0的对照平板菌落可以看出,15%(体积分数)乙醇处理不同时间,酿酒酵母Ds残余菌落密度无明显变化,表现出很高的乙醇耐受性;与酿酒酵母Ds相比,Mp-57在乙醇胁迫90 min后,菌落密度明显降低,表明Mp-57的乙醇耐受性低于酿酒酵母Ds,这与美极梅奇酵母具有较低乙醇耐受性的研究报道相符[32]。观察Mp-57和Ds在添加50 μmol/L的2-苯乙醇后,乙醇胁迫30、60、90 min后取样涂板培养相同时间,平板上残余菌落密度与各自对照相比均明显增加。表明50 μmol/L的2-苯乙醇可以提高Mp-57和Ds菌株对15%(体积分数)乙醇耐受性。这可能是由于该浓度的2-苯乙醇能显著促进2株菌生长的原因。5 μmol/L的2-苯乙醇对2株菌生长没有显著影响,所以添加此浓度的2-苯乙醇后残余菌落密度,与相应对照比较无明显变化。500 μmol/L的2-苯乙醇显著抑制Mp-57和Ds的生长,但添加此浓度2-苯乙醇后,2株菌与同样受乙醇胁迫的相应对照相比,菌落密度变化不明显,可能由于实验初始菌体浓度较高,因而一定程度上会削弱2-苯乙醇抑制效果。
3 结论
本研究从实验室前期分离鉴定的非酿酒酵母中,筛选出1株具有二型态转换的非酿酒酵母Mp-57。GC法鉴定出Mp-57能合成2-苯乙醇。测定并分析Mp-57菌株2-苯乙醇合成规律,发现2-苯乙醇合成起始具有细胞密度依赖性。其次,发现2-苯乙醇合成速率变化曲线呈钟形,即开始时合成速率随着培养时间延长不断增加,对数期末期达到最大值,然后迅速降低。这种合成速率变化导致上清液中2-苯乙醇合成量从开始不断增加,到静止期末期达到高峰并维持在高含量水平。不同于以往研究认为酿酒酵母2-苯乙醇合成能力更强,筛选到的二型态转换明显的Mp-57菌株,其2-苯乙醇合成能力更强,其总合成量显著高于酿酒酵母Ds。最后,我们还考察了外源添加2-苯乙醇对Mp-57及Ds菌株发酵相关性状的影响,发现2-苯乙醇类似信号分子,以剂量依赖方式影响菌体生长、成膜及乙醇耐受性。本文对混菌发酵体系中由2-苯乙醇引发的酵母间代谢交互作用和风味物质的修饰研究具有重要理论意义,并为定向调控混菌发酵风味物质研究奠定基础。
[1] 战吉宬, 曹梦竹, 游义琳, 等.非酿酒酵母在葡萄酒酿造中的应用[J].中国农业科学, 2020, 53(19):4057-4069.
ZHAN J C, CAO M Z, YOU Y L, et al.Research advance on the application of non-Saccharomyces in winemaking[J].Scientia Agricultura Sinica, 2020, 53(19):4057-4069.
[2] 阎贺静, 张鸣宇, 孙康, 等.野生酿酒酵母和葡萄汁有孢汉逊酵母混菌发酵对玫瑰香葡萄酒香气的影响[J].食品与发酵工业, 2020, 46(11):165-171.
YAN H J, ZHANG M Y, SUN K, et al.Effects of the co-fermentation of Saccharomyces cerevisiae and Hanseniaspora uvarum on aroma of Muscat wine[J].Food and Fermentation Industries, 2020, 46(11):165-171.
[3] 罗来庆, 林海明, 焦宇知, 等.非酿酒酵母与酿酒酵母混合发酵对葡萄酒香气的影响[J].中国酿造, 2022, 41(10):89-94.
LUO L Q, LIN H M, JIAO Y Z, et al.Effects of mixed-strain fermentation of non-Saccharomyces cerevisiae and Saccharomyces cerevisiae on wine aroma[J].China Brewing, 2022, 41(10):89-94.
[4] 魏天予, 牛永武, 陈启和.真菌的群体感应现象及群体感应分子(QSMs)研究进展[J].生物加工过程, 2020, 18(2):206-213.
WEI T Y, NIU Y W, CHEN Q H.Advances in quorum sensing and quorum sensing molecules of fungi[J].Chinese Journal of Bioprocess Engineering, 2020, 18(2):206-213.
[5] AHMAD PADDER S, PRASAD R, SHAH A H.Quorum sensing:A less known mode of communication among fungi[J].Microbiological Research, 2018, 210:51-58.
[6] LENGELER K B, DAVIDSON R C, et al.Signal transduction cascades regulating fungal development and virulence[J].Microbiology and Molecular Biology Reviews:MMBR, 2000, 64(4):746-785.
[7] MU OZ J F, MCEWEN J G, CLAY O K, et al.Genome analysis reveals evolutionary mechanisms of adaptation in systemic dimorphic fungi[J].Scientific Reports, 2018, 8:4473.
OZ J F, MCEWEN J G, CLAY O K, et al.Genome analysis reveals evolutionary mechanisms of adaptation in systemic dimorphic fungi[J].Scientific Reports, 2018, 8:4473.
[8] LIU G Q, CAO L, QIU X H, et al.Quorum sensing activity and hyphal growth by external stimuli in the entomopathogenic fungus Ophiocordyceps sinensis[J].Insects, 2020, 11(4):205.
[9] KOV CS R, MAJOROS L.Fungal quorum-sensing molecules:A review of their antifungal effect against Candida biofilms[J].Journal of Fungi, 2020, 6(3):99.
CS R, MAJOROS L.Fungal quorum-sensing molecules:A review of their antifungal effect against Candida biofilms[J].Journal of Fungi, 2020, 6(3):99.
[10] RODRIGUES C F,  ERN
ERN KOV
KOV L.Farnesol and tyrosol:Secondary metabolites with a crucial quorum-sensing role in Candida biofilm development [J].Genes, 2020, 11(4):444.
L.Farnesol and tyrosol:Secondary metabolites with a crucial quorum-sensing role in Candida biofilm development [J].Genes, 2020, 11(4):444.
[11] DAI J, XIA H L, YANG C L, et al.Sensing, uptake and catabolism of L-phenylalanine during 2-phenylethanol biosynthesis via the Ehrlich pathway in Saccharomyces cerevisiae[J].Frontiers in Microbiology, 2021, 12:601963.
[12] CHEN H, FINK G R.Feedback control of morphogenesis in fungi by aromatic alcohols[J].Genes &Development, 2006, 20(9):1150-1161.
[13] WINTERS M, ARU V, HOWELL K, et al.Reliable budding pattern classification of yeast cells with time-resolved measurement of metabolite production[J].BioTechniques, 2022, 72(3):100-103.
[14] LORENZ M C, CUTLER N S, HEITMAN J.Characterization of alcohol-induced filamentous growth in Saccharomyces cerevisiae[J].Molecular Biology of the Cell, 2000, 11(1):183-199.
[15] AVBELJ M, ZUPAN J R, RASPOR P.Quorum-sensing in yeast and its potential in wine making[J].Applied Microbiology and Biotechnology, 2016, 100(18):7841-7852.
[16] ZHANG D L, WANG F J, YU Y, et al.Effect of quorum-sensing molecule 2-phenylethanol and ARO genes on Saccharomyces cerevisiae biofilm[J].Applied Microbiology and Biotechnology, 2021, 105(9):3635-3648.
[17] HAN T L, CANNON R D, VILLAS-B AS S G.The metabolic basis of Candida albicans morphogenesis and quorum sensing[J].Fungal Genetics and Biology, 2011, 48(8):747-763.
AS S G.The metabolic basis of Candida albicans morphogenesis and quorum sensing[J].Fungal Genetics and Biology, 2011, 48(8):747-763.
[18] HAZELWOOD L A, DARAN J M, VAN MARIS A J A, et al.The Ehrlich pathway for fusel alcohol production:A century of research on Saccharomyces cerevisiae metabolism[J].Applied and Environmental Microbiology, 2008, 74(8):2259-2266.
[19] ZUPAN J R, AVBELJ M, BUTINAR B, et al.Monitoring of quorum-sensing molecules during minifermentation studies in wine yeast[J].Journal of Agricultural and Food Chemistry, 2013, 61(10):2496-2505.
[20] GONZ LEZ B, V
LEZ B, V ZQUEZ J, MORCILLO-PARRA M
ZQUEZ J, MORCILLO-PARRA M  , et al.The production of aromatic alcohols in non-Saccharomyces wine yeast is modulated by nutrient availability[J].Food Microbiology, 2018, 74:64-74.
, et al.The production of aromatic alcohols in non-Saccharomyces wine yeast is modulated by nutrient availability[J].Food Microbiology, 2018, 74:64-74.
[21] LIU P, FANG J F, CHEN K, et al.Phenylethanol promotes adhesion and biofilm formation of the antagonistic yeast Kloeckera apiculata for the control of blue mold on citrus[J].FEMS Yeast Research, 2014, 14(4):536-546.
[22] GONZ LEZ B, V
LEZ B, V ZQUEZ J, CULLEN P J, et al.Aromatic amino acid-derived compounds induce morphological changes and modulate the cell growth of wine yeast species[J].Frontiers in Microbiology, 2018, 9:670.
ZQUEZ J, CULLEN P J, et al.Aromatic amino acid-derived compounds induce morphological changes and modulate the cell growth of wine yeast species[J].Frontiers in Microbiology, 2018, 9:670.
[23] AVBELJ M, ZUPAN J R, KRANJC L, et al.Quorum-sensing kinetics in Saccharomyces cerevisiae:A symphony of ARO genes and aromatic alcohols[J].Journal of Agricultural and Food Chemistry, 2015, 63(38):8544-8550.
[24] 陈先锐, 王肇悦, 何秀萍.酵母菌合成2-苯乙醇的研究进展[J].生物工程学报, 2016, 32(9):1151-1163.
CHEN X R, WANG Z Y, HE X P.Advances in biosynthesis of 2-phenylethanol by yeasts[J].Chinese Journal of Biotechnology, 2016, 32(9):1151-1163.
[25] HUANG X F, REARDON K.Quorum-sensing molecules increase ethanol yield from Saccharomyces cerevisiae [J].FEMS yeast research, 2021, 21(8):foab056.
[26] AHMAD RATHER M, GUPTA K, MANDAL M.Microbial biofilm:Formation, architecture, antibiotic resistance, and control strategies[J].Brazilian Journal of Microbiology, 2021, 52(4):1701-1718.
[27] WANG Y S, BIAN Z R, WANG Y.Biofilm formation and inhibition mediated by bacterial quorum sensing[J].Applied Microbiology and Biotechnology, 2022, 106(19):6365-6381.
[28] WONGSUK T, PUMEESAT P, LUPLERTLOP N.Fungal quorum sensing molecules:Role in fungal morphogenesis and pathogenicity[J].Journal of Basic Microbiology, 2016, 56(5):440-447.
[29] YANG L Y, ZHENG C, CHEN Y, et al.FLO genes family and transcription factor MIG1 regulate Saccharomyces cerevisiae biofilm formation during immobilized fermentation[J].Frontiers in Microbiology, 2018, 9:1860.
[30] CHEN Y, LIU Q G, ZHOU T, et al.Ethanol production by repeated batch and continuous fermentations by Saccharomyces cerevisiae immobilized in a fibrous bed bioreactor[J].Journal of Microbiology and Biotechnology, 2013, 23(4):511-517.
[31] NATH B J, MISHRA A K, SARMA H K.Assessment of quorum sensing effects of tyrosol on fermentative performance by chief ethnic fermentative yeasts from northeast India[J].Journal of Applied Microbiology, 2021, 131(2):728-742.
[32] VICENTE J, RUIZ J, BELDA I, et al.The genus Metschnikowia in enology[J].Microorganisms, 2020, 8(7):1038.