我国是蒸馏酒酿造大国,据国家统计局的数据显示,2021年我国白酒产量为715.6万kL,按照每生产1 t白酒约产生3 t酒糟计算[1],我国每年酒糟产生量超过1 900万t。目前酒糟主要的处理方式是作为饲料和肥料,然而这种处理方式经济附加值低,同时所能处理的酒糟有限。酒糟含水率高,易腐败,大量的酒糟得不到有效的处理而被浪费,对环境造成危害。酒糟营养丰富,含有未被完全利用完的淀粉、蛋白质等营养物质[2]。近年来已有许多基于酒糟生产饲料、食品、燃料等产品的研究。MIRZOYAN等[3]利用大肠杆菌处理酒糟生产H2,MAYSUAN等[4]通过对比4种酒糟的处理方式,利用酒糟进行厌氧消化发电在获得1 410万澳元收入的同时,对环境也是最友好的。酒糟综合利用既可以提高企业的经济效益,又可以推动企业的可持续发展。
丁醇凭借其优异的理化特性和与燃油设备兼容的特点,被认为是可以替代汽油的新一代燃料。然而丁醇发酵仍面临诸多问题,传统上利用微生物进行丙酮-丁醇-乙醇(acetone-butanol-ethanol,ABE)发酵,但是产物丙酮会腐蚀发动机,并且燃料性能差,将丙酮转化为异丙醇进行异丙醇-丁醇-乙醇(isopropanol-butanol-ethanol,IBE)发酵被认为具有更广泛的应用前景[5-6]。此外,原料成本高也是限制IBE发酵产业化生产的原因之一。实验室前期采用白酒糟作为原料生产丁醇,但酒糟水解液(distillers’ grain waste hydrolysate, DGWH)中成分复杂,己酸等抑制物会对丁醇发酵造成严重抑制。为了综合利用酒糟生产丁醇,需要研究己酸对丁醇发酵的影响,并对其去除方法进行探究[7]。
随着丁醇发酵研究的深入有越来越多的脱毒方法应用于丁醇脱毒的研究中,比如碱处理、活性炭、树脂、生物炭等[8-10],这些脱毒方法在不同的生产案例中的脱毒效果不同,因此需要结合案例的实际情况综合分析得出最优脱毒方案。目前的评价准则主要集中在脱毒方法对抑制物的脱除以及对丁醇产量的提升方面,然而仅考虑上述2方面的因素来评价脱毒方法是不足的,理想中的脱毒方法应当脱毒效果好、成本低、操作简单、污染少,因此需要结合技术、经济、环境以及社会等多方面因素综合评价。层次分析法(analytic hierarchy process, AHP)能同时基于一组不同标准进行定量和定性分析,把影响复杂问题的各个因素按支配关系构成递阶层次结构,通过对同一层次中各因素的相对重要程度进行成对比较得出权重,然后利用权重对所有备选方案进行排序,得出最优方案[11]。
本研究探索酒糟水解液中己酸对丁醇发酵的影响,利用层次分析法在技术、经济、社会、环境等多方面因素综合评价活性炭、阴离子树脂和生物炭对己酸的脱毒效果,并结合酒糟水解液中己酸的含量选择最佳的脱毒策略,以期为酒糟发酵生产丁醇提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
丁醇生产菌Clostridium beijerinckii LY-5,来源于实验室-80 ℃甘油管保藏。
1.1.2 试剂
浓香型酒糟A(DGWA),湖北省咸宁市某酒厂;浓香型酒糟B(DGWB),湖北工业大学酿酒中试基地;浓香型酒糟C(DGWC),湖北省黄冈市某酒厂。酒糟经烘干之后粉碎过筛(0.45 mm)备用。糖化酶(酶活力100 000 U/g),阿拉丁试剂有限公司;液化酶(酶活力20 000 U/mL),宁夏和氏璧生物技术有限公司;YZA207强碱性苯乙烯系阴离子交换树脂,杭州泳洲水处理科技有限公司;玉米秸秆生物炭,晟利化学科技有限公司;活性炭,国药集团化学试剂有限公司。
1.2 仪器与设备
TDZ4-WS高速离心机,上海湘仪仪器有限公司;GC7890A气相色谱仪,美国安捷伦公司;Thermo U3000高效液相色谱仪,赛默飞世尔科技公司;DK-S22电热恒温水浴锅,上海精宏实验设备有限公司;ZHJH-1214B超净工作台,上海智诚分析仪器制造公司;YXQ-LS-75SH高压蒸汽灭菌锅,上海博讯实业公司医疗设备厂。
1.3 实验方法
1.3.1 酒糟水解液制备
300 g的酒糟(DGWC)溶于1 L的纯水中在60 ℃水浴2 h,用2 mol/L的NaOH溶液调节pH至6.0,然后用50 U/g高温淀粉酶沸水浴2 h,再调节pH至4.0,用150 U/g糖化酶在60 ℃糖化2 h,8 000 r/min离心5 min得到酒糟水解液。向酒糟水解液中添加Ca(OH)2溶液调节pH至10.77,在摇床转速为180 r/min,33.5 ℃的条件下脱毒处理4.4 h,离心抽滤取上清液。随后根据实验需要分别加入不同浓度的己酸溶液,并将pH调至5.5,备用。
1.3.2 酒糟水解液脱毒
活性炭脱毒:在酒糟水解液中加入30 g/L的活性炭粉末,于30 ℃、180 r/min条件下处理3 h,离心取上清液,将pH调至5.5。
阴离子树脂脱毒:在酒糟水解液中加入30 g/L的阴离子树脂,于30 ℃、180 r/min条件下处理3 h,离心取上清液,将pH调至5.5。
生物炭脱毒:在酒糟水解液中加入30 g/L的生物炭粉末,于30 ℃、180 r/min条件下处理3 h,离心取上清液,将pH调至5.5。
1.3.3 丁醇发酵
种子液培养基(g/L):葡萄糖20、蛋白胨20、酵母膏10,115 ℃蒸汽灭菌20 min,34 ℃培养42 h。
将72 mL脱毒后的水解液装于100 mL三角瓶中,经过115 ℃灭菌20 min,将种子液按照10%(体积分数)的接种量接入到水解液,加入3 g/L的CaCO3在34 ℃培养168 h,每24 h记录重量,绘制失重曲线。
1.4 测定方法
发酵过程中还原糖的测定参照DB34/T 2264—2014《固态发酵酒醅分析方法》;菌体干重的测定:取10 mL发酵液于离心管,8 000 r/min离心5 min,用去离子水洗涤离心后于105 ℃烘干至恒重;产物的测定;异丙醇、乙醇、丁醇采用气相色谱测定,色谱柱使用DB-WAX 122-7032(30 m×0.25 mm×0.25 μm,Agilent Technologies,USA),进样口温度220 ℃,进样量0.6 μL,分流比60∶1,分流流量48 mL/min,配备氢火焰离子检测器,检测器温度220 ℃。柱箱升温过程如下:起始40 ℃维持1 min,然后以10 ℃/min升至90 ℃维持5 min,最后以20 ℃/min升至220 ℃,维持10 min。乳酸、乙酸、丁酸、己酸采用液相色谱进行测定,Thermo U3000高效液相色谱仪,Acclaim OA色谱柱(4.6 mm×250 mm,5 μm)和紫外检测器,柱温25 ℃,检测波长210 nm。流动相:(A)100 mmol/L Na2SO4溶液、(B)乙腈、(C)2.5 mmol/L甲磺酸溶液,流速:0.8 mL/min。梯度洗脱程序为0 min:100% A;6 min:100% A;10 min:100% C;13 min:100% C;20 min:80% B和20% C;25 min:80% B和20% C(均为体积分数),具体步骤参考张瑞景等[12]的研究。
1.5 己酸脱毒方法综合评价模型的建立与综合评分计算
1.5.1 己酸脱毒评价指标的确立
为评价己酸脱毒方法,根据测定的指标与相关文献,设置技术、经济、社会、环境4个一级指标[13],在技术指标中设置丁醇产量、己酸去除率、糖损失率3个二级指标。根据指标间的相互关系以及层次隶属关系,构建目标层、准则层、指标层和方案层,如表1所示。
表1 酒糟水解液中己酸脱毒评价指标
Table 1 Evaluation index of hexanoic acid detoxification in DGWH
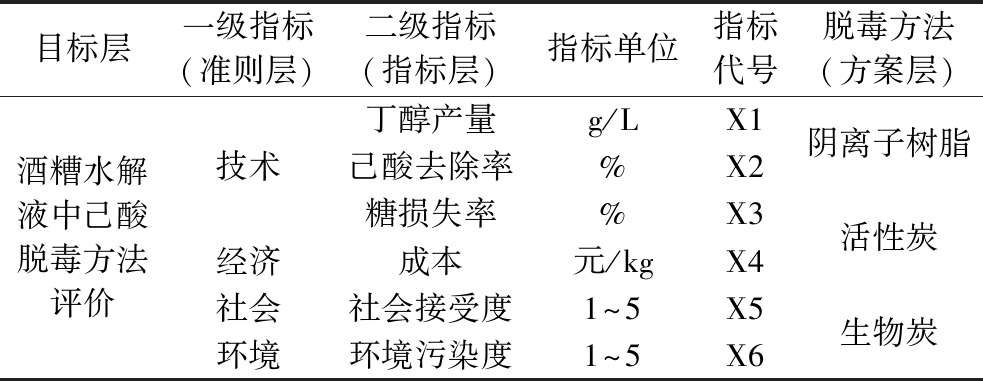
目标层一级指标(准则层)二级指标(指标层)指标单位指标代号脱毒方法(方案层)酒糟水解液中己酸脱毒方法评价技术经济社会环境丁醇产量g/LX1己酸去除率%X2糖损失率%X3成本元/kgX4社会接受度1^5X5环境污染度1^5X6阴离子树脂活性炭生物炭
1.5.2 指标原始数据无量纲化处理
由于各评价指标体系的单位和数量级不一致,因此需要对数据进行无量纲化处理,本文采用极差标准化法将数据统一映射到[0,1]区间。己酸去除率、丁醇产量和社会接受度为正指标,数值越大越好,因此需要进行正向化处理,如公式(1)所示;糖损失率、成本以及环境污染度为负指标,数值越小越好,因此需要逆向化处理,如公式(2)所示:
(1)
(2)
式中:x′、x″,处理之后的数据;x,指标中原始数据;max(x1)和min(x1)为指标系列中最大值、最小值。
1.5.3 判断矩阵的构造
为了判断不同指标对脱毒方法综合评价的重要性,需要确定各个指标的权重系数。综合专家意见和数据分析,对不同脱毒方法的脱毒效果进行评价,根据卜寿珍等[14]的标度法建立判断矩阵,如表2所示。计算矩阵的最大特征向量和各指标所对应的标准化特征向量,其标准化特征向量为各指标的权重系数。
表2 判断矩阵标度
Table 2 Scale of judgment matrix

注:aij=(2、4、6、8、1/2、1/4、1/6、1/8)重要性等级介于相邻标度之间。
序号重要性等级aij赋值1i元素与j元素同等重要12i元素比j元素稍微重要33i元素比j元素明显重要54i元素比j元素强烈重要75i元素比j元素极端重要96i元素比j元素不重要1/37i元素比j元素明显不重要1/58i元素比j元素强烈不重要1/79i元素比j元素极端不重要1/9
1.5.4 检验判断矩阵的一致性
一致性指标(consistency index,CI)和一致性比率(consistency ratio,CR)的计算如公式(3)和公式(4)所示:
(3)
(4)
式中:n,矩阵的阶数,RI,随机一致性指标均值,其值如表3所示。
表3 RI值
Table 3 Evaluation of RI
阶数123456789RI000.520.891.121.261.361.411.46
当CR<0.1时,判断矩阵通过一致性检验,否则需要修改矩阵。
1.5.5 综合评分的计算
将极差标准化之后各指标依据判断矩阵得出的相应权重加权做内积,得到最终的综合评分。
1.6 数据统计分析
所有实验均重复3次,实验结果表示为平均值±标准偏差。实验数据采用Origin 2021绘图,SPSS 26统计软件进行单因素ANOVA分析,P<0.05表示具有显著性差异。
2 结果与分析
2.1 浓香型白酒糟水解液中4种酸的含量
白酒生产过程中会产生各种有机酸,并在蒸馏过程中进入白酒中,是白酒重要的呈香呈味物质。但丁酸、己酸等有机酸的沸点较高,仍有一部分会残留在酒糟中,造成酒糟中的酸含量高。此外,酒糟的存储过程中也会在产酸微生物的作用下持续产生有机酸。不同来源的酒糟中有机酸种类和含量会存在显著差异。表4分析了不同来源的浓香型白酒糟中乳酸、乙酸、丁酸和己酸的含量。可以看出,乳酸的含量最高,达到了4.30~6.15 g/L,乙酸和丁酸的含量较低,分别为0.39~1.02 g/L和0.07~0.25 g/L,但这3种酸均低于所报道的抑制丁醇发酵的临界浓度[15-17]。己酸的含量差异较大,最高可以达到0.47 g/L,然而目前尚没有关于己酸抑制丁醇发酵的研究报道。研究表明,碳链越长的脂肪酸更易通过细胞膜,破坏细胞膜的完整性进而导致细胞活力下降,因此相比于短链酸对微生物细胞的损伤更大[18]。此外,实验室前期研究发现,酒糟水解液经过Ca(OH)2处理的丁醇产量最高,但仍低于合成培养基发酵水平,且仍有部分还原糖没有被完全利用。同时,Ca(OH)2对己酸的去除效果不明显(表4)。因此,研究己酸对丁醇发酵的影响并根据水解液中己酸的含量选择合适的脱毒方法,对酒糟综合利用生产丁醇具有重要意义。
表4 浓香型白酒糟水解液中4种酸的含量
Table 4 Contents of four acids in DGWH from strong-flavor Baijiu
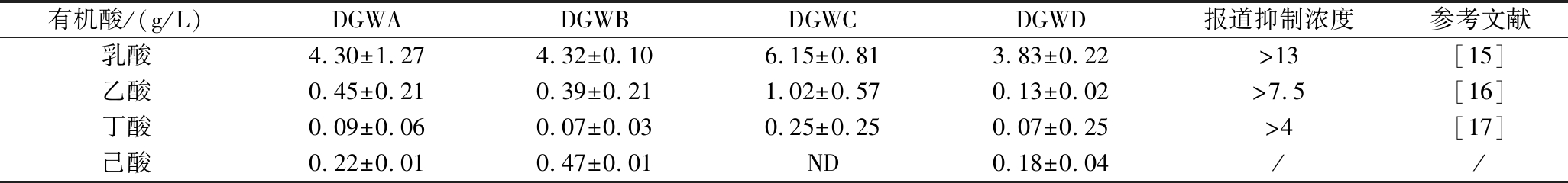
注:DGWD,浓香型酒糟水解液,经过Ca(OH)2处理的DGWA;ND,未检测出;/,未见相关文献报道。
有机酸/(g/L)DGWADGWBDGWCDGWD报道抑制浓度参考文献乳酸4.30±1.274.32±0.106.15±0.813.83±0.22>13[15]乙酸0.45±0.210.39±0.211.02±0.570.13±0.02>7.5[16]丁酸0.09±0.060.07±0.030.25±0.250.07±0.25>4[17]己酸0.22±0.010.47±0.01ND0.18±0.04//
2.2 不同浓度的己酸对酒糟水解液生产丁醇的影响
向经过Ca(OH)2处理之后的酒糟水解液(DGWC)中添加己酸至所需的浓度,研究不同浓度的己酸对酒糟水解液生产丁醇的影响。如图1所示,随着酒糟水解液中己酸浓度的升高,其对丁醇发酵的抑制作用显著增强,丁醇发酵速率下降,菌体量减少,糖利用率降低,丁醇和总溶剂产量显著下降。当己酸质量浓度为0.2 g/L时,菌体量与对照组相比下降了10.1%,糖利用率降低13.1%,丁醇和总溶剂产量分别减少了14.2%和13.9%。当己酸质量浓度为1.1 g/L时,发酵受到严重抑制,丁醇产量下降了89.5%。MADDOX等[19]的研究表明,有机酸会通过细胞膜进入到细胞内发生解离,使得细胞内的pH降低进而影响细胞的新陈代谢与丁醇的生产。相比于乙酸和丁酸,己酸的碳链更长,对微生物细胞的抑制作用更加明显,因此少量的己酸就会对丁醇发酵造成严重抑制。

a-丁醇产量;b-菌体干重、IBE、残糖;c-失重曲线
图1 不同质量浓度的己酸对酒糟水解液生产丁醇的影响
Fig.1 Effect of different concentrations of hexanoic acid on the production of butanol from DGWH
注:不同小写字母表示组间具有显著性差异,P<0.05。
2.3 不同脱毒方法对酒糟水解液中己酸的脱除效果
在酒糟水解液中添加己酸至所需浓度,再用阴离子树脂、活性炭和生物炭进行脱毒处理,测定脱毒后己酸的质量浓度和还原糖的损失率,如表5所示。
表5 不同脱毒方法对酒糟水解液中己酸的脱除效果
Table 5 Removal effects of different detoxification methods on hexanoic acid in DGWH
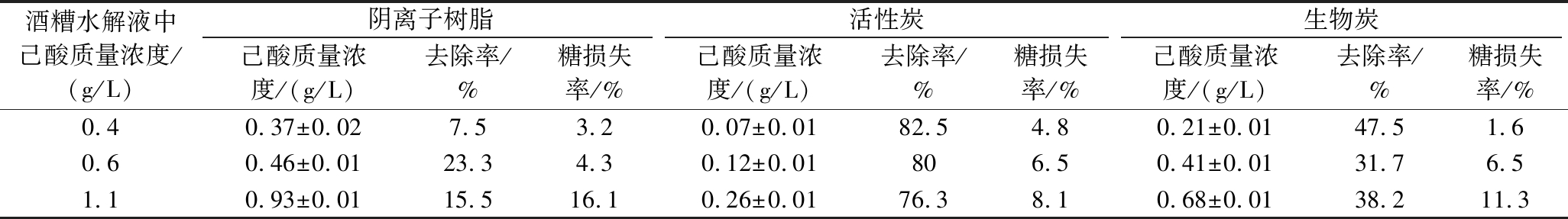
酒糟水解液中己酸质量浓度/(g/L)阴离子树脂活性炭生物炭己酸质量浓度/(g/L)去除率/%糖损失率/%己酸质量浓度/(g/L)去除率/%糖损失率/%己酸质量浓度/(g/L)去除率/%糖损失率/%0.40.37±0.027.53.20.07±0.0182.54.80.21±0.0147.51.60.60.46±0.0123.34.30.12±0.01806.50.41±0.0131.76.51.10.93±0.0115.516.10.26±0.0176.38.10.68±0.0138.211.3
将己酸从开始抑制的质量浓度0.2~0.4 g/L设为低浓度组,0.4~0.6 g/L为中浓度组,以及抑制作用较为明显的质量浓度0.6~1.1 g/L作为高浓度组。从表5中的数据可以发现,活性炭对己酸的去除效果最好,能将0.4 g/L的己酸降至0.07 g/L,去除率达到82.5%,即使己酸的质量浓度高达1.1 g/L,也能达到76.3%的去除率。生物炭的去除效果次之,去除率在31.7%~47.5%,同时对低浓度己酸脱除的同时,还原糖的损失仅为1.6%。MONLAU等[20]利用生物炭去除花旗松水解液中35%的乙酸和59%的甲酸,并且几乎没有造成糖损失,这与本实验结果基本一致。阴离子树脂对己酸的脱除效果为7.5%~23.3%,且随着己酸浓度的升高,脱毒处理造成的水解液糖损失率增加,最高达到了16.1%。FERNANDES等[21]也得到了类似的结果,他们在使用阴离子树脂脱除乙酸时,糖损失率高达28%。
2.4 不同脱毒方法处理之后酒糟水解液发酵
将含有不同质量浓度己酸的酒糟水解液分别经过阴离子树脂、活性炭和生物炭处理之后进行丁醇发酵。如图2所示,经过不同方法脱毒后的酒糟水解液丁醇产量均有提升,其中含有0.4 g/L己酸的酒糟水解液经过阴离子树脂和生物炭处理后丁醇产量与不含己酸的酒糟水解液接近,分别达到了9.7和9.2 g/L,阴离子树脂虽然去除己酸的效果不明显,但它对物质具有广泛地吸附性,可能去除了其他的一些抑制物进而提高丁醇的产量。GOTTUMUKKALA等[22]在研究树脂对稻草水解液脱毒生产丁醇时发现,树脂XAD7去除甲酸和乙酸的能力均优于树脂Seralite SRA-400,然而经树脂Seralite SRA-400脱毒后的稻草水解液丁醇产量更高,这可能由于其对乙酰丙酸、糠醛等其他抑制物有更好的脱毒效果。生物炭具有高孔隙率、丰富的官能团、pH缓冲能力和能提供营养物质等特点[23],同时比阴离子树脂对己酸有更好的脱除效果,以及比活性炭损失的糖更少,可能导致其在低浓度己酸的情况下具有良好的脱毒效果。在这3种方法中活性炭去除己酸的效果最好,但它同时也损失了更多的糖,这可能导致其丁醇产量相较于另2种脱毒方法更低。当己酸含量为0.6和1.1 g/L时,活性炭处理的酒糟水解液丁醇产量更高,相较于阴离子树脂与生物炭处理分别提升了21.2%、25.9%和17.0%、49.8%,这得益于其对己酸有更好的去除效果。

a-对丁醇产量的影响;b-对异丙醇的影响;c-对乙醇的影响
图2 不同脱毒方法处理之后酒糟水解液发酵
Fig.2 Butanol fermentation by DGWH with different detoxification methods
2.5 脱毒方法评价
使用层次分析法对脱毒方法进行评价,构造判断矩阵是关键,为得到科学矩阵,通过多次征询10位相关领域的专家意见后得到表6和表7的判断矩阵。
表6 准则层判断矩阵
Table 6 Criterion layer judgment matrix
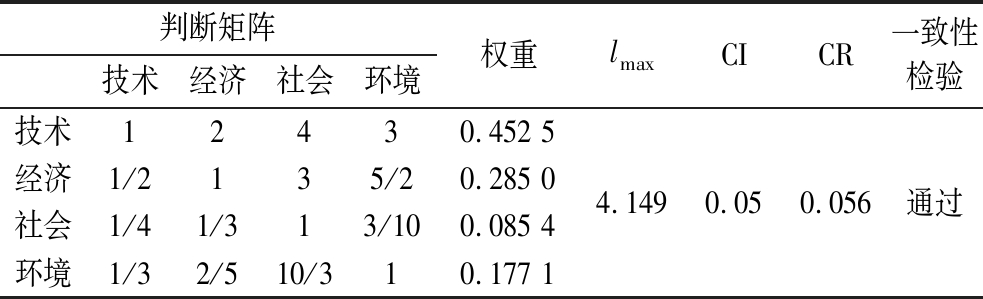
判断矩阵技术经济社会环境权重lmaxCICR一致性检验技术12430.452 5经济1/2135/20.285 0社会1/41/313/100.085 4环境1/32/510/310.177 14.1490.050.056通过
表7 方案层(技术)判断矩阵
Table 7 Scenario layer(technology) judgment matrix
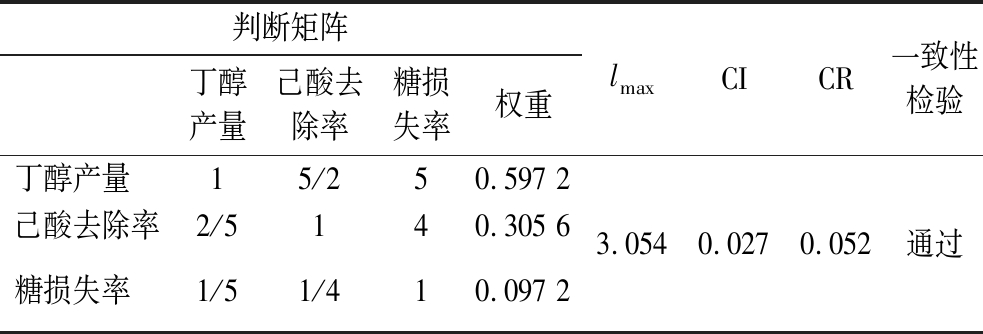
判断矩阵丁醇产量己酸去除率糖损失率权重lmaxCICR一致性检验丁醇产量15/250.597 2己酸去除率2/5140.305 6糖损失率1/51/410.097 23.0540.0270.052通过
所有CR值<0.1,判断矩阵通过一致性检验。水解液脱毒的目的是提高丁醇的产量,己酸去除率则是评估脱毒方法对己酸脱毒效果的重要指标,而糖损失率则是衡量脱毒所带来的负面影响。经济方面由于本文所采用的脱毒方法处理条件以及添加量基本一致,因此影响因素为脱毒剂自身的价格。社会层面主要为社会接受度,环境层面则主要为脱毒过程中对环境所造成的污染[13]。
基于本文的研究数据和市场价格,形成如表8所示的评价体系中的初步数据,对原始数据进行无量纲化处理,得到评价指标值,再结合判断矩阵所得到的权重,经过线性加权之后,得到评价得分。当酒糟水解液中己酸浓度处于低浓度时,生物炭的评价得分最高,为0.57。此外,生物炭可由酒糟经过高温裂解制备而成[24],将进一步减低生物炭的成本,提升酒糟综合利用的效益。当酒糟水解液中己酸浓度处于中、高浓度时,活性炭的评价得分最高,达到0.54和0.53,这得益于其对己酸良好的脱除效果。
表8 评价指标体系初步数据及得分
Table 8 Preliminary data and scores of the evaluation index system
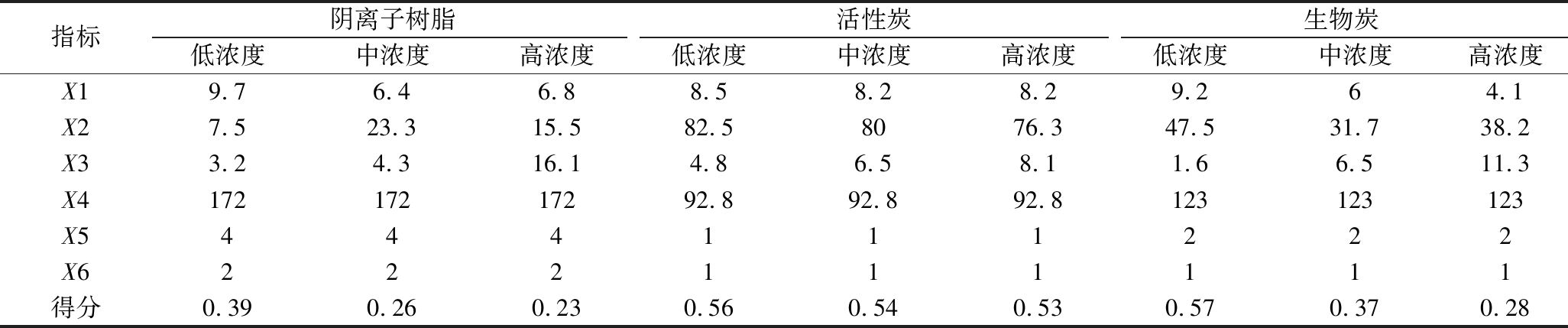
指标阴离子树脂活性炭生物炭低浓度中浓度高浓度低浓度中浓度高浓度低浓度中浓度高浓度X19.76.46.88.58.28.29.264.1X27.523.315.582.58076.347.531.738.2X33.24.316.14.86.58.11.66.511.3X417217217292.892.892.8123123123X5444111222X6222111111得分0.390.260.230.560.540.530.570.370.28
3 结论
浓香型白酒糟水解液中超过0.2 g/L的己酸即会降低丁醇发酵速率,影响菌体生长,降低糖利用率和丁醇产量。活性炭、阴离子交换树脂与生物炭处理等脱毒方法对己酸均具有一定的脱除效果,其中活性炭的己酸脱除效果最好,达到76.3%~82.5%。结合技术、经济、社会、环境等因素考虑,当己酸的质量浓度<0.4 g/L时,生物炭是最佳的己酸脱除方法。而己酸质量浓度>0.4 g/L时,选择活性炭处理更优。本研究为综合利用白酒糟工业化生产丁醇提供了参考。
[1] 张雯, 刘康, 罗霏霏, 等.响应面法优化木醋杆菌发酵酿酒丢糟水解液产细菌纤维素培养基及其产物性能[J].食品科学, 2015, 36(13):160-166.
ZHANG W, LIU K, LUO F F, et al.Optimization of culture medium based on vinasse hydrolysate for Acetobacter xylinum by response surface methodology for enhanced production of bacterial cellulose and properties of the product[J].Food Science, 2015, 36(13):160-166.
[2] 张丽华, 王小媛, 李昌文, 等.酒糟再利用的研究进展[J].食品与发酵工业, 2017, 43(11):250-256.
ZHANG L H, WANG X Y, LI C W, et al.Recent advances in comprehensive utilization of grain stillage[J].Food and Fermentation Industries, 2017, 43(11):250-256.
[3] MIRZOYAN S, TOLEUGAZYKYZY A, BEKBAYEV K, et al.Enhanced hydrogen gas production from mixture of beer spent grains (BSG) and distiller’s grains (DG) with glycerol by Escherichia coli[J].International Journal of Hydrogen Energy, 2020, 45(35):17233-17240.
[4] MAYSUAN L, ANDREW H, JIM P, et al.Techno-economic analysis for direct processing of wet solid residues originated from grain and inedible plant wastes[J].Bioenergy Research, 2022, 16(2):940-953.
[5] DOS SANTOS VIEIRA C F, MAUGERI FILHO F, MACIEL FILHO R, et al.Acetone-free biobutanol production:Past and recent advances in the Isopropanol-Butanol-Ethanol (IBE) fermentation[J].Bioresource Technology, 2019, 287:121425.
[6] ROCH N E, CEBREIROS F, FERRARI M D, et al.Isopropanol-butanol production from sugarcane and sugarcane-sweet sorghum juices by Clostridium beijerinckii DSM 6423[J].Biomass and Bioenergy, 2019, 128:105331.
N E, CEBREIROS F, FERRARI M D, et al.Isopropanol-butanol production from sugarcane and sugarcane-sweet sorghum juices by Clostridium beijerinckii DSM 6423[J].Biomass and Bioenergy, 2019, 128:105331.
[7] WANG J B, KONG B, FENG J W, et al.A novel strategy for comprehensive utilization of distillers’ grain waste towards energy and resource recovery[J].Process Biochemistry, 2022, 113:141-149.
[8] SUN X, ATIYEH H K, ADESANYA Y, et al.Feasibility of using biochar as buffer and mineral nutrients replacement for acetone-butanol-ethanol production from non-detoxified switchgrass hydrolysate[J].Bioresource Technology, 2020, 298:122569.
[9] LI J, SHI S, TU M B, et al.Detoxification of organosolv-pretreated pine prehydrolysates with anion resin and cysteine for butanol fermentation[J].Applied Biochemistry and Biotechnology, 2018, 186(3):662-680.
[10] ZHANG Y, XIA C L, LU M M, et al.Effect of overliming and activated carbon detoxification on inhibitors removal and butanol fermentation of poplar prehydrolysates[J].Biotechnology for Biofuels, 2018, 11(1):1-14.
[11] 朱建军. 层次分析法的若干问题研究及应用[D].沈阳:东北大学, 2005.
ZHU J J.Research and application of analytic hierarchy process[D].Shenyang:Northeastern University, 2005.
[12] 张瑞景, 王浩, 蔡凤娇, 等.高效液相色谱法检测白酒中四种有机酸的方法研究[J].中国酿造, 2022, 41(3):238-242.
ZHANG R J, WANG H, CAI F J, et al.Determination of four organic acids in Baijiu by HPLC[J].China Brewing, 2022, 41(3):238-242.
[13] LLANO T, RUEDA C, DOSAL E, et al.Multi-criteria analysis of detoxification alternatives:Techno-economic and socio-environmental assessment[J].Biomass and Bioenergy, 2021, 154:106274.
[14] 卜寿珍, 肖军, 沈来宏, 等.基于层次分析法的生物质直燃发电生命周期评价[J].太阳能学报, 2015, 36(4):994-1003.
BU S Z, XIAO J, SHEN L H, et al.Life cycle assessment of biomass combustion power generation based on analytic hierarchy process[J].Acta Energiae Solaris Sinica, 2015, 36(4):994-1003.
[15] DOS SANTOS VIEIRA C F, CODOGNO M C, FILHO F M, et al.Sugarcane bagasse hydrolysates as feedstock to produce the Isopropanol-Butanol-Ethanol fuel mixture:Effect of lactic acid derived from microbial contamination on Clostridium beijerinckii DSM 6423[J].Bioresource Technology, 2020, 319:124140.
[16] ZHOU Q, LIU Y, YUAN W Q.Kinetic modeling of lactic acid and acetic acid effects on butanol fermentation by Clostridium saccharoperbutylacetonicum[J].Fuel, 2018, 226:181-189.
[17] AL-SHORGANI N K N, KALIL M S, YUSOFF W M W, et al.Impact of pH and butyric acid on butanol production during batch fermentation using a new local isolate of Clostridium acetobutylicum YM1[J].Saudi Journal of Biological Sciences, 2018, 25(2):339-348.
[18] LIU P, CHERNYSHOV A, NAJDI T, et al.Membrane stress caused by octanoic acid in Saccharomyces cerevisiae[J].Applied Microbiology and Biotechnology, 2013, 97(7):3239-3251.
[19] MADDOX I S, STEINER E, HIRSCH S, et al.The cause of “Acid crash” and “Acidogenic fermentations” during the batch Acetone-Butanol-Ethanol (ABE) fermentation process[J].Journal of Molecular Microbiology and Biotechnology, 2000, 2(1):95-100.
[20] MONLAU F, SAMBUSITI C, ANTONIOU N, et al.Pyrochars from bioenergy residue as novel bio-adsorbents for lignocellulosic hydrolysate detoxification[J].Bioresource Technology, 2015, 187:379-386.
[21] FERNANDES D L A, SILVA C M, XAVIER A M R B, et al.Fractionation of sulphite spent liquor for biochemical processing using ion exchange resins[J].Journal of Biotechnology, 2012, 162(4):415-421.
[22] GOTTUMUKKALA L D, PARAMESWARAN B, VALAPPIL S K, et al.Biobutanol production from rice straw by a non acetone producing Clostridium sporogenes BE01[J].Bioresource Technology, 2013, 145:182-187.
[23] SUN X, ATIYEH H K, LI M X, et al.Biochar facilitated bioprocessing and biorefinery for productions of biofuel and chemicals:A review[J].Bioresource Technology, 2020, 295:122252.
[24] 李哲. 酒糟有机肥生产、肥效以及酒糟生物质炭的效应研究[D].重庆:西南大学, 2021.
LI Z.Production and fertilizer efficiency of organic fertilizer made from vinasse and effect of biochar made from vinasse[D].Chongqing:Southwest University, 2021.