中国白酒,作为世界六大蒸馏酒之一,以其独一无二的风味著称于世[1]。浓香型白酒作为白酒四大香型之一,具有窖香浓郁、绵柔醇厚、香味协调等特点[2]。窖池作为白酒酿造的容器,窖泥中含有己酸菌、甲烷菌等多种功能微生物,通过这些微生物的代谢活动,赋予了浓香型白酒独特的风味;这使窖泥成为浓香型白酒生产中最关键的部分之一,因此优质人工窖泥的培养成为生产优质白酒的前提[3-4]。目前人工窖泥培养研究主要包括窖泥配方优化、外源制剂添加、微生物作用机制和预防窖泥老化和复壮等方面[5]。但人工窖泥培养过程还存在水分易流失、营养物质利用率低、功能菌富集较慢等问题[6]。因此,加快培养的人工窖泥向优质老窖泥转化,提高人工窖泥培养质量具有重要的理论和现实意义。
生物炭常作为土壤改良剂,其对土壤理化性质和微生物群落结构具有较大的影响。而人工窖泥一般选用黄泥作为基质,与土壤有一定的相似性。生物炭是一种在缺氧状态下高温分解得到的比表面积大、孔隙发达且富含碳素的生物质炭,被广泛运用于环境等领域[7-8]。人工窖泥培养过程添加生物炭预期能够提高碳氮比,改善窖泥含水量、pH,进而调节窖泥微生物群落结构。在人工窖泥培养过程中,生物炭的孔隙能定植微生物细胞并且能保住水分[9-10],高碱度可以延缓窖泥pH过度降低,丰富的表面含氧官能团(oxygenated functional groups,OFGs)能促进电子迁移,加快微生物生长代谢活性,增强生物量及酶活性[11];另外生物炭富含大量羧、醇羟基等,能进一步提高窖泥保水性[12],加快人工窖泥向优质老窖泥转化。生物炭原料在结构、内含物等方面存在差别,不同原料高温裂解后在结晶度、交联和分支等结构特征上差异显著[13]。竹子等生物炭木质素含量高,炭化后大孔径结构多;而秸秆类生物炭由于纤维素含量高,炭化后结构以微孔为主,相比竹子生物炭,其灰分含量、矿物质种类和pH略高。另在碳含量上,秸秆生物炭一般为40%~80%,其他生物炭一般为60%~85%[14]。所以不同种类的生物炭在理化性质和结构上有明显差异,故有必要针对不同来源的生物炭对人工窖泥培养过程影响进行研究。
本研究选用宜宾本地某酒厂窖泥培养原料,在实验室条件下培养人工窖泥,分析添加丢糟生物炭(马弗炉烧制ZM、热解气化烧制ZR)、玉米秸秆生物炭(YM)、稻壳生物炭(DK)、水稻秸秆生物炭(SD)、竹生物炭(ZT)6种不同生物炭和不添加生物炭(B)的人工窖泥,在培养开始和结束(90 d)时微生物群落结构、内部菌属相关性、理化与微生物相关性的差异。对微生物群落结构与理化性质之间的相关性进行分析,解读生物炭添加对人工窖泥培养过程微生物种群结构的影响,为生物炭加快人工窖泥向优质老窖泥转化提供理论依据。
1 材料与方法
1.1 材料与试剂
培养人工窖泥材料均选取宜宾本地某酒厂;生物炭材料丢糟生物炭(马弗炉烧制、热解气化烧制)、玉米秸秆生物炭、稻壳生物炭、水稻秸秆生物炭、竹子生物炭(具体参数见表1);其他试剂均为国产分析纯。
表1 生物炭来源及主要特征参数
Table 1 Source and main characteristic parameters of biochar
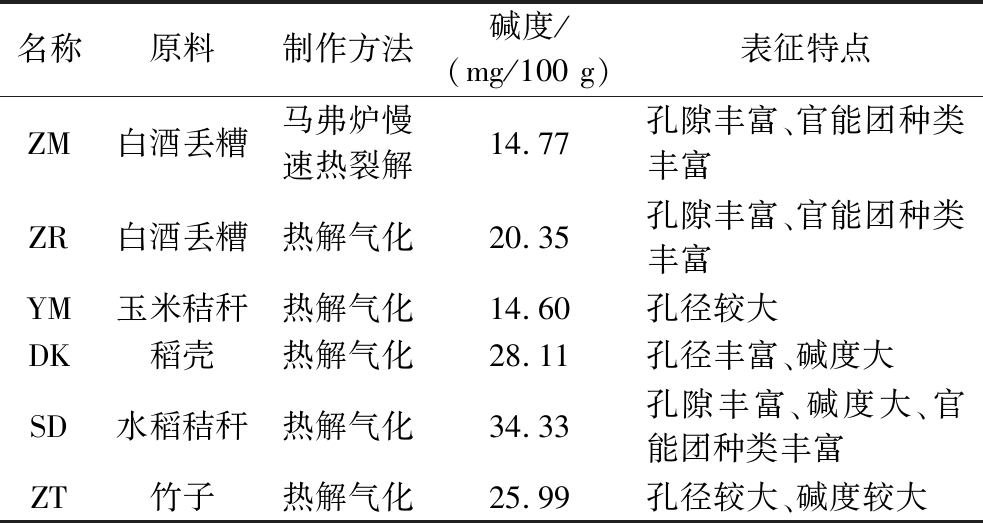
名称原料制作方法碱度/(mg/100 g)表征特点ZM白酒丢糟马弗炉慢速热裂解14.77孔隙丰富、官能团种类丰富ZR白酒丢糟热解气化20.35孔隙丰富、官能团种类丰富YM玉米秸秆热解气化14.60孔径较大DK稻壳热解气化28.11孔径丰富、碱度大SD水稻秸秆热解气化34.33孔隙丰富、碱度大、官能团种类丰富ZT竹子热解气化25.99孔径较大、碱度较大
1.2 仪器与设备
PHB-4型pH计,上海仪电科学仪器股份有限公司;7890A气相色谱仪,美国Agilent公司;LRH-250恒温培养箱,上海一恒科学仪器有限公司;TG-10台式离心机,四川蜀科仪器有限公司;101型鼓风干燥箱,北京中兴伟业仪器有限公司;T6新世纪分光光度计,北京普析通用仪器有限公司;RR224ZH/E电子分析天平,奥豪斯仪器有限公司。
1.3 实验方法
1.3.1 生物炭添加量及窖泥样本采集
各种生物炭添加量均为15%(质量分数),采用五点取样法对窖泥进行采样,原始窖泥样本标记为B_S;培养90 d后,未添加生物炭空白组窖泥样本标记为B_E;添加丢糟生物炭(马弗炉烧制和热解气化烧制)、玉米秸秆生物炭、稻壳生物炭、水稻秸秆生物炭、竹子生物炭的窖泥样本分别标记为ZM_E、ZR_E、YM_E、DK_E、SD_E、ZT_E。
1.3.2 理化性质分析
样品预处理:将1 g窖泥加入10 mL水中,充分摇匀,8 000 r/min离心10 min,将上清液通过20 μm滤膜转移至离心管中储存在冰箱中备用,即为样品液。
采用烘干干燥法测定窖泥含水量;使用pH计测定窖泥pH值[15];采用纳氏试剂分光光度法(HJ 535—2009)测定窖泥铵态氮含量;采用修正的Folin-Lowry法测定窖泥腐殖质含量[16];采用比色法测定窖泥有机酸含量[17]。采用固相微萃取技术结合气相色谱-质谱联用仪(solid-phase microextraction combined with gas chromatography-mass spectrometry,SPME-GC-MS)检测窖泥己酸含量。取1 g窖泥样品于25 mL顶空瓶中,加入5 mL超纯水2 g NaCl,再加入50 μL乙酸正丁酯(色谱纯)作为内标,混匀后超声振荡30 min。用萃取针在50 ℃下萃取30 min。GC条件:不分流,进样口温度230 ℃;升温程序:40 ℃保持5 min,以4 ℃/min升温至100 ℃不保持,以6 ℃/min升温至230 ℃保持10 min;MS条件:传输线温度230 ℃,电离方式为电子电离源,电子能量70 eV,离子源温度230 ℃。
1.3.3 宏基因组提取和微生物群落结构组成分析
将窖泥样品取少许于取样管中,委托上海美吉生物科技有限公司完成DNA抽提和测序。具体操作如下,抽提DNA样品,利用1%(质量分数)琼脂糖凝胶电泳检测抽提的基因组DNA,并对DNA抽提产物进行PCR扩增和纯化。采用荧光定量对PCR产物进行定量分析和均一化,建立PE文库并Illumina MiSeq双端测序,得到原始序列。其中16S rRNA扩增子引物对为515 FmodF:5′-GTGYCAGCMGCCGCGGTAA-3′,和806RmodR:5′-GGACTACHVGGGTWTCTAAT-3′,扩增区为16S rRNA的V4区[18-19]。
采用软件对测序原始序列进行质控,包括序列拼接,去除含有N的序列、引物、接头、质量值低于20的碱基、长度低于200 bp的序列及嵌合体序列得到有效序列。使用软件对有效序列进行分类,通过Illumina MiSeq平台,ASV分析流程对数据处理分析,并在物种分类水平统计每个样本的微生物群落组成。利用ASV分析结果,计算Shannon、Chao1等α多样性指数与冗余分析(redundancy analysis,RDA)等β多样性分析[15]。并完成后续的微生物群落分析。
2 结果与分析
2.1 理化性质分析
对培养90 d后人工窖泥理化参数作显著性分析(P<0.05),结果如表2所示。生物炭添加显著影响窖泥pH、含水量、腐殖质等。添加SD、YM,窖泥的pH显著提高(相比空白组高0.40和0.39),这主要是由于生物炭有较高的碱度,延缓了pH的降低。添加ZM、SD、DK窖泥含水量显著高于空白组窖泥,含水量分别提高了 4.02%、2.13%、0.68%,主要是因生物炭表面有大且丰富的孔径和醇羟基等结构锁住窖泥部分水分,提高窖泥的保水性。添加生物炭窖泥腐殖质等营养物质利用率显著提高,是由于生物炭富含OFGs,促进种间电子传递,微生物代谢加快所致。
表2 人工窖泥样品理化参数
Table 2 Physicochemical parameters of artificial pit mud samples
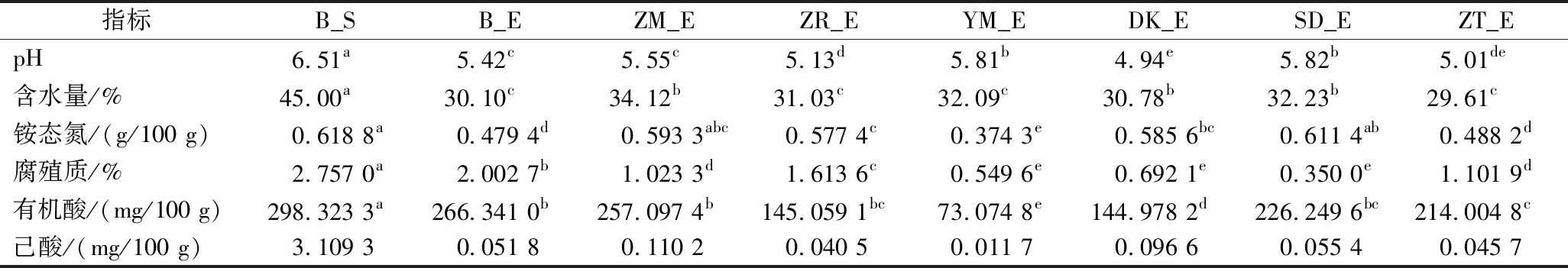
注:同行不同小写字母表示差异显著(P<0.05)。
指标B_SB_EZM_EZR_EYM_EDK_ESD_EZT_EpH6.51a 5.42c 5.55c 5.13d 5.81b 4.94e 5.82b 5.01de 含水量/%45.00a30.10c34.12b31.03c32.09c30.78b32.23b29.61c铵态氮/(g/100 g)0.618 8a0.479 4d0.593 3abc0.577 4c0.374 3e0.585 6bc0.611 4ab0.488 2d腐殖质/%2.757 0a2.002 7b1.023 3d1.613 6c0.549 6e0.692 1e0.350 0e1.101 9d有机酸/(mg/100 g)298.323 3a266.341 0b257.097 4b145.059 1bc73.074 8e144.978 2d226.249 6bc214.004 8c己酸/(mg/100 g)3.109 30.051 80.110 20.040 50.011 70.096 60.055 40.045 7
2.2 α多样性分析
如表3所示,培养90 d后的窖泥样本较原始样本丰富度指数(Chao1)降低。相较新窖泥,优质老窖泥Chao1指数会有一定程度的下降,表明人工窖泥在向老窖泥转化[20-21]。除YM和DK组外,其他生物炭添加组的物种丰富度均高于空白窖泥样本,添加SD窖泥Chao1指数相比空白组提高幅度达9.15%。除ZM组外,其余组窖泥多样性均下降。添加ZM、SD、ZR、ZT窖泥多样性Shannon指数比空白组高18.52%、12.15%、8.15%和4.81%,其中ZM组窖泥多样性最高。各组窖泥样品多样性指数随着窖龄增加总体呈上升趋势[22],且趋近于优质窖泥的多样性指数(Shannon 5.50~6.45)[15]。表明添加生物炭,能够使适应环境的微生物种群得到更好的富集并成为稳定的优势种群[23]。这可能是由于生物炭拥有丰富的多孔结构和OFGs,提高了人工窖泥丰富度和多样性的同时,加快微生物的富集。
表3 人工窖泥微生物群落α-多样性
Table 3 α-Diversity of microbial communities in artificial pit mud samples

指标B_SB_EZM_EZR_EYM_EDK_ESD_EZT_Eace783.206 7460.039 2462.783 7464.063 8394.546 1235501.099 5469.414 0Chao1782.5459.666 7462.666 7463.434 8393.833 3235501468.5Shannon4.805 5644.265 9115.095 8434.613 5974.111 2884.068 3054.784 334.470 959Simpson0.055 1860.047 8260.012 2330.024 3220.051 6950.030 2910.018 8540.036 322coverage0.999 8510.999 8760.999 9010.999 8760.999 85110.999 7020.999 851sobs782459462463393235498468
2.3 β多样性分析
如图1-a所示,所有窖泥在属水平上共有55种。其中主要是Caproiciproducens(19.87%)、Clostridium_sensu_stricto_12(16.26%)为己酸菌和梭状芽孢杆菌(图1-b)。说明这共有属如Caproiciproducens和Clostridium_sensu_stricto_12是窖泥中重要的功能微生物,共同主导窖泥培养的正常进行。

a-韦恩图;b-共有微生物饼图
图1 各窖泥样品属水平微生物韦恩图和共有微生物饼图
Fig.1 Venn plot of microorganisms and shared microbial pie chart in each pit mud samples on genus level
如图2所示,添加生物炭后人工窖泥优势功能微生物属得到富集,重要的功能优势古生菌Methanosarcina[22,24]也得到富集。对比空白组窖泥,除YM组外,其他添加生物炭组窖泥Caproiciproducens和Clostridium_sensu_stricto_12等优势功能菌属相对丰度都有明显增加。对比不同生物炭,添加DK窖泥组的Caproiciproducens菌属、DK、ZM、ZR窖泥Clostridium_sensu_stricto_12菌属均高于空白和原始组窖泥样本。同时Lactobacillus菌属相对含量较空白组都有降低,添加ZM窖泥Lactobacillus菌属相对丰度更少,这是由于己酸菌、梭菌产生己酸等抑制了部分Lactobacillus生长[25]。说明添加ZM组窖泥微生物富含较为丰富的Caproiciproducens外,有利于Clostridium_sensu_stricto_12和Methanosarcina等优势菌生长,同时抑制Lactobacillus生长效果更明显,能加快人工窖泥向优质老窖泥转化。这可能是生物炭拥有丰富的OFGs,促进了种间电子传递,加快了微生物生长代谢。
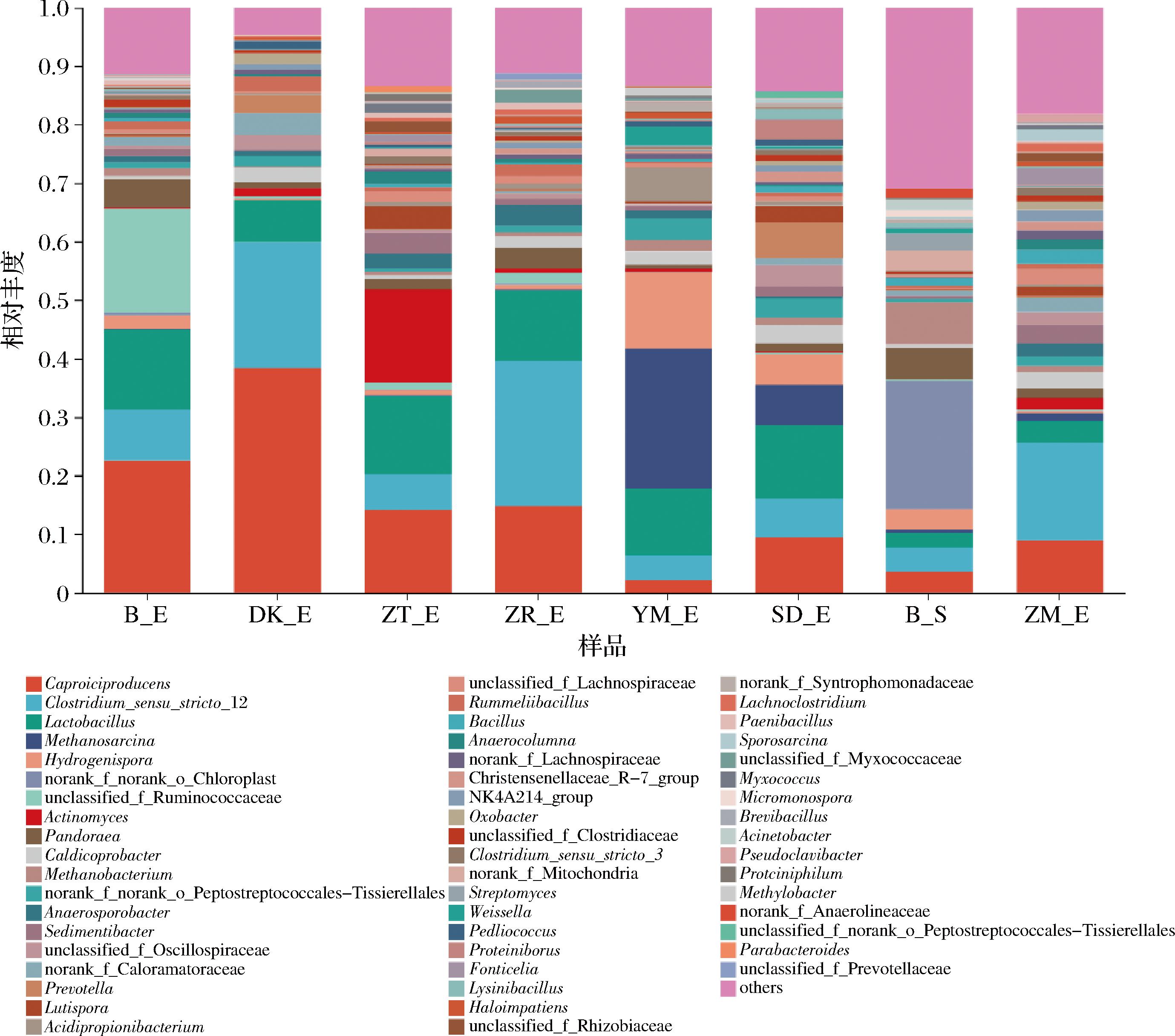
图2 各窖泥样品中相对丰度前50属水平微生物种群柱状图
Fig.2 Bar chart of microbial populations with relative abundance of the top 50 in each pit mud samples on genus level
通过热图进一步分析窖泥微生物属种,结果如图3所示。所有微生物属分别隶属于8个门,主要分布在Firmicutes。其中Caproiciproducens、Clostridium_sensu_stricto_12、Lactobacillus为窖泥中的优势菌属,与已报道四川酒企的窖泥中优势菌属类有高度的一致性[15]。
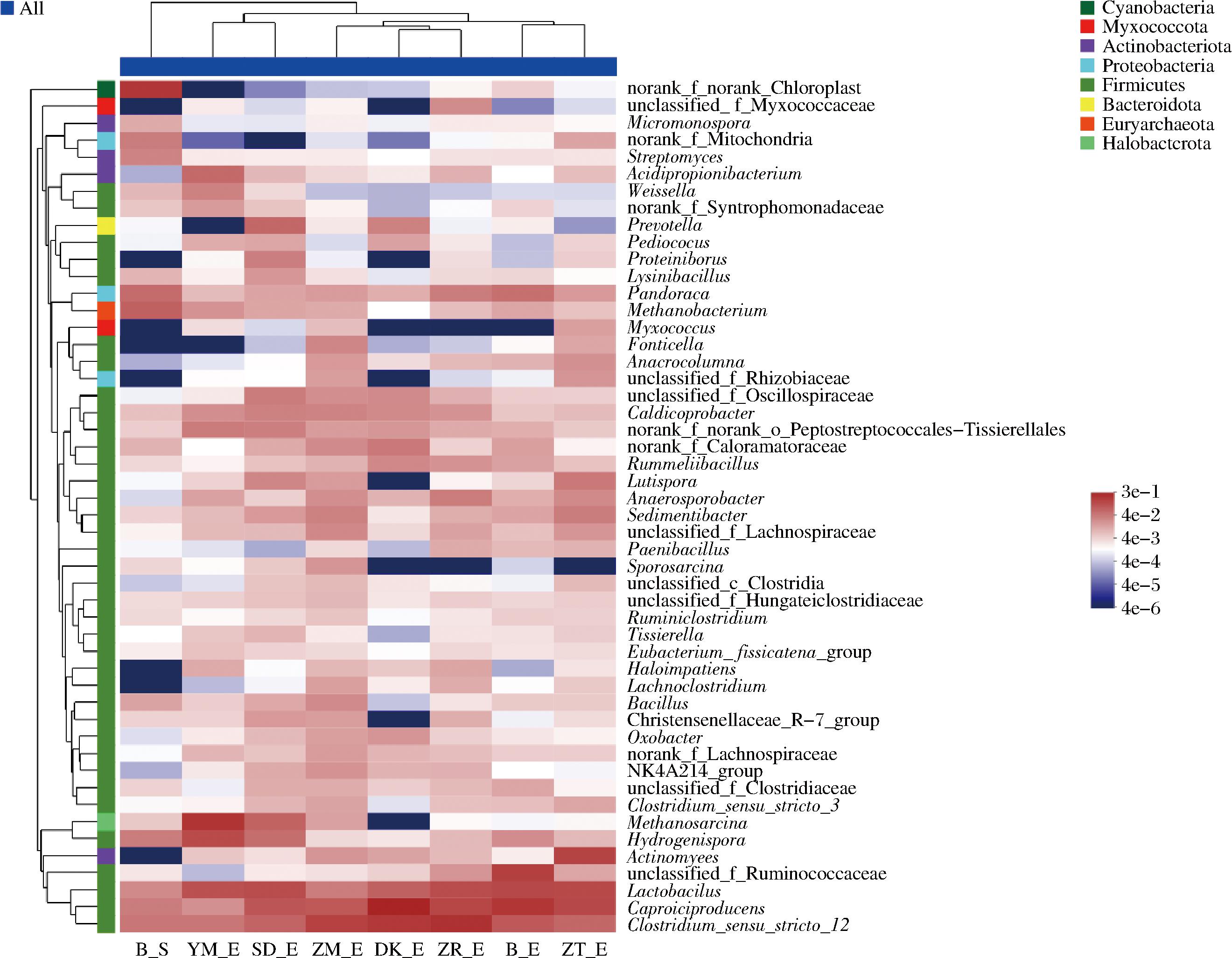
图3 各样品窖泥相对丰度前50属水平微生物种群热图
Fig.3 Heat map of microbial populations with relative abundance of the top 50 in each pit mud samples on genus level
如图3所示,聚类分析结果表明,原始窖泥样本为单独一大簇(Ⅰ),培养后的窖泥为另一大簇(Ⅱ)。培养90 d后YM、SD分为一个亚簇,ZM、DK、ZR分为一个亚簇,B、ZT又分为一个亚簇。表明窖泥培养后在微生物属种上具有差异性。除ZT外,其他生物炭添加窖泥组较空白组在微生物属种上差异显著。原始窖泥样本中存在丰度较高的norank_f__norank_o__Chloroplast等微生物属,在窖泥研究的文献中其功能并不明确。在添加生物炭培养后,这类微生物相对含量明显减少甚至消失。添加ZM、DK、ZR窖泥培养后有相似的微生物组成,与Caproiciproducens和Clostridium_sensu_stricto_12有较强的相关性,与Myxococcus和Sporosarcina菌属则呈显著负相关。YM、SD窖泥中则与Acidipropionibacterium和Weissella等菌呈著正相关,表明添加ZM、DK、ZR的窖泥与酿酒重要优势功能微生物有更强相关性,和Lactobacillus相关性更弱。此类生物炭表面孔径更丰富更密集,表面OFGs更多,对人工窖泥理化性质和微生态环境调节效果更好,更有利于加快人工窖泥向优质老窖泥转化。
2.4 窖泥微生物群落网络相关性分析
根据Spearman相关性(|ρ|>0.6,P<0.05),分析分类学总丰度前50的物种,结果如图4-a所示。这些微生物共49个节点,所有节点都隶属于8个门,主要集中在Firmicutes,占所有节点的71%。各窖泥样品中共存在5个枢纽,都属于Firmicutes,在网络中十分重要(图4-a)。在添加生物炭培养后,窖泥中微生物分为了2个模块,其中1个是以Firmicutes为主的主体部分,占了网络相关性中绝大部分,Clostridium_sensu_stricto_12和Caproiciproducens在网络中最为重要,它们都是己酸菌且呈正相关,这与已有文献报道一致[22]。添加生物炭不会使窖泥微生态稳定性变差或退化,不会受到Lactobacillus等微生物对窖泥网络平衡造成的影响。
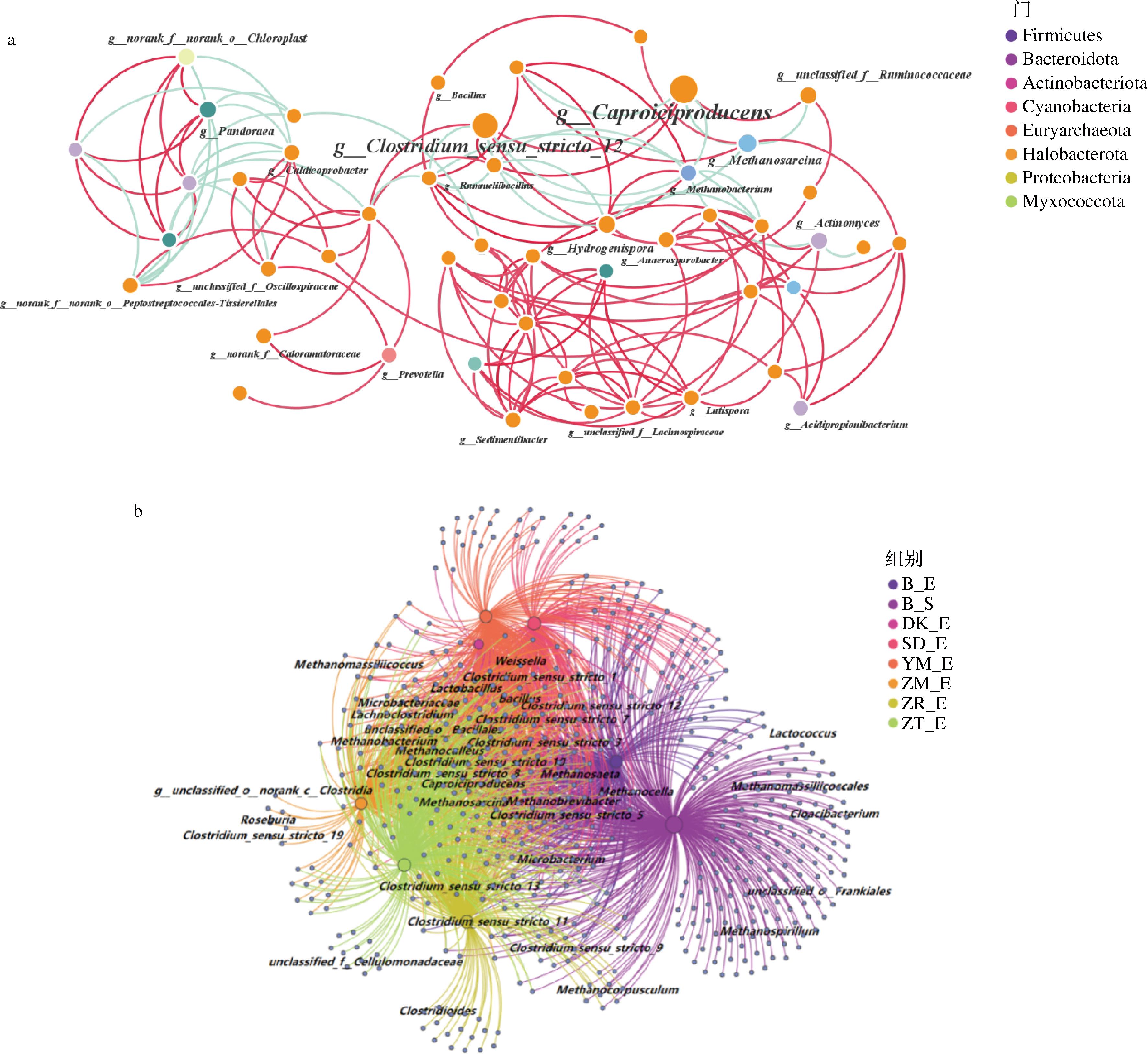
a-水平微生物网络相关性图;b-共线性网络图
图4 原始窖泥和培养90 d后窖泥属水平微生物网络相关性图和共线性网络图
Fig.4 Microbial network correlation chart and collinearity network chart of original and after 90 d culture pit mud on genus level
共线性网络如图4-b所示,不同生物炭添加,对培养后人工窖泥中微生物组成会造成明显差异。原始窖泥样本独有属种种类较多,添加生物炭会抑制这些微生物生长,并促进Caproiciproducens、Clostridium、Bacillus、Methanobacterium等菌属富集。添加ZM窖泥组与Clostridium_sensu_stricto_19、Roseburi和g__unclassified_o__norank_c__Clostridia有较强的相关性,此类微生物都是在酿酒过程中能起到重要作用的梭菌。ZR、ZT窖泥组与Clostridium_sensu_stricto_11有较强的相关性。DK则没有与特有的功能微生物有强相关性,多样性不强。这可能是由于ZM等拥有更丰富的OFGs增强了种间电子传递效率,富集了更多种类的酿酒功能微生物。同时也表明己酸菌作为窖泥中关键的微生物,能联系其他微生物从而带动整个窖泥正常运行[26-27]。
2.5 窖泥微生物群落与理化因子相关性分析
基于窖泥核心菌群与理化性质的RDA,结果如图5-a所示。理化因子对RDA1和RDA2解释度依次是pH(99.67%)>有机酸(86.05%)>腐殖质(75.25%)>水分(49.61%),其中pH和含水量与微生物群落结构呈现极显著关系(P<0.01),添加不同生物炭的窖泥也被明显区分。图5-a表明,添加生物炭主要与pH、含水量和铵态氮等具有相关性,而pH和含水量是提高窖泥质量的主要驱动力[28-29],添加生物炭有利于提升窖泥质量。添加YM、SD主要影响窖泥pH,ZM、ZR主要影响窖泥含水量,DK、ZR则主要影响窖泥铵态氮和己酸。微生物影响方面,添加生物炭主要与窖泥内Caproiciproducens、Clostridium_sensu_stricto_12、Methanobacterium和Hydrogenispora 有显著相关性。添加ZR、ZM和DK与Clostridium_

a-冗余分析;b-热图
图5 窖泥理化与微生物群落的冗余分析和热图
Fig.5 Redundancy analysis and heat map of physicochemical and microbial community in pit mud
sensu_stricto_12呈正相关。ZR和DK与Caproiciproducens呈正相关。YM、SD和ZM窖泥则与Methanobacterium和Hydrogenispora呈正相关性。说明添加生物炭能影响窖泥优势功能微生物的生长,添加ZR、ZM和DK影响窖泥Clostridium_sensu_stricto_12菌属的富集,ZR和DK影响窖泥Caproiciproducens菌属的富集。同时含水量、pH、铵态氮与Lactobacillus呈负相关,这与毕天然等[30]研究相符。pH及乳酸菌分别与大部分菌群和梭菌呈负相关,这与吴浪涛[26]的研究相符。但铵态氮、腐殖质与窖泥细菌有较强的相关性,与pH、含水量有负相关,这与较多学者的研究结果有差异[29-32]。
理化性质与微生物相关性热图如图5-b所示。pH、含水量和腐殖质与微生物呈显著相关性。pH降低与Methanobacterium呈极显著相关,而Methanobacterium产甲烷菌系是窖泥中功能古菌[23,33]。含水量和pH降低与Caproiciproducens和Clostridium_sensu_stricto_12呈负相关性。所以pH带来窖泥质量的影响可能与Methanobacterium有关。添加生物炭提高窖泥保水性并延缓pH降低,较高的含水量和偏中性的pH更有利于窖泥质量提高。
3 结论
本研究利用高通量测序技术研究添加不同生物炭对人工窖泥培养过程中微生物群落的影响,结果表明添加ZM窖泥含水量比空白组窖泥高4.02%,含水量提高有利于加快人工窖泥向优质窖泥的转化。添加ZM窖泥Shannon指数比空白组提高18.25%,多样性更趋近于优质老窖泥的多样性指数(Shannon 5.50~6.45)。添加ZM组能保证Caproiciproducens丰富度较高情况下,促进Clostridium_sensu_stricto_12等窖泥内产己酸功能微生物富集,其相对含量较空白组提高了7.99%,同时抑制Lactobacillus等对窖泥质量有不利影响的微生物生长,其相对含量较空白组减少了10.10%。RDA结果表明添加ZM与Clostridium_sensu_stricto_12有正相关性,且与Lactobacillus显著负相关。本研究为生物炭应用于人工窖泥向优质老窖泥转化提供了微生物学理论基础。
[1] 梁欢, 许长峰, 朱立宁, 等.浓香型白酒地域性及窖泥微生物研究进展[J].中国酿造, 2020, 39(11):5-8.
LIANG H, XU C F, ZHU L N, et al.Research progress on regional characteristics and pit mud microorganisms of strong-flavor Baijiu[J].China Brewing, 2020, 39(11):5-8.
[2] 赵静溶, 徐友强, 朱华, 等.浓香型白酒风味乙酯微生物合成机制研究进展[J].食品与生物技术学报, 2022, 41(10):1-16.
ZHAO J R, XU Y Q, ZHU H, et al.Research progress on microbial synthetic mechanism of flavor ethyl esters in strong-flavor Baijiu[J].Journal of Food Science and Biotechnology, 2022, 41(10):1-16.
[3] 冯小进, 陈周, 董孝元, 等.土质对人工窖泥培养的影响研究[J].酿酒, 2022, 49(4):77-79.
FENG X J, CHEN Z, DONG X Y, et al.Study on the influence of soil quality on the cultivation of artificial pit mud[J].Liquor Making, 2022, 49(4):77-79.
[4] 魏云, 李增, 高志远, 等.一种复合型窖泥养护方法的研究及应用[J].酿酒, 2022, 49(4):100-102.
WEI Y, LI Z, GAO Z Y, et al.Research and application of compound cellar mud maintenance method[J].Liquor Making, 2022, 49(4):100-102.
[5] 杜礼泉. 窖泥及窖泥功能菌液微生物群落的研究进展与发展趋势[J].中国酿造, 2018, 37(10):1-4.
DU L Q.Research progress and development trend of microbial community in pit mud and its functional strain liquid[J].China Brewing, 2018, 37(10):1-4.
[6] 李海峰, 沈才洪, 卢中明, 等.人工窖泥的研究进展[J].酿酒, 2012, 39(2):96-99.
LI H F, SHEN C H, LU Z M, et al.The research progress in artificial pit mud[J].Liquor Making, 2012, 39(2):96-99.
[7] 计海洋, 汪玉瑛, 刘玉学, 等.生物炭及改性生物炭的制备与应用研究进展[J].核农学报, 2018, 32(11):2281-2287.
JI H Y, WANG Y Y, LIU Y X, et al.Advance in preparation and application of biochar and modified biochar research[J].Journal of Nuclear Agricultural Sciences, 2018, 32(11):2281-2287.
[8] SUN Y F, LYU H H, CHENG Z, et al.Insight into the mechanisms of ball-milled biochar addition on soil tetracycline degradation enhancement:Physicochemical properties and microbial community structure[J].Chemosphere, 2022, 291:132691.
[9] RAHMAN M Y A, COOPER R, TRUONG N, et al.Water quality and hydraulic performance of biochar amended biofilters for management of agricultural runoff[J].Chemosphere, 2021, 283:130978.
[10] DOMINCHIN M F, VERDENELLI R A, BERGER M G, et al.Impact of N-fertilization and peanut shell biochar on soil microbial community structure and enzyme activities in a Typic Haplustoll under different management practices[J].European Journal of Soil Biology, 2021, 104:103298.
[11] ZHANG J, SHEN J L.Effects of biochar on soil microbial diversity and community structure in clay soil[J].Annals of Microbiology, 2022, 72(1):35.
[12] 张梦阳. 生物炭对酸性土壤微生物群落及钾素的作用机制[D].武汉:华中农业大学, 2021.
ZHANG M Y.The mechanisms of biochar on the microbial community and potassium in acidic soil[D].Wuhan:Huazhong Agricultural University, 2021.
[13] KEILUWEIT M, NICO P S, JOHNSON M G, et al.Dynamic molecular structure of plant biomass-derived black carbon (biochar)[J].Environmental Science &Technology, 2010, 44(4):1247-1253.
[14] 朱启林, 索龙, 刘丽君, 等.裂解温度对海南不同材料生物炭理化特性的影响[J].热带作物学报, 2022, 43(1):216-223.
ZHU Q L, SUO L, LIU L J, et al.Effect of pyrolysis temperature on the physicochemical properties of biochar from different materials in Hainan[J].Chinese Journal of Tropical Crops, 2022, 43(1):216-223.
[15] 胡晓龙, 余苗, 曹振华, 等.基于高通量测序的窖泥原核微生物群落多样性在退化窖池中的空间异质性[J].食品科学, 2021, 42(10):86-93.
HU X L, YU M, CAO Z H, et al.Spatial heterogeneity of prokaryotic microbial community diversity in pit mud from degraded cellar for the production of strong-flavor Baijiu revealed by high throughput sequencing[J].Food Science, 2021, 42(10):86-93.
[16] 刘美, 王湛.胞外聚合物对膜污染的影响[J].水处理技术, 2007, 33(10):7-13.
LIU M, WANG Z.Eps extraction, chemical analyses and its effect on membrane fouling[J].Technology of Water Treatment, 2007, 33(10):7-13.
[17] 刘颖, 陈雄, 廖蓓, 等.工业酒精发酵污染菌的分离及新型抑菌剂的应用[J].食品与发酵工业, 2017, 43(8):46-52.
LIU Y, CHEN X, LIAO B, et al.Isolation of contamination bacteria from industrial scale alcohol fermentation and application of novel antibacterial agents[J].Food and Fermentation Industries, 2017, 43(8):46-52.
[18] WALTERS W, HYDE E R, BERG-LYONS D, et al.Improved bacterial 16S rRNA gene (V4 and V4-5) and fungal internal transcribed spacer marker gene primers for microbial community surveys[J].mSystems, 2015, 1(1):e00009-e00015.
[19] SAMPSON T R, DEBELIUS J W, THRON T, et al.Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson’s disease[J].Cell, 2016, 167(6):1469-1480.e12.
[20] 张会敏, 王艳丽, 孟雅静, 等.浓香型白酒发酵新老窖泥理化因子和原核微生物群落结构差异分析[J].食品科学, 2020, 41(6):207-214.
ZHANG H M, WANG Y L, MENG Y J, et al.Differences in physicochemical properties and prokaryotic microbial communities between young and old pit mud from Chinese strong-flavor Baijiu brewing[J].Food Science, 2020, 41(6):207-214.
[21] 钱玮, 陆震鸣, 柴丽娟, 等.泸型酒酒醅与窖泥中梭菌群落结构、演替和功能差异[J].生物工程学报, 2020, 36(6):1190-1197.
QIAN W, LU Z M, CHAI L J, et al.Differences of the structure, succession and function of Clostridial communities between Jiupei and pit mud during Luzhou-flavour Baijiu fermentation[J].Chinese Journal of Biotechnology, 2020, 36(6):1190-1197.
[22] 任海伟, 孙一帆, 王希, 等.不同窖龄及位置浓香型白酒窖泥中细菌群落结构的差异性分析[J].食品与发酵工业, 2023, 49(9):103-111.
REN H W, SUN Y F, WANG X, et al.Difference analysis of bacterial community structure in pit mud with different ages and position[J].Food and Fermentation Industries, 2023, 49(9):103-111.
[23] 邓杰, 卫春会, 边名鸿, 等.浓香型白酒不同窖龄窖池窖泥中古菌群落结构分析[J].食品科学, 2017, 38(8):37-42.
DENG J, WEI C H, BIAN M H, et al.Archaeal community analysis of pit mud from cellars of different ages for Luzhou-flavor liquor[J].Food Science, 2017, 38(8):37-42.
[24] 杜礼泉, 罗惠波, 黄治国, 等.不同质量窖泥古菌群落的研究[J].酿酒科技, 2015(2):58-61.
DU L Q, LUO H B, HUANG Z G, et al.Archaea communities in pit mud of different quality[J].Liquor-Making Science &Technology, 2015(2):58-61.
[25] 何宏魁, 宰红玉, 李安军, 等.窖泥理化指标与微生物含量相关性研究[J].酿酒, 2019, 46(1):65-67.
HE H K, ZAI H Y, LI A J, et al.Research on the relationship between the index of cellar mud and the content of microorganism[J].Liquor Making, 2019, 46(1):65-67.
[26] 吴浪涛. 浓香型白酒窖泥梭菌的趋化性与代谢特性研究[D].无锡:江南大学, 2022.
WU L T.Chemotaxis and metabolic characteristics of Clostridium strains isolated from strong aroma Baijiu pit mud[D].Wuxi:Jiangnan University, 2022.
[27] 任聪, 辜杨, 杜海, 等.基于新老窖泥的微生物菌群结构判定浓香型白酒生产中的主体己酸菌[J].食品与发酵工业, 2018, 44(12):8-14.
REN C, GU Y, DU H, et al.Predicting dominant caproate-producing microbes by comparing the microbiotas between new-and aged-pit muds[J].Food and Fermentation Industries, 2018, 44(12):8-14.
[28] 张明珠, 吴学凤, 穆冬冬, 等.基于高通量测序的窖泥原核微生物群落结构及其理化因子相关性分析[J].食品科学, 2021, 42(18):111-118.
ZHANG M Z, WU X F, MU D D, et al.High throughput sequencing-based analysis of prokaryotic community structure in Chinese liquor fermentation pit muds and its correlation with physicochemical indexes[J].Food Science, 2021, 42(18):111-118.
[29] 徐相辉, 常强, 孙伟, 等.文王浓香型白酒不同深度新老窖泥理化性质与微生物演替分析[J].食品工业科技, 2022, 43(21):129-136.
XU X H, CHANG Q, SUN W, et al.Analysis of physicochemical properties and microbial succession of Wenwang Chinese strong-flavor Baijiu at different depths in old and new pit muds[J].Science and Technology of Food Industry, 2022, 43(21):129-136.
[30] 毕天然, 黄钧, 张宿义, 等.不同窖龄及位置窖泥微生物群落和代谢组分的差异[J].食品与发酵工业, 2022, 48(2):231-237.
BI T R, HUANG J, ZHANG S Y, et al.Difference of the microbial community and metabolite in pit mud with different age and position[J].Food and Fermentation Industries, 2022, 48(2):231-237.
[31] 高家坤, 李静心, 何宏魁, 等.窖泥理化指标与微生物含量相关性研究[J].环球市场信息导报, 2017(27):130-131.
GAO J K, LI J X, HE H K, et al.Correlation between physicochemical indexes and microbial content of pit mud[J].Global Market Information Guide, 2017(27):130-131.
[32] 刘梅, 邓杰, 谢军, 等.基于微生物群落结构相关的窖泥品质理化指标的筛选[J].食品科学, 2018, 39(19):44-50.
LIU M, DENG J, XIE J, et al.Screening of physicochemical quality indexes of pit mud based on correlation with microbial community structure[J].Food Science, 2018, 39(19):44-50.
[33] 刘茂柯, 唐玉明, 邹兰, 等.浓香型白酒窖泥古菌群落结构及其多样性[J].食品与发酵工业, 2013, 39(10):22-28.
LIU M K, TANG Y M, ZOU L, et al.Archaea community and diversity in the pit mud of Chinese Luzhou-flavour liquor[J].Food and Fermentation Industries, 2013, 39(10):22-28.