菊粉(菊糖)是自然界中资源丰富的功能性低聚果糖,主要存在于菊科类植物中,具有改善肠道微生态,促进益生菌增殖,调节血糖、血脂,改善便秘,促进矿物质的吸收以及减少患癌风险等功能,在乳制品、面制品、肉制品加工中有广泛的应用[1]。菊糖有多条代谢途径,其中一条途径是利用菊粉外切酶将菊粉分解为果糖[2],利用菊粉内切酶将菊糖降解为菊粉型低聚果糖[3]。菊粉型低聚果糖是不同聚合度的低聚果糖的混合物,如菊二糖(果果二糖)、菊三糖(果果三糖)、菊四糖(果果四糖)、菊五糖(果果五糖)、蔗果三糖、蔗果四糖和少量果糖,可发挥益生元作用,可较好地改善妊娠期的糖脂代谢,促进矿物质吸收,调节体内菌群平衡以及增强机体免疫力[3-6]。另一条途径是利用菊糖果糖转移酶(inulin fructotransferase,IFTase)降解菊糖为双果糖酐(difructose anhydride, DFA),菊糖可被三型菊糖果糖转移酶(DFA-Ⅲ-forming inulin fructotransferase, IFTase-Ⅲ,EC 4.2.2.18)和一型菊糖果糖转移酶(DFA-I-forming inulin fructotransferase, IFTase-Ⅰ,EC 4.2.2.17)分别酶解为三型双果糖酐DFA-Ⅲ和一型双果糖酐DFA-Ⅰ[7-8]。DFA-Ⅲ是一种功能性甜味剂,能量低,可以促进矿物质的吸收,降低胆固醇,抗龋齿,增殖有益菌[9]。DFA-Ⅲ可被DFA-Ⅲase进一步水解为菊二糖。菊糖这2条代谢途径都生成了菊二糖,其中菊糖、菊粉型低聚果糖和DFA-Ⅲ都具有特殊的功能,菊二糖却没有相关研究报道。另外,对低聚果糖的研究,多是直接研究混合糖的作用,没有分离出单一的糖,不能确定是哪种成分起作用,或是多种糖起协同作用。这主要由于酶法制备的低聚果糖为多种成分的混合体,其单一成分难以实现规模化合成以及纯化。
基于低聚果糖的生理功效,菊二糖也被推测为一种具有特殊功能的糖。然而菊二糖的产量很低,这限制了菊二糖相关性质的研究。天然菊二糖存在于牛蒡等植物的根茎和香蕉等水果内[10-11],但是量很少,且与其他糖分离困难。酶法生产菊二糖有较大潜力,蔗糖转化酶催化的蔗糖转糖基反应中,不仅生成了果糖和葡萄糖,同时还生成了菊二糖、1-蔗果三糖、6-蔗果三糖、新蔗果三糖,但是果糖和葡萄糖是主要产物[12]。菊粉酶和DFA-Ⅲase也能催化获得菊二糖。菊粉酶水解菊粉得到的低聚果糖,主要成分为菊三糖、菊四糖,而菊二糖相对较少[3,13]。DFA-Ⅲase能够水解DFA-Ⅲ获得单一的菊二糖,无其他副产物产生,因此,DFA-Ⅲase在合成菊二糖方面有望成为一种关键酶。1975年,具有水解DFA-Ⅲ功能的酶首次从Arthrobacter ureafaciens中被鉴定出来[14]。1997年,DFA-Ⅲase在Arthrobacter sp. H65-7中被分离纯化出,该酶在pH 4.5,60 ℃时转化DFA-Ⅲ为菊二糖的活性最高,同时该酶具有可逆催化功能,即催化菊二糖转化为DFA-Ⅲ[15]。SAITO等[16]实现了DFA-Ⅲase基因在大肠杆菌(Escherichia coli)中的异源表达。YU等[17]从Arthrobacter aurescens SK8.001中获得了DFA-Ⅲase编码基因,并将其在大肠杆菌中克隆和表达,开启了国内有关DFA-Ⅲase的研究。通过凝胶过滤和SDS-PAGE结果,得知该酶是一种同源三聚体,其单亚基相对分子质量和全相对分子质量分别为49 kDa和145 kDa,酶的活性中心位于亚基与亚基的裂缝之间,在pH 5.5,55 ℃时催化DFA-Ⅲ的活性最高。郁书怀[18]鉴定出了Arthrobacter chlorophenolicus A6中的DFA-Ⅲase,该酶是首个被报道能同时降解菊糖为DFA-Ⅲ,并催化DFA-Ⅲ水解为菊二糖的酶,即该酶具有连续催化性,其晶体结构也被首次解析出。关于DFA-Ⅲase的研究目前仍然较少,且活性都较低,因此,获得活性高、专一性强的DFA-Ⅲase对于菊二糖的研究至关重要。
本研究对来源于A.chlorophenolicus A6的AcDFA-Ⅲase进行分子改造,以期得到酶活性提高的突变体。由于设计的突变体数量较多,一一纯化测定酶活性,将十分耗时繁琐。糖分析方法主要有色谱法、比色法和滴定法等[19]。色谱法准确,但是耗时,滴定法不适用于大批量样品的测定。比色法利用紫外-可见分光光度法和标准曲线进行定量分析,有苯酚-硫酸法、蒽酮-硫酸法和3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法,前2种方法利用浓硫酸将多糖水解为单糖并脱水生成糖醛,再和苯酚/蒽酮生成有色化合物,利用分光光度计测量[19]。DNS法的原理是还原糖在碱性条件下与DNS反应生成红棕色化合物,且颜色深浅在一定范围内与还原糖的量成正比,准确性高,重复性好,被广泛使用[20-21]。菊二糖作为一种还原糖[14],可利用DNS法检测。另外,高通量筛选技术可大大提高筛选效率[22-23],所以本研究采用96孔板进行高通量培养,配合DNS法快速检测酶活性,筛选高酶活性的突变体,以期为DFA-Ⅲase突变体文库的快速筛选,菊二糖的大量生产、性质研究以及菊糖这一代谢途径的补充奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
大肠杆菌Escherichia coli BL21(DE3)、Escherichia coli DH5α,生工生物工程(上海)股份有限公司、含Arthrobacter chlorophenolicus A6来源的DFA-Ⅲase基因的重组质粒pET22b-AcDFA-Ⅲase由生工生物工程(上海)股份有限公司合成,保藏在本实验室。
1.1.2 工具酶
PrimeSTAR HS DNA Polymerase高保真酶和Dpn Ⅰ消化酶,TaKaRa公司。
1.1.3 培养基与主要试剂配制
LB培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10,调整pH至7.0,固体培养基在此基础上加入20 g/L琼脂粉,121 ℃高压灭菌20 min。液体培养基中加入氨苄青霉素至50 μg/mL,固体培养基中添加至100 μg/mL。配好的液体培养基于室温存放,平板置于4 ℃冰箱存放。
纯化所用缓冲液参考文献[18]的配制方法。Binding buffer:500 mmol/L NaCl、50 mmol/L NaH2PO4和50 mmol/L Na2HPO4,pH 7.4;Wash buffer:在Binding buffer基础上添加50 mmol/L的咪唑,用于洗除杂蛋白;Elution buffer:在Binding buffer基础上添加200 mmol/L咪唑,用于洗脱结合在柱子上的目的蛋白;酶透析液Ⅰ:Binding buffer中不添加NaCl和咪唑但添加10 mmol/L EDTA,用于去除蛋白溶液中的高浓度盐分和金属离子;酶透析液Ⅱ:在透析液I的基础上不添加EDTA,目的是进一步去除溶液中的盐分、金属离子以及EDTA。
DNS试剂:18.2 g酒石酸钾钠溶解于50 mL去离子水中,趁热加入0.63 g DNS,2.1 g NaOH和0.5 g苯酚,搅拌至溶解,冷却后定容至100 mL,贮于棕色瓶中,室温保存,放置1周后使用。
1.1.4 主要仪器
ProFlex PCR仪,美国赛默飞公司;Nano-300微量分光光度计,杭州奥盛公司;酶标仪,南京拜尔沃公司;电泳仪,美国BIO-RAD公司;4600SF凝胶成像仪,上海天能公司;GL-21MS离心机,卢湘仪离心机仪器有限公司;台式摇床,上海知楚仪器公司;超声波细胞粉碎机-粗频变杆,南京非奇经贸。
1.2 实验方法
1.2.1 突变体的构建
基于AcDFA-Ⅲase生物信息学分析、晶体结构,理性设计突变位点。基于AcDFA-Ⅲase基因序列设计含有突变氨基酸的PCR引物,序列见表1,其中C387A是重复本课题组之前的工作[18]。
表1 定点突变所用引物
Table 1 Primers for site-directed mutagenesis

引物核苷酸序列(5’-3’)T310K-FCATGAACCGTGGAAGCCGTTTT310K-RCCAAAAAACGGCTTCCACGGTTCA209C-FTCATAATTTTATTTGCGAATGTGGTTCTA209C-RGAACCACATTCGCAAATAAAATTATGATGS82C-FTGGCTTTACCTGCTCAAGCATTCGS82C-RGAATGCTTGAGCAGGTAAAGCCATGV89T-FTCGCTTTAATACTCCGGAAGAAGAATGGCV89T-RTCTTCTTCCGGAGTATTAAAGCGAATGCTR270A-FGGCGTCACCGCTTCTTCAGTTACCAATR270A-RTTGGTAACTGAAGAAGCGGTCACGCCTE294A-FTTCTAGTGCTAATCTGGTTGCCACCAATCE294A-RTGGTGGCAACCAGATTAGCACTAGAATT310A-FCATGAACCGTGGGCTCCGTTTT310A-RCCAAAAAACGGAGCCCACGGTTCV379E-FCGATGGATGAGGATGCAGCAAGTAGCGV379E-RGCTACTTGCTGCATCTCATCCATCGCD380A-FTGGATGTTGCTGCAGCAAGTAGCGATAGCD380A-RCTACTTGCTGCAGCAACATCCATCGCAACA381T-FGGATGTTGATACTGCAAGTAGCGATAGCTGA381T-RGCTATCGCTACTTGCAGTATCAACATCCS132A-FCGAAGGCGCTCCGCGCATTAGTS132A-RTAATGCGCGGAGCGCCTTCGCW220A-FCTGCGCGGTGCTGGTCAGGCW220A-RGCCTGACCAGCACCGCGCAGTTW220S-FCTGCGCGGTTCTGGTCAGGCCW220S-RGCCTGACCAGAACCGCGCAGTTCF388A-FAGCTGTGCTGAAGCCCAGGTGGATF388A-RTGGGCTTCAGCACAGCTATCGCTACTA397T-FTGCCCTGTTAACCACCGAAGCAGCA397T-RCTTCGGTGGTTAACAGGGCATCCACCC387A-FGTCGAGTGACTCCGCCTTCGAAGCCCAGGC387A-RGGCGGAGTCACTCGACGCAGCGTCCACATCCATA209D-FTCATAATTTTATTGACGAATGTGGTTCTTGA209D-RGAACCACATTCGTCAATAAAATTATGATGA209S-FTCATAATTTTATTAGTGAATGTGGTTCTA209S-RGAACCACATTCACTAATAAAATTATGATG
注:下划线部分是引入突变的位点
以重组质粒pET22b-AcDFA-Ⅲase为模板,通过重叠延伸PCR引进突变。PCR体系:5×PrimeSTAR Buffer 10 μL,dNTP Mixture 4 μL,引物各100 pmol,模板10 ng,DNA聚合酶0.5 μL,加入灭菌水至50 μL。反应条件:98 ℃预变性3 min,98 ℃变性10 s;55 ℃退火5 s,72 ℃延伸6.5 min;72 ℃延伸10 min。PCR产物用Dpn I酶消化质粒模板,消化产物转化E.coli DH5α感受态,涂布于含有氨苄青霉素的抗性平板上,过夜培养后挑取单菌落送生工生物工程(上海)股份有限公司测序,测序成功后返回质粒,转化至E.coli BL21(DE3)感受态细胞中,涂布于抗性平板,37 ℃过夜培养得到重组菌。
1.2.2 高通量孔板初筛
在已灭菌的超净工作台中,用移液排枪将LB培养基分装于已灭菌96深孔板,每孔分装600 μL。用灭菌枪头/牙签挑取单菌落转至深孔板中,用已灭菌的纱布或96孔板硅胶盖封住深孔板。将96孔板固定在摇床上,37 ℃、900 r/min培养过夜。按2%(体积分数)接种量转接至装有600 μL LB培养基的96深孔板,37 ℃、900 r/min培养至OD600为0.6~0.8,向孔板中添加终浓度为1 mmol/L的IPTG,于28 ℃低温诱导6 h。发酵结束后,对深孔板进行离心,向其中加入200 μL溶菌酶(750 g/L)进行破碎,并加入400 μL磷酸盐缓冲液进行稀释。使用DNS法测定酶活性,直接在96孔板中进行反应,用酶标仪批量测定540 nm下的吸光值,DNS法测酶活性时,酶活性定义为pH 6.5,55 ℃条件下,1 min生成1 μg葡萄糖还原当量的还原糖所需酶量为1个酶活性单位。
1.2.3 摇瓶复筛验证
将初筛得到的酶活性提高的突变体菌株接种于10 mL含氨苄青霉素抗性的LB液体培养基中,37 ℃、200 r/min条件下培养过夜后,按2%接种量转接至200 mL含氨苄青霉素抗性的LB液体培养基中,37 ℃、200 r/min条件下,培养至OD600达0.6~0.8时,加入IPTG(终浓度为1 mmol/L),置于28 ℃摇床中培养6 h,在4 ℃、10 000 r/min下离心15 min收集细胞,用磷酸盐缓冲液(pH 7.4,50 mmol/L)洗涤并悬浮,在冰水浴的条件下用超声波破碎仪破碎细胞(300 W,开1 s,停2 s,破碎10 min),破碎液在冰水浴中离心15 min,取上清液用于后续的蛋白纯化。蛋白纯化采用Ni-NTA柱亲和层析法,用不同浓度的咪唑进行洗脱,收集各部分洗脱液。收集液进行SDS-PAGE,验证纯度。得到纯酶后,用HPLC法进行酶活性测定。
1.2.4 酶学性质测定
酶活性测定:酶促反应体系1 mL包括10 g/L DFA-Ⅲ、100 nmol/L纯酶液、50 mmol/L磷酸盐缓冲液(pH 6.5),反应温度55 ℃,反应时间10 min。沸水浴灭酶活性后,10 000 r/min离心10 min,上清液过膜后进行HPLC检测。色谱柱:NH2P-50 4E氨基柱;流动相:65%乙腈;流速1 mL/min;柱温30 ℃;检测器:示差折光检测器。HPLC法测定时的酶活性定义为在pH 6.5,55 ℃条件下,1 min生成1 μmol菊二糖所需的酶量为1个酶活性单位。
最适温度:分别在30~80 ℃(间隔5 ℃)下测定酶活性,把最适温度下的酶活性定义为100%,计算其他温度下的相对酶活性。
最适pH:通过柠檬酸钠盐缓冲液(pH 5.0~6.5)、磷酸盐缓冲液(pH 6.5~7.0)、Tris-HCl缓冲液(pH 7.0~8.0)配制10 g/L的DFA-Ⅲ底物,在最适温度条件下反应后测酶活性,把最适pH下的酶活性定为100%,计算其他pH下的相对酶活性。
动力学研究:100 nmol/L的纯酶液与2.0~50 mmol/L的DFA-Ⅲ在pH 6.5、55 ℃时反应10 min。反应后测定酶活性,根据双倒数法或者非线性拟合方法计算动力学参数。
1.2.5 D380A同源建模
将D380A氨基酸序列提交至SWISS-MODEL在线蛋白质模型构建服务器(http://www.expasy.ch/swissmod/SWISS-MODEL.html)进行同源建模,模式选定为自动构建模式。选定AcDFA-Ⅲase晶体结构(PDB ID:5ZKS)作为模板进行三聚体结构的构建,模型的立体化学质量主要是通过Wincoot软件的拉氏构象图来判定,而原子模型(3D)和氨基酸序列(1D)兼容性的合理性是通过ASVES服务器的VERIFY-3D模块进行判定(http://services.mbi.ucla.edu/SAVES/)。最后使用可视化软件PyMOL对模拟结构进行展示和分析。
2 结果与讨论
2.1 突变位点的选择
AcDFA-Ⅲase的晶体结构已经被解析出(PDB ID:5ZKS),AcDFA-Ⅲase和底物双果糖酐复合物的结构也被解析出(PDB ID:5ZKU),AcDFA-Ⅲase是1个同源三聚体,活性口袋位于2个相邻亚基形成的裂缝中,口袋中心的活性残基分为亲水和疏水残基两部分,亲水残基有Ser84、Tyr163、Glu210、Arg258、Gln391、Asp177、Asp199、Gln222、Phe80、Ile85、Phe256以及Trp309。活性口袋正上方存在1个具有重要调控作用的loop环(将其称为活性口袋上方的盖子,区域为Asp378~Asp402)[18],loop区是蛋白最柔性部分,保守性低,选择这个区域的氨基酸残基可以避免改变酶蛋白的保守结构,而且活性中心以及盖子周围的氨基酸残基对催化起重要作用[24-25]。所以最终选择了这些区域的关键位点进行理性设计,例如Ala209位点是关键催化位点Glu210附近的残基,Ser82在活性口袋里,以及Thr310在活性口袋且与盖子交界处,Val379、Asp380、Ala381、Phe388、Ala397处于盖子区域,改变这些位点的残基有可能影响到酶的催化能力。
2.2 双果糖酐水解酶DFA-Ⅲase突变文库的高通量筛选
DNS法是还原糖测定常用的经典方法,但应用传统方法对大批量样品检测仍较繁琐,所以有必要建立微型化DNS法。本研究利用微孔板进行还原糖与DNS试剂反应,并用酶标仪测定540 nm波长下的吸光度。在96孔板中进行DNS法比色时,标准曲线为y=5.59x-0.026回归系数为0.993 4,线性良好,能满足实验测定的需要。而且利用96孔板作为反应容器时可同时处理96个样品,样品处理完再利用移液排枪转移至酶标板,几分钟内即可读取数据,操作简便;另外在96孔板中反应时,反应体系小,可节约试剂。所以微孔板结合DNS法检测有望成为酶活性高通量分析的方法。
将设计的突变体利用96孔板同步发酵培养,DFA-Ⅲase在大肠杆菌中是以胞内酶形式表达,利用96孔板对菌体进行发酵培养时,尽量保持每个孔的菌体浓度一致,为了保持结果的重复性,将同一样品的重组酶液分装在深孔板中,利用粗酶和底物反应,采用DNS法对水解物进行测定,结果如图1所示。
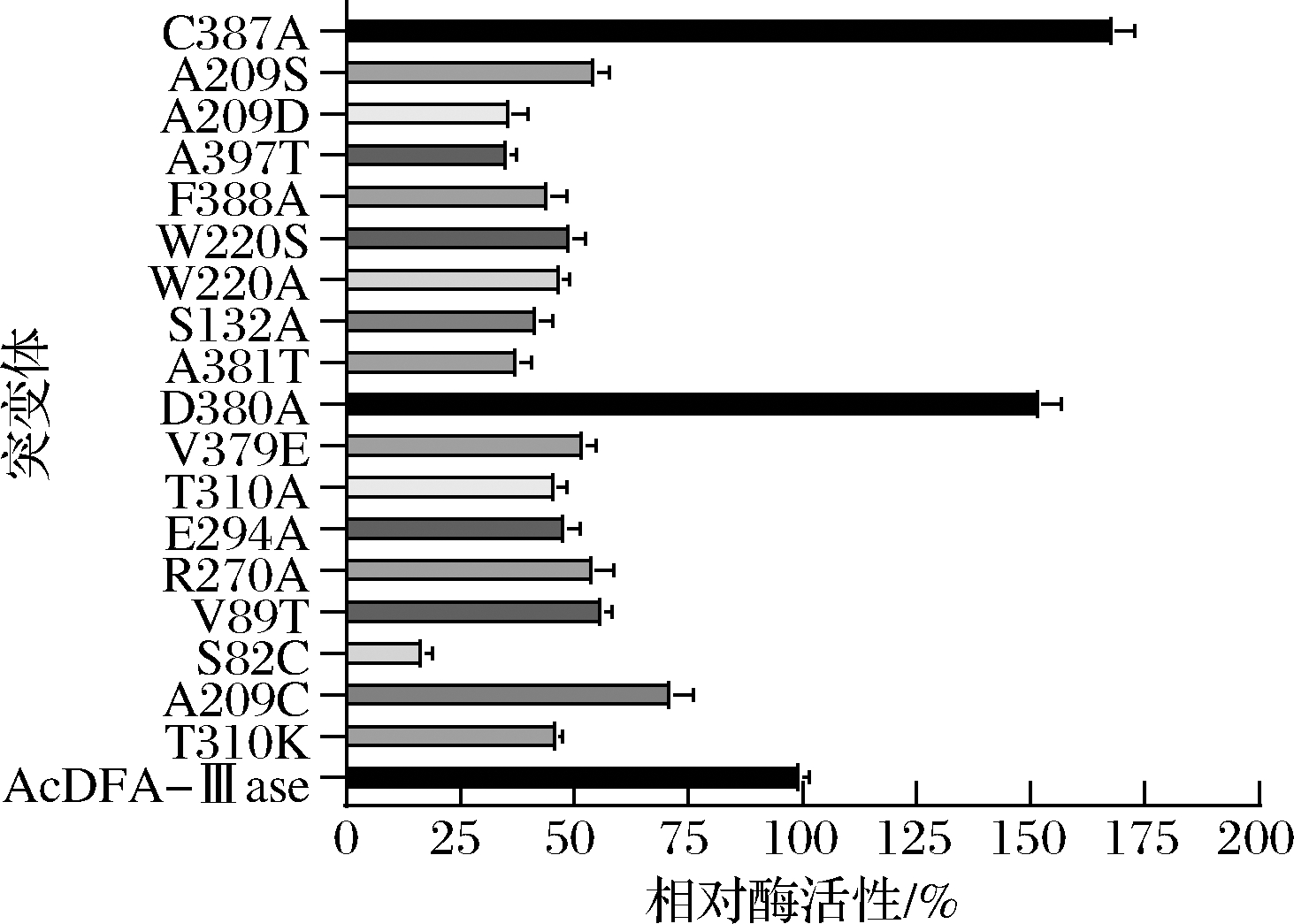
图1 原始酶和突变体的酶活性结果
Fig.1 Enzyme activities of wild enzyme and mutants
对原始AcDFA-Ⅲase进行定点突变得到的突变体酶仍然具有水解双果糖酐的能力,但是大部分突变体的酶活性大幅度降低,只有D380A和C387A的酶活性有明显提高。利用此方法测出D380A的酶活性是AcDFA-Ⅲase的152.5%,C387A的酶活性是AcDFA-Ⅲase的168.5%,而之前课题组用HPLC法测得C387A纯酶的相对酶活性是AcDFA-Ⅲase的185.2%[18],2种方法所得结果比较一致。可以初步认定,D380A也是1个正向突变体,但是之前并未有人利用DNS法来检测DFA-Ⅲase的酶活性,所以还需进一步用HPLC法对其可信度进行验证。
2.3 摇瓶复筛
将D380A突变体在LB培养基中进行摇瓶发酵,经过镍柱亲和层析纯化,纯化后的SDS-PAGE结果如图2所示,有2条清晰的单条带,纯度较高,D380A的相对分子质量在47 kDa左右,和AcDFA-Ⅲase一致,可以进行酶活性测定。
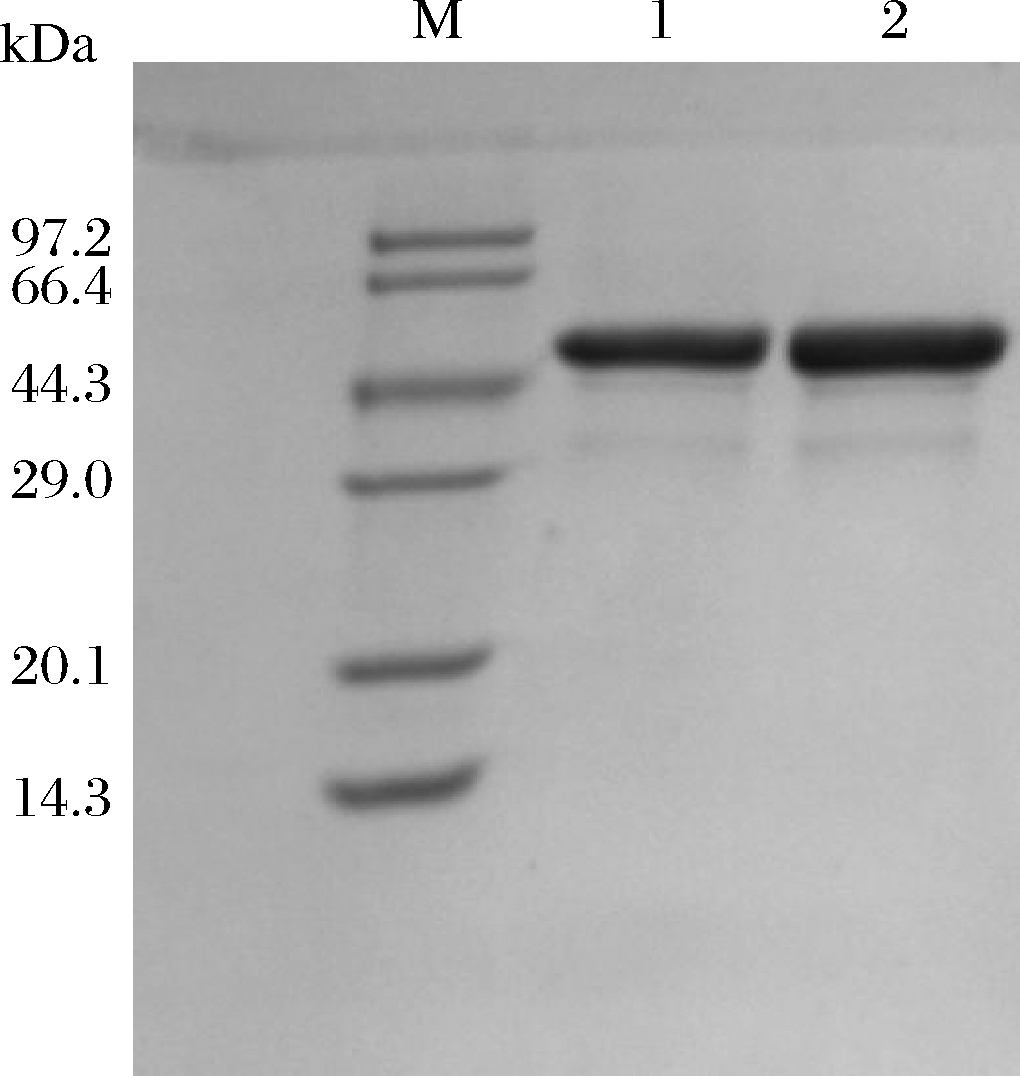
M-蛋白marker;1-AcDFA-Ⅲase;2-D380A
图2 纯化后的AcDFA-Ⅲase和突变体D380A的 SDS-PAGE分析
Fig.2 SDS-PAGE analysis of the purified AcDFA-Ⅲase and the mutant D380A
酶活性测定以DFA-Ⅲ为底物,在pH 6.5、55 ℃条件下,采用HPLC检测原始酶和突变酶的活性,突变体D380A的酶比活性为164.33 U/mg,原始菌株AcDFA-Ⅲase的酶比活性为101.25 U/mg,突变体D380A酶活性显著高于原始酶,是AcDFA-Ⅲase的162.3%。而DNS法初筛结果得出,D380A的酶活性是AcDFA-Ⅲase的152.5%,初筛和复筛结果一致。突变体库初筛时采用的96孔板和摇瓶培养复筛在体积、溶氧以及酶的纯度等参数上存在较大的差异,在这种情况下,2种测定方法的结果仍然有较好的一致性,这表明96孔板结合DNS法可以作为AcDFA-Ⅲase的酶活性筛选手段,大大提高筛选效率,减少劳力和成本。
2.4 AcDFA-Ⅲase和D380A的酶学性质
如图3所示,突变体D380A和原始酶的最适温度和最适pH均为55 ℃和6.5,在40~65 ℃以及pH 5.0~7.5范围内,酶活性仍能保持50%以上,结果表明理性设计可以在不改变酶的最适反应条件下进行。
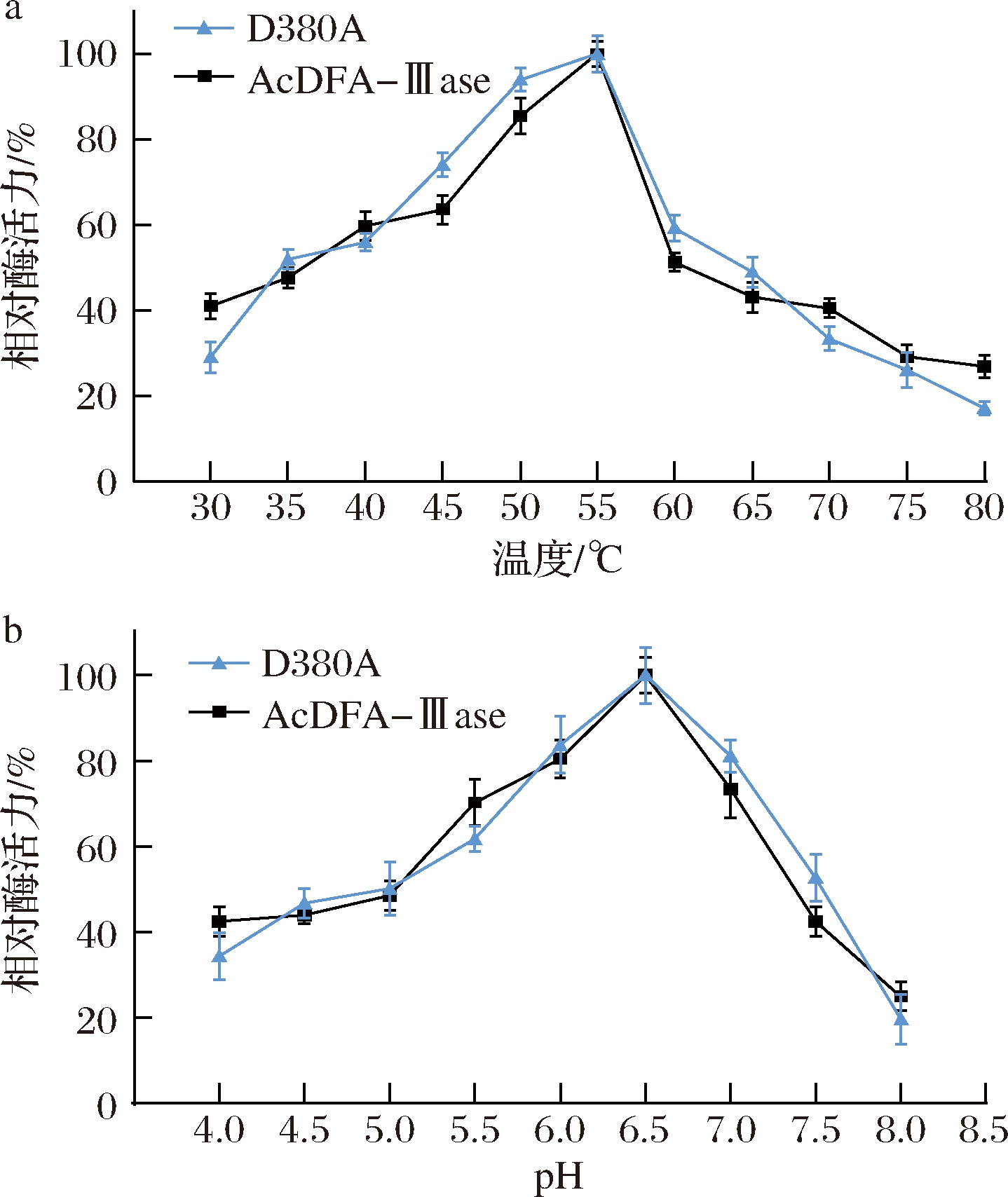
a-温度;b-pH
图3 AcDFA-Ⅲase和突变体D380A的最适反应条件
Fig.3 Optimum reaction conditions of AcDFA-Ⅲase and the mutant D380A
2.5 AcDFA-Ⅲase和D380A的反应动力学
对AcDFA-Ⅲase和D380A进行反应动力学分析,计算出它们的动力学参数,结果如表2所示。D380A的Km值较原始酶AcDFA-Ⅲase有所下降,说明突变之后D380A对底物双果糖酐的亲和力提高了,而且D380A催化效率提高到了原始酶的1.5倍。
表2 AcDFA-Ⅲase和突变体D380A的动力学参数
Table 2 Kinetic parameters of AcDFA-Ⅲase and the mutant D380A
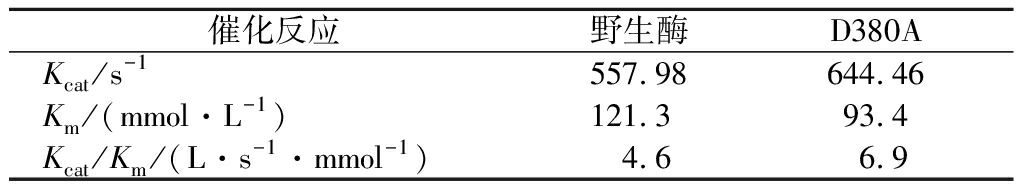
催化反应野生酶D380AKcat/s-1557.98644.46Km/(mmol·L-1)121.393.4Kcat/Km/(L·s-1·mmol-1)4.66.9
注:Km-米氏常数;Kcat-转换数;Kcat/Km-催化效率
2.6 D380A同源建模
针对突变体D380A酶活性高的原因进行分析,首先以野生酶的晶体结构(PDB ID:5ZKS)为模板,利用SWISS-MODEL进行同源建模。所构建的模型通过Wincoot在拉氏图(Ramachandran plot)进行氨基酸分析。结果显示,94.52%、4.80%和0.68%的氨基酸残基分别坐落于核心区、允许区和非允许区域。当落在核心区和允许区的氨基酸残基占整个蛋白质的比例高于90%,便可认为该模型的构象符合立体化学规则,而D380A模型拉氏图中核心区和允许区的氨基酸所占比例总和高达99.32%。同时,D380A模型有91.14%氨基酸残基的平均3D-1D分数在0.2以上。蛋白质原子三维结构模型(3D)和一级氨基酸序列(1D)的匹配程度(兼容性)也是一个模型合理性的判定依据,一般要求80%的氨基酸残基平均3D-1D分数达到0.2以上即可判定此模型较合理。综合这两方面的检测结果,所构建的D380A模型合理,可用于后续研究分析。
均方根偏差(relative mean square deviation,RMSD)可用于分析试验获得的数据和实际数据的偏差,2种酶之间RMSD值越小,说明其差异越小。D380A模型结构与AcDFA-Ⅲase结构比对的RMSD值为0.015 7 nm,说明380位点氨基酸突变并没有引发酶整体结构的变化。图4-a所示,野生酶AcDFA-Ⅲase活性口袋上方有1个loop环结构,类似盖子封住口袋,有利于口袋疏水微环境的形成和催化。此盖子富含疏水氨基酸,380位点的天冬氨酸与周边氨基酸并没有形成相互作用。且380毗邻的379、381、382位点以及对立的397位点皆为疏水性氨基酸,这些疏水氨基酸的存在使水分子不易进入活性中心。将380位点突变为丙氨酸后(图4-c),这5个位点全部为疏水性氨基酸,盖子区域疏水性显然增强(图4-d相对图4-b中的疏水面积更大)。因此,外界水分子更加不易通过盖子上方进入活性口袋内部,口袋中疏水微环境增强,更加有利于催化,即表现在380位点突变后的活性增加。

a-AcDFA-Ⅲase活性口袋区域结构及氨基酸残基 (活性口袋中底物DFA-Ⅲ为黄色);b-AcDFA-Ⅲase 活性口袋区域疏水性(疏水区域为粉红色); c-D380A活性口袋区域结构及氨基酸残基; d-D380A活性口袋区域疏水性
图4 D380A活性提高机制分析
Fig.4 Enhancement mechanism of D380A activity
3 结论
为了解决酶在实际生产和应用过程中稳定性差,活性不高等问题,需要对酶进行合理的改造,如定点突变,定向进化,这些方法取得了很大的成功。但是巨大的突变体库增加了筛选难度以及筛选的成本,解决此问题的关键是建立高通量筛选技术。
本研究对AcDFA-Ⅲase进行了分子改造,并基于DFA-Ⅲase与DFA-Ⅲ反应生成还原糖,建立了96孔板结合DNS法高效检测DFA-Ⅲase活性的方法。利用高通量方法筛选与HPLC法验证,成功从17个突变体中筛选到1个酶活性提高62.3%的突变体D380A。利用同源建模模拟分析得出,将380位天冬氨酸突变为丙氨酸,增强了蛋白活性口袋上方loop区的疏水性,使水分子不易进入活性中心,更益于催化,提高了酶的催化活性。
本研究建立的DFA-Ⅲase的高通量筛选方法,在人工操作的情况下可重复性高,耗时短,操作简单,提高了菌株的筛选效率。筛选得到的菌株为菊二糖的大量生产和性质研究提供了可能性,也为催化机制解析提供了基础数据。但是构建的重组DFA-Ⅲase生产菌的酶活性仍有较大的提升空间,接下来可以尝试通过多位点改造或随机突变等手段来进一步提高酶活性,提升其工业利用价值。
[1] 李烜, 罗登林, 向进乐, 等.菊粉的性质、功能及在食品中的应用进展[J].中国粮油学报, 2021, 36(4):185-192.
LI X, LUO D L, XIANG J L, et al.Physicochemical properties, functions and applications of inulin in food:A review[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(4):185-192.
[2] 何丽梅, 张蕊, 李娜, 等.外切菊粉酶的酶学研究进展[J].微生物学杂志, 2020, 40(5):117-128.
HE L M, ZHANG R, LI N, et al.Advances in enzymology of exo-inulinases[J].Journal of Microbiology, 2020, 40(5):117-128.
[3] 侯东军, 曾凡坤.菊粉低聚糖生产的研究进展[J].中国食品添加剂, 2003(5):88-90.
HOU D J, ZENG F K.The recent andvances in the manufacture of inulooligosaccharide[J].China Food Additives, 2003(5):88-90.
[4] CHUL K H, JIN K H, BONG C W, et al.Inulooligosaccharide production from inulin by Saccharomyces cerevisiae strain displaying cell-surface endoinulinase[J].Journal of Microbiology and Biotechnology, 2006, 16(3):360-367.
[5] 苗苗, 张悦, 穆娟, 等.菊粉型果聚糖对妊娠期糖尿病孕妇糖脂代谢的影响[J].江苏预防医学, 2021, 32(2):153-156.
MIAO M, ZHANG Y, MU J, et al.The effects of inulin-type fructans in pregnant women with gestational diabetes mellitus[J].Jiangsu Journal of Preventive Medicine, 2021, 32(2):153-156.
[6] 陈兴都, 陈庆安, 翟丹云, 等.菊粉果聚糖的保健功能及应用价值[J].中国酿造, 2018, 37(1):21-24.
CHEN X D, CHEN Q A, ZHAI D Y, et al.Healthy function and application value of inulin-fructan[J].China Brewing, 2018, 37(1):21-24.
[7] WANG X, YU S H, ZHANG T, et al.From fructans to difructose dianhydrides[J].Applied Microbiology and Biotechnology, 2015, 99(1):175-188.
[8] SAITO K, TOMITA F.Difructose anhydrides:Their mass-production and physiological functions[J].Bioscience, Biotechnology, and Biochemistry, 2000, 64(7):1 321-1 327.
[9] 孙怡, 帅玉英, 黄海娟, 等.双果糖酐Ⅲ的生理功能及制备方法[J].中国食品添加剂, 2014(8):85-90.
SUN Y, SHUAI Y Y, HUANG H J, et al.Physiological function and preparation of difructose anhydride Ⅲ[J].China Food Additives, 2014(8):85-90.
[10] CRUZ-C RDENAS C I, MIRANDA-HAM M L, CASTRO-CONCHA L A, et al.Fructans and other water soluble carbohydrates in vegetative organs and fruits of different Musa spp.accessions[J].Frontiers in Plant Science, 2015, 6:395-405.
RDENAS C I, MIRANDA-HAM M L, CASTRO-CONCHA L A, et al.Fructans and other water soluble carbohydrates in vegetative organs and fruits of different Musa spp.accessions[J].Frontiers in Plant Science, 2015, 6:395-405.
[11] ISHIGURO Y, UENO K, ONODERA S, et al.Effect of temperatures on inulobiose and inulooligosaccharides in burdock roots during storage[J].Journal of Food Composition & Analysis, 2011, 24(3):398-401.
[12] FARINE S, VERSLUIS C, BONNICI P J, et al.Application of high performance anion exchange chromatography to study invertase-catalysed hydrolysis of sucrose and formation of intermediate fructan products[J].Applied Microbiology and Biotechnology, 2001, 55(1):55-60.
[13] MUTANDA T, WILHELMI B S, WHITELEY C G.Biocatalytic conversion of inulin and sucrose into short chain oligosaccharides for potential pharmaceutical applications[J].African Journal of Science, Technology, Innovation and Development, 2015, 7(5):371-380.
[14] TANAKA T, UCHIYAMA T, KOBORI H, et al.Enzymic hydrolysis of di-D-fructofuranose 1, 2′;2, 3′ dianhydride with Arthrobacter ureafaciens[J].The Journal of Biochemistry, 1975, 78(6):1 201-1 206.
[15] SAKURAI H, YOKOTA A, SUMITA Y, et al.Metabolism of DFA Ⅲ by Arthrobacter sp.H65-7:Purification and properties of a DFA Ⅲ hydrolysis enzyme (DFA Ⅲase)[J].Bioscience, Biotechnology and Biochemistry, 1997, 61(6):989-993.
[16] SAITO K, SUMITA Y, NAGASAKA Y, et al.Molecular cloning of the gene encoding the di-D-fructofuranose 1, 2′:2, 3′ dianhydride hydrolysis enzyme (DFA Ⅲlase) from Arthrobacter sp H65-7[J].Journal of Bioscience and Bioengineering, 2003, 95(5):538-540.
[17] YU S H, WANG X, ZHANG T, et al.Identification of a novel di-D-fructofuranose 1, 2′:2, 3′ dianhydride (DFA Ⅲ) hydrolysis enzyme from Arthrobacter aurescens SK8.001[J].PLoS One, 2015, 10(11):e0142640.
[18] 郁书怀. 菊糖果糖转移酶和双果糖酐水解酶构效关系研究[D].无锡:江南大学, 2019.
YU S H.The investigation of structural and functional relationships of inulin fructotransferase and difructose anhydride hydrolase[D].Wuxi:Jiangnan University, 2019.
[19] 邱博韬, 张鸿宇, 许志茹, 等.多糖分析方法研究进展[J].食品工业科技, 2018, 39(6):327-333.
QIU B T, ZHANG H Y, XU Z Y, et al.Research progress on analysis of polysaccharides[J].Science and Technology of Food Industry, 2018, 39(6):327-333.
[20] 童爱均, 赵超, 曾峰, 等.产β-葡萄糖苷酶菌株的筛选与鉴定[J].福建农业科技, 2018(7):6-10.
TONG A J, ZHAO C, ZENG F, et al.Screening and identification of β-glucosidase-producing strains[J].Fujian Agricultural Science and Technology, 2018(7):6-10.
[21] 王希桐, 杨庆昊, 王宇航, 等.耐盐型纤维素酶产生菌的驯化与筛选[J].青岛科技大学学报(自然科学版), 2021, 42(3):22-26.
WANG X T, YANG Q H, WANG Y H, et al.Domestication and screening of salt-tolerant cellulase producing bacteria[J].Journal of Qingdao University of Science and Technology(Natural Science Edition), 2021, 42(3):22-26.
[22] 刘亚东, 王苏和, 贺敏, 等.高通量筛选鉴定耐受和吸附重金属Pb2+的酵母菌[J].中国食品学报, 2020, 20(6):246-255.
LIU Y D, WANG S H, HE M, et al.High-throughput screening and identification for yeasts of the absorption and tolerance to heavy metal as Pb2+[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(6):246-255.
[23] 周剑, 江红, 林风.基于深孔板培养高通量筛选rakicidin B1高产菌的研究[J].中国抗生素杂志, 2019, 44(12):1 352-1 355.
ZHOU J, JIANG H, LIN F.Studies on high throughput screening for high rakicidin B1-producing strains with deep-well plates[J].Chinese Journal of Antibiotics, 2019, 44(12):1 352-1 355.
[24] CHENG F, YANG J H, BOCOLA M, et al.Loop engineering reveals the importance of active-site-decorating loops and gating residue in substrate affinity modulation of arginine deiminase (an anti-tumor enzyme)[J].Biochemical & Biophysical Research Communications, 2018, 499(2):233-238.
[25] HEINEMANN P M, ARMBRUSTER D, HAUER B.Active-site loop variations adjust activity and selectivity of the cumene dioxygenase[J].Nature Communications, 2021, 12(1):1 095.