植物活性成分因种类丰富、功能多样、天然有机而广受关注[1]。与化学方法相比,植物发酵技术能够提高天然植物成分的活性,具有环境友好、条件温和等优点。大量研究证实,植物发酵提取物(plant fermentation extract,PFE)具有抗氧化[2]、抗菌[3]、抑制黑色素生成[4]等特性,已被广泛应用于功效化妆品中,如葡萄发酵面膜、海藻发酵精华、蘭蔷薇发酵卸妆油等。
微生物通过水解反应等释放原料中的植物活性物[5],并能进一步通过改造或修饰得到一些用化学方法难以制备的生物活性化合物[6]。多项研究表明,发酵可促进植物底物中有效成分转化为高生物活性化合物,如发酵促进黄芩素转化为抗炎活性更强的汉黄芩素[7],发酵赤芍不仅提高了总酚类化合物含量而且生成新的化合物邻苯三酚[8],表明植物发酵技术是提高植物提取物活性物质含量及其功能性的有效手段[9]。
不同植物中活性化合物种类和含量的差异会直接影响PFE功能性,葡萄籽多酚、枸杞多糖、银杏叶黄酮、荷叶生物碱是备受关注的植物活性成分。本文制备上述植物材料水和乙醇提取物以筛选高抗氧化活性植物底物,并使用不同菌株与筛选得到的植物底物制备PFE,分析发酵对其活性物质和功能性的影响,探讨植物与菌株间的相互作用,以期找到适配的发酵菌株与植物底物组合,为制备葡萄籽/枸杞PFE提供借鉴。
1 材料与方法
1.1 主要试剂及设备
葡萄糖、NaCl、乙醇、NaOH,国药集团上海化学试剂公司;蛋白胨、酵母提取物,英国Oxoid公司;芦丁,北京伊诺凯科技有限公司;没食子酸,上海泰坦科技股份有限公司;酪氨酸酶,Merck公司;1,1-二苯基-2-三硝基苯肼,上海阿拉丁化学试剂有限公司;卡那霉素,生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
HYL-C组合式恒温摇床,太仓市强乐实验设备有限公司;TU-1810紫外分光光度计,北京普析通用仪器有限责任公司;synergy H4多功能酶标仪,美国伯腾仪器有限公司;FreeZone 4.5L冷冻干燥机,美国Labconco公司;TSQ8000三重四级杆气质联用仪,赛默飞世尔科技有限公司。
1.2 实验材料及菌株
葡萄籽、荷叶,淘宝贵臣旗舰店;枸杞,京东桂小侠官方旗舰店;银杏叶,淘宝奢然旗舰店;布拉氏酵母CNCM I-3856,从法国乐斯福酵母益生菌固体饮料分离;鼠李糖乳杆菌LRH113,从乐力益生菌活菌调理冻干粉分离;ATCC 25922大肠杆菌O157:H7、ATCC 25923金黄色葡萄球菌,本研究室保藏。
1.3 实验方法
1.3.1 材料处理、培养基及培养条件
葡萄籽和枸杞于-40 ℃冷冻48 h后粉碎成渣,荷叶和银杏叶粉碎成渣,4 ℃保存。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose medium, YPD)培养基(g/L):酵母粉10.0,蛋白胨20.0,葡萄糖20.0。MRS(de Man,Rogosa and Sharpe)培养基(g/L):蛋白胨10.0,牛肉膏10.0,酵母膏5.0,柠檬酸氢二铵2.0,葡萄糖20.0,乙酸钠5.0,K2HPO4 2.0,MgSO4 0.5,MnSO4 0.3,吐温80 1.0 mL。LB(Luria-Bertani)培养基(g/L):酵母粉5.0,蛋白胨10.0,NaCl 10.0。固体培养基加入琼脂20.0 g/L;121 ℃灭菌20 min。
发酵培养基:YPD培养基/MRS培养基50.0 mL中加入2.0 g葡萄籽渣/枸杞渣。
发酵方法:250 mL三角瓶中发酵培养基装液量为50.0 mL,初始OD600为0.1。布拉氏酵母30 ℃,200 r/min培养60 h。鼠李糖乳杆菌37 ℃静置培养60 h。
葡萄籽/枸杞未发酵对照:250 mL三角瓶中装水50.0 mL,灭菌后不接种菌株,于30 ℃,200 r/min提取60 h。菌株对照:发酵培养基不添加植物底物,其余操作同“发酵方法”,所有实验设置3个平行。
水提取物和乙醇(φ=60%)提取物:50.0 mL水/乙醇中加入2.0 g葡萄籽、枸杞、荷叶、银杏叶渣,于37 ℃超声中处理15 min,离心取上清液并定容至50.0 mL。
1.3.2 总酚(total phenolic content, TPC)、总黄酮(total flavonoid content, TFC)和多糖测定
参考ISLAM等[10]的方法测定总酚和总黄酮,结果以1 mL PFE中没食子酸当量(mg GAE/mL PFE)和1 mL PFE中芦丁当量(mg RE/ mL PFE)表示。以水为空白对照排除溶剂本底及实验设备等可能对实验造成的影响。参考国标QB/T 5176—2017《枸杞多糖》方法测定多糖。
1.3.3 抗氧化活性测定和酪氨酸酶抑制活性
参考谢东东等[11]的方法测定DPPH自由基清除率和羟自由基(·OH)清除率。参考KONDO等[12]的方法测定酪氨酸酶抑制活性。
1.3.4 菌株胞外酶活力测定
蛋白酶活性测定参考梅源等[13]的方法。脂肪酶活性测定参考郑晓梅[14]的方法。β-葡萄糖苷酶活性测定参考曾钰等[15]的方法。
1.3.5 抑菌活性
发酵液冷冻干燥后稀释至200 g/L。参考LI等[16]的方法测定其对金黄色葡萄球菌和大肠杆菌抑菌活性。以游标卡尺用十字交叉法测量抑菌圈直径。用卡那霉素(0.03 g/L)作为阳性对照,以水为空白排除溶剂本底及环境等其他因素可能对实验造成的影响。
1.3.6 其他测定方法
生物量利用分光光度计测定培养液在600 nm处吸光值。GC-MS参考付依依等[17]方法,使用Xcalibur工作站利用面积归一化法计算各组分峰面积百分比(相对含量)。
1.4 数据处理与统计分析
试验所做平行次数均为3次,取平均值进行数据分析;采用Excel进行数据统计,Origin 2019绘图,采用SPSS 26.0软件进行数据分析。
2 结果与分析
2.1 高抗氧化活性植物底物筛选及发酵
葡萄籽、枸杞、银杏叶、荷叶的水提取物和60%乙醇提取物均具备清除自由基的能力,但差异较大。其中枸杞提取物对DPPH自由基和羟自由基的清除率分别为(51.4±0.2)%和(80.4±1.4)%,而葡萄籽提取物虽然·OH清除能力不突出,但DPPH自由基清除能力最优(图1),所以选择葡萄籽和枸杞制备PFE。
利用2种益生菌(布拉氏酵母和鼠李糖乳杆菌)研究发酵对葡萄籽和枸杞功能性的影响。制备PFE依赖于微生物代谢,但植物中部分物质会影响微生物生长[18]。本文中葡萄籽和枸杞对鼠李糖乳杆菌影响较小,却导致布拉氏酵母生长能力下降(图1-c)。
2.2 植物底物对胞外酶活性的影响
微生物分泌的蛋白酶、脂肪酶能够分解植物底物,促进产品的生物活性。发酵组蛋白酶活性较菌株对照均有显著提高(P<0.05),表明植物化学物质对微生物分泌上述酶有诱导作用(图2-a)。菌株对照中脂肪酶活性无差异,添加葡萄籽/枸杞后鼠李糖乳杆菌组脂肪酶活性提高了1.2~1.3倍,但布拉氏酵母仅在发酵葡萄籽时检测到脂肪酶酶活力(图2-b)。β-葡萄糖苷酶是释放结合于碳水化合物、有机酸上活性成分的主要水解酶[5],仅鼠李糖乳杆菌PFE中检测到β-葡萄糖苷酶活性(图2-c)。以上结果表明发酵过程中植物底物诱导菌株分泌上述酶表达,且不同植物底物的诱导能力存在差异。

a-DPPH自由基清除率;b-·OH清除率;c-植物基培养基中菌株生物量
图1 高抗氧化活性植物底物筛选及其对菌株生物量的影响
Fig.1 Screening of plant substrates with high antioxidant activity and their effect on the biomass of fermentation strains
注:图中小写字母不同表示有显著性差异(P<0.05)(下同)

a-蛋白酶活力;b-脂肪酶活力;c-β-葡萄糖苷酶活力
图2 发酵体系中酶活性测定
Fig.2 Determination of enzyme activity in fermentation systems
2.3 发酵提取物中活性成分分析
2.3.1 TPC、TFC和多糖含量
酚及黄酮类物质含量是评价植物发酵提取物品质的重要指标之一。未发酵对照中未检出TPC和TFC。鼠李糖乳杆菌发酵后TPC和TFC含量显著提高,葡萄籽中PFE分别为(4.3±0.2)mg GAE/mL PFE和(1.0±0.1)mg RE/mL PFE(表1)。研究发现,糖苷酶、蛋白酶等多种酶参与了乳酸菌生物转化提高TPC和TFC含量的过程[19]。本研究PFE中TPC(r=0.915,P=0.01<0.05)和TFC(r=0.823,P=0.012<0.05)含量与蛋白酶活性呈正相关,表明分泌蛋白酶是TPC和TFC含量积累的重要原因。有研究称酵母菌较乳酸菌提取酚及黄酮能力较弱[20],本文中布拉氏酵母组仅葡萄籽发酵PFE中检测到TPC和TFC含量,且TPC仅为鼠李糖乳杆菌发酵的47.5%,这与发酵体系中的酶活性结果一致。此外乳酸菌发酵形成低pH环境有利于活性成分的溶出并降低酚及黄酮类物质的氧化损失[19]。此前研究中酵母及乳酸菌制备PFE中TPC和TFC含量仅0.5 mg GAE/mL PFE和0.1 mg RE/mL PFE,其蛋白酶活性和淀粉酶活性仅(1.10±0.07)和(0.17±0.02)U/mL[21],本文中高TPC和TFC含量是布拉氏酵母和鼠李糖乳杆菌高酶活力的结果。
表1 植物发酵提取物中TPC,TFC和多糖含量
Table 1 TPC, TFC and polysaccharide in PFE

实验分组植物底物菌株TPC/(mg GAE·mL-1 PFE)TFC/(mg RE·mL-1 PFE)多糖/(mg·mL-1 PFE)发酵组葡萄籽布拉氏酵母2.0±0.1b1.3±0.1a7.1±0.1d葡萄籽鼠李糖乳杆菌4.3±0.2a1.0±0.1b7.1±0.1d枸杞布拉氏酵母--8.5±0.1c枸杞鼠李糖乳杆菌0.4±0.0c0.5±0.1c9.2±0.1c未发酵对照葡萄籽无--12.3±1.1b枸杞无--14.2±0.1a
注:“-”表示未检出;同列肩标的字母不同,表示其具有显著性差异(P<0.05)(下同)
与未发酵对照相比,发酵结束时葡萄籽中多糖下降了42.3%,枸杞多糖下降了35.2%~40.1%,微生物生长代谢会利用多糖化合物,但同时发生生物转化修饰多糖并提高其抗氧化活性[22]。此外,TPC、TFC均具有抗氧化能力,因此多糖总量的下降可能不会导致产品抗氧化活性的降低。
2.3.2 PFE中挥发性化合物
发酵前后PFE中共检测到73种挥发性化合物(volatile compounds, VOCs),包括醇类20种、醛类6种、酮类7种、酯类14种、酸类14种、萜类5种、酚类3种、醚类4种。总峰面积代表VOCs总量(排除少量硅氧烷杂质峰),发酵后VOCs总量均有提高,其中布拉氏酵母组PFE中醇类物质占比大幅度提高,而鼠李糖乳杆菌主要提高了酸类化合物占比(图3)。β-苯乙醇具有柔和的玫瑰香气,布拉氏酵母发酵后葡萄籽PFE和枸杞PFE中β-苯乙醇相对含量提高至27.79%和53.76%。发酵促进天然抗氧化剂4-乙烯愈创木酚、2,4-二叔丁酚含量的提高[23-24]。橙花叔醇、橙花醇和2,3,5-三甲基吡嗪仅在PFE中检出,据报道他们具有优异的抑菌活性[25-26]。糠醛是3类致癌物质,经发酵糠醛被降解,表明微生物发酵能够改变PFE物质组成、分解抗营养化合物、增加活性化合物占比。
有机酸是PFE主要活性成分之一。由表2可知,鼠李糖乳杆菌发酵代谢合成多种有机酸,葡萄籽PFE和枸杞PFE中相对含量分别为67.3%和60.4%。发酵产生了6种新的有机酸:丁酸、异丁酸、2-甲基丁酸、己酸、月桂酸、苯甲酸,且乙酸、辛酸、壬酸、葡萄花酸相对含量提高,其中辛酸和壬酸是有效的抗菌剂[27]。

A-布拉氏酵母/葡萄籽;B-鼠李糖乳杆菌/葡萄籽;C-未发酵葡萄籽;D-布拉氏酵母/枸杞;E-鼠李糖乳杆菌/枸杞;F-未发酵枸杞 a-总峰面积;b-挥发性化合物数量;c-各类别挥发性化合物数量;d-各类别挥发性化合物相对百分含量
图3 发酵与未发酵体系中挥发性化合物
Fig.3 Volatile compounds in fermented and unfermented systems
表2 植物发酵提取物中主要挥发性化合物
Table 2 Major VOCs in PFE

序号物质峰面积百分比(相对含量)/%葡萄籽枸杞未发酵对照鼠李糖乳杆菌布拉氏酵母未发酵对照鼠李糖乳杆菌布拉氏酵母醇类1乙醇0.310.164.481.340.29-2异丁醇-----0.223辛醇--3.36---4异戊醇1.080.3930.158.830.953.485异戊烯醇----0.10-6正己醇0.770.42--0.28-7庚醇4.37-----
续表2

序号物质峰面积百分比(相对含量)/%葡萄籽枸杞未发酵对照鼠李糖乳杆菌布拉氏酵母未发酵对照鼠李糖乳杆菌布拉氏酵母8壬醇0.363.05--0.19-9糠醇---0.90--10蘑菇醇-0.160.04-0.060.1111香叶醇---0.250.55-12橙花叔醇--0.14---13橙花醇-----0.2214香茅醇--1.45---15苯甲醇-0.130.16-0.310.1216β-苯乙醇0.371.4727.790.251.9153.76172,3-丁二醇--0.61---181-辛烯-3-醇0.51--0.30--191-戊醇---0.24--201-已醇---0.56--酚类1对乙烯基愈创木酚--4.820.5-1.3322,4-二叔丁酚-0.100.490.570.11-34-乙烯基苯酚--1.02--1.15醛类1壬醛0.940.46--0.43-2糠醛---10.49--3苯甲醛-0.461.251.853.520.294苯乙醛-0.33--1.020.4155-甲基糠醛---1.1--6椰子醛-----1.72酮类1丙酮-0.030.12-0.100.052茶香酮---0.27--3丁酮---0.22--4甲基庚烯酮0.210.080.120.780.250.1252-壬酮0.611.00----6苯基丙酮---0.120.27-7香叶基丙酮0.130.08-0.580.10-有机酸1乙酸-22.15-3.4839.65-2异戊酸-0.53-1.030.887.683丁酸-0.541.24-1.080.674异丁酸-0.11--0.200.335己酸-10.15--8.16-6辛酸13.4718.30.492.416.10-7壬酸11.398.460.111.410.38-8葡萄花酸2.515.14-0.532.019月桂酸-0.08--0.21-10癸酸0.331.32-0.321.70-11缬草酸0.110.240.070.10--122-辛烯酸-0.16-0.14--132-甲基丁酸--2.41---14苯甲酸-0.14---0.18酯类1乙酸乙酯0.070.030.850.140.041.542丙酸乙酯--0.13--0.043辛酸乙酯--0.030.20--4丙酸异戊酯--0.13---5丁酸乙酯--0.14---
续表2
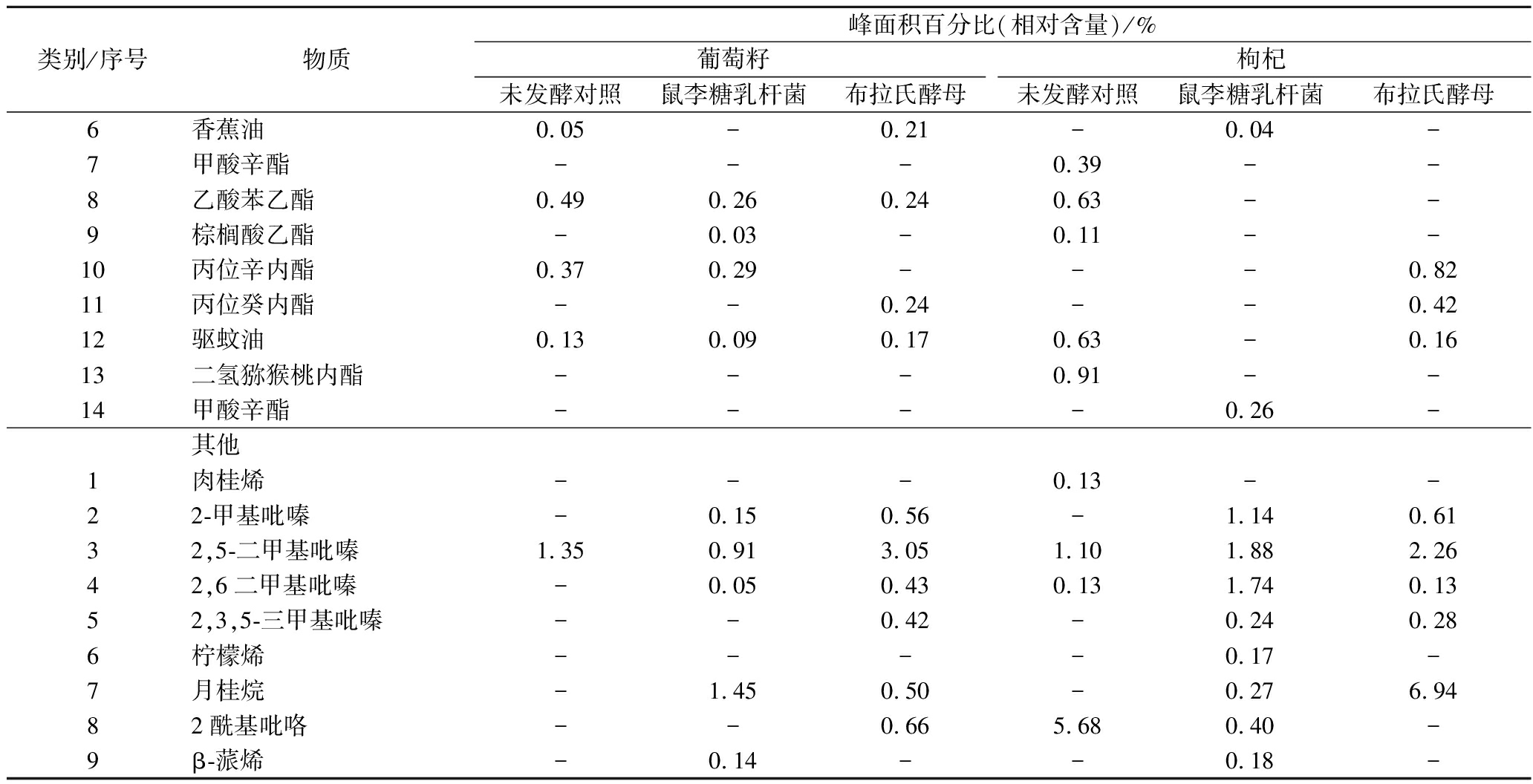
类别/序号物质峰面积百分比(相对含量)/%葡萄籽枸杞未发酵对照鼠李糖乳杆菌布拉氏酵母未发酵对照鼠李糖乳杆菌布拉氏酵母6香蕉油0.05-0.21-0.04-7甲酸辛酯---0.39--8乙酸苯乙酯0.490.260.240.63--9棕榈酸乙酯-0.03-0.11--10丙位辛内酯0.370.29---0.8211丙位癸内酯--0.24--0.4212驱蚊油0.130.090.170.63-0.1613二氢猕猴桃内酯---0.91--14甲酸辛酯----0.26-其他1肉桂烯---0.13--22-甲基吡嗪-0.150.56-1.140.6132,5-二甲基吡嗪1.350.913.051.101.882.2642,6二甲基吡嗪-0.050.430.131.740.1352,3,5-三甲基吡嗪--0.42-0.240.286柠檬烯----0.17-7月桂烷-1.450.50-0.276.9482酰基吡咯--0.665.680.40-9β-蒎烯-0.14--0.18-
注:“-”表示未检出
2.4 PFE功效性分析
2.4.1 抗氧化活性
DPPH自由基清除率(以下简称RDPPH)和羟自由基清除率(以下简称ROH)是常见的抗氧化活性评价指标,多酚、黄酮、多糖和有机酸均具备抗氧化活性,因此对照组中虽未检测出TPC和TFC但仍检测到自由基捕捉能力。与未发酵葡萄籽/枸杞相比,PFE清除自由基能力明显提高,且使用布拉氏酵母发酵葡萄籽RDPPH和鼠李糖乳杆菌发酵枸杞ROH提高效果较其他发酵组更为突出,分别为(75.2±3.0)%和(93.1±1.0)%(图4-a和图4-b),表明菌株和植物特性会影响PFE抗氧化活性。
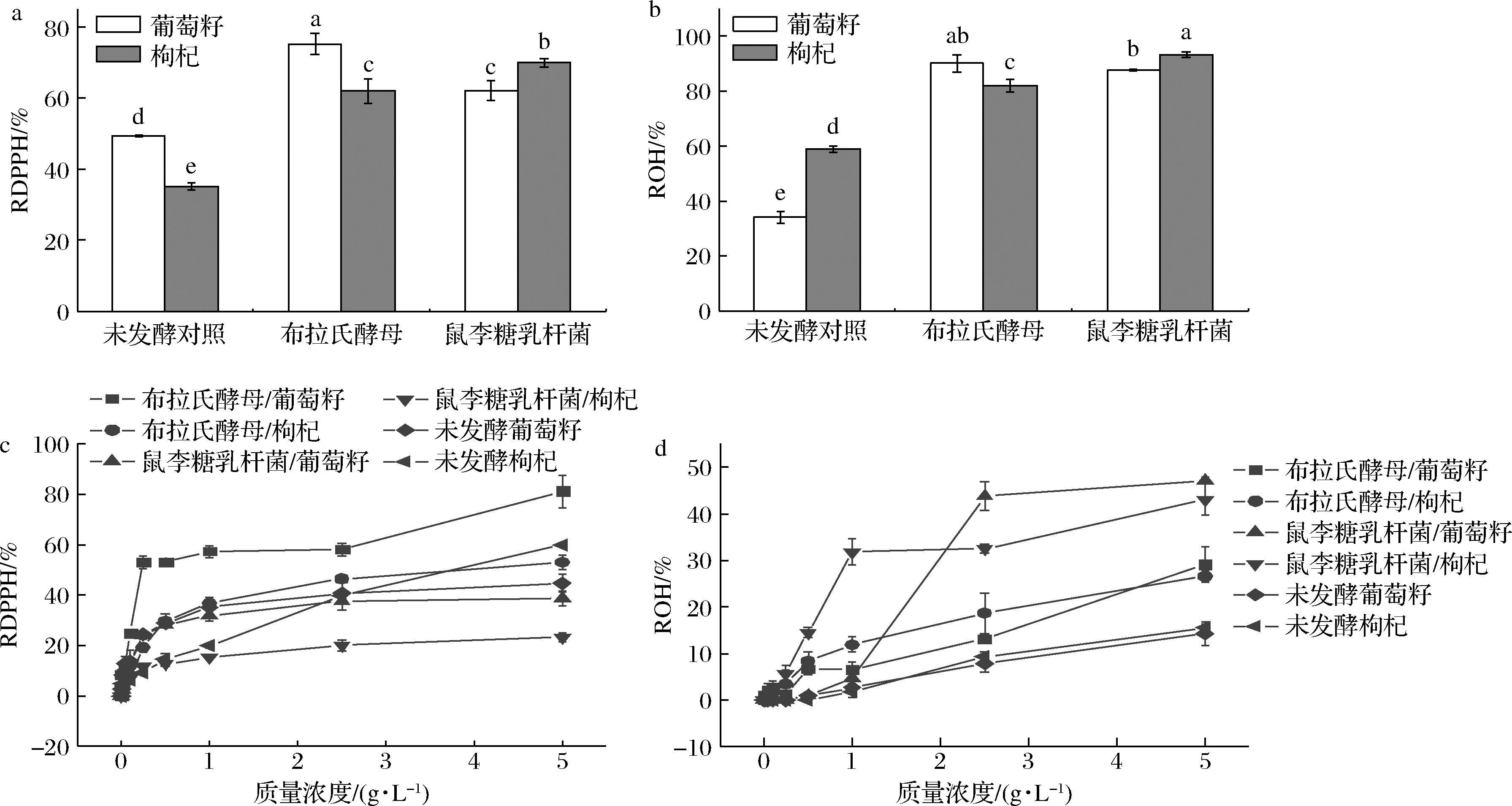
a-发酵结束时RDPPH;b-发酵结束时ROH;c-RDPPH随PFE质量浓度变化;d-ROH随PFE质量浓度变化
图4 植物发酵提取物自由基清除能力
Fig.4 Free radical scavenging ability of PFE
为进一步分析发酵提取物的抗氧化特性,将发酵后的PFE冷冻干燥以考察其质量浓度与RDPPH和ROH的关系(图4-c和图4-d)。RDPPH和ROH均随PFE质量浓度提高先快速增涨后趋于平缓,5.0 g/L时RDPPH和ROH可达(81.2±6.4)%(布拉氏酵母发酵葡萄籽)和(47.1±0.7)%(鼠李糖乳杆菌发酵葡萄籽)。进一步表明发酵能够提高葡萄籽和枸杞的抗氧化活性。
2.4.2 酪氨酸酶抑制活性
酪氨酸酶的抑制活性是经典美白能力评估指标。微生物促进活性成分释放而提高PFE酪氨酸酶抑制率,发酵组在较低浓度下即有更好的表现。高质量浓度下(20.0 g/L),枸杞PFE分别为(65.0±2.9)%(布拉氏酵母)和(51.4±3.9)%(鼠李糖乳杆菌),明显高于对应葡萄籽组,与未发酵葡萄籽/枸杞结果一致(图5-a),表明植物底物特性会影响PFE酪氨酸酶抑制活性。然而枸杞发酵提取物的TPC和TFC含量并无优势,因此酚及黄酮物质并非本文发酵产品中抑制酪氨酸酶活性的主要活性物质。多糖和有机酸能够通过与铜辅基结合抑制酪氨酸酶活性[28]。此外,抗氧化剂如4-乙烯基愈创木酚等能够通过拮抗氧对酪氨酸酶的激活作用抑制酪氨酸酶活性[29]。因此,植物发酵提取物可以通过多因素协同作用抑制酪氨酸酶活性。
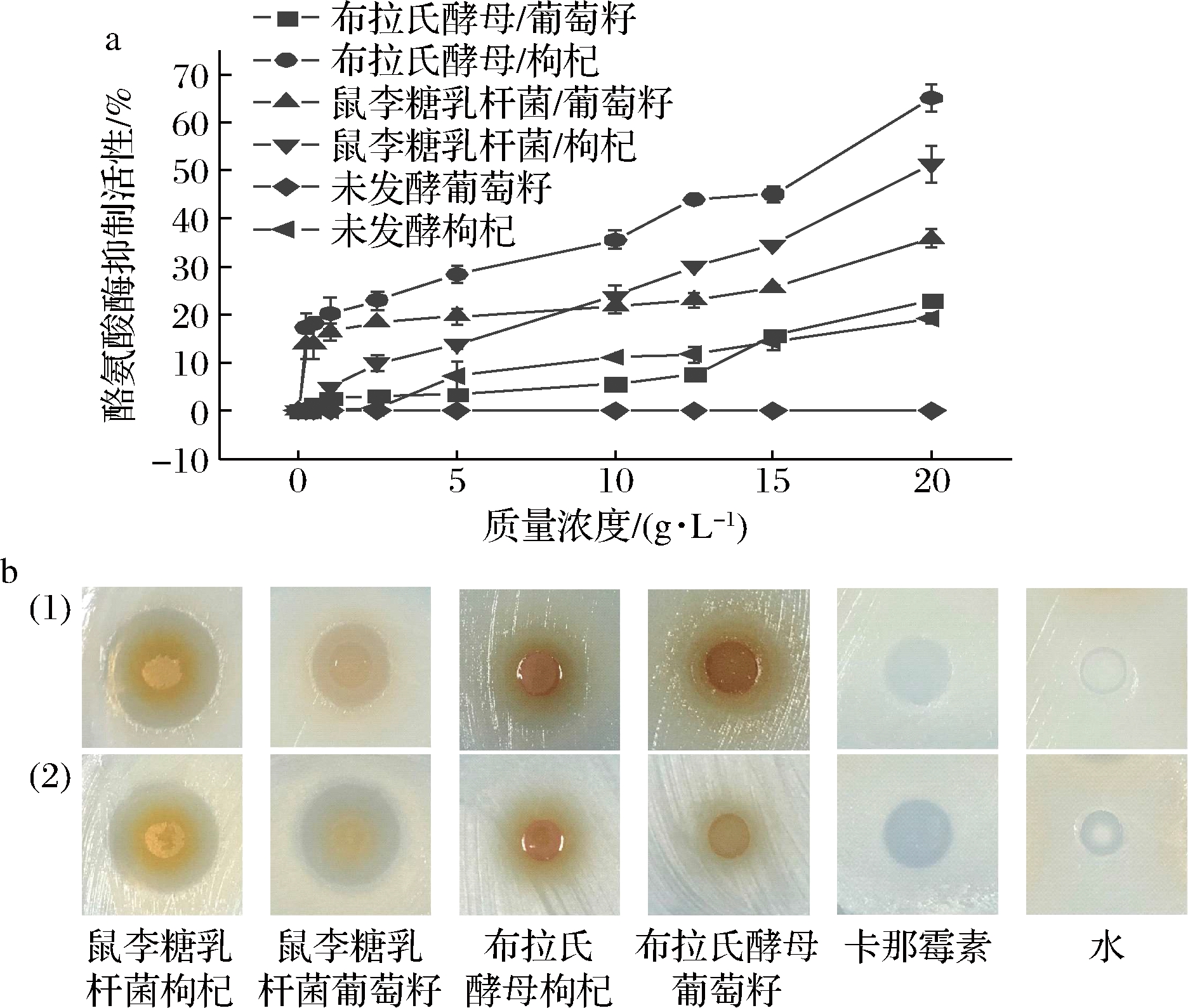
a-酪氨酸酶抑制活性;b-抑菌圈实验照片图[(1)-大肠杆菌; (2)-金黄色葡萄球菌]
图5 植物发酵提取物酪氨酸酶抑制活性及抑菌活性
Fig.5 Tyrosinase inhibitory activity and bacteriostatic activity of PFE
2.4.3 抑菌活性
鼠李糖乳杆菌组抑菌活性整体优于酵母组,对大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别为(17.3±0.6)和(16.7±0.3)mm(鼠李糖乳杆菌发酵枸杞)(表3)。橙花叔醇、2,3,5-三甲基吡嗪、2,4-二叔丁酚、乙酸、丙二酸、正戊酸等通过发酵积累,是PFE中主要抑菌成分。此外,鼠李糖乳杆菌合成有机酸有助于提高PFE抑菌活性,发酵后葡萄籽和枸杞中有机酸相对含量由8.2%和4.5%提高到49.0%和54.7%。研究发现含有相同质量浓度槲皮素的植物提取物对蜡状芽孢杆菌抑制能力显著优于槲皮素纯物质,相同pH值的乙酸或乳酸却没有抑菌活性[30]。表明发酵提取物抑菌能力并非仅受单一因素影响,而是多种活性成分协同作用的结果。
表3 植物发酵提取物抑菌圈直径
Table 3 Diameter of antibacterial circle of PFE
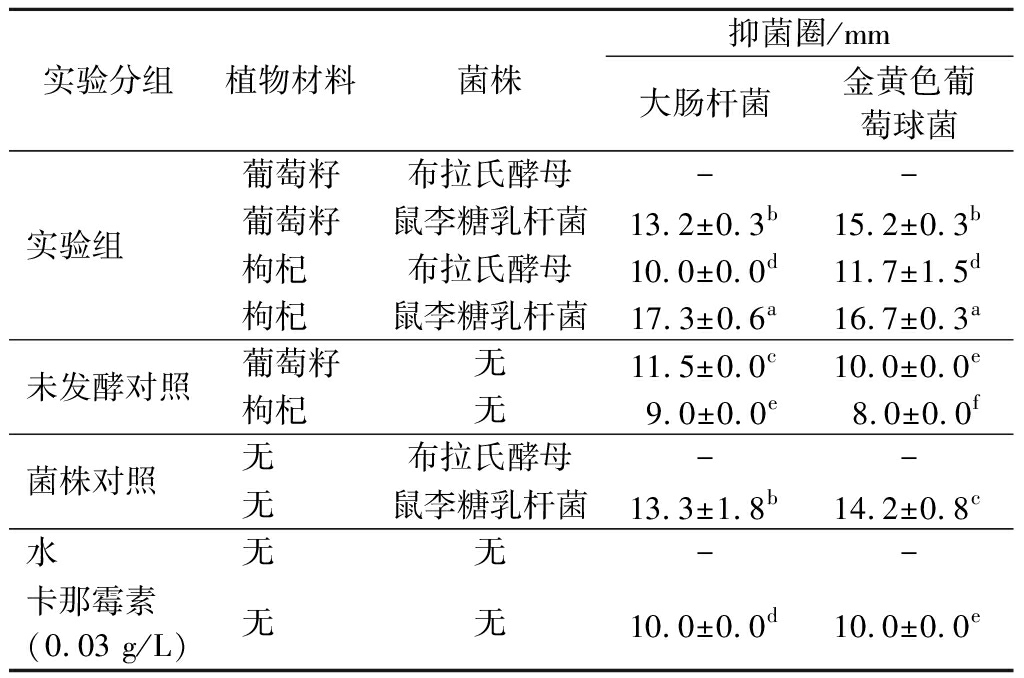
实验分组植物材料菌株抑菌圈/mm大肠杆菌金黄色葡萄球菌实验组葡萄籽布拉氏酵母--葡萄籽鼠李糖乳杆菌13.2±0.3b15.2±0.3b枸杞布拉氏酵母10.0±0.0d11.7±1.5d枸杞鼠李糖乳杆菌17.3±0.6a16.7±0.3a未发酵对照葡萄籽无11.5±0.0c10.0±0.0e枸杞无9.0±0.0e8.0±0.0f菌株对照无布拉氏酵母--无鼠李糖乳杆菌13.3±1.8b14.2±0.8c水无无--卡那霉素(0.03 g/L)无无10.0±0.0d10.0±0.0e
3 结论与讨论
本文筛选到2种高抗氧化活性植物材料并与布拉氏酵母、鼠李糖乳杆菌组合发酵。葡萄籽/枸杞诱导菌株分泌蛋白酶和/或脂肪酶和/或β-葡萄糖苷酶参与生物转化作用,提高了PFE中活性物质含量及其功能活性,改变了挥发性化合物组成及比例:4-乙烯愈创木酚、橙花醇、2,3,5-三甲基吡嗪、壬酸等挥发性活性化合物有所提高。不同PFE中活性物质种类、含量及其功能活性有较大差异,其DPPH自由基清除率和·OH清除率最高可达(75.2±3.0)%(布拉氏酵母/葡萄籽PFE)和(93.1±1.0)%(鼠李糖乳杆菌/枸杞PFE),酪氨酸酶抑制活性有显著提高(P<0.05),鼠李糖乳杆菌/枸杞PFE对大肠杆菌和金黄色葡萄球菌抑菌圈直径均在16.0 mm以上。综上所述,本文中PFE可作为潜在的抗氧化、美白和抑菌成分。
[1] TUTEL’IAN V A, LASHNEVA N V.Biologically active substances of plant origin.Flavonols and flavones:Prevalence, dietary sourses and consumption[J].Voprosy Pitaniia, 2013, 82(1):4-22.
[2] GHOSH K, RAY M, ADAK A, et al.Microbial, saccharifying and antioxidant properties of an Indian rice based fermented beverage[J].Food Chemistry, 2015, 168:196-202.
[3] BUNSE M, MAIL NDER L K, LORENZ P, et al.Evaluation of Geum urbanum L.extracts with respect to their antimicrobial potential[J].Chemistry & Biodiversity, 2022, 19(2):e202100850.
NDER L K, LORENZ P, et al.Evaluation of Geum urbanum L.extracts with respect to their antimicrobial potential[J].Chemistry & Biodiversity, 2022, 19(2):e202100850.
[4] CHEN Y M, SHIH T W, CHIU C P, et al.Effects of lactic acid bacteria-fermented soy milk on melanogenesis in B16F0 melanocytes[J].Journal of Functional Foods, 2013, 5(1):395-405.
[5] WILLIAMS I S, CHIB S, NUTHAKKI V K, et al.Biotransformation of chrysin to baicalein:Selective C6-hydroxylation of 5, 7-dihydroxyflavone using whole yeast cells stably expressing human CYP1A1 enzyme[J].Journal of Agricultural and Food Chemistry, 2017, 65(34):7 440-7 446.
[6] 程思佳, 李顺祥.生物转化技术在中药和天然药物开发中的应用进展[J].世界中医药, 2021, 16(13):2 051-2 057.
CHENG S J, LI S X.Application progress of biotransformation technology in development of Chinese medicinal and natural medicine[J].World Chinese Medicine, 2021, 16(13):2 051-2 057.
[7] ZHU X J, MAO Y, GUO M, et al.Enhancement of anti-acne effect of Scutellaria baicalensis extract by fermentation with symbiotic fungus Penicillium decumbens[J].Journal of Bioscience and Bioengineering, 2020, 130(5):457-463.
[8] SHAKYA S, DANSHIITSOODOL N, SUGIMOTO S, et al.Anti-oxidant and anti-inflammatory substance generated newly in paeoniae Radix alba extract fermented with plant-derived Lactobacillus brevis 174A[J].Antioxidants (Basel, Switzerland), 2021, 10(7):1071.
[9] WANG L, LUO Y, WU Y N, et al.Fermentation and complex enzyme hydrolysis for improving the total soluble phenolic contents, flavonoid aglycones contents and bio-activities of guava leaves tea[J].Food Chemistry, 2018, 264:189-198.
[10] ISLAM T, YU X, BADWAL T S, et al.Comparative studies on phenolic profiles, antioxidant capacities and carotenoid contents of red goji berry (Lycium barbarum) and black goji berry (Lycium ruthenicum)[J].Chemistry Central Journal, 2017, 11(1):59.
[11] 谢东东, 张楠, 孙英淇.不同种类水果酵素发酵特性及抗氧化特性的比较[J].河南工业大学学报(自然科学版), 2022, 43(1):35-41.
XIE D D, ZHANG N, SUN Y Q.Comparative study on fermentation and antioxidant properties of different kinds of fruit enzymes[J].Journal of Henan University of Technology (Natural Science Edition), 2022, 43(1):35-41.
[12] KONDO S, TAKAHASHI T, YOSHIDA K, et al.Inhibitory effects of autolysate of Leuconostoc mesenteroides isolated from kimoto on melanogenesis[J].Journal of Bioscience and Bioengineering, 2012, 114(4):424-428.
[13] 梅源, 唐佳颖, 何惠容, 等.霉豆瓣中优势微生物蛋白酶活性测定[J].食品与发酵工业, 2017, 43(9):130-136.
MEI Y, TANG J Y, HE H R, et al.Determination of protease activity of dominant microorganism from moldy bean[J].Food and Fermentation Industries, 2017, 43(9):130-136.
[14] 郑小梅. 脂肪酶产生菌的筛选及其脂肪酶基因的克隆[D].北京:中国农业科学院, 2009.
ZHENG X M.Screening of lipase producing strains and cloning of lipase genes[D].Beijing:Chinese Academy of Agricultural Sciences, 2009.
[15] 曾钰, 熊亮, 李洁, 等.UTH1基因破坏提高重组酿酒酵母分泌β-葡萄糖苷酶[J].菌物学报, 2018, 37(11):1 479-1 488.
ZENG Y, XIONG L, LI J, et al.Disruption of UTH1 improves β-glucosidase secretion by the recombinant Saccharomyces cerevisiae[J].Mycosystema, 2018, 37(11):1 479-1 488.
[16] LI Z, LEE J, CHO M H.Antioxidant, antibacterial, tyrosinase inhibitory, and biofilm inhibitory activities of fermented rice bran broth with effective microorganisms[J].Biotechnology and Bioprocess Engineering, 2010, 15(1):139-144.
[17] 付依依, 王永霞, 张笑莹, 等.植物乳杆菌发酵对沙棘原浆主要成分、抗氧化性及挥发性物质的影响[J].中国酿造, 2022, 41(2):125-131.
FU Y Y, WANG Y X, ZHANG X Y, et al.Effects of Lactobacillus plantarum fermentation on main components, antioxidant and volatile substances of sea buckthorn pulp[J].China Brewing, 2022, 41(2):125-131.
[18] 许英瑞, 朱妍丽, 薛元泰, 等.黑枸杞多糖的提取及其对副干酪乳杆菌L9、嗜热链球菌G2生长特性及抗氧化能力的影响[J].食品与发酵工业, 2021, 47(17):179-185.
XU Y R, ZHU Y L, XUE Y T, et al.Optimized ultrasonic extraction of Lycium ruthenicum polysaccharides and its effect on the growth and antioxidant capacity of Lactobacillus paracasei I9 and Streptococcus thermophilus G2[J].Food and Fermentation Industries, 2021, 47(17):179-185.
[19] PEDROSE M M, GUILLAMMON E, ARRIBAS C.Autoclaved and extruded legumes as a source of bioactive phytochemicals:A review[J].Foods, 2021, 10(2):379.
[20] 孙慧峰, 朱钧溢, 国立东, 等.乳酸菌生物转化药食同源植物活性成分研究进展[J].食品工业科技:2022, 43(7):474-481.
SUN H F, ZHU J Y, GUO L D, et al.Research progress on biotransformation of lactic acid bacteria on active ingredients from homologous plants of medicine and food[J].Science and Technology of Food Industry:2022, 43(7):474-481.
[21] 刘梦培, 李佳, 纵伟, 等.乳酸菌和酵母菌发酵对杜仲雄花茶汁品质及抗氧化活性的影响[J].中国酿造:2020, 39(5):71-76.
LIU M B.LI J, ZONG W, et al.Effects of lactic acid bacteria and yeast fermentation on the quality and antioxidant activity of male Eucommia ulmoides flower tea juice[J].China Brewing, 2020, 39(5):71-76.
[22] 郭怡, 马倩, 李小杰, 等.乳酸菌生物转化南瓜多糖抗氧化活性的初步研究[C].中国食品科学技术学会第十八届年会摘要集, 2022:215-216.
GUO Y, MA Q, LI X J, et al.Preliminary study on the antioxidant activity of lactic acid bacteria biotransforming pumpkin polysaccharides[C].Abstracts of the 18th Annual Meeting of the National Society for Food Science and Technology, 2022:215-216.
[23] 邹谋勇, 何理琴, 孙启星, 等.产4-乙基愈创木酚酵母的鉴定及其在酱油中的应用[J].食品科学, 2021, 42(12):138-144.
ZOU M Y, HE L Q, SUN Q X, et al.Identification of 4-ethylguaiacol producing yeast and its application in soy sauce brewing[J].Food Science, 2021, 42(12):138-144.
[24] DHARNI S, SANCHITA, MAURYA A, et al.Purification, characterization, and in vitro activity of 2,4-di-tert-butylphenol from Pseudomonas monteilii PsF84:Conformational and molecular docking studies[J].Journal of Agricultural and Food Chemistry, 2014, 62(26):6 138-6 146.
[25] 唐学超, 魏春, 袁围, 等.细胞凋亡调控因子BCL-2促进工程酵母合成橙花叔醇[J].食品与发酵工业, 2022, 48(4):10-15.
TANG X C, WEI C, YUAN W, et al.Apoptosis regulator BCL-2 promotes synthesis of nerolidol in engineered yeast[J].Food and Fermentation Industries, 2022, 48(4):10-15.
[26] 卫洁, 孙斌, 王立志, 等.2,3,5-三甲基吡嗪的合成研究进展[J].山东化工, 2014, 43(9):32-34.
WEI J, SUN B, WANG L Z, et al.Progress in the synthesis of 2,3,5-trimethylpyrazine[J].Shandong Chemical Industry, 2014, 43(9):32-34.
[27] BAUMANN L, BRUDER S, KABISCH J, et al.High-Throughput screening of an octanoic acid producer strain library enables detection of new targets for increasing titers in Saccharomyces cerevisiae[J].Acs Synthetic Biology, 2021, 10(5):1 077-1 086.
[28] 赵春萌.酪氨酸酶抑制剂筛选及花椒抗氧化、酪氨酸酶抑制活性研究[D].甘肃:兰州理工大学, 2014.
ZHAO C M.Screening of tyrosinase inhibitors and the prelimary research on the antioxidant and tyrosinase inhibition activities of Zanthoxylum bungeanum Maxim[D].Gansu:Lanzhou University of Technology, 2014.
[29] LIN Y, YANG T, SHEN L, et al.Study on the properties of Dendrobium officinale fermentation broth as functional raw material of cosmetics[J].Journal of Cosmetic Dermatol, 2022, 21(3):1 216-1 223.
[30] RYU J Y, KANG H R, CHO S K.Changes over the fermentation period in phenolic compounds and antioxidant and anticancer activities of blueberries fermented by Lactobacillus plantarum[J].Journal of Food Science, 2019, 84(8):2 347-2 356.