贝莱斯芽孢杆菌(Bacillus velezensis)是2005年由RUIZ-GARC A等[1]发现,为革兰氏阳性好氧细菌,内生孢子,是芽孢杆菌属(Bacillus)的新种,一种新型细菌[2]。近年来国内外对贝莱斯芽孢杆菌的研究越来越多,主要集中在生物防治[3]、药物研发[4]、食品发酵[5]和工业酶制剂[6-7]等领域。贝莱斯芽孢杆菌来源非常广泛,不同生境分离得到的贝莱斯芽孢杆菌功能也不完全相同[8],有研究表明贝莱斯芽孢杆菌L-1对梨灰霉和青霉病菌有抑制作用,能引起病原菌菌丝膨大、畸形[9]。贝莱斯芽孢杆菌RJW-5-5能够抑制禾旋孢腔菌(Cochlioboluss ativus)、辣椒疫霉病菌(Phytophthora capsici)和梨黑斑病菌(Alternaria kikuchiana Tanaka)等多种农作物病害,具有多种羊毛硫抗生素、套索肽、细菌素等抗菌肽基因簇[10]。而来自发酵海洋鱼酱油中的贝莱斯芽孢杆菌SW5对食品中多种常见病原菌具有明显的抑菌活性,发酵上清液中含有多种抑菌物质[11]。
A等[1]发现,为革兰氏阳性好氧细菌,内生孢子,是芽孢杆菌属(Bacillus)的新种,一种新型细菌[2]。近年来国内外对贝莱斯芽孢杆菌的研究越来越多,主要集中在生物防治[3]、药物研发[4]、食品发酵[5]和工业酶制剂[6-7]等领域。贝莱斯芽孢杆菌来源非常广泛,不同生境分离得到的贝莱斯芽孢杆菌功能也不完全相同[8],有研究表明贝莱斯芽孢杆菌L-1对梨灰霉和青霉病菌有抑制作用,能引起病原菌菌丝膨大、畸形[9]。贝莱斯芽孢杆菌RJW-5-5能够抑制禾旋孢腔菌(Cochlioboluss ativus)、辣椒疫霉病菌(Phytophthora capsici)和梨黑斑病菌(Alternaria kikuchiana Tanaka)等多种农作物病害,具有多种羊毛硫抗生素、套索肽、细菌素等抗菌肽基因簇[10]。而来自发酵海洋鱼酱油中的贝莱斯芽孢杆菌SW5对食品中多种常见病原菌具有明显的抑菌活性,发酵上清液中含有多种抑菌物质[11]。
益生菌是一类能够在宿主体内存活并发挥有益作用的微生物,具有维持肠黏膜屏障,调节免疫功能和促进营养物质的代谢吸收等重要功能[12]。具有酸和胆汁的耐受性,是益生菌在小肠中生存和发挥益生作用的重要因素[13]。抗生素敏感、抑制肠道中的致病菌生长,调节肠道菌群平衡,也是益生潜力评价的重要环节[14-15]。本实验室从农家酱中分离得到的一株有抑菌活性的分离株PJP10,对其进行生理生化和16S rDNA测序比对分析。通过耐受性测定、抗氧化活性分析和安全性试验来评价该菌株的益生潜力,为其在食品方面的开发和应用提供研究基础。
1 材料与方法
1.1 材料与设备
1.1.1 实验材料
农家酱,市售。
指示菌:肠炎沙门氏菌、大肠杆菌、金黄色葡萄球菌、粪肠球菌、酿酒酵母、白色念珠菌、黑曲霉,本实验室保存;铜绿假单胞菌、蜡样芽孢杆菌、单增李斯特菌,上海嘉楚生物工程有限公司;副溶血性弧菌,北纳生物技术研究院;青枯雷尔氏菌(辣椒青枯病病原菌)、黄单胞杆菌(柑橘溃疡病病原菌)、刺盘孢菌(梨炭疽病病原菌),江西农业大学农学院果蔬保藏实验室。
胰蛋白胨、琼脂粉、蛋白胨,生工生物工程(上海)股份有限公司;酵母膏、NaCl,天津市福晨化学试剂厂;DPPH、ABTS、三吡啶三吖嗪(tripyridine triazine, TPTZ)、过硫酸钾,美国Sigma公司;16种药敏纸片,杭州滨河微生物试剂有限公司;其他常规试剂采用进口分装或国产分析纯级。
1.1.2 培养基
LB培养基(g/L):NaCl 10.0、蛋白胨10.0、酵母粉5.0。固体培养基另加2%(质量分数)琼脂粉,121 ℃,灭菌20 min后备用。
不同pH培养基:用稀HCl溶液和NaOH溶液将LB培养基的pH调为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,灭菌备用。
高盐培养基:LB培养基中NaCl质量分数调整为8%,灭菌备用。
胆盐培养基:LB培养基中加入胆盐,使胆盐的质量分数分别为0.1%、0.3%、0.5%,灭菌备用。
1.1.3 仪器与设备
FA2104电子天平,上海菁海仪器有限公司;SW-CJ洁净工作台,苏州安泰空气技术有限公司;立式压力蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;Spcord200紫外可见分光光度计,德国耶拿分析仪器股份有限公司;HC-2518R高速冷冻离心机,湖南湘仪实验室仪器开发有限公司。
1.2 实验方法
1.2.1 菌株的分离
称取农家酱5 g,加入100 mL灭菌水,180 r/min摇床振荡20 min,制成菌悬液,吸取1 mL菌悬液进行梯度稀释,分别取10-3、10-4、10-5三个梯度均匀涂布在LB固体平板上,30 ℃培养48 h后挑取单菌落,纯化至纯培养保存,此为分离菌。
1.2.2 菌种活化与培养
从-80 ℃冰箱中取出冻存的菌液,划线到LB固体平板,37 ℃培养箱过夜培养,然后取培养好的单菌落转接至50 mL LB液体培养基中,37 ℃、180 r/min摇床培养36 h,作为种子液。
无菌发酵液制备:以2%接种量(体积分数,下同)转接种子液至250 mL LB液体培养基中,37 ℃、180 r/min培养36 h,4 ℃、10 000 r/min离心10 min,收集上清液,并用0.22 μm滤膜过滤,作为无菌发酵液。
1.2.3 菌株的筛选和鉴定
以金黄色葡萄球菌为指示菌,制备成菌悬液(1×108 CFU/mL),均匀涂布到LB固体平板上,晾干后,加入5 μL分离菌种子液,30 ℃培养1~2 d,选取能产生抑菌圈的分离菌进行革兰氏染色和16S rDNA测序。
采用16S rDNA测序法鉴定PJP10菌株,选择通用引物27F(5′-GTTTGATCMTGGCTCAG-3′)和1492R(5′-TACGGYTACCTTGTTACGACTT-3′)进行PCR扩增,PCR产物送生工生物工程(上海)股份有限公司进行测序分析,使用MEGA 5.1软件进行系统发育树构建。
1.2.4 PJP10菌株的耐受性评价
1.2.4.1 pH耐受性
按2%接种量将活化后的PJP10种子液接种到不同pH的LB液体培养基中,37 ℃,180 r/min培养36 h后,测定不同pH值培养的OD600。
1.2.4.2 高盐耐受性
按2%接种量转接种子液到高盐培养基,37 ℃培养36 h,平板菌落计数检测其盐耐受性。
1.2.4.3 高温耐受性
参考刘秀侠等[16]的测定方法,略作修改。将2瓶种子液分别于80和100 ℃水浴10 min,以10%的接种量转接至新鲜的LB液体培养基中,37 ℃培养,测定0和36 h的OD600,判断其耐热性。
1.2.4.4 胆盐耐受性
以10%的接种量,将种子液分别接种至含0.1%、0.3%、0.5%胆盐的LB培养基中,37 ℃水浴4 h,平板菌落计数检测胆盐耐受性。
1.2.4.5 胃肠液耐受性
以10%的接种量,将种子液分别接种于人工胃液和人工肠液[17]中,37 ℃水浴3 h,平板菌落计数分别检测胃液和肠液中PJP10菌株的耐受性。
1.2.4.6 抗生素耐受性
采用K-B纸片扩散法(Kirby-Bauer disk diffusion method)测定抗生素敏感性,将种子液用生理盐水梯度稀释,将菌浓度稀释到1×108CFU/mL,再吸取50 μL稀释后的菌液均匀涂布在LB固体培养基上,晾干后分别将16种抗生素药敏纸片放入平板中,37 ℃培养24 h后,观察抑菌效果并测量抑菌圈直径。
1.2.5 PJP10菌株的抑菌能力测定
将活化好的指示菌种子液,采用梯度稀释法用生理盐水稀释至所需的菌悬液浓度(1×108 CFU/mL)。取50 μL指示菌悬液,细菌涂布于LB固体平板上,真菌涂布于PDA平板上。抑制细菌试验采用打孔法,在各孔内分别加入100 μL PJP10无菌发酵液,以100 μL无菌LB液体培养基为阴性对照,37 ℃培养24 h后观察并测量抑菌圈直径。拮抗真菌试验在涂好指示菌的平板上滴加5 μL PJP10种子液,以5 μL无菌LB液体培养基为阴性对照,30 ℃培养3~5 d,观察并测量抑菌圈直径。
1.2.6 PJP10菌株自由基清除能力测定
ABTS阳离子自由基清除能力:参考孟歌等[18]的测定方法,略作改动。用去离子水稀释ABTS阳离子母液,稀释至其OD734=0.70左右,30 ℃避光平衡30 min,得到ABTS阳离子工作液。吸取200 μL无菌发酵液,加入2.0 mL ABTS阳离子工作液,混匀后25 ℃避光放置20 min,于734 nm处测定吸光值,ABTS阳离子自由基的清除率按公式(1)计算。
ABTS阳离子自由基清除率![]()
(1)
式中:A样品、A空白和A对照分别是样品组、样品空白组(以去离子水替代ABTS溶液)和对照组(去离子水替代样品)的吸光值。
DPPH自由基清除能力:参考TANG等[19]的测定方法,略作改动。吸取2.0 mL无菌发酵液加入到2.0 mL DPPH(0.2 mmol/L)溶液中,混匀后25 ℃避光反应30 min,于517 nm处测定吸光值。DPPH自由基的清除率按公式(2)计算。
DPPH自由基清除率![]()
(2)
式中:A样品、A空白和A对照分别是样品组、样品空白组(以无水乙醇替代DPPH溶液)和对照组(以无水乙醇替代样品)的吸光值。
1.2.7 铁离子还原能力的测定
参考BENZIE等[20]的测定方法,略作改动。首先取2.5 mL TPTZ溶液(0.01 mol/L)和25.0 mL醋酸-醋酸钠缓冲液(pH 3.6,0.3 mol/L),与2.5 mL FeCl3(0.02 mol/L)溶液充分混匀,即得FRAP(ferric reducing antioxidant power,FRAP)工作液。
绘制标准曲线:取0.5 mL浓度分别为0.025、0.1、0.15、0.2、0.4、0.5、0.8、1.0、1.5 mmol/L的FeSO4溶液与3.0 mL FRAP工作液混合,37 ℃保温15 min,于593 nm处测定吸光值。以反应体系中FeSO4浓度为纵坐标,吸光值为横坐标绘制标准曲线,计算回归方程为 y=3.695x+0.006,R2=0.994 6。
取0.5 mL无菌发酵液,加入3.0 mL FRAP工作液,37 ℃保温15 min,于593 nm处测定吸光值。
A样品-A空白-A对照的差值通过回归方程计算,获得FeSO4的浓度,即为FRAP值。A样品、A空白和A对照分别是样品组、样品空白组(以去离子水替代FRAP溶液)和对照组(去离子水替代样品)的吸光值。
1.2.8 亚铁离子螯合能力的测定
参考DECKER等[21]的测定方法,略作改动。吸取1.0 mL无菌发酵液与1.0 mL FeSO4溶液(2.0 mmol/L)混合,加入0.2 mL菲咯嗪溶液(5.0 mmol/L),充分混匀后25 ℃保温10 min,于562 nm处测定吸光值。亚铁离子螯合率按公式(3)计算。
亚铁离子螯合率![]()
(3)
式中:A样品、A空白和A对照分别是样品组、样品空白组(以去离子水替代菲咯嗪溶液)和对照组(去离子水替代样品)的吸光值。
1.2.9 安全性试验
溶血实验:参考矫艳平等[22]的测定方法,并进行修改。取100 μL PJP10菌株的无菌发酵液采用打孔法加在血平板上,放于37 ℃培养箱中静置24 h,观察有无溶血圈,以具有溶血性的蜡样芽胞杆菌ATCC 14579无菌发酵液为阳性对照。
饲喂实验:参考于景艳等[23]的测定方法,并进行修改。试验所需的彭泽鲫(Carassius auratus var.Pengze)鱼苗采购自江西省南昌市水产鱼苗养殖基地,在室内驯养1周后,选取初始体长(8±0.5)cm,健康无病无伤45尾,随机分为3个组,每组15尾鱼,每组一个养殖容器(45 cm×32 cm×26 cm的周转箱)开始实验,实验期间,充氧机充分曝气,每隔1 d换一次水。每天正常投喂饲料一次,投喂饲料分别为添加1×106和1×108 CFU/g的PJP10的通威鱼用膨化饲料181号,并以不添加PJP10的通威181号饲料为对照,喂养21 d,观察鱼的生长状态并计算各组鱼的死亡率。
1.2.10 数据分析
实验数据使用Excel 2019软件整理,使用SPSS 25.0软件统计分析,实验结果采用平均值±标准差表示,每组设置3组平行,实验重复3次。
2 结果与分析
2.1 PJP10菌株的分离与鉴定
以金黄色葡萄球菌为指示菌,筛选到一株具有明显拮抗活性的分离菌PJP10(图1-a)。分离菌PJP10在LB固体平板,于37 ℃培养箱培养24 h后,菌落呈浅黄色,圆形,边缘光滑,表面湿润(图1-b)。培养48 h进行革兰氏染色为阳性,菌体细胞成杆状,部分细菌可生成椭圆形芽孢(图1-c)。

a-抑菌圈;b-菌落形态;c-菌体形态(16×100)
图1 菌株PJP10的形态特征
Fig.1 Morphological characteristics of the PJP10
根据测序结果可知,分离株PJP10的16S rDNA序列长度为1 496 bp,将16S rDNA基因序列通过美国国家生物技术信息中心(NCBI)进行BLAST比对分析,发现其与Bacillus velezensis GS-1、Bacillus velezensis 504的16S rDNA的基因序列最为相似,同源性达99.67%。与Bacillus siamensis B268、Bacillus methylotrophicus IHB B 18137、Bacillus vallismortis Dc-02、Bacillus mojavensis RHPR20、Bacillus amyloliquefaciens SF14同源性分别为99.60%、99.53%、99.47%、99.46%和99.40%。利用MEGA5.1软件的Neighbor-Joining法构建系统发育树,结果显示分离株PJP10与Bacillus velezensis GS-1位于同一分支,根据序列比对分析,形态学和生理生化鉴定结果,初步确定分离株PJP10为Bacillus velezensis,命名为贝莱斯芽孢杆菌PJP10(Bacillus velezensis PJP10)(图2)。

图2 菌株PJP10基于16S rDNA序列构建的系统发育树
Fig.2 Phylogenetic tree of the PJP10 based on 16S rDNA sequence
注:括号内为菌株的16S rDNA序列在GenBank中的登录号; 分支结点处数字为Bootstrap值;标尺的数据为进化距离
2.2 PJP10菌株的耐受性评价
由表1可知,PJP10菌株可以耐受8%(质量分数)的高盐环境,培养36 h其生长浓度可以达到++(5×107 CFU/mL)。胆盐对PJP10菌株的生长有明显的抑制作用,0.1%的胆盐环境PJP10菌株的生长浓度可达到+++(108CFU/mL),在0.3%和0.5%的胆盐环境下,其生长浓度分别降到++(5×107 CFU/mL)和+(107 CFU/mL),由此可见PJP10菌株对胆盐敏感,虽然生长活力减弱,但是依然具备在胆盐环境下生长的能力。
PJP10菌株种子液分别经80和100 ℃水浴10 min后,转接培养36 h,其发酵液菌浓度依然可以培养至++和+,可见PJP10菌株形成的芽孢对高温环境的耐受性很强。
弱酸和弱碱性的培养环境对PJP10菌株的生长没有抑制作用,直到培养环境pH 9时,其生长浓度降为++,在pH 2、pH 3和pH 10等强酸和强碱的培养环境中,PJP10菌株的生长浓度为+,模拟的胃液和肠液环境对PJP10菌株的生长都有抑制作用,其生长浓度分别为++和+,由此表明,低pH对PJP10菌株的活力有抑制作用,但是PJP10菌株的生长也表现了其对低pH具有很好的耐受性。
表1 菌株PJP10的耐受性试验结果
Table 1 Results of tolerance tests of the PJP10
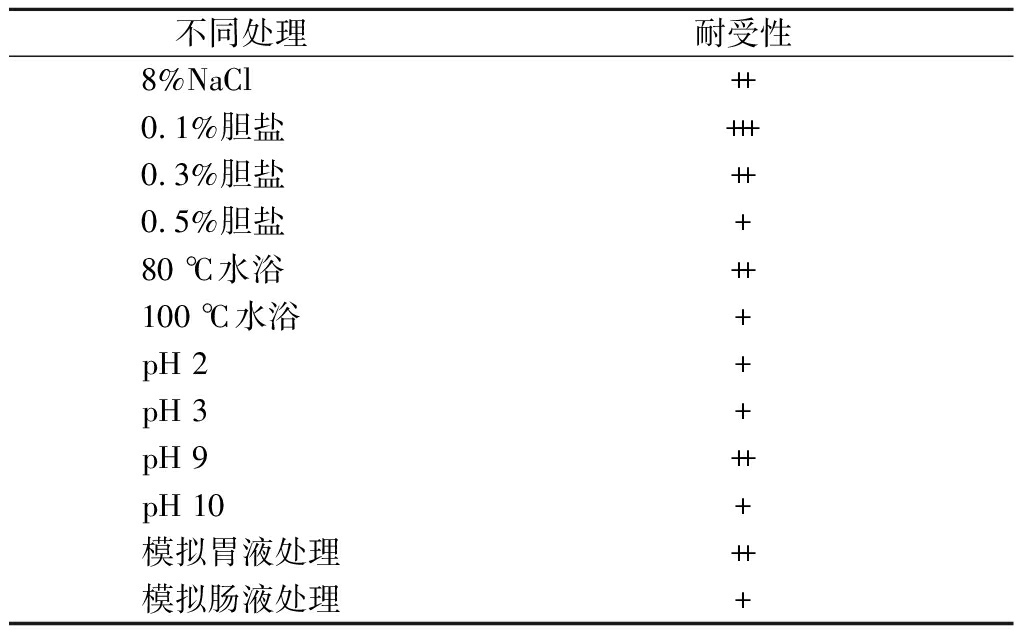
不同处理耐受性8%NaCl++0.1%胆盐+++0.3%胆盐++0.5%胆盐+80 ℃水浴++100 ℃水浴+pH 2+pH 3+pH 9++pH 10+模拟胃液处理++模拟肠液处理+
注:“+++”表示菌浓度≥108 CFU/mL,++表示菌浓度≥5×107 CFU/mL,+表示≥107 CFU/mL
PJP10菌株对于大观霉素、阿奇霉素和庆大霉素等16种不同抗生素的敏感性测定结果如表2所示。PJP10菌株仅对青霉素G和阿莫西林表现出耐药,对其余14种抗生素均表现敏感。朱亚珠等[11]分离的贝莱斯芽孢杆菌SW5,对β-内酰胺类抗生素和氯霉素表现敏感,对多粘菌素B与克林霉素表现耐药。贝莱斯芽孢杆菌抗生素敏感这一特性为其在食品开发领域创造了条件和基础。
表2 菌株PJP10抗生素敏感性结果
Table 2 Results of antibiotic susceptibility of the PJP10

抗生素种类纸片含量/(μg·片-1)抑菌圈大小/cm敏感/耐药青霉素G10-R阿米卡星302.8S左氟沙星53.2S大观霉素1001.7S阿奇霉素151.4S庆大霉素102.4S复方新诺明23.752.8S头孢唑林303.1S头孢曲松302.7S林可霉素21S苯唑西林11.7S头孢拉定304S诺氟沙星102.4S强力霉素303S阿莫西林10-R氨苄西林101.5S
注:R为耐药,S为敏感
2.3 PJP10菌株的抑菌能力
通过菌株拮抗实验测定PJP10无菌发酵液对病原菌的拮抗能力,结果显示PJP10抑菌谱广,对革兰氏阴性及阳性细菌都表现出拮抗活性,特别是对金黄色葡萄球菌、肠炎沙门氏菌、副溶血性弧菌、青枯雷尔氏菌的拮抗效果显著,对大肠杆菌、单增李斯特菌、铜绿假单胞菌和粪肠球菌也有拮抗活性,对黑曲霉、刺盘孢菌、白色念珠菌、酿酒酵母等真菌同样具有拮抗活性(表3)。
2.4 PJP10菌株的抗氧化能力
PJP10菌株的抗氧化能力如表4所示,ABTS经氧化能生成稳定的蓝绿色ABTS阳离子,当遇到具有抗氧化活性的物质时,ABTS阳离子会被还原,溶液颜色变浅,此特性被用来说明物质的抗氧化能力。解文利等[24]从四川泡菜中分离得到的6株植物乳杆菌中ABTS阳离子自由基清除率最高为(89.33±1.27)%。经测定,PJP10无菌发酵液对ABTS阳离子自由基的清除率达到了(95.66±3.1)%,表现出了较强的天然抗氧化活性。
DPPH自由基清除率通常用来评价益生菌的抗氧化活性,DPPH自由基被抗氧化剂还原后生成稳定的DPPH分子,颜色由深紫色变为淡黄色,因此可以通过颜色变化来判定物质的抗氧化能力。吴石金等[25]从传统发酵食品中分离得到的乳酸菌对DPPH自由基清除率均不超过30%。肖宇等[26]从藏灵菇中筛选得到的36株乳酸菌对DPPH自由基清除率最高为32.95%。经测定,PJP10无菌发酵液对DPPH自由基清除率为(44.81±2.2)%,由此可见,在未经优化的条件下,PJP10菌株表现出较强的DPPH自由基的清除能力。
表3 菌株PJP10对各指示菌的抑制作用
Table 3 Antimicrobial spectrum of the PJP10 against various indicator strains

分类指示菌名称菌株编号抑菌效果G-肠炎沙门氏菌(Salmonella enteritidis.)ATCC BAA708+++大肠杆菌(Escherichia coli)ATCC 35218++铜绿假单胞菌(Pseudomonas aeruginosa)ATCC 27853++副溶血弧菌(Vibrio parahaemolyticus)ATCC 17802+++黄单胞杆菌(Xanthomonas citri)KY2015+青枯雷尔氏菌(Ralstonia solanacearum)QK2013+++G+金黄色葡萄菌(Staphylococcus aureus)ATCC 25923+++单增李斯特菌(Listeria monocytogenes)ATCC 19115++蜡样芽孢杆菌(Bacillus cereus)ATCC 14579+粪肠球菌(Enterococcus faecalis)ATCC 29212++真菌酿酒酵母(Saccharomyces cerevisiae)ATCC 9763++白色念球菌(Candida albicans)ATCC 10231++黑曲霉(Aspergillus niger)ATCC 16404+++刺盘孢菌(Colletotrichum fructicola)TJ2020++
注:+++表示抑菌圈直径≥2.5 cm;++表示抑菌圈直径为1.5~2.5 cm;+表示抑菌圈直径为0.8~1.5 cm
表4 菌株PJP10的抗氧化活性
Table 4 Antioxidant activity of the PJP10
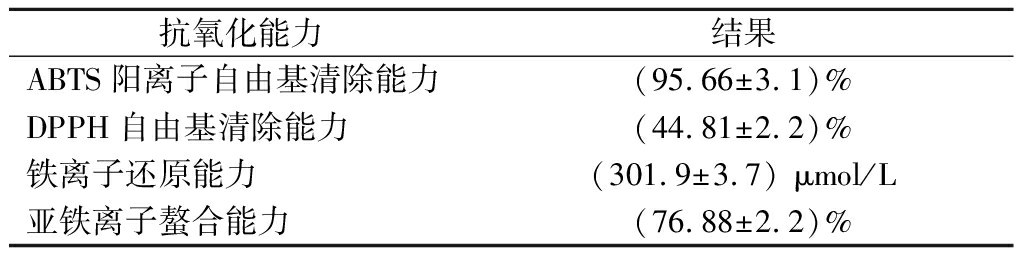
抗氧化能力结果ABTS阳离子自由基清除能力(95.66±3.1)%DPPH自由基清除能力(44.81±2.2)%铁离子还原能力(301.9±3.7) μmol/L亚铁离子螯合能力(76.88±2.2)%
铁离子还原能力是Fe3+被抗氧化物质还原成Fe2+,以供机体正常生长发育的能力。孟歌等[18]测定的药用灵芝具有较强的铁离子还原能力,在液体培养14 d后,铁离子还原能力达到峰值,为314.76 μmol/L。经测定,PJP10无菌发酵液铁离子还原能力为(301.9±3.7) μmol/L,表明了PJP10菌株同样具有较强的铁离子还原能力。
亚铁离子螯合能力已经被应用到工业上用于证明物质的抗氧化能力。李权威等[27]从风干羊肉中分离得到的24株乳酸菌的亚铁离子螯合率为22.20%~59.97%,平均螯合率为45.78%,其中螯合率最高为(59.97±0.02)%。经测定,PJP10无菌发酵液的亚铁离子螯合能力为(76.88±2.2)%,说明PJP10具有良好的亚铁离子螯合能力,具有通过清除体内自由基来实现抗氧化和预防疾病的潜力。
2.5 安全性试验结果
溶血试验结果如图3所示,阳性对照蜡样芽孢杆菌ATCC 14579的无菌发酵液在血平板培养基上培养24 h后出现明显的溶血圈,而菌株PJP10无溶血圈。

图3 菌株PJP10的溶血试验
Fig.3 Hemolysis test of the PJP10
由表5可知,通过连续给彭泽鲫饲喂含1×106和1×108 CFU/g PJP10的鱼饲料21 d,鲫鱼未出现异常,与对照组无明显差异,生理状态仍健康活泼,表明该菌株生物安全性较好,具备较好的益生潜力。
表5 菌株PJP10的安全性试验结果
Table 5 Results of safety test of the PJP10

处理试验用鱼/尾饲喂21 d后结果1×106 CFU/g15无病鱼死鱼,生长正常1×108 CFU/g15无病鱼死鱼,生长正常对照15无病鱼死鱼,生长正常
3 结论与讨论
贝莱斯芽孢杆菌在生物防治领域表现出来的潜力是近年来国内外研究的热点,研究表明贝莱斯芽孢杆菌是促进植物生长的根系微生物之一,其不仅能够通过直接分泌化合物促进植物生长,缓解压力,还能够通过自身分泌物诱导植物产生系统抗性,拮抗病原菌的反复入侵和病虫害压力[28-29]。从食品中分离得到贝莱斯芽孢杆菌的研究报道则相对较少,尤其对贝莱斯芽孢杆菌进行益生特性评价和抗氧化活性的研究更是鲜有报道。
本文以金黄色葡萄球菌、青枯雷尔氏菌、黑曲霉等多株细菌和真菌为指示菌,测定PJP10的抑菌活性和抑菌效果,结果显示PJP10对细菌和真菌都能表现出拮抗作用。耐受性测定实验表明PJP10可以耐受高盐、胆盐、高温、低pH培养和模拟的胃肠道消化液环境,在抗生素敏感性测定实验中对大多数抗生素表现敏感。抗氧化能力测定实验说明其对ABTS阳离子和DPPH自由基的清除效果较好,并且具有较强的铁离子还原能力和亚铁离子螯合能力,且无溶血性,彭泽鲫饲喂实验无病鱼死鱼现象,生物安全性较好。本实验室通过对天然发酵食品来源的贝莱斯芽孢杆菌PJP10进行了益生潜力评价和抗氧化活性分析,拓宽了贝莱斯芽孢杆菌的研究方向,为该菌在食品领域开发和应用提供了研究基础。
[1] RUIZ-GARC A C, BÉJAR V, MART
A C, BÉJAR V, MART NEZ-CHECA F, et al.Bacillus velezensis sp.nov., a surfactant-producing bacterium isolated from the river Vélez in Málaga, southern Spain[J].International Journal of Systematic and Evolutionary Microbiology, 2005, 55(1):191-195.
NEZ-CHECA F, et al.Bacillus velezensis sp.nov., a surfactant-producing bacterium isolated from the river Vélez in Málaga, southern Spain[J].International Journal of Systematic and Evolutionary Microbiology, 2005, 55(1):191-195.
[2] RABBEE M F, ALI M S, CHOI J, et al.Bacillus velezensis:A valuable member of bioactive molecules within plant microbiomes[J].Molecules (Basel, Switzerland), 2019, 24(6):1046.
[3] HASHEM A, TABASSUM B, FATHI ABD ALLAH E.Bacillus subtilis:A plant-growth promoting rhizobacterium that also impacts biotic stress[J].Saudi Journal of Biological Sciences, 2019, 26(6):1 291-1 297.
[4] CHEN X H, SCHOLZ R, BORRISS M, et al.Difficidin and bacilysin produced by plant-associated Bacillus amyloliquefaciens are efficient in controlling fire blight disease[J].Journal of Biotechnology, 2009, 140(1-2):38-44.
[5] SULTANA O F, LEE S, SEO H, et al.Biodegradation and removal of PAHs by Bacillus velezensis isolated from fermented food[J].Journal of Microbiology and Biotechnology, 2021, 31(7):999-1 010.
[6] LU M Y, GAO Z X, XING S Q, et al.Purification, characterization, and chemical modification of Bacillus velezensis SN-14 fibrinolytic enzyme[J].International Journal of Biological Macromolecules, 2021, 177:601-609.
[7] 陈龙, 吴兴利, 李立佳, 等.一株高产内切纤维素酶贝莱斯芽孢杆菌的产酶条件优化及酶学性质分析[J].中国畜牧兽医, 2019, 46(5):1 353-1 361.
CHEN L, WU X L, LI L J, et al.Optimization of enzyme production conditions and analysis of enzymatic properties of a high-yield endocellulolytic enzyme Bacillus velezensis[J].China Animal Husbandry & Veterinary Medicine, 2019, 46(5):1 353-1 361.
[8] 张德锋, 高艳侠, 王亚军, 等.贝莱斯芽孢杆菌的分类、拮抗功能及其应用研究进展[J].微生物学通报, 2020, 47(11):3 634-3 649.
ZHANG D F, GAO Y X, WANG Y J, et al.Advances in taxonomy, antagonistic function and application of Bacillus velezensis[J].Microbiology China, 2020, 47(11):3 634-3 649.
[9] 孙平平, 崔建潮, 贾晓辉, 等.贝莱斯芽孢杆菌L-1对梨灰霉和青霉病菌的抑制作用评价及全基因组分析[J].微生物学报, 2018, 58(9):1 637-1 646.
SUN P P, CUI J C, JIA X H, et al.Complete genome analysis of Bacillus velezensis L-1 and its inhibitory effect on pear gray and blue mold[J].Acta Microbiologica Sinica, 2018, 58(9):1 637-1 646.
[10] 任建雯, 罗云艳, 冯印印, 等.贝莱斯芽孢杆菌RJW-5-5的分离鉴定及细菌素、抗菌肽基因簇挖掘[J].微生物学通报, 2021, 48(3):742-754.
REN J W, LUO Y Y, FENG Y Y, et al.Isolation and identification of Bacillus velezensis RJW-5-5 and gene cluster mining of bacteriocin and RiPPs[J].Microbiology China, 2021, 48(3):742-754.
[11] 朱亚珠, 夏率博, 陈琳, 等.一株贝莱斯芽孢杆菌的生长特性及抑菌活性研究[J].食品科学技术学报, 2022, 40(1):85-92.
ZHU Y Z, XIA S B, CHEN L, et al.Study on growth characteristics and antimicrobial activities of Bacillus velezensis[J].Journal of Food Science and Technology, 2022, 40(1):85-92.
[12] 段云峰, 蔡峰, 律娜, 等.益生菌促进胃肠道健康的机制及应用[J].微生物学报, 2022, 62(3):836-847.
DUAN Y F, CAI F, LYU N, et al.The mechanism and application of probiotics in promoting gastrointestinal health[J].Acta Microbiologica Sinica, 2022, 62(3):836-847.
[13] ASHRAF R, SMITH S C.Commercial lactic acid bacteria and probiotic strains - tolerance to bile, pepsin and antibiotics[J].International Food Research Journal, 2016, 23:777-789.
[14] MARCO M L, PAVAN S, KLEEREBEZEM M.Towards understanding molecular modes of probiotic action[J].Current Opinion in Biotechnology, 2006, 17(2):204-210.
[15] LE LAY C, COTON E, LE BLAY G, et al.Identification and quantification of antifungal compounds produced by lactic acid bacteria and propionibacteria[J].International Journal of Food Microbiology, 2016, 239:79-85.
[16] 刘秀侠, 徐海燕, 辛国芹, 等.11株枯草芽孢杆菌益生特性研究[J].中国畜牧兽医, 2017, 44(8):2 333-2 341.
LIU X X, XU H Y, XIN G Q, et al.Study on probiotic characteristics of eleven Bacillus subtilis strains[J].China Animal Husbandry & Veterinary Medicine, 2017, 44(8):2 333-2 341.
[17] 吴艳丽, 刘朋, 苏咏欣, 等.嗜黏蛋白阿克曼氏菌ATCC BAA-835肠道益生作用的体外评价[J].食品与发酵工业, 2022, 48(2):156-162.
WU Y L, LIU P, SU Y X, et al.Intestinal probiotic effect of Akkermansia muciniphila ATCC BAA-835 in vitro[J].Food and Fermentation Industries, 2022, 48(2):156-162.
[18] 孟歌, 崔宝凯, 李春道, 等.药用真菌灵芝液体培养过程中的抗氧化活性研究[J].菌物学报, 2018, 37(4):486-501.
MENG G, CUI B K, LI C D, et al.Antioxidant activities of medicinal fungus Ganoderma Lingzhi in the process of liquid cultivation[J].Mycosystema, 2018, 37(4):486-501.
[19] TANG W, XING Z Q, LI C, et al.Molecular mechanisms and in vitro antioxidant effects of Lactobacillus plantarum MA2[J].Food Chemistry, 2017, 221:1 642-1 649.
[20] BENZIE I F, STRAIN J J.The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”:The FRAP assay[J].Analytical Biochemistry, 1996, 239(1):70-76.
[21] DECKER E A, WELCH B.Role of ferritin as a lipid oxidation catalyst in muscle food[J].Journal of Agricultural and Food Chemistry, 1990, 38(3):674-677.
[22] 矫艳平, 余萍, 赵迪, 等.植物乳杆菌HCS03-001安全性评价及其益生特性分析[J].食品工业科技, 2022, 43(5):165-171.
JIAO Y P, YU P, ZHAO D, et al.Safety evaluation and probiotic characteristics analysis of Lactobacillus plantarum HCS03-001[J].Science and Technology of Food Industry, 2022, 43(5):165-171.
[23] 于景艳, 王洋, 曾祥茜, 等.益生菌和不同水平壳聚糖对黄金鲫非特异性免疫力及抗病力的影响[J].中国饲料, 2020(11):69-76.
YU J Y, WANG Y, ZENG X X, et al.Effects of probiotics and chitosan on non-special immunity and disease resistance of the golden Carassius auratus[J].China Feed, 2020(11):69-76.
[24] 解文利, 吴雨烔, 白雪, 等.四川传统泡菜中乳酸菌的分离鉴定及抗氧化评估[J].食品与发酵科技, 2022, 58(1):35-41.
XIE W L, WU Y T, BAI X, et al.Isolation, identification and antioxidant evaluation of lactic acid bacteria from Sichuan traditional pickles[J].Food and Fermentation Science & Technology, 2022, 58(1):35-41.
[25] 吴石金, 张嘉琳, 陈彦霖, 等.发酵食品中抗氧化乳酸菌的筛选与鉴定[J].浙江工业大学学报, 2019, 47(6):685-691;698.
WU S J, ZHANG J L, CHEN Y L, et al.Screening and identification of lactic acid bacteria strains with antioxidant activities in fermented food[J].Journal of Zhejiang University of Technology, 2019, 47(6):685-691;698.
[26] 肖宇, 李键, 周钺, 等.从藏灵菇中筛选高抗氧化能力乳酸菌[J].食品与发酵工业, 2019, 45(22):179-184.
XIAO Y, LI J, ZHOU Y, et al.Lactic acid bacteria with high antioxidant capacity from Tibetan kefir[J].Food and Fermentation Industries, 2019, 45(22):179-184.
[27] 李权威, 张开屏, 赵艳红, 等.风干羊肉中乳酸菌的体内外抗氧化特性[J].微生物学通报, 2020, 47(12):4 094-4 104.
LI Q W, ZHANG K P, ZHAO Y H, et al.Antioxidation properties in vitro and in vivo of Lactobacillus in air-dried mutton[J].Microbiology China, 2020, 47(12):4 094-4 104.
[28] GOSWAMI D, THAKKER J N, DHANDHUKIA P C.Portraying mechanics of plant growth promoting rhizobacteria (PGPR):A review[J].Cogent Food & Agriculture, 2016, 2(1):1127500.
[29] SUN X L, XU Z H, XIE J Y, et al.Bacillus velezensis stimulates resident rhizosphere Pseudomonas stutzeri for plant health through metabolic interactions[J].The ISME Journal, 2022, 16(3):774-787.