魔芋是天南星科魔芋属的总称,主要分布在亚热带地区[1],我国魔芋种植历史悠久,资源丰富。中国和日本是世界上主要的魔芋生产和消费国[2],魔芋产品被世界卫生组织评为“十大健康产品”之一[3]。葡甘露聚糖是魔芋中主要的膳食纤维,是由β-1,4糖苷键连接甘露糖和葡萄糖组成的一种水溶性多糖,精制魔芋粉中其含量高达50~70 g/100 g[4]。魔芋葡甘露聚糖具有良好的吸水性、黏性、成膜性和增稠性,其应用广泛,可用于食品添加剂、健康食品和生物医学领域,可降低血清胆固醇浓度[5]、降低血糖[6]、减少便秘、促进人体肠道活动和免疫功能[3],此外还可以用于果蔬的成膜保鲜[7],控制亲脂性生物活性物质如姜黄素[8]、β-胡萝卜素[9]的释放速率等。
肥胖是当今社会普遍关注的问题,而膳食纤维本身的低能量与高饱腹感使其成为预防肥胖的潜在方法。大量研究表明膳食纤维影响小肠对葡萄糖和胆汁酸的吸收,从而降低餐后血糖、血清总胆固醇和低密度脂蛋白胆固醇浓度[10-11]。通过小鼠试验,发现膳食纤维可以减少小鼠食物摄入量和腹部脂肪含量[12],降低血液中胰高血糖素和甘油三酯(triacylglycerol,TAG)水平[13],并且膳食纤维对年老大鼠肝脏和脂肪组织质量的影响比年轻大鼠更强烈[14],同时有研究表明膳食纤维可以显著降低女性体重和脂肪增加的风险[15]。因此,在日常饮食中增加膳食纤维的摄入可以有效减少脂肪积累。
乳液消化模型包括体内模型(动物实验、人体实验)和体外消化模型,但体内模型成本较高,而体外消化实验成本低、重复性高且过程可视化,实验结果通常与体内实验结果相符[16],因此本研究采用体外消化实验进行基础研究。目前已有很多成人的体外消化模型,多数为静态模型,如利用pH-stat法实现胃肠系统pH恒定,该模型简单方便,消化结果具有可比性[17]。魔芋作为一种多功能植物资源,其减肥效果也受到了普遍关注[18]。本文以魔芋膳食纤维为原料,通过构建体外胃肠道消化系统,利用pH-stat法模拟并记录脂肪乳液体外消化过程,考察不同魔芋膳食纤维含量对脂肪乳液消化的影响,推测其可能的作用机制,以期为魔芋膳食纤维在食品方面的开发利用提供新思路,并为膳食纤维用于肥胖预防提供可靠的理论依据。
1 材料与方法
1.1 材料与试剂
颗粒魔芋膳食纤维,成都派特生物科技有限公司;金龙鱼玉米油,市售;黑曲霉脂肪酶A,阿拉丁试剂有限公司;胃蛋白酶,上海麦克林生化科技有限公司;猪胰脂肪酶,美国Sigma公司;NaCl、HCl、CaCl2·2H2O、NaOH、甲酸、无水乙醇(均为分析纯)、猪胆盐、吐温-20,国药集团化学试剂有限公司;异丙醇、正己烷(均为HPLC级),百灵威科技有限公司;尼罗红,北京伊诺凯科技有限公司。
1.2 仪器与设备
IKA T18 digital ULTRA-TURRAX分散机,上海凌仪生物科技有限公司;ZNCL-G智能恒温磁力搅拌仪,爱博特科技发展有限公司;STARTER 3100型 pH计,美国OHAUS公司;Zetasizer nano ZS纳米粒度及Zeta电位仪,英国马尔文公司;S3500激光粒度分析仪,美国Microtrac公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;SHZ-D循环水式多用真空泵,上海力辰邦西仪器科技有限公司;示差折光高效液相色谱仪,美国Waters公司;AB 104-N分析天平,梅特勒-托利多国际贸易有限公司;Axio Vert A1倒置荧光显微镜,德国蔡司公司。
1.3 实验方法
1.3.1 脂肪乳液的制备
参照文献[8,19]的方法制备并做相应修改。将0.5% (质量分数)的吐温-20溶解于去离子水中,搅拌30 min,提前1 d配制并置于4 ℃下过夜。在乳化剂溶液中加入质量分数分别为0%、0.1%、0.3%、0.5%的魔芋膳食纤维,搅拌4 h使纤维充分溶解,获得脂肪乳液的水相。使用高速剪切分散机[19],在9 000 r/min的条件下将5% (质量分数)的玉米油和95% (质量分数)的水相混合3 min,即获得最终的脂肪乳液,所有样品现配现用。
1.3.2 体外消化
基于前人对脂肪体外消化的研究[20-22],本实验对体外消化参数略作改动:
(1)消化储备液的配制:
胃部储备液:2 g/L NaCl和1.75 mL 1 mol/L HCl,去离子水定容至250 mL,调节pH值为3。
小肠储备液:6.574 g/L NaCl和1.457 g/L CaCl2·2H2O,去离子水定容至250 mL,调节pH值为6.8。
(2)胃消化液:向20 mL胃部储备液中加入一定量黑曲霉脂肪酶A(最终120 U/mL)和胃蛋白酶(最终2 000 U/mL),用1 mol/L HCl溶液调pH为3,恒温37 ℃下以10 r/min磁力搅拌20 min。
(3)肠消化液:向30 mL小肠储备液中加入胆盐(10 mmol/L)和胰酶(最终64~256 U/mL),用1 mol/L HCl溶液调pH为6.8,37 ℃,10 r/min磁力搅拌10 min,使溶液混匀。
(4)消化过程:
胃阶段:取40 mL脂肪乳液,调pH至3,与20 mL已预热的胃消化液混合,调整混合体系pH至3,然后将混合液放置于37 ℃水浴中搅拌1 h,模拟胃消化阶段,消化完成后取样以备后期分析。
肠阶段:取30 mL胃消化产物,调pH至6.8,加入30 mL已预热的肠消化液,37 ℃下反应2 h,不断滴加0.1 mol/L NaOH溶液,使体系恒定pH 6.8,记录NaOH溶液体积,消化完成后取样以备后期分析。
1.3.3 脂肪酸消化率的计算
根据消化过程中NaOH溶液消耗量来测定样品脂肪酸释放率,按公式(1)计算:
脂肪酸释放率![]()
(1)
式中:c, NaOH溶液浓度,0.1 mol/L;V,滴定所消耗的NaOH溶液体积,mL;M,油脂的摩尔质量,g/mol;m,乳液中油脂的质量,g。
1.3.4 脂解产物分析
提脂:乳液消化后脂肪的提取根据B&D法并略作修改[23]。取15 mL肠消化后样品与10 mL氯仿和5 mL甲醇混合,充分振荡10 min,静置30 min分层,收集下层有机相,用旋转蒸发仪去除有机相,所得脂肪储存于-20 ℃下以进行后续操作。
脂类组成分析:取称量过后的脂质,加入流动相,稀释为20 mg/mL,过滤膜后进行分析。利用配备示差检测器的高效液相色谱仪进行脂类组成分析,色谱条件为:色谱柱Sepax HP-Silica硅胶柱(4.6 mm×250 mm×5 μm),流动相V(正己烷)∶V(异丙醇)∶V(甲酸)= 15∶1∶0.003,流速1 mL/min,柱温35 ℃,进样量20 μL。依据样品浓度与峰面积呈线性关系,用面积归一法计算各脂质组分相对组成。
1.3.5 粒度测定
用激光粒度分析仪测定各消化阶段乳液的粒径,设置样品为球形,根据软件界面将样品稀释到合适的遮光度范围,测得的平均粒径采用体积平均粒径d43表示,按公式(2)计算:
(2)
式中:ni,粒径为di的颗粒个数。
1.3.6 Zeta-电位测定
乳液表面电位通过纳米粒度及Zeta电位仪测定,测量前使用同pH的蒸馏水将乳液稀释100倍。
1.3.7 微观结构观察
取200 μL样品用20 μL尼罗红染液(0.1 mg/mL,溶解于无水乙醇)染色,混合均匀后取20 μL于载玻片上,盖上盖玻片后利用倒置荧光显微镜观察乳液样品微观结构。
1.3.8 数据处理
所有实验均同时进行3个平行,实验数据以平均值±标准差表示,数据差异的显著性使用统计分析软件SPSS分析得到,P<0.05表示差异性具有统计学意义,实验结果图使用Origin 9.1绘制。
2 结果与分析
2.1 魔芋膳食纤维对脂肪消化的影响
人体胃消化阶段可以水解10%~30%的脂肪[24],但胃消化过程中,胃酸的分泌降低了体系pH值,脂肪酶活性较低,产生的脂肪酸对乳液pH影响较小[25],采用pH-stat法无法表征胃消化阶段脂肪酸释放率,故仅考察肠消化过程脂肪酸释放情况,如图1所示,未添加魔芋膳食纤维的脂肪乳液经消化后,脂肪酸释放率达到(16.72±0.68)%,当纤维添加量为0.5%时,乳液中脂肪酸的释放率仅为(14.84±0.5)%,释放率减少了11.1%,添加魔芋膳食纤维后释放率显著降低(P<0.05)。
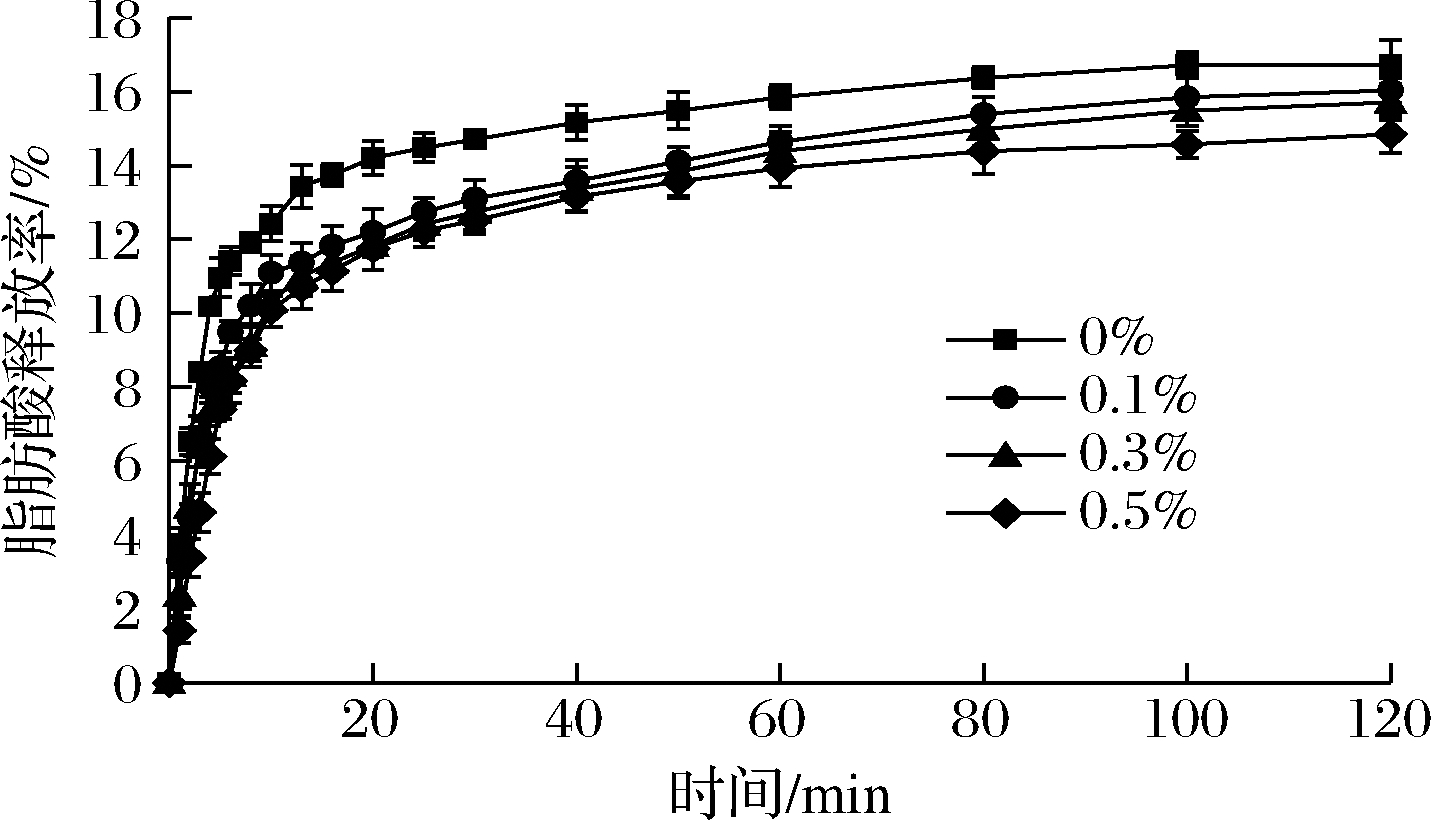
图1 魔芋膳食纤维对脂肪消化过程中脂肪 酸释放率的影响
Fig.1 Impact of konjac dietary fiber on fatty acids release rate in lipid digestion
另一方面,在消化前20 min内,脂肪酸释放速率快速增加,添加魔芋膳食纤维后初期释放速率减小,但纤维的添加量对其影响不明显。HE等[8]研究发现,是否添加魔芋葡甘露聚糖对姜黄素乳液中游离脂肪酸释放情况无显著影响(P>0.05),这是因为该研究中魔芋葡甘露聚糖添加量仅为0.3%,作用效果不明显。肠道作为脂肪吸收的主要场所,加入纤维增加乳液体系黏度,降低分子扩散速率,从而降低肠消化阶段脂质水解速率和程度;也可能会促进脂滴絮凝,降低脂酶与脂滴表面相互作用[26]。研究发现果蔬纤维可以有效减少脂肪的消化吸收,产生这种现象的机制可能与胃排空延迟、阻断部分脂肪消化吸收以及增加肠道运转速度有关[27]。
对体外胃肠道消化产物进行分析,甘油酯组成包括TAG、甘二酯(diacylglycerol,DAG)和单甘酯(monoacylglycerol, MAG)。
如图2所示,脂解产生少量MAG,脂消化产物以DAG为主。未添加魔芋膳食纤维的脂肪乳液消化后TAG、DAG和MAG相对含量分别为59.08%、39.43%和1.49%,添加0.5%魔芋纤维的乳液消化产物比例分别是66.72%、31.43%和1.85%,随着纤维添加量增加,TAG水解程度减少12.93%,DAG生产量减少8%,MAG变化不大。魔芋膳食纤维的高黏度和凝胶特性使其具有稳定乳状液的能力,在脂滴表面形成网状结构的保护层,阻碍胰脂肪酶与脂滴接触,导致乳液脂解程度减少[8]。
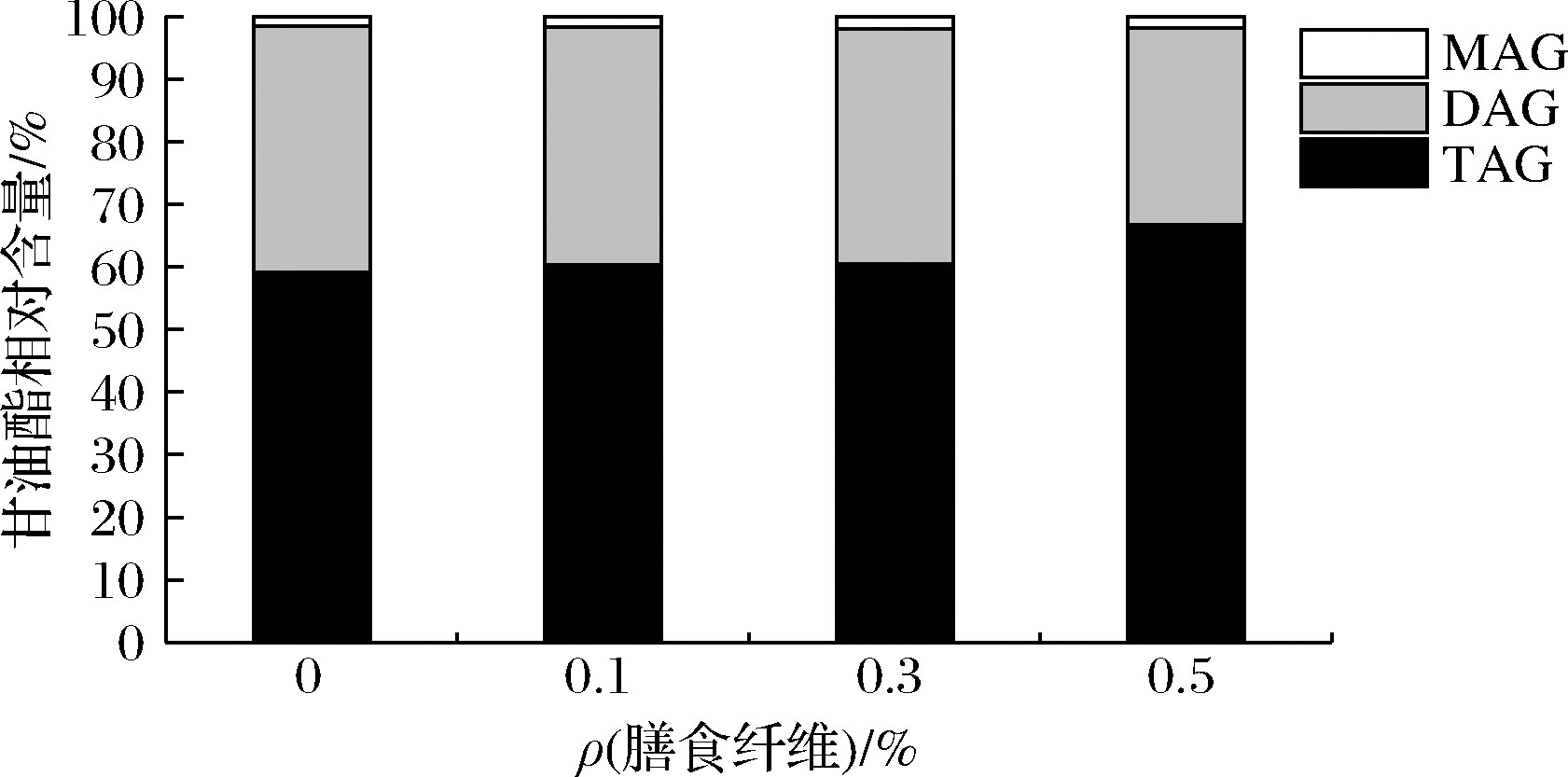
图2 魔芋膳食纤维对脂肪消化过程中甘油酯 生产量的影响
Fig.2 Impact of konjac dietary fiber on production volume of glycerides in lipid digestion
2.2 魔芋膳食纤维对脂肪乳液消化前后粒径的影响
如图3所示,经过体外消化,乳液平均粒径变化趋势相似,总体来说消化后的粒径均显著增加(P<0.05)。对于消化前的乳液样品,未添加膳食纤维的乳液粒径为(2.12±0.83) μm,当膳食纤维添加量为0.5%时,乳液有效粒径达到(28.22±2.74) μm。乳液体系中高分子聚合物会产生排空效应,高聚物膳食纤维浓度越大,产生空位的相对体积越大,相应的渗透压随之增大,乳液液滴更易发生聚集和絮凝[26]。初始乳液静置一段时间,乳液中脂滴上升到顶层形成不透明奶油层并在表层发生聚集[28]。肠消化后乳液粒径分别为(18.79±3.46)、(98.3±3.58)、(135±2.56)、(158.6±4.12) μm,所有含纤维样品均有较大的平均粒径,这是由于消化过程中机械搅拌加剧乳液脂滴聚集,同时肠液中阳离子会促进聚合物形成凝胶体系[29]。
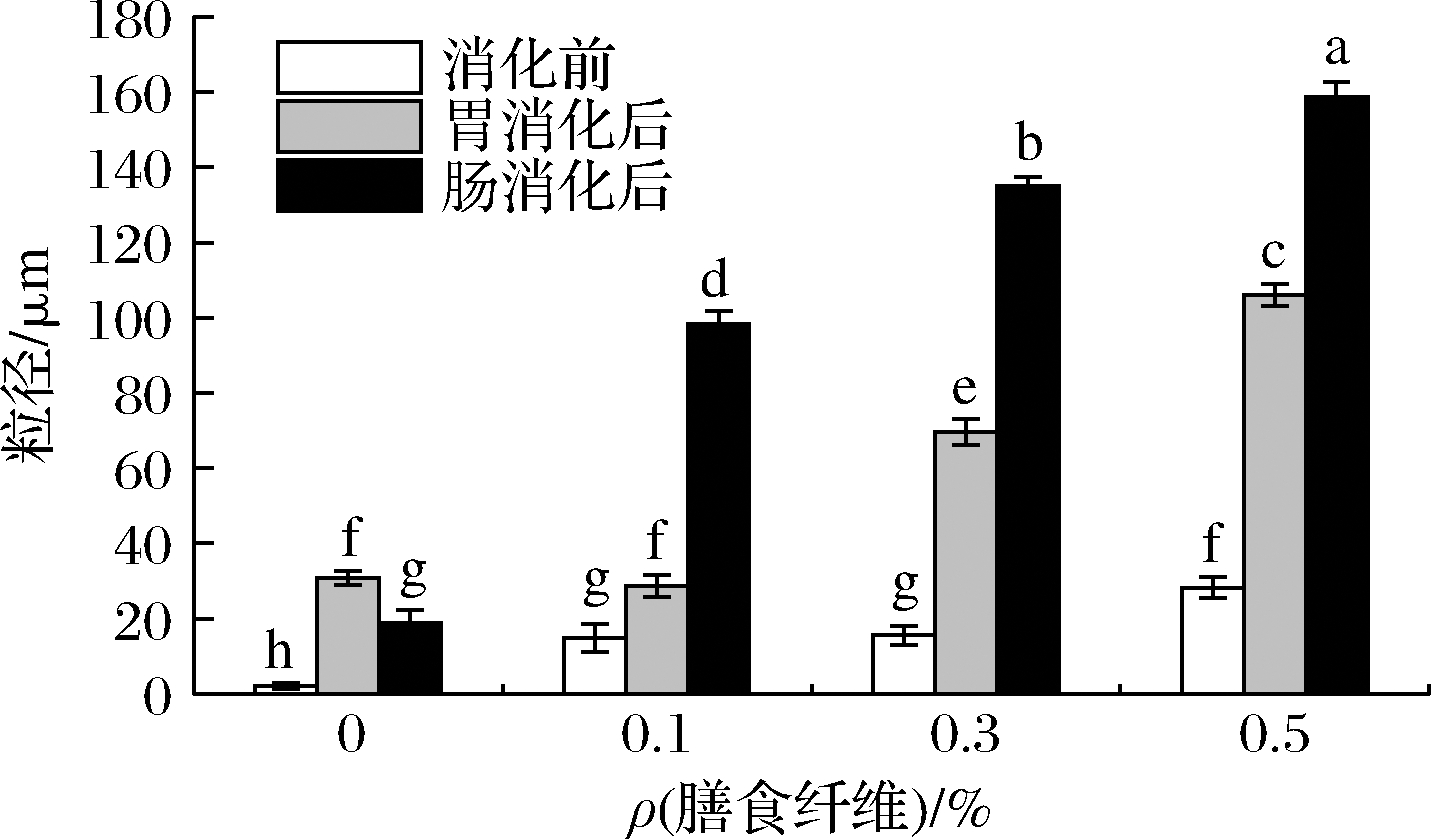
图3 魔芋膳食纤维对脂肪乳液消化前后粒径的影响
Fig.3 Impact of konjac dietary fiber on particle size of lipid emulsion before and after digestion
注:不同小写字母表示差异显著(P<0.05)(下同)
2.3 魔芋膳食纤维对脂肪乳液消化前后粒径分布的影响
由于是模拟人体摄入及消化食物的过程,因此仅对样品做高速剪切处理而未进行均质。如图4所示,与消化后的乳液相比,初始乳液粒径分布较为集中。纤维含量为0%的初始乳液粒径主要分布于0.01~10 μm,加入魔芋纤维后初始乳液粒径普遍增大,主要在1~100 μm之间,且随着纤维含量增加,粒径也有所增大。经过胃和肠消化后乳液稳定性变差,颗粒粒径分布变广,存在许多较大的颗粒,且魔芋纤维含量越高,大颗粒占比越高。脂质消化可能导致体系中存在许多不同种类的胶体颗粒,包括未消化脂滴、脂解产物和胆汁盐组成的混合胶束,以及生成的不溶性钙皂等[30],各种因素综合作用使消化后脂滴的尺寸增加。

a-0%;b-0.1%;c-0.3%;d-0.5%
图4 魔芋膳食纤维对脂肪乳液消化前后粒径分布的影响
Fig.4 Impact of konjac dietary fiber on particle size distribution of lipid emulsion before and after digestion
2.4 魔芋膳食纤维对脂肪乳液消化前后Zeta电位的影响
Zeta电位指剪切面的电位,是表征胶体分散系统稳定性的重要指标。由图5可知,未添加纤维的初始乳液表面带有较高正电荷(19.30±0.52) mV,可能是由于体系pH值过低,小于乳液等电点,一些正电荷如H+ 吸附在脂滴表面;添加魔芋膳食纤维的初始乳液表面电位有所下降,但仍带正电荷,说明魔芋膳食纤维表面带负电荷,可吸附到带正电荷的脂滴表面,降低脂滴表面电位[31]。
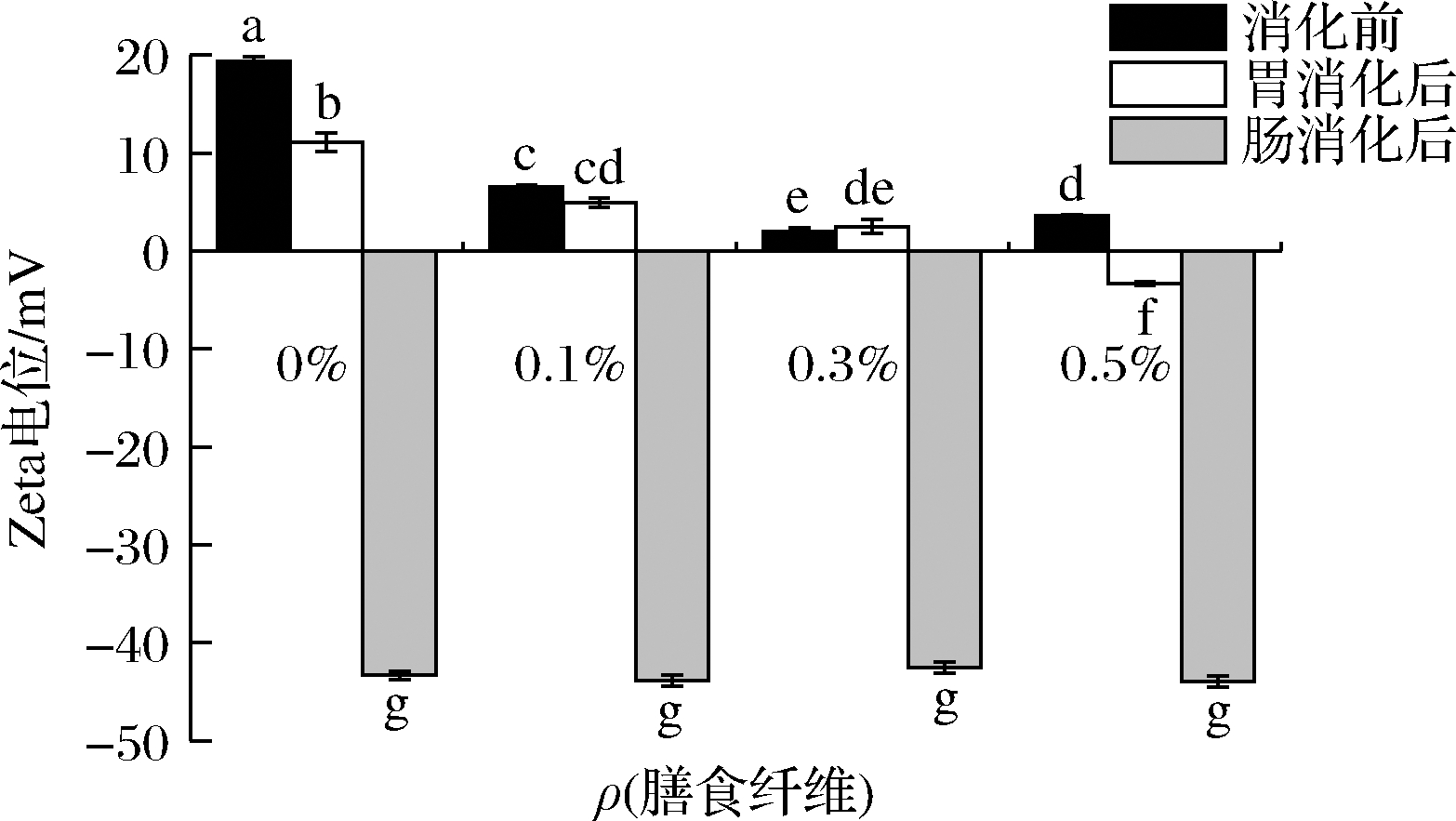
图5 魔芋膳食纤维对脂肪乳液消化前后Zeta电位的影响
Fig.5 Impact of konjac dietary fiber on Zeta potential of lipid emulsion before and after digestion
小肠是脂质消化的主要场所,经小肠消化后,乳液样品Zeta电位绝对值明显增大(P<0.05),分别为(-43.3±0.42)、(-43.83±0.58)、(-42.53±0.56)、(-44±0.57) mV,且均为负值,表明肠消化过程对乳液界面造成很大影响[32]。Zeta电位绝对值小于30 mV时,粒子容易发生聚集,所以肠消化后的乳液体系朝不稳定状态发展。但随着纤维含量增加,Zeta电位绝对值变化不显著,可解释为纤维含量对脂滴表面电位的作用达到饱和[29]。
2.5 魔芋膳食纤维对脂肪乳液消化前后微观结构的影响
如图6所示,脂肪乳液微观结构与激光粒度分析仪所测得的粒径变化趋势一致,整体来说乳液中较大颗粒尺寸随着纤维添加量增加相对变大。对于初始乳液,由于加入的膳食纤维具有一定黏性,脂滴相互粘连在一起,且纤维含量越高,粘连现象越明显。胃肠消化后脂滴发生聚集,相较于初始乳液其粒径明显增大。SRIKAEO等[4]研究发现,相比于抗性淀粉,魔芋葡甘露聚糖的存在会使植脂未乳液表现出更明显的液滴絮凝及合并现象,与本研究结果一致。

图6 魔芋膳食纤维对脂肪乳液消化前后微观结构的影响
Fig.6 Impact of konjac dietary fiber on microstructure of fat emulsion before and after digestion
3 结论与讨论
通过对消化过程监控,发现脂肪酸释放率与魔芋膳食纤维添加量呈负相关关系,纤维添加量越高消化后TAG相对含量越高,与脂肪酸释放率变化趋势相对应;魔芋膳食纤维对各消化阶段乳液粒径产生显著影响,随质量分数增大而升高,但对肠消化后乳液Zeta电位影响不显著。添加魔芋膳食纤维会减少油脂在体外的消化率,产生这种结果的机制可能是纤维促进脂滴絮凝,降低脂酶与脂滴作用面积;增加了乳液体系黏度,降低分子扩散速率;作为抑制剂抑制胰脂肪酶活性;在脂滴表面形成网状结构的保护层,阻碍胰脂肪酶与脂滴接触。
[1] DEVI DEVARAJ R D, REDDY C K, XU B J.Health-promoting effects of konjac glucomannan and its practical applications:A critical review[J].International Journal of Biological Macromolecules, 2019, 126:273-281.
[2] 周星, 金征宇.魔芋质量安全及研究进展[J].食品科学技术学报, 2017, 35(2):16-19.
ZHOU X, JIN Z Y.Quality safety issues and research progresses of konjac[J].Journal of Food Science and Technology, 2017, 35(2):16-19.
[3] BEHERA S S, RAY R C.Konjac glucomannan, a promising polysaccharide of Amorphophallus konjac K.Koch in health care[J].International Journal of Biological Macromolecules, 2016, 92:942-956.
[4] SRIKAEO K, SINGCHAI J.Effects of konjac glucomannan and resistant starch on in vitro lipid digestion of non-dairy creamers[J].International Food Research Journal, 2016, 23(4):1 403-1 408.
[5] HO H V T, JOVANOVSKI E, ZURBAU A, et al.A systematic review and meta-analysis of randomized controlled trials of the effect of konjac glucomannan, a viscous soluble fiber, on LDL cholesterol and the new lipid targets non-HDL cholesterol and apolipoprotein B[J].The American Journal of Clinical Nutrition, 2017, 105(5):1 239-1 247.
[6] CHEN H H, NIE Q X, HU J L, et al.Hypoglycemic and hypolipidemic effects of glucomannan extracted from konjac on type 2 diabetic rats[J].Journal of Agricultural and Food Chemistry, 2019, 67(18):5 278-5 288.
[7] YAN Y S, DUAN S Q, ZHANG H L, et al.Preparation and characterization of konjac glucomannan and pullulan composite films for strawberry preservation[J].Carbohydrate Polymers, 2020, 243:116446.
[8] HE S H, GU C, WANG D G, et al.The stability and in vitro digestion of curcumin emulsions containing konjac glucomannan[J].LWT, 2020, 117:108672.
[9] LU W, ZHENG B D, MIAO S.Improved emulsion stability and modified nutrient release by structuring O/W emulsions using konjac glucomannan[J].Food Hydrocolloids, 2018, 81:120-128.
[10] SURAMPUDI P, ENKHMAA B, ANUURAD E, et al.Lipid lowering with soluble dietary fiber[J].Current Atherosclerosis Reports, 2016, 18(12):75.
[11] STORY J A.Dietary fiber and lipid metabolism[J].Experimental Biology and Medicine, 1985, 180(3):447-452.
[12] KEENAN M J, ZHOU J, MCCUTCHEON K L, et al.Effects of resistant starch, a non-digestible fermentable fiber, on reducing body fat[J].Obesity, 2006, 14(9):1 523-1 534.
[13] MADAR Z.Effect of brown rice and soybean dietary fiber on the control of glucose and lipid metabolism in diabetic rats[J].The American Journal of Clinical Nutrition, 1983, 38(3):388-393.
[14] YAMADA K, TOKUNAGA Y, IKEDA A, et al.Effect of dietary fiber on the lipid metabolism and immune function of aged Sprague-Dawley rats[J].Bioscience, Biotechnology, and Biochemistry, 2003, 67(2):429-433.
[15] TUCKER L A, THOMAS K S.Increasing total fiber intake reduces risk of weight and fat gains in women[J].The Journal of Nutrition, 2009, 139(3):576-581.
[16] 古成. 魔芋甘露聚糖稳定姜黄素纳米乳状液及其缓释消化研究[D].哈尔滨:哈尔滨工业大学, 2019.
GU C.Using konjac glucomannan stabilize curcumin nanoemulsion and slow down its nutrient release during in vitro digestion[D].Harbin:Harbin Institute of Technology, 2019.
[17] 徐亚华. 早产儿母乳脂肪酸组成及体外消化特性研究[D].无锡:江南大学, 2018.
XU Y H.The fatty acids composition and in vitro digestion of preterm milk[D].Wuxi:Jiangnan University, 2018.
[18] 薛丽华, 陈继承, 冯瑞, 等.魔芋葡甘聚糖减肥作用及其机理研究进展[J].海峡科学, 2012 (8):47-49.
XUE L H, CHEN J C, FENG R, et al.Progress in weight loss of konjac gluanoglycan and its mechanism[J].Straits Science, 2012 (8):47-49.
[19] 徐俊杰. 甘油三酯的体外模拟消化水解研究[D].无锡:江南大学, 2014.
XU J J.Study on triglyceride hydrolysis during in vitro digestion[D].Wuxi:Jiangnan University, 2014.
[20] YE Z, CAO C, LIU Y F, et al.Triglyceride structure modulates gastrointestinal digestion fates of lipids:A comparative study between typical edible oils and triglycerides using fully designed in vitro digestion model[J].Journal of Agricultural and Food Chemistry, 2018, 66(24):6 227-6 238.
[21] GASA-FALCON A, ODRIOZOLA-SERRANO I, OMS-OLIU G, et al.Influence of mandarin fiber addition on physico-chemical properties of nanoemulsions containing β-carotene under simulated gastrointestinal digestion conditions[J].LWT, 2017, 84:331-337.
[22] LIANG L, QI C, WANG X G, et al.Influence of homogenization and thermal processing on the gastrointestinal fate of bovine milk fat:In vitro digestion study[J].Journal of Agricultural and Food Chemistry, 2017, 65(50):11 109-11 117.
[23] BLIGH E G, DYER W J.A rapid method of total lipid extraction and purification[J].Canadian Journal of Biochemistry and Physiology, 1959, 37(8):911-917.
[24] LIU T T, LIU X T, CHEN Q X, et al.Lipase inhibitors for obesity:A review[J].Biomedicine & Pharmacotherapy, 2020, 128:110314.
[25] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food-an international consensus[J].Food & Function, 2014, 5(6):1 113-1 124.
[26] ESPINAL-RUIZ M, PARADA-ALFONSO F, RESTREPO-S NCHEZ L P, et al.Impact of dietary fibers[methyl cellulose, chitosan, and pectin]on digestion of lipids under simulated gastrointestinal conditions[J].Food Function, 2014, 5(12):3 083-3 095.
NCHEZ L P, et al.Impact of dietary fibers[methyl cellulose, chitosan, and pectin]on digestion of lipids under simulated gastrointestinal conditions[J].Food Function, 2014, 5(12):3 083-3 095.
[27] TRISAT K, WONG-ON M, LAPPHANICHAYAKOOL P, et al.Vegetable juices and fibers reduce lipid digestion or absorption by inhibiting pancreatic lipase, cholesterol solubility and bile acid binding[J].International Journal of Vegetable Science, 2017, 23(3):260-269.
[28] HUR S J, DECKER E A, MCCLEMENTS D J.Influence of initial emulsifier type on microstructural changes occurring in emulsified lipids during in vitro digestion[J].Food Chemistry, 2009, 114(1):253-262.
[29] QIN D K, YANG X J, GAO S R, et al.Influence of hydrocolloids (dietary fibers) on lipid digestion of protein-stabilized emulsions:Comparison of neutral, anionic, and cationic polysaccharides[J].Journal of Food Science, 2016, 81(7):C1 636-C1 645.
[30] ESPINAL-RUIZ M, RESTREPO-S NCHEZ L P, NARV
NCHEZ L P, NARV EZ-CUENCA C E, et al.Impact of pectin properties on lipid digestion under simulated gastrointestinal conditions:Comparison of citrus and banana passion fruit (Passiflora tripartita var.mollissima) pectins[J].Food Hydrocolloids, 2016, 52:329-342.
EZ-CUENCA C E, et al.Impact of pectin properties on lipid digestion under simulated gastrointestinal conditions:Comparison of citrus and banana passion fruit (Passiflora tripartita var.mollissima) pectins[J].Food Hydrocolloids, 2016, 52:329-342.
[31] BEYSSERIAT M, DECKER E A, MCCLEMENTS D J.Preliminary study of the influence of dietary fiber on the properties of oil-in-water emulsions passing through an in vitro human digestion model[J].Food Hydrocolloids, 2006, 20(6):800-809.
[32] 吴克刚, 魏浩, 柴向华, 等.八角水溶性膳食纤维对油脂乳液消化特性的影响[J].食品科学, 2020, 41(20):68-75.
WU K G, WEI H, CHAI X H, et al.Effect of water soluble dietary fiber from star anise on digestibility of oil emulsion[J].Food Science, 2020, 41(20):68-75.