葡萄作为世界上产量较大的水果作物之一,约有80%用于葡萄酒或者果汁生产,酿酒厂和葡萄汁行业约年产250万t葡萄皮渣[1]。葡萄皮渣中含有丰富的酚类、黄酮、单宁等对人体健康有益的成分[2],作为天然生物活性化合物,在清除体内自由基、治疗炎症和调节糖代谢等方面发挥一定的功效[3]。酚类物质在植物中主要以游离态和结合态存在,游离态可通过甲醇、乙醇等溶剂直接萃取出来,结合态需要通过化学或酶处理方法从细胞壁上分离出来[4]。
热加工有助于植物原料释放生物活性物质的同时还可促进原料抗氧化能力的提升[5]。蒸汽爆破(steam explosion,SE)作为新兴的预处理技术,主要是利用高温高压的蒸汽作用于原料,并通过瞬间释压过程实现原料组分的分离和结构的变化。LIU等[6]以麦麸为原料经215 ℃蒸汽爆破处理120 s后,其总酚得率相较于未处理样品提高了39倍。利用蒸汽爆破处理芡实籽,在0.6 MPa-60 s的条件下其总酚含量提高了5.3倍,而在1.5 MPa-120 s的条件下其总酚含量却低于未处理组[7]。此外,研究发现小麦麸皮在2.5 MPa-30 s的条件下进行爆破,游离酚酸中香草酸的含量较未处理的增加了近50%,香豆酸和阿魏酸含量均达到最大,分别为对照组的36倍和11倍[8]。橡木材在160~220 ℃提取5~15 min,总酚含量与蒸汽爆破处理时间呈现正相关关系,但在240 ℃、15 min的条件下提取的总酚含量降低[9]。LI等[10]的研究也证实蒸汽爆破处理有助于苦荞麸皮酚类物质的溶出及体外细胞抗氧化活性的提高。这些研究表明蒸汽爆破可大幅提升原料中多酚的提取率以及抗氧化活性。
葡萄皮渣作为酿酒加工废弃物目前利用率较低,但其中含有丰富的多酚、黄酮、原花青素、花色苷等成分,蒸汽爆破处理对其中不同结合态的多酚、黄酮、花色苷、原花青素以及相应的抗氧化活性产生的影响等,目前未见相关的报道。因此本试验选用酿酒后剩余葡萄皮渣为原料,采用不同条件的蒸汽爆破处理,研究其对游离酚(free polyphenols,FP)和游离黄酮(free flavones,FF)、结合酚(bound polyphenols,BP)、结合黄酮(bound flavones,BF)、原花青素、花色苷的提取率及提取物的抗氧化活性的影响,并对抗氧化成分含量与其抗氧化活性之间的相关性进行分析,以期为葡萄皮渣的高值化利用提供参考,并拓展蒸汽爆破技术在食品预处理及加工行业的利用范围。
1 材料与方法
1.1 主要材料与试剂
本试验采用从葡萄酿酒厂回收的赤霞珠葡萄皮渣(产地甘肃)。福林酚试剂、没食子酸(纯度≥99%)、芦丁(纯度≥98%)、原花青素(纯度≥95%),上海源叶试剂公司;水溶性维生素E(Trolox)、DPPH、ABTS、2,4,6-三吡啶基-1,3,5-三嗪[2,4,6-tri(2-pyridyl)-s-triazine, TPTZ],麦克林生化科技有限公司;无水乙醇、甲醇、Na2CO3、AlCl3等均为分析纯,国药集团化学试剂有限公司。
1.2 主要仪器设备
QBS-80爆破试验台,鹤壁正道生物能源有限公司;FW177高速万能粉碎机,天津市泰斯特仪器有限公司;UV—5200紫外可见分光光度计,上海元析仪器有限公司;AR423CN电子分析天平,奥豪斯仪器(上海)有限公司;KQ-800DE数控超声清洗机,昆山市超声仪器有限公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 原料的蒸汽爆破预处理
蒸汽爆破设备由高压容器、蒸汽发生器、物料罐、接收器和速开球阀组成。将葡萄皮渣用水浸泡3 h,沥干水分后装入密封袋密封8 h,待设备预热后将其投入物料罐中,并通入高温饱和蒸汽,设定压力0.4、0.8、1.2 MPa,维压时间1、3 min,在距离爆破终点还有3 s时,打开气动阀门瞬间泄压完成后,在物料接收器处收集处理后的样品,并在60 ℃下干燥至恒重,然后粉碎过60目筛。设定的处理分别表示为SE1(0.4 MPa-1 min),SE2(0.4 MPa-3 min),SE3(0.8 MPa-1 min),SE4(0.8 MPa-3 min),SE5(1.2 MPa-1 min),SE6(1.2 MPa-3 min),以未经过蒸汽爆破处理的样品作为对照(CK)。
1.3.2 微观结构观察
为直观分析蒸汽爆破对葡萄皮渣结构的影响,利用扫描电子显微镜(scanning electron microscopy,SEM)对原料进行分析,使用导电胶将干燥的葡萄皮渣样品粉碎固定于样品台上,在5.0 kV电压下,使用离子溅射技术对样品表面进行喷金处理并放入电镜载物腔体内抽至真空,然后进行观察和拍照。
1.3.3 葡萄皮渣中多酚和黄酮的提取
FP和FF的提取:参照姜黎等[11]的方法略微改进,利用超声波辅助提取葡萄皮渣,料液比为1∶20(g∶mL)、乙醇50%(体积分数,下同)、560 W超声波处理1 h,然后5 000 r/min离心10 min,取上清液用于FP、FF、花青素测定,将剩余的残渣用于BP、BF和原花青素的提取。
BP和BF的提取:采用碱水解法[12]。将上一步剩余的残渣干燥后,加入5 mL NaOH 溶液(含10 mmol/L EDTA和质量分数为1% 维生素C)进行水解,室温置于摇床上振荡2 h。然后用6 mol/L HCl溶液调整pH值至(2.0±0.2)。在水解液中加入相同体积的V(乙醇)∶V(乙酸乙酯)=1∶1的混合液进行萃取,共萃取5次,合并上层萃取液,浓缩至干,然后加入一定量的50%乙醇溶解后用于测定BP和BF含量。
1.3.4 葡萄皮渣中FP和BP含量的测定
采用Folin-phenol法进行测定[13]。取2 mL蒸馏水加入200 μL福林-酚试剂混匀,加入100 μL葡萄皮渣提取液,吹打均匀后加入20%(质量分数)Na2CO3溶液900 μL,混匀后在暗处放置2 h,并在765 nm处测定吸光值A。以没食子酸为标样,在10~500 mg/L内制定标准曲线(y=0.003 1x+0.017 5,R2=0.996 5),计算提取液中多酚的含量。
1.3.5 葡萄皮渣FF和BF含量的测定
参考WU[14]的方法并稍加改进。分别取1.5 mL葡萄皮渣提取液与1.5 mL的2% AlCl3-甲醇溶液(含5%乙酸)混合均匀,静置15 min后,于430 nm处测定吸光度值,以芦丁为标样在10~500 mg/L内制定标准曲线(y=0.004 8x+0.013 8,R2=0.999),计算提取液中类黄酮的含量。
1.3.6 葡萄皮渣花色苷含量的测定
采用pH示差法进行测定[15],取0.9 mL提取液,分别加入2.1 mL的pH值1.0的HCl-KCl溶液和pH值4.5的HCl-乙酸钠溶液混合,然后分别测定混合物在510和700 nm处的吸光度值A,花色苷浓度和吸光度差值分别按公式(1)和公式(2)计算。
花色苷浓度/(mg·mL-1)=ΔA×Mw×DF/ε
(1)
ΔA=(A510 nm-A700 nm)pH1-(A510 nm-A700 nm)pH4.5
(2)
式中:ΔA,吸光度差值;Mw,矢车菊花青素-3-葡萄糖苷分子质量,449.2;DF,稀释倍数;ε,矢车菊花青素-3-葡萄糖苷的消光系数,26 900。
1.3.7 葡萄皮渣提取物中原花青素的提取与测定
采用正丁醇-盐酸比色法测定[16],提取葡萄皮渣游离态物质,剩余残渣干燥后加入40 mL的V(盐酸)∶V(丁醇)=5∶95的溶液,在100 ℃水浴1 h,冷却后5 000 r/min离心15 min,分离沉淀和上清液,在555 nm处测定上清液的吸光度值,以原花青素(95%)为标样在10~500 mg/L制定标准曲线(y=0.034 3x+0.066 1,R2=0.991 3),计算原花青素的含量。
1.3.8 葡萄皮渣提取物抗氧化活性的测定
ABTS自由基清除能力的测定:参照文献[17]的方法略加改进,取0.1 mL不同蒸汽爆破处理的葡萄皮提取液,加入3 mL ABTS反应液,混匀后于室温下静置反应6 min,在波长734 nm下测定样品的吸光值。以溶于甲醇的Trolox溶液为标样在20~250 mg/L制定标准曲线(y=0.475 2x-0.813 3,R2=0.999 3),结果用水溶性维生素E的抗氧化能力(trolox equivalent andoxidant capacity,TEAC)表示。
铁离子还原能力 (ferric ion reducing antioxidant power, FRAP)测定:参照文献[18]的方法略微改进,取4.9 mL的FRAP试剂与0.1 mL提取液混匀后,37 ℃水浴保温15 min,于593 nm处测定吸光值。以溶于甲醇的Trolox溶液为标样在20~250 mg/L制定标准曲线(y=0.003 1x+0.008 2,R2=0.999 4),结果用TEAC表示。
DPPH自由基清除能力的测定:参照文献[19]的方法,提取液0.1 mL加入到1.5 mL DPPH甲醇溶液(200 μmol/L)中。室温避光反应60 min,在517 nm处测定吸光度。以溶于甲醇的Trolox溶液为标样在20~250 mg/L制定标准曲线(y=0.317 3x-2.052 5,R2=0.997 3),结果用TEAC表示。
1.4 数据分析
使用SPSS 26.0对实验数据进行单因素方差分析,数据以均值±标准差表示,P<0.01表示样品之间具有极显著差异,P<0.05表示样品之间具有显著性差异;使用Origin 2010进行作图。
2 结果与分析
2.1 蒸汽爆破处理对葡萄皮渣微观结构特性的影响
不同条件处理葡萄皮渣粉碎后,用扫描电镜观察其微观结构的变化,图1分别列出500和1 000放大倍数的微观图。未经SE处理的葡萄皮渣SEM图(图1-a、图1-a1)表面结构相对完整且致密,随着压力的不断增大和维压时间的延长,葡萄皮渣的结构破裂程度愈发严重,其结构变得疏松多孔,当爆破压力增至1.2 MPa时,皮渣表面结构变得粗糙且疏松,形成大量的碎片物质(图1-f、图1-f1、图1-g及图1-g1)。

a~g-1 000×;a1~g1-500×
图1 葡萄皮渣扫描电镜图
Fig.1 Scanning electron microscopy of grape pomace
2.2 蒸汽爆破对葡萄皮渣中多酚和黄酮含量的影响
如表1所示,蒸汽爆破压力和时间对原料中多酚和黄酮的提取率有明显的影响。蒸汽爆破处理后,游离态提取物的含量明显增加,而结合态提取物的含量明显下降。随着汽爆强度的增加,FP和FF总体上呈现出先上升后降低的趋势,在SE5(1.2 MPa-1 min)时FP含量达最大为26.76 mg/g,是未爆破葡萄皮渣含量的2.41倍。而对FF的含量在SE4(0.8 MPa-3 min)、SE5(1.2 MPa-1 min)、SE6(1.2 MPa-3 min)这3个条件下没有明显的差异。对BP和BF含量,随着汽爆强度的增加,提取率呈现逐渐降低的趋势,这是由于在高温高压下部分结合态转化成游离态。总体来看,葡萄皮渣中BP的含量远远高于FP的含量。在低处理强度下,葡萄皮渣中BF的含量高于FF含量,而随着汽爆强度的增加,FF的含量又高于BF的含量。将游离态和结合态的部分相加分别得到总多酚(total content of phenolics,TCP)和总黄酮(total content of flavonoids,TCF),TCP的提取率明显高于TCF。TCP的含量随着汽爆强度增加呈下降趋势,在SE1(0.4 MPa-1 min)时含量最高;当汽爆强度增加到SE3(0.8 MPa-1 min)后,TCF的含量基本呈稳定状态。
表1 蒸汽爆破对葡萄皮渣中多酚和黄酮含量的影响 单位:mg/g DW
Table 1 Effects of SE on content of polyphenols and flavone in grape pomace
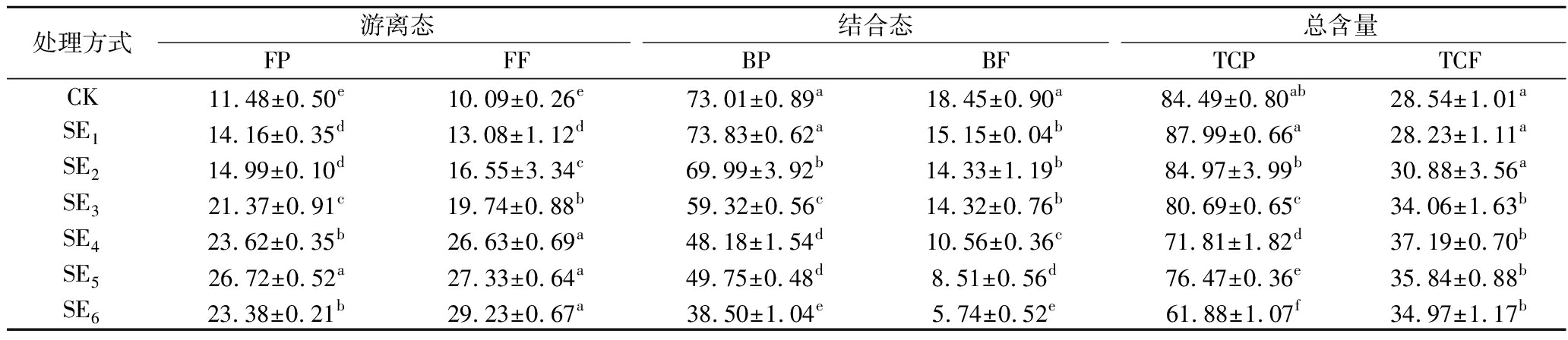
处理方式游离态结合态总含量FPFFBPBFTCPTCFCK11.48±0.50e10.09±0.26e73.01±0.89a18.45±0.90a84.49±0.80ab28.54±1.01aSE114.16±0.35d13.08±1.12d73.83±0.62a15.15±0.04b87.99±0.66a28.23±1.11aSE214.99±0.10d16.55±3.34c69.99±3.92b14.33±1.19b84.97±3.99b30.88±3.56aSE321.37±0.91c19.74±0.88b59.32±0.56c14.32±0.76b80.69±0.65c34.06±1.63bSE423.62±0.35b26.63±0.69a48.18±1.54d10.56±0.36c71.81±1.82d37.19±0.70bSE526.72±0.52a27.33±0.64a49.75±0.48d8.51±0.56d76.47±0.36e35.84±0.88bSE623.38±0.21b29.23±0.67a38.50±1.04e5.74±0.52e61.88±1.07f34.97±1.17b
注:同列不同小写字母表示具有显著性差异,P<0.05
2.3 蒸汽爆破对葡萄皮渣提取物花色苷和原花青素含量的影响
分别采用pH示差法和正丁醇-盐酸比色法测定了葡萄皮渣提取物中总花色苷和总原花青素的含量。由图2可知,总体而言,葡萄皮渣中总花色苷的含量明显高于总原花毒素的含量。经过蒸汽爆破处理后,葡萄皮渣原花青素和总花色苷含量明显下降,随着压力的增强及处理时间的增加两者含量的下降趋势更加明显,未处理组中总花色苷和总原花青素含量最高分别为(84.10±3.45) mg/g、(41.76±1.37) mg/g,是SE6组的26和5倍。
2.4 蒸汽爆破对葡萄皮渣提取物抗氧化活性的影响
通过测定DPPH自由基清除能力、FRAP还原力、ABTS阳离子自由基清除能力来研究蒸汽爆破对葡萄皮渣提取物抗氧化活性的影响,结果如图3所示。
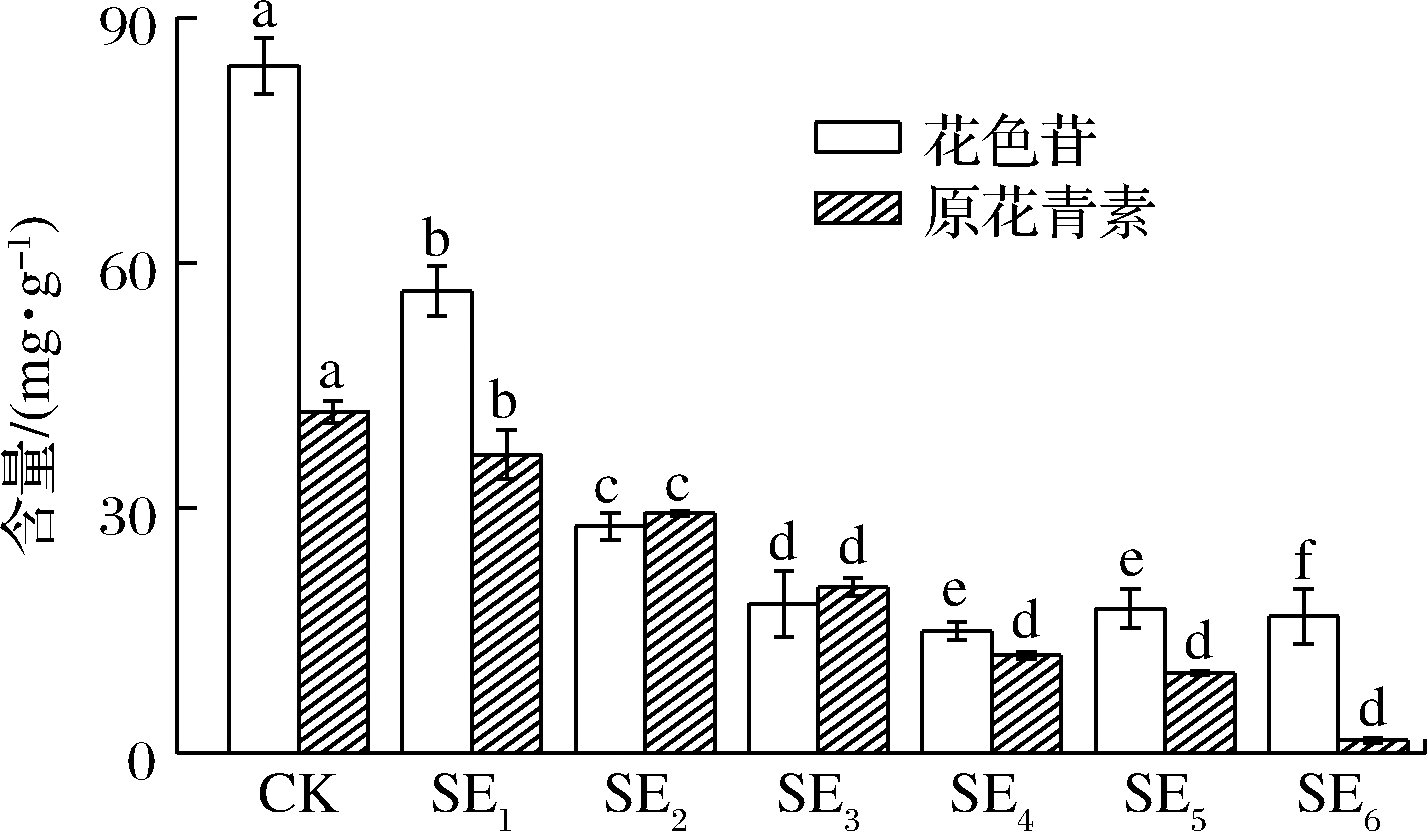
图2 蒸汽爆破对葡萄皮渣中花色苷和原花青素的影响
Fig.2 Effects of SE on anthocyanins and procyanidins of grape pomace
注:不同小写字母表示组间具有显著性差异(P<0.05),下同

a-游离态提取物ABTS阳离子自由基清除能力;b-游离态提取物FRAP还原力;c-游离态提取物DPPH自由基清除能力; d-结合态提取物ABTS阳离子自由基清除能力;e-结合态提取物FRAP还原力;f-结合态提取物DPPH自由基清除能力
图3 蒸汽爆破对葡萄皮渣提取物抗氧化活性的影响
Fig.3 Effect of SE to antioxidant activity of extracts from grape pomace
经过爆破后葡萄皮渣游离态提取物的抗氧化能力均高于未爆破组,且不同处理组提取物的抗氧化活性的变化与提取物多酚含量变化趋势基本一致,随着爆破压力和时间的不断增大,葡萄皮渣游离态提取物的抗氧化能力整体呈现先上升后下降的趋势,在SE5时其抗氧化能力达到最高,DPPH自由基清除能力、FRAP还原力、ABTS阳离子自由基清除能力分别为(9.54±0.13.14)、(6.59±0.47)、(66.02±0.22) mg/g。蒸汽爆破处理对葡萄皮渣结合态提取物的抗氧化活性整体呈逐渐降低的趋势,与蒸汽爆破处理的葡萄皮渣结合酚含量大体呈现一致的趋势,且在CK组其抗氧化能力达最高,DPPH自由基清除能力、FRAP还原力、ABTS阳离子自由基清除能力的值分别为(74.06±1.8)、(91.15±5.57)、(138.07±3.20) mg/g。由于结合态提取物的含量明显高于游离态,所以结合态提取物的抗氧活性也明显高于游离态提取物的抗氧化活性。
2.5 葡萄皮渣提取物与抗氧化活性之间的相关性分析
将葡萄皮渣中活性成分的含量与抗氧化活性进行了相关性分析,结果见表2。抗氧化活性与葡萄皮渣FP、FF、BP及BF含量存在极显著的相关性,其中最高的为BP含量与DPPH自由基抗氧化能力之间相关系数为0.985,最低的为FF含量与ABTS阳离子自由基抗氧化能力之间相关性系数为0.899。这表明提取物的抗氧化活性主要是归因于提取物中含有的酚类及黄酮等活性成分。
表2 葡萄皮渣提取物与抗氧化活性的相关性分析
Table 2 Correlation between extracts from grape pomace and antioxidant activities
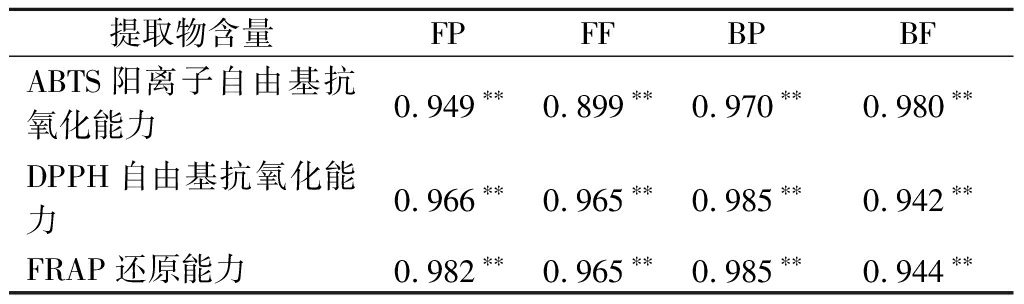
提取物含量FPFFBPBFABTS阳离子自由基抗氧化能力0.949∗∗0.899∗∗0.970∗∗0.980∗∗DPPH自由基抗氧化能力0.966∗∗0.965∗∗0.985∗∗0.942∗∗FRAP还原能力0.982∗∗0.965∗∗0.985∗∗0.944∗∗
注:**表示在0.01水平上显著相关
3 讨论
植物自身组成结构为其内部有效成分的提取构筑了一道多尺度的天然屏障,包括细胞壁组成的复杂性、结构不均一性、木质化程度以及表皮系统等。这些物理屏障不可避免地限制着提取过程的2个关键步骤:一是溶质与溶剂的可及接触性和溶解过程,二是溶剂夹带溶质通过植物结构的扩散过程。因此,在对有效成分提取前有必要对原料进行预处理,打破上述提取屏障,达到理想的提取效果。爆破加工是一项近年来迅速发展起来的预处理技术,逐渐应用到食品加工行业。该技术是利用高温和高压共同作用于原料,并通过瞬时释压的过程实现原料的组分分离和结构的变化,通过与其他分离技术的结合,可实现物料在组分、细胞和组织水平的分级分离。蒸汽爆破过程中存在类酸性水解、热降解、类机械断裂、氢键破坏以及结构重排等作用[20]。通过SEM观察发现蒸汽爆破处理后葡萄皮渣出现明显破裂,颗粒变小,形成许多孔隙,相对表面积增大等现象,因此增加了原料中有效活性成分与溶剂的可接触面积,增加溶解过程,同时有效减弱细胞壁的屏障作用,在一定程度上提高了葡萄皮渣中多酚、黄酮等活性物质的释放与提取。MART NEZ-MEZA等[21]采用可控瞬时压差技术处理葡萄皮渣,证明该法也能使原料形成许多孔隙,增大比表面积,提高活性成分的提取率。
NEZ-MEZA等[21]采用可控瞬时压差技术处理葡萄皮渣,证明该法也能使原料形成许多孔隙,增大比表面积,提高活性成分的提取率。
多酚类与黄酮类物质在葡萄皮渣中含量丰富,由于结合方式和提取方法不同,主要分为游离态和结合态。本实验结果表明葡萄皮渣的酚类化合物主要以结合态形式存在,约占总酚类提取物含量的60%以上,这一结论在玉米、小麦、大米等谷物中也得到了证实[22]。由于多酚和类黄酮的结合方式不同,蒸汽爆破对游离态和结合态提取物多酚与黄酮的释放量也存在差异,可能引起之间的迁移转化。本实验的研究结果表明,蒸汽爆破处理后增强了游离酚和黄酮的提取率,但随着强度的增加其含量有下降的趋势。而结合态酚和黄酮与游离态相反,蒸汽爆破降低了其提取率。相似的研究结果在红小豆[23]、黑稻米[24]以及茶渣[25]中也被证实。这可能归结于蒸汽爆破过程中的高温、高压作用于原料造成糖苷键、酯键、醚键等发生断裂,以及木质素、纤维素类物质发生降解,进而引起细胞内结合态的酚类物质转化为游离态促使游离酚含量增加,而过度的蒸汽爆破处理将会导致酚类物质受热分解产生损失[26]。蒸汽爆破是一个自水解过程,可形成小分子的有机酸,促使可溶性结合物酸性水解转化为游离态,也可导致羧基和酚羟基的增加以及β-O-4结构的显著降低[27]。由于蒸汽爆破过程中物理化学协同作用,酚类物质的形成和降解是共存的过程,需要达到一个平衡状态,因此随着蒸汽爆破程度的增加,趋势表现为先增加后减少[28]。蒸汽爆破处理葡萄皮渣游离态提取物DPPH自由基清除能力、FRAP还原能力及ABTS阳离子自由基清除能力得到了明显提升,而结合态提取物的抗氧化活性呈下降趋势,通过相关性分析表明提取物的抗氧化活性与提取物的含量之间呈显著相关。
原花青素是葡萄中的一类重要活性成分,其稳定性较差,易受光和温度的影响。蒸汽爆破处理后葡萄皮渣中原花青素含量明显降低,QIN等[29]以无花果叶为原料也证明具有相同的影响趋势。这主要是蒸汽爆破具有的高温高压作用导致原花青素的降解和氧化,且SE强度越大,降解越明显[30]。相似地,花色苷的稳定性也较差,因此蒸汽爆破处理后葡萄皮渣花色苷也会进一步降解,降低其含量。姜彦光等[31]研究表明超高压处理会降低蓝莓花色苷的稳定性。
4 结论
葡萄皮渣中结合态的多酚和黄酮含量明显高于游离态的含量。随着蒸汽爆破强度的增加,葡萄皮渣中FP、FF的释放和提取率呈现出先增加后减低的趋势,分别在1.2 MPa-1 min、1.2 MPa-3 min条件时,含量达到最大。但蒸汽爆破后BP、BF、原花青素和花色苷的提取率大幅度降低。蒸汽爆破处理后游离态提取物的抗氧化活性也呈现出先上升后降低的趋势,而结合态提取物的抗氧化能力逐渐降低,由于结合态提取物的含量明显高于游离态,所以结合态提取物的抗氧化活性明显高于游离态提取物。提取物中酚类和黄酮类物质的含量与抗氧化性之间具有显著相关性。因此,适度的蒸汽爆破对葡萄皮渣酚类物质的释放及抗氧化活性的提升具有良好的效果,为提升葡萄皮渣的综合利用提供一定参考。随着研究的深入,会进一步拓展爆破技术在食品原料预处理及加工行业的利用范围。
[1] NOWSHEHRI J A, ALI BHAT Z A, SHAH M Y.Blessings in disguise:Bio-functional benefits of grape seed extracts[J].Food Research International, 2015, 77:333-348.
[2] JIN L, ZHANG Y L, YAN L M, et al.Phenolic compounds and antioxidant activity of bulb extracts of six Lilium species native to China[J].Molecules (Basel, Switzerland), 2012, 17(8):9 361-9 378.
[3] YILMAZ Y, TOLEDO R T.Major flavonoids in grape seeds and skins:Antioxidant capacity of catechin, epicatechin, and Gallic acid[J].Journal of Agricultural and Food Chemistry, 2004, 52(2):255-260.
[4] REN S C, SUN J T.Changes in phenolic content, phenylalanine ammonia-lyase (PAL) activity, and antioxidant capacity of two buckwheat sprouts in relation to germination[J].Journal of Functional Foods, 2014, 7:298-304.
[5] CHEN Y S, SHEN Y B, FU X, et al.Stir-frying treatments affect the phenolics profiles and cellular antioxidant activity of Adinandra nitidatea (Shiyacha) in daily tea model[J].International Journal of Food Science & Technology, 2017, 52(8):1 820-1 827.
[6] LIU L Y, ZHAO M L, LIU X X, et al.Effect of steam explosion-assisted extraction on phenolic acid profiles and antioxidant properties of wheat bran[J].Journal of the Science of Food and Agriculture, 2016, 96(10):3 484-3 491.
[7] 方芳. 蒸汽爆破预处理对籽粒苋籽实抗氧化能力的影响[J].食品工业科技, 2018, 39(15):21-25;30.
FANG F.Effect of steam explosion treatment on amaranth seeds antioxidant capacity[J].Science and Technology of Food Industry, 2018, 39(15):21-25;30.
[8] LIU C, ZHANG R T, LIU B G, et al.Effect of steam explosion treatment on phenolic acid composition of wheat bran and its antioxidant capacity[J].Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(6):308-314.
[9] JUNG J Y, HA S Y, YANG J K.Response surface optimization of phenolic compounds extraction from steam exploded oak wood (Quercus mongolica)[J].Journal of the Korean Wood Science and Technology, 2017, 45(6):809-827.
[10] LI W Z, ZHANG X L, HE X Q, et al.Effects of steam explosion pretreatment on the composition and biological activities of Tartary buckwheat bran phenolics[J].Food & Function, 2020, 11(5):4 648-4 658.
[11] 姜黎, 刘娅.超声波辅助提取葡萄皮渣中多酚类物质的研究[J].中国食品添加剂, 2016(11):107-115.
JIANG L, LIU Y.The ultrasonic assistant extraction of polyphenols in grape skin[J].China Food Additives, 2016(11):107-115.
[12] SU D X, ZHANG R F, HOU F L, et al.Comparison of the free and bound phenolic profiles and cellular antioxidant activities of litchi pulp extracts from different solvents[J].BMC Complementary and Alternative Medicine, 2014, 14:9.
[13] ZHANG G, XU Z C, GAO Y Y, et al.Effects of germination on the nutritional properties, phenolic profiles, and antioxidant activities of buckwheat[J].Journal of Food Science, 2015, 80(5):H1111-H1119.
[14] WU N N.Free and bound phenolic profiles of the bran from different rice varieties and their antioxidant activity and inhibitory effects on ɑ-amylose and ɑ-glucosidase[J].Journal of Cereal Science, 2018, 82:206-212.
[15] 杨萍, 李哲.pH示差法与HPLC测定黑枸杞花青素方法比较[J].中国农机化学报, 2017, 38(7):74-78.
YANG P, LI Z.Comparison between pH differential method and HPLC method for measuring anthocyanin content of black wolfberry[J].Journal of Chinese Agricultural Mechanization, 2017, 38(7):74-78.
[16] CHEN Y S, ZHANG R T, LIU C, et al.Enhancing antioxidant activity and antiproliferation of wheat bran through steam flash explosion[J].Journal of Food Science and Technology, 2016, 53(7):3 028-3 034.
[17] MARTINEZ-VILLALUENGA C, PE AS E, CISKA E,et al.Time dependence of bioactive compounds and antioxidant capacity during germination of different cultivars of broccoli and radish seeds[J].Food Chemistry, 2010, 120(3):710-716.
AS E, CISKA E,et al.Time dependence of bioactive compounds and antioxidant capacity during germination of different cultivars of broccoli and radish seeds[J].Food Chemistry, 2010, 120(3):710-716.
[18] ZHANG H, JIANG L, YE S, et al.Systematic evaluation of antioxidant capacities of the ethanolic extract of different tissues of jujube (Ziziphus jujuba Mill.) from China[J].Food and Chemical Toxicology, 2010, 48(6):1 461-1 465.
[19] PENG H,LI W T,LI H Y, et al. Extractable and non-extractable bound phenolic compositions and their antioxidant properties in seed coat and cotyledon of black soybean (Glycine max (L.) merr)[J]. Functional Foods, 2017, 32: 296-312.
[20] GONG L X, HUANG L L, ZHANG Y.Effect of steam explosion treatment on barley bran phenolic compounds and antioxidant capacity[J].Journal of Agricultural and Food Chemistry, 2012, 60(29):7 177-7 184.
[21] MART NEZ-MEZA Y, PÉREZ-JIMÉNEZ J, ROCHA-GUZM
NEZ-MEZA Y, PÉREZ-JIMÉNEZ J, ROCHA-GUZM N N E, et al.Modification on the polyphenols and dietary fiber content of grape pomace by instant controlled pressure drop[J].Food Chemistry, 2021, 360:130035.
N N E, et al.Modification on the polyphenols and dietary fiber content of grape pomace by instant controlled pressure drop[J].Food Chemistry, 2021, 360:130035.
[22] ADOM K K, LIU R H.Antioxidant activity of grains[J].Journal of Agricultural and Food Chemistry, 2002, 50(21):6 182-6 187.
[23] CHENG A W, HOU C Y, SUN J Y, et al.Effect of steam explosion on phenolic compounds and antioxidant capacity in adzuki beans[J].Journal of the Science of Food and Agriculture, 2020, 100(12):4 495-4 503.
[24] TI H H, ZHANG R F, ZHANG M W, et al.Effect of extrusion on phytochemical profiles in milled fractions of black rice[J].Food Chemistry, 2015, 178:186-194.
[25] SUI W J, XIAO Y, LIU R, et al.Steam explosion modification on tea waste to enhance bioactive compounds’ extractability and antioxidant capacity of extracts[J].Journal of Food Engineering, 2019, 261:51-59.
[26] TALEBNIA F, KARAKSHEV D, AMGELIDAKI I, et al.Production of bioethanol from wheat straw:An overview on pretreatment, hydrolysis and fermentation[J].Bioresource Technology, 2010, 101(13):4 744-4 753.
[27] CHEN G Z, CHEN H Z.Extraction and deglycosylation of flavonoids from sumac fruits using steam explosion[J].Food Chemistry, 2011, 126(4):1 934-1 938.
[28] SEÇMELER Ö, GÜÇLÜ ÜSTÜNDA Ö, FERN
Ö, FERN NDEZ-BOLA
NDEZ-BOLA OS J, et al.Effect of subcritical water and steam explosion pretreatments on the recovery of sterols, phenols and oil from olive pomace[J].Food Chemistry, 2018, 265:298-307.
OS J, et al.Effect of subcritical water and steam explosion pretreatments on the recovery of sterols, phenols and oil from olive pomace[J].Food Chemistry, 2018, 265:298-307.
[29] QIN L Z, CHEN H Z.Enhancement of flavonoids extraction from fig leaf using steam explosion[J].Industrial Crops and Products, 2015, 69:1-6.
[30] 张杰. 蒸汽爆破和碱法预处理对霞多丽葡萄籽原花青素的影响[D].北京:北京化工大学, 2019.
ZHANG J.Effect of steam explosion andalkaline pretreatment onprocyanidins of chardonnaygrape seeds[D].Beijing:Beijing University of Chemical Technology, 2019.
[31] 姜彦光, 王殿夫, 朱金艳, 等.超高压处理对蓝莓花色苷稳定性的影响[J].食品工业科技, 2018, 39(18):83-86;148.
JIANG Y G, WANG D F, ZHU J Y, et al.The effect of high pressure processing treatment on the stability of anthocyanin in blueberry[J].Science and Technology of Food Industry, 2018, 39(18):83-86;148.