葛根为豆科植物野葛[Pueraria lobata(Willd.)Ohwi]的干燥根,始载于《神农本草经》,具有解肌退热、生津止渴、透疹、升阳止泻、通经活络和解酒毒等功效[1]。现代研究表明,葛根在维持心血管系统稳定性、保护脑神经、抗氧化、防止肝肾损伤、改善代谢与免疫功能等方面均有显著疗效[2]。因此,药用价值极高的葛根,素有“亚洲人参”之美誉。2002年葛根被国家卫生部正式批准成为首批“药食同源”植物,市场上出现了大批含有葛根的保健食品,具有很高的应用价值和经济价值。
研究表明,葛根中除了含有大量异黄酮类功效成分外,还含有丰富的淀粉、膳食纤维、矿物元素等营养成分,以及多种人体必需氨基酸,尤其是人体不能合成的必需氨基酸含量更高[3]。本课题组前期已经对葛根总蛋白的提取工艺及抗氧化活性进行了研究[4],但是对于葛根分级蛋白的相关研究并未公开。因此,为了更好地开发葛根这一优质蛋白资源,本研究以葛根为原料,采用Osborne法对葛根蛋白进行分级提取,比较4种分级蛋白的理化特性和抗氧化活性,以及谷蛋白的功能特性。旨在为葛根蛋白的深入研究和对葛根资源进行更合理有效的利用提供参考依据。
1 材料与方法
1.1 材料与仪器
葛根药材,吉林省长春市同仁堂大药房。
考马斯亮蓝G-250、牛血清白蛋白、甘油、PBS(pH 7.4)、丙烯酰胺、溴酚蓝、四甲基乙二胺(N,N,N′,N′-tetramethylethylenediamine, TEMED)、维生素C、ABTS、低分子质量蛋白Marker,北京索莱宝科技有限公司;甲醇、无水乙醇,安耐吉化学;冰醋酸,天津市津东天正化学试剂厂;DPPH,上海麦克林生化科技股份有限公司;30%H2O2,索尔维集团;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、过硫酸铵、FeCl3、NaCl、NaOH、NaH2PO4、Na2HPO4、K3[Fe(CN)6]、FeSO4·7H2O,西陇科学股份有限公司;三氯乙酸(trichloroacetic acid,TCA),天津化学试剂有限公司。所有试剂均为分析纯。
UV-1700紫外分光光度计,日本岛津(中国)有限公司;Mini-PROTEAN Tetra电泳仪,美国Bio-Rad公司;微型离心机,德国Sigma有限公司;DF-101S磁力搅拌器,巩义市予华仪器有限公司;HH-6数显恒温水浴锅,金坛市佳美仪器有限公司;A300全自动氨基酸分析仪,德国 membraPure GmbH公司;低温离心机,美国贝克曼库尔特有限公司;酶标仪,SW-CJ苏州苏洁净化设备有限公司;FTIR-850傅里叶变换红外光谱仪,天津港东公司。
1.2 试验方法
1.2.1 葛根蛋白组分提取
参考文献[5]采用Osborne法对葛根蛋白进行分级提取,具体工艺如图1所示。所得上清液A、B、C、D于4 ℃透析,冷冻干燥,分别得到清蛋白、球蛋白、醇溶蛋白和谷蛋白。
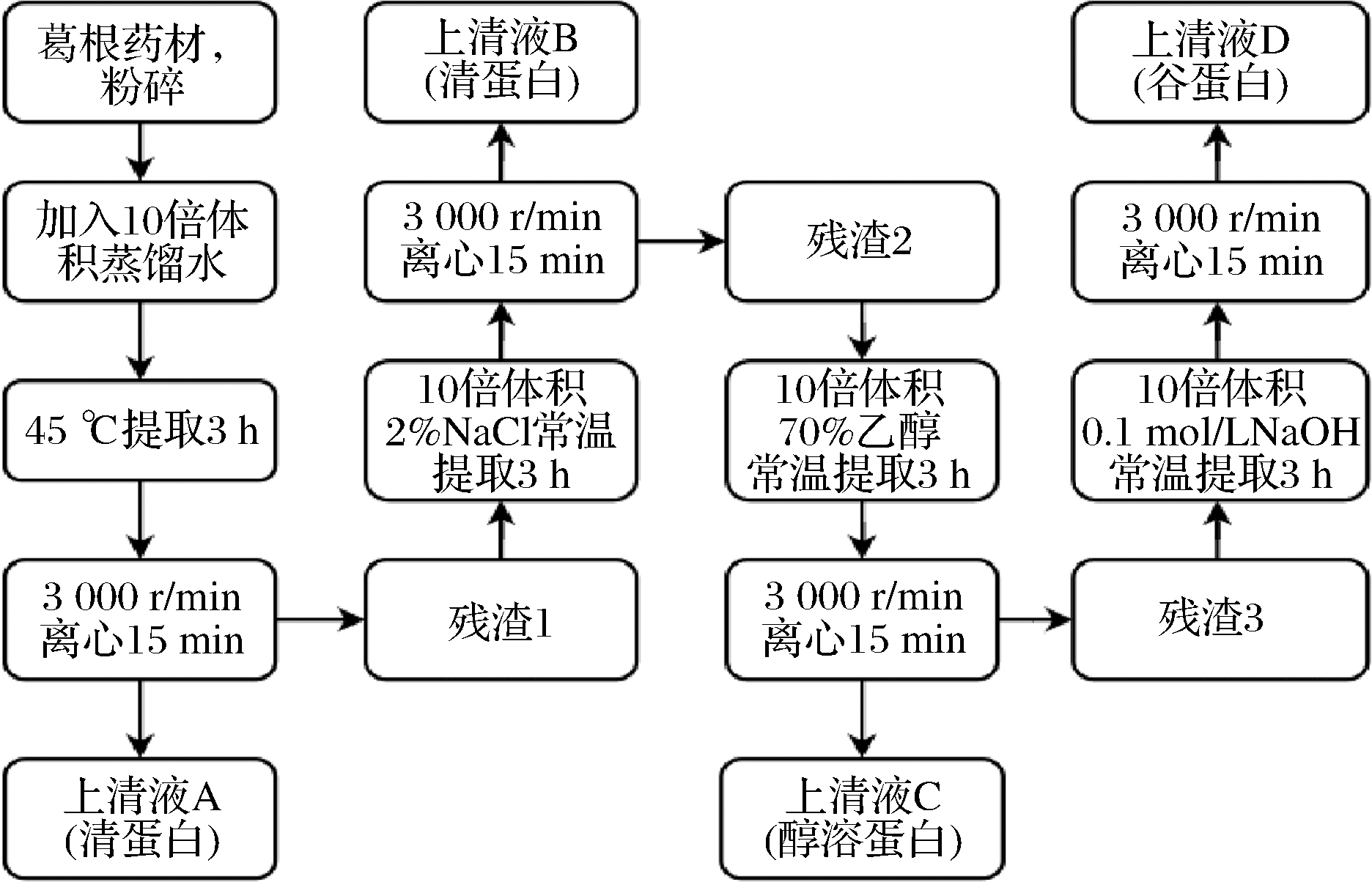
图1 葛根分级蛋白提取工艺流程图
Fig.1 Extraction process flow chart of P.lobata grading protein
1.2.2 葛根分级蛋白的定量和定性分析
1.2.2.1 考马斯亮蓝法测定分级蛋白含量
参照考马斯亮蓝说明书,分别吸取0、20、40、60、80、100、120 μL牛血清蛋白标准溶液(1 mg/mL),加0.01 mol/L PBS补足至3 mL,考马斯亮蓝染色,采用紫外分光光度法在595 nm处测定不同浓度的蛋白质溶液吸光度。以不同浓度的牛血清蛋白为横坐标,吸光度(A)为纵坐标,绘制标准曲线。葛根分级蛋白样品溶液用上述方法测定,由标准曲线求其质量分数。
1.2.2.2 SDS-PAGE电泳分析
参照LAEMMLI等[6]方法。分别将葛根蛋白组分与上样缓冲液,按1∶1(体积比)混合,100 ℃煮沸5 min,冷却至室温,上样。分离胶浓度12%、浓缩胶浓度5%,样品上样量20 μL。采用垂直板电泳,浓缩胶电压70 mV,时间30 min,分离胶电压140 mV,时间60 min。电泳结束后,采用考马斯亮蓝R250染色30 min,脱色后,Invitrogen iBright FL 1000扫描成像。
1.2.3 葛根分级蛋白的氨基酸组成测定
参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》方法。分别称取葛根分级蛋白冻干样品30.00 mg于水解管中,加入6 mol/L HCl溶液,抽真空,封管,110 ℃水解24 h,吸取800 μL水解液蒸干,用0.02 mol/L HCl溶液稀释,采用A300全自动氨基酸分析仪进行测定。
1.2.4 葛根分级蛋白的二级结构测定
参照林凤英[7]的方法,采用FT-IR进行葛根分级蛋白的二级结构测定。分别称取葛根分级蛋白4 mg,与200 mg KBr粉末混合研磨压片。以KBr作为空白对照,通过傅里叶变换红外光谱仪在波数为500~4 000 cm-1测定吸收光谱,分辨率为4 cm-1。
1.2.5 葛根分级蛋白的体外抗氧化活性测定
1.2.5.1 DPPH自由基清除能力
参照徐武等[8]的方法并略作修改。分别移取葛根分级蛋白溶液1 mL于试管中,加入2 mL 0.004%(质量分数) DPPH溶液,混匀于暗室反应30 min,在517 nm处测定吸光度值A1;空白组用1 mL蒸馏水代替样品溶液,测定吸光度值A0;样品对照组用2 mL甲醇代替DPPH溶液,测定吸光度值A2。以甲醇作为空白调零,维生素C作为阳性对照组,DPPH自由基清除率按公式(1)计算:
DPPH自由基清除率/%=[A0-(A1-A2)]/A0×100
(1)
1.2.5.2 ·OH清除能力
参照文献[8]的方法并略作修改。分别移取葛根分级蛋白溶液1 mL于试管中,加入1 mL 0.75 mmol/L邻二氮菲溶液和1.5 mL 0.2 mol/L磷酸盐缓冲溶液,混匀,再加入1 mL 0.75 mmol/L FeSO4溶液和1 mL 0.01%(体积分数,下同)H2O2溶液,混匀,37 ℃水浴反应1 h,在536 nm处测定吸光度值A1;正常组以2 mL蒸馏水代替1 mL样品溶液和1 mL 0.01% H2O2溶液,测定吸光度值A0;阴性组以1 mL蒸馏水代替样品,测定吸光度值A2;样品对照组以3 mL蒸馏水代替1 mL 0.75 mmol/L邻二氮菲溶液、1 mL 0.75 mmol/L FeSO4溶液、1 mL 0.01% H2O2溶液,测定吸光度值A3。以蒸馏水作为空白调零,维生素C作为阳性对照,·OH清除率按公式(2)计算:
·OH清除率/%=(A1-A3-A2)/(A0-A2)×100
(2)
1.2.5.3 ABTS阳离子自由基清除能力
参照文献[8]的方法并略作修改。取0.4 mL ABTS阳离子储备液,用pH 7.4磷酸盐缓冲溶液稀释,保持溶液在常温下734 nm处吸光值为(0.7±0.02),制成ABTS工作液。分别将200 mL ABTS工作液与10 mL不同浓度的样品溶液混匀,室温避光反应6 min,于734 nm处测定吸光值A1。用10 mL磷酸盐缓冲溶液代替样品溶液作为对照组,测定吸光值A0,以维生素C为阳性对照组,ABTS阳离子自由基清除率按公式(3)计算:
ABTS阳离子自由基清除率/%=[1-(A0-A1)/A0]×100
(3)
1.2.5.4 总还原能力
参照文献[8]的方法并略作修改。分别称取葛根分级蛋白溶液加入2.5 mL 0.2 mol/L磷酸盐缓冲溶液和2.5 mL 1%(质量分数) K3Fe(CN)6溶液,50 ℃水浴反应20 min,冷却,加入2.5 mL 10%(体积分数)三氯乙酸,离心,取上清液2.5 mL,依次加入2.5 mL蒸馏水和0.5 mL 0.1%(质量分数) FeCl3溶液,摇匀,静置,在700 nm处测定吸光度值A1;以2.5 mL蒸馏水代替2.5 mL 1% K3Fe(CN)6溶液,其余步骤相同,测定吸光度值A2。以蒸馏水作为空白调零,维生素C作为阳性对照组。总还原能力按公式(4)计算:
总还原能力=A1-A2
(4)
1.2.6 葛根谷蛋白的功能特性测定
1.2.6.1 pH值对蛋白质功能特性的影响
称取葛根谷蛋白样品适量配制成一定浓度,用0.1 mol/L HCl溶液或NaOH溶液将pH调至2、3、4、5、6、7,分别测定不同pH值对葛根谷蛋白的持水性(waterabsorption capacity, WAC)、持油性(oil absorption capacity, OAC)、起泡性(foam capability, FC)及起泡稳定性(foam stability, FS)、乳化性(emulsion capability, EC)及乳化稳定性(emulsion stability, ES)的影响。
1.2.6.2 温度对蛋白质功能特性的影响
称取葛根谷蛋白样品适量配制成一定浓度,分别置于30、40、50、60、70 ℃水浴锅中加热10 min,冷却后分别测定不同温度对葛根谷蛋白WAC、OAC、FC、FS、EC及ES的影响。
1.2.6.3 NaCl浓度对蛋白质功能特性的影响
称取葛根谷蛋白样品适量配制成一定浓度,分别置于0、0.5、1.0、1.5、2.0、2.5、3.0 mol/L的NaCl溶液,测定不同离子强度对葛根谷蛋白WAC、OAC、FC、FS、EC及ES的影响。
1.2.6.4 功能特性指标测定
参照文献[9]的方法,WAC和OAC分别按公式(5)和(6)计算。
(5)
(6)
式中:m0,蛋白样品质量,g;m1,蛋白样品和空离心管的质量,g;m2,离心管和沉淀物的质量,g。
参照文献[9]的方法,EC和ES按公式(7)和(8)计算。
(7)
(8)
式中:h,液体总高度,cm;h1,乳化层高度,cm;h2,再次乳化层高度,cm。
参照文献[9]的方法,FC和FS按公式(9)和(10)计算。
(9)
(10)
式中:V0,搅拌前液体体积,mL;V1,静止前泡沫体积,mL;V2,下层液体体积,mL;V3,静止后泡沫体积,mL。
1.2.7 数据统计与分析
每个试验均重复3次,结果以均值±标准差表示。采用 Excel 2010、SPSS 20.0、Origin Pro 2019 对试验所得数据进行统计分析、相关性分析及图像绘制。
2 结果与分析
2.1 葛根4种分级蛋白的含量
采用Osborne分级法提取葛根分级蛋白,分别得到清蛋白、球蛋白、醇溶蛋白和谷蛋白,再采用考马斯亮蓝法测定4种蛋白含量。以不同浓度的牛血清蛋白质量为横坐标,吸光度(A)为纵坐标,得到线性回归方程:Y=38.799X+0.546 6,R2=0.994 5。由图2可知,谷蛋白质量分数最高为253.2 mg/g。球蛋白次之,为82.7 mg/g,所得醇溶蛋白和清蛋白较少。
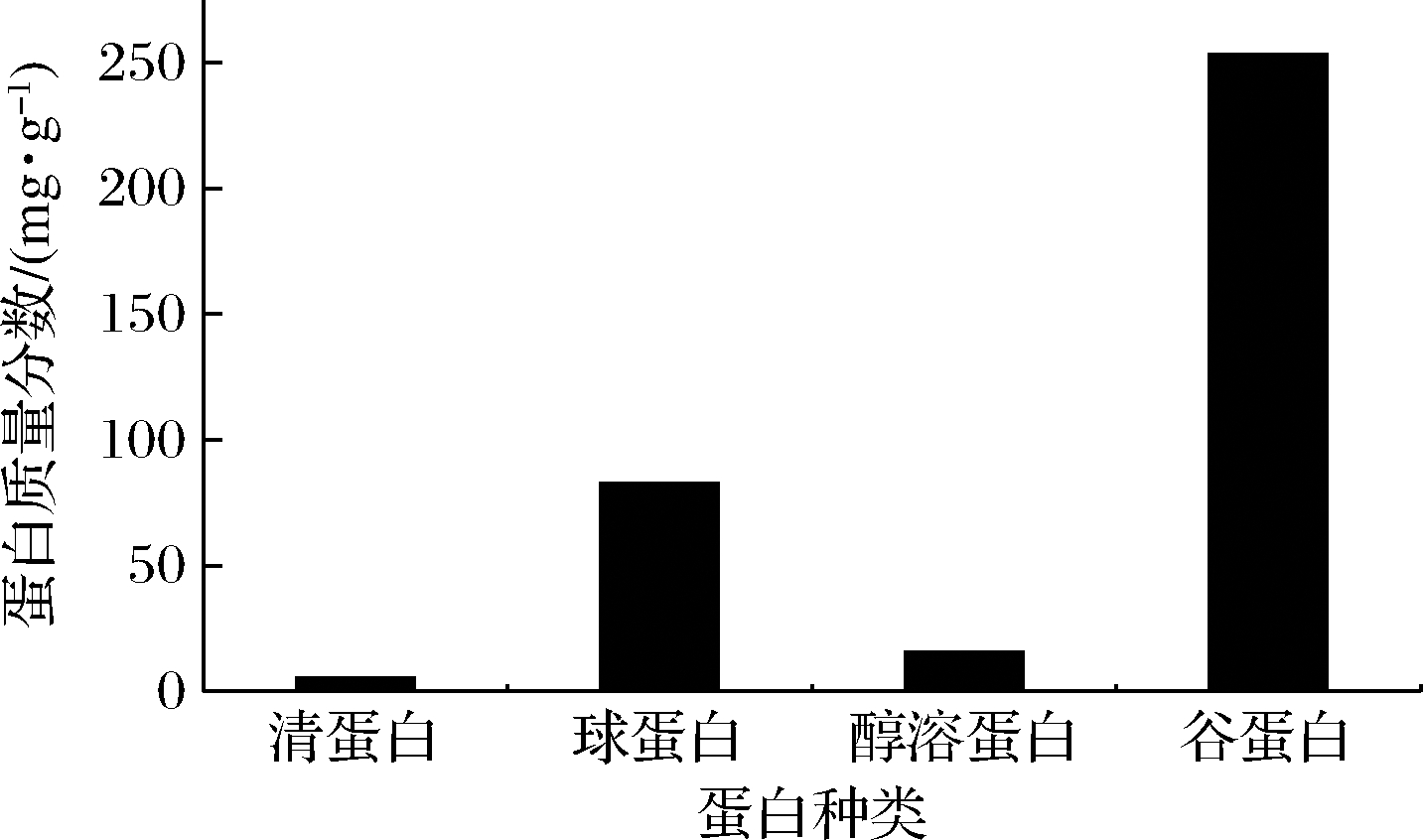
图2 葛根4种分级蛋白的质量分数
Fig.2 Mass fraction of four P.lobata grading proteins
2.2 葛根分级蛋白的SDS-PAGE分析
利用SDS-PAGE对葛根分级蛋白进行相对分子质量的表征。由图3可知,在还原条件下,葛根总蛋白和分级蛋白亚基条带区别显著。总蛋白在15~60 kDa内亚基条带分布明显,主要有6个亚基;清蛋白、球蛋白和谷蛋白的亚基主要分布在15~25 kDa,醇溶蛋白无明显亚基条带。
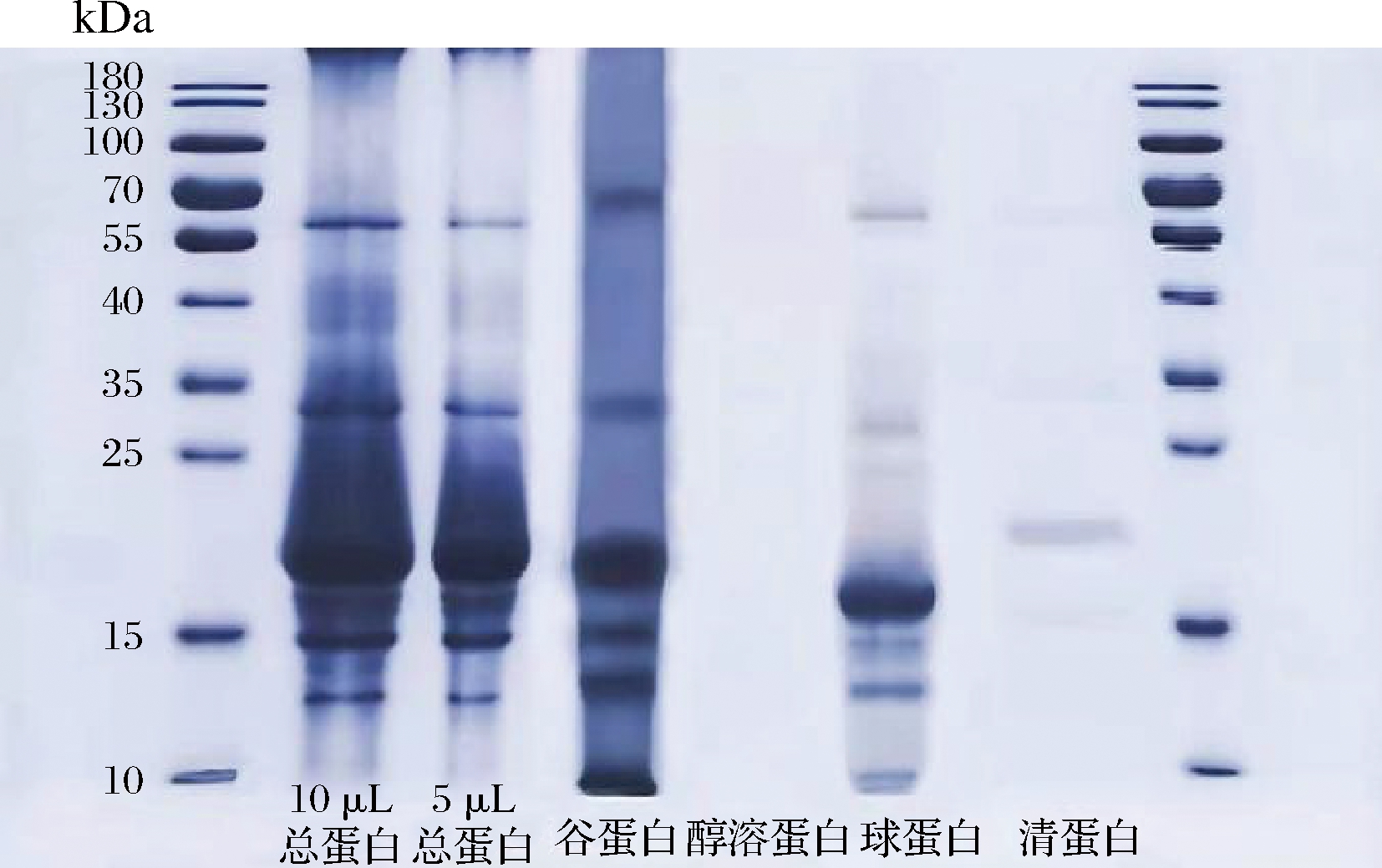
图3 葛根分级蛋白的SDS-PAGE
Fig.3 SDS-PAGE results of P.loabta grading protein
2.3 葛根分级蛋白的氨基酸组成分析
氨基酸是人体必需的营养成分。缺乏氨基酸时,人体正常的生长发育就会受到抑制或导致疾病产生(表1)。
由表1可知,4种组分蛋白中均含有8种必需氨基酸和9种非必需氨基酸,Osborne法分级分离结果表明,葛根中的清蛋白、球蛋白、醇溶蛋白和谷蛋白含量分别为1.81%、17.28%、1.36%和25.26%,葛根蛋白以球蛋白与谷蛋白为主,二者各种氨基酸含量有很大相似之处,酸性氨基酸(天冬门氨酸、谷氨酸)含量最高,其中球蛋白中含有22.91%,谷蛋白中含有23.44%;而谷氨酸是生物机体内氮代谢的基本氨基酸之一,在代谢上具有重要意义,其能与氨结合生成谷氨酰胺,能够增加血氨的去路,可用于治疗肝昏迷[10]。
表1 葛根分级蛋白的氨基酸组成和含量 单位:g/100 g
Table 1 Amino acid composition and content of P.loabta grading protein
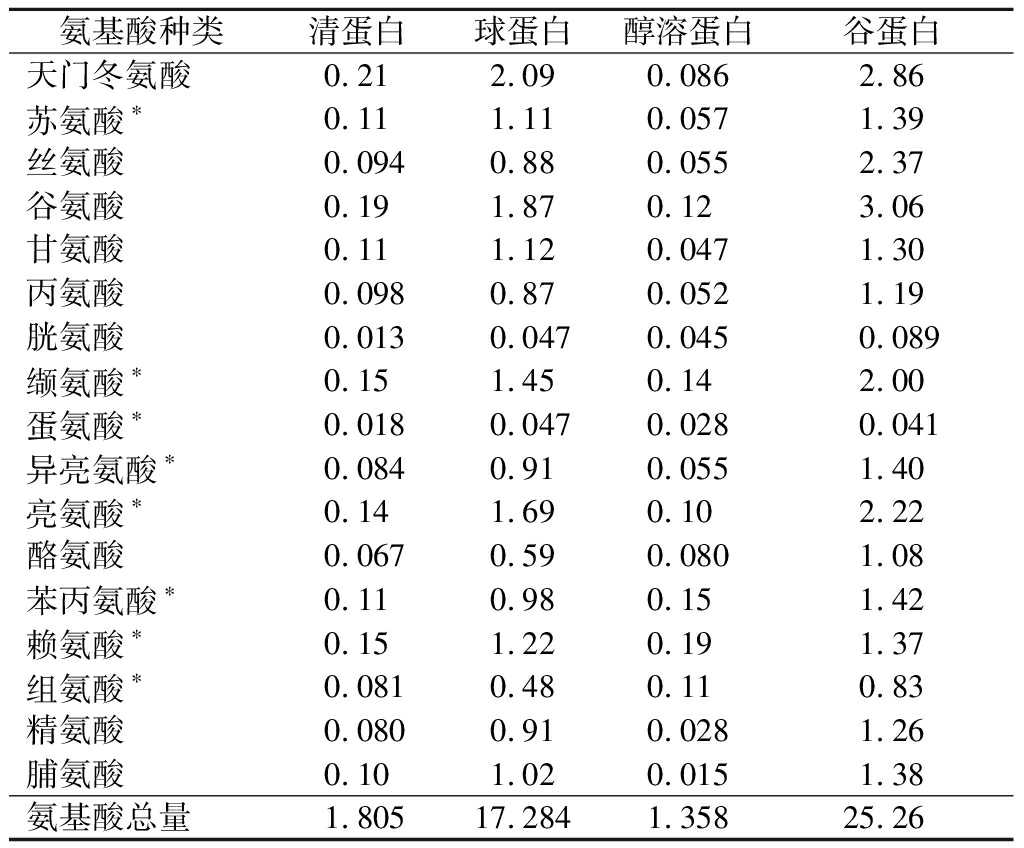
氨基酸种类清蛋白球蛋白醇溶蛋白谷蛋白天门冬氨酸0.212.090.0862.86苏氨酸∗0.111.110.0571.39丝氨酸0.0940.880.0552.37谷氨酸0.191.870.123.06甘氨酸0.111.120.0471.30丙氨酸0.0980.870.0521.19胱氨酸0.0130.0470.0450.089缬氨酸∗0.151.450.142.00蛋氨酸∗0.0180.0470.0280.041异亮氨酸∗0.0840.910.0551.40亮氨酸∗0.141.690.102.22酪氨酸0.0670.590.0801.08苯丙氨酸∗0.110.980.151.42赖氨酸∗0.151.220.191.37组氨酸∗0.0810.480.110.83精氨酸0.0800.910.0281.26脯氨酸0.101.020.0151.38氨基酸总量1.80517.2841.35825.26
注:*代表必需氨基酸
2.4 葛根分级蛋白的二级结果分析
FT-IR技术是分析分子结构最有效的技术之一。如图4所示,蛋白质的红外光谱中有许多特征吸收峰,在3 400~3 300 cm-1处为酰胺A带的吸收峰(N—H伸缩振动)。

a-清蛋白;b-球蛋白;c-醇溶蛋白;d-谷蛋白
图4 葛根组分蛋白红外分析谱图
Fig.4 Infrared analysis spectrum of P.lobata grading protein
2 850~2 980 cm-1附近出现的吸收峰主要是酰胺B带的—NH和—OH的伸缩振动峰。酰胺II带位于1 400 cm-1附近(N—H弯曲的顺式构象)。酰胺Ⅲ带位于1 300~ 1 200 cm-1(C—O和C—O—C振动)。其中1 600 cm-1附近的酰胺Ⅰ带是蛋白质典型的肽键(O![]() C—N—H)伸缩振动峰[11]。运用PeakFit v4.12软件对红外光谱图酰胺Ⅰ带进行分析,得知葛根谷蛋白的二级结构以β-转角为主,占47.51%,少数为β-折叠和无规则卷曲结构。β-转角是一种非重复性结构,主要与多肽链的弯曲、回折和重新定向有关,β-转角大多处在蛋白质分子的表面,因为在这里改变多肽链方向的阻力比较小,β-转角的存在更有利于蛋白质生成结实、球状的结构[12]。
C—N—H)伸缩振动峰[11]。运用PeakFit v4.12软件对红外光谱图酰胺Ⅰ带进行分析,得知葛根谷蛋白的二级结构以β-转角为主,占47.51%,少数为β-折叠和无规则卷曲结构。β-转角是一种非重复性结构,主要与多肽链的弯曲、回折和重新定向有关,β-转角大多处在蛋白质分子的表面,因为在这里改变多肽链方向的阻力比较小,β-转角的存在更有利于蛋白质生成结实、球状的结构[12]。
2.5 葛根分级蛋白抗氧化活性分析
2.5.1 DPPH自由基清除能力
DPPH自由基在有机溶剂中非常稳定,呈紫色,在517 nm处有一个特征吸收峰,自由基清除剂可与DPPH自由基的孤对电子配对,使其在最大吸收波长处的吸光度变小,颜色从紫色褪至黄色。因此,通过测定吸光度的变化可评价对DPPH自由基的捕获能力。该方法灵敏、简便、实用且重现性好,多用于天然有机化合物和植物提取物的抗氧化活性评价[13]。由图5可知,4种葛根分级蛋白均具有对DPPH自由基的清除能力,且呈现良好的剂量依赖性。在质量浓度为0~1.6 mg/mL时,DPPH自由基清除能力随葛根分级蛋白浓度升高而增大,在1.6 mg/mL后各组分蛋白清除率趋于稳定,DPPH的IC50值由小到大依次为谷蛋白(0.118 mg/mL)、球蛋白(0.221 mg/mL)、清蛋白(0.300 mg/mL)、醇溶蛋白(0.700 mg/mL)。
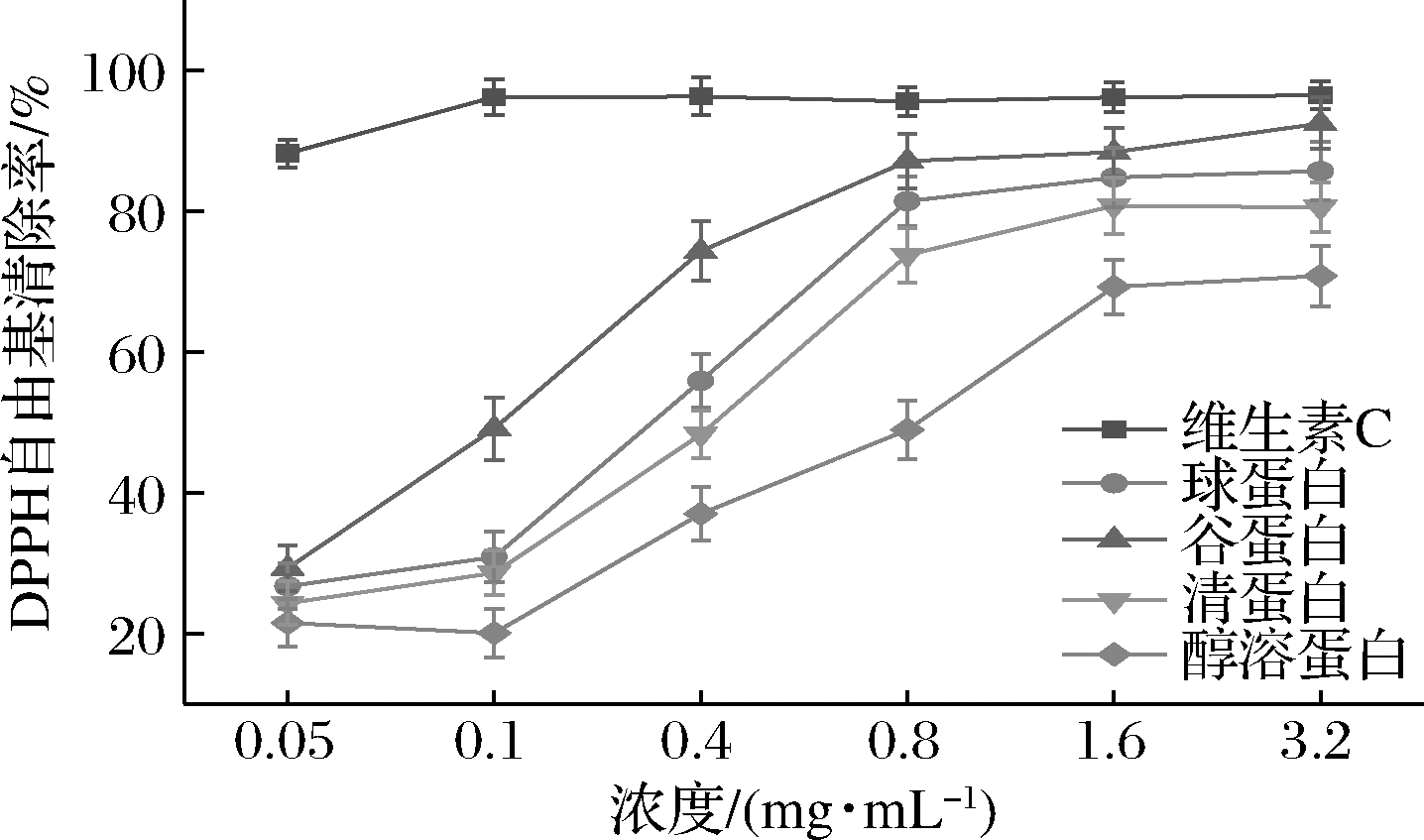
图5 葛根分级蛋白DPPH自由基清除能力
Fig.5 DPPH radical scavenging ability of P.lobata grading protein
2.5.2 ·OH清除能力
·OH是一种非常容易发生化学反应的活泼自由基,在Cu2+或Fe3+存在的条件下,可由![]() 和H2O2反应形成。·OH极易与氨基酸、蛋白质、DNA 等发生反应,也可引起脂质过氧化反应,·OH清除率大小可作为评价抗氧化活性的重要指标[15]。由图6可知,4种葛根分级蛋白均有·OH清除能力,其IC50值由小到大依次排序为谷蛋白(0.217 mg/mL)、球蛋白(0.428 mg/mL)、清蛋白(0.982 mg/mL)、醇溶蛋白(4.188 mg/mL),其中谷蛋白清除能力明显高于其他3种蛋白,且与维生素C相近。而·OH清除活性与一些生理活性有直接关系,很有可能具有血管紧张素转化酶抑制活性[15]。
和H2O2反应形成。·OH极易与氨基酸、蛋白质、DNA 等发生反应,也可引起脂质过氧化反应,·OH清除率大小可作为评价抗氧化活性的重要指标[15]。由图6可知,4种葛根分级蛋白均有·OH清除能力,其IC50值由小到大依次排序为谷蛋白(0.217 mg/mL)、球蛋白(0.428 mg/mL)、清蛋白(0.982 mg/mL)、醇溶蛋白(4.188 mg/mL),其中谷蛋白清除能力明显高于其他3种蛋白,且与维生素C相近。而·OH清除活性与一些生理活性有直接关系,很有可能具有血管紧张素转化酶抑制活性[15]。
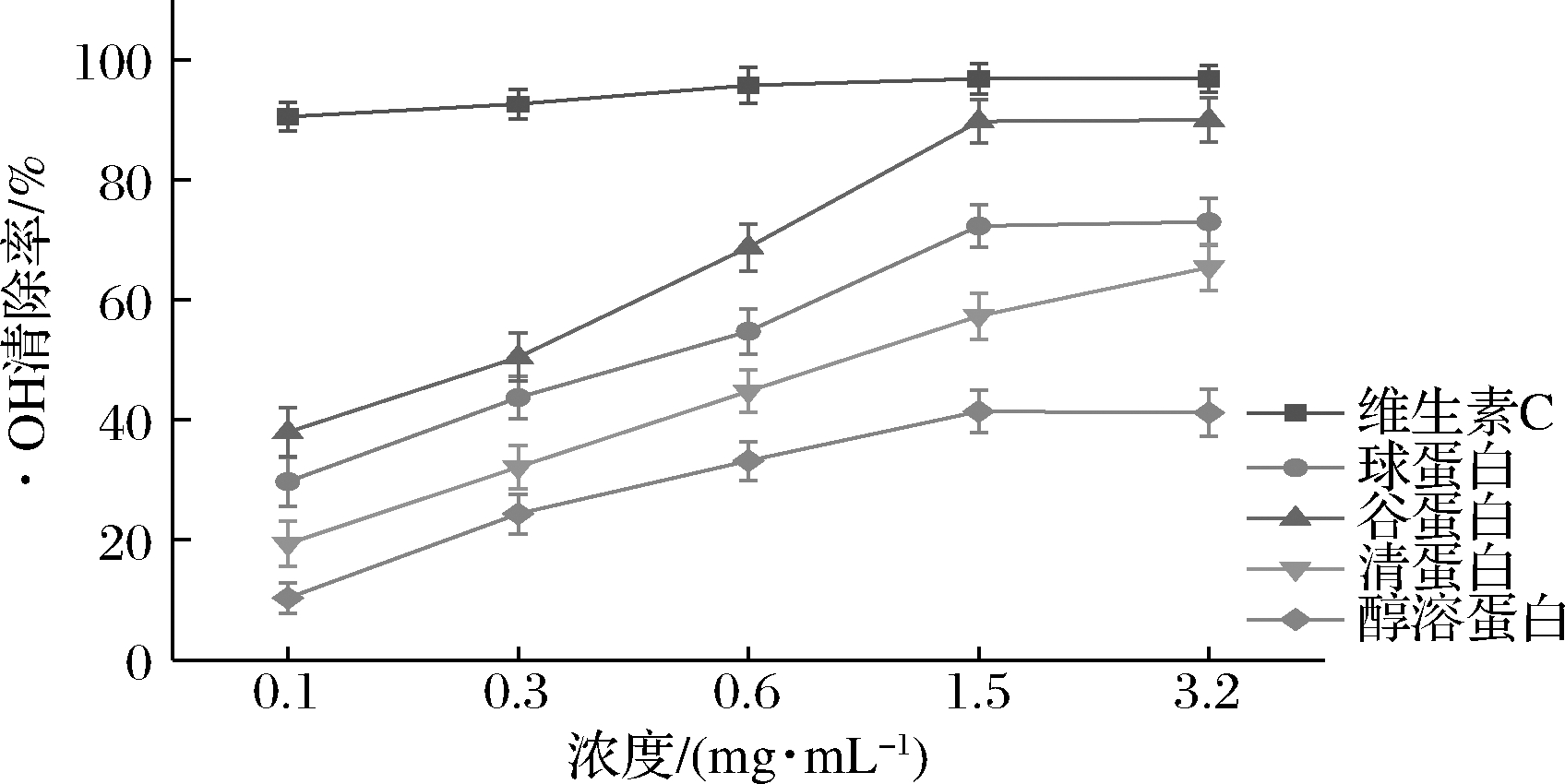
图6 葛根分级蛋白·OH清除能力
Fig.6 ·OH free radical scavenging ability of P.lobata grading protein
2.5.3 ABTS阳离子自由基清除能力
ABTS阳离子用于测定亲水性和亲脂性物质的抗氧化能力。K2SO4可以催化ABTS生成稳定的绿色自由基。生物活性物质的抗氧化活性可以通过ABTS阳离子自由基清除率来评估[16]。当某物质与ABTS阳离子自由基反应后,如果在734 nm处的吸光值降低,则说明该化合物具有自由基清除活性。吸光值下降越多则其清除率越高。
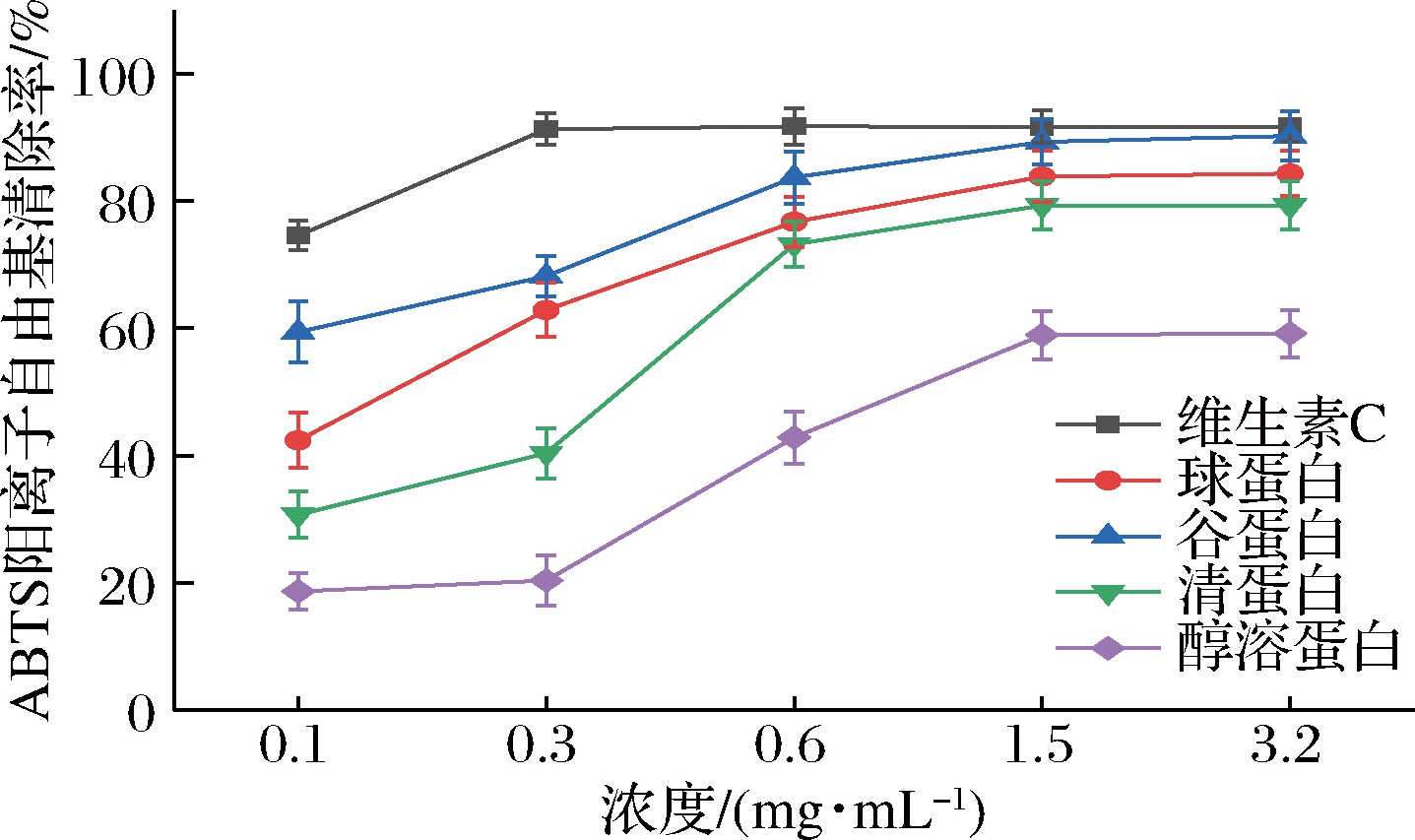
图7 葛根分级蛋白ABTS阳离子自由基清除能力
Fig.7 ABTS free radical scavenging ability of P.lobata grading protein
由图7可知,葛根分级蛋白随浓度增加ABTS阳离子自由基清除能力呈逐渐上升趋势,与其DPPH自由基清除能力趋势相似,当蛋白浓度达到3.2 mg/mL时,ABTS阳离子自由基清除能力趋于平稳,谷蛋白达到90.22%,接近维生素C的清除率,球蛋白达到84.32%,清蛋白达79.29%,醇溶蛋白清除能力最差,只有59.21%。谷蛋白、球蛋白、清蛋白和醇溶蛋白的IC50值分别为0.089、0.135、0.307、1.281 mg/mL。
2.5.4 还原能力
抗氧化剂使K4[Fe(CN)6]被还原成K4Fe(CN)6,Fe3+与K4Fe(CN)6可以发生反应,产生普鲁士蓝,普鲁士蓝在700 nm处有强吸收峰,还原力与抗氧化剂的能力成一定正比例,所以吸光度值越大,产生的普鲁士蓝越多,说明其抗氧化能力越强[17]。本实验利用上述原理表征还原能力。由图8可知,葛根4种分级蛋白及维生素C对Fe3+有还原能力,但4种蛋白还原能力远低于维生素C,尽管如此,谷蛋白的还原能力仍优于其他蛋白,还原能力达1.33。
2.6 葛根谷蛋白功能特性分析
2.6.1 pH对葛根谷蛋白功能性质的影响
由图9可知,随着pH值增大,持水性、持油性、乳化性、乳化稳定性和起泡性都是先降低后升高,在pH 4.0时都达到了最低值;而起泡稳定性变化不明显。可能是pH值在等电点附近时,变性形成粗糙聚集物,致使溶解度很低,降低了蛋白的持水性、乳化性、乳化稳定性及起泡性[18]。当pH值大于或小于等电点时,蛋白溶解度增加,使得蛋白的持水性、持油性、乳化性、乳化性稳定性及起泡性也随之增加。
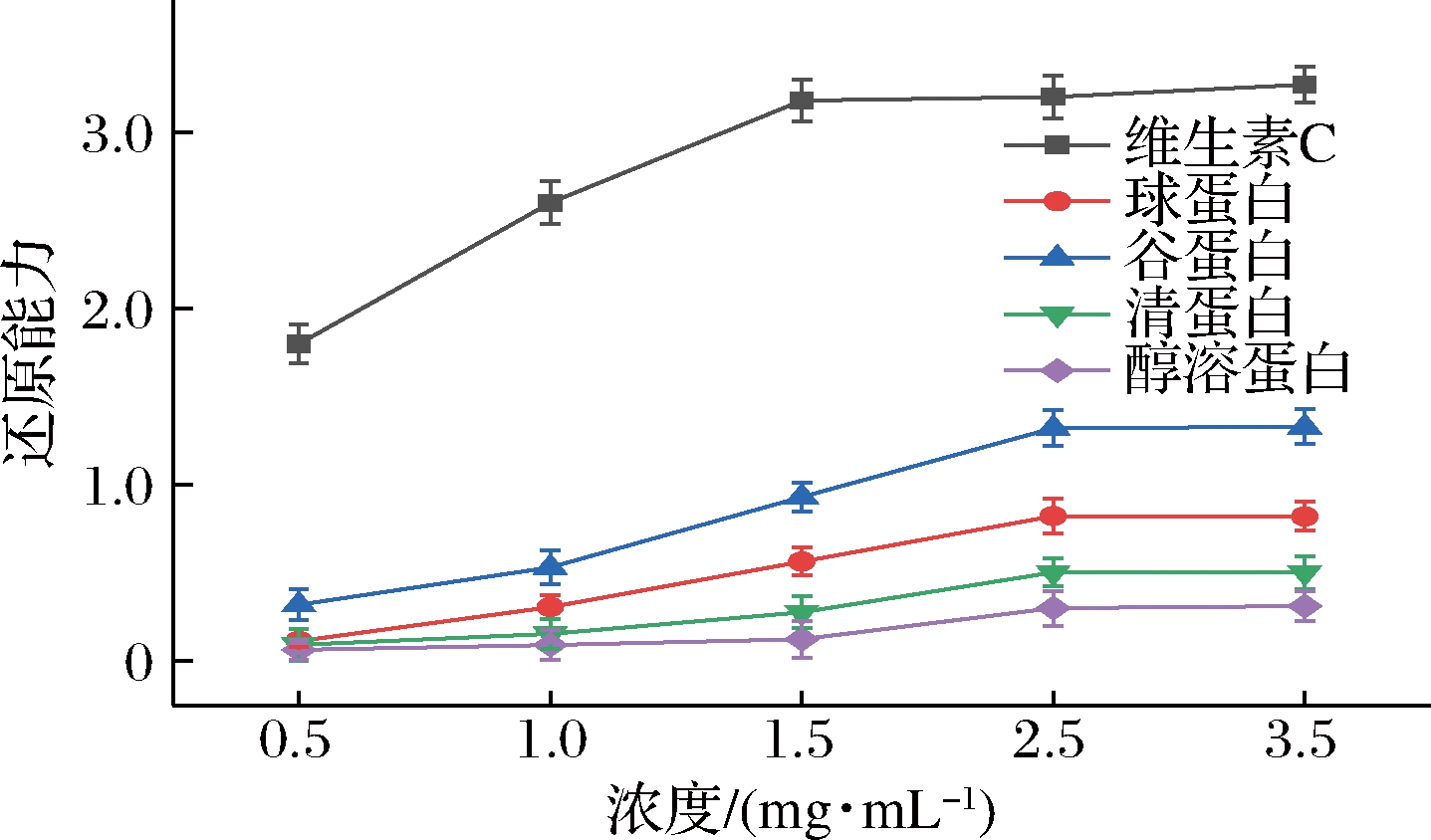
图8 葛根分级蛋白还原能力
Fig.8 Reducting ability of P.lobata grading protein
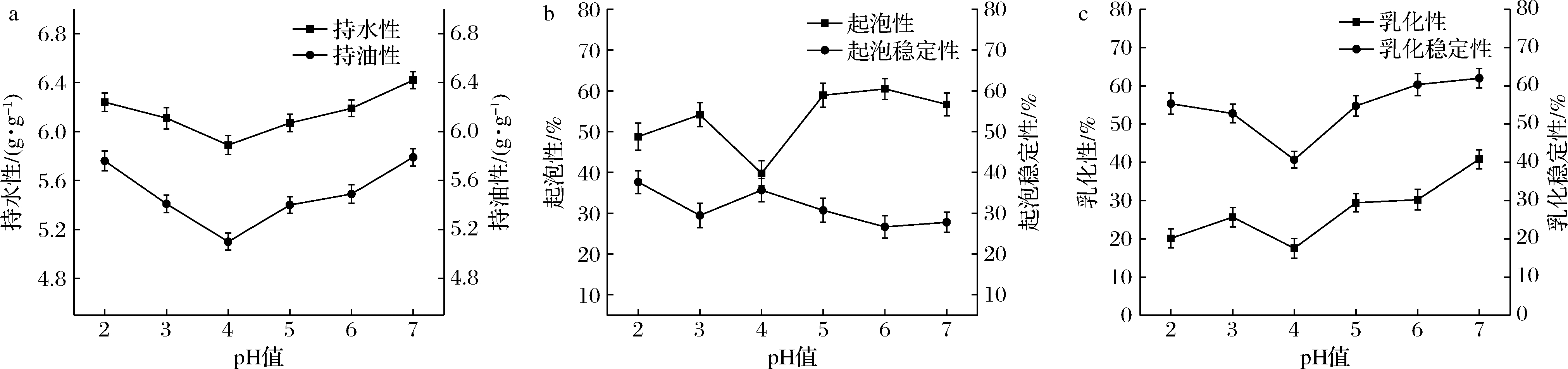
a-持水性和持油性;b-起泡性和起泡稳定性;c-乳化性和乳化稳定性
图9 pH值对谷蛋白功能特性的影响
Fig.9 Effect of pH value on functional characteristics of glutenin
2.6.2 温度对葛根谷蛋白功能性质的影响
由图10可知,温度对葛根谷蛋白功能特性影响较大。随着温度的升高,葛根谷蛋白的持水性、乳化稳定性呈现先下降后上升再下降趋势。持油性、乳化性与起泡性趋势相反。当温度为60 ℃时,乳化性降到最低值为65%,乳化稳定性则升到最大值为90%。在温度为50 ℃时,起泡性达到最大值为40.78%。在50~60 ℃时,可能是因为蛋白质在较低温度时,其结构变得疏散,增加了蛋白质持水性和起泡性,而在较高温度的作用下,破坏了水表面的泡沫结构[19],从而起泡稳定性降低。

a-持水性和持油性;b-起泡性和起泡稳定性;c-乳化性和乳化稳定性
图10 温度对谷蛋白功能特性的影响
Fig.10 Effect of temperature on functional characteristics of glutenin
2.6.3 NaCl浓度对葛根谷蛋白功能性质的影响
离子强度对谷蛋白功能性质的影响见图11,随着离子强度的增大,持水性、乳化性及乳化稳定性呈下降趋势,持油性、起泡性及起泡稳定性变化不明显。当离子浓度为1.0 mol/L时,乳化性、乳化稳定性及起泡稳定性最好。可能由于盐浓度达到一定程度时形成大量的蛋白质网络结构,从而导致稳定性增加[20]。
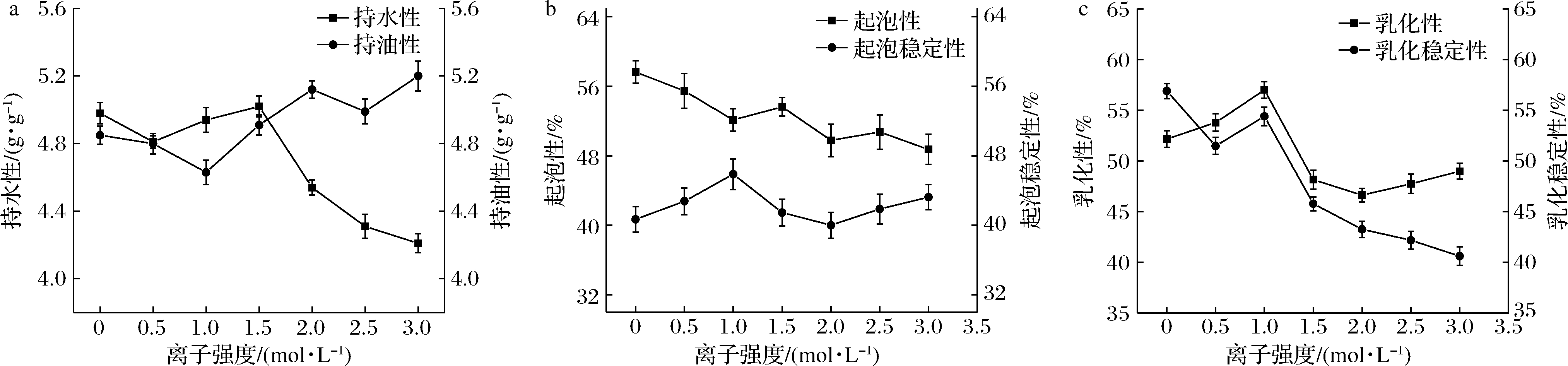
a-持水性和持油性;b-起泡性和起泡稳定性;c-乳化性和乳化稳定性
图11 NaCl浓度对谷蛋白功能特性的影响
Fig.11 Effect of NaCl concentration on functional characteristics of glutenin
3 结论
本次试验根据Osborne分级分离方法提取葛根分级蛋白后对其进行定量和定性分析,通过SDS-PAGE、傅里叶红外光谱及氨基酸组分测定分析其分子质量分布及二级结构,并对其抗氧化活性进行评价与比较。结果表明谷蛋白的蛋白含量较高。SDS-PAGE表明醇溶蛋白没有明显条带,可能提取出的成分主要是低分子质量的肽类成分,球蛋白的条带最明显,分子质量主要分布在15~25 kDa。红外光谱分析谷蛋白的二级结构较稳定。氨基酸组分分析结果表明,球蛋白与谷蛋白的氨基酸含量较高,2种蛋白中酸性氨基酸与支链氨基酸含量较高,在代谢与延缓疲劳方面具有重要作用。
新陈代谢产生的自由基会导致机体内生物膜、蛋白质、酶及活细胞产生过氧化损伤,从而加速机体衰老及导致多种疾病的发生,添加抗氧化剂能够有效清除自由基、预防疾病、延缓机体衰老。本实验抗氧化活性研究结果表明4种蛋白均有较好的体外抗氧化能力,谷蛋白的DPPH自由基、·OH、ABTS阳离子自由基的清除率及还原能力较好,且与维生素C接近。综上表明在葛根组分蛋白中,谷蛋白具有良好的抗氧化活性。谷蛋白的功能特性结果表明,pH值、温度及离子强度对谷蛋白功能特性产生一定的影响。
综上所述,葛根谷蛋白是一个氨基酸含量丰富、抗氧化活性强、值得开发和利用的优质蛋白质。本研究结果为葛根谷蛋白在产品开发及其在食品加工中的应用提供基础实验支撑。
[1] 李时珍.本草纲目[M].2版.北京:中国言实出版社, 2012.
LI S Z.Compendium of Materia Medica[M].Beijing:China Yan shi Press, 2012.
[2] 李蓉, 宋宗良, 张效科, 等. 葛根现代药理作用及复方临床应用研究进展[J]. 海南医学院学报, 2023, 29(2):153-160.
LI R, SONG Z L, ZHANG X K, et al. Research progress of modern pharmacological effects of Pueraria lobata and its compound clinical application[J]. Journal of Hainan Medical University, 2023, 29(2):153-160.
[3] 唐婷范, 杨杰, 黄芳丽, 等.不同产地葛根蛋白质提取工艺及其功能性研究[J].食品研究与开发, 2020, 41(9):32-37.
TANG T F, YANG J, HUANG F L, et al.Study of extraction technology and function of Pueraria lobata protein from different habitats[J].Food Research and Development, 2020, 41(9):32-37.
[4] 王苗, 张红印, 范琳, 等.葛根蛋白提取工艺及其体外抗氧化性研究[J].食品研究与开发, 2021, 42(1):73-79.
WANG M, ZHANG H Y, FAN L, et al.Study on extraction technology of Pueraria lobata protein and its antioxidant activity in vitro[J].Food Research and Development, 2021, 42(1):73-79.
[5] 夏雨, 卓倩婷, 徐雅囡, 等.美藤果蛋白的分级提取、理化性质鉴定及抗氧化活性研究[J].食品科技, 2021, 46(1):193-198.
XIA Y, ZHUO Q T, XU Y N, et al.Study on fractional extraction, physicochemical properties and antioxidant activity of Sacha inchi protein[J].Food Science and Technology, 2021, 46(1):193-198.
[6] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature, 1970, 227(5 259):680-685.
[7] 林凤英. 美藤果清蛋白的提取工艺及性质研究[D].广州:华南农业大学, 2016.
LIN F Y.Study on extraction and property of Sacha inchi albumin[D].Guangzhou:South China Agricultural University, 2016.
[8] 徐武, 黄浩, 宋春丽, 等.黄芪下脚料糖蛋白分离纯化及其抗氧化活性[J].食品科技, 2020, 45(9):188-195.
XU W, HUANG H, SONG C L, et al.Isolation, purification and antioxidant activities of glycoprotein from Astragalus membranaceus waste[J].Food Science and Technology, 2020, 45(9):188-195.
[9] 耿正玮, 樊林娟, 张咏梅, 等.杏鲍菇谷蛋白理化性质及功能特性研究[J].食品研究与开发, 2020, 41(14):55-62.
GENG Z W, FAN L J, ZHANG Y M, et al.Research on physicochemical and functional properties of gluten from Pleurotus eryngii[J].Food Research and Development, 2020, 41(14):55-62.
[10] 魏旭, 肖志刚, 冯秋娟, 等.玉米胚芽分离蛋白提取率及氨基酸组分分析[J].东北农业大学学报, 2011, 42(11):51-57.
WEI X, XIAO Z G, FENG Q J, et al.Extraction rate of protein isolate in corn germ and its amino acid composition[J].Journal of Northeast Agricultural University, 2011, 42(11):51-57.
[11] AHMAD M, BENJAKUL S.Extraction and characterisation of pepsin-solubilised collagen from the skin of unicorn leatherjacket (Aluterus monocerous)[J].Food Chemistry, 2010, 120(3):817-824.
[12] 袁星星, 余元善, 吴继军, 等.荔枝汁中谷蛋白结构及特性[J].食品科学, 2018, 39(12):47-52.
YUAN X X, YU Y S, WU J J, et al.Structure and characteristics of glutelin in litchi juice[J].Food Science, 2018, 39(12):47-52.
[13] 谢正军. 苜蓿叶蛋白和酶法制备抗氧化肽的研究[D].无锡:江南大学, 2009.
XIE Z J.Study on the alfalfa leaf protein and preparation of antioxidant peptides by enzymic hydrolyzing[D].Wuxi:Jiangnan University, 2009.
[14] 郑志强, 李宝林, 郝利民, 等.不同蛋白酶对小麦蛋白酶解物抗氧化活性的影响[J].食品科学, 2017, 38(7):161-166.
ZHENG Z Q, LI B L, HAO L M, et al.Effects of different proteases on antioxidant activities of wheat gluten hydrolysates[J].Food Science, 2017, 38(7):161-166.
[15] RAJAPAKSE N, MENDIS E, JUNG W K, et al.Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J].Food Research International, 2005, 38(2):175-182.
[16] 谷艳菲, 闫伯前, 丁轲, 等.纯化作用对五味子木脂素抗氧化性的影响[J].林业科学, 2015, 51(9):96-105.
GU Y F, YAN B Q, DING K, et al.Effect of purification on antioxidative activity of lignan fractions from Schisandra chinensis[J].Scientia Silvae Sinicae, 2015, 51(9):96-105.
[17] 王海东, 韩荣欣, 张红印, 等.Osborne法分级提取五味子蛋白及抗氧化活性比较[J].食品工业科技, 2021, 42(23):59-65.
WANG H D, HAN R X, ZHANG H Y, et al.Extraction of Schisandra chinensis protein by Osborne method and its antioxidant activity[J].Science and Technology of Food Industry, 2021, 42(23):59-65.
[18] WU H W, WANG Q, MA T Z, et al.Comparative studies on the functional properties of various protein concentrate preparations of peanut protein[J].Food Research International, 2009, 42(3):343-348.
[19] 陈智仙, 张海波, 张双庆, 等.3种不同来源蛋白质的氨基酸组成及体外动态消化研究[J].河南工业大学学报(自然科学版), 2019, 40(2):62-68.
CHEN Z X, ZHANG H B, ZHANG S Q, et al.Amino acid composition analysis and in vitro dynamic digestion of proteins from three different sources[J].Journal of Henan University of Technology (Natural Science Edition), 2019, 40(2):62-68.
[20] 史瑞婕, 郭丰铭, 董亚楠, 等.杏鲍菇蛋白质功能特性研究[J].食品科技, 2018, 43(2):131-136.
SHI R J, GUO F M, DONG Y N, et al.Research on the functional properties of Pleurotus eryngii protein[J].Food Science and Technology, 2018, 43(2):131-136.