凡纳滨对虾(Litopenaeus vannamei)是世界上养殖最广泛的甲壳类动物,2020年我国凡纳滨对虾产量为186多万t[1],占全世界对虾养殖量的80%以上。对虾加工需去除头部和硬壳(占质量近40%~60%)[2],产生大量废物,给虾类行业带来环境污染。然而,虾的生物废弃物是生产几丁质的良好来源。几丁质,由β-(1-4)-聚-N-乙酰-D-氨基葡萄糖残基通过氢键高度交联的一种不溶性生物聚合物,是自然界中最丰富的有机化合物之一(仅次于纤维素)[3]。值得注意的是,几丁质衍生物(如壳聚糖)具有良好的生物降解性、生物相容性和无毒性等功能特性,可广泛应用于生物医学、化妆品、废水处理等领域[4]。但传统化学提取几丁质会产生大量的环境污染物并增加几丁质的部分脱乙酰化。
而酶提取法由于其具有环保性越来越受欢迎,被广泛认为是绿色提取方法之一。几丁质酶在自然界中广泛存在,是一组水解酶,具有几丁质结合和催化结构域,可以水解几丁质中的糖苷键。几丁质酶可将几丁质转化为废物管理、生物医学和酶工业中的有用产品[5]。已有报道称几丁质酶存在于甲壳动物,例如南美白对虾、中华绒螯蟹、斑节对虾、脊尾白虾[6]。来自海洋甲壳动物的几丁质酶具有作为工业应用生物催化剂的潜能。然而,几丁质酶商业应用因为酶产率低、生产成本高及酶稳定性差受到限制[3]。因此,探索提高几丁质酶活性的途径是一项必要的研究。
短波紫外线(ultraviolet-C,UV-C)照射是一种非热技术[7],具有操作简单、安全性高、经济、无污染、无化学残留等优点。BHAT等[8]表明紫外线照射增加了鱼糜凝胶强度,主要是由于紫外线照射引起鱼蛋白空间结构发生变化。KRISTO等[9]观察到紫外诱导的蛋白构象变化增加了乳清蛋白对胃蛋白酶水解的敏感性。另外,适度的UV-C照射可激活生物酶活性,紫外线照射后海参体壁酸性磷酸酶和组织蛋白酶的活性增加,表明紫外线照射在海参体壁“融化”过程中具有潜在的作用[10]。前期研究表明UV-C照射可激活凡纳滨对虾虾头几丁质酶[11],但尚未系统研究优化UV-C照射激活几丁质酶的工艺。因此,本研究以凡纳滨对虾为研究对象,根据其不同组织部位几丁质酶的分布,选择几丁质酶分布最集中的组织部位进行最优工艺的探讨。使用正交实验优化了UV-C照射参数,以开发一种更有效提高几丁质酶活力的工艺。此外,探究了UV-C照射对几丁质酶酶学性质影响,为UV-C照射提高凡纳滨对虾几丁质酶活力提供理论支撑。
1 材料与方法
1.1 材料与试剂
鲜活的凡纳滨对虾,平均体质量:(13.99±0.92) g,平均体长:(13.92±0.58) cm,购自广东省湛江市麻章区湖光市场,将凡纳滨对虾不同部位进行分离,分出头壳、壳(来自虾背部)、胃、肝脏、肠、肉、尾及虾头等组织部位。
几丁质(试剂级),美国Sigma公司;对二甲氨基苯甲醛(4-dimethylaminobenzaldehyde,DMAB)(分析纯),广州化学试剂厂;蜗牛酶,上海源叶生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
DZKW-S-4型电热恒温水浴锅,北京光明医疗仪器有限公司;LG20-W型台式高速冷冻离心机,北京京立离心机有限公司;2-16KL型台式高速冷冻离心机,德国Sigma公司;JYL-C012型榨汁搅拌机,九阳股份有限公司;FE28型实验室pH计,上海梅特勒-托利多仪器有限公司;QL-905型旋涡混合器,海门市其林贝尔仪器制造有限公司;Varioskan Flash型全自动酶标仪,美国Thermo公司;紫外灯(波长 253.7 nm,功率分别为 6、10、20、30、40 W),广东雪莱特光电科股份有限公司。
1.3 实验方法
1.3.1 不同组织部位几丁质酶液制备
参照王贺等[11]的方法,稍作修改。将头壳、壳、胃、肝脏、肠、肉、尾等组织部位按料液比1∶4(g∶mL)加入乙酸钠缓冲液(20 mmol/L,pH 5),再利用搅拌机得到不同组织部位的匀浆物。将匀浆物速冻到0 ℃,待解冻完全后,于4 ℃抽提1 h。随后8 000 r/min离心15 min,得到的上清液即为头壳、壳、胃、肝脏、肠、肉、尾的粗酶液。将酶液分装后放在-80 ℃冰箱储存。
1.3.2 几丁质酶活力的测定
按照王婧[12]的方法,稍作修改,采用DMAB方法用酶标仪测定几丁质酶活力。将乙酸钠缓冲液(50 mmol/L,pH 5.0)、1%胶体几丁质及粗酶液各200 μL在37 ℃水浴反应2 h。将反应混合物以4 000 r/min离心10 min终止反应。取200 μL上清液,加入20 μL 10 g/L蜗牛酶溶液,于37 ℃水浴0.5 h。再加入100 μL饱和硼砂溶液,沸水浴7 min。待冷却后,加入1 000 μL冰醋酸及500 μL 10 g/L DMAB溶液,于37 ℃下水浴15 min。然后在585 nm处测定其吸光度值,并使用不同浓度的N-乙酰葡萄糖胺绘制标准曲线。一个活性单位(U)定义为1 mL酶液每小时分解胶体几丁质产生1 μg N-乙酰氨基葡萄糖的酶量。以20 min加热灭活的酶为阴性对照。几丁质酶比活力以原料鲜重计算,单位为U/g原料。
1.3.3 UV-C照射对虾头几丁质酶的影响
参考CAO等[13]的方法,稍作修改。UV-C照射虾头几丁质酶的固定条件为:照射功率30 W、照射时间20 min、照射高度20 cm。设置的各因素梯度分别为:照射功率10、20、30、40、50 W,照射时间10、15、20、25、30 min,照射高度10、15、20、25、30 cm。在实验过程中,改变以上某种因素,其他条件不变。按照1.3.1得到虾头匀浆物,将其铺在玻璃培养皿(直径9 cm),厚度大概为5 mm。将紫外灯(波长253.7 nm)放在培养皿正上方进行照射。按照1.3.1制备不同UV-C照射条件下的粗酶液,测定几丁质酶活力。以未照射的虾头几丁质酶液为对照组。
1.3.4 正交实验设计
以UV-C照射功率、照射时间、照射高度为试验因素,以几丁质酶比活力为试验指标,选择3因素3水平进行正交试验,试验设计如表1所示。
表1 正交试验设计因素与水平
Table 1 Factors and levels of the orthogonal experiment design

水平因素A(照射功率)/WB(照射时间)/minC(照射高度)/cm16151021020153202520
1.3.5 凡纳滨对虾不同组织部位的激活
将各组织部位的匀浆物按照最优工艺参数进行UV-C照射,然后按照1.3.1制备UV-C照射条件下不同组织部位的粗酶液,来测定照射后各组织部位的几丁质酶活力。以未照射的各组织部位粗酶液为对照。
1.3.6 UV-C照射前后虾头几丁质酶酶学性质变化
1.3.6.1 温度对几丁质酶活力的影响
将UV-C照射的酶液与底物反应体系混合物在pH 5和20~60 ℃的温度范围内测定几丁质酶活力,确定酶的最佳温度。未经UV-C照射的为对照,同上操作。
1.3.6.2 pH对几丁质酶活力的影响
在37 ℃下确定UV-C照射前后虾头几丁质酶的最适pH。使用甘氨酸-HCl缓冲液(pH 2.2~3)、醋酸-醋酸钠缓冲液(pH 4~5)、Na2HPO4-NaH2PO4缓冲液(pH 6~8)和Na2CO3-NaHCO3缓冲液(pH 9)作为50 mmol/L反应缓冲液测定不同pH值下UV-C照射前后几丁质酶活力。
1.3.6.3 金属离子对几丁质酶活力的影响
加入Na2HPO4-柠檬酸缓冲液(50 mmol/L,pH 6.4)配制浓度为10 mmol/L金属盐溶液(Na+、K+、Ca2+、Mg2+、Mn2+、Zn2+、Cu2+、Fe3+)。将各种金属离子添加到UV-C照射和未照射的几丁质酶液中,然后测定几丁质酶活力。
1.4 数据处理
所有实验均做3次平行,结果表示为平均值±标准差。采用SPSS 26.0、Origin 2018软件分析数据及作图。通过Duncan多重检验确定样本之间差异的显著性(P<0.05,差异显著)。
2 结果与分析
2.1 凡纳滨对虾不同组织部位几丁质酶活力分布
如图1-a所示,凡纳滨对虾肝脏、胃、肠、头壳、壳、尾的几丁质酶比活力分别为(72.84±2.54)、(33.54±1.31)、(27.25±0.91)、(21.40±1.25)、(10.74±0.48)、(5.22±0.05)U/g,说明凡纳滨对虾中几丁质酶大部分存在于虾头。凡纳滨对虾不同组织部位几丁质酶活力占比如图1-b所示,肝脏最高,其次是胃、头壳及壳,最后是肠及尾,这主要与各部位质量及酶活力相关。虾头部位(含肝脏、胃、头壳)的几丁质酶活力占比达到84.83%。因此选择虾头做后续试验。研究发现,南美白对虾几丁质酶在肝胰腺中高水平表达但在表皮组织中低水平表达[14]。斑节对虾几丁质酶在肝胰腺和肠道中表达,且参与了蜕皮时几丁质的降解[15]。可知,几丁质酶主要存在于凡纳滨对虾的一些消化吸收器官及表皮,这主要因为几丁质酶可分解几丁质及参与甲壳类动物蜕皮。几丁质酶对于甲壳类动物来说是必不可少的,具有消化几丁质食物、修饰肠道围营养膜和降解几丁质外骨骼的功能[16]。

a-几丁质酶的比活力;b-几丁质酶活力占比
图1 凡纳滨对虾不同组织部位几丁质酶比活力 及酶活力占比
Fig.1 Specific activity and proportion of the chitinase activity in different tissues of L.vannamei
注:不同小写字母表示组间差异显著(P<0.05)(下同)
2.2 UV-C照射对虾头几丁质酶活力的影响
2.2.1 照射功率对几丁质酶活力的影响
如图2所示,不同照射功率下(6、10、20、30、40 W)的几丁质酶比活力均高于未照射的,分别增加了27.32%、40.70%、33.26%、29.30%、17.48%,说明UV-C照射提高了几丁质酶活力。随着照射功率的增加,几丁质酶比活力逐渐增大,在照射功率为10 W时最高,达到(37.75±1.35)U/g(P< 0.05)。当照射功率超过10 W后,酶比活力增加的趋势逐渐减小。相比10 W时最高的几丁质酶比活力,20、30、40 W时几丁质酶比活力分别降低了5.29%、8.11%、16.51%。这些结果表明,低强度光处理可能会改变酶活性位点的构象,而不会损害其催化能力,但会导致整体活性增加。相比之下,UV-C更高强度处理与导致酶失活的不可逆结构变化有关。光会通过2条主要途径改变蛋白质的结构,从而影响蛋白质的生物活性,一是蛋白质结构或发色团吸收辐射引起的直接光氧化,另一个是通过光敏剂能量转移产生单线态氧形成的间接蛋白质氧化[17]。
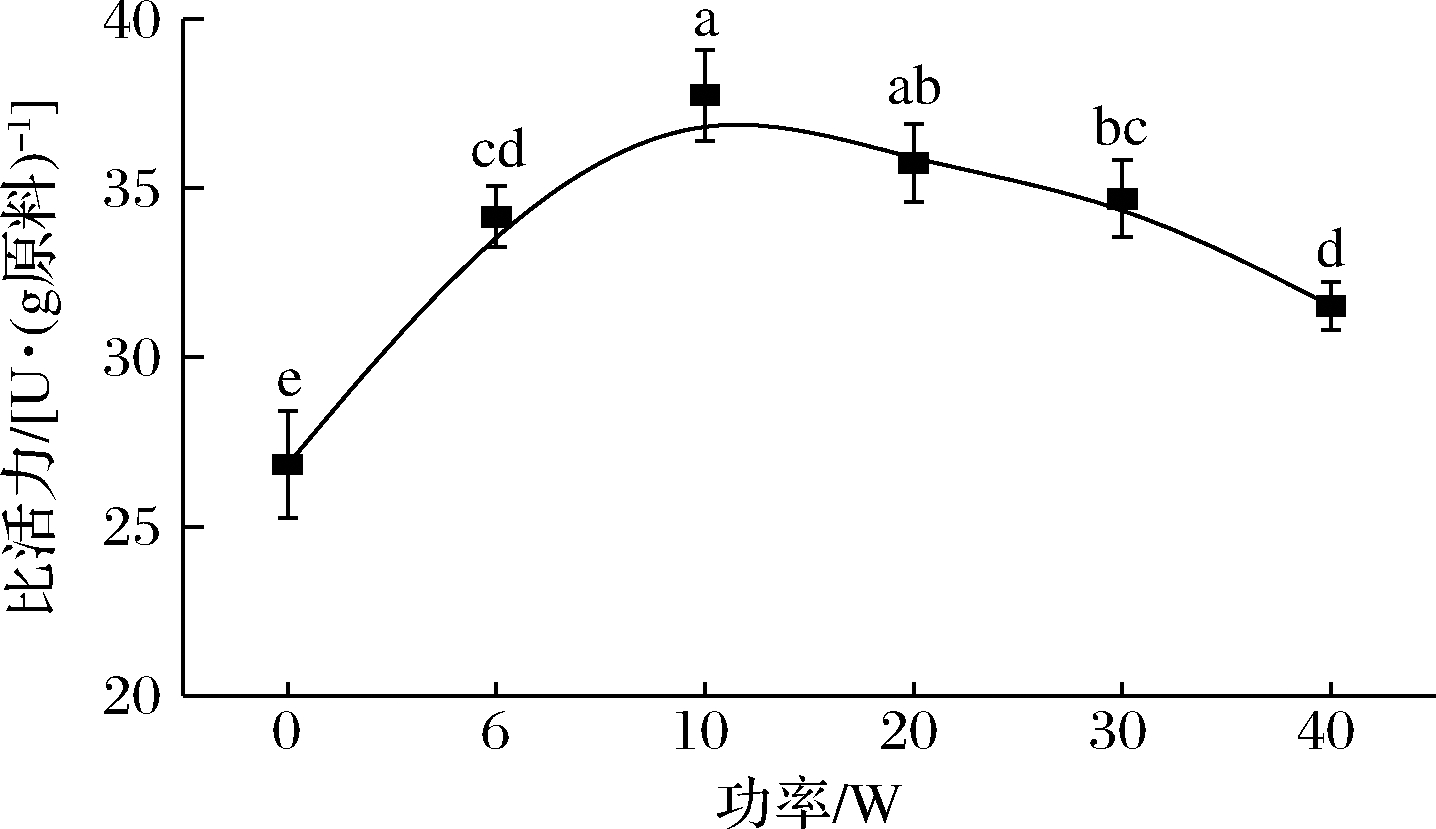
图2 不同照射功率下虾头几丁质酶的比活力
Fig.2 Specific activity of chitinase in shrimp heads under different irradiation powers
注:不同小写字母表示组间差异显著(P<0.05)(下同)
2.2.2 照射时间对几丁质酶活力的影响
如图3所示,相比未照射的样品,几丁质酶在10、15、20、25、30 min照射时间下均有不同程度的激活,分别提高了25.08%、65.36%、133.77%、96.81%、4.44%。由图3可知,几丁质酶随着照射时间的增加而被激活,然后随着处理时间的进一步延长而降低。当照射时间为20 min时,几丁质酶比活力为(36.37±2.29)U/g(P<0.05)。当处理时间超过20 min时,几丁质酶比活力显著降低。相比20 min时的酶比活力,25、30 min下酶比活力分别降低了15.80%、55.33%。刘亮等[18]观察到在照射功率20 W和照射距离10 cm的条件下,水蜜桃果汁中多酚氧化酶活性随照射时间延长而降低,并在41.42 min时损失50%。ZHANG等[19]发现油桃中UV-C处理的几丁质酶活力随着时间的延长呈上升趋势,并在24 h达到峰值,之后急剧下降。前期温和的UV-C照射条件增强了几丁质酶活力,但长时间的UV-C照射会破坏几丁质酶蛋白的结构导致其活力降低。

图3 不同照射时间下虾头几丁质酶的比活力
Fig.3 Specific activity of chitinase in shrimp heads at different irradiation time
2.2.3 照射高度对几丁质酶活力的影响
如图4所示,相比未处理的样品,在照射高度为10、15、20、25、30 cm下照射处理的几丁质酶有不同程度的激活,分别增加了36.64%、80.81%、62.21%、44.55%、9.14%。随着照射高度的增加,几丁质酶比活力增大,之后随着照射高度的进一步增加而降低。在照射高度为15 cm下酶比活力最高,达到(26.07±0.83)U/g(P<0.05)。相比15 cm时酶比活力,在20、25、30 cm的照射高度下观察到酶比活力的损失,分别为10.28%、20.05%、39.63%。BOYCE等[20]发现当微生物样品表面距UV-C设备更远的距离时,细菌对数减少量较低。刘亮等[19]发现在10、20、30 cm的照射距离下,多酚氧化酶活性随照射距离的增加而逐渐上升。
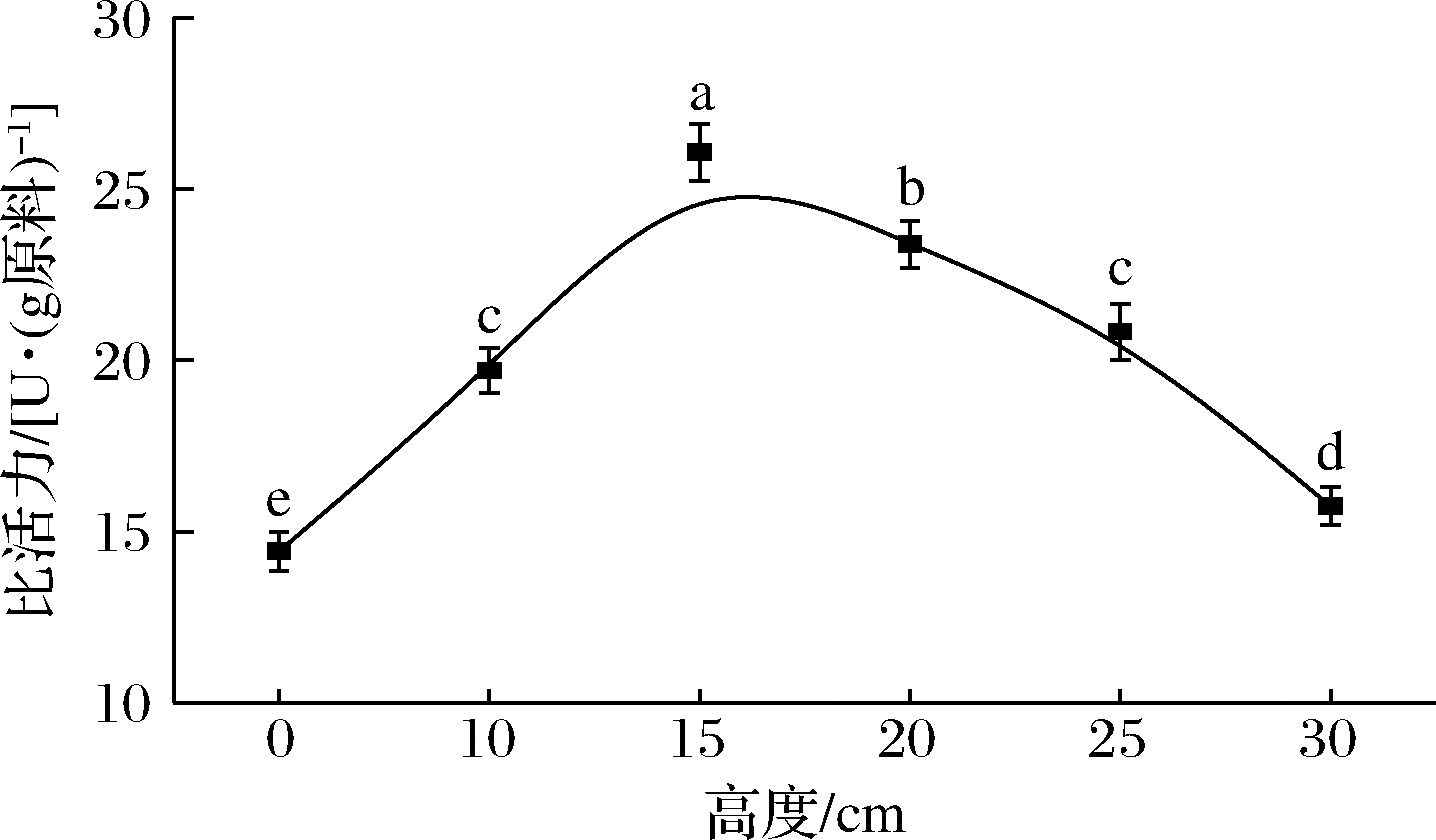
图4 不同照射高度下虾头几丁质酶的比活力
Fig.4 Specific activity of chitinase in shrimp heads under different irradiation heights
2.3 UV-C照射工艺的正交试验优化
对照射功率、照射时间、照射高度,采用4因素3水平的正交表L9(34),以几丁质酶比活力为评价指标进行试验,试验方案及结果分析如表2所示。
表2 正交试验设计及试验结果
Table 2 Design and results of the orthogonal experiment

试验号A(照射功率)/WB(照射时间)/minC(照射高度)/cm空列比活力/(U/g)1111113.69±0.632122211.26±0.443133321.27±0.794212315.92±0.575223111.34±0.636231227.06±0.107313211.06±0.638321313.50±0.719332120.99±0.20K146.2240.6754.2446.01K254.3236.0948.1749.38K345.5469.3243.6650.69k115.4113.5618.0815.34k218.1112.0316.0616.46k315.1823.1114.5516.90极差R2.9311.083.531.56因素主次顺序B>C>A最优组合A2B3C1
表2的极差结果显示,在UV-C照射几丁质酶工艺条件中影响酶比活力的主次因素为B>C>A,即照射时间>照射高度>照射功率。UV-C照射几丁质酶的最佳工艺为A2B3C1,即照射功率10 W,照射时间20 min,照射高度10 cm。得到的最佳工艺是试验6号的组合,此时的酶活力也是9组试验中最高的,为(27.06±0.10)U/g。因此,利用UV-C照射最佳工艺对接下来不同组织部位激活以及酶学性质进行探究。
2.4 UV-C照射对不同组织部位几丁质酶的激活作用
UV-C照射可作为提高酶活力的有效手段,图5结果显示,UV-C照射对凡纳滨对虾肝脏、肠、胃、头壳、壳、尾几丁质酶有不同程度的激活,分别升高41.41%、157.81%、137.86%、64.12%、25.68%、16.61%。
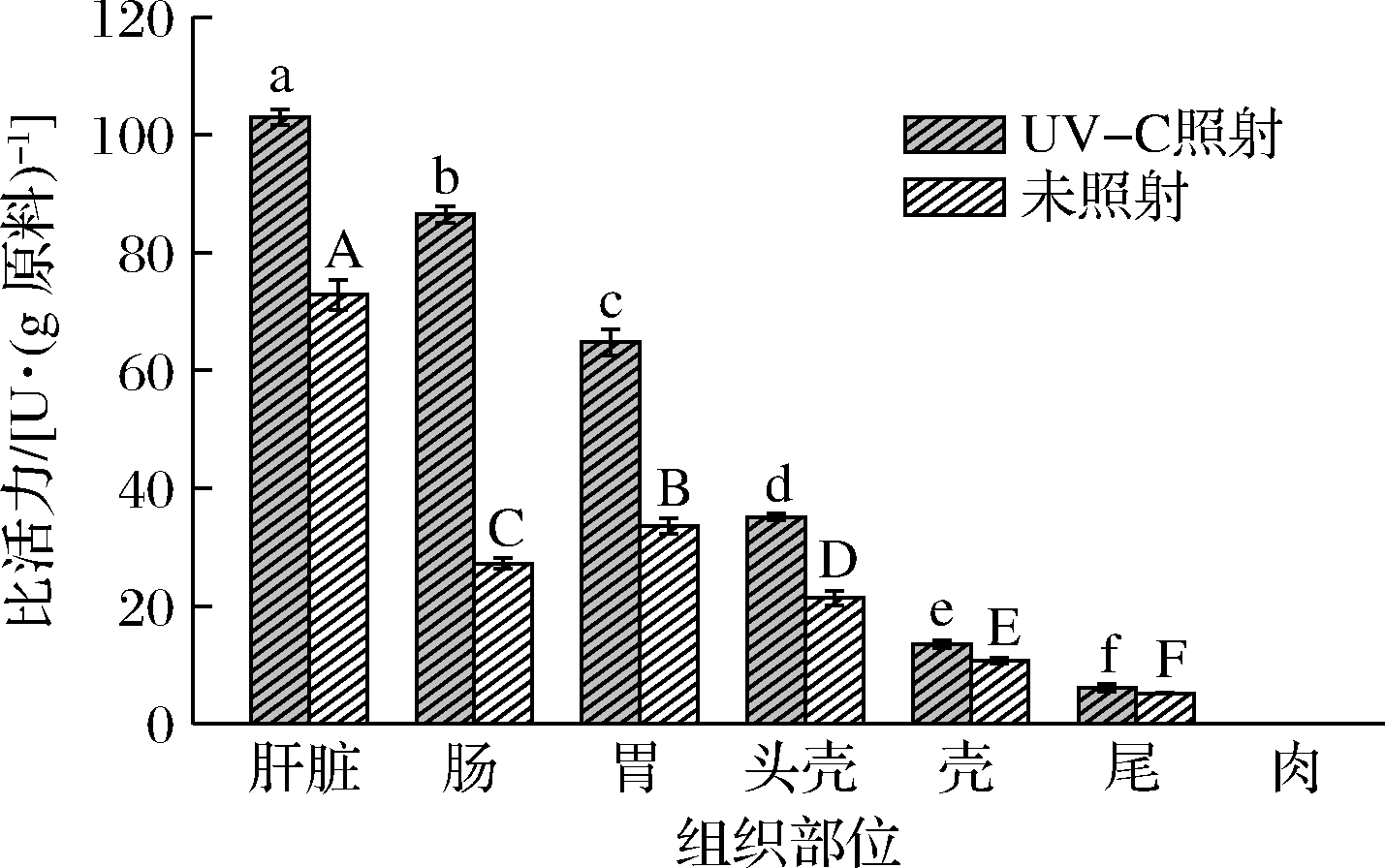
图5 UV-C照射对不同组织部位几丁质酶激活作用
Fig.5 Activation of the chitinase in different tissues by UV-C irradiation
注:不同的大小写字母分别表示0.05水平下UV-C照射 前后组间有显著性差异(下同)
可见,UV-C照射可以显著激活凡纳滨对虾不同组织部位的几丁质酶。CAO等[13]利用30 W紫外灯照射虾头20 min,发现蛋白酶水解活性相对于未处理样品增加了62%。郑丽等[21]发现紫外线照射能提高扇贝加工废弃物中自溶酶活力。UV-C照射可以通过改变氨基酸微环境来激活酶[22],并可能改变芳香族残基的修饰,导致结构变化,使芳香族氨基酸分子侧链基团逐渐暴露于溶液中[23]。蛋白质空间结构的适度伸展使其能够更好地与底物结合,从而提高其催化能力。UV-C照射技术可增大凡纳滨对虾废弃物中几丁质酶在几丁质降解上的利用价值。
2.5 UV-C照射对几丁质酶酶学性质的影响
2.5.1 温度对几丁质酶活力的影响
如图6所示,pH 5.0时UV-C照射前后温度对酶的影响趋势一致,几丁质酶最适温度为40 ℃,说明UV-C照射对几丁质酶的温度没有影响。照射前后虾头几丁质酶最适温度与脊尾白虾[12]的最适温度一致。而斑节对虾几丁质酶的最适温度为55 ℃,这主要是因为不同品种虾的生活环境不一样[24]。此外,最适温度下照射前后几丁质酶活力由(37.22±0.77)U/g升高至(44.91±1.32)U/g,提高了20.67%,说明UV-C照射可提高几丁质酶活力。在20~50 ℃的温度范围内,几丁质酶显示出较高的比活力。相反,当温度>60 ℃后,照射前后酶活力损失均超过60%。这可能是由于热变性所致。BEYGMORADI等[25]观察到墨吉明对虾中的几丁质酶在高于60 ℃时酶活性损失超过 60%。因此,UV-C照射可作为提高凡纳滨对虾废弃物中几丁质酶在适温条件下降解几丁质的绿色技术。
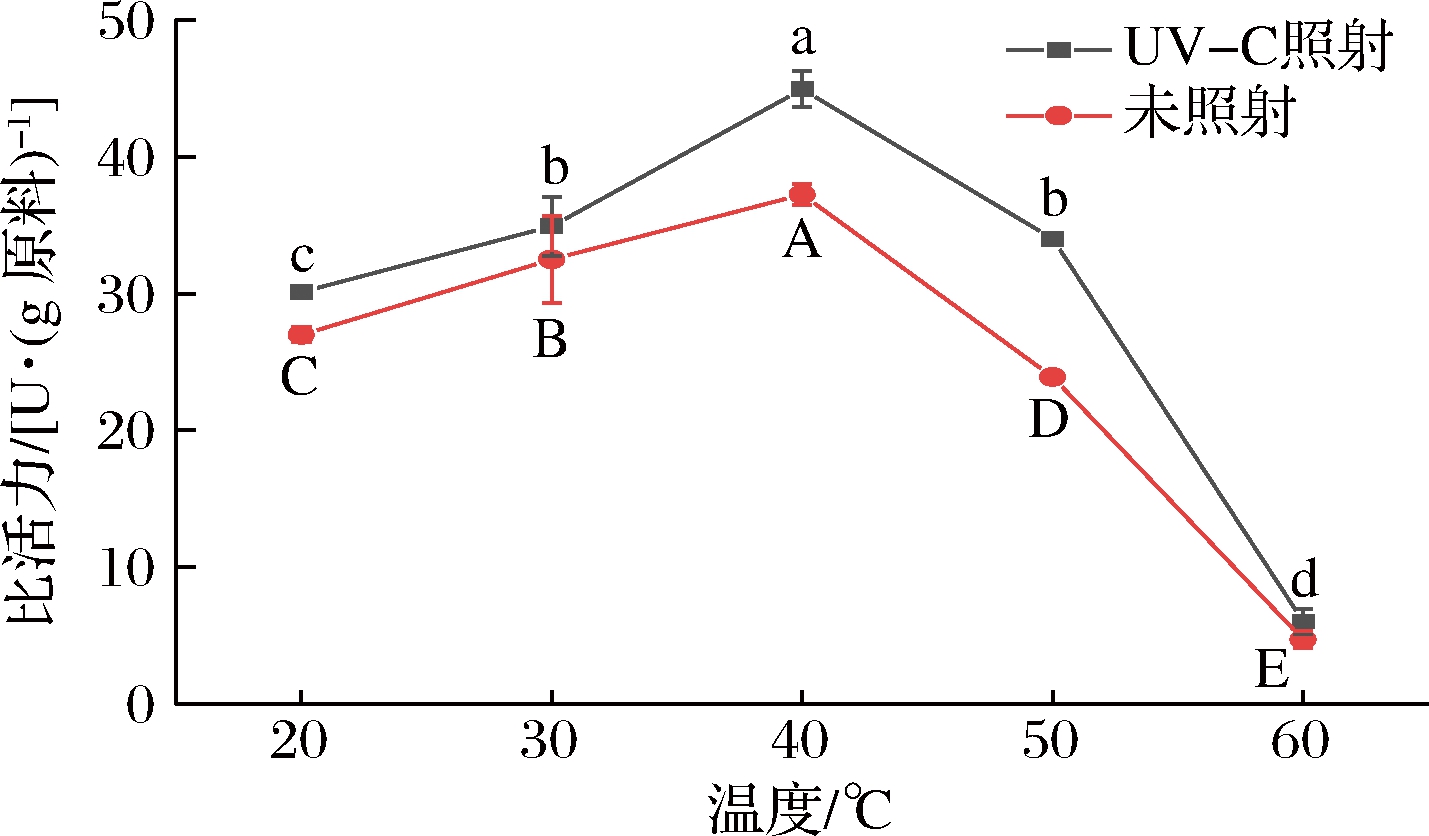
图6 UV-C照射前后不同温度对几丁质酶比活力的影响
Fig.6 Effects of different temperatures on the chitinase specific activity before and after UV-C irradiation
2.5.2 pH对几丁质酶活力的影响
UV-C照射前的几丁质酶在pH 4.0具有最大的几丁质分解活性(图7),接近斑节对虾的最适pH[24],这表明甲壳类几丁质分解酶的最佳pH是酸性的。而UV-C照射的几丁质酶在pH 5.0时酶活性最高。可知,UV-C增大了几丁质酶的最适pH值,结果与王贺等[11]研究结果相似。在最适pH下,UV-C照射前后的几丁质酶比活力分别为(37.08±1.17)、(29.71±0.55)U/g,提高24.83%。相反,在其他pH下,观察到UV-C照射前后几丁质酶活性有损失,而在pH 9下UV-C照射前后酶活性最大损失分别为63.74%、56.71%。酶活性的降低可能是由于蛋白质构象的变化[26]和酶不能正确地结合底物[27]所致。具有低pH值特性的凡纳滨对虾几丁质酶是一类适用于消化酸性条件下含几丁质食物的酶。

图7 UV-C照射前后不同pH对几丁质酶比活力的影响
Fig.7 Effects of different pH on the chitinase specific activity before and after UV-C irradiation
2.5.3 金属离子对几丁质酶活力的影响
如图8所示,Na+、Ca2+对照射前后的几丁质酶有轻微的激活作用,K+、Mg2+、Mn2+、Zn2+、Fe3+、Cu2+有不同程度抑制作用,说明UV-C照射没有改变几丁质酶对金属离子的特性。K+、Mg2+、Mn2+、Zn2+、Fe3+对未处理的酶分别抑制了7.93%、28.05%、24.38%、76.49%、38.14%,而对照射的酶分别抑制了2.75%、10.87%、35.25%、27.82%、49.14%。Cu2+对照射前后的酶完全抑制。OLIVEIRA等[28]发现Cu2+、Fe3+、Zn2+显著降低了腰果中几丁质酶活性。在不同金属离子的作用下,经UV-C照射的几丁质酶活力均比未照射的显著提高。Zn2+、Fe3+、Cu2+能引起几丁质酶的失活是因为其与组氨酸或半胱氨酸结合而导致酶蛋白构象的变化[29]。据推测,金属离子与关键催化残基的侧链羧酸盐基团的相互作用固定了它们的构象,限制了它们的水解能力[30]。上述结果表明,虾头几丁质酶可能是一种金属酶,其活性依赖于阳离子的存在。

图8 UV-C照射前后不同金属离子对几 丁质酶比活力的影响
Fig.8 Effects of different metal ions on the specific activity of chitinase before and after UV-C irradiation
3 结论
凡纳滨对虾肝脏、胃、肠、头壳、壳、尾的几丁质酶比活力分别为(72.84±2.54)、(33.54±1.31)、(27.25±0.91)、(21.40±1.25)、(10.74±0.48)、(5.22±0.05)U/g原料。几丁质酶主要分布在虾头部位(含肝脏、胃、头壳),占比达84.83%。UV-C照射可显著激活几丁质酶。正交优化UV-C照射激活虾头几丁质酶工艺为:照射功率10 W,照射时间25 min,照射高度10 cm,此时几丁质酶活力为(27.06±0.10)U/g原料。在最优照射条件下,UV-C照射显著激活对虾各组织部位中几丁质酶且对几丁质酶酶学性质无显著影响。适度UV-C照射使几丁质酶蛋白质空间结构伸展,形成了利于其与底物结合的空间结构。有关UV-C照射几丁质酶的分子机制有待后续深入研究。
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会.2021年中国渔业统计年鉴[M].北京:中国农业出版社, 2021.
Ministry of Agriculture and Rural Affairs of the People’s Republic of China, National Fisheries Technology Extension Centre, China Society of Fisheries.2021 China Fishery Statistical Yearbook[M].Beijing:China Agriculture Press, 2021.
[2] MAO X Z, GUO N, SUN J N, et al.Comprehensive utilization of shrimp waste based on biotechnological methods:A review[J].Journal of Cleaner Production, 2017, 143:814-823.
[3] KUMAR A, KUMAR D, GEORGE N, et al.A process for complete biodegradation of shrimp waste by a novel marine isolate Paenibacillus sp.AD with simultaneous production of chitinase and chitin oligosaccharides[J].International Journal of Biological Macromolecules, 2018, 109:263-272.
[4] MOHAN K, GANESAN A R, EZHILARASI P N, et al.Green and eco-friendly approaches for the extraction of chitin and chitosan:A review[J].Carbohydrate Polymers, 2022, 287:119349.
[5] PATEL S, GOYAL A.Chitin and chitinase:Role in pathogenicity, allergenicity and health[J].International Journal of Biological Macromolecules, 2017, 97:331-338.
[6] NIU S W, YANG L W, ZUO H L, et al.A chitinase from Pacific white shrimp Litopenaeus vannamei involved in immune regulation[J].Developmental and Comparative Immunology, 2018, 85:161-169.
[7] HAN C, ZHEN W N, CHEN Q M, et al.UV-C irradiation inhibits surface discoloration and delays quality degradation of fresh-cut stem lettuce[J].LWT, 2021, 147:111533.
[8] BHAT R, KARIM A.Ultraviolet irradiation improves gel strength of fish gelatin[J].Food Chemistry, 2009, 113(4):1 160-1 164.
[9] KRISTO E, HAZIZAJ A, CORREDIG M.Structural changes imposed on whey proteins by UV irradiation in a continuous UV light reactor[J].Journal of Agricultural and Food Chemistry, 2012, 60(24):6 204-6 209.
[10] ZHU B W, ZHENG J, ZHANG Z S, et al.Autophagy plays a potential role in the process of sea cucumber body wall “melting” induced by UV irradiation[J].Wuhan University Journal of Natural Sciences, 2008, 13(2):232-238.
[11] 王贺, 曹文红, 章超桦, 等.UV-C辐照对凡纳滨对虾虾头主要内源酶酶学性质的影响[J].食品与发酵工业, 2019, 45(19):32-37.
WANG H, CAO W H, ZHANG C H, et al.Effects of UV-C irradiation on enzymatic properties of main endogenous enzymes in the head of Litopenaeus vannamei[J].Food and Fermentation Industries, 2019, 45(19):32-37.
[12] 王婧. 脊尾白虾几丁质酶的分离、特征及功能分析[D].青岛:中国科学院研究生院(海洋研究所), 2015.
WANG J.Chitinases from ridgetail white prawn Exopalaemon carinicauda:Purification, enzymatic characterization and function analysis[D].Qingdao:Institute of Oceanology, Chinese Academy of Sciences, 2015.
[13] CAO W H, TAN C Y, ZHAN X J, et al.Ultraviolet irradiation and gradient temperature assisted autolysis for protein recovery from shrimp head waste[J].Food Chemistry, 2014, 164:136-141.
[14] HUANG Q S, YAN J H, TANG J Y, et al.Cloning and tissue expressions of seven chitinase family genes in Litopenaeus vannamei[J].Fish and Shellfish Immunology, 2010, 29(1):75-81.
[15] TAN S H, DEGNAN B M, LEHNERT S A.The Penaeus monodon chitinase 1 gene is differentially expressed in the hepatopancreas during the molt cycle[J].Marine Biotechnology, 2000, 2(2):126-135.
[16] ZHANG S Y, JIANG S F, XIONG Y W, et al.Six chitinases from oriental river prawn Macrobrachium nipponense:cDNA characterization, classification and mRNA expression during post-embryonic development and moulting cycle[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2014, 167:30-40.
[17] MANZOCCO L, QUARTA B, DRI A.Polyphenoloxidase inactivation by light exposure in model systems and apple derivatives[J].Innovative Food Science and Emerging Technologies, 2009, 10(4):506-511.
[18] 刘亮, 曹少谦, 陈伟, 等.脉冲强光及紫外线对水蜜桃多酚氧化酶活性的影响[J].核农学报, 2014, 28(1):85-90.
LIU L, CAO S Q, CHEN W, et al.Effects of pulsed light and ultraviolet-C irradiation on the activity of polyphenol oxidase from honey peach[J].Journal of Nuclear Agricultural Sciences, 2014, 28(1):85-90.
[19] ZHANG W L, JIANG H T, CAO J K, et al.UV-C treatment controls brown rot in postharvest nectarine by regulating ROS metabolism and anthocyanin synthesis[J].Postharvest Biology and Technology, 2021, 180:111613.
[20] BOYCE J M, FARREL P A, TOWLE D, et al.Impact of room location on UV-C irradiance and UV-C dosage and antimicrobial effect delivered by a mobile UV-C light device[J].Infection Control and Hospital Epidemiology, 2016, 37(6):667-672.
[21] 郑丽, 汪秋宽, 谢智芬, 等.扇贝加工废弃物自溶技术的研究[J].大连水产学院学报, 2007, 22(1):49-52.
ZHENG L, WANG Q K, XIE Z F, et al.The rapid autolytic technology of scallop processing wastes[J].Journal of Dalian Fisheries University, 2007, 22(1):49-52.
[22] PIVA T J, FRANCIS K G, KRAUSE D R, et al.Effect of UV irradiation on cell surface protease activity and amino acid uptake[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1998, 422(1):55-67.
[23] GABRIEL M A, DARE E V, MEUNIER S M, et al.Ultraviolet irradiation of trypsin, lysozyme and β-galactosidase:How does UVC affect these enzymes when used as a secondary barrier against adventitious agents?[J].Vaccine, 2019, 37(43):6 518-6 525.
[24] PROESPRAIWONG P, TASSANAKAJON A, RIMPHANITCHAVAKIT V.Chitinases from the black tiger shrimp Penaeus monodon:Phylogenetics, expression and activities[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2010, 156(2):86-96.
[25] BEYGMORADI A, HOMAEI A, HEMMATI R, et al.Identification of a novel tailor-made chitinase from white shrimp Fenneropenaeus merguiensis[J].Colloids and Surfaces B:Biointerfaces, 2021, 203:111747.
[26] VANNABUN A, KETNAWA S, PHONGTHAI S, et al.Characterization of acid and alkaline proteases from viscera of farmed giant catfish[J].Food Bioscience, 2014, 6:9-16.
[27] BENJAKUL S, MORRISSEY M T.Protein hydrolysates from Pacific whiting solid wastes[J].Journal of Agricultural and Food Chemistry, 1997, 45(9):3 423-3 430.
[28] OLIVEIRA S T, AZEVEDO M I G, CUNHA R M S, et al.Structural and functional features of a class VI chitinase from cashew (Anacardium occidentale L.) with antifungal properties[J].Phytochemistry, 2020, 180:112527.
[29] XIE X L, HUANG Q S, GONG M, et al.Inhibitory kinetics of β-N-acetyl-D-glucosaminidase from prawn (Litopenaeus vannamei) by zinc ion[J].IUBMB Life, 2009, 61(2):163-170.
[30] HSIEH Y C, WU Y J, CHIANG T Y, et al.Crystal structures of Bacillus cereus NCTU2 chitinase complexes with chitooligomers reveal novel substrate binding for catalysis:A chitinase without chitin binding and insertion domains[J].Journal of Biological Chemistry, 2010, 285(41):31 603-31 615.