豆渣是大豆加工过程中产生的副产物,富含蛋白质、膳食纤维等营养成分,还含有大豆异黄酮、大豆皂苷等活性物质,具有预防心脑血管疾病、减肥等生理功效,对人体健康具有促进作用[1-2]。豆渣原料廉价易得,是一种低脂低糖髙膳食纤维的食物资源,具有很好的开发应用前景。但是由于豆腥味和低聚糖等不良因素的存在,豆渣的消费一直受到限制[3-4]。传统豆渣仅用于动物饲料,甚至会被丢弃,导致资源浪费和环境污染。豆渣制品中的豆腥味主要来源于各类链长比较短的醛、醇、酮等挥发性物质,这些物质是脂肪氧化酶催化的亚油酸、亚麻酸等不饱和脂肪酸形成的。因此,如何更有效地改善豆渣制品风味成为研究热点。
豆渣加工再利用的方法中,微生物发酵法是一种可行的方法。豆渣中富含的多种营养物质为微生物的生长提供了良好的条件[5]。发酵豆渣中的大豆蛋白能被分解为氨基酸和寡肽,破坏豆渣中的胰蛋白酶抑制剂、胀气因子等抗营养因子,更容易被人体吸收[6]。益生菌有较强的代谢碳水化合物产酸能力,可以改善豆渣制品的风味和质地,提高营养价值,并能降低或去除豆渣本身的豆腥味[3]。类干酪乳杆菌(Lactobacillus casei)对酸、胆盐具有良好的抵抗力,黏附性较强,能定殖于肠道,耐受人体消化系统的防御机制,是一株具有广阔应用前景的潜在功能性益生菌[7]。熊涛等[8]通过体外细胞模型(人体结肠腺癌细胞系Caco-2细胞)测定副干酪乳杆菌NCU622的黏附性能,结果表明副干酪乳杆菌NCU622具有良好的耐酸耐胆盐能力及较强的黏附性能,且对Caco-2细胞无裂解作用,符合微生态制剂和乳酸菌发酵功能食品的菌种要求。LIU等[9]采用酸米汤与副干酪乳杆菌和马克斯克鲁维酵母进行混合发酵,提高了酸米汤的产酸和香气,缩短其发酵时间,风味和品质特性明显得到改善。
目前针对益生菌发酵豆渣饮料的挥发性芳香物质的组成以及特征气味分析的研究较少,且有关于豆渣的发酵研究多集中在其发酵前后的风味对比或是一些工艺的优化。因此,本研究选用类干酪乳杆菌为发酵菌种与豆渣混合发酵制成豆渣饮料,并对该豆渣饮料发酵过程中风味物质的组成与差异进行分析。旨在为豆渣的综合利用以及益生菌发酵豆渣饮料的开发与生产提供理论支撑。
1 材料与方法
1.1 材料与仪器
鲜豆渣,盘锦宋大房豆制品厂;类干酪乳杆菌CICC 6244,中国工业微生物菌种保藏管理中心;白砂糖、无水柠檬酸、稳定剂(果胶、羧甲基纤维素钠)、维生素C、菠萝香精,广东永信食品配料公司;环己酮,上海阿拉丁生化科技股份有限公司。
JM50胶体磨,上海贝工泵业制造有限公司;QDGX-18高精密湿法超细粉碎机,无锡轻大食品设备有限公司;SW-CJ-2FD超净工作台,苏州安泰空气技术有限公司;LRH-250F生化培养箱,上海一恒科学仪器有限公司;DHG-9243BS-Ⅲ立式压力蒸汽灭菌锅,上海新苗医疗器械制造有限公司;CHROMA METER CR-400色彩色差计,日本Minolta公司;PEN3电子鼻,日本Insent公司;A7890气相色谱-质谱联用仪、P-5MS弹性石英毛细管柱(30 m×0.25 mm×0.25 μm),美国Agilent公司。
1.2 实验方法
1.2.1 发酵豆渣饮料的制备
新鲜豆渣经过2%~4%食用碱处理后,90 ℃水浴加热60 min,并用纱布滤去脱腥用碱,经清水清洗,最后采用食品级柠檬酸溶液中和过量碱,与水质量比为1∶10,过胶体磨和湿法粉碎机,制成豆渣原浆。加入8%白砂糖、0.15%柠檬酸、1%维生素C、0.2%菠萝香精、0.3%稳定剂[m(果胶)∶m(羧甲基纤维素钠)=1∶1],均质20 min,121 ℃高压蒸汽灭菌20 min,冷却之后接种,接种体积分数为3%菌液(108CFU/mL)的种子液,37 ℃发酵24 h,于4 ℃冰箱保藏。分别于发酵0、6、12、18、24 h取样,以0 h代表未发酵豆渣饮料,作为对照组(CK)。
1.2.2 色差测定
豆渣饮料的色泽指标用全自动色彩色差计CR-400通过反射法进行测定。L*值表示亮度;a*值表示红绿偏向;b*值表示黄蓝偏向[10]。
1.2.3 不同发酵时间的豆渣饮料香气成分检测
1.2.3.1 感官评价
采用9点快感标度法[11]对发酵过程中豆渣饮料的感官品质进行评价,20名受试者对5种豆渣饮料进行感官评估,其中包括学生和教职员工(10名男性和10名女性),对颜色、酸甜度、香气、味道、体态、风味和整体接受性7个性质进行评价,评级范围从极度不喜欢(1分)到极度喜欢(9分)。
1.2.3.2 电子鼻分析
样品预处理:取10 mL样品于50 mL样品瓶中,用保鲜膜密封并盖上瓶盖。平衡20 min后进行检测,每个样品重复6次。
检测条件:采用顶空抽样的方法,不同传感器的性能参考王当丰等[12]的描述如表1,电子鼻样品准备时间5 s,清洗时间100 s,检测时间120 s。分析样品的风味成分信息,进行3次重复实验。59~61 s数据较稳定,可进行分析。运用PEN3型电子鼻配套软件WinMuster对数据进行主成分分析(principal component analysis,PCA)、负荷加载(loadings)分析和线性判别分析(linear discriminant analysis,LDA)。
表1 PEN3 便携式标准传感器阵列及性能
Table 1 PEN3 portable standard sensor array and performance

编号传感器传感器响应特征检查极限/(mL·mL-1)R1W1C对芳香化合物敏感10-5R2W5S对氮氧化物敏感10-6R3W3C对氨和芳香化合物敏感10-5R4W6S对氢敏感10-4R5W5C对烯烃和芳香化合物敏感10-6R6W1S对碳氢化合物敏感10-4R7W1W对硫化氢敏感10-6R8W2S对醇类和一些芳香族化合物敏感10-4R9W2W对芳香族化合物和有机硫化物敏感10-6R10W3S对烷烃(甲烷等)敏感10-5
1.2.3.3 GC-MS分析
样品处理:样品用量5.0 g、内标环己酮10 μg,加入15 mL带聚四氟乙烯隔膜的顶空瓶中,在55 ℃水浴处理10 min,向该瓶中插入SPME手动进样柄的针头。让其在空气中进行萃取反应,30 min后将其插入气相色谱-质谱进样口,在250 ℃环境下解析5 min。
色谱条件:分离柱,HP-5MS弹性石英毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度250 ℃;载气为He;载气流速0.8 mL/min;不分流进样;采用程序升温方式,柱箱初始温度35 ℃保持5 min,以2 ℃/min升至65 ℃,再以3 ℃/min升至110 ℃,再以10 ℃/min升至230 ℃保持5 min。
质谱条件:离子化模式,EI+;电子能70 eV;离子源温度200 ℃;发射电流200 μA;传输温度250 ℃;检测气压350 V;数据采集,全扫描。
定性定量分析:利用质谱全离子扫描图谱及NIST质谱数据库,相似度≥80%初步判定为目标化合物,并根据C8~C20烷烃混合标准品的保留时间,用保留指数法(retention index,RI)对挥发性物质进行定性,挥发性组分采用加入内标物质进行半定量分析[13]。
1.3 数据处理
采用Origin 2018和SPSS 22.0进行图像绘制及数据处理。平均值的差异性用单因素方差分析(ANOVA)中的最小显著差异法(least significant difference,LSD)检验。除电子鼻外,所有试验均重复3次,数值用平均值±标准差表示,P<0.05为有统计学差异。
2 结果与分析
2.1 色差分析
表2给出了不同发酵时间豆渣饮料的颜色分析结果,结合图1可知,与CK组豆渣饮料相比,随着发酵时间的延长,L*值、b*值逐渐升高,呈现出更饱和的淡黄色。a*值较稳定,高温处理促进酶失活,这有助于维持特征颜色。

图1 不同发酵时间的豆渣饮料
Fig.1 Okara beverages with different fermentation times
表2 发酵豆渣饮料的色泽
Table 2 Color of fermented okara beverages
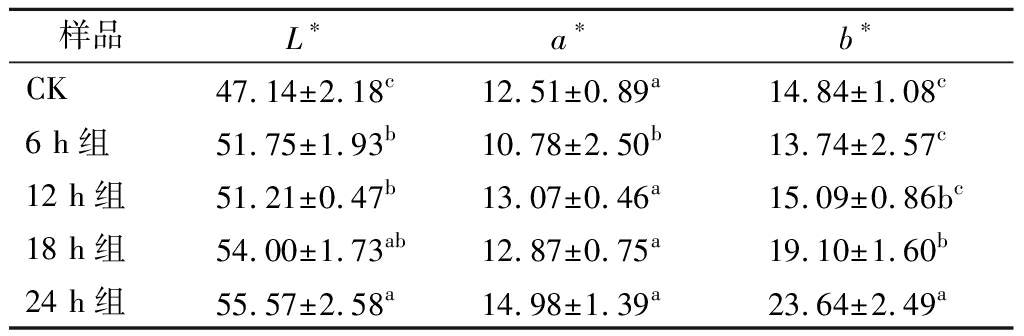
样品L∗a∗b∗CK47.14±2.18c12.51±0.89a14.84±1.08c6 h组51.75±1.93b10.78±2.50b13.74±2.57c12 h组51.21±0.47b13.07±0.46a15.09±0.86bc18 h组54.00±1.73ab12.87±0.75a19.10±1.60b24 h组55.57±2.58a14.98±1.39a23.64±2.49a
注:同一列中不同字母表示有显著性差异(P<0.05)
2.2 不同发酵时间豆渣饮料的感官评价
由表3可知,5种豆渣饮料除体态指标差异不显著外,其余均差异显著(P<0.05)。CK组豆渣饮料呈现乳白色,随着发酵时间的延长,颜色逐渐呈现浅黄色,更具感官吸引力,平均分高。酸甜度在喜好程度评分中得分最高的是18 h组(6.23±0.25),CK组酸味明显,导致得分较低(P<0.05);香气方面,发酵后有明显的豆香味,18 h组得分较高(P<0.05);味道方面,CK组豆渣饮料味道寡淡,有豆腥味,发酵24 h味道酸甜清爽且豆香味浓郁(P<0.05);体态方面,所有样品均在6分左右,无沉淀、稳定性较好;发酵组较未发酵组在风味方面得到明显改善;整体接受性得分最高的是24 h组(P<0.05)。24 h组在颜色(6.33±0.25)、酸甜度(6.23±0.21)、香气(6.03±0.15)得分处于中上等,味道(7.10±0.10)、风味(6.90±0.17)和整体(7.40±0.10)得分最高(P<0.05)。发酵24 h组在一定程度上改善了豆渣饮料的感官品质,使得豆渣饮料口感更佳。
表3 不同发酵时间豆渣饮料感官喜好程度评分结果
Table 3 Score results of sensory preference of okara beverages at different fermentation times
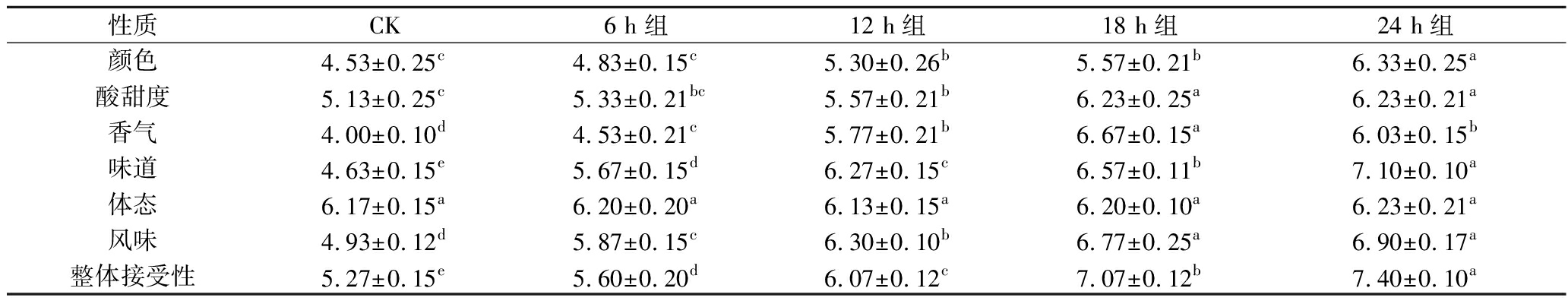
性质CK6 h组12 h组18 h组24 h组颜色4.53±0.25c4.83±0.15c5.30±0.26b5.57±0.21b6.33±0.25a酸甜度5.13±0.25c5.33±0.21bc5.57±0.21b6.23±0.25a6.23±0.21a香气4.00±0.10d4.53±0.21c5.77±0.21b6.67±0.15a6.03±0.15b味道4.63±0.15e5.67±0.15d6.27±0.15c6.57±0.11b7.10±0.10a体态6.17±0.15a6.20±0.20a6.13±0.15a6.20±0.10a6.23±0.21a风味4.93±0.12d5.87±0.15c6.30±0.10b6.77±0.25a6.90±0.17a整体接受性5.27±0.15e5.60±0.20d6.07±0.12c7.07±0.12b7.40±0.10a
注:同一行中不同字母表示有显著性差异(P<0.05)
2.3 电子鼻分析
5种样品气味差异的电子鼻分析见图2。各样品之间有一定的差异,W5S、W1W和W1S三个传感器对每组豆渣饮料的信号值都较大,尤其是W5S(对氮氧化合物灵敏)和W1W(对硫化物灵敏)。发酵24 h组与CK组相比,W1W显著降低,W1S有上升趋势,W5S显著增加。其他7个传感器的信号值在不同种类之间基本是相似的,并且几乎重叠,表明这7个传感器检测出的挥发性物质组成基本一致。硫化物在食品中含量很低,呈味阈值也极低,通过加工过程中发生的美拉德反应形成,对谷物加工做出很大贡献,因此加入类干酪乳杆菌发酵可在一定程度上抑制美拉德反应[14]。
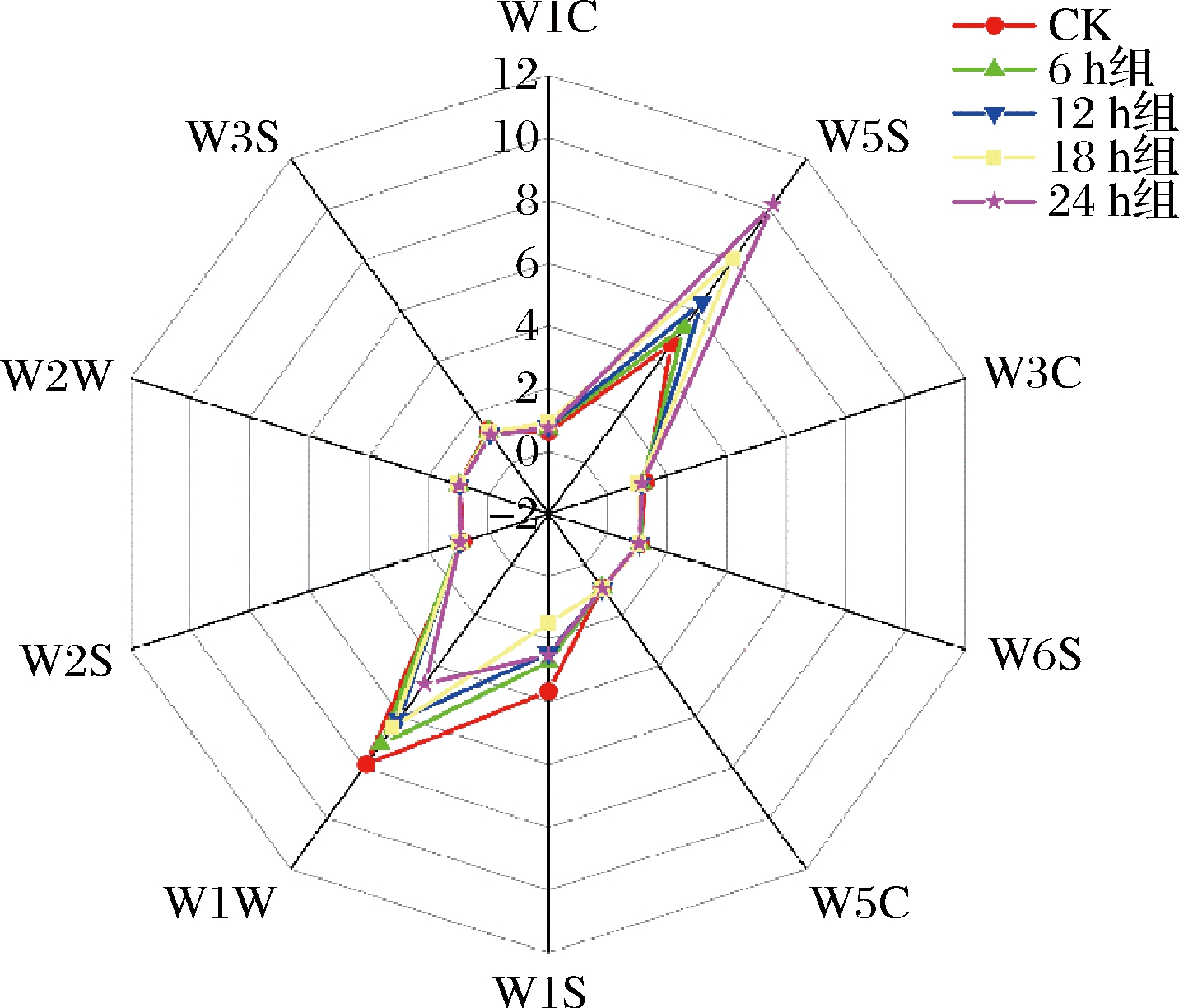
图2 不同发酵时间豆渣饮料电子鼻分析雷达图
Fig.2 Electronic nose analysis radar of okara beverages at different fermentation times
图3为5种样品的电子鼻PCA图。第1和第2主成分(PC1,PC2)的贡献率分别为98.96%和0.75%,总贡献率为99.71%。不同样品之间位置较分散,不同样品之间互不重叠,气味差异较大且从右到左呈现一定的变化趋势。发酵24 h组与CK、0、6、12、18 h组均距离较远,说明发酵24 h组与其他4组豆渣饮料风味各不相同,均存在显著性差异。其原因是类干酪乳杆菌在发酵6 h后进入对数生长期,在此阶段,豆渣饮料中的碳水化合物和蛋白质被大量分解,产生各种挥发性化合物[15]。随着发酵时间的延长,在嗅觉上呈现一定的变化规律。由图2可知,与气味变化最密切相关的是氮氧化合物,整个发酵过程中其含量明显增加,其次是无机硫化物含量显著降低,而其他类别化合物含量并无明显变化。
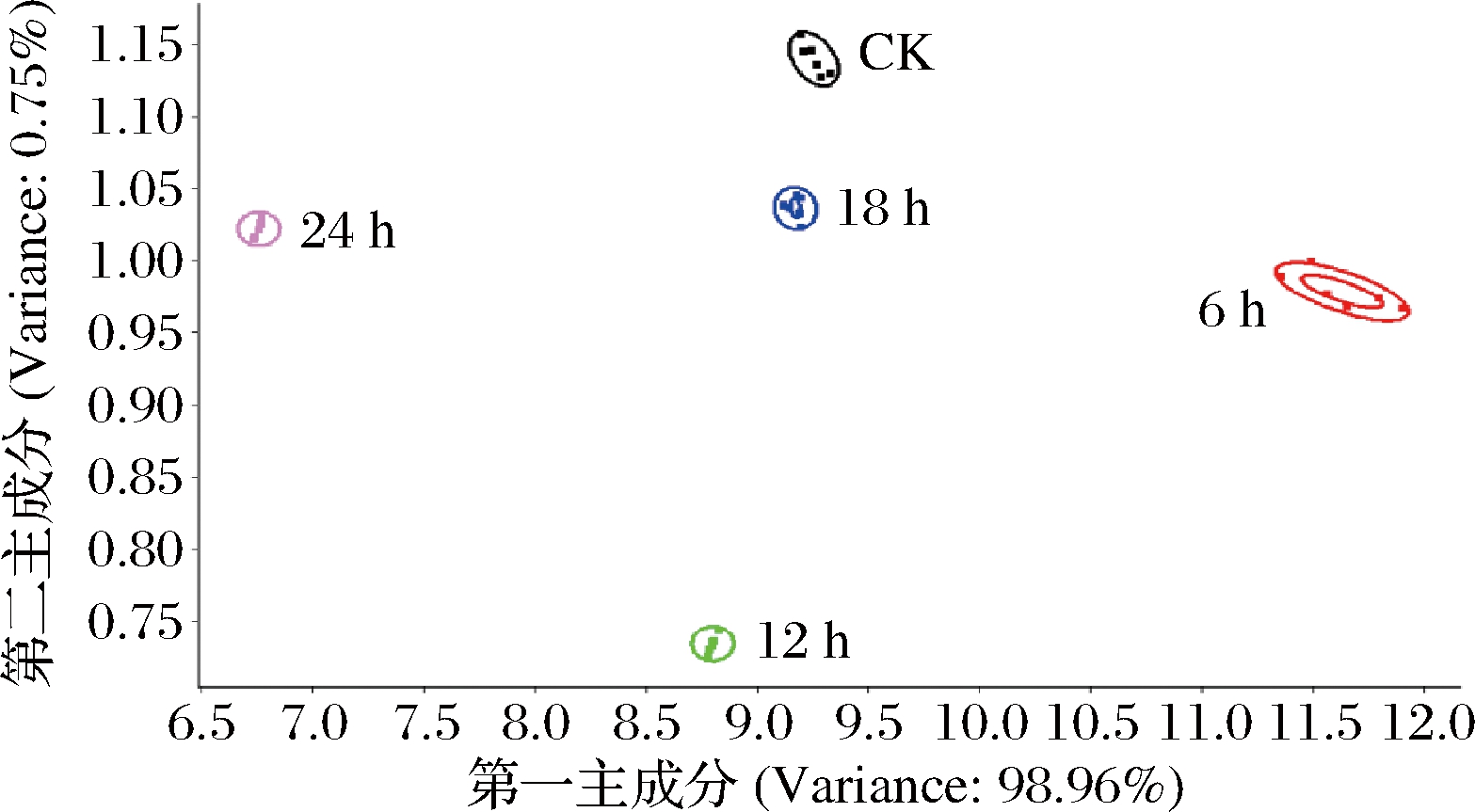
图3 不同发酵时间豆渣饮料PCA图
Fig.3 PCA plot of okara beverages at different fermentation times
Loadings分析可区分出样品中起主要作用的挥发性风味成分。由图4可知,W5S传感器对第1主成分贡献率最大,其次是W1W,W1S传感器对第2主成分贡献率最大。参照各传感器的性能特征可知,第1主成分主要对氮氧化物、硫化物敏感,第2主成分对碳氢化合物敏感[16]。
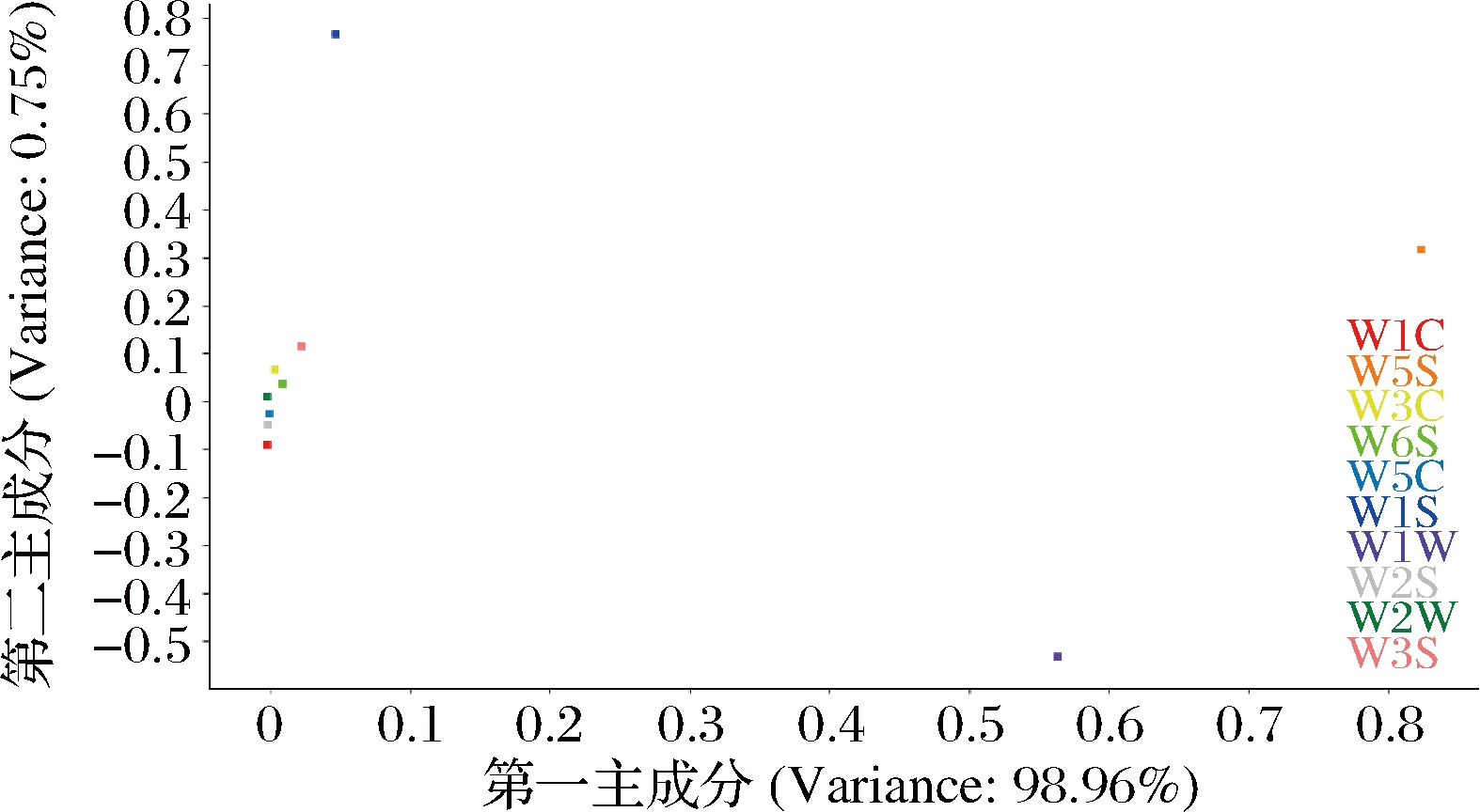
图4 不同发酵时间豆渣饮料Loadings分析图
Fig.4 Loadings analysis of okara beverages at different fermentation times
不同发酵时间的豆渣饮料的LDA结果见图5,第1主成分区分贡献率为68.07%,第2主成分区分贡献率为26.37%,主成分总的贡献率达94.44%,5个样品中,除了CK组和6 h组相距较近,其他样品两两之间都相距较远,可以在LDA完全区分开,这与感官审评结果一致,表明不同发酵时间对豆渣饮料香气的改变差异较大。整体结果对比PCA较为相似,说明不同发酵时间豆渣饮料均可以被电子鼻显著区分。

图5 不同发酵时间豆渣饮料LDA图
Fig.5 LDA plot of okara beverages at different fermentation times
2.4 顶空固相微萃取/气质联用技术(solid phase microextraction/gas chromatography-mass spectrometry,SPME/GC-MS)分析不同发酵阶段豆渣饮料挥发性成分
利用SPME/GC-MS对不同发酵阶段的豆渣饮料挥发性物质进行分析,共检测出87种挥发性风味物质,包括醇类24种、醛类8种、酸类10种、酮类7种、烃类14种、酯类17种和其他化合物7种(见电子增强出版附件1,https://doi.org/10.13995/j.cnki.11-1802/ts.033142)。发酵24 h比CK组增加了20种挥发性风味物质,挥发性香气成分的增加或生成是发酵豆渣饮料提升感官品质的重要因素。
2.4.1 醇类化合物
4组发酵豆渣饮料中醇类化合物种类及含量显著增多。其中,1-壬醇有玫瑰和橙子香气,1-辛烯-3-醇具有蘑菇、玫瑰和干草香气[17],1-己醇具有水果香,1-庚醇具有土质、油质的风味[18]。在发酵6、12和24 h均检测出α-松油醇,α-松油醇有紫丁香气味,这些醇类赋予益生菌发酵豆渣饮料鲜香醇厚的特征香气,对豆渣饮料香气的形成具有促进作用[19]。其中,1-辛烯-3-醇被认为是豆腥味[20],随着发酵的进行逐渐消失。发酵期间检测到1-己醇的含量分别为2.69、2.69、3.48、3.95和3.55 μg/g。1-壬醇的含量分别为3.23、3.37、2.02、2.62和2.31 μg/g。2,4-癸二烯-1-醇的含量分别为1.56、3.94和4.26 μg/g、0、0(具体数据见电子增强出版附件1)。
2.4.2 醛类化合物
醛类化合物是脂质降解产物,在挥发性成分中含量高且阈值较低,对样品整体风味形成贡献大,这也是豆渣饮料发酵过程中形成豆腥味的主要原因[21]。豆渣饮料发酵阶段共检测出8种醛类化合物,总含量随发酵时间的延长显著降低,其中CK组豆渣饮料中醛类化合物的总含量最高为17.87 μg/g,发酵24 h后的醛类化合物的含量显著减少到5.44 μg/g(P<0.05)(图6-a)。CK组豆渣饮料中含有(E)-2-己烯醛、壬醛、(E,E)-2,4-癸二烯醛3种被定义为豆腥味的物质[20]。4组发酵豆渣饮料中,以上3种醛类化合物均显著降低或消失。这与前人结果一致,也解释了发酵使豆渣饮料豆腥味减弱[22]。糠醛具有苦杏仁味、癸醛具有清爽的芳香味脂肪气息、2,4-壬二烯醛具有柑橘味甜瓜和黄瓜味[23],赋予豆渣饮料独特的风味。
2.4.3 酸类化合物
己酸具有奶酪、辛辣的味道,辛酸具有腐败、刺激气味,己酸是含量较高的酸类化合物,分别为0.33、0.94、0.93、1.37、1.98 μg/g(见电子增强出版附件1)。己酸赋予发酵豆渣饮料爽口的酸味,是发酵豆渣饮料中重要的风味化合物。
2.4.4 酮类化合物
酮类化合物是由于多不饱和脂肪酸氧化、热降解、氨基酸降解或微生物代谢产生的[24]。在发酵12 h时其含量达到最大为0.67 μg/g(图6-a)。在酮类物质中,2-壬酮呈水果、花、油脂和药草似香气,在豆渣饮料中的含量远高于其他酮类化合物。
2.4.5 酯类化合物
酯类化合物具有水果香气和甜香,其中,己酸己酯有水果味、热带风味清香,辛酸甲酯有甜橙味,庚酸烯丙酯有菠萝香,这些酯类对豆渣饮料香气有积极的影响。影响发酵豆渣饮料风味的最重要化合物是辛酸甲酯,检测到的含量分别为2.84、4.93、4.82、5.26、5.70 μg/g(见电子增强出版附件1)。
2.4.6 烷烃类化合物
从豆渣饮料中共鉴定出14种烃类化合物,大部分烷烃类化合物阈值水平较高,对整体香气几乎没有贡献[25]。发酵18 h含量最高为3.75 μg/g(图6-a)。
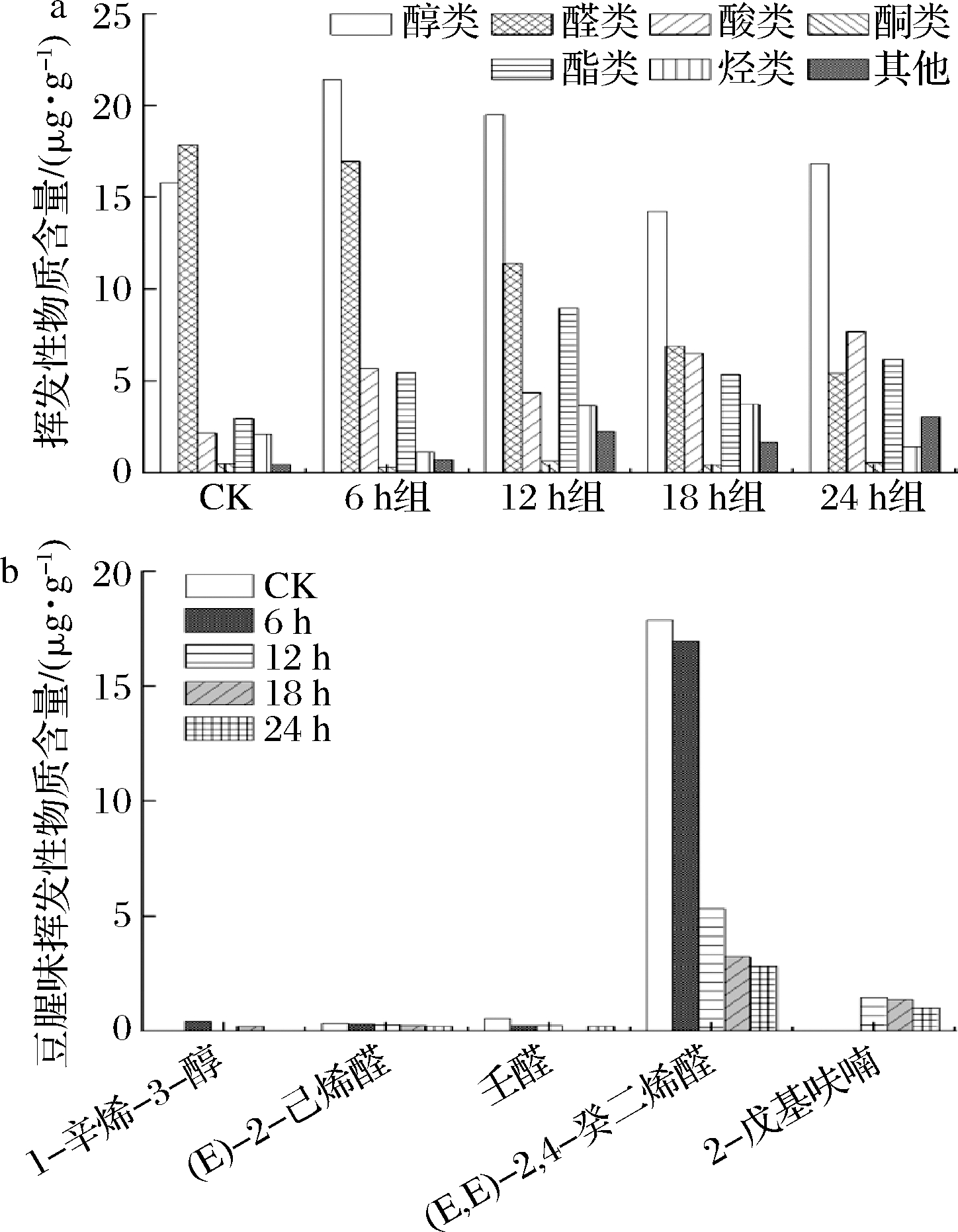
a-挥发性物质含量;b-豆腥味挥发性物质含量
图6 不同发酵时间豆渣饮料含量变化
Fig.6 Content change of okara beverages at different fermentation times
2.4.7 其他化合物
豆渣饮料中还检出呋喃类和苯酚类等7种化合物,这些化合物在发酵24 h后的种类和含量比发酵初期都有明显的增加(图6-a)。茴香脑具有独特甘草风味,2-戊基呋喃呈豆腥味,随着发酵时间的延长,2-戊基呋喃含量有降低趋势(见电子增强出版附件1)。在后发酵阶段醛、酮、酸类化合物挥发性风味物质总含量较低,却是豆渣饮料风味中不可缺少的成分[26-27]。在后发酵阶段酸类和醛类物质含量相差不大,但醛类物质香气浓烈,以花果香味为主,微量的醛类的香味在豆渣饮料中起到调和作用[28]。
2.5 豆渣饮料致豆腥味挥发性物质分析
本研究豆渣饮料中检测到的致豆腥味的物质有1-辛烯-3-醇、(E)-2-己烯醛、壬醛、(E,E)-2,4-癸二烯醛、2-戊基呋喃。图6-b为各致豆腥味挥发性物质含量变化,其中决定豆腥味的挥发性物质(E,E)-2,4-癸二烯醛含量显著降低(P<0.05),发酵24 h组(2.81 μg/g)显著低于CK组(17.87 μg/g)(P<0.05);1-辛烯-3-醇、(E)-2-己烯醛、壬醛、2-戊基呋喃含量降低。此外,发酵过程中可能导致豆腥味难以消除的原因是风味物质能与大豆蛋白发生疏水结合,其结合常数随碳链数的增加而增加[20, 29]。
2.6 不同发酵时间豆渣饮料样品聚类分析
利用层次聚类作为一种初步方法,评估不同样品的芳香图谱之间的定量关系。由图7所示,CK组与4组发酵豆渣饮料相比,挥发性气味物质的差异变化显著,与主成分分析结果相似。CK组中(E)-2-己烯醛、壬醛、(E,E)-2,4-癸二烯醛含量远高于发酵豆渣饮料样品,由此可知,发酵24 h组致豆腥味挥发性风味物质含量更低,与CK组差异显著(P<0.05)。在所有样品中,4-癸醇、3-羟基己酸乙酯、乙酸庚基酯、辛酸甲酯、壬酸、(Z)-2-庚烯醛、2,4-壬二烯醛、3-壬烯-1-醇、庚酸、1-癸醇、3-辛烯-2-酮、庚酸烯丙酯、2-庚烯-1-醇、2-十三烯酸、溴乙酸癸酯、氯乙酸含量差异最大,表明类干酪乳杆菌发酵参与了与豆渣饮料中挥发性香气合成相关的代谢途径,是影响豆渣饮料香气特征的主要因素。

图7 不同发酵时间豆渣饮料样品聚类分析
Fig.7 Cluster analysis of okara beverage samples at different fermentation times
3 结论
本研究应用SPME/GC-MS技术结合电子鼻检测分析类干酪乳杆菌发酵豆渣饮料过程中的挥发性风味物质。SPME/GC-MS结果表明,5种豆渣饮料样品在发酵过程中共检测出87种挥发性成分,其中醇类24种、醛类8种、酸类10种、酮类7种、烃类14种、酯类17种和其他化合物7种,醛类和醇类挥发性物质对豆渣饮料风味的影响起关键作用,类干酪乳杆菌发酵使豆渣饮料形成新的风味。电子鼻对不同发酵时间豆渣饮料的挥发性物质进行检测与分析,同时PCA、Loadings及LDA能有效区分不同发酵时间样品的品质变化。综合上述风味物质和气味的变化,类干酪乳杆菌发酵豆渣饮料24 h趋于成熟,是品质最佳点。研究结果将为功能性谷物饮料的开发提供新的思路。
[1] 姜慧燕, 邹礼根, 翁丽萍, 等.豆渣营养成分分析及蛋白质营养价值评价[J].食品工业, 2020, 41(6):325-328.
JIANG H Y, ZOU L G, WENG L P, et al.Nutritional components analyzation and protein nutrition evaluation of soybean residue[J].The Food Industry, 2020, 41(6):325-328.
[2] CRESCENTI A, SOL R, VALLS R M, et al.Polymorphisms in LEP and NPY genes modify the response to soluble fibre Plantago ovata husk intake on cardiovascular risk biomarkers[J].Genes & Nutrition, 2013, 8(1):127-136.
R, VALLS R M, et al.Polymorphisms in LEP and NPY genes modify the response to soluble fibre Plantago ovata husk intake on cardiovascular risk biomarkers[J].Genes & Nutrition, 2013, 8(1):127-136.
[3] VOSS G B, MONTERIO M J P, JAUREGI P, et al.Functional characterisation and sensory evaluation of a novel synbiotic okara beverage[J].Food Chemistry, 2021, 340:127793.
[4] VONG W C, HUA X Y, LIU S Q.Solid-state fermentation with Rhizopus oligosporus and Yarrowia lipolytica improved nutritional and flavour properties of okara[J].LWT, 2018, 90:316-322.
[5] 杨洋, 汤晓娟, 王江勤, 等.发酵豆渣的菌种选择及应用研究进展[J].食品研究与开发, 2021, 42(8):192-196.
YANG Y, TANG X J, WANG J Q, et al.Research progress on selection of microorganism degrading species and application of fermented soybean dregs[J].Food Research and Development, 2021, 42(8):192-196.
[6] 韩金志, 潘雯丽, 沈昊, 等.不同乳酸菌发酵豆浆挥发性气味物质的差异性分析[J].中国食品学报, 2021, 21(9):296-305.
HAN J Z, PAN W L, SHEN H, et al.Diversity analysis of volatile odors in soy milk fermented by different lactic acid bacteria[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(9):296-305.
[7] 张宇, 赵家源, 郑佳鹏, 等.一株高产胞外多糖降血糖副干酪乳杆菌JY062(TD062)的黏附性与耐受性评价[J].中国乳品工业, 2022, 50(4):4-8;13.
ZHANG Y, ZHAO J Y, ZHENG J P, et al.Evaluation of adhesion and tolerance of a high-yield exopolysaccharide Lactobacillus paracasei JY062 (TD062) with hypoglycemic function[J].China Dairy Industry, 2022, 50(4):4-8;13.
[8] 熊涛, 刘妍妍, 黄涛, 等.副干酪乳杆菌NCU622耐酸耐胆盐及其黏附性能[J].食品科学, 2015, 36(5):93-98.
XIONG T, LIU Y Y, HUANG T, et al.Acid, bile tolerance and adhesion properties of Lactobacillus paracasei NCU622[J].Food Science, 2015, 36(5):93-98.
[9] LIU N, QIN L K, LU X F, et al.Physicochemical components and flavor properties of acid rice soup (rice-acid) fermented with Lactobacillus paracasei and/or Kluyveromyces marxianus[J].Food Bioscience, 2021, 43:101278.
[10] 沈金荣, 史梦珂, 邓泽元, 等.大豆复合植物蛋白饮料配方优化及其理化性质[J].食品工业科技, 2018, 39(2):175-181.
SHEN J R, SHI M K, DENG Z Y, et al.Formulation optimization and physicochemical properties of soybean compound plant protein beverage[J].Science and Technology of Food Industry, 2018, 39(2):175-181.
[11] 刘倩, 袁越, 张杰, 等.不同菌种发酵对诺丽果酵素的抗氧化性及风味物质的影响[J].食品工业科技,2023,44(4):129-137.
LIU Q, YUAN Y, ZHANG J, et al.Effects of different fermentation strains on the antioxidant activities and flavor substances of Morinda citrifolia L.(Noni) Fruit Jiaosu[J].Science and Technology of Food Industry, 2023,44(4):129-137.
[12] 王当丰, 李婷婷, 刘楠, 等.顶空固相微萃取-气质联用法结合电子鼻分析鱼精蛋白对草鱼片挥发性气味的影响[J].食品与发酵工业, 2016, 42(10):163-170.
WANG D F, LI T T, LIU N, et al.Analysis of effects of protamine on volatile compounds for grass garp slices by HS-SPME-GC-MS technology combined with electronic nose[J].Food and Fermentation Industries, 2016, 42(10):163-170.
[13] 金刚, 张雪, 谷晓博, 等.贺兰山东麓不同子产区赤霞珠葡萄自然发酵对葡萄酒香气的影响[J].食品与发酵工业, 2021, 47(7):153-160.
JIN G, ZHANG X, GU X B, et al.Effects of spontaneous fermentation of Cabernet Sauvignon from different sub-regions of Helan Mountain east foothill on wine aroma[J].Food and Fermentation Industries, 2021, 47(7):153-160.
[14] 刘建林, 孙学颖, 张晓蓉, 等.GC-MS结合电子鼻/电子舌分析发酵羊肉干的风味成分[J].中国食品学报, 2021, 21(5):348-354.
LIU J L, SUN X Y, ZHANG X R, et al.Analysis of flavor components of fermented mutton jerky by GC-MS combined with electronic nose/electronic tongue[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):348-354.
[15] 明庭红, 苏秀榕, 周君, 等.植物乳杆菌发酵牛乳挥发性风味物质的解析[J].食品与发酵工业, 2016, 42(12):163-171.
MING T H, SU X R, ZHOU J, et al.Analysis on volatile compounds in milk fermented by Lactobacillus plantarum[J].Food and Fermentation Industries, 2016, 42(12):163-171.
[16] 蓬桂华, 李文馨, 殷勇, 等.电子鼻和电子舌在分析桑果汁风味上的应用[J].食品工业科技, 2020, 41(12):234-237;244.
PENG G H, LI W X, YIN Y, et al.Analysis of flavor difference of mulberry juice by E-nose and E-tongue[J].Science and Technology of Food Industry, 2020, 41(12):234-237;244.
[17] LEDUC F, TOURNAYRE P, KONDJOYAN N, et al.Evolution of volatile odorous compounds during the storage of European seabass (Dicentrarchus labrax)[J].Food Chemistry, 2012, 131(4):1 304-1 311.
[18] 贺红军, 邹慧, 孙宁, 等.紫薯酸奶和普通酸奶挥发性风味物质差异性研究[J].现代食品科技, 2014, 30(8):225-230.
HE H J, ZOU H, SUN N, et al.Volatile flavor compounds in regular and purple sweet potato yogurt[J].Modern Food Science and Technology, 2014, 30(8):225-230.
[19] 于倩, 蒋玉梅, 李霁昕, 等.霞多丽葡萄、苦水玫瑰及其混合发酵酒的香气比较分析[J].食品工业科技, 2012, 33(22):172-177.
YU Q, JIANG Y M, LI J X, et al.Comparative analysis of aroma components in chardonnay, kushui rose and their mixed fermentation wine[J].Science and Technology of Food Industry, 2012, 33(22):172-177.
[20] 郭帅, 韩之皓, 白梅, 等.嗜热链球菌S10复合植物乳杆菌P-8发酵豆乳中挥发性风味物质的SPME-GC-MS分析[J].中国食品学报, 2020, 20(10):268-279.
GUO S, HAN Z H, BAI M, et al.Analysis of fermented soybean milk produced by streptococcus thermophilus S10 compound Lactobacillus plantarum P-8 by SPME-GC-MS[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(10):268-279.
[21] WIDJAJA R, CRASKE J D, WOOTTON M.Comparative studies on volatile components of non-fragrant and fragrant rices[J].Journal of the Science of Food and Agriculture, 1996, 70(2):151-161.
[22] 高雅鑫, 倪楠, 许斌, 等.枯草芽孢杆菌BSNK-5发酵豆乳特有风味物质研究[J].食品与发酵工业, 2020, 46(15):258-264.
GAO Y X, NI N, XU B, et al.Exploration on the peculiar flavor of fermented soymilk by Bacillus subtilis BSNK-5[J].Food and Fermentation Industries, 2020, 46(15):258-264.
[23] 曾琦琦, 李文钊, 刘亚平, 等.党参复合饮料在不同储藏温度下的风味变化[J].食品研究与开发, 2020, 41(24):57-64.
ZENG Q Q, LI W Z, LIU Y P, et al.The flavor changes of Codonopsis pilosula compound beverage at different storage temperature[J].Food Research and Development, 2020, 41(24):57-64.
[24] CARROLL A L, DESAI S H, ATSUMI S.Microbial production of scent and flavor compounds[J].Current Opinion in Biotechnology, 2016, 37:8-15.
[25] ZHANG Y Y, WU H Z, TANG J, et al.Influence of partial replacement of NaCl with KCl on formation of volatile compounds in Jinhua ham during processing[J].Food Science and Biotechnology, 2016, 25(2):379-391.
[26] CAPORASO N, WHITWORTH M B, CUI C H, et al.Variability of single bean coffee volatile compounds of Arabica and robusta roasted coffees analysed by SPME-GC-MS[J].Food Research International, 2018, 108:628-640.
[27] DONG W J, HU R S, LONG Y Z, et al.Comparative evaluation of the volatile profiles and taste properties of roasted coffee beans as affected by drying method and detected by electronic nose, electronic tongue, and HS-SPME-GC-MS[J].Food Chemistry, 2019, 272:723-731.
[28] 蒋立文, 谢艳华, 李跑, 等.HS-SPME/GC-MS和电子感官技术分析毛霉型豆豉发酵过程中风味品质[J].核农学报, 2020, 34(7):1 497-1 506.
JIANG L W, XIE Y H, LI P, et al.Analysis of the volatile flavor components and quality of mucor-type Douchi with HS-SPME /GC-MS method and electric-sense technology[J].Journal of Nuclear Agricultural Sciences, 2020, 34(7):1 497-1 506.
[29] WANG K, ARNTFIELD S D.Binding of carbonyl flavours to canola, pea and wheat proteins using GC/MS approach[J].Food Chemistry, 2014, 157:364-372.