糙米是稻谷去除稻壳后保留胚芽、糠层和胚乳的全谷米粒,因其富含膳食纤维、γ-氨基丁酸、酚类物质、维生素和矿物质,被认为是绿色健康食品[1-3]。此外,糙米的麸皮和胚芽层完整,使其具有坚果口味和丰富的质感[4]。糙米作为全球多个国家膳食结构中的重要组成食物,不仅能提供能量来源,还能提供人体必需的微量元素[5-7]。然而,水稻的生长特性极易从其生长环境中吸收重金属元素,一旦积累到谷粒中重金属元素超标,就会对人类健康构成危害。因此,准确测定糙米中的微量元素含量具有十分重要的意义。
糙米中多种微量元素的测定已有大量文献报道,主要分析技术包括:原子吸收(atomic absorption spectrometry, AAS)[8-10]、电感耦合等离子体发射光谱(inductively coupled plasma optical emission spectrometry, ICP-OES)[11-13]和电感耦合等离子体质谱(inductively coupled plasma mass spectrometry, ICP-MS)[14-16]。其中,ICP-MS具有极低的检测限和高灵敏度,并能满足多元素同时测定的需求,但ICP-MS分析维护成本高,面对复杂干扰需采用碰撞/反应池(collision/reaction cell, CRC)技术或高分辨ICP-MS[high resolution, (HR)-ICP-MS]才能彻底消除,仪器价格昂贵且操作要求高;AAS的线性范围窄,单元素分析特性不能满足多元素快速测定的高通量分析需求,对于难熔元素和非金属元素的分析灵敏度低。ICP-OES线性范围宽且能满足多元素快速测定需求,但应用于糙米中多元素的测定仍具挑战性:即使在高温等离子体条件下,常规液体雾化样品引入难电离元素的电离不充分,导致这些元素的分析灵敏度低;糙米中部分元素含量低,尤其是难电离毒理性元素As、Sn、Sb、Hg,而ICP-OES的检测限偏高,导致这些元素难以检出。氢化物发生(hydride generation, HG)技术能将难电离元素转化为挥发性氢化物,极大地提高了这些元素在等离子体中的输送、雾化和激发效率,与常规液体雾化样品引入方式相比,能降低元素的检出限(limit of detection, LOD)达1~2个数量级[17-19],但挥发性氢化物的形成需使用氢化物发生进样装置,对于样品中氢化物和非氢化物元素的测定需要更换不同的进样系统,操作复杂繁琐,不能满足大批量样品中多元素的快速分析要求。多模式进样系统(multimode sample introduction system, MSIS)在双重模式下兼具常规液体雾化和氢化物发生功能,能同时测定氢化物元素和非氢化物元素[20]。
本文将糙米进行微波消解,在MSIS双重模式下,采用ICP-OES对糙米中的氢化物元素(As、Se、Sn、Sb、Hg)和非氢化物元素(Cr、Mn、Fe、Ni、Cu、Zn、Mo、Sr、Cd、Pb)同时进行测定,通过构建快速自动曲线拟合技术(fast automatic curve fitting technology, FACT)模型消除测定过程中的光谱干扰和背景干扰,建立了糙米中多种微量元素快速准确测定的分析方法。
1 材料与方法
1.1 材料和试剂
1 000 mg/L的Cr、Mn、Fe、Ni、Cu、Zn、Mo、Sr、Cd、Pb、As、Se、Sn、Sb、Hg单元素标准溶液,国家标准物质中心;10 mg/L的Y、Bi内标溶液、65%(质量分数)硝酸、37%(质量分数)盐酸,德国Merck;L-半胱氨酸(生物纯)、酒石酸、氢氧化钠、硼氢化钠(均为分析纯),国药集团化学试剂有限公司;国家标准参考物质湖南大米(GBW10045),中国地质科学院地球物理地球化学勘查研究所;不同产地的6种糙米,京东超市。硝酸采用亚沸蒸馏纯化。
预还原剂:在4 g酒石酸中加入100 g/L L-半胱氨酸溶液20 mL,用超纯水定容至100 mL,得到20 g/L L-半胱氨酸/40 g/L 酒石酸混合溶液。
还原剂:将0.5 g NaOH和1.5 g硼氢化钠溶于超纯水中并定容至100 mL,得到15.0 g/L硼氢化钠/5.0 g/L氢氧化钠混合溶液。
1.2 仪器与设备
5110电感耦合等离子体发射光谱仪,美国Agilent公司;MARs 5微波消解系统,美国CEM公司;Milli-Q超纯水机,美国Millipore公司。
1.3 样品前处理
准确称取0.4 g经粉碎糙米样品置入微波消解系统反应罐内,用少量超纯水润湿后加入65%(质量分数)硝酸2.5 mL,敞口消解20 min后置入微波消解系统进行消解。消解完成后转移至25 mL容量瓶中,加入37%(质量分数)盐酸3.5 mL,用超纯水稀释至刻度,得到样品溶液。按相同条件制得空白溶液。
1.4 实验方法
1.4.1 工作条件
ICP-OES:射频功率1 350 W;等离子气流速11.5 L/min;辅助气流速1.0 L/min;泵速20 r/min;读取时间20 s;重复次数3次;样品提升延迟时间30 s;稳定时间25 s;冲洗时间60 s;光谱/背景干扰校正,FACT。
微波消解:功率1 600 W,3 min升温至100 ℃,保持3 min;7 min升温至150 ℃,保持3 min;7 min升温至170 ℃,保持3 min;5 min升温至190 ℃,保持10 min。
MSIS:样品溶液引入流速0.5 mL/min;还原剂引入流速0.5 mL/min;预还原剂引入流速2.0 mL/min;雾化气流速0.65 L/min。
1.4.2 ICP-OES分析
开启MSIS双重模式(图1),采用蠕动泵将样品溶液分两路引入MSIS雾化室,一路经通道2引入进行常规液体雾化后导入ICP-OES,一路经通道3与来自通道5的预还原剂在三通线圈均匀混合后进入MSIS雾化室,与来自通道1的还原剂进行氢化物发生反应,产生的氢化物蒸气导入ICP-OES,所形成的废液经通道4排出。
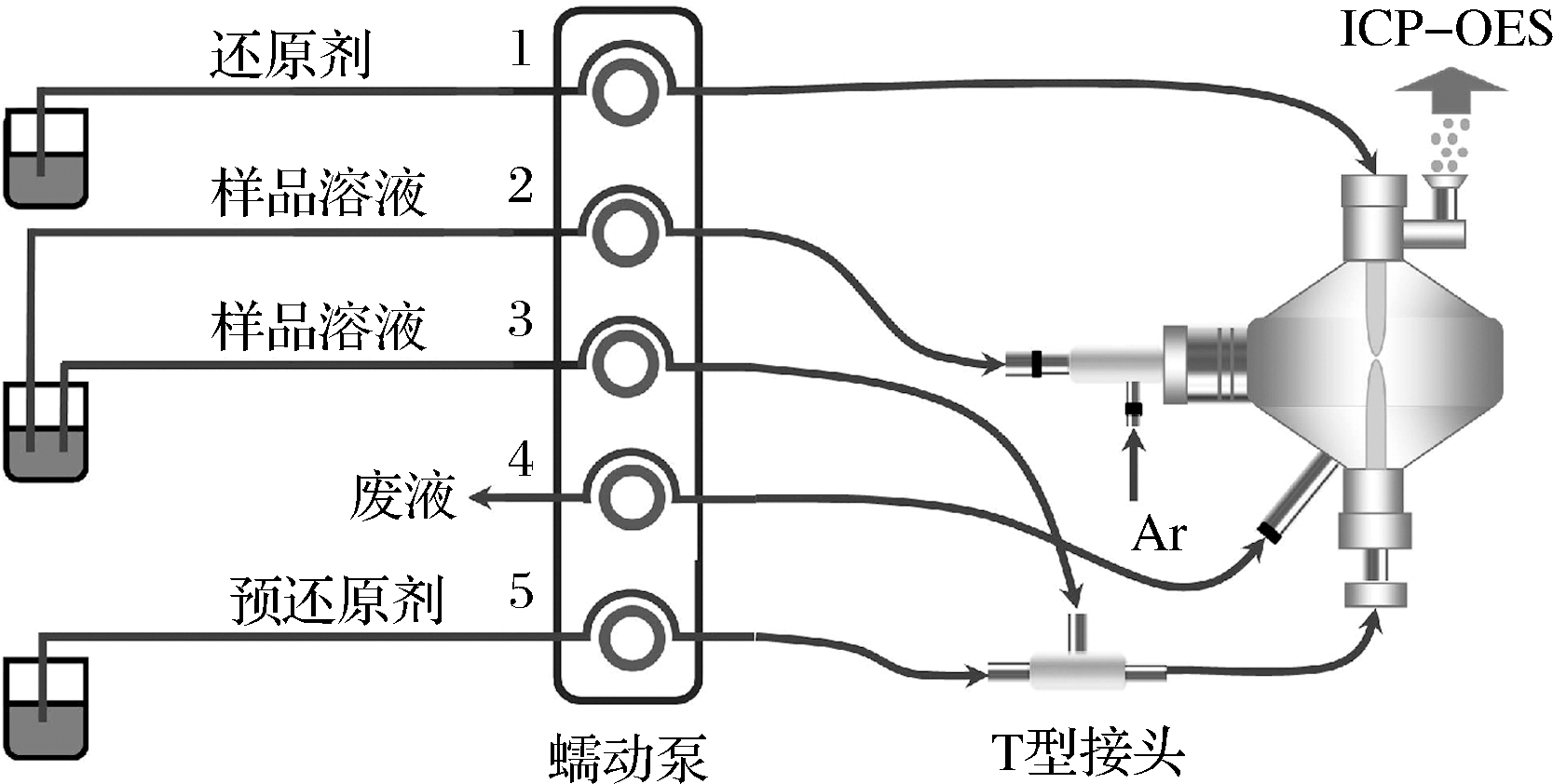
图1 在双重模式下运行的多模式样品导入系统(MSIS)
Fig.1 Multimode sample introduction system (MSIS) operating in dual mode
分别配制0、1、5、20、100、500 μg/L的Cr、Mn、Fe、Ni、Cu、Zn、Mo、Sr和0、0.1、0.5、2.0、10、50 μg/L的Cd、Pb、As、Se、Sn、Sb、Hg系列混合标准溶液,加入1 mg/L的Y和Bi内标混合溶液,采用ICP-OES测定,选择FACT校正光谱/背景干扰,以分析元素信号强度与内标元素信号强度的比值(相对信号强度)对标准溶液所对应的浓度进行回归,利用ICP Expert软件建立校准曲线。在相同的条件下测定空白溶液和样品溶液,根据样品溶液中分析元素的相对信号强度,利用校准曲线计算样品溶液中分析元素的含量。
2 结果与讨论
2.1 氢化物发生条件的选择
糙米样品中的微量元素通常以稳定的高氧化态存在,选择还原酸对样品进行酸化还原有利于提高分析元素的氢化物发生效率[21]。盐酸兼具酸化和还原性,能使高氧化态分析物转化为低氧化态或基态原子。在糙米样品的预处理过程中,本实验选择盐酸对消解溶液进行酸化还原。考察了不同含量盐酸对氢化物元素As、Se、Sn、Sb、Hg的影响,结果见图2-a。As和Sb的氢化物AsH3和SbH3为四面体结构,含一对孤对电子的弱极性分子;Sn氢化物SnH4为正四面体结构,不含孤对电子的非极性分子,在酸度适中的介质中,有利于SnH4、AsH3和SbH3产生;Se氢化物H2Se为四面体结构,是含2对孤对电子的极性分子,较低酸度不利于H2Se产生,而Hg氢化物发生产物为基态原子蒸气,受酸度的影响较小。因此,当盐酸体积分数在低含量范围(5%~10%)变化时,As、Sn、Sb的信号强度随盐酸的体积分数增大而增大,而Se、Hg的信号强度基本无变化;随后增大盐酸含量,As、Sn、Sb的信号强度变化不大,而Se的信号强度逐渐增大,Hg的信号强度仍然维持平稳;当盐酸体积分数增高至14%时,As、Sn、Sb的信号强度开始缓慢下降,但Se的信号强度趋于平稳,Hg的信号强度仍然无明显变化。由于5种氢化物元素中As的信号强度相对较低,本实验选择盐酸体积分数为14%,确保了As的信号强度最大而其余氢化物元素也具有较大信号强度。通过在线加入由20 g/L L-半胱氨酸/40 g/L酒石酸组成的预还原剂与样品溶液混合,提高了分析元素的氢化物发生效率。

a-盐酸含量;b-硼氢化钠含量
图2 浓度对氢化物元素As、Se、Sn、Sb、Hg的影响
Fig.2 Effect of concentrations on hydride-generation elements As, Se, Sn, Sb, and Hg
硼氢化钠与酸反应产生的H2,可与样品溶液中的低氧化态的As、Se、Sn、Sb反应形成氢化物蒸气,并能将基态原子Hg还原形成蒸气。在氢化物发生反应过程中,硼氢化钠含量的增加导致生成的水蒸气也逐渐增多,由于SnH4为非极性分子,AsH3和SbH3为弱极性分子,SnH4不会受到水偶极距溶解影响,AsH3和SbH3受到水偶极距溶解的影响较小;而H2Se为强极性分子,受水偶极距溶解的影响,在水蒸气中极易形成弱酸被硼氢化钠的稳定剂(NaOH)中和吸收,导致H2Se的产率降低;Hg蒸气的信号强度取决于H2的生成量,较大浓度硼氢化钠会生成更多H2。考察了不同硼氢化钠浓度对As、Se、Sn、Sb、Hg氢化物发生的影响,从图2-b可以看出,随着硼氢化钠浓度的增大,各元素的信号强度逐渐增大,当硼氢化钠的质量浓度为10 g/L时,As和Hg的信号强度继续增大,Sn和Sb的信号强度增幅变小,而Se的信号强度趋于平缓,当硼氢化钠的质量浓度增大至15 g/L时,Se的信号强度开始降低。为确保所有分析物具有较大信号强度,本实验选择15 g/L硼氢化钠为还原溶液,并加入0.5%的NaOH稳定硼氢化钠溶液。
2.2 分析谱线的选择
根据ICP Expert谱线库提供的分析谱线优先排序和潜在的干扰,选择灵敏度高并能避开谱线重叠干扰的波长为分析谱线。对于高灵敏谱线存在重叠干扰,而无干扰谱线的灵敏度过低不能满足分析要求时,需要对选择的高灵敏谱线进行重叠干扰校正。以Cd为例,Cd波长为226.502和214.439 nm处的2条高灵敏分析谱线均受到了Fe谱线干扰,其中,Fe波长为226.505 nm处谱线与Cd在226.502 nm处的谱线峰间距离仅为3 pm,现有ICP-OES的光学系统无法完全分开这2条谱线,当样品中Fe含量很高时,Fe谱线226.459 nm也会对Cd在226.502 nm处的谱线形成尾翼干扰。Cd在214.439 nm处的谱线与Fe波长为214.445 nm处谱线的峰间距离为6 pm,虽然受到的干扰比Cd谱线226.502 nm小,但ICP-OES仍然无法分离这2条谱线,同时,在高浓度Fe基质中Cd在226.502 nm处的谱线还会受到Fe在214.457 nm处谱线的重叠干扰。本实验选择Cd的分析波长为214.439 nm,采用FACT对Fe谱线干扰进行实时光谱校正。
分别测定Cd标准溶液、Fe标准溶液和空白溶液,收集相应的光谱响应信息构建数据模型,对模型进行高斯曲线拟合,将谱峰转换为数学描述。检验剩余结构的残差,如果残差足够大,则将其拟合到其他高斯分布中[22]。因此,FACT模型为高斯峰与相对小的残差之和,通过算法将分析谱线从原始光谱中解析出来。从图3可以看出,利用FACT模型可将Cd谱线214.439 nm处受到的Fe干扰峰完全分离,从而校正光谱重叠干扰。由于在建模过程中使用了空白溶液响应数据,因此,FACT能同时校正背景干扰。基于FACT能同时校正光谱重叠和背景干扰,本实验分别选择Cr 267.716 nm、Mn 257.610 nm、Fe 238.204 nm、Ni 231.604 nm、Cu 327.395 nm、Zn 213.857 nm、Mo 202.032 nm、Sr 216.596 nm、Pb 220.353 nm、As 188.980 nm、Se 196.026 nm、Sn 189.925 nm、Sb 217.582 nm、Hg 194.164 nm为分析谱线进行测定。
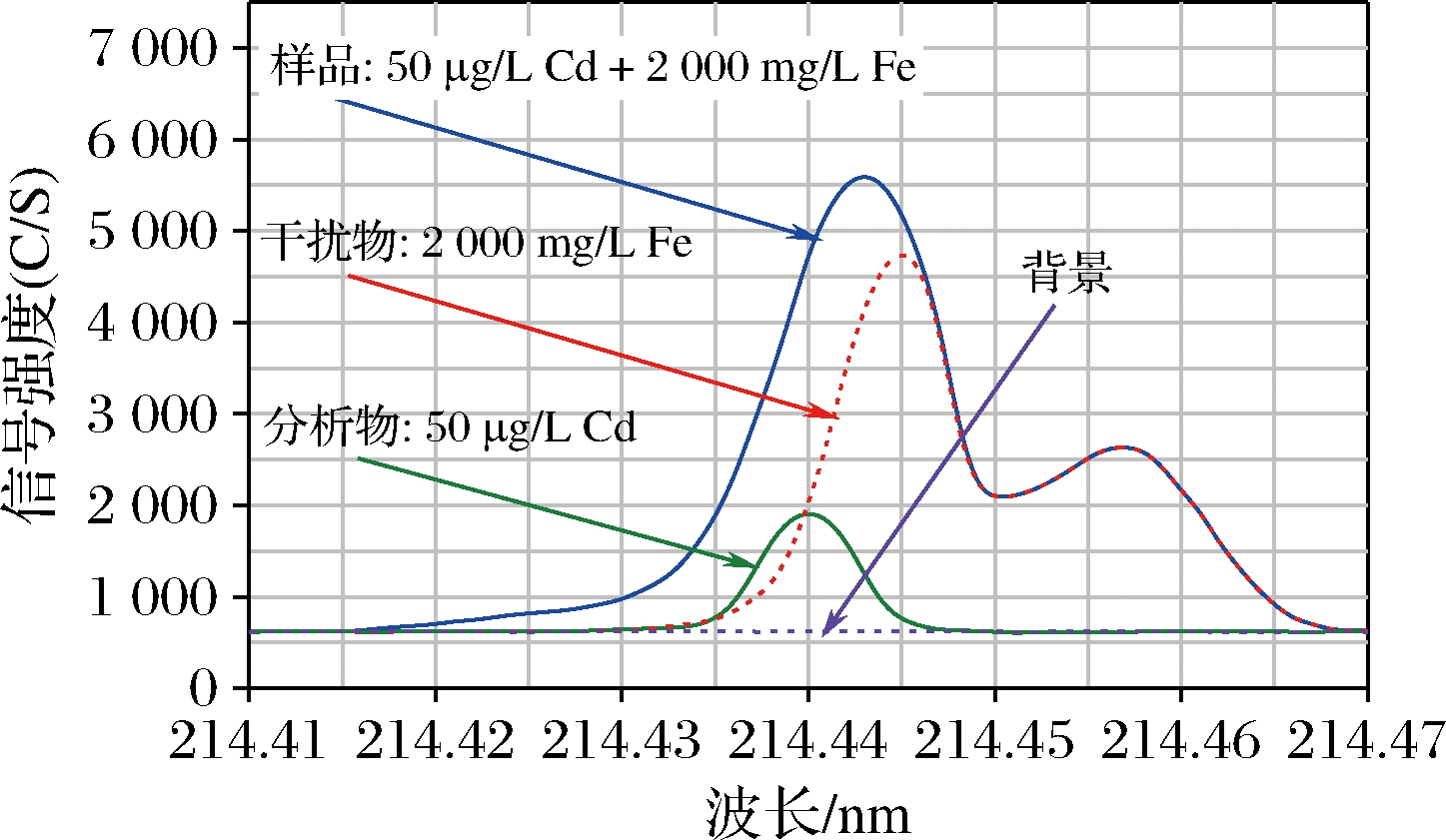
图3 采用FACT模型校正Fe对Cd的谱线重叠干扰
Fig.3 Correction of spectral overlap interference of Fe on Cd using FACT model
2.3 方法的分析稳定性
为评价长时间分析过程的稳定性,向样品溶液中加入由10 μg/L的非氢化物发生元素和1 μg/L的氢化物发生元素组成的混合标准溶液,选择Y为Cr、Mn、Ni、Mo、Cd、Pb的内标元素,Bi为Fe、Cu、Zn、Sr、As、Se、Sn、Sb、Hg的内标元素,每10 min测定1次,共测定12次,分析元素在120 min内的归一化相对强度的变化(图4)。可以看出,几乎所有分析元素每次测定的归一化信号强度值均在(1±0.05)内变化,表示方法在长时间分析过程中的稳定性良好。
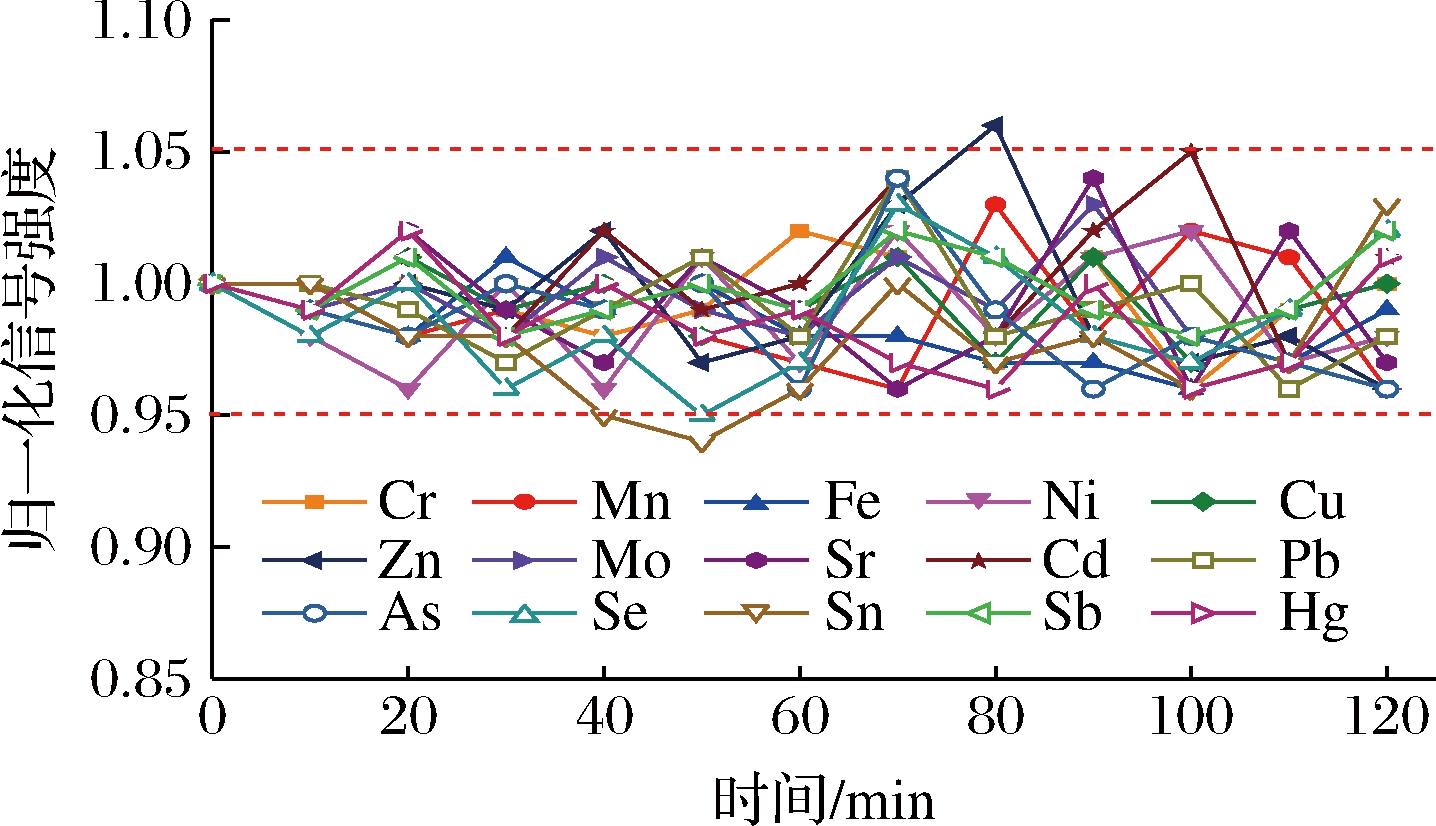
图4 在120 min内加标到样品溶液中多元素 标准溶液的分析稳定性
Fig.4 Analytical stability of multi-element standard solutions spiked into sample solutions within 120 min
2.4 方法的线性与检出限
利用选定的分析波长和内标谱线对系列多元素混合标准溶液进行测定,建立分析元素的标准曲线。对空白溶液重复测定11次,以测定结果3倍标准偏差所对应浓度为各元素仪器的LOD,乘以样品的稀释倍数为方法的检出限(method detection limit, MDL),结果见表1。可以看出,所有分析元素在各自线性范围内的线性相关系数≥0.999 6,表明方法具有良好的线性关系。各元素的LOD为0.01~1.06 μg/L,MDL为0.63~66.2 μg/kg。其中所有非氢化物元素均低于国标GB 5009.268—2016《食品安全国家标准 食品中多元素的测定》ICP-OES法所得到的LOD;氢化物元素除Se以外,均低于国标GB 5009.268—2016电感耦合等离子体质谱(ICP-MS)法所得到的LOD。
表1 方法的线性与检出限
Table 1 Linearity of method and limit of detection

元素波长/nm内标(波长)线性范围/(μg·L-1)相关系数RLOD/(μg·L-1)MDL/(μg·kg-1)Cr267.716Y(371.029)1.20~5001.000 00.3622.5Mn257.610Y(371.029)0.13~5000.999 70.042.50Fe238.204Bi(223.061)0.97~5000.999 90.2918.1Ni231.604Y(371.029)0.73~5000.999 90.2213.8Cu327.395Bi(223.061)1.27~5000.999 80.3823.8Zn213.857Bi(223.061)3.52~5000.999 91.0666.2Mo202.032Y(371.029)1.50~5001.000 00.4528.1Sr216.596Bi(223.061)0.78~5000.999 90.2314.3Cd214.439Y(371.029)0.23~50.00.999 80.074.38Pb220.353Y(371.029)0.52~50.01.000 00.1610.0As188.980Bi(223.061)0.30~50.00.999 90.095.63Se196.026Bi(223.061)0.18~50.00.999 60.3220.0Sn189.925Bi(223.061)0.06~50.01.000 00.021.25Sb217.582Bi(223.061)0.06~50.00.999 90.021.25Hg194.164Bi(223.061)0.03~50.00.999 80.010.63
2.5 标准参考物质GBW10045的分析
为评价分析方法的准确性和可靠性,对国家标准参考物质湖南大米(GBW10045)重复测定6次,比较测定结果与标准参考物质参考值的一致性,并采用加标回收实验,考察各元素的加标回收率和相对标准偏差(relative standard deviation, RSD)。表2结果表明,标准参考物质的分析结果与参考值基本一致,各元素的平均加标回收率为93.0%~106%,RSD为2.2%~4.9%,验证了分析方法准确度和精密度高,能满足实际检测需要。
表2 标准参考物质湖南大米(GBW10045)的分析结果
Table 2 Analysis results of standard reference material Hunan rice (GBW10045)

元素测定值/(μg·kg-1)RSD/%加标量/(μg·kg-1)加标测定值/(μg·kg-1)平均回收率/%参考值/(μg·kg-1)Cr146±5.113.5200337±10.795.5140Mn9 230±3403.710 00019 100±56298.79 000±400Fe6 720±1862.810 00017 300±3531066 300±800Ni292±13.54.6200484±16.096.0310±40Cu2 560±80.23.12 0004 620±1741032 400±200Zn14 100±5363.810 00024 300±72810214 400±800Mo915±41.34.52 0002 840±90.196.3890±60Sr144±7.054.9200351±10.5104160±30Cd201±8.214.1200387±12.293.0190±20Pb82.2±2.493.0100176±6.4193.870±23As108±3.022.8100212±6.79104110±20Se61.7±1.342.2100157±4.8595.353±14Sn8.53±0.303.510.018.1±0.4395.78Sb9.70±0.414.210.020.3±0.6610610Hg3.16±0.123.810.013.0±0.3998.42.8±0.5
2.6 样品分析
应用建立的方法分析了来自黑龙江、湖南、江西、辽宁、泰国、日本的6个不同产地的糙米(样品编号分别为1、2、3、4、5、6)样品,每个样品重复测定6次,结果见表3。糙米中微量营养元素的含量普遍高于精米,但稻谷吸收的重金属元素主要分布在纤维素更多的部位[23],糙米中重金属元素的含量也比精米高。对照国家标准GB 2762—2022《食品安全国家标准 食品中污染物限量》,所有样品中重金属元素的含量均低于限量标准。尽管糙米的营养高于精米,但仍需关注糙米中重金属元素超标对健康带来的潜在风险。
表3 不同产地糙米样品的分析结果(n=6) 单位:μg/kg
Table 3 Analysis results of brown rice samples from different origins(n=6)

元素样品1样品2样品3样品4样品5样品6Cr86.5±2.6129.0±0.7162.0±1.8537.3±2.8640.5±2.1118.7±0.62Mn18 400±50221 200±61516 500±29111 500±48214 100±35610 300±231Fe23 100±57513 500±37419 300±6079 790±3378 410±31011 900±282Ni692±18.3913±29.0388±10.4415±16.0215±7.22581±30.4Cu6 600±2028 500±3076 040±2454 380±1715 300±1735 920±287Zn25 300±63018 700±62121 600±57130 200±89023 600±65220 100±595Mo1 450±65.21 610±70.31 850±90.22 100±64.21 850±90.22 100±64.3Sr381±10.0276±8.55432±9.83188±5.74161±4.89223±7.80Cd32.0±1.1673.1±3.0570.4±2.1041.3±1.2527.8±1.0658.1±1.92Pb105±3.2876.4±1.9790.0±3.2931.5±1.1045.5±1.6762.2±2.30As89.3±2.60116±3.1171.1±1.6460.1±2.37102±3.7250.1±1.83Se40.2±1.0156.3±2.0583.0±2.2647.2±2.0967.5±1.9858.4±2.16Sn260±3.94710±2.62144±3.5036.8±1.1668.1±2.71188±6.79Sb28.4±1.1623.0±0.8015.8±0.6719.0±0.8310.5±0.4117.3±0.56Hg4.29±0.135.32±0.192.13±0.083.06±0.064.76±0.123.85±0.10
3 结论
本研究基于MSIS的双重模式下能同时进行标准雾化和氢化物发生,开发了ICP-OES同时测定糙米中氢化物元素和非氢化物元素的分析方法。方法操作简单,无需切换不同的进样系统,缩短了分析时间,降低了分析运行成本。所有分析元素均具有高灵敏度、低LOD和良好的线性,整个测定过程稳定性好,分析结果准确可靠,非常适合大批量样品中氢化物元素和非氢化物元素的高通量检测。虽然糙米中的微量营养元素的含量高于精米,但仍需关注重金属元素超标所带来的健康风险。
[1] MIR S A, BOSCO S J D, SHAH M A, et al.Effect of puffing on physical and antioxidant properties of brown rice[J].Food Chemistry, 2016, 191:139-146.
[2] 王熠瑶, 张烝彦, 孙俊, 等.基于GC-IMS技术分析糙米储藏过程中风味物质变化[J].食品与发酵工业, 2020, 46(6):250-255.
WANG Y Y, ZHANG Z Y, SUN J, et al.Analysis of flavor changes of brown rice during storage based on gas chromatography-ion mobility spectrometry[J].Food and Fermentation Industries, 2020, 46(6):250-255.
[3] 张培茵, 孟宁, 刘明, 等.低温等离子体处理对糙米原料及糙米饭风味特性的影响[J].食品科学, 2021, 42(15):74-80.
ZHANG P Y, MENG N, LIU M, et al.Effects of low temperature plasma treatment on flavor characteristics of raw and cooked brown rice[J].Food Science, 2021, 42(15):74-80.
[4] BABU P D, SUBHASREE R, BHAKYARAJ R, et al.Brown rice-beyond the color reviving a lost health food:A review[J].Magnesium, 2009, 187(13.10):67-72.
[5] 李萍, 普绍荣, 李凤英, 等.碾磨度对粳稻外观品质和食味理化特性的影响[J].食品与发酵工业, 2021, 47(4):21-26.
LI P, PU S R, LI F Y, et al.Effect of milling degree on the appearance quality and physicochemical properties to the palatability of Japonica rice[J].Food and Fermentation Industries, 2021, 47(4):21-26.
[6] PÉREZ-RODR GUEZ M, DIRCHWOLF P M,SILVA T V,et al.Brown rice authenticity evaluation by spark discharge-laser-induced breakdown spectroscopy[J].Food Chemistry, 2019, 297:124960.
GUEZ M, DIRCHWOLF P M,SILVA T V,et al.Brown rice authenticity evaluation by spark discharge-laser-induced breakdown spectroscopy[J].Food Chemistry, 2019, 297:124960.
[7] DING C, KHIR R, PAN Z, et al.Influence of infrared drying on storage characteristics of brown rice[J].Food Chemistry, 2018, 264:149-156.
[8] PARENGAM M, JUDPRASONG K, SRIANUJATA S, et al.Study of nutrients and toxic minerals in rice and legumes by instrumental neutron activation analysis and graphite furnace atomic absorption spectrophotometry[J].Journal of Food Composition and Analysis, 2010, 23(4):340-345.
[9] AKAMATSU S, YOSHIOKA N, MITSUHASHI T.Sensitive determination of cadmium in brown rice and spinach by flame atomic absorption spectrometry with solid-phase extraction[J].Food Additives & Contaminants.Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2012, 29(11):1 696-1 700.
[10] CERVEIRA C, POZEBON D, DE MORAES D P, et al.Speciation of inorganic arsenic in rice using hydride generation atomic absorption spectrometry (HG-AAS)[J].Analytical Methods, 2015, 7(11):4 528-4 534.
[11] CHUNG I M.Discrimination of geographical origin of rice (Oryza sativa L.) by multielement analysis using inductively coupled plasma atomic emission spectroscopy and multivariate analysis[J].Journal of Cereal Science, 2015, 65:252-259.
[12] DA SILVA I J S, PAIM A P S, DA SILVA M J.Composition and estimate of daily mineral intake from samples of Brazilian rice[J].Microchemical Journal, 2018, 137:131-138.
[13] RUNGE J, HERINGER O A, RIBEIRO J S, et al.Multi-element rice grains analysis by ICP OES and classification by processing types[J].Food Chemistry, 2019, 271:419-424.
[14] FERNANDEZ Z H, ALVAREZ J R E, ALVAREZ A M, et al.Metal contaminants in rice from Cuba analyzed by ICP-MS, ICP-AES and CVAAS[J].Food Additives & Contaminants.Part B, Surveillance, 2021, 14(1):59-65.
[15] BARNET L S, POZEBON D, DRESSLER V L, et al.Method validation for As speciation in rice using LC-ICP-MS and the inorganic arsenic limit for Brazilian rice[J].Journal of Food Composition and Analysis, 2021, 99:103849.
[16] JO G, TODOROV.Distribution of nutrient and toxic elements in brown and polished rice[J].Food Chemistry, 2019, 289:299-307.
[17] CHEN H, WU J, BRINDLE I D, et al.Simultaneous reduction of arsenic and lead to hydrides by sodium tetrahydroborate(Ⅲ) for inductively coupled plasma-atomic emission spectrometry:An investigation into the reaction medium[J].Talanta, 1995, 42(3):353-360.
[18] 郭莹莹, 王联珠, 朱文嘉, 等.南极磷虾及其产品中砷含量分析及安全性评价[J].食品科学, 2018, 39(19):182-187.
GUO Y Y, WANG L Z, ZHU W J, et al.Arsenic content analysis and safety evaluation of Antarctic krill(Euphausia superba) and its products[J].Food Science, 2018, 39(19):182-187.
[19] KUMAR A R, RIYAZUDDIN P.Chemical interferences in hydride-generation atomic spectrometry[J].TrAC Trends in Analytical Chemistry, 2010, 29(2):166-176.
[20] PROCH J, NIEDZIELSKI P.Multi-mode Sample Introduction System (MSIS) as an interface in the hyphenated system 2 HPLC-MSIS-ICP-OES in simultaneous determination of metals and metalloids species[J].Analytica Chimica Acta, 2021, 1 147:1-14.
[21] RIBEIRO A S, VIEIRA M A, CURTIUS A J, et al.Determination of hydride forming elements (As, Sb, Se, Sn) and Hg in environmental reference materials as acid slurries by on-line hydride generation inductively coupled plasma mass spectrometry[J].Spectrochimica Acta Part B:Atomic Spectroscopy, 2004, 59(2):243-253.
[22] CZARNECKI S, DÜRING R A.Closed-vessel miniaturised microwave-assisted EDTA extraction to determine trace metals in plant materials[J].International Journal of Environmental Analytical Chemistry, 2014, 94(8):801-811.
[23] SHRAIM A M, AHMAD M I, RAHMAN M S F, et al.Concentrations of essential and toxic elements and health risk assessment in brown rice from Qatari market[J].Food Chemistry, 2022, 376:131938.